Method Article
高解像度の呼吸計測測定のための差動遠心分離することにより骨格筋から無傷ミトコンドリアの単離
要約
Here, a quadriceps muscle specimen is taken from an anaesthetized pig and mitochondria are isolated by differential centrifugation. Then, the respiratory rates of mitochondrial respiratory chain complexes I, II and IV are determined using high-resolution respirometry.
要約
Mitochondria are involved in cellular energy metabolism and use oxygen to produce energy in the form of adenosine triphosphate (ATP). Differential centrifugation at low- and high-speed is commonly used to isolate mitochondria from tissues and cultured cells. Crude mitochondrial fractions obtained by differential centrifugation are used for respirometry measurements. The differential centrifugation technique is based on the separation of organelles according to their size and sedimentation velocity. The isolation of mitochondria is performed immediately after tissue harvesting. The tissue is immersed in an ice-cold homogenization medium, minced using scissors and homogenized in a glass homogenizer with a loose-fitting pestle. The differential centrifugation technique is efficient, fast and inexpensive and the mitochondria obtained by differential centrifugation are pure enough for respirometry assays. Some of the limitations and disadvantages of isolated mitochondria, based on differential centrifugation, are that the mitochondria can be damaged during the homogenization and isolation procedure and that large amounts of the tissue biopsy or cultured cells are required for the mitochondrial isolation.
概要
ミトコンドリア生体エネルギーと呼吸容量は透過性細胞または繊維ではなく、また、単離されたミトコンドリアだけでなく研究することができます。本研究では、高解像度の呼吸計測測定のために分画遠心法を用いて、無傷の骨格筋のミトコンドリアを単離するためのプロトコルを説明します。
呼吸計測のための完全なミトコンドリアを単離するために、組織が均質化され、ミトコンドリアは、従来の分画遠心法により単離されます。遠心分離法は、組織ホモジネートの連続遠心分離(増速の直列)に基づいて差は最初、ほぼ70年前に1 Palladeおよび共同研究者によって導入されました。組織は、最初にハサミを使って細かく刻み、ゆったり乳棒でガラスホモジナイザーで機械的に均質化されます。その後、ホモジネートを低速と切れ目のない組織が含まれている得られたペレットを、携帯で遠心分離され、破片および核は破棄されます。その後、上清を高速で数回遠心分離し、ミトコンドリア富化画分が回収されます。ミトコンドリアを単離するための差動遠心分離法の利点は、ということです:ⅰ)メソッドは高速であり、ミトコンドリアは(呼吸実験は可能な限り迅速として行われるべきである)1〜1.5時間以内に単離することができます。 ⅱ)それは安価です。そしてiii)それは非常に効率的であり、微分遠心分離によって得られたミトコンドリアは、呼吸計測分析のために十分に純粋です。ミトコンドリアを単離するための差動遠心分離法の欠点は、ⅰ)ミトコンドリアが均質化中に損傷し、非結合を受ける可能性があることです。 ⅱ)他の細胞成分とミトコンドリアの汚染は()、さらに追加の遠心分離工程でミトコンドリアのペレットを洗浄することにより解決することができます。 ⅲ)差動遠心分離工程の間に、異なるミトコンドリア亜集団、 例えばを選択する可能性を、MIT下の密なとochondriaは7除外することができます。およびiv)ミトコンドリアの細胞周囲の不足しているとだけ理論的な最大の呼吸を測定することができます。呼吸計測分析のためにミトコンドリアを単離するための別の方法は、密度勾配遠心分離2です。この技術では、組織抽出物(遠心管の底部でのより高い密度を有する)スクロース溶液またはPercoll勾配の上に積層され、一定の速度で遠心分離し、ミトコンドリアが、それらに応じて、他の細胞成分から分離することを引き起こします密度。この方法は、多くの場合、シナプトソームから非常に低い汚染に脳ミトコンドリアを単離するために使用されます。しかしながら、密度勾配遠心分離によって単離されたラット肝ミトコンドリアは非常に他の細胞小器官3で汚染されています。この方法の制限の一つは、遠心分離管に存在するショ糖勾配がそう破裂かもしれないということです私ミトコンドリア(浸透圧ショック)。
組織の種類に応じ。差動遠心分離による無傷ミトコンドリアの単離のために考慮すべきいくつかの重要な要因があります。最初の必要性は穏やかな方法で組織を均質化することです。例えば、腎臓、脳や肝臓などの軟組織は、均質化の間に適用される穏やかな機械的な力を必要とします。これは、はるかに強い機械的な力を必要とし、心臓および骨格筋などの硬組織とは対照的です。細分化した組織は、通常、組織を柔らかくするために均質化前にプロテアーゼで処理されます。均質化および遠心分離の間に使用されるすべての緩衝液は、冷たい氷であると細胞質ゾル4、5と互換性のイオン性及び浸透強度と生理的に適切なpHを有していなければなりません。
分離されたミトコンドリアの生体エネルギーを研究する利点の一つは、細胞形質膜はpermeabiである必要はないということですこのようなミトコンドリア外膜の完全性を損なう可能性がありますジギトニンまたはサポニン4、6、などの界面活性剤とlized。単離ミトコンドリアの別の利点は、酸素消費量としてミトコンドリアの機能の分析を妨害し得る他のサイトゾル因子の欠如です。単離されたミトコンドリアを用いての欠点は、単離されたミトコンドリア7,8の良好な収率を得るために遠心分離工程中のあるミトコンドリアの集団の可能な選択、均質化の間にミトコンドリアの損傷、および生物学的サンプルの大量の要求です。
分離手順の後、ミトコンドリア複合体I、II-IV及び依存(状態2,3および4)の呼吸速度は、高解像度の呼吸計測を使用して決定されます。複合体I-駆動呼吸のために、グルタミン酸リンゴ酸は、アデノシン二リン酸(ADP)を加え、続いています。複合体II駆動型の呼吸のために、コハク酸は、ADPを添加し、続いています。複雑なIV-駆動呼吸については、アスコルビン酸及びtetramethylphenylendiamine(TMPD)はADP 9、10、11、12、続いて添加されます。状態2は、単独で、基質の存在下での酸素消費量を指します。状態3は、基板と、ADPの存在下での酸素消費量を指します。状態4は、ADPの枯渇後の酸素消費量を指します。呼吸調節比(RCR)は、酸素消費量のATP生産の結合の指標であり、状態3及び状態4 13、15との間の比として計算されます。
要約すると、我々は、差動遠心分離により、機能と無傷の骨格筋のミトコンドリアを単離し、これらの単離されたmitochonを使用するプロトコルを記述しますこのような高解像度の呼吸計測などの機能や生体エネルギー研究のためdria。
プロトコル
大腿四頭筋生検は、ミトコンドリアを分画遠心分離によって分離されて、そこから麻酔したブタから採取されます。豚は別の実験のために後で使用されます。研究は、実験動物の管理と使用のためにとベルン、スイスの動物ケア委員会の承認を得て国立衛生研究所のガイドラインに従って行われます。
1.骨格筋の均質化とミトコンドリアの単離
- 消費税麻酔したブタ5〜10グラムの大腿四頭筋標本。本発明のアッセイでは、ブタの骨格筋を使用しています。このプロトコルは、他の種からミトコンドリアを単離することができる( 例えば 、ラット、マウス、ヒト、 など )。
注:この手順は、手術を専門とする医療専門家によって行われます。- 筋肉内ケタミン(20 mgの/ kg)およびキシラジン(2 mgの/ kg)で鎮静ブタ、麻酔内で誘導される前静脈ミダゾラム(0.5ミリグラム/キログラム、プラスアトロピン0.02ミリグラム/キログラム)。手術中にプロポフォールの連続静脈内注入(1時間当たり4-8ミリグラム/キログラム)で麻酔し、フェンタニル(1時間当たり30μgの/キログラム)を維持。
- 直ちに氷冷ミトコンドリアの単離緩衝液( 表1)の20 mLを含むビーカーに組織試料を浸します。
注:ホモジナイズし、遠心分離中に使用される緩衝液は、冷たい氷であると細胞質ゾルと互換性のイオン性及び浸透強度と生理的に適切なpHを有していなければなりません。 - 分析風袋を計ったバランスのビーカー内の組織サンプルを秤量します。風袋分離バッファの20ミリリットルを入れたビーカーとのバランス。
- アイスバケットにビーカーを置きます。
注:アイスバケット温度で均質化の手順については、次の手順をすべて実行し、アイスバケットにすべてのバッファを保持します。 - ビーカーの中に骨格筋をみじん切り罰金scissを使用して3-4分間1〜2ミリメートル小片に(氷上で保持)ORS。
- 氷冷分離バッファ(各20mL洗浄工程)で2回ビーカー内のみじん切り組織をすすいでください。
- 5 mgのプロテアーゼ/ g組織を含む組織重量(g)当たりの単離緩衝液の10体積の組織を一時停止します。
- マグネチックスターラー上で氷浴中でビーカーを置き、10分間攪拌します。
- 0.2%(重量/体積)の脱脂ウシ血清アルブミン(BSA)を補充した組織の重量(g)当り分離緩衝液の追加の10容量のビーカー中の懸濁液を希釈します。
- 0.2%BSAを補充した単離緩衝液のすべてをデカントし、0.2%BSA(20 mLを各洗浄工程)を補充した氷冷分離緩衝液で2回ビーカー中で組織をすすぎます。
- 脱脂BSAと0.2%を補充した組織の重量(g)当り分離緩衝液の10体積の組織を再懸濁します。
- ゆったりと乳棒(10ストローク)で(氷上で保持)半自動ガラスホモジナイザーで組織をホモジナイズします。
注:Homogeniz同様に、常に電子組織(ストロークの同じ数、 例えば 、10ストローク)。ストローク数が多いほど、ミトコンドリアを損傷し、切り離すことができます。好ましくは、自動化されたホモジナイザーを用いて組織をホモジナイズします。手動で(および主観)ガラスホモジナイザーでホモジナイズした組織試料は、単離されたミトコンドリアの異なる品質を生成することができます。 - 遠心分離機万×gで10分間4℃でホモジナイズした組織。
注:すべての遠心操作は固定角ローターと遠心機で実行されています。 - (10ミリリットル/ g組織)血清学的ピペットを用いて上清を捨て、BSAを補充した氷冷分離培地にペレットを再懸濁します。
- 遠心分離機350×gで10分間4℃でサスペンション。
- 血清学的ピペットを用いて上清を予約し、ペレット(細胞破片を)捨てます。
- 細胞debrを除去するために、ガーゼの2層(17スレッド/ cm 2)を介して(氷上で保持)ビーカーに上清をフィルターです。
- 遠心分離機7000×gで10分間4℃で懸濁液を濾過。
- 上清を捨て、7000×gで10分間4℃で0.2%(重量/体積)BSAおよび遠心サスペンションを補充した単離緩衝液(5ミリリットル/ g組織)中の粗ミトコンドリアペレットを再懸濁。
- 上清を捨て、洗浄緩衝液(表1)中の粗ミトコンドリアペレットを再懸濁。遠心分離機7000×gで10分間4℃で再びサスペンション。
- 上清を捨て、7000 X gで10分間4℃で再び洗浄緩衝液および遠心分離中の懸濁液を、粗ミトコンドリアペレットを再懸濁。
- 上清を捨て、洗浄緩衝液1.0mLの中の粗ミトコンドリアペレットを再懸濁。
- ミトコンドリア懸濁液のタンパク質濃度を決定し、氷上で濃厚ミトコンドリア懸濁液を保ちます。
注記:タンパク質濃度は、任意の標準的な方法を用いて測定することができます。 - 直前アッセイ呼吸計測するために、0.4 mg / mlでミトコンドリアタンパク質の最終濃度に呼吸緩衝液中のミトコンドリア懸濁液を再懸濁します。
2.高解像度の呼吸計測
- ピペット高解像度oxygraph室に呼吸緩衝液( 表1)16の2.1 mL及び連続の安定した酸素フラックス信号まで1時間、37℃でチャンバ内に存在する磁気撹拌棒(700 rpm)を用いて緩衝液をかき混ぜますポーラログラフ酸素センサが得られます。
注:各oxygraph室内のポーラログラフ酸素電極は、酸素濃度を測定し、各チャンバー内の酸素消費量(フラックス)を計算します。酸素濃度と酸素消費速度(フラックス)は、データ収集および分析のためのソフトウェアを使用してコンピュータにオンラインでリアルタイムに表示されます。また、正確で信頼性のある結果を確保するために、楽器の酸素のバックグラウンド補正があるべきです製造業者の指示に従って行いました。
注:呼吸バッファの正確2.1 mLの栓を閉じた後、2.0 mLの最終チャンバ容積の較正のためのチャンバーに添加されます。 - 製造業者のプロトコル17に従ってポーラログラフ酸素センサのエアキャリブレーションを実行します。
注意:空気校正の間、気相に存在して、メディアの酸素濃度は、15〜20分程度で平衡化します。温度、気圧、およびメディア - 酸素濃度の溶解度に応じて算出することができます。 - エアキャリブレーション後、oxygraph室から呼吸培地を吸引し、oxygraphのチャンバーにステップ1.24から単離されたミトコンドリア懸濁液(0.4 mg / mlでミトコンドリアタンパク質)の2.1 mLを加え。
注:呼吸バッファの容量が設定し、機器とメーカーによって異なります。高解像度の呼吸計測のために、呼吸府の2.1 mLのfferはストッパーを閉じた後、2.0 mLの最終チャンバ容積の較正のためのチャンバーに添加されます。 - ストッパーの挿入によってoxygraph室を閉じます。
- 連続して37℃のチャンバ内に存在する磁気攪拌棒(700 rpm)を用いて、ミトコンドリア懸濁液を撹拌し、安定した酸素フラックス信号が達成されるまで、3〜5分間、ベースライン時に細胞呼吸を記録。
注:酸素濃度と酸素フラックス信号はデータ収集および分析17のためのソフトウェアを使用してコンピュータにオンラインでリアルタイムに表示されます。 - その後、以下の標準的なプロトコルを使用して、ストッパのチタン注入ポートを介してミトコンドリア呼吸の基質と阻害剤を注入します。
3.複合体I-依存呼吸
- ステップ2.1から2.5に記載の手順に従って、単離されたミトコンドリア懸濁液(0.4ミリグラム/ ml)を含むoxygraph室を準備し、安定した信号を待ちます。
- チャンバーストッパーのチタン注入口から分離されたミトコンドリア懸濁液(0.4ミリグラム/ ml)を含むoxygraph室に0.8 Mリンゴ酸(5mMの最終濃度)の12.5μLと2 Mグルタミン酸(10mMの最終濃度)の10μLを注入し、安定した酸素フラックス信号が達成されるまで、3〜5分間、細胞呼吸を記録。
注:以下の手順のすべての注射は注射器を使用してストッパーのチタン注入ポートを介して実行されます。 - チャンバーストッパーのチタン注入口からoxygraph室に0.05 M ADP(0.25ミリモル)の10μLを注入し、酸素フラックス信号が増加するまで、ミトコンドリア呼吸を記録し、その後減少し、安定化(3-5分)。
注:ADP添加後の呼吸の高原は、ADP濃度が高く、飽和したことを示しています。呼吸中に使用されるミトコンドリアの量に応じて、ADP濃度を滴定されるべきです安定した状態3の酸素消費量(最大呼吸)のために。ミトコンドリア懸濁液にADPの添加は、(状態3呼吸)を増加させる酸素消費量の増加及び酸素フラックスシグナルを誘発します。 ADPが消費された後、酸素フラックス信号は(状態4呼吸)が低くなります。
4.複合体II依存の呼吸
- ステップ2.1から2.5に記載されており、安定した信号を待つ手順に従って、単離されたミトコンドリア懸濁液(0.4ミリグラム/ ml)を含むoxygraph室を準備します。
- 注射器を用いてチャンバストッパーのチタン注入ポートを介してoxygraph室に0.2 mMのロテノン(0.2μM)「注意」の2μLを注入し、安定した酸素フラックス信号が達成されるまで、3〜5分間、細胞呼吸を記録。
注:ロテノンは危険毒であり、ヒトの健康に重大な影響を有することができます。 - oxygraphのCHに1 Mコハク酸(10mMの)の20μLを注入アンバーと安定した酸素フラックス信号が達成されるまで、3〜5分間、ミトコンドリア呼吸を記録します。
- チャンバーストッパーのチタン注入口からoxygraph室に0.05 M ADP(0.25ミリモル)の10μLを注入し、酸素フラックス信号が増加するまで、細胞呼吸を記録し、安定化、その後減少し、安定化(3-5分)。
注:ミトコンドリア懸濁液にADPの添加は、(状態3呼吸)を増加させる酸素消費量の増加及び酸素フラックスシグナルを誘発します。 ADPが消費された後、酸素フラックス信号は(状態4呼吸)が低くなります。
5.複合体IV依存の呼吸
- 手順プロトコルの2.5から2.1と安定した信号を待つに記載の手順に従って、単離されたミトコンドリア懸濁液を含むoxygraph室(0.4ミリグラム/ mL)を準備します。
- その後、0.8 mMのアスコルビン酸(1ミリモル)の2.5μLを注入。その直後に0.2の2.5μLを注入M TMPD(0.25ミリモル)および0.05 M ADP(0.25ミリモル)の10μLoxygraph室へと酸素フラックス信号が増加するまで、細胞呼吸を記録し、(3-5分)を安定化させます。
- 最後にoxygraph室に1 Mアジ化ナトリウム(5 mM)の「警告」の10μLを注入し、酸素フラックス信号が減少するまで、細胞呼吸を記録し、安定化させます。
注:アジ化ナトリウムは危険毒であり、ヒトの健康に重大な影響を有することができます。
6.チトクロームCテスト
- 手順プロトコルの2.5から2.1と安定した信号を待つに記載の手順に従って、単離されたミトコンドリア懸濁液を含むoxygraph室(0.4ミリグラム/ mL)を準備します。
- チャンバーストッパーのチタン注入口から分離されたミトコンドリア懸濁液(0.4ミリグラム/ ml)を含むoxygraph室に0.8 Mリンゴ酸(5mMの最終濃度)の12.5μLと2 Mグルタミン酸(10mMの最終濃度)の10μLを注入し安定した酸素フラックス信号が達成されるまで、3〜5分間、細胞呼吸を記録。
- チャンバーストッパーのチタン注入口からoxygraph室に0.5 M ADP(2.5 mM)の10μLのを注入し、酸素フラックス信号が増加するまで、ミトコンドリア呼吸を記録し、その後減少し、安定化(3-5分)。
- 最後に、oxygraph室に4mMのシトクロムc(10μM)の5μLを注入し、安定した酸素フラックス信号が達成されるまで5分間細胞呼吸を記録。
結果
複合体I-依存呼吸
単離されたミトコンドリア複合体I依存呼吸数(状態2、図3、図4)は、高解像度の呼吸計測( 図1、代表的な図)を用いて決定されます。ミトコンドリア複合体I基板、グルタミン酸とリンゴ酸は、ADPを加え、続いています。状態2は、単独で、基質の存在下での酸素消費量を指します。状態3は、基板と、ADPの存在下での酸素消費量を指します。状態4は、ADPの枯渇後の酸素消費量を指します。 RCRはATP生産に酸素消費の結合の指標であり、 図1に示すように、状態3及び状態4の間の比として計算される、ADPを添加すると、直ちにミトコンドリア呼吸速度が上昇する(状態3呼吸)、およびその後、非常にsのレベルに(状態4呼吸)を減少させますこれは、高RCRを示し、ミトコンドリアの完全性がよく分離手順中に保存される状態2の場合とimilar。 図2は、不適切と失敗ミトコンドリアの分離を示す、ハイ状態4呼吸速度と低い状態3呼吸速度とRCRの測定の代表的な図です。状態4で高い呼吸速度がミトコンドリアプロトン漏出15の指標です。

図1: 成功したミトコンドリアの単離:ミトコンドリアの完全性は十分に分離手順の間に保持されます。基材(複合体I-依存呼吸)としてグルタミン酸とリンゴ酸を使用した高解像度の呼吸計測からの追跡。青い線は、酸素濃度を表します。赤い線は、酸素流(酸素濃度の勾配)を表します。オキシ単離されたミトコンドリアが利用可能な酸素を使用するようGEN濃度が経時的に減少します。酸素消費量は、ピコモル/(SX mgのミトコンドリアタンパク質)として表されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
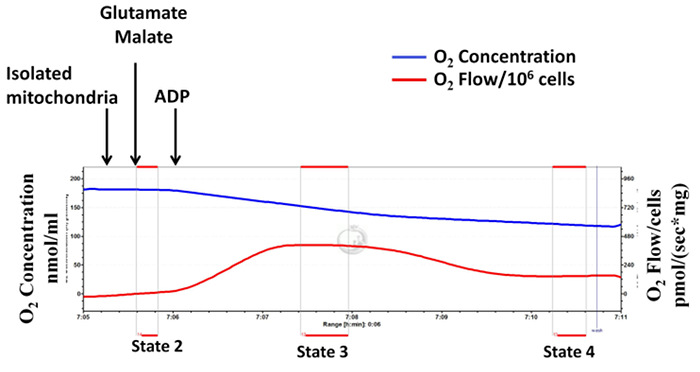
図2:失敗したミトコンドリアの単離:ミトコンドリアの整合性がよく、不適切なミトコンドリアの分離を示す単離手順の間に保持されません。基材(複合体I-依存呼吸)としてグルタミン酸とリンゴ酸を使用した高解像度の呼吸計測からの追跡。青い線は、酸素濃度を表します。赤い線は、酸素流(酸素濃度の勾配)を表します。単離されたミトコンドリアがご利用できますを使用するように酸素濃度が経時的に減少しますル酸素。酸素消費量は、ピコモル/(SX mgのミトコンドリアタンパク質)として表されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
複合体II依存性の呼吸
単離されたミトコンドリア複合体II依存性呼吸数(状態2、図3、図4)は、高解像度の呼吸計測( 図3、代表的な図)を用いて決定されます。このアッセイでは、ミトコンドリア複合体Iのロテノンの添加によって阻害され、その後コハク酸塩(複合体II基板)ADP、続いて添加されます。 図3は、すぐに、ADPを添加することは、ミトコンドリア呼吸の増加を示し、その後、状態2のものと非常に類似のレベルまで減少し、十分に結合されたミトコンドリアを示し、そのミトコンドリアの完全性は十分に分離手順の間に保持されます。この典型的な実験のために計算されたRCR値は、入手可能な文献10、11、23)に示す値とほぼ一致している、4.23です。 図4は、不適切な分離を示すハイ状態4呼吸速度と、低い状態3呼吸速度とRCRの測定の代表的な図です。
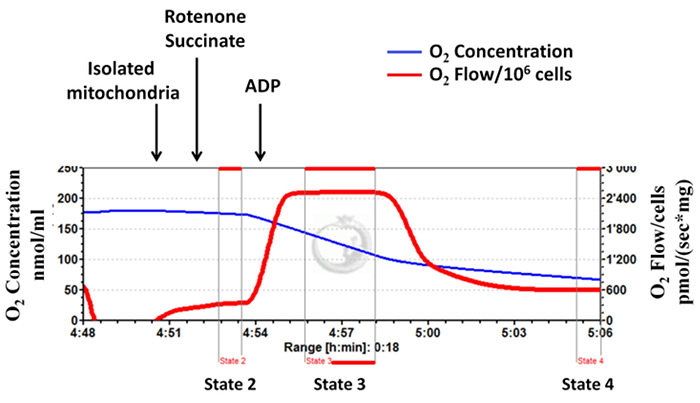
図3: 成功したミトコンドリアの単離:ミトコンドリアの完全性は十分に分離手順の間に保持されます。基板(複合体II-依存呼吸)としてコハク酸を用いて、高解像度の呼吸計測からの追跡。青い線は、酸素濃度を表します。赤い線は、酸素流量(の傾きを表し、酸素濃度)。単離されたミトコンドリアが利用可能な酸素を使用するように酸素濃度が経時的に減少します。酸素消費量は、ピコモル/(SX mgのミトコンドリアタンパク質)として表されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図4: 失敗したミトコンドリアの単離:ミトコンドリアの整合性がよく、不適切な分離を示す単離手順の間に保持されません。基板(複合体II-依存呼吸)としてコハク酸を用いて、高解像度の呼吸計測からの追跡。青い線は、酸素濃度を表します。赤い線は、酸素流(酸素濃度の勾配)を表します。酸素濃度は、単離されたmitocとして経時的に減少しますhondriaは、利用可能な酸素を使用します。酸素消費量は、ピコモル/(SX mgのミトコンドリアタンパク質)として表されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
複合体IV依存の呼吸
単離されたミトコンドリア複合体IVに依存する呼吸数(状態2、3)は、高解像度の呼吸計測( 図5、代表図)を用いて決定されます。このアッセイのためにアスコルビン酸/ TMPDおよびADPは、複雑なIVを阻害するアジ化ナトリウム、続いて添加されます。
アジ化ナトリウムを添加する前と後の酸素消費量との差は、実際の複雑なIV呼吸として解釈されます。 図5は measurの代表的な図です。ミトコンドリアの完全性がよく分離手順中に保持されていることを示す高複雑なIV-依存状態3呼吸速度のement。対照的に、 図6は、不適切な分離を示すロー状態3の測定の代表的な図です。

図5: 成功したミトコンドリアの単離:ミトコンドリアの完全性は十分に分離手順の間に保持されます。基板(複雑なIV-依存呼吸)としてアスコルビン酸/ TMPDを使用して、高解像度の呼吸計測からの追跡。複合体IV呼吸(状態3)のアジ化ナトリウムを添加する前と後の酸素消費量を減算することによって解釈されます。青い線は、酸素濃度を表します。赤い線は、酸素流(酸素濃度の勾配)を表します。酸素濃度は、単離されたmitochoとして経時的に減少します利用可能な酸素を使用ndria。酸素消費量は、ピコモル/(SX mgのミトコンドリアタンパク質)として表されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図6: 失敗したミトコンドリアの単離:ミトコンドリアの整合性がよく、不適切な分離を示す単離手順の間に保持されません。基板(複雑なIV-依存呼吸)としてアスコルビン酸/ TMPDを使用して、高解像度の呼吸計測からの追跡。複合体IV呼吸(状態3)のアジ化ナトリウムを添加する前と後の酸素消費量を減算することによって解釈されます。青い線は、酸素濃度を表します。赤い線は、酸素流(酸素濃度の勾配)を表します。酸素conce単離されたミトコンドリアが利用可能な酸素を使用するようntrationは、時間の経過とともに減少します。酸素消費量は、ピコモル/(SX mgのミトコンドリアタンパク質)として表されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
シトクロムcを用いて、ミトコンドリア外膜の完全性の評価
ミトコンドリア調製物の品質を評価するために、シトクロムc試験をグルタミン酸とリンゴ酸のその後の添加後にミトコンドリア呼吸を測定することによって、ミトコンドリア外膜の完全性を決定するために実行され、ADPおよびシトクロムc(ADPは、複雑なII依存状態3呼吸を刺激しましたシトクロムcの存在)。 図7に示すように、シトクロムcは、複素I依存状態3再増強しません単離ミトコンドリアのspiration、そこミトコンドリア外膜からシトクロムcの損失をしなかったし、ミトコンドリアの完全性が維持されていることを示します。
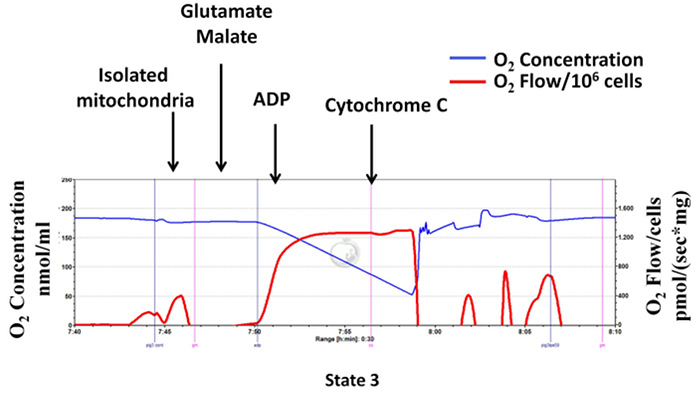
図 7: シトクロムcは、単離された ミトコンドリア の呼吸を増強しない : ミトコンドリアの完全性は十分に分離手順の間に保持されます。基板(複合体I-依存呼吸)としてグルタミン酸/リンゴ酸を使用した高解像度の呼吸計測からの追跡。青い線は、酸素濃度を表します。赤い線は、酸素流(酸素濃度の勾配)を表します。単離されたミトコンドリアが利用可能な酸素を使用するように酸素濃度が経時的に減少します。酸素消費量は、ピコモル/(SX mgのミトコンドリアタンパク質)として表されます。メートル/ファイル/ ftp_upload / 55251 / 55251fig7large.jpg "ターゲット=" _空白"> この図の拡大版をご覧になるにはこちらをクリックしてください。
| ミトコンドリア分離バッファ | |
| 化学物質 | 濃度 |
| 塩化カリウム | 100 mMの |
| 硫酸マグネシウム | 10 mMの |
| モルホリノスルホン酸(MOPS) | 50 mMの |
| エチレンジ酢酸(EGTA) | 1.0 mMの |
| ATP | 1.1 mMの |
| pHが7.4 | |
| ミトコンドリアの洗浄緩衝液 | |
| 化学物質 | 濃度 |
| 塩化カリウム | 100 mMの |
| MOPS | 50 mMの |
| EGTA | 0.5 mMの |
| pHが7.4 | |
| ミトコンドリア呼吸バッファ 16 | |
| 化学物質 | 濃度 |
| スクロース | 110 mMの |
| EGTA | 0.5 mMの |
| MgCl 2 | 3.0 mMの |
| 塩化カリウム | 80 mMの |
| K-ラクトビオン | 60 mMの |
| KH 2 PO 4 | 10 mMの |
| タウリン | 20 mMの |
| ヘペス | 20 mMの |
| BSA | 1.0g / L |
| pHは7.1 | |
表1:緩衝液の組成物。
ディスカッション
本研究において、我々は、無傷でしっかりこのような高解像度の呼吸計測等の機能的研究のために使用することができる差動遠心分離によって骨格筋のミトコンドリアを結合、高品質を単離するためのプロトコルを説明します。
無傷と密結合ミトコンドリアを単離するために、本プロトコル内で考慮すべきいくつかの重要なポイントがあります。骨格組織を採取した後、直ちに氷冷したミトコンドリアの単離緩衝液中に浸漬する必要があります。全ての遠心操作は4℃で行われるべきであり、ミトコンドリア懸濁液は、単離の間に氷の上に常に保たれるべきです。単離手順は、可能な限り迅速に行われるべきです。ホモジネートは、クリーン界面活性剤を含まない遠心管中で遠心分離されるべきです。手順の終わりに、ミトコンドリア懸濁液を濃縮保たれるべきであり、呼吸計測直前に希釈します。呼吸計測データは、第二のPEあたりピコモルとして表されているのでミトコンドリアタンパク質のRミリグラム、正確に分離した後、ミトコンドリアタンパク質の濃度を測定するために良好な技術を使用することが重要です。
いくつかのミトコンドリアの単離手順では、ミトコンドリアが非結合であるか、または高解像度の呼吸計測を使用して適切に酸素を消費しないことが起こるかもしれません。これらの問題を克服するために、組織は常にゆったり乳棒(ステップ1.12)でホモジナイザーを用いて同様(ストロークの数が同じ)で均質化されるべきです。ここで、我々は常に10ストロークで自動化されたホモジナイザーを用いて骨格筋組織を均質化。ストローク数が多いほど、ミトコンドリアを損傷し、切り離すことができます。手動で(および主観)ガラスホモジナイザーでホモジナイズした組織試料は、単離されたミトコンドリアの異なる品質を生成することができます。ミトコンドリアの凍結することも、非結合ミトコンドリアになることがあり、もう一方は遠心分離がなく、このテの下に4°Cで行われていることを確認する必要がありますmperature。緩衝溶液のpHが間違っているか、遠心分離管がきれいでない場合はミトコンドリアの完全性は、同様に損なわれる可能性があります。一つは、遠心分離管が界面活性剤を含まない、適切に洗浄されていることを確認する必要があります。
分離時に考慮すべき最初の重要な要因の一つは、穏やかな方法で組織を均質化することです。硬組織は、はるかに強い機械的な力を必要とするのに対し、軟組織は、均質化の間に適用される穏やかな機械的な力を必要とします。均質化および遠心分離の際に使用される緩衝液は、冷たい氷であると細胞質ゾルと互換性のイオン性及び浸透強度と生理的に適切なpHを有していなければなりません。例えば、骨格筋などの硬組織のために、機械的な均質化の後、トリプシンなどのプロテアーゼは、組織4,5を脱凝集するために添加することができます。
Dに基づいて、単離ミトコンドリアのいくつかの制限、ifferential遠心私は均質化中の特定のミトコンドリアの電子伝達鎖複合体のサブユニットでⅲ)損失の可能性や変更、ミトコンドリアの単離のために必要な組織標本のii)の大量、均質化および単離手順19の間に)可能性が損傷したミトコンドリアであり、遠心分離は、18ステップ 、およびiv)ミトコンドリア機能18と干渉することができる均質化および遠心分離工程の間、反応性酸素種の産生の増加します。ダウンス均質化および分画遠心法の利点は、密度勾配遠心分離20として既存の方法に対して呼吸実験のために、粗ミトコンドリアを単離する方法は迅速であり、ミトコンドリアを短時間で分離されていることです。したがって、呼吸の実験は、1内で実行することができます時間。また、手順は非常に効率的で、安価であり、分画遠心分離によって得られたミトコンドリアは、呼吸計測分析のために使用することができます。単離ミトコンドリアを用いたミトコンドリア酸素消費の調査は、透過性繊維や細胞に比べていくつかの利点を提供しています:ミトコンドリア機能と生体エネルギーを妨げる可能性がサイトゾルタンパク質との有意な干渉を。携帯透過性は必要ありません。ミトコンドリア呼吸鎖複合体の基質は、単離されたミトコンドリアに直接添加することができます。
骨格筋ミトコンドリア呼吸を測定するための別の方法の一つは、使用は、筋線維9を透過性です。単離ミトコンドリアを超える透過性筋線維の利点のいくつかされているi)は、機械的均質化工程が必要でないと、ⅱ)組織(数mg)の非常に少量が呼吸計測アッセイのために必要とされます。 Pの欠点ermeabilized筋肉の繊維が繊維束中のミトコンドリアに低い酸素拡散です。この拡散制限は、呼吸計測アッセイ中のADPのより大きな金額を必要とします。他の代替方法は、非常に迅速な方法であり、ミトコンドリアを単離するための差動遠心分離工程を必要としない、全組織ホモジネート22、の使用です。全組織ホモジネートの使用は、それらの単離の間にいくつかのミトコンドリアの損失を防止することができるが、このような酸素消費量としてミトコンドリアの機能の分析を妨害する可能性が存在する他のサイトゾル因子が存在してもよいです。
呼吸アッセイのために、粗ミトコンドリアを単離するために、差動遠心分離を習得した後、将来のアプリケーションは、ミトコンドリア外膜抗TOM22(ミトコンドリア外膜22ホモログのカーゼ)抗体couplを使用するなど、新興技術により単離されたミトコンドリアの呼吸能力を調査することですエド磁気ビーズ21。
開示事項
The authors have nothing to disclose.
謝辞
This study was supported by the Swiss National Science Foundation (Grant 32003B_127619).
資料
| Name | Company | Catalog Number | Comments |
| ADP | Sigma | A 4386 | Chemical |
| Antimycin A | Sigma | A 8674 | Chemical, dissolve in ethanol |
| Ascorbate | Merck | 1.00127 | Chemical |
| ATP | Sigma | A 7699 | Chemical |
| BSA | Sigma | A 6003 | Chemical |
| EGTA | fluka | 3779 | Chemical |
| Glutamate | Sigma, | G 1626 | Chemical |
| Hepes | Sigma | H 7523 | Chemical |
| KCl | Merck | 1.04936 | Chemical |
| KH2PO4 | Merck | 1.04873 | Chemical |
| K-lactobionate | Sigma | L 2398 | Chemical |
| MgCl2 | Sigma | M 9272 | Chemical |
| Morpholinopropane sulphonic acid (MOPS) | Merck | 1.06129 | Chemical |
| O2k-Core: Oxygraph-2k | Oroboros Instruments | 10000-02 | High-resolution respirometry instrument |
| Proteinase, bacterial | Sigma | P 8038 | Chemical |
| Sodium azide | Sigma | S2002 | Chemical |
| Rotenone | Sigma | R 8875 | Chemical, dissolve in ethanol |
| Succinate | Sigma | S 2378 | Chemical |
| Schuett homogen-plus semiautomatic homogeniser | schuett-biotec GmbH | 3.201 011 | Tissue homogenizer |
| Taurine | Sigma | T 8691 | Chemical |
| TMPD | Sigma | T 3134 | Chemical |
参考文献
- Hogeboom, G. H., Schneider, W. C., Pallade, G. E. Cytochemical studies of mammalian tissues. I. Isolation of intact mitochondria from rat liver; some biochemical properties of mitochondria and submicroscopic particulate material. J. Biol. Chem. 172, 619-635 (1948).
- Sims, N. R. Rapid isolation of metabolically active mitochondria from rat brain and subregions using Percoll density gradient centrifugation. J. Neurochem. 55 (2), 698-707 (1990).
- Hartwig, S., et al. A critical comparison between two classical and a kit-based method for mitochondria isolation. Proteomics. 9 (11), 3209-3214 (2009).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 65, 1-35 (2001).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
- Niklas, J., Melnyk, A., Yuan, Y., Heinzle, E. Selective permeabilization for the high-throughput measurement of compartmented enzyme activities in mammalian cells. Anal. Biochem. 416 (2), 218-227 (2011).
- Kuznetsov, A. V., et al. Analysis of mitochondrial function in situ in permeabilized muscle fibers, tissues and cells. Nat. Protoc. 3 (6), 965-976 (2008).
- Perry, C. G., Kane, D. A., Lanza, I. R., Neufer, P. D. Methods for assessing mitochondrial function in diabetes. Diabetes. 62 (4), 1041-1053 (2013).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle: new perspectives of mitochondrial physiology. Int. J. Biochem. Cell Biol. 41 (10), 1837-1845 (2009).
- Vuda, M., et al. Effects of catecholamines on hepatic and skeletal muscle mitochondrial respiration after prolonged exposure to faecal peritonitis in pigs. Innate Immun. 18 (2), 217-230 (2012).
- Corrêa, T. D., et al. Angiotensin II in septic shock: effects on tissue perfusion, organ function, and mitochondrial respiration in a porcine model of fecal peritonitis. Crit. Care Med. 42 (8), e550-e559 (2014).
- Jeger, V., et al. Dose response of endotoxin on hepatocyte and muscle mitochondrial respiration in vitro. Biomed Res Int. 2015, 353074 (2015).
- Nicholls, D. G., Ferguson, S. J. . Bioenergetics. 3, (2002).
- Chance, B., Williams, G. R. The respiratory chain and oxidative phosphorylation. Adv. Enzymol. Relat. Subj. Biochem. 17, 65-134 (1956).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochem. J. 435 (2), 297-312 (2011).
- Gnaiger, E., Méndez, G., Hand, S. C. High phosphorylation efficiency and depression of uncoupled respiration in mitochondria under hypoxia. Proc. Natl. Acad. Sci. USA. 97 (20), 11080-11085 (2000).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods Mol. Biol. 810, 25-58 (2012).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard isolation methods. PLoS One. 6 (3), e18317 (2011).
- Picard, M., et al. Mitochondrial functional impairment with aging is exaggerated in isolated mitochondria compared to permeabilized myofibers. Aging Cell. 9 (6), 1032-1046 (2010).
- Graham, J. M. Purification of a crude mitochondrial fraction by density-gradient centrifugation. Curr. Protoc. Cell. Biol. Chapter 3. 3, (2001).
- Franko, A., et al. Efficient isolation of pure and functional mitochondria from mouse tissues using automated tissue disruption and enrichment with anti-TOM22 magnetic beads. PLoS One. 8 (12), 382392 (2013).
- Pecinová, A., Drahota, Z., Nůsková, H., Pecina, P., Houštěk, J. Evaluation of basic mitochondrial functions using rat tissue homogenates. Mitochondrion. 11 (5), 722-728 (2011).
- Lombardi, A., et al. Characterisation of oxidative phosphorylation in skeletal muscle mitochondria subpopulations in pig: a study using top-down elasticity analysis. FEBS Lett. 475 (2), 84-88 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved