Method Article
Aislamiento de mitocondrias intactas de músculo esquelético por centrifugación diferencial para Medidas respirometría de alta resolución
En este artículo
Resumen
Here, a quadriceps muscle specimen is taken from an anaesthetized pig and mitochondria are isolated by differential centrifugation. Then, the respiratory rates of mitochondrial respiratory chain complexes I, II and IV are determined using high-resolution respirometry.
Resumen
Mitochondria are involved in cellular energy metabolism and use oxygen to produce energy in the form of adenosine triphosphate (ATP). Differential centrifugation at low- and high-speed is commonly used to isolate mitochondria from tissues and cultured cells. Crude mitochondrial fractions obtained by differential centrifugation are used for respirometry measurements. The differential centrifugation technique is based on the separation of organelles according to their size and sedimentation velocity. The isolation of mitochondria is performed immediately after tissue harvesting. The tissue is immersed in an ice-cold homogenization medium, minced using scissors and homogenized in a glass homogenizer with a loose-fitting pestle. The differential centrifugation technique is efficient, fast and inexpensive and the mitochondria obtained by differential centrifugation are pure enough for respirometry assays. Some of the limitations and disadvantages of isolated mitochondria, based on differential centrifugation, are that the mitochondria can be damaged during the homogenization and isolation procedure and that large amounts of the tissue biopsy or cultured cells are required for the mitochondrial isolation.
Introducción
bioenergética mitocondrial y capacidades respiratorias pueden ser estudiados no sólo en las células permeabilizadas o fibras, sino también en las mitocondrias aisladas. En el presente estudio, se describe un protocolo para aislar las mitocondrias del músculo esquelético intactas utilizando centrifugación diferencial para las mediciones de respirometría de alta resolución.
Para aislar las mitocondrias intactas para respirometría, el tejido se homogeneiza y mitocondrias están aislados por un método de centrifugación diferencial convencional. El método de centrifugación diferencial se basa en centrifugaciones secuenciales (en una serie de aumentar la velocidad) del tejido homogeneizado fue introducido por primera vez por Pallade y compañeros de trabajo hace casi 70 años 1. El tejido se pica primero con unas tijeras y se homogeneiza mecánicamente en un homogeneizador de vidrio con una mano de mortero holgada. Después, el homogeneizado se centrifugó a baja velocidad y el sedimento resultante que contiene tejido ininterrumpida, celularescombros y los núcleos se desecha. Entonces, el sobrenadante se centrifugó varias veces a alta velocidad y se recoge la fracción enriquecida mitocondrial. Las ventajas del método de centrifugación diferencial para aislar las mitocondrias son que: i) el método es rápido y mitocondrias se puede aislar dentro de 1-1,5 h (experimentos respiratorias deben realizarse lo más rápido posible); ii) que es barato; y iii) es muy eficiente y las mitocondrias obtenidos por centrifugación diferencial son lo suficientemente puro para los ensayos de respirometría. Las desventajas de método de centrifugación diferencial para aislar las mitocondrias son que: i) las mitocondrias podrían dañarse y desacoplado durante la homogeneización; ii) la contaminación de las mitocondrias con otros componentes celulares (se podría solucionar por lavado adicional el sedimento mitocondrial con etapas de centrifugación adicionales); iii) la posibilidad de seleccionar diferentes subpoblaciones mitocondriales, por ejemplo, durante centrifugaciones diferenciales pasos, mitochondria con menor densidad se puede excluir 7; y iv) la mitocondrial circundante celular que falta y sólo la respiración máxima teórica se puede medir. Otro método para aislar las mitocondrias para los ensayos de respirometría es el gradiente de densidad de centrifugación 2. En esta técnica, el extracto de tejido se coloca en capas sobre una solución de sacarosa o un gradiente de Percoll (con una mayor densidad en la parte inferior del tubo de centrifugación) y se centrifugó a una velocidad determinada, haciendo que las mitocondrias que ser aislado de otros componentes celulares de acuerdo con su densidades. Este método se utiliza a menudo para aislar las mitocondrias del cerebro con muy baja contaminación de sinaptosomas. Sin embargo, las mitocondrias de hígado de rata aislados por centrifugación en gradiente de densidad están altamente contaminados con otros orgánulos celulares 3. Una de las limitaciones de este método es que el gradiente de sacarosa presente en el tubo de centrifugación podría romperse tanMe mitocondrias (choque osmótico).
Dependiendo del tipo de tejido; hay algunos factores importantes a considerar para el aislamiento de las mitocondrias intactas por centrifugación diferencial. La primera necesidad es para homogeneizar los tejidos de una manera suave. Los tejidos blandos tales como riñón, hígado y cerebro requieren fuerzas mecánicas suaves aplicadas durante la homogeneización. Esto contrasta con los tejidos duros, tales como el músculo cardíaco y esquelético que requieren fuerzas mecánicas mucho más fuerte. El tejido picado se trata generalmente con proteinasa antes de la homogeneización para suavizar el tejido. Todos los tampones utilizados durante la homogeneización y centrifugación debe ser enfriado en hielo y tienen un pH pertinente fisiológico con una fuerza iónica y osmótica compatible con citosol 4, 5.
Una de las ventajas de estudiar aislados bioenergética mitocondrial es que las membranas de plasma celular no necesitan ser permeabilized con detergentes tales como digitonina o saponina 4, 6, que podrían comprometer la integridad de la membrana externa mitocondrial. Otra ventaja de la mitocondrias aisladas es la ausencia de otros factores citosólicos, que pueden interferir con el análisis de las funciones mitocondriales tales como el consumo de oxígeno. Las desventajas de utilizar la mitocondria aisladas son la posible selección de ciertas poblaciones mitocondriales durante los pasos de centrifugación, el daño a la mitocondria durante la homogeneización, y el requisito de grandes cantidades de muestras biológicas con el fin de obtener un buen rendimiento de mitocondrias aisladas 7, 8.
Después de que el procedimiento de aislamiento, las tasas respiratorias de los complejos mitocondriales I, II- y IV-dependientes (estados 2, 3 y 4) se determinan mediante respirometría de alta resolución. Por complejo impulsado I respiración, glutamatoy malato se añaden seguido por difosfato de adenosina (ADP). Para la respiración complejo II-conducido, succinato es seguido de la ADP. Para el complejo IV impulsada por la respiración, ascorbato y tetramethylphenylendiamine (DPMT) se añaden seguido por ADP 9, 10, 11, 12. Estado 2 se refiere a consumo de oxígeno en la presencia de sustratos solo. Estado 3 se refiere a consumo de oxígeno en la presencia de sustratos y ADP. Estado 4 se refiere al consumo de oxígeno después de la depleción de ADP. La relación del control respiratorio (RCR) es un índice de acoplamiento de la producción de ATP consumo de oxígeno y se calcula como la relación entre el estado 3 y el estado 4 13, 15.
En resumen, se describe un protocolo para aislar las mitocondrias del músculo esquelético y funcionales intactas por centrifugación diferencial y utilizar estos mitochon aisladodría para los estudios funcionales y bioenergéticos como respirometría de alta resolución.
Protocolo
La biopsia del músculo cuádriceps se ha tomado de un cerdo anestesiado, a partir del cual las mitocondrias se aíslan mediante centrifugación diferencial. El cerdo se utiliza después para otro experimento. El estudio se realizó de acuerdo con los Institutos Nacionales de Salud directrices para el cuidado y uso de animales de experimentación y con la aprobación del Comité de Cuidado de Animales del cantón de Berna, Suiza.
1. La homogeneización del músculo esquelético y aislamiento mitocondrial
- Impuestos Especiales 5-10 g de muestras de músculo cuadriceps de un cerdo anestesiado. En el presente ensayo, utilizar el músculo esquelético porcino. Este protocolo también se puede utilizar para aislar las mitocondrias a partir de otras especies (por ejemplo, rata, ratones, humanos, etc.).
NOTA: Este paso se lleva a cabo por un médico especialista con experiencia en cirugía.- cerdos Sedate con ketamina intramuscular (20 mg / kg) y xilazina (2 mg / kg), antes de la anestesia se induce con intramidazolam venosa (0,5 mg / kg, más atropina 0,02 mg / kg). Mantener la anestesia con infusiones continuas intravenosas de propofol (4-8 mg / kg por h) y fentanilo (30 g / kg por h) durante la cirugía.
- Inmediatamente sumergir la muestra de tejido en un vaso de precipitados que contiene 20 ml de tampón de aislamiento mitocondrial enfriado con hielo (Tabla 1).
NOTA: Los tampones utilizados durante la homogeneización y centrifugaciones deben ser enfriado en hielo y tienen un pH pertinente fisiológico con una fuerza iónica y osmótica compatible con citosol. - Pesar la muestra de tejido en el vaso de precipitados en una balanza analítica tarado. Tarar la balanza con el vaso que contiene 20 ml de tampón de aislamiento.
- Colocar el vaso en un cubo de hielo.
NOTA: Realizar todos los pasos a seguir para el procedimiento de homogeneización a la temperatura cubo de hielo y mantener todos los buffers en el cubo de hielo. - Picar el músculo esquelético en el vaso (mantener en hielo) en 1-2 mm trozos pequeños de 3-4 min usando bien scissORS.
- Enjuague el tejido picado en el vaso de precipitados dos veces con tampón de aislamiento frío hielo (20 ml cada etapa de lavado).
- Suspender el tejido en 10 volúmenes del tampón de aislamiento por el peso del tejido (g) que contiene 5 mg de proteasa / g de tejido.
- Colocar el vaso de precipitados en un baño de hielo en el agitador magnético y se agita durante 10 min.
- Diluir la suspensión en el vaso de precipitados con 10 volúmenes adicionales de la memoria intermedia de aislamiento por el peso del tejido (g) suplementado con 0,2% (peso / volumen) de albúmina de suero bovino sin grasa (BSA).
- Decantar todo el tampón de aislamiento suplementado con 0,2% de BSA y enjuagar el tejido en el vaso de precipitados dos veces con tampón de aislamiento frío hielo suplementado con 0,2% de BSA (20 ml cada etapa de lavado).
- Resuspender el tejido en 10 volúmenes de tampón de aislamiento por el peso del tejido (g) suplementado con 0,2% con BSA desgrasada.
- Homogeneizar el tejido con un homogeneizador de vidrio semi-automático (mantener en hielo) con una mano de mortero holgada (10 golpes).
NOTA: Homogenize el tejido siempre de la misma manera (el mismo número de golpes, por ejemplo, 10 golpes). Un mayor número de golpes puede dañar y desacoplar las mitocondrias. Preferiblemente, homogeneizar el tejido usando un homogeneizador automatizado. Manualmente (y subjetivamente) muestras de tejido homogeneizadas en homogeneizadores de vidrio pueden producir diferentes calidades de mitocondrias aisladas. - Centrifugar el tejido homogeneizado a 4 ° C durante 10 min a 10.000 x g.
NOTA: Todas las etapas de centrifugación se llevan a cabo en centrífugas con rotor de ángulo fijo. - Descartar el sobrenadante usando una pipeta serológica y volver a suspender el sedimento en medio de aislamiento enfriado con hielo suplementado con BSA (10 ml / g de tejido).
- Centrifugar la suspensión a 4 ° C durante 10 minutos a 350 x g.
- Reservar el sobrenadante con una pipeta serológica y desechar el sedimento (restos celulares).
- Filtrar el sobrenadante a un vaso de precipitados (mantener en hielo) a través de dos capas de gasa (17 hilos / cm 2) para eliminar Debr célulaes.
- Centrifugar la suspensión se filtró a 4 ° C durante 10 minutos a 7000 x g.
- Eliminar el sobrenadante y resuspender el pellet mitocondrial crudo en el tampón de aislamiento (5 ml / g de tejido) suplementado con 0,2% (peso / volumen) de BSA y centrifugar la suspensión a 4 ° C durante 10 minutos a 7000 x g.
- Eliminar el sobrenadante y resuspender el pellet mitocondrial crudo en tampón de lavado (Tabla 1). Centrifugar la suspensión de nuevo a 4 ° C durante 10 minutos a 7000 x g.
- Eliminar el sobrenadante y resuspender el pellet mitocondrial crudo en tampón de lavado y se centrifuga de nuevo la suspensión a 4 ° C durante 10 minutos a 7000 x g.
- Eliminar el sobrenadante y resuspender el pellet mitocondrial crudo en 1,0 ml de tampón de lavado.
- Determinar la concentración de proteína de la suspensión mitocondrial y mantener la suspensión mitocondrial concentrado en hielo.
NOTA: La concentración de proteína se puede medir usando cualquier método estándar. - Justo antesa respirometría ensayos, resuspender la suspensión mitocondrial en el tampón de respiración a una concentración final de 0,4 mg de proteína mitocondrial / ml.
2. alta resolución Respirometría
- Pipetear 2,1 ml de tampón de respiración (Tabla 1) 16 en una cámara de oxygraph de alta resolución y se agita la memoria intermedia continuamente utilizando una barra de agitación magnética presente en la cámara (700 rpm) a 37 ° C durante 1 h hasta que una señal de flujo de oxígeno estable de se obtiene el sensor de oxígeno polarográfico.
NOTA: electrodos de oxígeno polarográficos dentro de cada cámara de oxygraph miden la concentración de oxígeno y calcular el consumo de oxígeno (flujo) dentro de cada cámara. La concentración de oxígeno y las tasas de consumo de oxígeno (flujo) se visualizan en tiempo real en línea en un ordenador utilizando el software de adquisición y análisis de datos. Además, con el fin de asegurar resultados precisos y fiables, oxígeno instrumentales corrección de fondo debe serrealizado de acuerdo con las instrucciones del fabricante.
NOTA: con precisión 2,1 ml de tampón de la respiración se añade en la cámara para la calibración de un volumen de la cámara final de 2,0 ml después de cerrar los tapones. - Realizar una calibración de aire del sensor de oxígeno polarográfico de acuerdo con los protocolos del fabricante 17.
NOTA: Durante la calibración de aire, con una fase gaseosa presente, la concentración de oxígeno se equilibrará los medios de comunicación del orden de 15-20 min. Dependiendo de la temperatura, la presión barométrica, y la solubilidad de la concentración de medios -oxygen se puede calcular. - Después de la calibración de aire, aspirar el medio de la respiración de la cámara oxygraph y añadir 2,1 ml de la suspensión mitocondrial aislado (0,4 mg / ml de proteína mitocondrial) de la etapa 1.24 a una cámara de la oxygraph.
NOTA: El volumen de tampón de la respiración depende de la configuración del instrumento y del fabricante. Para alta resolución respirometría, los 2,1 ml de bu respiraciónffer se añade en la cámara para la calibración de un volumen de la cámara final de 2,0 ml después de cerrar los tapones. - Cierre de la cámara de oxygraph mediante la inserción del tapón.
- Agitar la suspensión mitocondrial continuamente usando una barra magnética de agitación presente en la cámara (700 rpm) a 37 ° C y la respiración celular registro al inicio del estudio durante 3-5 minutos hasta que se logre una señal de flujo de oxígeno estable.
NOTA: La concentración de oxígeno y la señal de flujo de oxígeno se visualizan en tiempo real en línea en un ordenador utilizando el software de adquisición y análisis de datos 17. - Después, inyectar sustratos e inhibidores de la respiración mitocondrial a través de los puertos de inyección de titanio de los tapones usando los siguientes protocolos estándar.
3. Respiración Complejo I-dependiente
- Preparar una cámara de oxygraph que contiene la suspensión mitocondrial aislado (0,4 mg / ml) siguiendo el procedimiento descrito en los pasos 2.1-2.5 yesperar una señal estable.
- Inyectar 12,5 l de 0,8 M malato de (5 mM de concentración final) y 10 l de glutamato 2 M (10 mM de concentración final) en la cámara de oxygraph que contiene suspensión mitocondrial aislado (0,4 mg / ml) a través del puerto de inyección de titanio del tapón de cámara y grabar la respiración celular durante 3-5 minutos hasta que se consigue una señal de flujo de oxígeno estable.
NOTA: Todas las inyecciones en los siguientes pasos se realizan a través de los puertos de inyección de titanio de tapones utilizando jeringas. - Inyectar 10 l de 0,05 M ADP (0,25 mM) en la cámara de oxygraph a través del puerto de inyección de titanio del tapón de cámara y grabar hasta que la respiración mitocondrial se incrementa la señal de flujo de oxígeno, entonces disminuye y se estabiliza (3-5 min).
NOTA: La meseta de la respiración después de la adición de ADP indica que la concentración de ADP era alto y de saturación. Dependiendo de la cantidad de las mitocondrias utilizados durante la respiración, la concentración de ADP debe ajustarsepara un consumo de oxígeno estable el estado 3 (respiración máxima). La adición de ADP a la suspensión mitocondrial inducirá un aumento del consumo de oxígeno y la señal de flujo de oxígeno se incrementará (estado 3 respiración). Después de que se consume el ADP, la señal de flujo de oxígeno disminuirá (respiración de estado 4).
4. La respiración II dependiente Complex
- Preparar una cámara que contiene oxygraph suspensión mitocondrial aislado (0,4 mg / ml) siguiendo el procedimiento descrito en los pasos 2.1-2.5 y esperar a una señal estable.
- Inyectar 2 l de rotenona 0,2 mM (0,2 mM) 'PRECAUCIÓN' en la cámara de oxygraph a través del puerto de inyección de titanio del tapón cámara usando una jeringa y registrar la respiración celular durante 3-5 minutos hasta que se consigue una señal de flujo de oxígeno estable.
NOTA: La rotenona es un veneno peligroso y puede tener un impacto significativo en la salud humana. - Inyectar 20 l de 1 M de succinato (10 mM) en el cap oxygraphse logra ámbar y la respiración mitocondrial récord de 3-5 minutos hasta que una señal de flujo de oxígeno estable.
- Inyectar 10 l de 0,05 M ADP (0,25 mM) en la cámara de oxygraph a través del puerto de inyección de titanio del tapón de cámara y grabar la respiración celular hasta que se incrementa la señal de flujo de oxígeno, estabiliza, entonces disminuye y se estabiliza (3-5 min).
NOTA: La adición de ADP a la suspensión mitocondrial inducirá un aumento del consumo de oxígeno y la señal de flujo de oxígeno se incrementará (estado 3 respiración). Después de que se consume el ADP, la señal de flujo de oxígeno disminuirá (respiración de estado 4).
5. Complejo respiración IV-dependiente
- Preparar una cámara que contiene oxygraph suspensión mitocondrial aislado (0,4 mg / ml) siguiendo el procedimiento descrito en los puntos 2.1 a 2.5 del protocolo y esperar una señal estable.
- Entonces inyectar 2,5 l de ascorbato 0,8 mM (1 mM). Inmediatamente después inyectar 2,5 l de 0,2M TMPD (0,25 mM) y 10 l de 0,05 M ADP (0,25 mM) en la cámara de oxygraph y la respiración celular registro hasta que el oxígeno aumenta la señal de flujo y estabiliza (3-5 min).
- Finalmente inyectar 10 l de azida de sodio 1 M (5 mM) 'PRECAUCIÓN' en la cámara de oxygraph y registrar la respiración celular hasta que la señal disminuye el flujo de oxígeno y se estabiliza.
NOTA: La azida sódica es un veneno peligroso y puede tener un impacto significativo en la salud humana.
6. El citocromo C de prueba
- Preparar una cámara que contiene oxygraph suspensión mitocondrial aislado (0,4 mg / ml) siguiendo el procedimiento descrito en los puntos 2.1 a 2.5 del protocolo y esperar una señal estable.
- Inyectar 12,5 l de 0,8 M malato de (5 mM de concentración final) y 10 l de glutamato 2 M (10 mM de concentración final) en la cámara que contiene oxygraph suspensión mitocondrial aislado (0,4 mg / ml) a través del puerto de inyección de titanio del tapón de cámara dey registrar la respiración celular durante 3-5 minutos hasta que se logre una señal de flujo de oxígeno estable.
- Inyectar 10 l de 0,5 M ADP (2,5 mM) en la cámara de oxygraph a través del puerto de inyección de titanio del tapón de cámara y la respiración mitocondrial registro hasta la señal aumenta el flujo de oxígeno, entonces disminuye y se estabiliza (3-5 min).
- Finalmente, inyectar 5 l de 4 mM citocromo c (10 mM) en la cámara de oxygraph y registrar la respiración celular de 5 min hasta que se alcanza una señal de flujo de oxígeno estable.
Resultados
Complejo I-dependiente de la respiración
Aislado tasas mitocondriales complejos I dependiente de las vías respiratorias (estados 2, 3 y 4) se determinan usando respirometría de alta resolución (Figura 1, un diagrama representativo). sustratos complejo I mitocondrial, glutamato y malato, se añaden seguidos por la adición de ADP. Estado 2 se refiere a consumo de oxígeno en presencia de los sustratos solo. Estado 3 se refiere a consumo de oxígeno en presencia de los sustratos y ADP. Estado 4 se refiere al consumo de oxígeno después de la depleción de ADP. RCR es un índice del acoplamiento de consumo de oxígeno para la producción de ATP y se calcula como la relación entre el estado 3 y el estado 4. Como se muestra en la Figura 1, después de la adición de ADP, la velocidad de la respiración mitocondrial se incrementa inmediatamente (estado 3 respiración), y luego disminuye (respiración de estado 4) a niveles muy similar a la del estado 2. Esto indica un alto RCR y que la integridad mitocondrial está bien conservado durante el procedimiento de aislamiento. La figura 2 es un diagrama representativo de medición de una tasa de respiración y el estado 3 bajo RCR, con una alta tasa de respiración de estado 4, lo que indica el aislamiento mitocondrial inapropiada y sin éxito. Una alta tasa de respiración en el estado 4 es un indicador de la permeabilidad de protones mitocondrial 15.

Figura 1: Aislamiento mitocondrial con éxito: la integridad mitocondrial está bien conservado durante el procedimiento de aislamiento. Los trazados de la alta resolución de respirometría utilizando el glutamato y malato como sustratos (complejo respiración I-dependiente). La línea azul representa la concentración de oxígeno. La línea roja representa el flujo de oxígeno (pendiente de la concentración de oxígeno). el oxiGen concentración disminuye con el tiempo como las mitocondrias aisladas utilizan el oxígeno disponible. El consumo de oxígeno se expresa como (sx mg de proteína mitocondrial) pmol /. Haga clic aquí para ver una versión más grande de esta figura.
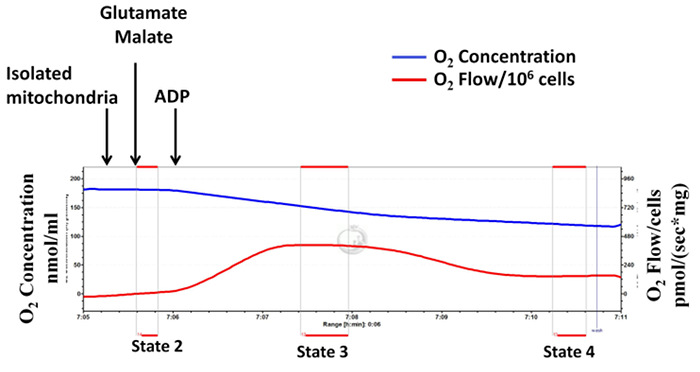
Figura 2: Aislamiento mitocondrial sin éxito: mitocondrial integridad no está bien conservado durante el procedimiento de aislamiento que indica el aislamiento mitocondrial apropiado. Los trazados de la alta resolución de respirometría utilizando el glutamato y malato como sustratos (complejo respiración I-dependiente). La línea azul representa la concentración de oxígeno. La línea roja representa el flujo de oxígeno (pendiente de la concentración de oxígeno). La concentración de oxígeno disminuye con el tiempo como aislados mitocondrias utilizan el availabLe oxígeno. El consumo de oxígeno se expresa como (sx mg de proteína mitocondrial) pmol /. Haga clic aquí para ver una versión más grande de esta figura.
Complejo respiración II dependiente
Las tasas respiratorias II-dependientes aislado complejos mitocondrial (estados 2, 3 y 4) se determinan usando respirometría de alta resolución (Figura 3, un diagrama representativo). Para este ensayo, el complejo I mitocondrial es inhibida por la adición de rotenona, y luego succinato (sustrato complejo II) se añade seguido por ADP. Figura 3 muestra que después de la adición de ADP, los aumentos de la respiración mitocondrial de inmediato, y luego disminuye a niveles muy similares a la de estado 2, indicando las mitocondrias bien acoplados y quela integridad mitocondrial está bien conservado durante el procedimiento de aislamiento. El valor calculado para RCR este experimento típico es 4,23, que está en estrecho acuerdo con los valores indicados en la literatura disponible 10, 11, 23). La figura 4 es un diagrama representativo de medición de una tasa de respiración y el estado 3 bajo RCR, con una alta tasa de respiración de estado 4 indica el aislamiento apropiado.
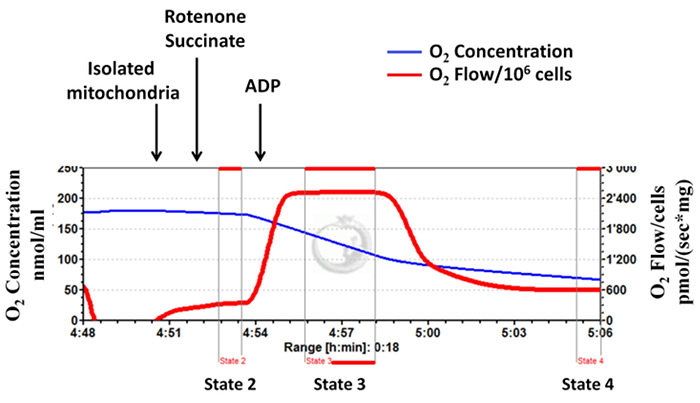
Figura 3: Aislamiento mitocondrial con éxito: la integridad mitocondrial está bien conservado durante el procedimiento de aislamiento. Los trazados de la respirometría de alta resolución utilizando como succinato (respiración II dependiente de complejo) sustrato. La línea azul representa la concentración de oxígeno. La línea roja representa el flujo de oxígeno (pendiente deconcentración de oxígeno). La concentración de oxígeno disminuye con el tiempo como aislados mitocondrias utilizan el oxígeno disponible. El consumo de oxígeno se expresa como (sx mg de proteína mitocondrial) pmol /. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Aislamiento mitocondrial sin éxito: mitocondrial integridad no está bien conservado durante el procedimiento de aislamiento que indica el aislamiento apropiado. Los trazados de la respirometría de alta resolución utilizando como succinato (respiración II dependiente de complejo) sustrato. La línea azul representa la concentración de oxígeno. La línea roja representa el flujo de oxígeno (pendiente de la concentración de oxígeno). La concentración de oxígeno disminuye con el tiempo como Mitoc aisladohondria utilizan el oxígeno disponible. El consumo de oxígeno se expresa como (sx mg de proteína mitocondrial) pmol /. Haga clic aquí para ver una versión más grande de esta figura.
Complejo IV dependiente de la respiración
Complejos mitocondriales tasas aisladas IV dependiente de las vías respiratorias (estados 2, 3) se determinan mediante respirometría de alta resolución (Figura 5, un diagrama representativo). Para este ensayo de ascorbato / se añaden TMPD y ADP, seguido de azida sódica para inhibir el complejo IV.
La diferencia entre el consumo de oxígeno antes y después de la adición de azida de sodio se interpreta como la verdadera respiración complejo IV. La Figura 5 es un diagrama representativo de measurement de un alto estado 3 tasa de respiración IV dependiente compleja que indica que la integridad mitocondrial está bien conservado durante el procedimiento de aislamiento. En contraste, la Figura 6 es un diagrama representativo de la medición de un estado de bajo 3 que indica el aislamiento apropiado.

Figura 5: Aislamiento mitocondrial con éxito: la integridad mitocondrial está bien conservado durante el procedimiento de aislamiento. Los trazados de la respirometría de alta resolución utilizando ascorbato / DPMT como sustrato (respiración complejo IV-dependiente). Complejo respiración IV (estado 3) se interpreta restando el consumo de oxígeno antes y después de la adición de azida de sodio. La línea azul representa la concentración de oxígeno. La línea roja representa el flujo de oxígeno (pendiente de la concentración de oxígeno). La concentración de oxígeno disminuye con el tiempo como mitocho aisladondria utilizar el oxígeno disponible. El consumo de oxígeno se expresa como (sx mg de proteína mitocondrial) pmol /. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Aislamiento mitocondrial sin éxito: mitocondrial integridad no está bien conservado durante el procedimiento de aislamiento que indica el aislamiento apropiado. Los trazados de la respirometría de alta resolución utilizando ascorbato / DPMT como sustrato (respiración complejo IV-dependiente). Complejo respiración IV (estado 3) se interpreta restando el consumo de oxígeno antes y después de la adición de azida de sodio. La línea azul representa la concentración de oxígeno. La línea roja representa el flujo de oxígeno (pendiente de la concentración de oxígeno). El oxígeno concentration disminuye con el tiempo como las mitocondrias aisladas utilizan el oxígeno disponible. El consumo de oxígeno se expresa como (sx mg de proteína mitocondrial) pmol /. Haga clic aquí para ver una versión más grande de esta figura.
Evaluación de la integridad de la membrana externa mitocondrial utilizando citocromo c
Para evaluar la calidad de la preparación mitocondrial, prueba de citocromo c se realiza para determinar la integridad mitocondrial membrana externa, mediante la medición de la respiración mitocondrial después de la adición posterior de glutamato y malato, ADP y el citocromo c (ADP estimulada complejo II dependiente de estado 3 de respiración en el presencia de citocromo c). Como se muestra en la Figura 7, el citocromo c no mejora complejo I-dependiente de estado 3 re inspiración de la mitocondrias aisladas, lo que indica que no hubo pérdida de citocromo c de la membrana externa mitocondrial y se conserva la integridad mitocondrial.
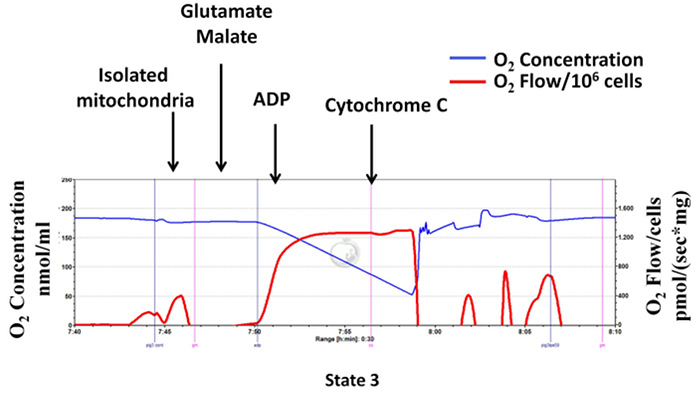
Figura 7: Citocromo c no mejora la respiración de la mitocondria aislada: la integridad mitocondrial está bien conservado durante el procedimiento de aislamiento. Los trazados de la respirometría de alta resolución utilizando glutamato / malato como sustrato (complejo respiración I-dependiente). La línea azul representa la concentración de oxígeno. La línea roja representa el flujo de oxígeno (pendiente de la concentración de oxígeno). La concentración de oxígeno disminuye con el tiempo como aislados mitocondrias utilizan el oxígeno disponible. El consumo de oxígeno se expresa como (sx mg de proteína mitocondrial) pmol /.m / archivos / ftp_upload / 55251 / 55251fig7large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
| Tampón de aislamiento mitocondrial | |
| Químico | Concentración |
| KCl | 100 mM |
| MgSO 4 | 10 mM |
| morfolinopropano ácido sulfónico (MOPS) | 50 mM |
| ácido etilendinitrilotetraacético (EGTA) | 1.0 mM |
| ATP | 1.1 mM |
| pH 7,4 | |
| Tampón de lavado mitocondrial | |
| Químico | Concentración |
| KCl | 100 mM |
| MOPS | 50 mM |
| EGTA | 0,5 mM |
| pH 7,4 | |
| Tampón de la respiración mitocondrial 16 | |
| Químico | Concentración |
| sacarosa | 110 mM |
| EGTA | 0,5 mM |
| MgCl 2 | 3.0 mM |
| KCl | 80 mM |
| K-lactobionato | 60 mM |
| KH 2 PO 4 | 10 mM |
| La taurina | 20 mM |
| Hepes | 20 mM |
| BSA | 1,0 g / L |
| pH 7,1 | |
Tabla 1: La composición de los tampones.
Discusión
En el presente estudio se describe un protocolo para aislar de alta calidad, intactos y bien acoplados mitocondrias de músculo esquelético por centrifugación diferencial que pueden ser utilizados para estudios funcionales tales como de alta resolución respirometría.
Con el fin de aislar las mitocondrias intactas y bien acoplados, hay algunos puntos críticos que deben ser considerados en el presente protocolo. Después de cosechar el tejido esquelético, debe ser sumergido inmediatamente en tampón de aislamiento mitocondrial enfriado con hielo. Todos los pasos de centrifugación se deben hacer a 4 ° C y la suspensión mitocondrial deben mantenerse siempre en hielo durante el aislamiento. El procedimiento de aislamiento debe hacerse tan pronto como sea posible. El homogeneizado se debe centrifugar en tubos de centrifugación libre de detergentes de limpieza. Al final del procedimiento, la suspensión mitocondrial debe mantenerse concentrado y se diluyó justo antes de respirometría. Puesto que los datos de respirometría se expresan como pmol por segundo per miligramo de proteína mitocondrial, es importante utilizar una buena técnica para medir con precisión la concentración de proteína mitocondrial después del aislamiento.
En algunos procedimientos de aislamiento mitocondrial, puede suceder que las mitocondrias están desacoplados o no consumen oxígeno correctamente mediante respirometría de alta resolución. Para superar estos problemas, el tejido debe ser siempre homogeneizó de la misma manera (el mismo número de golpes) usando el homogeneizador con la mano del mortero holgada (paso 1,12). Aquí, siempre homogeneizar el tejido del músculo esquelético utilizando un homogeneizador automatizado con 10 golpes. Un mayor número de golpes puede dañar y desacoplar las mitocondrias. Manualmente (y subjetivamente) muestras de tejido homogeneizadas en homogeneizadores de vidrio pueden producir diferentes calidades de mitocondrias aisladas. Congelación de la mitocondria también puede resultar en las mitocondrias desacopladas y uno debe asegurarse de que centrifugaciones se realizan a 4 ° C y no por debajo de este temperatura. La integridad mitocondrial puede verse comprometida, así si el pH de las soluciones tampón es incorrecto o los tubos de centrifugación no están limpias. Uno debe asegurarse de que los tubos de centrifugación son libres de detergente y adecuadamente lavados.
Uno de los primeros factores importantes a considerar durante el aislamiento es de homogeneizar los tejidos de una manera suave. Los tejidos blandos requieren fuerzas mecánicas aplicadas durante la homogeneización suaves, mientras que los tejidos duros requieren fuerzas mecánicas mucho más fuertes. Los tampones utilizados durante la homogeneización y centrifugaciones deben ser enfriado en hielo y tienen un pH pertinente fisiológico con una fuerza iónica y osmótica compatible con citosol. Para los tejidos duros, tales como el músculo esquelético, después de la homogeneización mecánica, proteasas tales como la tripsina se pueden añadir a desagregar aún más el tejido 4, 5.
Algunas de las limitaciones de mitocondrias aisladas, basado en dcentrifugación ifferential son i) las mitocondrias posiblemente dañado durante la homogeneización y el aislamiento procedimiento 19, ii) las grandes cantidades de las muestras de tejido necesarias para el aislamiento mitocondrial, iii) la posible pérdida y alteraciones en ciertos electrones mitocondrial complejos de la cadena de transporte subunidades durante la homogeneización y centrifugación los pasos 18, y iv) el aumento de la producción de las especies reactivas del oxígeno durante la homogeneización y centrifugación pasos, que pueden interferir con la función mitocondrial 18. Las ventajas de la homogeneización Dounce y el método de centrifugación diferencial para aislar las mitocondrias crudo para experimentos respiratorias con respecto a los métodos existentes tales como la centrifugación en gradiente de densidad 20 son que el método es rápido y las mitocondrias están aislados dentro de un corto período de tiempo. Por lo tanto experimentos respiratorias se pueden realizar dentro de 1marido. Además, el procedimiento es barato, muy eficiente y las mitocondrias obtenidos por centrifugación diferencial puede ser utilizado para los ensayos de respirometría. La investigación del consumo de oxígeno mitocondrial usando mitocondrias aisladas ofrece varias ventajas sobre las fibras o células permeabilizadas: No hay interferencia significativa con las proteínas citosólicas que pueden interferir con la función mitocondrial y la bioenergética; no hay necesidad de permeabilización celular; y sustratos de los complejos de la cadena respiratoria mitocondrial se pueden añadir directamente a las mitocondrias aisladas.
Uno de los métodos alternativos para medir el músculo esquelético la respiración mitocondrial es el uso permeabilized fibras musculares 9. Algunas de las ventajas de las fibras musculares permeabilizadas más de mitocondrias aisladas son i) no es necesaria ninguna etapa de homogeneización mecánica y, ii) se requieren cantidades muy pequeñas de tejido (unos pocos mg) para los ensayos de respirometría. La desventaja de pfibra muscular ermeabilized es la menor difusión de oxígeno a la mitocondria en el haz de fibras. Esta restricción de la difusión requiere mayores cantidades de ADP durante los ensayos de respirometría. Otro método alternativo es el uso de homogeneizados de tejido integrales 22, que es un método muy rápido y no requiere etapas de centrifugación diferencial para aislar las mitocondrias. El uso de homogeneizado de tejido conjunto puede prevenir la pérdida de algunas mitocondrias durante su aislamiento, pero puede haber otros factores citosólicos presentes, que pueden interferir con el análisis de las funciones mitocondriales tales como el consumo de oxígeno.
Después de dominar la centrifugación diferencial para aislar las mitocondrias crudo para los ensayos de las vías respiratorias, una futura aplicación es investigar las capacidades respiratorias de las mitocondrias aisladas a través de técnicas emergentes, tales como el uso de la membrana mitocondrial externa anti-TOM22 (translocasa de la membrana mitocondrial externa 22 homólogo) de anticuerpos coupl21 perlas magnéticas ed.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This study was supported by the Swiss National Science Foundation (Grant 32003B_127619).
Materiales
| Name | Company | Catalog Number | Comments |
| ADP | Sigma | A 4386 | Chemical |
| Antimycin A | Sigma | A 8674 | Chemical, dissolve in ethanol |
| Ascorbate | Merck | 1.00127 | Chemical |
| ATP | Sigma | A 7699 | Chemical |
| BSA | Sigma | A 6003 | Chemical |
| EGTA | fluka | 3779 | Chemical |
| Glutamate | Sigma, | G 1626 | Chemical |
| Hepes | Sigma | H 7523 | Chemical |
| KCl | Merck | 1.04936 | Chemical |
| KH2PO4 | Merck | 1.04873 | Chemical |
| K-lactobionate | Sigma | L 2398 | Chemical |
| MgCl2 | Sigma | M 9272 | Chemical |
| Morpholinopropane sulphonic acid (MOPS) | Merck | 1.06129 | Chemical |
| O2k-Core: Oxygraph-2k | Oroboros Instruments | 10000-02 | High-resolution respirometry instrument |
| Proteinase, bacterial | Sigma | P 8038 | Chemical |
| Sodium azide | Sigma | S2002 | Chemical |
| Rotenone | Sigma | R 8875 | Chemical, dissolve in ethanol |
| Succinate | Sigma | S 2378 | Chemical |
| Schuett homogen-plus semiautomatic homogeniser | schuett-biotec GmbH | 3.201 011 | Tissue homogenizer |
| Taurine | Sigma | T 8691 | Chemical |
| TMPD | Sigma | T 3134 | Chemical |
Referencias
- Hogeboom, G. H., Schneider, W. C., Pallade, G. E. Cytochemical studies of mammalian tissues. I. Isolation of intact mitochondria from rat liver; some biochemical properties of mitochondria and submicroscopic particulate material. J. Biol. Chem. 172, 619-635 (1948).
- Sims, N. R. Rapid isolation of metabolically active mitochondria from rat brain and subregions using Percoll density gradient centrifugation. J. Neurochem. 55 (2), 698-707 (1990).
- Hartwig, S., et al. A critical comparison between two classical and a kit-based method for mitochondria isolation. Proteomics. 9 (11), 3209-3214 (2009).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 65, 1-35 (2001).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
- Niklas, J., Melnyk, A., Yuan, Y., Heinzle, E. Selective permeabilization for the high-throughput measurement of compartmented enzyme activities in mammalian cells. Anal. Biochem. 416 (2), 218-227 (2011).
- Kuznetsov, A. V., et al. Analysis of mitochondrial function in situ in permeabilized muscle fibers, tissues and cells. Nat. Protoc. 3 (6), 965-976 (2008).
- Perry, C. G., Kane, D. A., Lanza, I. R., Neufer, P. D. Methods for assessing mitochondrial function in diabetes. Diabetes. 62 (4), 1041-1053 (2013).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle: new perspectives of mitochondrial physiology. Int. J. Biochem. Cell Biol. 41 (10), 1837-1845 (2009).
- Vuda, M., et al. Effects of catecholamines on hepatic and skeletal muscle mitochondrial respiration after prolonged exposure to faecal peritonitis in pigs. Innate Immun. 18 (2), 217-230 (2012).
- Corrêa, T. D., et al. Angiotensin II in septic shock: effects on tissue perfusion, organ function, and mitochondrial respiration in a porcine model of fecal peritonitis. Crit. Care Med. 42 (8), e550-e559 (2014).
- Jeger, V., et al. Dose response of endotoxin on hepatocyte and muscle mitochondrial respiration in vitro. Biomed Res Int. 2015, 353074 (2015).
- Nicholls, D. G., Ferguson, S. J. . Bioenergetics. 3, (2002).
- Chance, B., Williams, G. R. The respiratory chain and oxidative phosphorylation. Adv. Enzymol. Relat. Subj. Biochem. 17, 65-134 (1956).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochem. J. 435 (2), 297-312 (2011).
- Gnaiger, E., Méndez, G., Hand, S. C. High phosphorylation efficiency and depression of uncoupled respiration in mitochondria under hypoxia. Proc. Natl. Acad. Sci. USA. 97 (20), 11080-11085 (2000).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods Mol. Biol. 810, 25-58 (2012).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard isolation methods. PLoS One. 6 (3), e18317 (2011).
- Picard, M., et al. Mitochondrial functional impairment with aging is exaggerated in isolated mitochondria compared to permeabilized myofibers. Aging Cell. 9 (6), 1032-1046 (2010).
- Graham, J. M. Purification of a crude mitochondrial fraction by density-gradient centrifugation. Curr. Protoc. Cell. Biol. Chapter 3. 3, (2001).
- Franko, A., et al. Efficient isolation of pure and functional mitochondria from mouse tissues using automated tissue disruption and enrichment with anti-TOM22 magnetic beads. PLoS One. 8 (12), 382392 (2013).
- Pecinová, A., Drahota, Z., Nůsková, H., Pecina, P., Houštěk, J. Evaluation of basic mitochondrial functions using rat tissue homogenates. Mitochondrion. 11 (5), 722-728 (2011).
- Lombardi, A., et al. Characterisation of oxidative phosphorylation in skeletal muscle mitochondria subpopulations in pig: a study using top-down elasticity analysis. FEBS Lett. 475 (2), 84-88 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados