Method Article
Hücresel Lipid damlacıklar İzolasyonu: Maya Hücreleri ve insan plasentası itibaren iki Arıtma Teknikleri
Bu Makalede
Özet
: 1) hücresel lipid damlacıkları izole maya hücreleri ve 2) insan plasenta sunulmuştur için iki teknikleri. Her iki prosedürlerinin merkezinde damlacıkları ihtiva eden elde edilen yüzer tabaka, hali hazırda, göz ile görselleştirilmiştir ekstre edilmiş ve saflık için Western Blot analizi ile tayin edilebilir yoğunluk gradyan santrifüj vardır.
Özet
Lipid damlacıkları en ökaryotik ve prokaryotik hücrelerde bazı bulunabilir dinamik organellerdir. Yapısal olarak, damlacıkları, bir fosfolipid tek tabaka ile çevrilidir nötr lipitlerin bir çekirdekten oluşur. Damlacıkların hücresel rolleri belirlenmesinde en yararlı tekniklerden biri damlacıkları ile birlikte izole edilebilir bağlı proteinler, proteomik tanımlanması olmuştur. Fizyon maya ve insan plasental villöz hücreleri: Burada, iki yöntem, iki geniş ökaryotlardan lipid damlacıkları ve bunların bağlı proteinleri izole etmek için tarif edilmiştir. Her iki teknik farklılıklar olmasına rağmen, ana yöntem - yoğunluk gradyan santrifüj - hem hazırlıkları tarafından paylaşılır. Bu sunulan damlacık izolasyon teknikleri geniş uygulama gösterilmektedir.
İlk protokolde, maya hücreleri, hücre duvarlarının enzimatik sindirme ile spheroplastlar dönüştürülür. Oluşan sferoplastlar sonra Gently bir gevşek homojenizatör içinde eritildi. Ficoll yoğunluk gradyanı sağlamak için lizat ilave edilir ve karışım, üç kez santrifüj edilir. Ilk dönüşü sonra, lipid damlacıkları, endoplazmik retikulum (ER), plazma zarı ve vakuoller ile birlikte santrifüj tüplerine beyaz renkli bir kayan tabakaya lokalizedir. Daha sonraki iki spin bu diğer üç organellere kaldırmak için kullanılır. Sonuç olarak sadece damlacıkları ve bağlanmış proteinler sahip bir tabakadır.
İkinci protokolde, plasenta villöz hücreler tripsin ve DNase I Hücreler, gevşek homojenleştiricide homojenize edilir ile enzimatik sindirme ile insan plasentası terimi izole edilmiştir. Düşük hız ve orta hızlı santrifüj adımları kırılmamış hücreleri, hücresel atıkları, çekirdek ve mitokondri kaldırmak için kullanılır. Sakaroz bir yoğunluk gradyanı sağlamak için homojenat ilave edilir ve karışım, diğer cellula gelen lipid damlacıkları ayırmak için santrifüj edilirr kesirler.
Her iki protokolde de lipid damlacıkları saflığı, Western Blot analizi ile teyit edilir. Her iki preparatlarıyla gelen damlacık fraksiyonlar sonraki proteomik ve lipidomic analiz için uygundur.
Giriş
Hücresel lipid damlacıkları hücrelerinde birden fazla işleve hizmet dinamik organelleri. Bunlar enerjiye dönüştürülür ya da fosfolipid sentezi için kullanılabilir nötr lipidler, depolama merkezleri vardır. Damlacıklar, ateroskleroz, obezite ve ilişkili metabolik hastalıklar da dahil olmak üzere fizyolojik ve patolojik durumlarda merkezi bir rol oynar ve aynı zamanda bulaşıcı hastalıklar 1,2. Buna ek olarak, biyodizel yakıtları için ilgi çekici kaynaklarıdır.
Lipid damlacıkları hücre rolleri hakkında bilgisi geniş organizmalar 3 saflaştırılan damlacıklarının proteomik ve lipidomic analizinden elde edilmiştir. Bu organizmalar, bakteri 4,5, maya 6-11 dahil 12,13 bitkiler, 14 nematodları, ve 15,16 sinekler var. İnsan metabolik hastalıklar lipid damlaları rolü olan ilgi dikkate alındığında, damlacıkları ile kültürden geçirilmiş hayvan hücreleri ve a izole edilmişNimal dokular. Kültürlü hücre çizgileri, 3T3-L1 adipositler 17, Çin hamsteri yumurtalık (CHO) hücreleri 18 K2, insan hepatocyes 19,20 ve epitel hücre hatları 21 dahil ettik. Damlacıklar izole edilmiş olan hayvan dokuları fare iskelet kas 22, karaciğer 23 ve 23 meme bezleri dahil ettik. Yukarıda zikredildiği gibi, en çok damlacık izolasyon çalışmaların amacı bağlı faktör ile nötr ve fosfolipidlerden lipidomic analizine proteomik analiz etmektir.
Nötr lipidler yana - lipid damlacıkları en çok bileşenli - En çok diğer hücre malzemelere nazaran daha az yoğun olan, damlacıkların izolasyon geleneksel yoğunluk gradyan santrifüjlemesi kullanılarak gerçekleştirilmiştir. Bu tekniği Burada sunulan iki preparatlarıyla merkezinde olduğunu. Önceki teknikler 6,24 kültürlenmiş bölünmüş maya hücrelerinden damlacıklarının izolasyonu bir görsel sunum halinde bir araya getirilmiş ve modifiyeve noncultured insan hücreleri plasenta dokusundan elde edilmiştir. Amaç damlacık izolasyonu için başlangıç noktası olarak, iki çok farklı hücre tiplerini seçerek bu tekniğin geniş uygulanabilirlik göstermektir. Bu teknik çoğu organizmalar damlacıkların izole etmek isteyenler için yararlı olacaktır.
Protokol 1 ökaryotik hücre bölünmesi esnasında 25, damlacık oluşumunu gözlemlemek için bir model olarak kullanılmıştır fizyon maya, Schizosaccharomyces pombe, ikinci lipid damlacıkları izolasyonunu tarif eder. Tomurcuklanan maya Saccharomyces cerevisiae lipid damlacık biyoloji eğitimi için bir model organizma olarak yaygın şekilde kullanılmaktadır. Protokol 1 organizmalar ve hazırlıkları farklılıklar hem de uygulanabilir vurgulanır.
Protokol 2 İnsan plasentası terimi, elde edilen sırayla olan plasental villöz hücrelerden lipid damlacıkları izolasyonunu tarif eder.Terim Plasentaların koleksiyonu güvenle ve etik lipid damlacıkları önemli numaralarını içeren hazır insan dokusunda 26, 200-250 g almak için eşsiz bir fırsat sunuyor. Bu damlacıklar kültürlenmiş hücrelerden kaynaklanan daha yüksek ökaryotlarda en lipid damlacık izolasyon çalışma aksine bulunmaktadır. Bu çalışmalarda, yağ asitleri genellikle nötral lipid ve böylece damlacıkların büyümesinin sentezini teşvik etmek için kültüre eklenir. Bu lipid damlacıkları plasental dokudaki doğal koşullar altında oluşturulmaktadır burada çalışma aksine bulunmaktadır.
Lipid damlacık fraksiyonlarının saflıkları organel markör antikorları kullanılarak Western Blot analizi ile belirlenir. Bu iki protokol sonraki proteomik ve lipidomic analiz için uygun olan lipid damlacık kesirler verecektir.
Protokol
1.. (Fisyon) Maya Hücreleri gelen Lipid Damlalarda Yalıtımlı
Maya Saccharomyces cerevisiae tomurcuklanan popüler model organizma damlacıkları izolasyonu aşağıdaki protokole 6 hemen hemen aynıdır. Hazırlıklarında farklılıklar belirtilmiştir.
1.. Büyüyen maya hücreleri
- Ortamını hazırlayın. Cam şişe ya da kültür şişelerinde dH 2 O litresi başına YE5S toz 36 g 'ını. Ortam yaklaşık 2 L gerekli olacaktır. 20 dakika boyunca 121 ° C'de otoklav ortamı. Medya oda sıcaklığına kadar soğumasını bekleyiniz. S. cerevisiae YDP ile YE5S değiştirin.
- Steril teknikler kullanılarak, 250 ml kültür şişesi içine soğutulmuş YE5S ortamın 10-20 ml yerleştirin. Steril bir tahta bir çubuk ya da eşdeğeri kullanılarak Bir agar plakasından maya hücrelerinin küçük bir miktar ile inoküle ortamı. Hücreler, 30 ° C'de, istenen optik yoğunluğa büyümesine izin A optik yoğunluğunun ölçülmesiBir spektrofotometre kullanılarak 595 nm dalga boyu.
- 2.8 L şişelerinde kalan ortamı yerleştirin. Çalkalama inkübatöründe hücre büyümesi sırasında düzgün karışmasını sağlamak için ortam başına 2.8 L şişenin en fazla 1 L kullanın. Islak hücre Nihai verim proteomik ve lipidomic analiz için yeterli lipid damlacıkları elde edebilmek için yaklaşık 10 g olmalıdır.
- Her bir adım 1.1 hazırlandı ortamı 1 L olan 2.8 L şişelere aşama 1.2 'den hücreleri tanıtılması.
- 30 ° C'de arzu edilen yoğunluğa hücrelerin büyümesine
- Hücrelerin lipid damlacıkları olduğundan emin olun. Hücrelerin Reserve 1 mi. Numunenin optik yoğunluğu (OD) ölçün. Numuneye hücrelerin OD başına etanol içinde BODIPY 493/503 içinde bir 100 mM stok 0.1 ml ilave edilir. Bir cam slayt ve bir cam kapak kayma arasındaki örnek 3 ul koyun. GFP filtre (Şekil 1A) ile bir floresan mikroskop altında gözünüzde canlandırın.
- 4 ve # 'de aşama 1.5 gelen hücreleri Pelet176, C 10 dakika boyunca 3,800 x g. Santrifüj tüplerinin kapasitesine bağlı olarak gruplar halinde çalışır.
- YE5S ortamı dökün ve sorbitol EMM + 600 mM tampon maddesi ile hücreleri yıkayın. Sorbitol ozmotik destek sağlar.
- , Steril bir 50 ml santrifüj tüpüne hücreleri aktarın ve 10 dakika boyunca 2000 x g'de 4 ° C'de pellet hücreleri. Süpernatant kaldırmak. Islak hücreler tartılır. Hücre gramı başına (EMM + 600 mM sorbitol), tampon 2 ml hücreleri yeniden süspanse edin.
2. Spheroplastlar ve daha sonra lizis içine bölünmüş maya hücreleri dönüştürme
- ) Maya litik enzim 5 mg 1 Her ekleyin ve 2) maya Trichoderma harzianum başına gram adımda 1.9 tartıldı ıslak hücre enzimleri yokedici. S. cerevisiae askiyle sonuçlanır ki aynı miktarda bu enzimleri artırmaktadır.
- 60 dakika boyunca 100 rpm'de hafif sallama altında 30 ° C'de inkübe hücreleri.
- Sferoplastlar lipit dr emin olmak için kontrol edinoplets. Adım 1.6 (Şekil 1 B) tekrarlanarak.
3. Density gradient santrifüjleme
- 5 dakika boyunca 2000 x g'de 4 ° C'de santrifüj ile spheroplastlar Pelet.
- Dikkatle plastik bir transfer pipet kullanarak süpernatant kaldırmak.
- Yavaşça buz gibi soğuk 10 mM Tris-HCI, 600 mM sorbitol, ve 200 uM EDTA ile pelet spheroplastlar tekrar süspansiyon. Sferoplastlar çok kırılgan olduğunu aklınızda tutun.
- Adım 3.1 olarak aynı ayarları kullanarak yeniden spheroplastlar Pelet. Süpernatantı dikkatlice çıkarın ve 2 ml / g-hücre konsantrasyonunda 12% Ficoll plastik transfer pipeti, 10 mM Tris-HCl ve 200 mM EDTA kullanılarak spheroplastlar tekrar süspansiyon.
- Bir cam homojenizatör üzere yeniden süspansiyon haline getirilmiş ve yavaşça spheroplastlar transfer cam homojenleştirici gevşek havan tokmağı ile, buz üzerinde 20-30 vuruş homojenleştirin.
- Santrifüj tüplerine parçalanır spheroplastlar aktarın ve aynı vo kaplanacak% 12 Ficoll, 10 mM Tris-HCl ve 200 uM EDTA tamponu lume. Böylece her tüp yaklaşık üçte ikisi dolu olduğunu kullanmak için santrifüj tüplerinin sayısını seçin.
- Bir SVV28 rotor veya eşdeğeri, 1.5 saat boyunca 100,000 x g hızında, 4 ° C 'de santrifüj. Bir stop (rotor yavaşlama = 0) için kıyıya rotor izin verin.
- Yavaşça bir pipet ya da bir bükülmüş Pasteur pipeti kullanarak yeni bir santrifüj tüpüne (ler) için damlacıkları içeren üst yüzen beyaz tabaka (Şekil 2A), transfer. Bu santrifüj tüpünün aşağı yukarı üçte biri doldurur, böylece numune için yeterli% 12 Ficoll hacmi, 10 mM Tris-HCl ve 200 uM EDTA tamponu ekleyin.
- Yeni bir santrifüj tüpüne (s) 'de örnek (ler) üstüne denk% 8 Ficoll hacmi, 10 mM Tris-HCl ve 200 uM EDTA tamponu ekleyin. Bu eklenmesinden sonra, tüpler tam üçte ikisi olmalıdır tampon.
- Bir SVV28 rotor veya eşdeğeri 1 saat boyunca 100,000 x g hızında, 4 ° C 'de santrifüj. Durdurmak için kıyıya rotor izin (rotor yavaşlama = 0).
- Yavaşça bir pipet ya da bir bükülmüş Pasteur pipeti kullanarak yeni bir santrifüj tüpüne (ler), damlacıkları içerecek En iyi yüzen beyaz tabaka (Şekil 2B), aktarın. Bu santrifüj tüpüne yaklaşık üçte biri doldurur, böylece örnek, sorbitol% 8 Ficoll, 10 mM Tris-HCl ve 200 mM EDTA tampon maddesi 600 mM ekleyin.
- Yeni bir santrifüj tüpüne (s) 'de örnek (ler) en üstüne, sorbitol 10 mM Tris-HCl, 250 mM eşdeğer hacim ekleyin ve 200 uM EDTA tampon maddesi. Bu eklenmesinden sonra, tüpler tam üçte ikisi olmalıdır tampon.
- Bir SVV28 rotor veya eşdeğeri 1 saat boyunca 100,000 x g hızında, 4 ° C 'de santrifüj. Bir stop (rotor yavaşlama = 0) için kıyıya rotor izin verin.
- Diyaliz boru için, sadece lipid damlacıkları ve bağlanmış proteinler içerir ve Ficoll ortadan kaldırmak için 10 mM Tris-HCl ve 200 mM EDTA tampon olarak O / N dialyze gerektiği iyi beyaz bir tabaka (Şekil 2C), aktarın.
Plasenta tekiz gebelik öncesi dönemde spontan doğumun başlamasından elektif sezaryen doğum yapan ile sağlıklı kadınlarda toplanmıştır. Denekler kendi plasenta koleksiyonu için yazılmış, bilgilendirilmiş onam verdi. Plasentaların toplanması ve daha sonraki kullanım, Knoxville Kurumsal Değerlendirme Kurulu Tennessee ve Tıp Tennessee Enstitüsü Üniversitesi Üniversitesi (sırasıyla # # 8757B ve 3338) onayı ile yapıldı.
1.. Insan plasental villöz hücreleri tecrit
Protokolün Part 1 Petroff et al. 26 daha önceki bir yayınlanan bir protokolün modifikasyonudur
Aşağıdaki çözeltiler hazırlayın:
- NaCI (1 L), bir 1 L'lik bir çözelti elde etmek dH 2 O 9 g NaCl (M + 58.4 g / mol) içinde çözülür. Filtre sterilize (0.2; Mikron zar).
- 10x Hank dengeli tuz çözeltisi (10x HBSS) (1 L): 4 g KCl (M + 74.5 g / mol), 0.6 g KH 2 PO 4 (M + 136,086 g / mol), 80 g NaCl (M 58,44 g / mol); 10 g D-glukoz (M 180,16 g / mol), 2 HPO 4 (M + 141.96 g / mol) Na. Bir 1 L çözelti elde etmek üzere dH 2 O bileşenlerin her çözülür. Filtre sterilize (0.2 mikron zar).
- Enzim sindirim tamponu (0.6 mi) 3.3 ml% 7.5 Na Biscarbonate, 17.5 ml 1 M HEPES, ve 266.1 ml dH 2 O ile 70 ml HBSS 10x birleştirmek, sterilize (0.2 mikron zar). 4 ° C'de saklayın
- DNase I: Kullanımdan hemen önce, DNase bir şişeye, 5 ml steril% 0.9 NaCl ilave edin. -20 ° C'de kullanıma veya mağaza kadar buz üzerinde tutmak
- Diseksiyon için hazırlık plasenta
- Bir insan plasenta ve mümkün olduğunca teslimat zamanına yakın süreci edinin. Bu tür plasenta taşımak için bir soğutucu olarak bir sızdırmaz kılınmış tekne kullanın. Zaman el her zaman dikkatli olunling insan biyolojik materyaller.
- Biyolojik güvenlik kabini içinde, steril bir otoklavlanabilir bir kaba aktarmak plasenta ve dikkatli bir şekilde steril% 0.9 NaCl (tuzlu su) çözeltisi kullanılarak plasenta ve membranlar kan yıkayın. Sıvı biyolojik atık olarak 1 L beher kanlı tuz atın.
- Pürüzsüz yüzey yukarı bakacak göbek kordonunu rulman ile, steril bir alan üzerinde plasentayı yerleştirin. Keskin, ince nokta makas ve forseps ile fetal membranlar ve göbek kordonunu çıkarın.
- Maternal yüzey (pürüzlü yüzey) yukarıya bakacak şekilde plasentayı ters çevirin. Örten bazal plaka doku, yüzeyden yaklaşık 3 mm çıkarın.
- Plasenta Diseksiyon
- Koryon plaka kaçınarak her seferinde bir kotiledon ayır. Tuzlu su ile 250 ml'lik bir behere villöz doku toplayın.
- Sıvı atık için 1 L kabı kullanarak, forseps ile dönen ile% 0.9 NaCI ile ayrı bir çanak içinde doku birkaç kez yıkayın.
- Bir 150 mm Petri kabı, bir seferde bir kotiledon aktarın. Forseps ile tutun ve Petri kabı gemilerin jilet ile doku kazıyın. % 0.9 NaCl içeren ayrı bir beher içine kazınmış doku yerleştirin. Tüm doku parçaları için tekrarlayın.
- Hücre ayrışma eleğe doku küçük bir bölümünü transfer ve ortaya çıkan ürün berrak hale gelinceye kadar yaygın olarak% 0.9 NaCl ile yıkayınız. Her doku için tekrarlayın.
- Hücre ayrışma elek kazınmış doku durulanmasından sonra, fazla sıvı ve ağırlık olarak boşaltın.
Bu noktada doku DMEM içinde 4 ° C'de steril bir Erlenmeyer şişesi içinde O / N depolanabilir.
- Plasenta dokusundan enzimatik sindirim
- Önceden ısıtılmış enzim seyreltme tamponu 100 mi, 1 ml DNase I ve 20 ml% 2.5 tripsin 10x: Doku sindirimi karışım hazırlayın.
- 500 ml'lik bir Erlenmeyer şişeye steril toplanan toplam doku (genellikle yaklaşık 250-300 g), 60 g aktarılması, doku bölün.
- doku içeren Erlenmeyer şişeye doku sindirim karışımı ekleyin ve 150 rpm'de 45 dakika için bir sallayıcı içinde 37 ° C'de inkübe edin.
- Ayrışmış hücreleri toplamak
- Doku yerleşir kadar ilk 45 dakika ayrıldıktan sonra, bir eğimde sindirim şişeyi ayarlayın.
- Ayrışmamış doku toplamak için özen, süpernatant toplayın. Toplanan yüzer için HBSS eşit miktarda eklenir ve steril bir 15 ml santrifüj tüplerine aktarılır. Çözünmemiş doku malzemesinden ek kısımlar için, çözülmemiş doku ile adım 3.2 başlangıç prosedürü tekrarlayın.
- 15 dakika boyunca 1000 x g'de 4 ° C'de Homojenat santrifüj.
- Her grup için, santrifüjün ardından, pelet bozmadan, süpernatan aspire. Plasental villöz hücreler, kırmızı kan hücreleri üzerinde uzanan, pelet beyaz bölümünde ağırlıklı olarak.
- Bir st villus hücreleri (pelet beyaz kısmı) aktarın50 mL konik santrifüj tüpü erile ve buz üzerinde tutun.
- Üç sindirim aşamalarında hücreleri toplanmasından sonra, steril bir 50 ml lik konik bir santrifüj tüpünün üst sokulan bir 100 um naylon hücre süzgeç kullanılarak süspansiyon filtre. Hücre süspansiyonunun filtrasyon yavaşlattığında, boru içinde bir vakum çekmek için filtre üzerinde yukarı kaldırın.
- 10 dakika boyunca 1000 x g'de 4 ° C'de santrifüje. Dikkatle pelet bozmadan süpernatant kaldırmak.
2. Plasental villöz hücreleri homojenize
- Izolasyon işlemi başlamadan önce, 20 mM Tris-HCI, pH 7.4 ve 1 mM EDTA ihtiva eden Hipotonik Lysis Ortamı (HLM) 50 ml hazırlar. Kullanımdan hemen önce HLM proteaz inhibitörleri eklenir ve buz üzerinde orta tutun.
- Biyolojik güvenlik kabini olarak, hücrelere buz soğukluğunda HLM 4 katı hücre topağı ses ekleyin. Yavaşça ve iyice hücreleri pipetleme hücreleri tekrar süspansiyon yukarı bir10 ml pipet kullanarak d-aşağı.
- 10 dakika boyunca buz üzerinde asılı hücreleri inkübe edin.
- Buz üzerinde olmalıdır Dounce homojenleştirici, hücreleri aktarın. Yavaş yavaş homojenleştirici gevşek havan tokmağı ile 20-25 hafif vuruş uygulayarak hücreleri homojenize edilmiştir.
- Santrifüj 10 dakika boyunca 3000 x g, 4 ° C 'de, hücre lisatı kesintisiz hücreler, hücre artıkları ve çekirdeklerin giderilmesi için.
- Süpernatant toplayın ve bir SVV28 tüp (ya da 25.000 x g'de santrifüj edilebilir alternatif) transfer. Mitokondri çıkarmak için 20 dakika için 25,000 xg'de 4 ° C'de santrifüj.
3. Ultra-santrifüj ile izole edilmesi lipid damlacıkları
- 50 mM sodyum karbonat, 100 (M + 106 g / mol) tamponu (pH 11.5) ve ml ve 50 mi% 60 sukroz (ağırlık / ağırlık) çözeltisi hazırlayın. Kullanımdan hemen önce, sodyum karbonat tamponuna proteaz inhibitörleri eklenir ve buz üzerinde tutun.
- Ayarlayın, bir 50 ml santrifüj tüpüne aşama 2.6 'dan süpernatan toplamakBir SVV28 rotoru ya da eşdeğer bir ultra santrifüj tüpünün dibine sükroz ve transfer% 20. ~ Buz gibi soğuk 100 mM sodyum karbonat tamponu (pH 11.5) 10 ml ve tüpün doldurulması için buz soğukluğunda HLM 0.5-1 ml Kaplama yoğunluğu ayarlanabilir yüzer.
- SVV28 sallanan kovalı rotor kullanılarak 45 dakika boyunca 130,000 x g'de, 4 ° C'de santrifüj. Bir stop (rotor yavaşlama = 0) için kıyıya rotor izin verin.
- % 10 sakaroza ayarlamak ve bir SW41Ti rotor ya da eşdeğer bir 13.2 ml ultra santrifüj tüpünün tabanına içine aktarın, yüzen tabakayı toplayın. Kaplama yoğunluğu yaklaşık 5 buz gibi soğuk 100 mM sodyum karbonat tamponu (pH 11.5) içinde çözdürülür ve buz soğukluğundaki HLM 0.5 ml süpernatant ayarlandı.
- SW41Ti sallanan kovalı rotor kullanılarak 60 dakika boyunca 274,000 x g'de, 4 ° C'de santrifüj. (Rotor yavaşlama = 0) lipit damlacık tabakasının bozulmasını en aza indirmek için bir durdurmak için kıyıya rotor izin verin.
- Dikkatle içeren üst yüzen tabaka (Şekil 2B) toplamak1 ml pipet ve tekrar adım 3.4 ile lipid damlacıkları.
- SW41Ti sallanan kovalı rotor kullanılarak 30 dakika boyunca 274,000 x g'de, 4 ° C'de santrifüj. Bir stop (rotor yavaşlama = 0) için kıyıya rotor izin verin.
- 100'yi ul Hlm içeren üç 1.5 ml tüpler içine bükülmüş Pasteur pipeti ile lipid damlacıkları içeren üst beyaz renkli kayan tabaka toplamak.
Niteleme, lipid damlacıkları fraksiyonu (Protokoller 1 ve 2)
Lipid damlacık fraksiyonunun geri kazanımı ve saflık ışık veya elektron mikroskobu ile birlikte Western Blot ile doğrulanabilir. Buna ek olarak, farklı santrifüj adımları sonra tam bölünen miktarları, toplanabilir ve arıtma verimi belirlemek için korunmuştur. Western Blot, bu t diğer zar fraksiyonları lipid damlacıkları karşılaştırarak daha bütün hücre lizatının bir eşdeğeridir lipit fraksiyonunun bir damlacık hacmi karşılaştırmak için daha uygun olduğunutoplam protein içeriği 24 diye temeli.
Sonuçlar
Beklendiği gibi yoğunluk gradyan santrifüj çalıştıysanız, yüzen tabaka lipid damlacıkları içermelidir ve yüksek hızda spin ilerlemesi boyunca diğer organellere tükenmiş olabilir.
Protokol 1 için, Western blot işaretleyici lipid damlacıkları (Erg6p) antikorları ve maya, ER (Dpm1p), mitokondri (Por1p) lipid damlaları ile etkileşim için tespit edilmiştir organel ile yapıldı, plazma membranı (Pma1p) ve vakuol (Vma1p).
Her üç spin yüzer tabaka (adım 3.7, 3.10 ve 3.13) toplandı ve eşit hacimleri, trikloroasetik asit (% 15 nihai konsantrasyon) ile çökeltilmiş ve su içinde çözünür. 13. Hücre lizatının ml (Şekil 3A, "Lys") ve her bir üç spin protein prep (Şekil 3A, "Spin1", "Spin2" ve "Spin3"), nitroselüloza aktarıldı,% 12 SDS-PAGE üzerinde ayrıldı Membran ve organel özgüllükle imünoFIC antikorlar. Beklendiği gibi, lipid damlacık markör proteinin Erg6p üç spin (Şekil 3A), her sonra yüzer tabakada mevcut değil, Por1p (Şekil 3A) Spin1 sonra yüzer tabaka içinde mevcut değildir; Vma1p Spin2 sonra yüzer tabakasından tüketilir (Şekil 3A) ve Dpm1p ve Pma1p Spin3 (Şekil 3A) sonra yüzer tabaka içinde mevcut değildir.
Protokol 2, insan plasental terimi, villöz hücrelerinden izole edilen lipid damlacıklarının varlığı da nötral bir lipid özel flüoresan boya, BODIPY 493/503 ile lekeleme tarafından doğrulanmıştır. Damlacıklar daha sonra bir floresan mikroskobu (Şekil 3B) altında görselleştirilmiştir. İzole edilmiş lipid damlacık fraksiyonlarının saflığı, lipid (2 perilipin) damlacıklar, ER (calnexin), Golgi (GM130), mitokondri (COX IV) ve plazma zarına (MEK1) (Şekil 3C) için işaretleyici proteinler ile, Western Blotting ile değerlendirildi. Lipid droplets soğuk aseton ile de-lipide edilmiş ve protein ekstre edilmiştir. Post-nükleer süpernatant (PNS) eşit yüzdeler, son spin yüzen tabakası (Şekil 3C adım 3.6, "Spin4") altında fraksiyonu, sonraki yıkama adımı (adım 3.8, "Spin5" Şekil 3C), ve yüzer lipid damlacık tabaka (aşama 3.8, Şekil 3C'de on "LD") içinde de-lipide edilmiş protein hazırlık, 12% SDS-PAGE üzerinde ayrılmış ve transfer belirtilen antikorlar ile imüno edilmiştir. (Aynı zamanda ADRP olarak da bilinir) perilipin 2, lipid damlacık protein, post-nükleer yüzer ve lipid damlacıkları ihtiva eden izole edilmiş, beyaz yüzer tabakası içinde tespit edildi. Plazma membranı (MEK1) için özel ve Golgi (GM130) Proteinler Spin4 ve Spin5 için yüzen tabakası altında Tabakalarda damlacık lipid fraksiyonlarında tespit edilmedi. Daha önce bildirildiği gibi, ER protein calnexin 18,27,28 ve mitokondrial membran proteini COX IV zayıf bir boyama bozulan olmuşturLipid fraksiyon damlacık 22 başka bir yerde cted. Bu sonuçlar lipid damlacıkları memeli hücrelerinde 29 ve ER 30,31 ile mitokondri ile etkileşim gösteren daha önceki raporlar ile uyumludur.
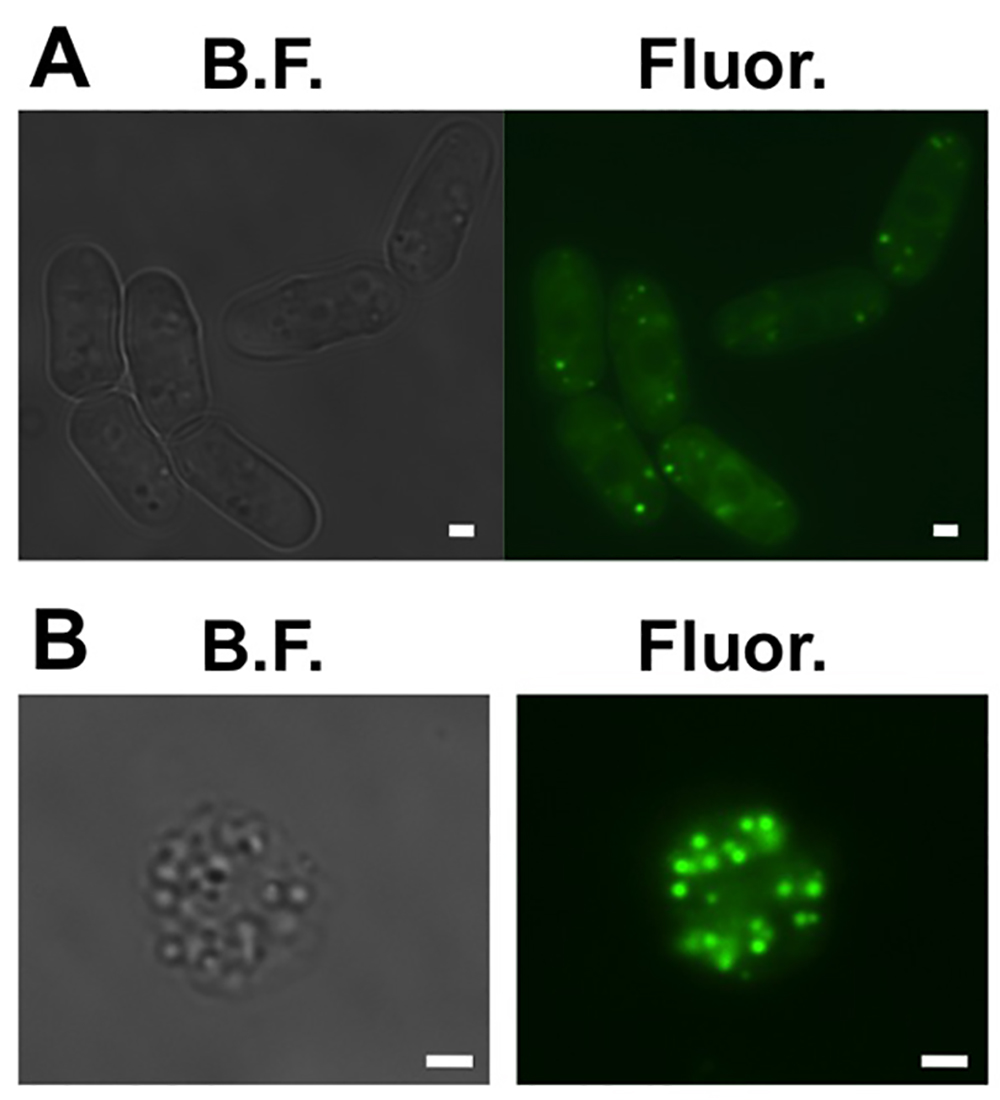
Şekil 1. Fisyon maya hücreleri hücresel lipid damlacıkları. (A) Parlak alan (BF) ve geniş alan floresan lipid damlacıkları BODIPY 493/503 ile boyanmış altı temsilci fisyon maya hücrelerinin (Fluor.) görüntüleri. (B) Parlak alan (BF ) ve geniş alan floresan lipid damlacıkları BODIPY 493/503 ile boyanmış bir temsilci sferoplast arasında (Fluor.) görüntüler. Ölçek çubukları 1 mm. daha büyük bir versiyonu o görmek için buraya tıklayınızf bu rakam.

Şekil 2. Yoğunluk gradyanlı santrifüj işleminden sonra yüzen katmanı. Sonra santrifüj tüpleri (A) Spin1 (adım 3.8), (B) Spin2 (adım 3.11), ve Protokol 1 (C) Spin3 (adım 3.14). (D) Santrifüj tüpleri sonra Protokol 2 Spin4 (adım 3.6). Lipid damlacıkları ihtiva eden yüzer tabakalar oklar ile belirtilmiştir.

Şekil 3,. İzole edilmiş lipid damlacıkları saflığı analizi. Protokol 1 'de önemli adımlar (A), Western lekeleme. Her protein hazırlık (Spin1 Eşit hacimleri - adım 3.7, Spin2 - 3.10 adım ve Spi n3 - adım 3.13)), nitroselüloz membranlarına transfer, SDS-PAGE ile ayrılmış ve Erg6p (LD, lipid damlacıkları için antikorları ile bağışık lekelenmesi, Dpm1p (ER), Por1p (MT, mitokondri), Pma1p (PM, plazma membranı), ve Vma1p (vakuoller). (B) faz kontrast (PC) ve geniş alan floresan insan plasental villöz hücrelerinden izole edilmiştir BODIPY 493/503-stained lipid damlacıkları (Fluor.) görüntüler. (C) önemli adımlardan Western blotlar Protokol 2. Eşit yüzde pf PNS (post nükleer süpernatant), son dönüş (Spin4 - adım 3.6) sonra yüzen katmanının altında yüzer, daha sonra yıkama (Spin5 - adım 3.8) ve yüzer tabakası (LD) transfer, SDS-Page ile ayrıldı membranlar ve 2 (LD, lipid damlacıkları) perilipin için antikorlar ile imüno, calnexin (ER), GM130 (Golgi matris protein, Golgi), COX IV (sitokrom c oksidazı, MT, mitokondri), MEK1 ve (MAPK kinaz, PM, plazma membran).ad/50981/50981fig3highres.jpg "target =" _blank "> bu rakamın daha büyük bir versiyonunu görmek için buraya tıklayınız.
Tartışmalar
Bu protokol kapsamında kritik adım
Kültür haline gelmiş hücrelerin büyümesi sırasında ortam ve hücre yoğunlukları ile tutarlı olması için emin olun. Cellular lipid damlacıkları, ilişkili proteinlerin hücreler kültürlendi 17 olduğu çevre üzerine son derece bağımlı olmasıyla benzersizdir. Bu nedenle, hücrelerin yetiştirildiği ortam ve hücre yoğunluğu yakından lizis önce izlenmelidir.
Lipid damlacıkları protein bileşimi, maya hücrelerinin büyüme fazının bir fonksiyonudur. Daha az proteinler sabit fazda karşı log büyüme fazında damlacıkları bağlı olacaktır. Ayrıca, verimlilik spheroplasting maya hücrelerinin büyüme fazının bir fonksiyonudur. Ikinci enzimatik tedaviye daha dirençli olduğu için log büyüme fazında hücreler hareketsiz safhasında bulunan hücreler daha spheroplastlar yüksek verim olacaktır.
çadır ">Hücreler. Enzimatik sindirme ile maya hücre duvarı yıkmak Teknikleri uygulanan kuvvet yoluyla hücre duvarını yırtma teknikleri tercih edilmektedir açık kırmak için nazik teknikleri kullanmak emin olun. Bu ikinci yöntem, bağlı proteinler ya da lipidler kaybı ile sonuçlanan damlacıkların yapısal bütünlüğünü bozabilir.
Bu bağlı bir protein ya da lipidlerin kaybı ile sonuçlanan, yapısal bütünlüğünü etkileyebilir çünkü hücreler lize edilmiş sonra numune dondurma kaçının. Donma damlacıklar tavsiye edilmez. Donma da damlacıklar 24 sigorta veya fragman neden olabilir. Damlacıkları mümkün küçük olanları içine parçalamak veya geçmesi parçalanma canlı maya hücreleri 25 ve böylece daha büyük damlacıkların dağılımı gözlenmiştir beri bu özellikle ilgili olabilir. Fragman f görünmesini kaldırma kuvvetine sahip olmayabilir damlacıklar Adetyoğunluk gradyanlı santrifüj sırasında loating katmanı. Bu yapay damlacık yüzeylerinin protein bileşimi damlacık boyutu 32 bir fonksiyonu olabilir, çünkü bu teknik ile belirlenebilir olacaktır damlacık faktör sayısını azaltabilir.
Lipid damlacıkları lipid damlacık ilişkili faktörlerin yerelleştirme test emin olun. Lipid damlacıklarının özelliklerinden biri de diğer organellere 33-37 ile etkileşim olmasıdır. Bu nedenle, bu organelleri faktörleri sıklıkla damlacık lipid fraksiyonda bulunmuştur. Bu nedenle, bu faktörler damlacıklarının lokalize olmasını sağlamak için ek teknikler kullanmak önemlidir. Lipid damlacıkları farklı bir flüoresan işaretleyici ile boyanıp hücrelerde ilgilenilen proteine bağlanmış bir floresan füzyon proteini ile yapılan çalışmalar, yardımcı sınırlama 15'in kapsamını belirlemek için kullanılmalıdır. Gibi protein korelasyon gibi teknikler profiling ayrıca damlacık lipid fraksiyonu 15 saflığını ölçmek için kullanılabilir. Bu stratejide, iki bileşen, her biri farklı izotop-ihtiva-eden amino asitler ile etiketlenir. Birinci bileşen, bilinen bir lipid damlacık faktörüdür ve ikinci bileşen analiz edilmektedir fraksiyonudur. Karşılaştırmalar sonra iki bileşenden fraksiyonel konumlar arasında yapılır.
Değişiklikler ve sorun giderme
Tomurcuklanan maya Saccharomyces cerevisiae lipid damlacıkları izole etmek için Protokol 1 Değişiklikler belirtilmiştir. Lipid damlacıkların boyutları büyük ölçüde değişebilir unutmayın. Density gradient santrifüjleme hızı, yüzer tabakanın birikmesine küçük damlalar için artırılabilir gerekebilir.
Tekniğin sınırlamaları
Gibi bir ultra santrifüj erişimkova rotor winging hücre lipid damlacıkları izolasyonu için gereklidir. Ekipman bu parça çoğu hücre biyolojisi ve biyokimya laboratuarlarında standart olmasına rağmen, pahalı.
Mevcut yöntemlerle ya da diğer alternatif yöntem ile ilgili olarak tekniğin önemi
Yukarıda belirtildiği gibi, Protokol 1 yakından Leber et al. 6 ve Protokol 2 parçası 1 Petroff et al. 26 daha önceki bir yayınlanan bir protokolün bir modifikasyonu olan bir iş dayanır
Uygulamalar
Lipid damlacık izolasyonu bağlı proteinler, nötral lipidler ve fosfolipidler sonraki proteomik ve lipidomic analizi için çok yararlıdır. Lipid damlacık ilişkili protein ve lipid Stoklar 4,6-17,19,20,22,23,28 derlenmiştir.
Açıklamalar
Yazarlar herhangi bir mali çıkarlarını beyan.
Teşekkürler
Bu çalışma Emniyeti'ne Emniyeti'ne Amerikan Kalp Derneği ödül 13SDG14500046, Sürdürülebilir Enerji Eğitim ve Araştırma Merkezi Ödülü (Tennessee Univ.) tarafından desteklenen ve JM için Hekim Tıp Eğitimi ve Araştırma Vakfı (Tennessee Univ.) tarafından ödüllü edildi Onun sallayarak inkübatör, masaüstü santrifüj, ve Western Blot analizi ekipman kullanımı için Eric T. Boder (Tennessee Univ.); yazarlar spheroplastlar için fisyon maya dönüştürmek için protokol için Caroline Leplante (. Yale Üniversitesi) teşekkür ve için Merkezi ultra santrifüj kullanımı için Çevresel Biyoteknoloji (Univ. Tennessee); maya antikorlar Günther Daum (Graz Üniversitesi Teknoloji, Avusturya.); teknik yardım için Kadın Hastalıkları ve Doğum (Univ. Tennessee Tıp Merkezi) Bölümü personel .
Malzemeler
| Name | Company | Catalog Number | Comments |
| PROTOCOL #1: | |||
| 1.Growing yeast cells and converting to spheroplasts | |||
| Edinburgh Minimal Media (EMM) | Sunrise Science Products | 2005 | |
| Yeast extract with 5 supplements (YE5S) | Sunrise Science Products | 2011 | YE5S media with 225 mg/ml of each supplement: adeninie, histidine, leucine, lysine, uracil. The equivalent for budding yeast would be YPD. |
| YPD powder | Sunrise Science Products | 1875 | For S. cerevisiae |
| Sorbitol | Fisher Scientific | BP439 | |
| Yeast Lytic Enzyme | MP Biomedicals | 215352610 | |
| Lysing Enzymes from Trichoderma harzianum | Sigma-Aldrich | L1412 | |
| Zymolayse-20T | Sunrise Science Products | N0766391 | For S. cerevisiae |
| BODIPY 493/503 | Invitrogen | D-3922 | |
| Microscope Slides | Fisher Scientific | 12-544-7 | |
| Microscope Cover Glass | Fisher Scientific | 12-542-B | |
| Plastic transfer pipette | Fisher Scientific | 137115AM | |
| 1 liter glass bottle | |||
| 250 ml flask | |||
| 2.8 liter flasks | |||
| 2. Yeast lipid droplet isolation | |||
| Tris-HCl | Fisher Scientific | BP153 | |
| EDTA | Fisher Scientific | BP120 | |
| Ficoll 400 | Fisher Scientific | BP525 | |
| 12-14k Spectra/Por Dialysis Membrane | SpectrumLabs | 132680 | |
| EDTA-free Protease Inhibitor Cocktail Tablets | Roche Diagnostics | 11873580001 | irritant |
| Dounce Homogenizer | Sigma-Aldrich | D9938 | |
| Ultracentrifuge Tubes 25x89mm (for SW28) | Beckman-Coulter | 355642 | |
| 12-14k Spectra/Por Dialysis Membrane | SpectrumLabs | 132680 | |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| Temperature-controlled shaker | New Brunswick Scientific | C25KC | |
| Thermo Sorvall Legend XTR centrifuge | Thermo-Scientific | 75004521 | |
| Swinging Bucket Centrifuge Rotor | Thermo-Scientific | 75003607 | |
| Fiberlite* F15-6x100y Fixed-Angle Rotor | Thermo-Scientific | 75003698 | |
| Ultracentrifuge LB-M | Beckman-Coulter | ||
| SW28 Ultracentrifuge Rotor | Beckman-Coulter | 342204 | |
| PROTOCOL #2 | |||
| 1. Placental villous cells isolation | |||
| Disposable underpads | Fisher Scientific | 23666062 | |
| Autoclavable pan (container), 3L | Fisher Scientific | 1336110 | |
| Fine scissors, sharp-sharp, straight | Fine science tools | 1406011 | |
| London Forceps | Fine science tools | 1108002 | |
| Dumont #7b Forceps | Fine science tools | 1127020 | |
| Razor blades | Fisher Scientific | S65921 | |
| Screen cup for CD-1 | Fisher Scientific | S1145 | |
| 40 mesh screen | Fisher Scientific | S0770 | |
| Fisherbrand cell stainers 100μm | Fisher Scientific | 22363549 | |
| 150 mm Petri Dishes | Fisher Scientific | NC9054771 | |
| NaCl | Fisher Scientific | S642 | |
| KCl | Fisher Scientific | P333 | |
| KH2PO4 | Fisher Scientific | P386 | |
| Na2HPO4 | Fisher Scientific | S374 | |
| D-glucose | Fisher Scientific | D16 | |
| HEPES | Fisher Scientific | BP310 | |
| 2.5% trypsin 10x | Invitrogen | 15090046 | |
| DNase I grade II, from bovine pancreas | Roche Applied Science | 10104159001 | |
| Sodium bicarbonate solution | Sigma-aldrich | S8761 | |
| 500 ml Erlenmeyer flasks | |||
| 250 ml beakers | |||
| 15 ml centrifuge tubes | |||
| 10 ml serological pipettes | |||
| 50 ml centrifuge tubes | |||
| DMEM | Invitrogen | 11965084 | |
| 2. Lipid droplets isolation from villous placental cells | |||
| Tris-HCl | Fisher Scientific | BP153 | |
| EDTA | Fisher Scientific | BP120 | |
| D-Sucrose | Fisher Scientific | BP220 | |
| Sodium Carbonate | Fisher Scientific | BP357 | |
| EDTA-free protease inhibitor cocktail tablets | Roche Diagnostics | 11873580001 | irritant |
| Dounce homogenizer | Sigma-Aldrich | D9938 | |
| Ultracentrifuge tubes 25x89mm (for SW28) | Beckman-Coulter | 355642 | |
| Ultra-Clear centrifuge tubes 14x89mm (for SW41) | Beckman-Coulter | 344059 | |
| Disposable borosilicate glass pasteur pipets | Fisher Scientific | 1367820C | |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| Biological safety hood | Thermo-Scientific | ||
| Waterbath | Fisher Scientific | ||
| Temperature-controlled shaker | New Brunswick Scientific | C25KC | |
| Thermo Sorvall Legend XTR centrifuge | Thermo-Scientific | 75004521 | |
| Swinging Bucket Centrifuge Rotor | Thermo-Scientific | 75003607 | |
| Ultracentrifuge LB-M | Beckman-Coulter | ||
| SW28 Ultracentrifuge Rotor | Beckman-Coulter | 342204 | |
| SW41 Ti Ultracentrifuge Rotor | Beckman-Coulter | 331336 | |
| Western blot | |||
| IRDye 680 Goat Anti-Rabbit IgG | LI-COR | 926-68071 | dilution 1:15000 |
| IRDye 800CW Goat Anti-Mouse IgG | LI-COR | 926-32210 | dilution 1:5000 |
| NuPAGE® Novex® 12% Bis-Tris gels | Invitrogen | NP0341 | |
| primary antibodies for PROTOCOL #1 | |||
| Erg6p | gift from Dr. G. Daum | Graz University of Technology, Austria | dilution 1:5000 |
| Dpm1p | Abcam | ab113686 | 4 μg/ml |
| Por1p | gift from Dr. G. Daum | Graz University of Technology, Austria | dilution 1:5000 |
| Pma1p | gift from Dr. G. Daum | Graz University of Technology, Austria | dilution 1:10000 |
| Vma1p (anti-ATP6V1A) | Abcam | ab113745 | 0.5 μg/ml |
| primary antibodies for PROTOCOL #2 | |||
| perilipin 2 (anti-ADFP) | Abcam | ab52355 | 2 μg/ml |
| calnexin | Cell Signaling technology | 2679 | dilution 1:1000 |
| GM130 | Biorbyt | orb40533 | dilution 1:25 |
| COX IV | Cell Signaling technology | 4850 | dilution 1:1000 |
| MEK1 | Biorbyt | orb38775 | dilution 1:50 |
Referanslar
- Ploegh, H. L. A lipid-based model for the creation of an escape hatch from the endoplasmic reticulum. Nature. 448, 435-438 (2007).
- Herker, E. Efficient hepatitis C virus particle formation requires diacylglycerol acyltransferase-1. Nat. Med. 16, 1295-1298 (2010).
- Ding, Y. F., et al. Isolating lipid droplets from multiple species. Nat. Protoc. 8, 43-51 (2013).
- Kalscheuer, R., et al. Preparative isolation of lipid inclusions from Rhodococcus opacus and Rhodococcus rubber and identification of granule-associated proteins. Arch. Microbiol. 177, 20-28 (2001).
- Low, K. L., et al. Lipid droplet-associated proteins are involved in the biosynthesis and hydrolysis of triacylglycerol in mycobacterium bovis bacillus calmette-guerin. J. Biol. Chem. 285, 21662-21670 (2010).
- Leber, R., Zinser, E., Zellnig, G., Paltauf, F., Daum, G. Characterization of lipid particles of the yeast, Saccharomyces cerevisiae. Yeast. 10, 1421-1428 (1994).
- Grillitsch, K., et al. Lipid particles/droplets of the yeast Saccharomyces cerevisiae revisitied: lipidome meets proteome. Biochim. Biophys. Acta. , 1165-1176 (2011).
- Binns, D., et al. An intimate collaboration between peroxisomes and lipid bodies. J. Cell Biol. 173, 719-731 (2006).
- Ivashov, V. A., et al. Lipidome and proteome of lipid droplets from the methylotropic yeast Pichia pastoris. Biochim. Biophys. Acta. 1831, 282-290 (2013).
- Connerth, M., Grillitsch, K., Kofeler, H., Daum, G. Analysis of lipid particles from yeast. Lipidomics: Vol. 1: Methods and Protocols. 579, 359-374 (2009).
- Wolinski, H., Kohlwein, S. D. Microscopic analysis of lipid droplet metabolism and dynamics in yeast. Methods Mol. Biol. 457, 151-163 (2008).
- Jolivet, P., et al. Protein composition of oil bodies in Arabidopsis thaliana ecotype WS. Plant Physiol. Biochem. 42, 501-509 (2004).
- Katavic, V., Agrawal, G. K., Hajduch, M., Harris, S. L., Thelen, J. J. Protein and lipid composition analysis of oil bodies from two Brassica napus cultivers. Proteomics. 6, 4586-4598 (2006).
- Zhang, P., et al. Proteomic study and marker protein identification of Caenorhabditis elegans lipid droplets. Mol. Cell. Proteomics. 11, 317-328 (2012).
- Krahmer, N., Hilger, M., Kory, N., Wilfling, F., Stoehr, G., Mann, M., Farese, R. V., Walther, T. C. Protein correlation profiles identify lipid droplet proteins with high confidence. Mol. Cell Proteomics. 12, 1115-1126 (2013).
- Cermelli, S., Gou, Y., Gross, S. P., Welte, M. A. The lipid-droplet proteome reveals that droplets are a protein-storage depot. Curr. Biol. 16, 1783-1795 (2006).
- Brasaemle, D. L., Dolios, G., Shapiro, L., Wang, R. Proteomic analysis of proteins associated with lipid droplets of basal and lipolytically stimulated 3T3-L1 adipocytes. J. Biol. Chem. 279, 46835-46842 (2004).
- Liu, P. S., Ying, Y. S., Zhao, Y. M., Mundy, D. I., Zhu, M. F., Anderson, R. G. W. Chinese hamster ovary K2 cell lipid droplets appear to be metabolic organelles involved in membrane traffic. J. Biol. Chem. 279, 3787-3792 (2004).
- Fujimoto, Y., et al. Identification of major proteins in the lipid droplet-enriched fraction isolated from the human hepatocyte cell line HuH7. Biochim. Biophys. Acta. , 47-59 (2004).
- Sato, S., et al. Proteomic profiling of lipid droplet proteins in hepatoma cell lines expressing hepatitis C virus core protein. J. Biochem. 139, 921-930 (2006).
- Umlauf, E., Csaszar, E., Moertelmaier, M., Schuetz, G. J., Parton, R. G., Prohaska, R. Association of stomatin with lipid bodies. J. Biol. Chem. 279, 23699-23709 (2004).
- Zhang, H. N., et al. Proteome of skeletal muscle lipid droplet reveals association with mitochondria and apolipoprotein A-I. J. Proteome Res. 10, 4757-4768 (2011).
- Wu, C. C., Howell, K. E., Neville, M. C., Yates, J. R., McManaman, J. L. Proteomics reveal a link between the endoplasmic reticulum and lipid secretory mechanisms in mammary epithelial cells. Electrophoresis. 21, 3470-3482 (2000).
- Brasaemle, D. L., Wolins, N. E. Isolation of lipid droplets from cells by density gradient centrifugation. Curr. Protoc. Cell Biol. , 3.15.1-3.15.12 (2005).
- Long, A. P., et al. Lipid droplet de novo formation and fission are linked to the cell cycle in fission yeast. Traffic. 13, 705-714 (2012).
- Petroff, M. G., Phillips, T. A., Ka, H., Pace, J. L., Hunt, J. S. Isolation and culture of term human trophoblast cells. Methods Mol. Med. 121, 203-217 (2006).
- Cho, S. Y., et al. Identification of mouse Prp19p as a lipid droplet-associated protein and its possible involvement in the biogenesis of lipid droplets. J. Biol. Chem. 282, 2456-2465 (2007).
- Ding, Y. B., Wu, Y. B., Zeng, R., Liao, K. Proteomic profiling of lipid droplet-associated proteins in primary adipocytes of normal and obese mouse. Biochim. Biophys. Acta. 44, 394-406 (2012).
- Jagerstrom, S., et al. Lipid droplets interact with mitochondria using SNAP23. Cell Biol. Int. 33, 934-940 (2009).
- Xu, N. Y., et al. The FATP1-DGAT2 complex facilitates lipid droplet expansion at the ER-lipid droplet interface. J. Cell Biol. 198, 895-911 (2012).
- Ozeki, S., Cheng, J. L., Tauchi-Sato, K., Hatano, N., Taniguchi, H., Fujimoto, T. Rab18 localizes to lipid droplets and induces their close apposition to the endoplasmic reticulum-derived membrane. J. Cell Sci. 118, 2601-2611 (2005).
- Yang, H. Y., Galea, A., Sytnyk, V., Crossley, M. Controlling the size of lipid droplets: lipid and protein factors. Curr. Opin. Cell Biol. 24, 509-516 (2012).
- Jacquier, N., Choudhary, V., Mari, M., Toulmay, A., Reggiori, F., Schneiter, R. Lipid droplets are functionally connected to the endoplasmic reticulum in Saccharomyces cerevisiae. J. Cell Sci. 124, 2424-2437 (2011).
- Pu, J., Ha, C. W., Zhang, S., Jung, J. P., Huh, W. K., Liu, P. Interactomic study on interaction between lipid droplets and mitochondria. Protein Cell. 2, 487-496 (2011).
- Shaw, C. S., Jones, D. A., Wagemakers, A. J. M. Network distribution of mitochondria and lipid droplets in human muscle fibres. Histochem. Cell Biol. 129, 65-72 (2008).
- Goodman, J. M. The gregarious lipid droplet. J. Biol. Chem. 283, 28005-28009 (2008).
- Brasaemle, D. L., Wolins, N. E. Packaging of fat: an evolving model of lipid droplet assembly and expansion. J. Biol. Chem. 287, 2273-2279 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır