Method Article
Isolamento dei lipidi cellulari Goccioline: due tecniche di purificazione partire da cellule di lievito e placente umane
In questo articolo
Riepilogo
Due tecniche per isolare gocce lipidiche cellulari da 1) cellule di lievito e 2) placente umane sono presentati. Il fulcro di entrambe le procedure è la densità centrifugazione in gradiente, dove lo strato risultante galleggiante contenente le goccioline può essere facilmente visualizzato occhio, estratto, e quantificato mediante analisi Western Blot per la purezza.
Abstract
Gocce lipidiche sono organelli dinamiche che si possono trovare nella maggior parte delle cellule procariote eucariotiche e certe. Strutturalmente, le goccioline costituiti da un nucleo di lipidi neutri circondato da un monostrato di fosfolipidi. Una delle tecniche più utili nella determinazione dei ruoli cellulari delle goccioline è stato individuazione proteomica di proteine legate, che possono essere isolati con le goccioline. Qui, due metodi sono descritti per isolare gocce lipidiche e le loro proteine legate da due ampie eucarioti: fissione lievito e cellule dei villi placentari umani. Anche se entrambe le tecniche hanno differenze, il metodo principale - Densità di centrifugazione in gradiente - è condivisa da entrambi i preparativi. Questo dimostra l'ampia applicabilità delle tecniche di isolamento droplet presentate.
Nel primo protocollo, le cellule di lievito vengono convertiti in sferoplasti mediante digestione enzimatica delle loro pareti cellulari. I sferoplasti risultanti sono poi gently lisato in un omogeneizzatore larghi. Ficoll viene aggiunto al lisato di fornire un gradiente di densità, e la miscela viene centrifugata per tre volte. Dopo la prima rotazione, le goccioline lipidiche sono localizzati al livello fluttuante colore bianco delle provette da centrifuga con il reticolo endoplasmatico (ER), la membrana plasmatica, e vacuoli. Due successivi giri sono utilizzati per rimuovere questi altri tre organelli. Il risultato è uno strato che ha solo goccioline e proteine legate.
Nel secondo protocollo, le cellule dei villi placentari sono isolate da placenta umana termine per digestione enzimatica con tripsina e DNasi I. Le cellule vengono omogeneizzati in un omogeneizzatore larghi. Passaggi a bassa velocità e centrifugazione a velocità media vengono utilizzati per rimuovere le cellule continue, detriti cellulari, nuclei e mitocondri. Il saccarosio è aggiunto l'omogeneizzato per fornire un gradiente di densità e la miscela viene centrifugata per separare le goccioline lipidiche dall'altro cellulafrazioni r.
La purezza delle goccioline lipidiche in entrambi i protocolli è confermata mediante analisi Western Blot. Le frazioni di gocce di entrambe le preparazioni sono adatti per la successiva analisi proteomica e lipidomico.
Introduzione
Gocce lipidiche cellulari sono organelli dinamiche che servono molteplici funzioni nelle cellule. Essi sono hub stoccaggio dei lipidi neutri, che possono essere convertiti in energia o utilizzati per la sintesi dei fosfolipidi. Le goccioline giocano un ruolo centrale in condizioni fisiologiche e patologiche tra cui l'aterosclerosi, obesità e malattie metaboliche, malattie infettive e anche 1,2. Inoltre, sono fonti interessanti per carburanti biodiesel.
Molte informazioni sui ruoli cellulari di gocce lipidiche è stato ottenuto da analisi proteomica e lipidomico di goccioline purificate da organismi di ampio respiro 3. Questi organismi hanno incluso i batteri, lieviti 4,5 6-11, piante 12,13, nematodi 14, e vola 15,16. Dato l'interesse per il ruolo di goccioline lipidiche in malattie metaboliche umane, goccioline sono anche stati isolati da cellule animali in coltura etessuti Nimal. Linee cellulari coltivate hanno incluso 3T3-L1 adipociti 17, ovaia di criceto cinese (CHO), cellule K2 18, hepatocyes umane 19,20, e linee cellulari epiteliali 21. Tessuti animali da cui sono state isolate gocce hanno incluso il mouse muscolo scheletrico 22, 23 fegato e ghiandole mammarie 23. Come accennato in precedenza, l'obiettivo della maggior parte degli studi isolamento gocciolina è effettuare analisi proteomica sui fattori legati e analisi lipidomico sul neutro e fosfolipidi.
Poiché i lipidi neutri - i più numerosi dei componenti di goccioline lipidiche - sono meno dense maggior parte degli altri materiali cellulari, isolamento di gocce è stata tradizionalmente eseguita utilizzando gradiente di densità centrifugazione. Tale tecnica è il fulcro di entrambi preparazioni presentate qui. Tecniche precedenti 6,24 sono combinate e modificate in una presentazione visiva dell'isolamento di goccioline da cellule di lievito di fissione coltivatee cellule umane noncultured ottenute dal tessuto placentare. L'obiettivo è di mostrare la vasta applicabilità di questa tecnica scegliendo due tipi di cellule molto diverse come punti per l'isolamento gocciolina di partenza. Questa tecnica dovrebbe essere utile per coloro che desiderano isolare le goccioline dalla maggior parte degli organismi.
Protocollo 1 descrive l'isolamento di goccioline lipidiche dal lievito di fissione, Schizosaccharomyces pombe, che è stato usato come modello per osservare la formazione di goccioline durante la divisione cellulare eucariotica 25. Il lievito Saccharomyces cerevisiae in erba è stato ampiamente utilizzato come organismo modello per lo studio dei lipidi droplet biologia. Protocollo 1 è applicabile a entrambi gli organismi e le differenze nei preparativi sono evidenziati.
Protocollo 2 descrive l'isolamento di goccioline lipidiche dalle cellule dei villi placentari, che sono a loro volta ottenuti da placenta umana termine. Ilraccolta di placente termine offre un'opportunità unica di ottenere in modo sicuro ed eticamente 200-250 g di facilmente reperibile tessuto umano 26, che contiene un numero significativo di goccioline lipidiche. Questo è in contrasto con la maggior parte del lavoro di isolamento lipidi gocciolina in eucarioti superiori dove le goccioline originano da cellule coltivate. In questi studi, gli acidi grassi sono spesso aggiunti alla coltura per promuovere la sintesi di lipidi neutri e quindi la crescita di goccioline. Questo è in contrasto con il lavoro qui dove goccioline lipidiche si formano in condizioni native nel tessuto placentare.
Le purezza delle frazioni lipidi goccioline sono determinati mediante analisi Western Blot usando anticorpi marcatori organelli. Questi due protocolli produrranno frazioni lipidiche goccioline che sono adatti per la successiva analisi proteomica e lipidomico.
Protocollo
1. Isolare lipidi goccioline da (fissione) cellule di lievito
Isolamento di goccioline dalla famosa organismo modello in erba lievito Saccharomyces cerevisiae è quasi identico al seguente protocollo 6. Le differenze tra le preparazioni sono noti.
1. Cellule di lievito in crescita
- Preparare il supporto. Unire 36 g di YE5S polvere per litro di dH 2 O in bottiglie di vetro o flaconi di coltura. Saranno necessari circa 2 L di media. Autoclavare il supporto a 121 ° C per 20 min. Lasciare i media a raffreddare a temperatura ambiente. Per S. cerevisiae sostituire YE5S con YPD.
- Posizionare 10-20 ml del terreno YE5S raffreddati in un pallone di coltura da 250 ml con tecniche sterili. Inoculare il supporto con una piccola quantità di cellule di lievito da una piastra di agar usando un bastoncino di legno sterile o equivalente. Lasciare che le cellule crescono alla densità ottica desiderata a 30 ° C. Misurare la densità ottica allalunghezza d'onda di 595 nm usando uno spettrofotometro.
- Posizionare i mezzi rimasti in 2,8 L palloni. Utilizzare non più di 1 L di supporto per 2.8 L pallone per garantire la corretta miscelazione durante la crescita delle cellule in incubatore agitazione. La resa finale di cellule umide dovrebbe essere di circa 10 g per essere in grado di acquisire abbastanza goccioline lipidiche nell'analisi proteomica e lipidomico.
- Introdurre le cellule dal punto 1.2 in 2,8 L palloni ciascuno con 1 L di mezzi di comunicazione che sono stati preparati nel passaggio 1.1.
- Crescere le cellule alla densità desiderata a 30 ° C.
- Assicurarsi che le cellule hanno goccioline lipidiche. Riserva 1 ml delle cellule. Misurare la densità ottica (OD) del campione. Aggiungere 0,1 ml di uno stock di 100 mm BODIPY 493/503 in etanolo per OD delle cellule al campione. Posizionare 3 microlitri del campione tra un vetrino ed un vetrino di vetro. Visualizzare sotto un microscopio a fluorescenza con un filtro GFP (Figura 1A).
- Agglomerare le cellule dal punto 1.5 a 4 & #176; C a 3.800 xg per 10 min. Lavorare in lotti a seconda della capacità delle provette da centrifuga.
- Versare i media YE5S e lavare le cellule con un buffer di EMM + 600 mm sorbitolo. Sorbitolo fornisce il supporto osmotica.
- Trasferire le cellule ad una sterile 50 ml provetta da centrifuga e agglomerare le cellule a 4 ° C a 2.000 xg per 10 min. Rimuovere il surnatante. Pesare le celle umide. Risospendere le cellule in 2 ml di (EMM + 600 mM sorbitolo) tampone per grammo di cellule.
2. Conversione di cellule di lievito di fissione in sferoplasti e successiva lisi
- Aggiungere 5 mg ciascuna di 1) lievito litico enzima e 2) lievito lisi enzimi da Trichoderma harzianum per grammo di cellule umide che furono pesate nel passaggio 1.9. Per S. cerevisiae augment questi enzimi con la stessa quantità di Zymolyase.
- Incubare le cellule a 30 ° C sotto leggera agitazione a 100 rpm per 60 min.
- Verificare che le sferoplasti hanno dr lipidioplets. Ripetendo il punto 1.6 (Figura 1B).
3. Gradiente di densità centrifugazione
- Agglomerare le sferoplasti mediante centrifugazione a 4 ° C a 2.000 xg per 5 min.
- Rimuovere con cautela il surnatante con una pipetta di trasferimento di plastica.
- Risospendere delicatamente gli sferoplasti pellet con ghiaccio freddo 10 mM Tris-HCl, 600 mM sorbitolo e 200 mM EDTA. Tenete a mente che le sferoplasti sono molto fragili.
- Pellet di nuovo le sferoplasti utilizzando le stesse impostazioni come al punto 3.1. Rimuovere con cura il supernatante e risospendere le sferoplasti utilizzando una pipetta di plastica a 12% Ficoll, 10 mM Tris-HCl, 200 mM e EDTA ad una concentrazione di 2 ml / g-cellule.
- Trasferire i sferoplasti risospese ad un omogeneizzatore vetro e omogeneizzare dolcemente sul ghiaccio, 20-30 tratti, con il pestello larghi del omogeneizzatore vetro.
- Trasferire i sferoplasti lisati di provette da centrifuga e sovrapporre con la stessa volume del 12% Ficoll, 10 mM Tris-HCl, 200 mM tampone EDTA. Scegliere il numero di provette da centrifuga da usare in modo che ogni tubo è di circa due terzi.
- Centrifugare a 4 ° C a 100.000 xg per 1,5 ore in un rotore SW28 o equivalente. Lasciare rotore per inerzia (rotore di decelerazione = 0).
- Trasferire delicatamente lo strato superiore galleggiante bianco (Figura 2A), che contiene le goccioline, in un tubo da centrifuga (s) utilizzando una pipetta o un piegato pipetta Pasteur. Aggiungere abbastanza volume del 12% Ficoll, 10 mM Tris-HCl, 200 mM e tampone EDTA al campione in modo da riempire circa un terzo della provetta da centrifuga.
- Aggiungere il volume equivalente dell'8% Ficoll, 10 mM Tris-HCl, 200 mM e tampone EDTA all'inizio del campione (s) nella nuova provetta da centrifuga (s). Dopo l'aggiunta di questo buffer tubi dovrebbero essere di circa due terzi pieno.
- Centrifugare a 4 ° C a 100.000 xg per 1 ora in un rotore SW28 o equivalente. Lasciare rotore per inerzia (rotor decelerazione = 0).
- Trasferire delicatamente la parte superiore bianca livello fluttuante (Figura 2B), che conterrà le goccioline, in un tubo da centrifuga (s) utilizzando una pipetta o un piegato pipetta Pasteur. Aggiungere 600 mM sorbitolo, 8% Ficoll, 10 mM Tris-HCl, 200 mM e tampone EDTA al campione in modo da riempire circa un terzo della provetta da centrifuga.
- Aggiungere il volume equivalente di 250 mM sorbitolo, 10 mM Tris-HCl, e tampone 200 mM EDTA all'inizio del campione (s) nella nuova provetta da centrifuga (s). Dopo l'aggiunta di questo buffer tubi dovrebbero essere di circa due terzi pieno.
- Centrifugare a 4 ° C a 100.000 xg per 1 ora in un rotore SW28 o equivalente. Lasciare rotore per inerzia (rotore di decelerazione = 0).
- Trasferire top strato bianco (Figura 2C), che dovrebbe contenere solo le goccioline lipidiche e proteine legate, a tubi di dialisi, e Dializzare O / N in 10 mM Tris-HCl e 200 mM tampone EDTA per eliminare il Ficoll.
Placente sono stati raccolti da donne sane con gravidanza singola fase elettiva sezione parto cesareo prima del travaglio spontaneo a termine. I soggetti hanno dato, il consenso informato scritto per la raccolta dei loro placenta. La raccolta e successivo utilizzo, di placente è stata effettuata con l'approvazione presso l'Università del Tennessee e University of Tennessee Graduate School of Medicine di Knoxville Institutional Review Board (# 8757B e # 3338, rispettivamente).
1. Isolare le cellule dei villi placentari umane
Parte 1 del protocollo è una modifica di un protocollo pubblicato prima da Petroff et al 26.
Preparare le seguenti soluzioni:
- NaCl (1 L): sciogliere 9 g di NaCl (M 58,4 g / mol) in dH 2 O per fornire una soluzione di 1 L. Filtro sterilizzare (0,2; Micron membrana).
- Soluzione salina bilanciata di 10x Hank (10x HBSS) (1 L): 4 g KCl (M 74,5 g / mol), 0,6 g KH 2 PO 4 (M 136,086 g / mol), 80 g di NaCl (M 58,44 g / mol); Na 2 HPO 4 (M 141.96 g / mol), 10 g di D-glucosio (M 180.16 g / mol). Sciogliere ciascuno dei componenti in dH 2 O per fornire una soluzione di 1 L. Sterilizzare Filter (0,2 micron membrana).
- Tampone di digestione enzimatica (0,6 ml): unire 70 ml 10x HBSS con 3,3 ml di 7,5% Na Biscarbonate, 17,5 ml di 1 M HEPES, e 266,1 ml di dH 2 O e sterilizzare il filtro (0,2 micron membrana). Conservare a 4 ° C.
- DNasi I: appena prima dell'uso, aggiungere 5 ml sterile 0,9% NaCl ad una fiala di DNasi. Tenere in ghiaccio fino al momento dell'uso o conservare a -20 ° C.
- Preparazione placenta per la dissezione
- Ottenere una placenta e di processo più vicino possibile al momento della consegna del possibile umano. Utilizzare un vaso sigillato come un dispositivo di raffreddamento per trasportare la placenta. Usare sempre cautela quando la manomateriali biologici umani Ling.
- Nella cappa di sicurezza biologica, trasferire la placenta in un contenitore autoclavabile sterile, e lavare accuratamente sangue dalla placenta e le membrane con una soluzione sterile allo 0,9% di NaCl (soluzione fisiologica). Gettare salina sanguinosa nel bicchiere 1 L come rifiuti biologici liquidi.
- Posizionare la placenta su un campo sterile, con la superficie liscia recante il cordone ombelicale rivolto verso l'alto. Con taglienti, forbici a punta fine e pinze rimuovere membrane fetali e cordone ombelicale.
- Capovolgere la placenta in modo che la superficie materna (superficie ruvida) sia rivolta verso l'alto. Rimuovere il tessuto sovrastante piastra basale, circa 3 mm dalla superficie.
- Sezionare la placenta
- Sezionare un cotiledone alla volta per evitare la piastra coriali. Raccogliere il tessuto dei villi in un bicchiere da 250 ml con soluzione fisiologica.
- Sciacquare tessuto più volte in un bicchiere separato con 0,9% NaCl agitando con le pinze, con il bicchiere 1 L per rifiuti liquidi.
- Trasferire un cotiledone alla volta per una piastra di Petri di 150 mm. Tenere con una pinza e raschiare il tessuto con lametta da navi in piastra di Petri. Collocare il tessuto raschiato nel bicchiere separato contenente 0.9% NaCl. Ripetere l'operazione per tutti i pezzi di tessuto.
- Trasferire piccola porzione di tessuto al setaccio dissociazione cellulare e risciacquare con 0,9% NaCl ampiamente finché l'eluato diventa chiaro. Ripetere l'operazione per tutto il tessuto.
- Dopo aver sciacquato il tessuto raschiato nel setaccio dissociazione cellulare, scolarla di liquidi in eccesso e peso.
A questo punto il tessuto può essere conservato O / N in un matraccio di Erlenmeyer sterile a 4 ° C in DMEM.
- Digestione enzimatica del tessuto placentare
- Preparare il tessuto digestione impasto: 100 ml di preriscaldata tampone di diluizione enzimatica, 1 ml di DNasi I e 20 ml 2,5% 10x tripsina.
- Dividere il tessuto, trasferendo 60 g di tessuto raccolti totale (solitamente circa 250-300 g) a una beuta sterile 500 ml.
- Aggiungere la miscela di digestione tessuto sulla beuta contenente il tessuto e incubare a 37 ° C in un agitatore per 45 min a 150 rpm.
- Raccogliere le cellule dissociate
- Dopo i primi 45 minuti di dissociazione, impostare il pallone digestione in una inclinazione fino tessuto si deposita.
- Raccogliere il surnatante, facendo attenzione a non raccogliere il tessuto non dissociato. Aggiungere una quantità uguale di HBSS al supernatante raccolto e trasferire in provette da centrifuga da 15 ml sterili. Per ulteriori porzioni di tessuto non dissociato, ripetere la procedura dal punto 3.2 con il tessuto non dissociato.
- Centrifugare l'omogeneizzato a 4 ° C a 1000 xg per 15 min.
- Per ciascun lotto, dopo la centrifugazione, aspirare il surnatante senza disturbare il pellet. Le cellule dei villi placentari sono prevalentemente nella porzione bianca del pellet, sormontante i globuli rossi.
- Trasferire le cellule dei villi (parte bianca del pellet) per una sterile 50 ml tubo da centrifuga conica e tenere in ghiaccio.
- Dopo aver raccolto le cellule da tutte e tre le fasi di digestione, filtrare la sospensione con una 100 um filtro cella Nylon inserita nella parte superiore di una sterile 50 ml provetta da centrifuga conica. Se la filtrazione della sospensione cellulare rallenta, sollevare verso l'alto sul filtro per disegnare un vuoto all'interno del tubo.
- Centrifugare a 4 ° C a 1000 xg per 10 min. Rimuovere con attenzione il surnatante senza disturbare il pellet.
2. Omogeneizzando le cellule dei villi placentari
- Prima di iniziare con il processo di isolamento, preparare 50 ml di ipotonico Lysis Medium (HLM) contenente 20 mM Tris-HCl, pH 7.4 e 1 mM EDTA. Aggiungere inibitori della proteasi per HLM appena prima dell'uso e mantenere il mezzo su ghiaccio.
- Nella cappa biologica, aggiungere 4 volte il volume pellet di cellule di HLM ghiacciata alle cellule. Delicatamente e completamente sospendere nuovamente le cellule pipettando le cellule su-und-giù con una pipetta 10 ml.
- Incubare le cellule sospese in ghiaccio per 10 min.
- Trasferire le cellule per l'omogeneizzatore Dounce, che dovrebbe essere sul ghiaccio. Lentamente omogeneizzare le cellule applicando 20-25 movimenti delicati con il pestello larghi del omogeneizzatore.
- Centrifugare il lisato cellulare a 4 ° C a 3000 xg per 10 minuti per rimuovere le cellule intatte, detriti e nuclei cellulari.
- Raccogliere il surnatante e trasferire in una provetta SW28 (o alternativo che può essere centrifugato a 25.000 xg). Centrifugare a 4 ° C a 25.000 xg per 20 min per rimuovere i mitocondri.
3. Isolare gocce lipidiche da ultracentrifugazione
- Preparare 50 ml di 100 mM di carbonato di sodio (M 106 g / mol) tampone (pH 11,5) e 50 ml di soluzione di saccarosio al 60% (w / w). Aggiungere inibitori della proteasi al tampone carbonato di sodio appena prima dell'uso e mantenere in ghiaccio.
- Raccogliere il supernatante dal passo 2.6 in una provetta da centrifuga da 50 ml, regolareal 20% di saccarosio e trasferimento nel fondo di un tubo un'ultracentrifuga per un rotore SW28, o equivalente. Surnatante densità Overlay regolato con ~ 10 ml di tampone carbonato di sodio 100 mM ghiacciato (pH 11,5) e 0,5-1 ml di ghiacciata HLM per riempire il tubo.
- Centrifugare a 4 ° C a 130.000 xg per 45 minuti usando SW28 rotore oscillante. Lasciare rotore per inerzia (rotore di decelerazione = 0).
- Raccogliere il livello fluttuante, regolare al 10% di saccarosio e trasferire nel fondo di un tubo 13,2 ml un'ultracentrifuga per un rotore SW41Ti, o equivalente. Densità Overlay adeguato surnatante con circa 5 ml di tampone 100 mM di carbonato di sodio ghiacciato (pH 11,5) e 0,5 ml di HLM ghiacciata.
- Centrifugare a 4 ° C a 274.000 xg per 60 minuti con SW41Ti oscillante rotore secchio. Lasciare rotore per inerzia (rotore di decelerazione = 0) per minimizzare i disagi dello strato lipidico gocciolina.
- Raccogliere accuratamente il livello fluttuante superiore (Figura 2D) contenentegocce lipidiche con una pipetta 1 ml e ripetere il punto 3.4.
- Centrifugare a 4 ° C a 274.000 xg per 30 minuti usando SW41Ti oscillante rotore secchio. Lasciare rotore per inerzia (rotore di decelerazione = 0).
- Raccogliere accuratamente lo strato galleggiante di colore bianco-top contenenti goccioline lipidiche con un'inclinazione pipetta Pasteur in tre provette da 1,5 ml contenenti 100 microlitri HLM.
Frazione di goccioline lipidiche che caratterizzano (protocolli 1 e 2)
Il recupero e la purezza della frazione lipidica gocciolina possono essere verificate mediante western blot combinata con la luce o la microscopia elettronica. Inoltre, aliquote dopo differenti fasi di centrifugazione possono essere raccolti e conservati per determinare l'efficienza di depurazione. In Western Blotting, è più appropriato per confrontare un volume della frazione lipidica gocciolina che rappresenta un equivalente di tutta lisato cellulare che confrontare goccioline lipidiche ad altre frazioni di membrana su tegli base del contenuto totale di proteine 24.
Risultati
Se la centrifugazione in gradiente di densità lavorato come previsto, il livello fluttuante dovrebbe contenere goccioline lipidiche e essere impoverito di altri organelli durante la progressione delle rotazioni ad alta velocità.
Per il protocollo 1, Western Blot sono stati eseguiti con anticorpi marcatori a gocce lipidiche (Erg6p), e gli organelli che sono stati trovati ad interagire con le goccioline di lipidi nel lievito, ER (Dpm1p), mitocondri (Por1p), membrana plasmatica (Pma1p), e vacuoli (Vma1p).
Volumi uguali di strato galleggiante di ogni tre giri (passi 3.7, 3.10 e 3.13) sono stati raccolti, precipitate con acido tricloroacetico (concentrazione finale 15%), e disciolti in acqua. 13 ml di lisato cellulare (Figura 3A, "Lys") e proteine preparazione di ogni tre giri (Figura 3A, "Spin1", "Spin2", e "Spin3") sono stati separati su 12% SDS-PAGE, trasferiti su nitrocellulosa membrana, e immunoblotting con organello specianticorpi FIC. Come previsto, il lipide gocciolina proteina marker Erg6p è presente nello strato galleggiante dopo ciascuna delle tre rotazioni (Figura 3A); Por1p non è presente nello strato galleggiante dopo Spin1 (Figura 3A); Vma1p 'esaurita dal livello fluttuante dopo Spin2 (Figura 3A), e Dpm1p e Pma1p non sono presenti nello strato galleggiante dopo Spin3 (Figura 3A).
Per protocollo 2, la presenza di goccioline lipidiche isolate da cellule dei villi placentari termine umano è stata verificata mediante colorazione con un lipide specifico colorante fluorescente neutro, BODIPY 493/503. Le goccioline sono poi visualizzati sotto un microscopio a fluorescenza (Figura 3B). La purezza delle frazioni isolate lipidi gocciolina è stata valutata mediante Western blotting con proteine marker di goccioline lipidiche (perilipin 2), ER (calnexin), Golgi (GM130), mitocondri (COX IV) e membrana plasmatica (MEK1) (Figura 3C). Il dr lipidioplets stati de-lipidated con acetone freddo e le proteine sono state estratte. Percentuali uguali di supernatante post-nucleare (PNS), la frazione sotto il livello fluttuante dell'ultima centrifuga (passo 3.6, "Spin4" in Figura 3C), la successiva fase di lavaggio (passo 3.8, "Spin5" in Figura 3C), e de-lipidated proteina preparazione di galleggiare strato lipidico gocciolina (passo 3.8, "LD" in Figura 3C) sono stati separati su 12% SDS-PAGE, trasferiti e immunoblotting con anticorpi indicati. Perilipin 2 (noto anche come ADRP), la proteina lipidi gocciolina, è stato rilevato nel supernatante post-nucleare e isolato strato galleggiante bianco contenente goccioline lipidiche. Proteine specifiche per la membrana plasmatica (MEK1) e Golgi (GM130) non sono stati rilevati in lipidi frazioni gocciolina in uno strato sotto lo strato galleggiante per Spin4 e Spin5. Come precedentemente riportato, la calnexina proteina ER 18,27,28 e una debole colorazione della proteina di membrana mitocondriale COX IV sono stati deteCTED altrove nella frazione lipidica gocciolina 22. Questi risultati sono coerenti con i rapporti precedenti dimostrano che goccioline lipidiche interagiscono con mitocondri in cellule di mammifero 29 e con l'ER 30,31.
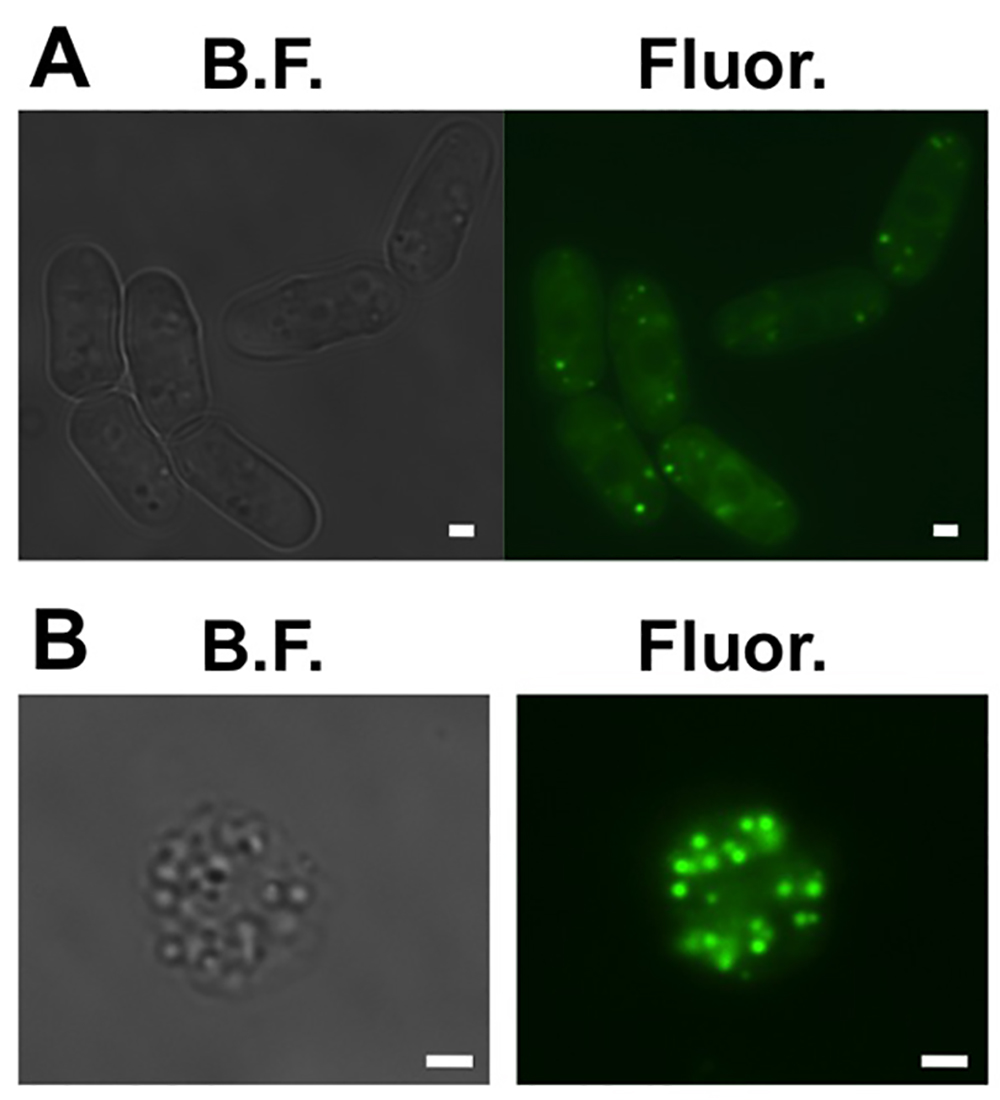
Figura 1. Gocce lipidiche cellulari in cellule di lievito a fissione. (A) campo chiaro (BF) e largo fluorescenza campo (Fluor.) immagini di sei rappresentative cellule di lievito a fissione in cui le goccioline lipidiche sono tinti con BODIPY 493/503. (B) campo chiaro (BF ) e largo fluorescenza campo (Fluor.) le immagini di un spheroplast rappresentante, se le goccioline lipidiche sono tinti con BODIPY 493/503. Barre di scala sono da 1 mm. Cliccate qui per vedere una versione più grande of questa figura.

Figura 2. Floating strato dopo centrifugazione in gradiente di densità. Provette da centrifuga dopo (A) Spin1 (passo 3,8), (B) Spin2 (passo 3.11) e (C) Spin3 (punto 3.14) del protocollo 1. (D) Provette per centrifuga dopo Spin4 (punto 3.6) del protocollo 2. Gli strati galleggianti contenenti goccioline lipidiche sono indicati da frecce.

Figura 3. Analisi della purezza dei isolate gocce lipidiche. (A) Western Blot dei passaggi chiave del protocollo 1. Volumi uguali di ogni preparazione proteina (Spin1 - punto 3.7, Spin2 - passo 3.10, e Spi n3 - passo 3.13) è stato separato mediante SDS-PAGE, trasferiti su membrane di nitrocellulosa, e immunoblotting con anticorpi per Erg6p (LD, goccioline lipidiche), Dpm1p (ER), Por1p (MT, mitocondri), Pma1p (PM, membrana plasmatica), e Vma1p (vacuoli). (B) contrasto di fase (PC) e largo fluorescenza campo (Fluor.) immagini di BODIPY 493/503-stained gocce lipidiche che sono stati isolati dalle cellule dei villi placentari umane. (C) Western blot dei passaggi chiave nel protocollo 2. Uguale percentuale pf PNS (surnatante alberino nucleare), supernatante sotto del livello fluttuante dopo l'ultima rotazione (Spin4 - passo 3.6), successivo lavaggio (Spin5 - passo 3.8), e livello fluttuante (LD) sono state separate mediante SDS-PAGE, trasferiti membrane e immunoblotting con anticorpi per perilipin 2 (LD, gocce lipidiche), calnexina (ER), GM130 (proteina della matrice Golgi, Golgi), COX IV (citocromo c ossidasi, MT, mitocondri), e MEK1 (MAPK chinasi, PM, plasma membrana).ad/50981/50981fig3highres.jpg "target =" _blank "> Clicca qui per vedere una versione più grande di questa figura.
Discussione
Passaggi critici all'interno di questo protocollo
Assicurarsi coerente con media e densità cellulari durante la crescita delle cellule in coltura. Goccioline lipidiche cellulari sono unici in quanto le loro proteine associate sono altamente dipendenti l'ambiente in cui le cellule sono coltivate 17. Pertanto, il supporto in cui si coltivano le cellule e la densità delle cellule devono essere strettamente monitorati prima lisi.
La composizione proteica di goccioline lipidiche è funzione della fase di crescita delle cellule di lievito. Meno proteine saranno vincolati alle goccioline di registro fase di crescita rispetto fase stazionaria. Inoltre, spheroplasting efficienza è funzione della fase di crescita delle cellule di lievito. Le cellule in fase di crescita log avranno rendimenti più elevati di sferoplasti di cellule in fase stazionaria perché questi ultimi sono più resistenti al trattamento enzimatico.
tenda ">Assicurarsi di utilizzare tecniche dolci per rompere le cellule. Tecniche che rompono la parete cellulare del lievito per digestione enzimatica sono preferite rispetto alle tecniche che la rottura della parete cellulare attraverso la forza applicata. Quest'ultimo metodo può compromettere l'integrità strutturale delle goccioline conseguente perdita di proteine o lipidi legate.
Evitare il congelamento dei campioni dopo che le cellule sono state lisate. Goccioline di congelamento non è raccomandato perché può influenzare la loro integrità strutturale con conseguente perdita delle proteine o lipidi. Il congelamento potrebbe anche causare le goccioline di fondere o frammento 24. Questo può essere particolarmente rilevante in quanto le goccioline sono stati osservati a frammentare o subire la fissione in cellule di lievito vivo 25 e quindi la ripartizione di gocce più grandi in quelle più piccole è possibile. Pezzi di goccioline che il frammento non può avere la galleggiabilità a comparire in fstrato loating durante gradiente di densità centrifugazione. Questo potrebbe ridurre artificialmente il numero di fattori di goccioline, che potrebbero essere identificati da questa tecnica poiché la composizione proteica di superfici gocciolina può essere una funzione della dimensione delle gocce 32.
Assicurati di testare la localizzazione di lipidi gocciolina fattori associati a gocce lipidiche. Una delle caratteristiche di goccioline lipidiche è che essi interagiscono con altri organelli 33-37. Pertanto, i fattori di questi organuli si trovano spesso nella frazione lipidica gocciolina. Pertanto, è importante utilizzare tecniche aggiuntive per garantire che questi fattori localizzano alle goccioline. Studi con una proteina di fusione fluorescente legato alla proteina di interesse in cellule in cui le goccioline lipidiche sono colorate con un marcatore fluorescente differente dovrebbero essere usati per determinare il grado di colocalizzazione 15. Tecniche come proteina correlazione profiling può essere utilizzato per quantificare ulteriormente la purezza della frazione lipidica gocciolina 15. In tale strategia, due componenti sono etichettati ciascuno con differenti aminoacidi contenenti isotopi. Il primo componente è un fattore gocciolina lipidica noto, e il secondo componente è la frazione che viene analizzato. I confronti sono poi effettuati tra le località frazionali dei due componenti.
Modifiche e risoluzione dei problemi
Le modifiche al protocollo 1 per isolare gocce lipidiche dalle erba lievito Saccharomyces cerevisiae sono noti. Si noti che le dimensioni delle goccioline lipidiche possono variare notevolmente. Velocità di centrifugazione in gradiente di densità può essere necessario un aumento di gocce più piccole per accumulare nello strato galleggiante.
Limiti della tecnica
Accesso ad una centrifuga ultra con quantovolando rotore benna è essenziale per l'isolamento di goccioline lipidiche cellulari. Anche se questo pezzo di equipaggiamento è standard nella maggior parte dei laboratori di biologia cellulare e biochimica, è costoso.
Importanza della tecnica rispetto ai metodi esistenti o altri metodi alternativi
Come accennato in precedenza, il protocollo 1 è strettamente basata sul lavoro di Leber et al. 6 e parte 1 del protocollo 2 è una modifica di un protocollo pubblicato prima da Petroff et al 26.
Applicazioni
Isolamento dei lipidi droplet è più utile per la successiva analisi proteomica e lipidomico di proteine legate, lipidi neutri e fosfolipidi. Le rimanenze di lipidi gocciolina proteine e dei lipidi associati sono stati compilati 4,6-17,19,20,22,23,28.
Divulgazioni
Gli autori dichiarano interessi finanziari concorrenti.
Riconoscimenti
Questo lavoro è stato supportato dal premio American Heart Association 13SDG14500046 al PD, a Educazione Energia Sostenibile & Research Center Award (Univ. of Tennessee) al PD, e dal Physicians 'Medical Education and Research Foundation (Univ. of Tennessee) premio a JM L' autori ringraziano Caroline Leplante (Yale University.) per il protocollo per la conversione di lievito di fissione a sferoplasti; Eric T. Boder (Univ. of Tennessee) per l'utilizzo dei suoi incubatori stringono, tavolo centrifuga e apparecchiature Western Blot, e il Centro per Biotecnologie Ambientali (Univ. Tennessee) per l'uso della loro ultra-centrifuga, Günther Daum per gli anticorpi di lievito (Graz University of Technology, Austria.), il personale del Dipartimento di Ostetricia e Ginecologia (Univ. Tennessee Medical Center) per l'assistenza tecnica .
Materiali
| Name | Company | Catalog Number | Comments |
| PROTOCOL #1: | |||
| 1.Growing yeast cells and converting to spheroplasts | |||
| Edinburgh Minimal Media (EMM) | Sunrise Science Products | 2005 | |
| Yeast extract with 5 supplements (YE5S) | Sunrise Science Products | 2011 | YE5S media with 225 mg/ml of each supplement: adeninie, histidine, leucine, lysine, uracil. The equivalent for budding yeast would be YPD. |
| YPD powder | Sunrise Science Products | 1875 | For S. cerevisiae |
| Sorbitol | Fisher Scientific | BP439 | |
| Yeast Lytic Enzyme | MP Biomedicals | 215352610 | |
| Lysing Enzymes from Trichoderma harzianum | Sigma-Aldrich | L1412 | |
| Zymolayse-20T | Sunrise Science Products | N0766391 | For S. cerevisiae |
| BODIPY 493/503 | Invitrogen | D-3922 | |
| Microscope Slides | Fisher Scientific | 12-544-7 | |
| Microscope Cover Glass | Fisher Scientific | 12-542-B | |
| Plastic transfer pipette | Fisher Scientific | 137115AM | |
| 1 liter glass bottle | |||
| 250 ml flask | |||
| 2.8 liter flasks | |||
| 2. Yeast lipid droplet isolation | |||
| Tris-HCl | Fisher Scientific | BP153 | |
| EDTA | Fisher Scientific | BP120 | |
| Ficoll 400 | Fisher Scientific | BP525 | |
| 12-14k Spectra/Por Dialysis Membrane | SpectrumLabs | 132680 | |
| EDTA-free Protease Inhibitor Cocktail Tablets | Roche Diagnostics | 11873580001 | irritant |
| Dounce Homogenizer | Sigma-Aldrich | D9938 | |
| Ultracentrifuge Tubes 25x89mm (for SW28) | Beckman-Coulter | 355642 | |
| 12-14k Spectra/Por Dialysis Membrane | SpectrumLabs | 132680 | |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| Temperature-controlled shaker | New Brunswick Scientific | C25KC | |
| Thermo Sorvall Legend XTR centrifuge | Thermo-Scientific | 75004521 | |
| Swinging Bucket Centrifuge Rotor | Thermo-Scientific | 75003607 | |
| Fiberlite* F15-6x100y Fixed-Angle Rotor | Thermo-Scientific | 75003698 | |
| Ultracentrifuge LB-M | Beckman-Coulter | ||
| SW28 Ultracentrifuge Rotor | Beckman-Coulter | 342204 | |
| PROTOCOL #2 | |||
| 1. Placental villous cells isolation | |||
| Disposable underpads | Fisher Scientific | 23666062 | |
| Autoclavable pan (container), 3L | Fisher Scientific | 1336110 | |
| Fine scissors, sharp-sharp, straight | Fine science tools | 1406011 | |
| London Forceps | Fine science tools | 1108002 | |
| Dumont #7b Forceps | Fine science tools | 1127020 | |
| Razor blades | Fisher Scientific | S65921 | |
| Screen cup for CD-1 | Fisher Scientific | S1145 | |
| 40 mesh screen | Fisher Scientific | S0770 | |
| Fisherbrand cell stainers 100μm | Fisher Scientific | 22363549 | |
| 150 mm Petri Dishes | Fisher Scientific | NC9054771 | |
| NaCl | Fisher Scientific | S642 | |
| KCl | Fisher Scientific | P333 | |
| KH2PO4 | Fisher Scientific | P386 | |
| Na2HPO4 | Fisher Scientific | S374 | |
| D-glucose | Fisher Scientific | D16 | |
| HEPES | Fisher Scientific | BP310 | |
| 2.5% trypsin 10x | Invitrogen | 15090046 | |
| DNase I grade II, from bovine pancreas | Roche Applied Science | 10104159001 | |
| Sodium bicarbonate solution | Sigma-aldrich | S8761 | |
| 500 ml Erlenmeyer flasks | |||
| 250 ml beakers | |||
| 15 ml centrifuge tubes | |||
| 10 ml serological pipettes | |||
| 50 ml centrifuge tubes | |||
| DMEM | Invitrogen | 11965084 | |
| 2. Lipid droplets isolation from villous placental cells | |||
| Tris-HCl | Fisher Scientific | BP153 | |
| EDTA | Fisher Scientific | BP120 | |
| D-Sucrose | Fisher Scientific | BP220 | |
| Sodium Carbonate | Fisher Scientific | BP357 | |
| EDTA-free protease inhibitor cocktail tablets | Roche Diagnostics | 11873580001 | irritant |
| Dounce homogenizer | Sigma-Aldrich | D9938 | |
| Ultracentrifuge tubes 25x89mm (for SW28) | Beckman-Coulter | 355642 | |
| Ultra-Clear centrifuge tubes 14x89mm (for SW41) | Beckman-Coulter | 344059 | |
| Disposable borosilicate glass pasteur pipets | Fisher Scientific | 1367820C | |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| Biological safety hood | Thermo-Scientific | ||
| Waterbath | Fisher Scientific | ||
| Temperature-controlled shaker | New Brunswick Scientific | C25KC | |
| Thermo Sorvall Legend XTR centrifuge | Thermo-Scientific | 75004521 | |
| Swinging Bucket Centrifuge Rotor | Thermo-Scientific | 75003607 | |
| Ultracentrifuge LB-M | Beckman-Coulter | ||
| SW28 Ultracentrifuge Rotor | Beckman-Coulter | 342204 | |
| SW41 Ti Ultracentrifuge Rotor | Beckman-Coulter | 331336 | |
| Western blot | |||
| IRDye 680 Goat Anti-Rabbit IgG | LI-COR | 926-68071 | dilution 1:15000 |
| IRDye 800CW Goat Anti-Mouse IgG | LI-COR | 926-32210 | dilution 1:5000 |
| NuPAGE® Novex® 12% Bis-Tris gels | Invitrogen | NP0341 | |
| primary antibodies for PROTOCOL #1 | |||
| Erg6p | gift from Dr. G. Daum | Graz University of Technology, Austria | dilution 1:5000 |
| Dpm1p | Abcam | ab113686 | 4 μg/ml |
| Por1p | gift from Dr. G. Daum | Graz University of Technology, Austria | dilution 1:5000 |
| Pma1p | gift from Dr. G. Daum | Graz University of Technology, Austria | dilution 1:10000 |
| Vma1p (anti-ATP6V1A) | Abcam | ab113745 | 0.5 μg/ml |
| primary antibodies for PROTOCOL #2 | |||
| perilipin 2 (anti-ADFP) | Abcam | ab52355 | 2 μg/ml |
| calnexin | Cell Signaling technology | 2679 | dilution 1:1000 |
| GM130 | Biorbyt | orb40533 | dilution 1:25 |
| COX IV | Cell Signaling technology | 4850 | dilution 1:1000 |
| MEK1 | Biorbyt | orb38775 | dilution 1:50 |
Riferimenti
- Ploegh, H. L. A lipid-based model for the creation of an escape hatch from the endoplasmic reticulum. Nature. 448, 435-438 (2007).
- Herker, E. Efficient hepatitis C virus particle formation requires diacylglycerol acyltransferase-1. Nat. Med. 16, 1295-1298 (2010).
- Ding, Y. F., et al. Isolating lipid droplets from multiple species. Nat. Protoc. 8, 43-51 (2013).
- Kalscheuer, R., et al. Preparative isolation of lipid inclusions from Rhodococcus opacus and Rhodococcus rubber and identification of granule-associated proteins. Arch. Microbiol. 177, 20-28 (2001).
- Low, K. L., et al. Lipid droplet-associated proteins are involved in the biosynthesis and hydrolysis of triacylglycerol in mycobacterium bovis bacillus calmette-guerin. J. Biol. Chem. 285, 21662-21670 (2010).
- Leber, R., Zinser, E., Zellnig, G., Paltauf, F., Daum, G. Characterization of lipid particles of the yeast, Saccharomyces cerevisiae. Yeast. 10, 1421-1428 (1994).
- Grillitsch, K., et al. Lipid particles/droplets of the yeast Saccharomyces cerevisiae revisitied: lipidome meets proteome. Biochim. Biophys. Acta. , 1165-1176 (2011).
- Binns, D., et al. An intimate collaboration between peroxisomes and lipid bodies. J. Cell Biol. 173, 719-731 (2006).
- Ivashov, V. A., et al. Lipidome and proteome of lipid droplets from the methylotropic yeast Pichia pastoris. Biochim. Biophys. Acta. 1831, 282-290 (2013).
- Connerth, M., Grillitsch, K., Kofeler, H., Daum, G. Analysis of lipid particles from yeast. Lipidomics: Vol. 1: Methods and Protocols. 579, 359-374 (2009).
- Wolinski, H., Kohlwein, S. D. Microscopic analysis of lipid droplet metabolism and dynamics in yeast. Methods Mol. Biol. 457, 151-163 (2008).
- Jolivet, P., et al. Protein composition of oil bodies in Arabidopsis thaliana ecotype WS. Plant Physiol. Biochem. 42, 501-509 (2004).
- Katavic, V., Agrawal, G. K., Hajduch, M., Harris, S. L., Thelen, J. J. Protein and lipid composition analysis of oil bodies from two Brassica napus cultivers. Proteomics. 6, 4586-4598 (2006).
- Zhang, P., et al. Proteomic study and marker protein identification of Caenorhabditis elegans lipid droplets. Mol. Cell. Proteomics. 11, 317-328 (2012).
- Krahmer, N., Hilger, M., Kory, N., Wilfling, F., Stoehr, G., Mann, M., Farese, R. V., Walther, T. C. Protein correlation profiles identify lipid droplet proteins with high confidence. Mol. Cell Proteomics. 12, 1115-1126 (2013).
- Cermelli, S., Gou, Y., Gross, S. P., Welte, M. A. The lipid-droplet proteome reveals that droplets are a protein-storage depot. Curr. Biol. 16, 1783-1795 (2006).
- Brasaemle, D. L., Dolios, G., Shapiro, L., Wang, R. Proteomic analysis of proteins associated with lipid droplets of basal and lipolytically stimulated 3T3-L1 adipocytes. J. Biol. Chem. 279, 46835-46842 (2004).
- Liu, P. S., Ying, Y. S., Zhao, Y. M., Mundy, D. I., Zhu, M. F., Anderson, R. G. W. Chinese hamster ovary K2 cell lipid droplets appear to be metabolic organelles involved in membrane traffic. J. Biol. Chem. 279, 3787-3792 (2004).
- Fujimoto, Y., et al. Identification of major proteins in the lipid droplet-enriched fraction isolated from the human hepatocyte cell line HuH7. Biochim. Biophys. Acta. , 47-59 (2004).
- Sato, S., et al. Proteomic profiling of lipid droplet proteins in hepatoma cell lines expressing hepatitis C virus core protein. J. Biochem. 139, 921-930 (2006).
- Umlauf, E., Csaszar, E., Moertelmaier, M., Schuetz, G. J., Parton, R. G., Prohaska, R. Association of stomatin with lipid bodies. J. Biol. Chem. 279, 23699-23709 (2004).
- Zhang, H. N., et al. Proteome of skeletal muscle lipid droplet reveals association with mitochondria and apolipoprotein A-I. J. Proteome Res. 10, 4757-4768 (2011).
- Wu, C. C., Howell, K. E., Neville, M. C., Yates, J. R., McManaman, J. L. Proteomics reveal a link between the endoplasmic reticulum and lipid secretory mechanisms in mammary epithelial cells. Electrophoresis. 21, 3470-3482 (2000).
- Brasaemle, D. L., Wolins, N. E. Isolation of lipid droplets from cells by density gradient centrifugation. Curr. Protoc. Cell Biol. , 3.15.1-3.15.12 (2005).
- Long, A. P., et al. Lipid droplet de novo formation and fission are linked to the cell cycle in fission yeast. Traffic. 13, 705-714 (2012).
- Petroff, M. G., Phillips, T. A., Ka, H., Pace, J. L., Hunt, J. S. Isolation and culture of term human trophoblast cells. Methods Mol. Med. 121, 203-217 (2006).
- Cho, S. Y., et al. Identification of mouse Prp19p as a lipid droplet-associated protein and its possible involvement in the biogenesis of lipid droplets. J. Biol. Chem. 282, 2456-2465 (2007).
- Ding, Y. B., Wu, Y. B., Zeng, R., Liao, K. Proteomic profiling of lipid droplet-associated proteins in primary adipocytes of normal and obese mouse. Biochim. Biophys. Acta. 44, 394-406 (2012).
- Jagerstrom, S., et al. Lipid droplets interact with mitochondria using SNAP23. Cell Biol. Int. 33, 934-940 (2009).
- Xu, N. Y., et al. The FATP1-DGAT2 complex facilitates lipid droplet expansion at the ER-lipid droplet interface. J. Cell Biol. 198, 895-911 (2012).
- Ozeki, S., Cheng, J. L., Tauchi-Sato, K., Hatano, N., Taniguchi, H., Fujimoto, T. Rab18 localizes to lipid droplets and induces their close apposition to the endoplasmic reticulum-derived membrane. J. Cell Sci. 118, 2601-2611 (2005).
- Yang, H. Y., Galea, A., Sytnyk, V., Crossley, M. Controlling the size of lipid droplets: lipid and protein factors. Curr. Opin. Cell Biol. 24, 509-516 (2012).
- Jacquier, N., Choudhary, V., Mari, M., Toulmay, A., Reggiori, F., Schneiter, R. Lipid droplets are functionally connected to the endoplasmic reticulum in Saccharomyces cerevisiae. J. Cell Sci. 124, 2424-2437 (2011).
- Pu, J., Ha, C. W., Zhang, S., Jung, J. P., Huh, W. K., Liu, P. Interactomic study on interaction between lipid droplets and mitochondria. Protein Cell. 2, 487-496 (2011).
- Shaw, C. S., Jones, D. A., Wagemakers, A. J. M. Network distribution of mitochondria and lipid droplets in human muscle fibres. Histochem. Cell Biol. 129, 65-72 (2008).
- Goodman, J. M. The gregarious lipid droplet. J. Biol. Chem. 283, 28005-28009 (2008).
- Brasaemle, D. L., Wolins, N. E. Packaging of fat: an evolving model of lipid droplet assembly and expansion. J. Biol. Chem. 287, 2273-2279 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon