Method Article
세포 지질 방울의 분리 : 효모 세포와 인간의 태반에서 시작 두 정화 기술
요약
1)에서 세포 지질 방울을 분리 효모 세포, 2) 인간의 태반이 제시하는 두 가지 기술. 두 절차의 핵심은 방울을 함유하는 생성 된 부동 층은 쉽게 눈에 의해 시각을 추출하고, 순도에 대한 웨스턴 블롯 분석에 의해 정량화 될 수있는 밀도 구배 원심 분리된다.
초록
지질 방울은 대부분의 진핵 및 원핵 특정 세포에서 발견 될 수있는 동적 소기관이다. 구조적으로, 방울 인지질 단층으로 둘러싸인 중성 지질의 핵심으로 구성되어 있습니다. 액적 셀룰러 역할을 결정하는데 가장 유용한 기술 중 하나는 작은 방울과 함께 단리 할 수있다 결합 단백질의 프로테옴 식별되었다. 분열 효모 및 인간의 태반 융모 세포 : 여기, 두 가지 방법은 두 개의 광범위한 진핵 생물에서 지질 방울과 그들의 결합 된 단백질을 분리 할 수 있도록 서술되어있다. 두 기술의 차이가 있지만, 주요 방법 - 밀도 구배 원심 분리 - 모두 준비가 공유됩니다. 이 제시 액적 분리 기법의 넓은 적용 가능성을 보여준다.
첫 번째 프로토콜에서 효모 세포는 세포벽의 소화 효소에 의해 spheroplasts로 변환됩니다. 그 결과 spheroplasts는 신사된다LY는 헐렁한 균질화에 용해. 피콜은 밀도 구배를 제공하기 위해 파쇄물을 첨가하고, 혼합물을 세 번 원심 분리된다. 첫번째 스핀 후, 지질 방울을 소포체 (ER), 세포막과 액포 함께 원심 분리기 튜브의 하얀색 부동 층에 지역화된다. 두 개의 연속 스핀은 다른 세 가지 세포 기관을 제거하는 데 사용됩니다. 결과는 작은 방울과 결합 단백질을 가지고 층이다.
두 번째 프로토콜에서, 태반 융모 세포는 트립신과 DNA 분해 효소 나 세포가 느슨한 맞는 균질의 균질화되어있는 소화 효소에 의해 인간의 장기 태반에서 격리됩니다. 저속 및 중속 원심 분리 단계는 손상되지 않은 세포, 세포 파편, 핵, 미토콘드리아를 제거하는 데 사용됩니다. 자당은 밀도 구배를 제공하기 위해 파쇄 액에 첨가하고, 혼합물을 다른 cellula로부터 지질 방울을 분리하기 위해 원심 분리R 분수.
두 프로토콜의 지질 방울의 순도는 웨스턴 블롯 분석에 의해 확인된다. 모두 최상의 상태로 준비에서 물방울 분수 이후 프로테오믹스 및 lipidomic 분석에 적합하다.
서문
세포의 지질 방울은 세포의 여러 기능을 제공 동적 세포 기관이다. 이들은 에너지로 변환하거나 인지질 합성을 위해 사용될 수있다 중성 지질, 스토리지 허브이다. 방울은 동맥 경화증, 비만과 관련된 대사 질환 등의 생리 학적 및 병리학 적 조건에서 중심 역할을하고, 또한 전염병 1,2. 또한, 그들은 바이오 디젤 연료에 대한 흥미로운 소스입니다.
지질 방울의 세포 역할에 대한 많은 정보가 광범위한 생물 3에서 정제 방울의 프로테옴 lipidomic 분석에서 얻을 수있다. 이 생명체는 박테리아 4,5, 효모 6-11 포함 12,13 식물, 14 선충, 그리고 15, 16 비행했다. 인간 대사 질환에서 지질 소적의 역할에 관심을 감안할 때, 액적 또한 배양 된 동물 세포에서 분리 된nimal 조직. 배양 세포주는 3T3-L1 지방 세포 (17), 중국 햄스터 난소 (CHO) 세포 K2 18 인간 hepatocyes 19,20 및 상피 세포 라인 (21)을 포함했다. 물방울이 고립되어있는 동물 조직 마우스 골격근 22 일 간 (23) 및 유 방 땀 샘 (23)를 포함했다. 전술 한 바와 같이, 대부분의 액적 분리 연구의 목표는 결합 계수 및 중립 및 인지질에 lipidomic 분석 프로테옴 분석을 수행하는 것이다.
중성 지질시기 - 지질 방울의 대부분의 수많은 구성 요소 - 대부분의 다른 세포 물질보다 밀도이며, 액적 분리 전통적 밀도 구배 원심 분리를 사용하여 수행되었다. 그 기술은 여기에 제시된 두 수험 공부의 중심이다. 이전 기술 6,24은 배양 분열 효모 세포에서 물방울의 분리의 시각적 표현으로 결합 및 수정및 noncultured 인간의 세포는 태반 조직에서 얻을. 목표는 액적 분리를위한 시작점으로서이 크게 다른 세포 유형을 선택하여이 기술의 광범위한 응용을 보여주는 것이다. 이 기술은 대부분의 생물에서 물방울을 분리하고자하는 사람들에게 유용하게 쓰일 수있을 것이다.
프로토콜 하나는 진핵 세포 분열 (25) 중에 액적 형성을 관찰하기위한 모델로서 이용되어왔다 분열 효모 Schizosaccharomyces 용의 pombe로부터 지질 방울의 분리를 설명한다. 신진 효모 사카로 마이 세스 세레 비시 애 지질 방울 생물학 연구의 모델 생물로 광범위하게 사용되어왔다. 프로토콜 1 생물과 준비의 차이 모두에 적용이 강조된다.
프로토콜 2는 인간의 장기 태반에서 얻을 수 차례에 태반 융모 세포에서 지질 방울의 분리에 대해 설명합니다.용어 태반의 수집은 안전하고 윤리적으로 지질 방울의 상당한 숫자가 포함 쉽게 사용할 수 인체 조직 26, 200-250 g을 수득 할 수있는 독특한 기회를 제공합니다. 이것은 물방울이 배양 된 세포에서 발생한 높은 진핵 가장 지질 액적 분리 작업 대조적이다. 그 연구에서, 지방산은 종종 중성 지질 따라서 방울의 성장의 합성을 촉진하는 문화에 추가됩니다. 이 지질 방울는 태반 조직의 기본 조건이 형성되어 여기에 작업 대조적이다.
지질 방울 분획의 순도는 소기관 마커 항체를 사용하여 웨스턴 블롯 분석에 의해 결정된다. 이 두 프로토콜은 다음, 프로테옴 lipidomic 분석에 적합한 지질 방울 분수를 얻을 것입니다.
프로토콜
1. (분열) 효모 세포에서 지질 방울을 분리
효모 사카로 마이 세스 세레 비시 애의 신진 인기 모델 생물에서 물방울의 분리는 다음 프로토콜 6과 거의 동일합니다. 준비의 차이가 설명되어 있습니다.
1. 성장 효모 세포
- 미디어를 준비합니다. 유리 병 또는 배양 플라스크에 dH보다 2 O 리터당 YE5S 분말 36g을 결합합니다. 미디어의 약 2 L이 필요합니다. 20 분 동안 121 ° C에서 미디어를 압력솥. 미디어가 실내 온도까지 냉각 할 수 있습니다. S.에 대한 사카로 마이 세스 세레 비시 애는 YPD와 YE5S를 교체합니다.
- 무균 기술을 사용하여 250 ㎖의 배양 플라스크에 냉각 YE5S 미디어의 10 ~ 20 ㎖를 놓습니다. 멸균 나무 막대기를 사용하거나 동등한 한천 플레이트에서 효모 세포의 소량의 매체를 접종한다. 세포가 30 ℃에서 원하는 광학 밀도로 성장하자 에서 광학 밀도를 측정분광 광도계를 사용하여 595 ㎚의 파장.
- 2.8 L 플라스크에 남아있는 용지를 넣습니다. 진탕 배양기에서 세포 성장하는 동안 적절한 혼합을 보장하기 위해 미디어 2.8 L 당 플라스크의 1 더 이상으로보다 L을 사용합니다. 젖은 세포의 최종 수율은 프로테옴 lipidomic 분석을 위해 충분한 지질 방울을 취득 할 수 있도록 약 10 g으로한다.
- 각 단계 1.1으로 제조 하였다 미디어 1 L를 갖는 2.8 L 플라스크에 1.2 단계에서 세포를 소개합니다.
- 30 ° C에서 원하는 농도로 세포를 성장
- 세포가 지질 방울을 가지고 있는지 확인합니다. 세포의 준비 1 ㎖. 샘플의 광학 밀도 (OD)를 측정한다. 샘플 세포의 OD 당 에탄올에 BODIPY 503분의 493의 100 ㎜ 주식의 0.1 ML을 추가합니다. 유리 슬라이드와 유리 커버 슬립 사이의 샘플 3 μL를 놓습니다. GFP 필터 (그림 1A)과 형광 현미경으로 시각화.
- 4 & #에서 단계 1.5에서 세포 펠렛176, C 10 분 동안 3,800 XG에. 원심 분리기 튜브의 용량에 따라 일괄 적으로 작동한다.
- YE5S 미디어를 붓고 소르비톨 EMM + 600 mm의 버퍼로 세포를 씻어. 소르비톨은 삼투 지원을 제공합니다.
- 멸균 50 ML의 원심 분리기 튜브에 세포를 전송하고 10 분 동안 2,000 XG에서 4 ° C에서 세포 펠렛. 뜨는을 제거합니다. 젖은 세포를 무게. 셀 그램 당 (EMM + 600 mM의 소르비톨) 버퍼의 2 ml의 세포를 Resuspend.
2. spheroplasts 이후의 용해에 분열 효모 세포를 변환
- ) 효모 세포 용해 효소를 5 mg의 1을 각각 추가, 2) 효모 트리코더마 harzianum 그램 당 단계 1.9에 무게했다 젖은 세포에서 효소를 용균. S.에 대한 사카로 마이 세스 세레 비시 애는 Zymolyase 같은 양의 효소를 증가.
- 60 분 동안 100 rpm으로 흔들어 부드러운에서 30 ° C에서 세포를 품어.
- spheroplasts 지질 박사가 있는지 확인하십시오oplets. 단계 1.6 (그림 1B)를 반복하여.
3. 밀도 구배 원심 분리
- 5 분 2,000 XG에서 4 ° C에서 원심 분리하여 spheroplasts 펠렛.
- 조심스럽게 플라스틱 전송 피펫을 사용하여 상층 액을 제거합니다.
- 조심스럽게 얼음 차가운 10 mM 트리스 - 염산, 소르비톨 600 ㎜, 200 μM EDTA와 펠렛 spheroplasts을 재현 탁. spheroplasts 매우 깨지기 있음을 알아 두셔야합니다.
- 3.1 단계에서와 동일한 설정을 사용하여 다시 spheroplasts 펠렛. 조심스럽게 상층 액을 제거하고 2 ㎖ / g-세포의 농도로 12 % 피콜있는 플라스틱 전송 피펫, 10 mM 트리스 - 염산, 200 μM EDTA를 사용 spheroplasts를 재현 탁.
- 유리 균질에 재현 탁 spheroplasts를 전송하고 부드럽게 유리 균질의 느슨한 피팅 유 봉, 얼음에 20 ~ 30 스트로크를 균질화.
- 원심 분리기 튜브에 용해 spheroplasts를 전송하고 같은 할머니와 오버레이12 % 피콜, 10 mM 트리스 - 염산, 및 200 μM의 EDTA 완충액 LUME. 각각의 관은 3 분의 2 가득 차있는 것을 사용하는 원심 분리기 튜브의 수를 선택합니다.
- SW28 로터 또는 이에 상응하는 1.5 시간 동안 10 만 XG에 4 ° C에서 원심 분리기. 정지 (로터 감속 = 0)에 해안에 회 전자를 허용합니다.
- 부드럽게 피펫 또는 구부러진 파스퇴르 피펫을 사용하여 새로운 원심 분리 관 (들)에 방울을 포함하는 상위 떠있는 하얀 층 (그림 2A)를, 전송할 수 있습니다. 이 원심 관의 약 3 분의 1을 채우도록 시료에 충분한 12 % 피콜 부피, 10 mM 트리스 - 염산, 및 200 μM의 EDTA 버퍼를 추가.
- 새로운 원심 분리 관 (들)의 샘플 (들)의 상단에 해당하는 8 % 피콜의 양, 10 MM 트리스 - 염산, 200 μM의 EDTA 버퍼를 추가합니다. 이 첨가 후, 튜브는 전체 3 분의 2이어야 버퍼.
- SW28 로터 또는 동급에서 1 시간 동안 10 만 XG에 4 ° C에서 원심 분리기. 정지 해안에 회 전자를 허용 (ROTOR 감속 = 0).
- 부드럽게 피펫 또는 구부러진 파스퇴르 피펫을 사용하여 새로운 원심 분리 관 (들)에 방울을 포함 할 최고 떠있는 하얀 층 (그림 2B)를 전송합니다. 이 원심 관의 약 3 분의 1을 채우도록 샘플, 소르비톨 8 % 피콜, 10 mM 트리스 - 염산, 및 200 μM의 EDTA 완충액을 600 mM의 추가.
- 새로운 원심 분리 관 (들)의 샘플 (들)의 정상에, 소르비톨 10 MM 트리스 - 염산을 250 ㎜의 동등한 볼륨을 추가, 200 μM의 EDTA 버퍼. 이 첨가 후, 튜브는 전체 3 분의 2이어야 버퍼.
- SW28 로터 또는 동급에서 1 시간 동안 10 만 XG에 4 ° C에서 원심 분리기. 정지 (로터 감속 = 0)에 해안에 회 전자를 허용합니다.
- 투석 튜브에 만 지질 방울과 결합 단백질을 포함하고 피콜을 제거하기 위해 10 mM 트리스 - 염산과 200 μM EDTA 버퍼에 O / N을 dialyze한다 최고 백색 층 (그림 2C)를 전송합니다.
태반은 싱글 임신 전에 용어의 자발적인 노동의 발병에 선택적 제왕 절개 배달을 겪고있는 건강한 여성에서 수집되었다. 주제는 태반의 수집에 대한 서면 동의서를 주었다. 태반의 수집 및 후속 사용은 녹스빌 기관 검토위원회의 테네시 의학 테네시 대학 대학원 대학 (각각 # 1 8757B 및 # 3338)에서 승인을 수행 하였다.
1. 인간의 태반 융모 세포를 분리
프로토콜의 1 부 Petroff 등. (26)에 의해 이전에 발표 된 프로토콜의 변형입니다
솔루션 다음과 같은 준비
- 염화나트륨 (1 L) : 1 L 용액을 수득 dH보다 2 O에 9g의 NaCl (M 58.4 g / 몰)을 용해. 소독 필터 (0.2; μm의 막).
- 배 행크의 균형 소금 솔루션 (10X HBSS) (1 L) : 4g의 KCl (M 74.5 g / 몰), 0.6 g의 KH 2 PO 4 (M 136.086 g / 몰), 80g의 NaCl (M 58.44 g / 몰) 10g의 D-글루코오스 (M 180.16 g / mol)의 2 HPO 4 (M 141.96 g / mol)의 NA. 1 L 용액을 수득 dH보다 2 O에서 각각의 성분을 용해. 소독 필터 (0.2 ㎛ 멤브레인).
- 효소 소화 버퍼 (0.6 ㎖) : 3.3 ml의 7.5 % 나 Biscarbonate, 17.5 ㎖의 1 M HEPES 및 266.1 ㎖의 dH보다 2 O와 70 ㎖의 10 배 HBSS를 결합, 소독 필터 (0.2 ㎛의 막). 4 ℃에서 보관
- DNA 분해 효소 I : 그냥 사용하기 전에, DNA 분해 효소의 유리 병에 5 ㎖ 멸균 0.9 %의 NaCl을 추가합니다. -20 ° C에서 사용하거나 보관 할 때까지 얼음에 보관
- 해부를위한 준비 태반
- 인간 태반 가능한 배달 시간에 가까운 과정을 구합니다. 이러한 태반을 수송하는 쿨러로 밀폐 용기를 사용합니다. 때 손을 항상주의하십시오링 인간의 생물학적 물질.
- 생물학적 안전 후드에서 멸균 고압 증기 멸균 용기에 태반을 전송하고, 신중하게 멸균 0.9 % 염화나트륨 (염분) 용액을 이용하여 태반과 세포막에서 혈액을 씻어. 액체 생물학적 폐기물로 1 L 비이커에 피 묻은 염분을 폐기하십시오.
- 부드러운면이 위를 향하고 탯줄 베어링과, 무균 영역에서 태반을 놓습니다. 샤프, 미세 포인트 가위와 집게로 태아 막 탯줄을 제거합니다.
- 산모의 표면 (거친 표면)이 위로 오도록 태반을 뒤집습니다. 위에 놓인 기초 판의 조직, 표면으로부터 약 3mm를 제거합니다.
- 태반을 해부
- 융모 판을 피하고 한 번에 하나의 떡잎을 해부하다. 식염수 250 ㎖의 비이커에 융모 조직을 수집합니다.
- 액체 폐기물의 1 L 비이커를 사용하여 집게로 소용돌이 치는 0.9 % NaCl로 별도의 비커에 조직을 여러 번 씻어.
- 150mm 배양 접시에 한 번에 한 자엽을 전송. 집게로 잡고 페트리 접시에 배에서 면도날로 조직을 다 쳤어요. 0.9 %의 NaCl을 포함하는 별도의 비커에 스크랩 한 조직을 놓습니다. 모든 조직의 조각에 대해 반복합니다.
- 세포 분리 체에 조직의 작은 부분을 전송하고 용출액이 명확해질 때까지 광범위하게 0.9 % NaCl로 씻어냅니다. 모든 조직에 대해이 단계를 반복합니다.
- 세포 분리 체에 스크랩 한 조직을 세척 한 후 물기와 무게를 배수.
이 시점에서 조직을 DMEM에서 4 ° C에서 멸균 삼각 플라스크에 O / N을 저장 될 수있다.
- 태반 조직의 효소 소화
- 데워진 효소 희석액 100 ㎖, 1 ㎖ DNase의 I 및 20 ㎖의 2.5 % 트립신 10X : 티슈 소화 혼합물을 제조한다.
- 500 ㎖ 멸균 삼각 플라스크에 총 수집 된 조직 (일반적으로 250-300 g)를에서 60g을 전송, 조직을 나눈다. 조직을 포함하는 삼각 플라스크에 조직 소화 혼합물을 추가하고 150 rpm에서 45 분 동안 진탕에서 37 ° C에서 알을 품다.
- 해리 세포를 수집
- 조직이 정착 될 때까지 처음 45 분 해리 후, 경사에서 소화 플라스크를 설정합니다.
- 해리되지 않은 조직을 수집하지 않도록주의하면서 상층 액을 수집합니다. 수집 된 상층 액에 HBSS의 동일한 금액을 추가하고 멸균 15 ML의 원심 분리기 튜브로 전송할 수 있습니다. 해리되지 않은 조직의 추가 부분과, 해리되지 않은 조직과 단계 3.2부터 절차를 반복합니다.
- 15 분 1,000 XG에서 4 ° C에서 균질를 원심 분리기.
- 각 배치의 경우, 원심 분리 다음, 펠렛을 방해하지 않고 뜨는을 대기음. 태반 융모 세포는 적혈구를 덮는, 펠릿의 흰 부분에 우세하다.
- 세인트 융모 세포 (펠렛의 흰색 부분)로 이동50 ㎖에게 원뿔 원심 분리 관을 erile 얼음 계속.
- 세 소화 단계에서 세포를 수집 한 후, 멸균 50 ㎖ 원추형 원심 분리 관의 상단에 삽입 100 μM 나일론 세포 여과기를 이용하여 현탁액을 고를. 세포 현탁액의 여과 속도가 느려 경우, 튜브 내에서 진공을 그립니다 필터를 위로 들어 올립니다.
- 10 분 1,000 XG에 4 ° C에서 원심 분리기. 조심스럽게 펠렛을 방해하지 않고 뜨는을 제거합니다.
2. 태반 융모 세포를 균질화
- 분리 과정을 시작하기 전에, 20 MM 트리스 - 염산, 산도 7.4, 1 mM의 EDTA를 포함 저장성 용해 중간 (HLM) 50 ㎖를 준비합니다. 사용 직전에 HLM에 단백질 분해 효소 억제제를 추가하고 얼음에 매체를 유지합니다.
- 생물학적 안전 후드에서, 세포에 빙냉 HLM의 4 배 세포 펠렛 부피를 추가한다. 부드럽게하고 철저하게 세포를 피펫 팅하여 세포를 재현 탁 업10 ㎖ 피펫을 사용하여 D 다운.
- 10 분 동안 얼음에 일시 중단 된 세포를 품어.
- 얼음에 있어야 다운스 균질에 세포를 전송합니다. 천천히 균질의 헐렁한와 유 봉, 20-25 부드러운 스트로크를 적용하여 세포를 균질화.
- 원심 분리기는 10 분 동안 3,000 XG에 4 ° C에서 세포 용 해물은 손상되지 않은 세포, 세포 파편과 핵을 제거합니다.
- 상층 액을 수집하고 SW28 튜브 (25,000 XG에서 원심 분리 할 수있는 대안)에 전송할 수 있습니다. 미토콘드리아를 제거하는 20 분 동안 25,000 XG에 4 ° C에서 원심 분리기.
3. 초 원심 분리에 의해 지질 방울을 분리
- 50 100 밀리미터 탄산나트륨 (M 106g / 몰) 완충액 (pH 11.5)의 ㎖ 및 50 ㎖의 60 % 자당 (W / W) 솔루션을 준비합니다. 사용 직전에 탄산나트륨 버퍼에 프로테아제 억제제를 추가하고 얼음에 보관.
- 조정, 50 ㎖ 원심 관에 단계 2.6에서 뜨는 수집SW28 로터 또는 이와 동등한에 대한 초 원심 분리기 튜브의 바닥에 자당 및 전송의 20 %. ~ 빙냉 100 mM의 탄산나트륨 완충액 (pH 11.5) 10 ㎖ 및 튜브를 채우기 위해 빙냉 HLM의 0.5-1 ml의 오버레이와 밀도를 조정 상등액.
- SW28 스윙 버킷 로터를 사용하여 45 분 동안 130,000 XG에 4 ° C에서 원심 분리기. 정지 (로터 감속 = 0)에 해안에 회 전자를 허용합니다.
- 10 % 자당에 조정 SW41Ti 로터, 또는 동등의 13.2 ML 초 원심 분리기 튜브의 바닥으로 전송, 부동 층을 수집합니다. 오버레이 밀도 약 5 빙냉 100 mM의 탄산나트륨 완충액 (pH 11.5) ml의 빙냉 HLM 0.5 ml의 상등액을 조정.
- SW41Ti 스윙 버킷 로터를 사용하여 60 분 동안 274,000 XG에 4 ° C에서 원심 분리기. (로터 감속 = 0) 지질 방울 층의 혼란을 최소화하기 위해 정지 해안에 회 전자를 허용합니다.
- 조심스럽게 들어있는 최고 부유 계층 (그림 2D)를 수집1 ㎖ 피펫 단계를 반복 3.4과 지질 방울.
- SW41Ti 스윙 버킷 로터를 사용하여 30 분 동안 274,000 XG에 4 ° C에서 원심 분리기. 정지 (로터 감속 = 0)에 해안에 회 전자를 허용합니다.
- 조심스럽게 100 μL의 HLM을 포함하는 세 1.5 ML 튜브에 구부러진 파스퇴르 피펫과 지질 방울을 포함하는 상위의 흰색 부동 층을 수집합니다.
특성화 지질 방울 분획 (프로토콜 1, 2)
지질 방울 부분의 복구 및 순도는 빛이나 전자 현미경과 함께 서양의 얼룩에 의해 확인 될 수있다. 또 다른 원심 분리 단계 후에 분액 수집 될 수 있고, 정화 효율을 결정하기 위해 유지. 웨스턴 블 롯팅에서, t에 다른 막 분획에 지질 방울을 비교보다는 전체 세포 용 해물의 등가를 나타내는 지질 액적 분획의 양을 비교하는 것이 더 적절하다총 단백질 함량의 24 그는 기초.
결과
예상대로 밀도 구배 원심 분리에 근무하는 경우, 부동 층은 지질 방울을 포함해야하고, 고속 스핀의 진행 내내 다른 소기관 고갈 될.
프로토콜 1의 경우, 웨스턴 블롯 마커 지질 방울 (Erg6p)에 대한 항체, 효모, ER (Dpm1p), 미토콘드리아 (Por1p)의 지질 방울과 상호 작용하는 것으로 밝혀졌다 세포 기관으로 수행하고, 세포막 (Pma1p), 및 액포 (Vma1p).
각 3 스핀의 부동 층 (단계 3.7, 3.10, 3.13)가 수집 된 같은 부피는, 트리클로로 아세트산 (15 % 최종 농도)로 침전, 물에 용해. 13 세포 용 해물의 ML (도 3a, "리스")와 각 3 돕니 단백질 프렙 (도 3a, "Spin1", "Spin2"및 "Spin3")은 니트로 셀룰로오스로 전달, 12 % SDS-PAGE에서 분리 하였다 멤브레인 및 세포 기관의 시험편에 immunoblottedFIC 항체. 예상했던대로, 지질 방울 마커 단백질 Erg6p 세 스핀 (그림 3A)의 각 후 부동 층에 존재하는, Por1p (그림 3A) Spin1 후 부동 층에 존재하지 않는, Vma1p는 Spin2 후 부동 층에서 소진 (그림 3A)과 Dpm1p 및 Pma1p는 Spin3 (그림 3A) 후 부동 층에 존재하지 않습니다.
이 프로토콜의 경우, 사람의 용어 태반 융모 세포로부터 단리 지질 소적의 존재는 중성 지질 특정 형광 염료, BODIPY 503분의 493으로 염색하여 확인 하였다. 소적이어서 형광 현미경 (도 3b) 하에서 가시화 하였다. 고립 된 지질 방울 분수의 순도는 지질 (2 perilipin) 방울, ER (calnexin), 골지체 (GM130), 미토콘드리아 (COX IV)와 세포막 (MEK1) (그림 3C)에 대한 마커 단백질과 웨스턴 블로 팅에 의해 평가 하였다. 지질 박사oplets 차가운 아세톤으로 해제 lipidated하고, 단백질을 추출 하였다. 포스트 핵 상층 액 (PNS)의 동등한 비율, 마지막 스핀의 부동 층 (그림 3C에 단계 3.6, "Spin4") 아래의 부분, 이후의 세척 단계 (단계 3.8, "Spin5"그림 3C)에, 그리고 부동 지질 방울 층 (단계 3.8, 그림 3C에 "LD")의 드 lipidated 단백질 준비, 12 % SDS-PAGE에서 분리 전송 및 표시 항체 immunoblotted했다. (또한 ADRP라고도 함) Perilipin 2는 지질 액적 단백질은, 포스트 - 핵 상등액에서 지질 소적을 함유하는 격리 된 흰색 부동 층에서 발견되었다. 세포막 (MEK1)에 대한 구체적이고 골지 (GM130) 단백질은 Spin4 및 Spin5의 부동 층 아래에 두 층의 지질 방울 분수에서 검출되지 않았다. 이전에보고 된 바와 같이, ER 단백질 calnexin 18,27,28과 미토콘드리아 막 단백질 COX IV의 약한 염색 dete되었습니다지질 방울 분획 (22)의 다른 cted. 이러한 결과는 지질 방울은 포유 동물 세포 (29)와 ER (30, 31)과 미토콘드리아와 상호 작용을 보여주는 이전 보고서와 일치한다.
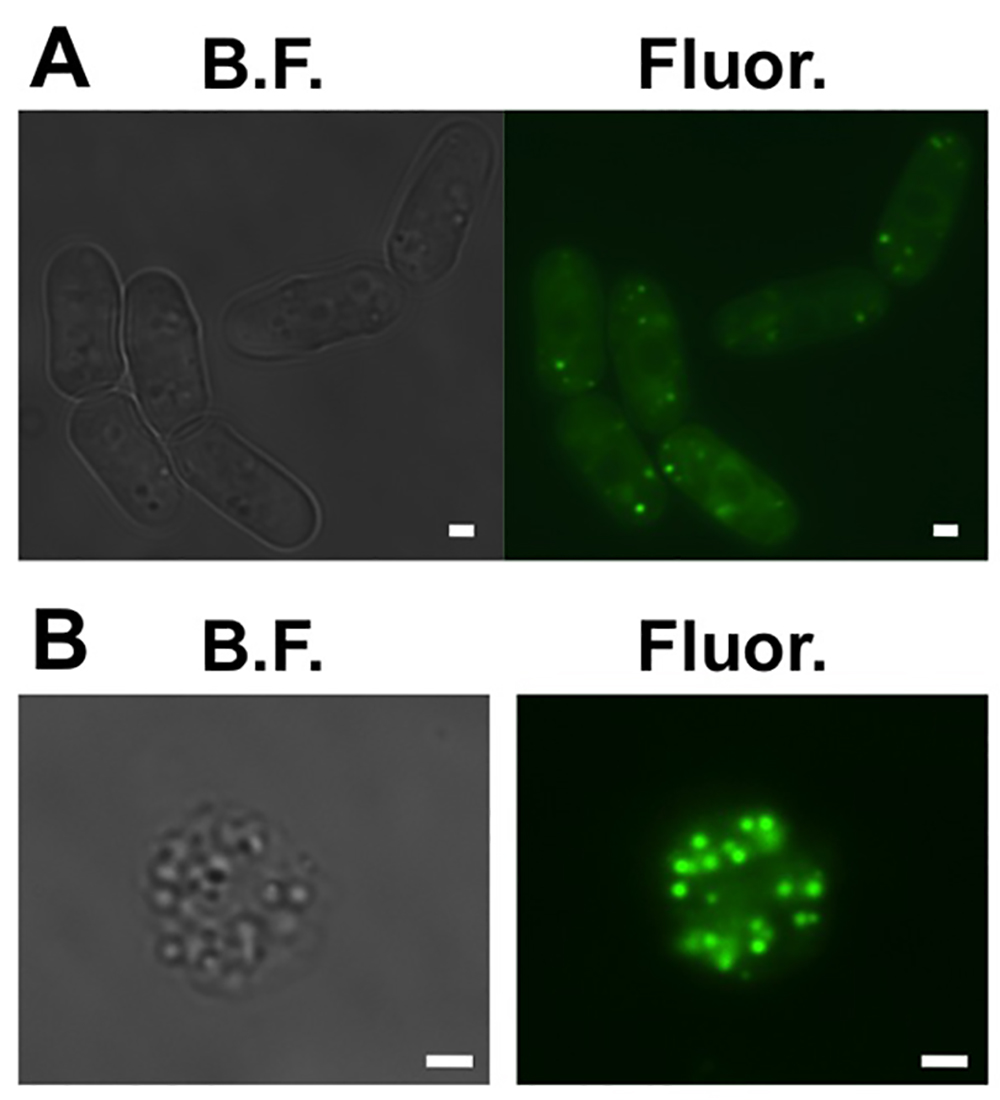
그림 1. 분열 효모 세포에서 세포의 지질 방울. (A) 시야 (BF)와 폭 넓은 분야의 형광 지질 방울을 BODIPY 503분의 493 염색 여섯 대표 분열 효모 세포의 (Fluor.) 이미지. (B) 시야 (BF )와 폭 넓은 분야의 형광 지질 방울을 BODIPY 503분의 493으로 염색 대표 스페의 (Fluor.) 이미지. 스케일 바는 1mm입니다. 큰 버전의 O를 보려면 여기를 클릭하세요F이 그림.

그림 2. 밀도 구배 원심 분리 후 부동 층. 후 원심 분리기 튜브 (A) Spin1 (단계 3.8), (B) Spin2 (단계 3.11), 및 프로토콜 1 (C) Spin3 (단계 3.14). (D) 원심 분리기 튜브 후 프로토콜 2 Spin4 (단계 3.6). 지질 방울을 함유 부동 층은 화살표로 표시된다.

그림 3. 고립 된 지질 방울의 순도 분석. 프로토콜 1의 주요 단계 (A) 서부 말입니다. 각 단백질의 준비 (Spin1 같은 부피 - 단계 3.7, Spin2은 - 3.10 단계, 및 SPI N3 - 단계 3.13)가) 니트로 셀룰로오스 막에 전송, SDS-PAGE로 분리하고, Erg6p (LD, 지질 방울에 대한 항체와 immunoblotted했다 Dpm1p (ER), Por1p (MT, 미토콘드리아), Pma1p (PM, 세포막), 및 Vma1p (액포). (B) 위상 대비 (PC)와 폭 넓은 분야의 형광 인간의 태반 융모 세포에서 분리 된 BODIPY 493/503-stained 지질 방울의 (Fluor.) 이미지. (C) 주요 단계의 웨스턴 오 프로토콜 2. 등 비율 PF PNS (포스트 핵 상층 액), 마지막 스핀 (Spin4 - 단계 3.6) 이후 부동 층 아래 뜨는 이후의 세척 (Spin5 - 단계 3.8), 부동 층 (LD)가에 전송, SDS-PAGE로 분리 막과 2 (LD, 지질 방울을) perilipin에 대한 항체로 immunoblotted, calnexin (ER), GM130 (골지 매트릭스 단백질, 골지), COX IV (시토크롬 C 산화 효소, MT, 미토콘드리아) 및 MEK1 (MAPK 키나아제, PM, 플라즈마 막).ad/50981/50981fig3highres.jpg "대상 ="_blank ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜 내에서 중요한 단계
배양 세포의 성장하는 동안 미디어 및 세포 밀도와 일치해야합니다. 세포 지질 방울들이 관련된 단백질이 세포가 배양 된 17되는 환경에 크게 의존한다는 점에서 독특합니다. 따라서, 세포가 성장되어있는 미디어와 세포의 밀도는 밀접 용해 전에 모니터링해야한다.
지질 방울의 단백질 조성물은 효모 세포의 성장 단계의 함수이다. 간단히 단백질 정지상 대 로그 성장 단계에서 방울에 결합 될 것이다. 또한, 효율 spheroplasting 것은 효모 세포의 성장 단계의 함수이다. 후자는 효소 치료에 저항하기 때문에 로그 성장 단계에있는 세포는 정지 단계에서 세포보다 spheroplasts의 높은 수율을해야합니다.
십t ">세포. 소화 효소에 의해 효모 세포벽을 분해 기술이 적용 힘을 통해 세포벽을 파열 기술을 선호하는 개방 휴식 부드러운 기술을 사용해야합니다. 후자의 방법은 결합 단백질이나 지질의 손실의 결과 방울의 구조적 완전성을 방해있다.
이 결합 된 단백질이나 지질의 손실의 결과로 자신의 구조적 무결성에 영향을 미칠 수 있기 때문에 세포가 용해 된 후 샘플을 동결하지 마십시오. 냉동 방울 사용하지 않는 것이 좋습니다. 냉동은 또한 물방울 24 융합 또는 조각하는 원인이 될 수 있습니다. 물방울이 가능 작은 것들에 파편이 나 받아야 분열을 살아있는 효모 세포 (25)에 따라서 큰 물방울의 고장 관찰 되었기 때문에 특히 관련이있을 수 있습니다. 조각은 F로 표시하는 부력이되지 않을 수 방울의 조각밀도 기울기 원심 분리 동안 loating 층. 이는 인공적 액적 표면 단백질 조성물이 액적 크기 (32)의 함수가 될 수 있기 때문에이 기술에 의해 식별 될 액적 요소의 수를 줄일 수있다.
지질 방울에 지질 방울 관련 요인의 지역화를 테스트해야합니다. 지질 방울의 특성 중 하나는 다른 세포 소기관 33-37과 상호 작용하는 것입니다. 따라서 이러한 소기관에서 인자는 종종 지질 액적 분획에서 발견된다. 따라서, 이들 요인이 소적으로 집중되도록하여 추가적인 기술을 사용하는 것이 중요하다. 지질 방울은 상이한 형광 마커로 더러워 세포에서 그 단백질에 연결된 형광 융합 단백질 연구 colocalization을 (15)의 범위를 결정하기 위해 사용되어야한다. 단백질 상관 같은 기술 PRofiling 더욱 지질 액적 분획 (15)의 순도를 정량화하는데 사용될 수있다. 그 전략에는 두 개의 구성 요소가 각기 다른 동위 원소를 함유 아미노산으로 표시됩니다. 첫 번째 구성 요소는 공지 된 지질 액적 요소이며, 제 2 성분 분석되는 분획이다. 비교는 다음 두 개의 구성 요소의 소수 위치 사이에서 이루어진다.
수정 및 문제 해결
신진 효모 사카로 마이 세스 세레 비시에서의 지질 방울을 분리하는 프로토콜 1의 수정이 설명되어 있습니다. 지질 방울의 크기가 크게 다를 수 있습니다. 밀도 기울기 원심 분리 속도는 부동 층에 축적하는 작은 물방울 증가해야 할 수 있습니다.
기술의 한계
로와 초 원심 분리기에 대한 액세스버킷 로터를 공중을하는 셀룰러 지질 방울의 분리를 위해 필수적이다. 장비의이 조각은 대부분의 세포 생물학 및 생화학 실험실에서 표준이지만, 그것은 비싸다.
기존의 방법 또는 기타 다른 방법에 대하여 기술의 중요성
위에서 언급 한 바와 같이, 프로토콜 1 밀접 LEBER 등. 6 프로토콜 2의 1 부 Petroff 등. (26)에 의해 이전에 발표 된 프로토콜의 변형이다의 작업을 기반으로합니다
응용 프로그램
지질 방울 격리 결합 단백질, 중성 지질 및 인지질의 후속 프로테옴 lipidomic 분석을 위해 가장 유용합니다. 지질 방울 관련된 단백질과 지질의 재고는 4,6-17,19,20,22,23,28를 컴파일 된.
공개
저자는 더 경쟁 재정적 이익을 선언하지 않습니다.
감사의 말
이 작품은 PD에 PD로 미국 심장 협회 (American Heart Association) 상 13SDG14500046, 지속 가능한 에너지 교육 및 연구 센터 상 (테네시 Univ.의)에 의해 지원되며, JM에 대한 의사의 의학 교육 및 연구 재단 (테네시 Univ.의)에 의해 수상했다 그의 떨고 인큐베이터, 탁상 원심 분리기, 웨스턴 블롯 분석 장비의 사용 에릭 T. Boder (테네시 Univ.의), 저자는 spheroplasts에 분열 효모를 변환하는 프로토콜 캐롤라인 Leplante (. 예일 대학교를) 감사를위한 센터 자신의 초 원심 분리기의 사용 환경 생명 공학 명 (대학 테네시), 효모 항체 귄터 다음 세대 (그라츠 대학 기술, 오스트리아.) 기술 지원 산부인과 명 (대학 테네시 의료 센터)의 부서의 직원 .
자료
| Name | Company | Catalog Number | Comments |
| PROTOCOL #1: | |||
| 1.Growing yeast cells and converting to spheroplasts | |||
| Edinburgh Minimal Media (EMM) | Sunrise Science Products | 2005 | |
| Yeast extract with 5 supplements (YE5S) | Sunrise Science Products | 2011 | YE5S media with 225 mg/ml of each supplement: adeninie, histidine, leucine, lysine, uracil. The equivalent for budding yeast would be YPD. |
| YPD powder | Sunrise Science Products | 1875 | For S. cerevisiae |
| Sorbitol | Fisher Scientific | BP439 | |
| Yeast Lytic Enzyme | MP Biomedicals | 215352610 | |
| Lysing Enzymes from Trichoderma harzianum | Sigma-Aldrich | L1412 | |
| Zymolayse-20T | Sunrise Science Products | N0766391 | For S. cerevisiae |
| BODIPY 493/503 | Invitrogen | D-3922 | |
| Microscope Slides | Fisher Scientific | 12-544-7 | |
| Microscope Cover Glass | Fisher Scientific | 12-542-B | |
| Plastic transfer pipette | Fisher Scientific | 137115AM | |
| 1 liter glass bottle | |||
| 250 ml flask | |||
| 2.8 liter flasks | |||
| 2. Yeast lipid droplet isolation | |||
| Tris-HCl | Fisher Scientific | BP153 | |
| EDTA | Fisher Scientific | BP120 | |
| Ficoll 400 | Fisher Scientific | BP525 | |
| 12-14k Spectra/Por Dialysis Membrane | SpectrumLabs | 132680 | |
| EDTA-free Protease Inhibitor Cocktail Tablets | Roche Diagnostics | 11873580001 | irritant |
| Dounce Homogenizer | Sigma-Aldrich | D9938 | |
| Ultracentrifuge Tubes 25x89mm (for SW28) | Beckman-Coulter | 355642 | |
| 12-14k Spectra/Por Dialysis Membrane | SpectrumLabs | 132680 | |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| Temperature-controlled shaker | New Brunswick Scientific | C25KC | |
| Thermo Sorvall Legend XTR centrifuge | Thermo-Scientific | 75004521 | |
| Swinging Bucket Centrifuge Rotor | Thermo-Scientific | 75003607 | |
| Fiberlite* F15-6x100y Fixed-Angle Rotor | Thermo-Scientific | 75003698 | |
| Ultracentrifuge LB-M | Beckman-Coulter | ||
| SW28 Ultracentrifuge Rotor | Beckman-Coulter | 342204 | |
| PROTOCOL #2 | |||
| 1. Placental villous cells isolation | |||
| Disposable underpads | Fisher Scientific | 23666062 | |
| Autoclavable pan (container), 3L | Fisher Scientific | 1336110 | |
| Fine scissors, sharp-sharp, straight | Fine science tools | 1406011 | |
| London Forceps | Fine science tools | 1108002 | |
| Dumont #7b Forceps | Fine science tools | 1127020 | |
| Razor blades | Fisher Scientific | S65921 | |
| Screen cup for CD-1 | Fisher Scientific | S1145 | |
| 40 mesh screen | Fisher Scientific | S0770 | |
| Fisherbrand cell stainers 100μm | Fisher Scientific | 22363549 | |
| 150 mm Petri Dishes | Fisher Scientific | NC9054771 | |
| NaCl | Fisher Scientific | S642 | |
| KCl | Fisher Scientific | P333 | |
| KH2PO4 | Fisher Scientific | P386 | |
| Na2HPO4 | Fisher Scientific | S374 | |
| D-glucose | Fisher Scientific | D16 | |
| HEPES | Fisher Scientific | BP310 | |
| 2.5% trypsin 10x | Invitrogen | 15090046 | |
| DNase I grade II, from bovine pancreas | Roche Applied Science | 10104159001 | |
| Sodium bicarbonate solution | Sigma-aldrich | S8761 | |
| 500 ml Erlenmeyer flasks | |||
| 250 ml beakers | |||
| 15 ml centrifuge tubes | |||
| 10 ml serological pipettes | |||
| 50 ml centrifuge tubes | |||
| DMEM | Invitrogen | 11965084 | |
| 2. Lipid droplets isolation from villous placental cells | |||
| Tris-HCl | Fisher Scientific | BP153 | |
| EDTA | Fisher Scientific | BP120 | |
| D-Sucrose | Fisher Scientific | BP220 | |
| Sodium Carbonate | Fisher Scientific | BP357 | |
| EDTA-free protease inhibitor cocktail tablets | Roche Diagnostics | 11873580001 | irritant |
| Dounce homogenizer | Sigma-Aldrich | D9938 | |
| Ultracentrifuge tubes 25x89mm (for SW28) | Beckman-Coulter | 355642 | |
| Ultra-Clear centrifuge tubes 14x89mm (for SW41) | Beckman-Coulter | 344059 | |
| Disposable borosilicate glass pasteur pipets | Fisher Scientific | 1367820C | |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| Biological safety hood | Thermo-Scientific | ||
| Waterbath | Fisher Scientific | ||
| Temperature-controlled shaker | New Brunswick Scientific | C25KC | |
| Thermo Sorvall Legend XTR centrifuge | Thermo-Scientific | 75004521 | |
| Swinging Bucket Centrifuge Rotor | Thermo-Scientific | 75003607 | |
| Ultracentrifuge LB-M | Beckman-Coulter | ||
| SW28 Ultracentrifuge Rotor | Beckman-Coulter | 342204 | |
| SW41 Ti Ultracentrifuge Rotor | Beckman-Coulter | 331336 | |
| Western blot | |||
| IRDye 680 Goat Anti-Rabbit IgG | LI-COR | 926-68071 | dilution 1:15000 |
| IRDye 800CW Goat Anti-Mouse IgG | LI-COR | 926-32210 | dilution 1:5000 |
| NuPAGE® Novex® 12% Bis-Tris gels | Invitrogen | NP0341 | |
| primary antibodies for PROTOCOL #1 | |||
| Erg6p | gift from Dr. G. Daum | Graz University of Technology, Austria | dilution 1:5000 |
| Dpm1p | Abcam | ab113686 | 4 μg/ml |
| Por1p | gift from Dr. G. Daum | Graz University of Technology, Austria | dilution 1:5000 |
| Pma1p | gift from Dr. G. Daum | Graz University of Technology, Austria | dilution 1:10000 |
| Vma1p (anti-ATP6V1A) | Abcam | ab113745 | 0.5 μg/ml |
| primary antibodies for PROTOCOL #2 | |||
| perilipin 2 (anti-ADFP) | Abcam | ab52355 | 2 μg/ml |
| calnexin | Cell Signaling technology | 2679 | dilution 1:1000 |
| GM130 | Biorbyt | orb40533 | dilution 1:25 |
| COX IV | Cell Signaling technology | 4850 | dilution 1:1000 |
| MEK1 | Biorbyt | orb38775 | dilution 1:50 |
참고문헌
- Ploegh, H. L. A lipid-based model for the creation of an escape hatch from the endoplasmic reticulum. Nature. 448, 435-438 (2007).
- Herker, E. Efficient hepatitis C virus particle formation requires diacylglycerol acyltransferase-1. Nat. Med. 16, 1295-1298 (2010).
- Ding, Y. F., et al. Isolating lipid droplets from multiple species. Nat. Protoc. 8, 43-51 (2013).
- Kalscheuer, R., et al. Preparative isolation of lipid inclusions from Rhodococcus opacus and Rhodococcus rubber and identification of granule-associated proteins. Arch. Microbiol. 177, 20-28 (2001).
- Low, K. L., et al. Lipid droplet-associated proteins are involved in the biosynthesis and hydrolysis of triacylglycerol in mycobacterium bovis bacillus calmette-guerin. J. Biol. Chem. 285, 21662-21670 (2010).
- Leber, R., Zinser, E., Zellnig, G., Paltauf, F., Daum, G. Characterization of lipid particles of the yeast, Saccharomyces cerevisiae. Yeast. 10, 1421-1428 (1994).
- Grillitsch, K., et al. Lipid particles/droplets of the yeast Saccharomyces cerevisiae revisitied: lipidome meets proteome. Biochim. Biophys. Acta. , 1165-1176 (2011).
- Binns, D., et al. An intimate collaboration between peroxisomes and lipid bodies. J. Cell Biol. 173, 719-731 (2006).
- Ivashov, V. A., et al. Lipidome and proteome of lipid droplets from the methylotropic yeast Pichia pastoris. Biochim. Biophys. Acta. 1831, 282-290 (2013).
- Connerth, M., Grillitsch, K., Kofeler, H., Daum, G. Analysis of lipid particles from yeast. Lipidomics: Vol. 1: Methods and Protocols. 579, 359-374 (2009).
- Wolinski, H., Kohlwein, S. D. Microscopic analysis of lipid droplet metabolism and dynamics in yeast. Methods Mol. Biol. 457, 151-163 (2008).
- Jolivet, P., et al. Protein composition of oil bodies in Arabidopsis thaliana ecotype WS. Plant Physiol. Biochem. 42, 501-509 (2004).
- Katavic, V., Agrawal, G. K., Hajduch, M., Harris, S. L., Thelen, J. J. Protein and lipid composition analysis of oil bodies from two Brassica napus cultivers. Proteomics. 6, 4586-4598 (2006).
- Zhang, P., et al. Proteomic study and marker protein identification of Caenorhabditis elegans lipid droplets. Mol. Cell. Proteomics. 11, 317-328 (2012).
- Krahmer, N., Hilger, M., Kory, N., Wilfling, F., Stoehr, G., Mann, M., Farese, R. V., Walther, T. C. Protein correlation profiles identify lipid droplet proteins with high confidence. Mol. Cell Proteomics. 12, 1115-1126 (2013).
- Cermelli, S., Gou, Y., Gross, S. P., Welte, M. A. The lipid-droplet proteome reveals that droplets are a protein-storage depot. Curr. Biol. 16, 1783-1795 (2006).
- Brasaemle, D. L., Dolios, G., Shapiro, L., Wang, R. Proteomic analysis of proteins associated with lipid droplets of basal and lipolytically stimulated 3T3-L1 adipocytes. J. Biol. Chem. 279, 46835-46842 (2004).
- Liu, P. S., Ying, Y. S., Zhao, Y. M., Mundy, D. I., Zhu, M. F., Anderson, R. G. W. Chinese hamster ovary K2 cell lipid droplets appear to be metabolic organelles involved in membrane traffic. J. Biol. Chem. 279, 3787-3792 (2004).
- Fujimoto, Y., et al. Identification of major proteins in the lipid droplet-enriched fraction isolated from the human hepatocyte cell line HuH7. Biochim. Biophys. Acta. , 47-59 (2004).
- Sato, S., et al. Proteomic profiling of lipid droplet proteins in hepatoma cell lines expressing hepatitis C virus core protein. J. Biochem. 139, 921-930 (2006).
- Umlauf, E., Csaszar, E., Moertelmaier, M., Schuetz, G. J., Parton, R. G., Prohaska, R. Association of stomatin with lipid bodies. J. Biol. Chem. 279, 23699-23709 (2004).
- Zhang, H. N., et al. Proteome of skeletal muscle lipid droplet reveals association with mitochondria and apolipoprotein A-I. J. Proteome Res. 10, 4757-4768 (2011).
- Wu, C. C., Howell, K. E., Neville, M. C., Yates, J. R., McManaman, J. L. Proteomics reveal a link between the endoplasmic reticulum and lipid secretory mechanisms in mammary epithelial cells. Electrophoresis. 21, 3470-3482 (2000).
- Brasaemle, D. L., Wolins, N. E. Isolation of lipid droplets from cells by density gradient centrifugation. Curr. Protoc. Cell Biol. , 3.15.1-3.15.12 (2005).
- Long, A. P., et al. Lipid droplet de novo formation and fission are linked to the cell cycle in fission yeast. Traffic. 13, 705-714 (2012).
- Petroff, M. G., Phillips, T. A., Ka, H., Pace, J. L., Hunt, J. S. Isolation and culture of term human trophoblast cells. Methods Mol. Med. 121, 203-217 (2006).
- Cho, S. Y., et al. Identification of mouse Prp19p as a lipid droplet-associated protein and its possible involvement in the biogenesis of lipid droplets. J. Biol. Chem. 282, 2456-2465 (2007).
- Ding, Y. B., Wu, Y. B., Zeng, R., Liao, K. Proteomic profiling of lipid droplet-associated proteins in primary adipocytes of normal and obese mouse. Biochim. Biophys. Acta. 44, 394-406 (2012).
- Jagerstrom, S., et al. Lipid droplets interact with mitochondria using SNAP23. Cell Biol. Int. 33, 934-940 (2009).
- Xu, N. Y., et al. The FATP1-DGAT2 complex facilitates lipid droplet expansion at the ER-lipid droplet interface. J. Cell Biol. 198, 895-911 (2012).
- Ozeki, S., Cheng, J. L., Tauchi-Sato, K., Hatano, N., Taniguchi, H., Fujimoto, T. Rab18 localizes to lipid droplets and induces their close apposition to the endoplasmic reticulum-derived membrane. J. Cell Sci. 118, 2601-2611 (2005).
- Yang, H. Y., Galea, A., Sytnyk, V., Crossley, M. Controlling the size of lipid droplets: lipid and protein factors. Curr. Opin. Cell Biol. 24, 509-516 (2012).
- Jacquier, N., Choudhary, V., Mari, M., Toulmay, A., Reggiori, F., Schneiter, R. Lipid droplets are functionally connected to the endoplasmic reticulum in Saccharomyces cerevisiae. J. Cell Sci. 124, 2424-2437 (2011).
- Pu, J., Ha, C. W., Zhang, S., Jung, J. P., Huh, W. K., Liu, P. Interactomic study on interaction between lipid droplets and mitochondria. Protein Cell. 2, 487-496 (2011).
- Shaw, C. S., Jones, D. A., Wagemakers, A. J. M. Network distribution of mitochondria and lipid droplets in human muscle fibres. Histochem. Cell Biol. 129, 65-72 (2008).
- Goodman, J. M. The gregarious lipid droplet. J. Biol. Chem. 283, 28005-28009 (2008).
- Brasaemle, D. L., Wolins, N. E. Packaging of fat: an evolving model of lipid droplet assembly and expansion. J. Biol. Chem. 287, 2273-2279 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유