Method Article
عزل الخلوية الدهون قطرات: اثنان تقنيات تنقية بدءا من خلايا الخميرة ومشيمة الآدمي
In This Article
Summary
اثنين من التقنيات لعزل قطرات الدهون الخلوية من 1) خلايا الخميرة و 2) يتم عرض مشيمة الآدمي. محور كل الإجراءات هو كثافة الطرد المركزي التدرج، حيث طبقة عائمة الناتجة تحتوي على قطرات يمكن تصور بسهولة بالعين، المستخرج، وكميا عن طريق تحليل لطخة غربية للنقاء.
Abstract
قطرات الدهون هي العضيات الحيوية التي يمكن العثور عليها في معظم الخلايا بدائية النواة حقيقية النواة وبعض. هيكليا، تتكون قطرات من مجموعة أساسية من الدهون محايدة محاطة أحادي الطبقة فوسفورية. كان واحدا من أكثر التقنيات المفيدة في تحديد أدوار الخلوية من قطرات تحديد البروتين من البروتينات ملزمة، والتي يمكن أن تكون معزولة جنبا إلى جنب مع قطرات. هنا، يتم وصف طريقتين لعزل قطرات الدهون والبروتينات الخاصة بهم المنضم من اثنين واسعة النطاق حقيقيات النوى: الخميرة الانشطار وخلايا المشيمة الزغابي الإنسان. على الرغم من كل التقنيات لديها خلافات، والأسلوب الرئيسي - يتم مشاركتها من قبل كل من الاستعدادات - التدرج الكثافة الطرد المركزي. وهذا يدل على تطبيق واسع من تقنيات العزل الحبرية المقدمة.
في البروتوكول الأول، يتم تحويل خلايا الخميرة في spheroplasts بواسطة الهضم الأنزيمي من جدران الخلايا الخاصة بهم. وspheroplasts الناتجة ثم يتم جنتلاي هي lysed في الخالط فضفاضة. يضاف إلى Ficoll المحللة لتوفير التدرج الكثافة، ويتم طرد الخليط ثلاث مرات. بعد تدور الأولى، يتم ترجمة قطرات الدهون إلى طبقة العائمة بيضاء اللون من أنابيب الطرد المركزي جنبا إلى جنب مع الشبكة الإندوبلازمية (ER)، غشاء البلازما، والفجوات. وتستخدم اثنين من يدور لاحقة لإزالة هذه العضيات الثلاثة الأخرى. والنتيجة هي الطبقة التي ليس لديها سوى قطرات والبروتينات ملزمة.
في البروتوكول الثاني، يتم عزل الخلايا المشيمة الزغابي من مشيمة الإنسان على المدى بواسطة الهضم الأنزيمي مع التربسين والدناز أولا والمتجانس الخلايا في الخالط فضفاضة. تستخدم السرعة المنخفضة والمتوسطة السرعة الطرد المركزي خطوات لإزالة الخلايا غير منقطعة، والحطام الخلوية، نوى، والميتوكوندريا. يضاف السكروز إلى جناسة لتوفير التدرج الكثافة ويتم طرد الخليط لفصل قطرات الدهون من cellula أخرىالكسور ص.
يتم تأكيد نقاء قطرات الدهون في كلا البروتوكولين من خلال تحليل لطخة غربية. الكسور قطرات من كلا محضرات هي مناسبة لاحقة تحليل البروتين وlipidomic.
Introduction
قطرات الدهون الخلوية هي العضيات الحيوية التي تخدم وظائف متعددة في الخلايا. فهي محاور لتخزين الدهون المحايدة، والتي يمكن تحويلها إلى طاقة أو تستخدم لتخليق فوسفورية. قطرات تلعب دورا محوريا في الظروف الفسيولوجية والمرضية بما في ذلك تصلب الشرايين، والسمنة والأمراض الاستقلابية ذات الصلة، وكذلك الأمراض المعدية 1،2. بالإضافة إلى ذلك، فهي مصادر فضول للوقود وقود الديزل الحيوي.
لقد تم الحصول على الكثير من المعلومات حول أدوار الخلوية من قطرات الدهون من تحليل البروتين وlipidomic من قطرات تنقيته من الكائنات الحية واسعة النطاق 3. وقد شملت هذه الكائنات البكتيريا 4،5، الخميرة 6-11، والنباتات 12،13 والديدان الخيطية 14، 15،16 والذباب. نظرا للاهتمام في دور قطرات الدهون في الأمراض الاستقلابية الإنسان، كما تم عزل قطرات من الخلايا الحيوانية مثقف ونيمال الأنسجة. وشملت خطوط خلايا مستنبتة الخلايا الشحمية 3T3-L1 17، الهامستر الصيني المبيض (شو) الخلايا K2 18، 19،20 hepatocyes الإنسان، وخطوط الخلايا الظهارية 21. وشملت الأنسجة الحيوانية التي تم عزلها قطرات الماوس الهيكل العظمي العضلات 22، 23 الكبد، والغدد الثديية 23. كما ذكر أعلاه، فإن الهدف من معظم الدراسات الحبرية العزلة هو إجراء تحليل البروتين على عوامل مقيدة وتحليل lipidomic على الحياد والدهون الفوسفاتية.
منذ الدهون محايدة - المكون الأكثر عددا من قطرات الدهون - أقل كثافة من معظم المواد الخلوية الأخرى، وقد جرت العادة على إجراء عزل قطرات باستخدام التدرج الكثافة الطرد المركزي. هذا الأسلوب هو محور كل من محضرات المقدمة هنا. التقنيات السابقة 6،24 يتم الجمع بين وتعديلها في عرض تقديمي مرئي للعزل قطرات من خلايا الخميرة الانشطار مثقفوالخلايا البشرية noncultured تم الحصول عليها من أنسجة المشيمة. والهدف هو إظهار تطبيق واسعة من هذه التقنية عن طريق اختيار اثنين من أنواع مختلفة من الخلايا واسع نظرا نقاط البدء لعزل الحبرية. وينبغي أن يكون هذا الأسلوب مفيدا لأولئك الذين يرغبون في عزل قطرات من معظم الكائنات الحية.
بروتوكول 1 يصف عزل قطرات الدهون من الخميرة الانشطار، السكيراء pombe، التي استخدمت كنموذج لمراقبة تشكيل الحبرية خلال انقسام الخلايا حقيقية النواة 25. تم استخدام الخميرة في مهدها خميرة الخباز على نطاق واسع باعتبارها النموذج الحي لدراسة الدهون الحبرية علم الأحياء. بروتوكول 1 ينطبق على كل الكائنات الحية والاختلافات في الاستعدادات وتسليط الضوء عليها.
بروتوكول 2 يصف عزل قطرات الدهون من خلايا المشيمة الزغابي، والتي هي بدورها حصلت عليها من مشيمة الإنسان الأجل. المجموعة من مشيمة الأجل يوفر فرصة فريدة بأمان وأخلاقيا للحصول على 200-250 غرام من الأنسجة البشرية المتاحة بسهولة 26، والذي يحتوي على أعداد كبيرة من قطرات الدهون. هذا هو على النقيض من معظم أعمال الدهون الحبرية العزلة في حقيقيات النوى أعلى حيث تنشأ قطرات من الخلايا المستزرعة. في تلك الدراسات، وغالبا ما يضاف الأحماض الدهنية للثقافة لتعزيز تخليق الدهون المحايدة، وبالتالي نمو قطرات. هذا هو على النقيض من العمل هنا حيث تتشكل قطرات الدهون تحت ظروف الأصلي في أنسجة المشيمة.
يتم تحديد درجات نقاء من الكسور الدهون قطيرة من خلال تحليل لطخة غربية باستخدام الأجسام المضادة علامة عضية. وسوف تسفر هذه البروتوكولات اثنين من الدهون الكسور الحبرية التي هي مناسبة لاحقة تحليل البروتين وlipidomic.
Protocol
1. عزل الدهن قطرات من (الانشطار) خلايا الخميرة
عزل قطرات من طراز كائن شعبية في مهدها خميرة الخباز الخميرة هو مطابق تقريبا لبروتوكول التالي 6. وقد لوحظت اختلافات في الأعمال التحضيرية.
1. تنامي خلايا الخميرة
- إعداد وسائل الإعلام. الجمع بين 36 غرام من مسحوق YE5S لكل لتر من DH 2 O في عبوات زجاجية أو قوارير الثقافة. وسوف تكون هناك حاجة إلى حوالي 2 لتر من وسائل الإعلام. الأوتوكلاف وسائل الإعلام في درجة حرارة 121 مئوية لمدة 20 دقيقة. السماح لوسائل الإعلام لتبرد إلى درجة حرارة الغرفة. لS. الخباز استبدال YE5S مع YPD.
- وضع 10-20 مل من وسائل الإعلام YE5S تبريد إلى ثقافة قارورة 250 مل باستخدام تقنيات العقيمة. تطعيم وسائل الإعلام مع كمية صغيرة من خلايا الخميرة من لوحة آغار باستخدام عصا خشبية معقمة أو ما يعادلها. السماح للخلايا تنمو إلى الكثافة البصرية المطلوب عند 30 درجة مئوية. قياس الكثافة البصرية فيالطول الموجي من 595 نانومتر باستخدام مطياف.
- وضع وسائل الإعلام المتبقية في 2.8 L القوارير. استخدام ما لا يزيد عن 1 لتر من وسائل الإعلام في 2.8 L قارورة لضمان خلط الصحيح أثناء نمو الخلايا في الحاضنة تهتز. العائد النهائي من الخلايا الرطب يجب أن يكون حوالي 10 غرام لتكون قادرة على الحصول على ما يكفي من قطرات الدهون والبروتين لتحليل lipidomic.
- إدخال الخلايا من الخطوة 1.2 في 2.8 L قوارير لكل منها 1 لتر من وسائل الإعلام التي أعدت في الخطوة 1.1.
- تنمو الخلايا إلى الكثافة المطلوبة في 30 درجة مئوية.
- تأكد من أن الخلايا لديها قطرات الدهون. الاحتياطي 1 مل من الخلايا. قياس الكثافة الضوئية (OD) من العينة. إضافة 0.1 مل من 100 ملي الأسهم من BODIPY 493/503 في الايثانول في OD الخلايا إلى العينة. وضع 3 ميكرولتر من العينة بين شريحة زجاجية وزلة غطاء زجاجي. تصور تحت المجهر الفلورسنت مع مرشح GFP (الشكل 1A).
- بيليه الخلايا من الخطوة 1.5 في 4 & #176؛ C في 3،800 x ج لمدة 10 دقيقة. العمل على دفعات تبعا لقدرة أنابيب الطرد المركزي.
- تخلصي من وسائل الإعلام YE5S وغسل الخلايا مع عازلة من EMM + 600 ملي السوربيتول. يوفر الدعم السوربيتول الاسموزي.
- نقل الخلايا إلى العقيمة 50 مل أنبوب الطرد المركزي وبيليه الخلايا في 4 درجات مئوية في 2000 x ج لمدة 10 دقيقة. إزالة طاف. تزن الخلايا رطبة. resuspend الخلايا في 2 مل من (EMM + 600 ملي السوربيتول) عازلة للغرام الواحد من الخلايا.
2. تحويل خلايا الخميرة الانشطار في spheroplasts وتحلل لاحقة
- إضافة 5 ملغ لكل 1) انزيم الخميرة التحللي و2) الخميرة lysing الانزيمات من الترايكوديرما harzianum حسب كل غرام من خلايا الرطب التي تم وزنه في الخطوة 1.9. لS. الخباز زيادة هذه الانزيمات مع نفس الكمية من Zymolyase.
- احتضان الخلايا عند 30 درجة مئوية تحت لطيف تهتز عند 100 دورة في الدقيقة لمدة 60 دقيقة.
- تحقق للتأكد من أن لديك spheroplasts الدكتور الدهونoplets. من خلال تكرار الخطوة 1.6 (الشكل 1B).
3. التدرج الكثافة الطرد المركزي
- بيليه spheroplasts بواسطة الطرد المركزي في 4 درجات مئوية في 2000 x ج لمدة 5 دقائق.
- إزالة بعناية طاف باستخدام ماصة نقل البلاستيك.
- resuspend بلطف spheroplasts مكعبات الثلج الباردة مع 10 ملي تريس، حمض الهيدروكلوريك، 600 ملي السوربيتول، و 200 ميكرومتر EDTA. نضع في اعتبارنا أن spheroplasts هشة جدا.
- بيليه spheroplasts مرة أخرى باستخدام نفس الإعدادات كما في الخطوة 3.1. إزالة بعناية طاف و resuspend spheroplasts باستخدام ماصة نقل البلاستيك في 12٪ Ficoll، 10 ملي تريس، حمض الهيدروكلوريك، و 200 ميكرومتر EDTA بتركيز 2 مل / ز الخلايا.
- نقل spheroplasts معلق إلى الخالط الزجاج والتجانس بلطف على الجليد، 20-30 السكتات الدماغية، مع مدقة الفضفاضة من الخالط الزجاج.
- نقل spheroplasts هي lysed إلى أنابيب الطرد المركزي وتراكب مع نفس فولوم من 12٪ Ficoll، 10 ملي تريس، حمض الهيدروكلوريك، و 200 ميكرومتر العازلة EDTA. اختيار عدد من أنابيب الطرد المركزي لاستخدام بحيث كل أنبوب حوالي ثلثي كامل.
- أجهزة الطرد المركزي في 4 درجات مئوية في 100،000 x ج لمدة 1.5 ساعة في الدوار SW28 أو ما يعادلها. تسمح الدوار إلى الساحل لوقف (الدوار التباطؤ = 0).
- بلطف نقل أعلى العائمة طبقة بيضاء (الشكل 2A)، والذي يحتوي على قطرات، إلى أنبوب الطرد المركزي الجديدة (ق) باستخدام إما pipettor أو باستور ماصة عازمة. إضافة حجم ما يكفي من 12٪ Ficoll، 10 ملي تريس، حمض الهيدروكلوريك، و 200 ميكرومتر العازلة EDTA للعينة بحيث يملأ ما يقرب من ثلث أنبوب الطرد المركزي.
- إضافة حجم يعادل 8٪ Ficoll، 10 ملي تريس، حمض الهيدروكلوريك، و 200 ميكرومتر العازلة EDTA إلى الأعلى من العينة (ق) في أنبوب الطرد المركزي الجديدة (ق). بعد إضافة هذا المخزن المؤقت يجب أن تكون الأنابيب حوالي ثلثي كامل.
- أجهزة الطرد المركزي في 4 درجات مئوية في 100،000 x ج لمدة 1 ساعة في الدوار SW28 أو ما يعادلها. تسمح الدوار إلى الساحل لوقف (ص أذني التباطؤ = 0).
- بلطف نقل أعلى العائمة طبقة بيضاء (الشكل 2B)، والتي سوف تحتوي على قطرات، إلى أنبوب الطرد المركزي الجديدة (ق) باستخدام إما pipettor أو باستور ماصة عازمة. إضافة 600 ملي السوربيتول، 8٪ Ficoll، 10 ملي تريس، حمض الهيدروكلوريك، و 200 ميكرومتر العازلة EDTA للعينة بحيث يملأ حوالي ثلث من أنبوب الطرد المركزي.
- إضافة حجم ما يعادل 250 ملي السوربيتول، 10 ملي تريس، حمض الهيدروكلوريك، والعازلة 200 ميكرومتر EDTA إلى الأعلى من العينة (ق) في أنبوب الطرد المركزي الجديدة (ق). بعد إضافة هذا المخزن المؤقت يجب أن تكون الأنابيب حوالي ثلثي كامل.
- أجهزة الطرد المركزي في 4 درجات مئوية في 100،000 x ج لمدة 1 ساعة في الدوار SW28 أو ما يعادلها. تسمح الدوار إلى الساحل لوقف (الدوار التباطؤ = 0).
- نقل أعلى طبقة بيضاء (الشكل 2C)، والتي يجب أن تحتوي فقط على قطرات الدهون والبروتينات ملزمة لغسيل الكلى الأنابيب، وdialyze O / N في 10 ملي تريس، حمض الهيدروكلوريك، و 200 ميكرومتر العازلة EDTA للقضاء على Ficoll.
الطبقة = "jove_title"> 2. عزل الدهن قطرات من خلايا المشيمة البشرية الزغابي
تم جمع مشيمة من النساء صحية مع الحمل المفرد تمر العملية القيصرية الاختيارية التسليم قبل بدء المخاض العفوي في المدى. أعطى المواضيع المكتوبة، الموافقة المسبقة لجمع المشيمة عند هؤلاء النساء. تم إجراء جمع، واستخدامه لاحقا، من مشيمة بموافقة من جامعة ولاية تينيسي وجامعة ولاية تينيسي مدرسة الدراسات العليا في الطب في نوكسفيل مجلس المراجعة المؤسسية (# 8757B و # 3338، على التوالي).
1. عزل خلايا المشيمة الزغابي الإنسان
الجزء 1 من البروتوكول هو تعديل لبروتوكول نشرت في وقت سابق من قبل بيتروف وآخرون 26
إعداد الحلول التالية:
- كلوريد الصوديوم (1 L): حل 9 ز كلوريد الصوديوم (M 58.4 جم / مول) في DH 2 O لتسفر عن حل 1 L. فلتر تعقيم (0.2؛ ميكرومتر غشاء).
- محلول ملحي متوازن 10X هانك (10X HBSS) (1 L): 4 ز بوكل (M 74.5 جم / مول)؛ 0.6 غ KH 2 PO 4 (M 136،086 غ / مول)، و 80 غرام كلوريد الصوديوم (M 58.44 جم / مول)؛ نا 2 هبو 4 (M 141.96 جم / مول)، و 10 غ مد الجلوكوز (M 180.16 جم / مول). حل لكل من المكونات في DH 2 O لتسفر عن حل 1 L. فلتر تعقيم (0.2 ميكرومتر غشاء).
- انزيم الهضم العازلة (0.6 مل): الجمع بين 70 مل 10X HBSS مع 3.3 مل 7.5٪ نا Biscarbonate، 17.5 مل 1 M HEPES، و266.1 مل درهم 2 O؛ تعقيم فلتر (0.2 ميكرومتر غشاء). تخزين عند 4 درجات مئوية.
- الدناز الأول: فقط قبل الاستخدام، إضافة 5 مل العقيمة كلوريد الصوديوم 0.9٪ إلى قارورة من الدناز. الحفاظ على الجليد حتى استخدامها أو تخزينها في -20 درجة مئوية.
- إعداد المشيمة للتشريح
- الحصول على المشيمة البشرية وعملية أقرب إلى وقت التسليم وقت ممكن. استخدام وعاء مختوم مثل برودة لنقل المشيمة. دائما استخدام الحذر عند اليدلينغ المواد البيولوجية البشرية.
- في هود السلامة البيولوجية، ونقل المشيمة إلى حاوية autoclavable معقمة، وغسل الدم من المشيمة بعناية والأغشية باستخدام معقم 0.9٪ كلوريد الصوديوم (المالحة) حل. تجاهل المالحة الدامية في دورق 1 لتر كما النفايات البيولوجية السائلة.
- وضع المشيمة في حقل معقمة، مع سطح أملس تحمل الحبل السري مواجهة. مع حادة، ومقص غرامة نقطة وملقط إزالة الأغشية الجنينية والحبل السري.
- الوجه المشيمة أكثر من ذلك أن سطح الأمهات (سطح خشن) ومواجهة. إزالة الأنسجة المغطي لوحة القاعدية، حوالي 3 ملم من السطح.
- تشريح المشيمة
- تشريح فلقة واحدة في وقت وتجنب لوحة المشيمي. جمع الأنسجة الزغابي في كوب 250 مل مع المياه المالحة.
- شطف الأنسجة عدة مرات في كوب منفصلة مع 0.9٪ كلوريد الصوديوم بواسطة يحوم بالملقط، وذلك باستخدام 1 لتر كوب للنفايات السائلة.
- نقل فلقة واحدة في وقت واحد إلى 150 ملم طبق بيتري. عقد مع ملقط وكشط الأنسجة مع شفرة حلاقة من السفن على طبق بيتري. وضع الأنسجة كشط في كوب منفصلة تحتوي على 0.9٪ كلوريد الصوديوم. أكرر لجميع قطع الأنسجة.
- نقل جزء صغير من الأنسجة إلى غربال تفارق الخلية وشطف مع 0.9٪ كلوريد الصوديوم على نطاق واسع حتى يصبح شطافة واضحة. أكرر لجميع الأنسجة.
- بعد الشطف الأنسجة كشط في غربال تفارق الخلية، وصرفها من السائل الزائد والوزن.
عند هذه النقطة الأنسجة قد يتم تخزين O / N في دورق مخروطي سعة العقيمة في 4 درجات مئوية في DMEM.
- الهضم الأنزيمية للأنسجة المشيمة
- تحضير الأنسجة خليط الهضم: 100 مل من prewarmed العازلة انزيم التخفيف، 1 مل الدناز الأول و20 مل 10X 2.5٪ التربسين.
- تقسيم الأنسجة، ونقل 60 غ من مجموع الأنسجة التي تم جمعها (عادة حوالي 250-300 ز) إلى 500 مل دورق مخروطي سعة العقيمة. إضافة الأنسجة خليط الهضم إلى دورق مخروطي يحتوي على الأنسجة، واحتضان عند 37 درجة مئوية في شاكر لمدة 45 دقيقة في 150 دورة في الدقيقة.
- جمع الخلايا نأت
- بعد أول 45 دقيقة التفكك، تعيين قارورة الهضم في الميل حتى يستقر الأنسجة.
- جمع طاف، مع الحرص على عدم جمع الأنسجة undissociated. إضافة مبلغ مساو من HBSS لطاف جمع ونقل إلى أنابيب معقمة 15 مل الطرد المركزي. لأجزاء إضافية من الأنسجة undissociated، كرر الإجراء بدءا من الخطوة 3.2 مع الأنسجة undissociated.
- أجهزة الطرد المركزي لجناسة في 4 درجات مئوية في 1000 x ج لمدة 15 دقيقة.
- لكل دفعة، وبعد الطرد المركزي، ونضح طاف دون الإخلال بيليه. خلايا المشيمة الزغابي في الغالب في الجزء الأبيض من بيليه، تغمر خلايا الدم الحمراء.
- نقل الخلايا الزغابي (الجزء الأبيض من بيليه) إلى شارعerile 50 مل المخروطية أنبوب الطرد المركزي والحفاظ على الجليد.
- بعد جمع الخلايا من جميع مراحل عملية الهضم الثلاثة، تحديد التعليق باستخدام 100 ميكرومتر مصفاة الخلية نايلون إدراجها في الجزء العلوي من 50 مل العقيمة المخروطية أنبوب الطرد المركزي. إذا كان الترشيح لتعليق الخلية يبطئ، ورفع التصاعدي على مرشح لرسم الفراغ داخل الأنبوب.
- أجهزة الطرد المركزي في 4 درجات مئوية في 1000 x ج لمدة 10 دقيقة. إزالة بعناية طاف دون الإخلال بيليه.
2. المجانسة خلايا المشيمة الزغابي
- قبل البدء في عملية العزل، وإعداد 50 مل من تحلل منخفض التوتر متوسطة (HLM) تحتوي على 20 ملي تريس، حمض الهيدروكلوريك، ودرجة الحموضة 7.4 و 1 ملي EDTA. إضافة مثبطات الأنزيم البروتيني لHLM فقط قبل الاستخدام والحفاظ على المتوسط على الجليد.
- في هود السلامة البيولوجية، إضافة 4 أضعاف حجم بيليه خلية من HLM الجليد الباردة إلى الخلايا. بلطف وبدقة resuspend الخلايا بواسطة pipetting الخلايا يصل إلىد إلى أسفل باستخدام ماصة 10 مل.
- احتضان الخلايا علقت على الجليد لمدة 10 دقيقة.
- نقل الخلايا إلى الخالط Dounce، التي ينبغي أن تكون على الجليد. التجانس ببطء الخلايا من خلال تطبيق 20-25 السكتات الدماغية لطيف مع مدقة فضفاضة من الخالط.
- أجهزة الطرد المركزي في الخلية المحللة في 4 درجات مئوية في 3000 x ج لمدة 10 دقيقة لإزالة الخلايا غير منقطعة، والحطام الخلوي والنواة.
- جمع طاف ونقل إلى أنبوب SW28 (أو البديلة التي يمكن طرد في 25،000 x ج). أجهزة الطرد المركزي في 4 درجات مئوية في 25،000 x ج لمدة 20 دقيقة لإزالة الميتوكوندريا.
3. عزل قطرات الدهون بواسطة تنبيذ فائق
- إعداد 50 مل من 100 ملي كربونات الصوديوم (M 106 جم / مول) العازلة (درجة الحموضة 11.5) و 50 مل من 60٪ سكروز (ث / ث) الحل. إضافة مثبطات الأنزيم البروتيني إلى المخزن المؤقت كربونات الصوديوم فقط قبل الاستخدام والحفاظ على الجليد.
- جمع طاف من الخطوة 2.6 في أنبوب الطرد المركزي 50 مل، وضبطإلى 20٪ من السكروز ونقل في الجزء السفلي من أنبوب نابذة فائقة السرعة لSW28 الدوار، أو ما يعادلها. طاف الكثافة تراكب تعديلها مع ~ 10 مل من العازلة كربونات الصوديوم 100 ملي الجليد الباردة (درجة الحموضة 11.5) و0.5-1 مل من الجليد الباردة HLM لملء الأنبوب.
- أجهزة الطرد المركزي في 4 درجات مئوية في 130،000 x ج لمدة 45 دقيقة باستخدام SW28 الدلو المتأرجح الدوار. تسمح الدوار إلى الساحل لوقف (الدوار التباطؤ = 0).
- جمع طبقة عائمة، وضبط إلى 10٪ سكروز ونقل إلى الجزء السفلي من 13.2 مل أنبوب نابذة فائقة السرعة لSW41Ti الدوار، أو ما يعادلها. الكثافة تراكب تعديل طاف مع حوالي 5 مل من العازلة 100 ملي كربونات الصوديوم الجليد الباردة (درجة الحموضة 11.5) و 0.5 مل من الجليد الباردة HLM.
- أجهزة الطرد المركزي في 4 درجات مئوية في 274،000 x ج لمدة 60 دقيقة باستخدام SW41Ti يتأرجح دلو الدوار. تسمح الدوار إلى الساحل لوقف (الدوار التباطؤ = 0) للحد من اختلال طبقة الدهون الحبرية.
- جمع بعناية أعلى طبقة العائمة (الشكل 2D) التي تحتوي علىقطرات الدهون مع ماصة 1 مل وكرر الخطوة 3.4.
- أجهزة الطرد المركزي في 4 درجات مئوية في 274،000 x ج لمدة 30 دقيقة باستخدام SW41Ti يتأرجح دلو الدوار. تسمح الدوار إلى الساحل لوقف (الدوار التباطؤ = 0).
- جمع بعناية بيضاء بلون الطبقة العليا العائمة التي تحتوي على قطرات الدهون مع ماصة باستور عازمة إلى ثلاثة أنابيب 1.5 مل تحتوي على 100 ميكرولتر HLM.
قطرات الدهون التي تميز الكسر (البروتوكولات 1 و 2)
يمكن التحقق من الانتعاش والنقاء من الكسر القطيرات الدهنية بواسطة لطخة غربية مجتمعة مع ضوء أو المجهر الإلكتروني. بالإضافة إلى ذلك، مأخوذة بعد خطوات الطرد المركزي مختلفة يمكن جمعها والاحتفاظ بها لتحديد كفاءة التنقية. في الغربية التنشيف، فمن أكثر ملاءمة لمقارنة حجم القطيرات الدهنية جزء الذي يمثل يعادل المحللة خلية كاملة من مقارنة قطرات الدهون في غشاء الكسور الأخرى على رانه أساس مجموع محتوى البروتين 24.
النتائج
إذا عملت التدرج الكثافة الطرد المركزي كما هو متوقع، يجب أن يحتوي على طبقة العائمة قطرات الدهون وتستنفد من العضيات الأخرى في جميع أنحاء تطور يدور عالية السرعة.
لبروتوكول 1، أجريت البقع الغربية مع الأجسام المضادة علامة لقطرات الدهون (Erg6p)، والعضيات التي تم العثور عليها للتفاعل مع قطرات الدهون في الخميرة، ER (Dpm1p)، الميتوكوندريا (Por1p)، غشاء البلازما (Pma1p)، والفجوات (Vma1p).
أحجام متساوية من طبقة عائمة من كل ثلاثة يدور (الخطوات 3.7، 3.10، 3.13 و) تم جمعها، مع حمض الخليك ثلاثي الكلور عجلت (15٪ تركيز النهائي)، وsolubilized في الماء. 13 مل من المحللة الخلية (الشكل 3A، "ليز") والبروتين الإعدادية من كل ثلاثة يدور (الشكل 3A، "Spin1"، "Spin2"، و "Spin3") تم فصل على 12٪ SDS-PAGE، ونقل إلى النيتروسليلوز الغشاء، وimmunoblotted مع عضية SPECIالأجسام المضادة المرورية. كما هو متوقع، والدهون قطيرة البروتين علامة Erg6p موجود في طبقة العائمة بعد كل من يدور الثلاثة (الشكل 3A)؛ Por1p غير موجود في الطبقة الطافية بعد Spin1 (الشكل 3A)؛ يتم استنفاد Vma1p من الطبقة العائمة بعد Spin2 (الشكل 3A)، وDpm1p وPma1p ليست موجودة في طبقة العائمة بعد Spin3 (الشكل 3A).
للبروتوكول 2، تم التحقق من وجود قطرات الدهون معزولة من خلايا المشيمة الزغابي المدى البشرية من خلال تلطيخ مع الدهون محايدة صبغ مضان محددة، BODIPY 493/503. كانت قطرات ثم تصور تحت المجهر مضان (الشكل 3B). تم تقييم نقاء معزولة كسور الدهون قطرات عن طريق ويسترن التنشيف مع البروتينات علامة للحصول على قطرات الدهون (perilipin 2)، ER (calnexin)، جولجي (GM130)، الميتوكوندريا (COX الرابع) وغشاء البلازما (MEK1) (الشكل 3C). الدكتور الدهونoplets تم إلغاء lipidated مع الأسيتون البارد وتم استخراج البروتينات. نسب متساوية من طاف آخر النووية (الجهاز العصبي المحيطي)، الكسر تحت طبقة تعويم تدور الماضي (الخطوة 3.6، "Spin4" على الشكل 3C)، فإن الخطوة اللاحقة غسل (الخطوة 3.8، "Spin5" على الشكل 3C)، و تم فصل دي lipidated الإعدادية البروتين العائمة طبقة الدهون الحبرية (الخطوة 3.8، "LD" على الشكل 3C) على 12٪ SDS-PAGE، نقلت وimmunoblotted مع الأجسام المضادة المشار إليها. Perilipin 2 (المعروف أيضا باسم ADRP)، والبروتين الدهني الحبرية، تم الكشف في طاف آخر النووية وفي بيضاء معزولة طبقة العائمة التي تحتوي على قطرات الدهون. بروتينات معينة لغشاء البلازما (MEK1) وجولجي (GM130) لم تكتشف في الدهون الكسور الحبرية في أي طبقة تحت طبقة عائمة لSpin4 وSpin5. كما ذكرت سابقا، فإن calnexin البروتين ER 18،27،28 وتلطيخ ضعيفة من البروتين غشاء الميتوكوندريا COX الرابع كانت ديتىالمديرية في أي مكان آخر في جزء الدهن الحبرية 22. هذه النتائج متسقة مع تقارير سابقة تبين أن قطرات الدهون التفاعل مع الميتوكوندريا في خلايا الثدييات 29 و ER مع 30،31.
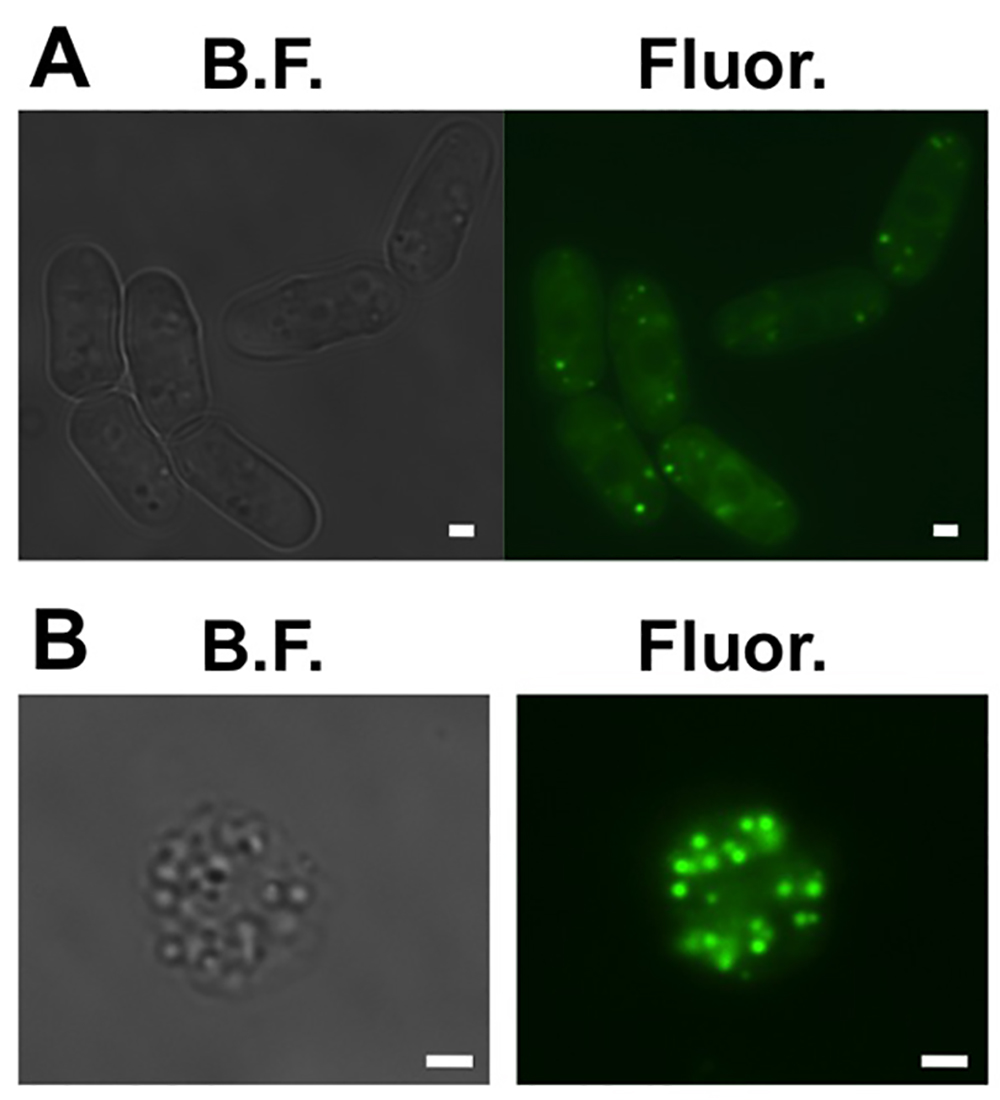
الشكل 1. قطرات الدهون الخلوية في خلايا الخميرة الانشطار. (A) حقل مشرق (BF) والميدان مضان واسعة (Fluor.) وصور من ستة خلايا الخميرة الانشطار ممثل حيث مصبوغ قطرات الدهون مع BODIPY 493/503. (B) حقل مشرق (BF ) والميدان مضان واسعة (Fluor.) صورا لممثل الكوراء حيث مصبوغ قطرات الدهون مع BODIPY 493/503. أشرطة النطاق هي 1 ملم. الرجاء انقر هنا لعرض أكبر نسخة سو هذا الرقم.

الشكل 2. طبقة العائمة بعد التدرج الكثافة الطرد المركزي. أنابيب الطرد المركزي بعد (A) Spin1 (الخطوة 3.8)، (B) Spin2 (الخطوة 3.11)، و (C) Spin3 (الخطوة 3.14) من البروتوكول 1. (D) أنابيب الطرد المركزي بعد Spin4 (الخطوة 3.6) من البروتوكول 2. يشار إلى طبقات العائمة التي تحتوي على قطرات الدهون عن طريق الأسهم.

الرقم 3. تحليل نقاء قطرات الدهون معزولة. (A) البقع الغربية من الخطوات الرئيسية في البروتوكول 1. كميات متساوية من كل من البروتين الإعدادية (Spin1 - الخطوة 3.7، Spin2 - الخطوة 3.10، وإسبي N3 - فصلت الخطوة 3.13) بواسطة SDS-الصفحة، ونقل إلى الأغشية النيتروسليلوز، وimmunoblotted مع الأجسام المضادة لErg6p (LD، قطرات الدهون)، Dpm1p (ER)، Por1p (MT، الميتوكوندريا)، Pma1p (مساء، غشاء البلازما)، وVma1p (فجوات). (B) المرحلة النقيض (PC) والميدان مضان واسعة (Fluor.) صور BODIPY 493/503-stained قطرات الدهون التي تم عزلها من خلايا المشيمة الزغابي الإنسان. (C) البقع الغربية من الخطوات الرئيسية في بروتوكول 2. تساوي نسبة PF الجهاز العصبي المحيطي (طاف آخر النووية)، طاف تحت طبقة عائمة بعد تدور الماضي (Spin4 - الخطوة 3.6) - تم فصل، وطبقة العائمة (LD) بواسطة SDS-الصفحة، ونقل إلى، وغسل اللاحقة (خطوة 3.8 Spin5) الأغشية وimmunoblotted مع الأجسام المضادة لperilipin 2 (LD، قطرات الدهون)، calnexin (ER)، GM130 (جولجي البروتين مصفوفة، جولجي)، COX الرابع (ج السيتوكروم أوكسيديز؛ MT، الميتوكوندريا)، وMEK1 (MAPK كيناز؛ PM، البلازما غشاء).ad/50981/50981fig3highres.jpg "الهدف =" _blank "> الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
Discussion
خطوات حاسمة في هذا البروتوكول
تأكد من أن تكون متسقة مع وسائل الاعلام وكثافة الخلايا أثناء نمو الخلايا المستزرعة. قطرات الدهون الخلوية هي فريدة من نوعها في أن البروتينات المرتبطة بها تعتمد اعتمادا كبيرا على البيئة التي كانت الخلايا المستزرعة 17. ولذلك، فإن وسائل الإعلام التي تزرع الخلايا وكثافة الخلايا ينبغي مراقبتها عن كثب من قبل تحلل.
تكوين البروتين من قطرات الدهون هي وظيفة من مرحلة النمو من خلايا الخميرة. وسوف تكون ملزمة أقل البروتينات إلى قطرات في مرحلة النمو سجل مقابل مرحلة ثابتة. أيضا، spheroplasting الكفاءة هي وظيفة من مرحلة النمو من خلايا الخميرة. سوف الخلايا في مرحلة النمو لديها سجل عائدات أعلى من spheroplasts من الخلايا في مرحلة ثابتة لأن هذه الأخيرة هي أكثر مقاومة للعلاج الأنزيمية.
خيمة ">تأكد من استخدام تقنيات لطيف لكسر مفتوح ويفضل الخلايا. التقنيات التي كسر جدار خلية الخميرة بواسطة الهضم الأنزيمي على التقنيات التي تمزق جدار الخلية من خلال القوة المطبقة. الأسلوب الأخير قد يعطل السلامة الهيكلية للقطرات مما أدى إلى فقدان البروتينات ملزمة أو الدهون.
تجنب تجميد عينات بعد أن تم هي lysed الخلايا. لا ينصح قطرات التجميد لأنها يمكن أن تؤثر على السلامة الهيكلية مما يؤدي إلى فقدان البروتين منضم أو الدهون. يمكن أيضا أن يسبب تجميد قطرات لتلتحم أو جزء 24. قد يكون هذا أهمية خاصة منذ لوحظت قطرات إلى تفتيت أو الخضوع الانشطار في خلايا الخميرة الحية 25 وبالتالي انهيار قطرات أكبر إلى أصغر منها هو ممكن. قطعة من قطرات أن شظية قد لا يكون الطفو لتظهر في وطبقة loating خلال التدرج الكثافة الطرد المركزي. هذا يمكن أن تقلل بشكل مصطنع عدد من العوامل الحبرية التي يتم تحديدها بواسطة هذه التقنية منذ تكوين البروتين من السطوح الحبرية قد تكون وظيفة من حجم القطيرات 32.
تأكد لاختبار توطين الدهون الحبرية العوامل المرتبطة قطرات الدهون. واحدة من الخصائص من قطرات الدهون هو أنها تتفاعل مع غيرها من العضيات 33-37. لذلك، وغالبا ما توجد عوامل من هذه العضيات في جزء الدهن الحبرية. وبالتالي، فمن المهم استخدام تقنيات إضافية لضمان أن هذه العوامل لتوطين قطرات. الدراسات مع انصهار بروتين فلوري مرتبطة بروتين من الفائدة في الخلايا حيث يتم ملطخة قطرات الدهون مع علامة فلوري مختلفة ينبغي استخدامها لتحديد مدى colocalization 15. تقنيات مثل البروتين ارتباط العلاقات العامةofiling يمكن استخدامها لتحديد المزيد من نقاء قطرة دهن جزء 15. في تلك الاستراتيجية، وصفت كل عنصرين مع مختلف الأحماض الأمينية التي تحتوي على النظائر. المكون الأول هو الدهون عامل الحبرية المعروفة، والعنصر الثاني هو جزء التي يتم تحليلها. ثم يتم إجراء مقارنات بين المواقع كسور من عنصرين.
التعديلات واستكشاف الأخطاء وإصلاحها
وأشار تعديلات في البروتوكول 1 لعزل قطرات الدهون من مهدها خميرة خميرة الخباز. لاحظ أن أحجام قطرات الدهون يمكن أن تختلف اختلافا كبيرا. قد تحتاج سرعات متدرجة الكثافة الطرد المركزي إلى زيادة لقطرات صغيرة تتراكم في الطبقة العائمة.
القيود المفروضة على تقنية
الوصول إلى أجهزة الطرد المركزي فائقة مع ماتحلق في دلو الدوار ضروري لعزل قطرات الدهون الخلوية. على الرغم من أن هذه قطعة من المعدات هو المعيار في معظم المختبرات بيولوجيا الخلية والكيمياء الحيوية، وأنها مكلفة.
أهمية هذه التقنية فيما يتعلق بأساليب القائمة أو طرق بديلة أخرى
كما ذكر أعلاه، بروتوكول 1 يستند كثب على عمل يبر وآخرون. 6 والجزء 1 من 2 البروتوكول هو تعديل لبروتوكول نشرت في وقت سابق من قبل بيتروف وآخرون 26
تطبيقات
الدهون الحبرية العزلة هو الأكثر فائدة لاحقة تحليل البروتين وlipidomic من البروتينات ملزمة، والدهون الفوسفاتية ومحايدة. وقد جمعت مخزونات من الدهون الحبرية البروتينات والدهون المرتبطة 4،6-17،19،20،22،23،28.
Disclosures
الكتاب تعلن أي المصالح المالية المتنافسة.
Acknowledgements
وأيد هذا العمل من قبل على جائزة جمعية القلب الأمريكية 13SDG14500046 لPD، والتعليم والطاقة المستدامة بحوث جائزة مركز (جامعة تينيسي) إلى PD، والتعليم الطبي والأطباء ومؤسسة أبحاث (جامعة تينيسي) الجائزة إلى JM و الكتاب أشكر كارولين Leplante (ييل جامعة.) لبروتوكول لتحويل الانشطار الخميرة لspheroplasts؛ اريك T. بودر (جامعة تينيسي) لاستخدام له حاضنات الهز، منضدية أجهزة الطرد المركزي، والبقعة الغربية المعدات التحليل؛ ومركز ل التكنولوجيا الحيوية البيئية (جامعة تينيسي) لاستخدام أجهزة الطرد المركزي الخاصة بهم، فائقة؛ غونتر داوم عن الأجسام المضادة الخميرة (غراتس جامعة للتكنولوجيا، النمسا)؛ موظفي قسم التوليد وأمراض النساء (مركز Univ. تينيسي الطبية) لتقديم المساعدة التقنية .
Materials
| Name | Company | Catalog Number | Comments |
| PROTOCOL #1: | |||
| 1.Growing yeast cells and converting to spheroplasts | |||
| Edinburgh Minimal Media (EMM) | Sunrise Science Products | 2005 | |
| Yeast extract with 5 supplements (YE5S) | Sunrise Science Products | 2011 | YE5S media with 225 mg/ml of each supplement: adeninie, histidine, leucine, lysine, uracil. The equivalent for budding yeast would be YPD. |
| YPD powder | Sunrise Science Products | 1875 | For S. cerevisiae |
| Sorbitol | Fisher Scientific | BP439 | |
| Yeast Lytic Enzyme | MP Biomedicals | 215352610 | |
| Lysing Enzymes from Trichoderma harzianum | Sigma-Aldrich | L1412 | |
| Zymolayse-20T | Sunrise Science Products | N0766391 | For S. cerevisiae |
| BODIPY 493/503 | Invitrogen | D-3922 | |
| Microscope Slides | Fisher Scientific | 12-544-7 | |
| Microscope Cover Glass | Fisher Scientific | 12-542-B | |
| Plastic transfer pipette | Fisher Scientific | 137115AM | |
| 1 liter glass bottle | |||
| 250 ml flask | |||
| 2.8 liter flasks | |||
| 2. Yeast lipid droplet isolation | |||
| Tris-HCl | Fisher Scientific | BP153 | |
| EDTA | Fisher Scientific | BP120 | |
| Ficoll 400 | Fisher Scientific | BP525 | |
| 12-14k Spectra/Por Dialysis Membrane | SpectrumLabs | 132680 | |
| EDTA-free Protease Inhibitor Cocktail Tablets | Roche Diagnostics | 11873580001 | irritant |
| Dounce Homogenizer | Sigma-Aldrich | D9938 | |
| Ultracentrifuge Tubes 25x89mm (for SW28) | Beckman-Coulter | 355642 | |
| 12-14k Spectra/Por Dialysis Membrane | SpectrumLabs | 132680 | |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| Temperature-controlled shaker | New Brunswick Scientific | C25KC | |
| Thermo Sorvall Legend XTR centrifuge | Thermo-Scientific | 75004521 | |
| Swinging Bucket Centrifuge Rotor | Thermo-Scientific | 75003607 | |
| Fiberlite* F15-6x100y Fixed-Angle Rotor | Thermo-Scientific | 75003698 | |
| Ultracentrifuge LB-M | Beckman-Coulter | ||
| SW28 Ultracentrifuge Rotor | Beckman-Coulter | 342204 | |
| PROTOCOL #2 | |||
| 1. Placental villous cells isolation | |||
| Disposable underpads | Fisher Scientific | 23666062 | |
| Autoclavable pan (container), 3L | Fisher Scientific | 1336110 | |
| Fine scissors, sharp-sharp, straight | Fine science tools | 1406011 | |
| London Forceps | Fine science tools | 1108002 | |
| Dumont #7b Forceps | Fine science tools | 1127020 | |
| Razor blades | Fisher Scientific | S65921 | |
| Screen cup for CD-1 | Fisher Scientific | S1145 | |
| 40 mesh screen | Fisher Scientific | S0770 | |
| Fisherbrand cell stainers 100μm | Fisher Scientific | 22363549 | |
| 150 mm Petri Dishes | Fisher Scientific | NC9054771 | |
| NaCl | Fisher Scientific | S642 | |
| KCl | Fisher Scientific | P333 | |
| KH2PO4 | Fisher Scientific | P386 | |
| Na2HPO4 | Fisher Scientific | S374 | |
| D-glucose | Fisher Scientific | D16 | |
| HEPES | Fisher Scientific | BP310 | |
| 2.5% trypsin 10x | Invitrogen | 15090046 | |
| DNase I grade II, from bovine pancreas | Roche Applied Science | 10104159001 | |
| Sodium bicarbonate solution | Sigma-aldrich | S8761 | |
| 500 ml Erlenmeyer flasks | |||
| 250 ml beakers | |||
| 15 ml centrifuge tubes | |||
| 10 ml serological pipettes | |||
| 50 ml centrifuge tubes | |||
| DMEM | Invitrogen | 11965084 | |
| 2. Lipid droplets isolation from villous placental cells | |||
| Tris-HCl | Fisher Scientific | BP153 | |
| EDTA | Fisher Scientific | BP120 | |
| D-Sucrose | Fisher Scientific | BP220 | |
| Sodium Carbonate | Fisher Scientific | BP357 | |
| EDTA-free protease inhibitor cocktail tablets | Roche Diagnostics | 11873580001 | irritant |
| Dounce homogenizer | Sigma-Aldrich | D9938 | |
| Ultracentrifuge tubes 25x89mm (for SW28) | Beckman-Coulter | 355642 | |
| Ultra-Clear centrifuge tubes 14x89mm (for SW41) | Beckman-Coulter | 344059 | |
| Disposable borosilicate glass pasteur pipets | Fisher Scientific | 1367820C | |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| Biological safety hood | Thermo-Scientific | ||
| Waterbath | Fisher Scientific | ||
| Temperature-controlled shaker | New Brunswick Scientific | C25KC | |
| Thermo Sorvall Legend XTR centrifuge | Thermo-Scientific | 75004521 | |
| Swinging Bucket Centrifuge Rotor | Thermo-Scientific | 75003607 | |
| Ultracentrifuge LB-M | Beckman-Coulter | ||
| SW28 Ultracentrifuge Rotor | Beckman-Coulter | 342204 | |
| SW41 Ti Ultracentrifuge Rotor | Beckman-Coulter | 331336 | |
| Western blot | |||
| IRDye 680 Goat Anti-Rabbit IgG | LI-COR | 926-68071 | dilution 1:15000 |
| IRDye 800CW Goat Anti-Mouse IgG | LI-COR | 926-32210 | dilution 1:5000 |
| NuPAGE® Novex® 12% Bis-Tris gels | Invitrogen | NP0341 | |
| primary antibodies for PROTOCOL #1 | |||
| Erg6p | gift from Dr. G. Daum | Graz University of Technology, Austria | dilution 1:5000 |
| Dpm1p | Abcam | ab113686 | 4 μg/ml |
| Por1p | gift from Dr. G. Daum | Graz University of Technology, Austria | dilution 1:5000 |
| Pma1p | gift from Dr. G. Daum | Graz University of Technology, Austria | dilution 1:10000 |
| Vma1p (anti-ATP6V1A) | Abcam | ab113745 | 0.5 μg/ml |
| primary antibodies for PROTOCOL #2 | |||
| perilipin 2 (anti-ADFP) | Abcam | ab52355 | 2 μg/ml |
| calnexin | Cell Signaling technology | 2679 | dilution 1:1000 |
| GM130 | Biorbyt | orb40533 | dilution 1:25 |
| COX IV | Cell Signaling technology | 4850 | dilution 1:1000 |
| MEK1 | Biorbyt | orb38775 | dilution 1:50 |
References
- Ploegh, H. L. A lipid-based model for the creation of an escape hatch from the endoplasmic reticulum. Nature. 448, 435-438 (2007).
- Herker, E. Efficient hepatitis C virus particle formation requires diacylglycerol acyltransferase-1. Nat. Med. 16, 1295-1298 (2010).
- Ding, Y. F., et al. Isolating lipid droplets from multiple species. Nat. Protoc. 8, 43-51 (2013).
- Kalscheuer, R., et al. Preparative isolation of lipid inclusions from Rhodococcus opacus and Rhodococcus rubber and identification of granule-associated proteins. Arch. Microbiol. 177, 20-28 (2001).
- Low, K. L., et al. Lipid droplet-associated proteins are involved in the biosynthesis and hydrolysis of triacylglycerol in mycobacterium bovis bacillus calmette-guerin. J. Biol. Chem. 285, 21662-21670 (2010).
- Leber, R., Zinser, E., Zellnig, G., Paltauf, F., Daum, G. Characterization of lipid particles of the yeast, Saccharomyces cerevisiae. Yeast. 10, 1421-1428 (1994).
- Grillitsch, K., et al. Lipid particles/droplets of the yeast Saccharomyces cerevisiae revisitied: lipidome meets proteome. Biochim. Biophys. Acta. , 1165-1176 (2011).
- Binns, D., et al. An intimate collaboration between peroxisomes and lipid bodies. J. Cell Biol. 173, 719-731 (2006).
- Ivashov, V. A., et al. Lipidome and proteome of lipid droplets from the methylotropic yeast Pichia pastoris. Biochim. Biophys. Acta. 1831, 282-290 (2013).
- Connerth, M., Grillitsch, K., Kofeler, H., Daum, G. Analysis of lipid particles from yeast. Lipidomics: Vol. 1: Methods and Protocols. 579, 359-374 (2009).
- Wolinski, H., Kohlwein, S. D. Microscopic analysis of lipid droplet metabolism and dynamics in yeast. Methods Mol. Biol. 457, 151-163 (2008).
- Jolivet, P., et al. Protein composition of oil bodies in Arabidopsis thaliana ecotype WS. Plant Physiol. Biochem. 42, 501-509 (2004).
- Katavic, V., Agrawal, G. K., Hajduch, M., Harris, S. L., Thelen, J. J. Protein and lipid composition analysis of oil bodies from two Brassica napus cultivers. Proteomics. 6, 4586-4598 (2006).
- Zhang, P., et al. Proteomic study and marker protein identification of Caenorhabditis elegans lipid droplets. Mol. Cell. Proteomics. 11, 317-328 (2012).
- Krahmer, N., Hilger, M., Kory, N., Wilfling, F., Stoehr, G., Mann, M., Farese, R. V., Walther, T. C. Protein correlation profiles identify lipid droplet proteins with high confidence. Mol. Cell Proteomics. 12, 1115-1126 (2013).
- Cermelli, S., Gou, Y., Gross, S. P., Welte, M. A. The lipid-droplet proteome reveals that droplets are a protein-storage depot. Curr. Biol. 16, 1783-1795 (2006).
- Brasaemle, D. L., Dolios, G., Shapiro, L., Wang, R. Proteomic analysis of proteins associated with lipid droplets of basal and lipolytically stimulated 3T3-L1 adipocytes. J. Biol. Chem. 279, 46835-46842 (2004).
- Liu, P. S., Ying, Y. S., Zhao, Y. M., Mundy, D. I., Zhu, M. F., Anderson, R. G. W. Chinese hamster ovary K2 cell lipid droplets appear to be metabolic organelles involved in membrane traffic. J. Biol. Chem. 279, 3787-3792 (2004).
- Fujimoto, Y., et al. Identification of major proteins in the lipid droplet-enriched fraction isolated from the human hepatocyte cell line HuH7. Biochim. Biophys. Acta. , 47-59 (2004).
- Sato, S., et al. Proteomic profiling of lipid droplet proteins in hepatoma cell lines expressing hepatitis C virus core protein. J. Biochem. 139, 921-930 (2006).
- Umlauf, E., Csaszar, E., Moertelmaier, M., Schuetz, G. J., Parton, R. G., Prohaska, R. Association of stomatin with lipid bodies. J. Biol. Chem. 279, 23699-23709 (2004).
- Zhang, H. N., et al. Proteome of skeletal muscle lipid droplet reveals association with mitochondria and apolipoprotein A-I. J. Proteome Res. 10, 4757-4768 (2011).
- Wu, C. C., Howell, K. E., Neville, M. C., Yates, J. R., McManaman, J. L. Proteomics reveal a link between the endoplasmic reticulum and lipid secretory mechanisms in mammary epithelial cells. Electrophoresis. 21, 3470-3482 (2000).
- Brasaemle, D. L., Wolins, N. E. Isolation of lipid droplets from cells by density gradient centrifugation. Curr. Protoc. Cell Biol. , 3.15.1-3.15.12 (2005).
- Long, A. P., et al. Lipid droplet de novo formation and fission are linked to the cell cycle in fission yeast. Traffic. 13, 705-714 (2012).
- Petroff, M. G., Phillips, T. A., Ka, H., Pace, J. L., Hunt, J. S. Isolation and culture of term human trophoblast cells. Methods Mol. Med. 121, 203-217 (2006).
- Cho, S. Y., et al. Identification of mouse Prp19p as a lipid droplet-associated protein and its possible involvement in the biogenesis of lipid droplets. J. Biol. Chem. 282, 2456-2465 (2007).
- Ding, Y. B., Wu, Y. B., Zeng, R., Liao, K. Proteomic profiling of lipid droplet-associated proteins in primary adipocytes of normal and obese mouse. Biochim. Biophys. Acta. 44, 394-406 (2012).
- Jagerstrom, S., et al. Lipid droplets interact with mitochondria using SNAP23. Cell Biol. Int. 33, 934-940 (2009).
- Xu, N. Y., et al. The FATP1-DGAT2 complex facilitates lipid droplet expansion at the ER-lipid droplet interface. J. Cell Biol. 198, 895-911 (2012).
- Ozeki, S., Cheng, J. L., Tauchi-Sato, K., Hatano, N., Taniguchi, H., Fujimoto, T. Rab18 localizes to lipid droplets and induces their close apposition to the endoplasmic reticulum-derived membrane. J. Cell Sci. 118, 2601-2611 (2005).
- Yang, H. Y., Galea, A., Sytnyk, V., Crossley, M. Controlling the size of lipid droplets: lipid and protein factors. Curr. Opin. Cell Biol. 24, 509-516 (2012).
- Jacquier, N., Choudhary, V., Mari, M., Toulmay, A., Reggiori, F., Schneiter, R. Lipid droplets are functionally connected to the endoplasmic reticulum in Saccharomyces cerevisiae. J. Cell Sci. 124, 2424-2437 (2011).
- Pu, J., Ha, C. W., Zhang, S., Jung, J. P., Huh, W. K., Liu, P. Interactomic study on interaction between lipid droplets and mitochondria. Protein Cell. 2, 487-496 (2011).
- Shaw, C. S., Jones, D. A., Wagemakers, A. J. M. Network distribution of mitochondria and lipid droplets in human muscle fibres. Histochem. Cell Biol. 129, 65-72 (2008).
- Goodman, J. M. The gregarious lipid droplet. J. Biol. Chem. 283, 28005-28009 (2008).
- Brasaemle, D. L., Wolins, N. E. Packaging of fat: an evolving model of lipid droplet assembly and expansion. J. Biol. Chem. 287, 2273-2279 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved