Method Article
Alphaherpes Virüs İleriye Taşıma ve Değişken Canlı Hücre Görüntüleme
Bu Makalede
Özet
Alphaherpes virüs enfeksiyonlarının Canlı hücre görüntüleme yönelik ulaşım ve hücreler arası yayılma dinamik olayların analizi sağlar. Burada, birincil nöronların enfeksiyon sırasında viral meclislerinin görselleştirme kolaylaştırmak için floresan füzyon proteinleri ifade rekombinant viral suşlar kullanmak yöntemleri sunuyoruz.
Özet
Canlı hücre floresan mikroskopi teknikleri, hem de floresan füzyon proteinleri ifade rekombinant viral suşlar yapımında gelişmeler taşıma ve nöron alphaherpes virüs enfeksiyonunun yayılmasını gerçek zamanlı görsel sağladı. Canlı hücre görüntüleme ile birlikte viral membran, zar ve capsids için yeni floresan füzyon proteinlerin programı, akson içinde ulaşım geçiren viral partikül meclisleri tespit. Benzer araçları başarıyla hücreler arasında iletilen virionlann sayısı ve çeşitliliği ölçmek için viral parçacıkların yayılması, hücre-hücre analizi için kullanılmıştır. Önemlisi, anterograd ulaşım ve yayılma canlı hücre görüntüleme teknikleri parçacık taşıma hızları, parçacıkların dağılımları, ve protein yerelleştirme zamansal analizleri de dahil olmak üzere bilgi hazinesi üretmek. Klasik viral genetik teknikleri yanı sıra, bu yöntem kritik bilgiler sağladıönemli mekanik soruları. Bu yazıda ayrıntılı olarak alphaherpes virüs taşıma ve yayılmasının temel sorulara cevap için geliştirilmiştir görüntüleme yöntemleri açıklar.
Giriş
Alphaherpes herpes simpleks virüsü gibi virüsler (HSV) -1, -2, ve pseudorabies virüs periferik sinir sistemi (PNS) enfeksiyon (PRV) viral yaşam döngüsü boyunca çeşitli karmaşık ve oldukça düzenli bir adımdan oluşur. PNS nöronlar içinde Ulaştırma primer viral enfeksiyon ve sonraki arası ana yayılma hem de olaylar sırasında önemlidir. Viral yaşam döngüsü iki bileşeni modüle moleküler mekanizmalar; uzak akson (ileriye taşıma) ve duyarlı hücreleri (ileriye yayılması) için virionlar sonraki iletim içinde hücre organlarından viral meclislerin yönettiği taşıma anlayışı herpes patogenezinde için önemlidir.
Nöronlarda viral parçacıkların taşıma ve çıkış olgun bir bulaşıcı virion 1,2 montajı bağlıdır. Immünofloresan (eğer varsa) ve elektron mikroskopisi (EM) dahil olmak üzere, daha önceden belirlenmiş deneyleri, parçacık montaj durumu ve prot incelemek için kullanılmıştırein etkileşimleri virion ulaşım ve yayılması 3-6 ile ilişkilidir. Ancak kimyasal sabitleme tarafından tanıtıldı taşıma virionların ve deneysel eserler dinamik yapısı sabit görüntülerin 7,8 yorumlanması eleştirilmiştir. Son zamanlarda, viral floresan füzyon proteinleri bir dizi protein fonksiyonu üzerinde ihmal edilebilir etkilere sahip HSV ve PRV için tarif edilmiştir. Kapsid, zar ve glikoprotein 9-11: Yeşil floresan proteini (GFP) ve Kırmızı floresan proteinleri (mCherry veya MRFP) fluorophores genellikle olgun bir virionun üç yapısal bileşenlerinin iki görüntüleme sağlamak için eşleştirilmiş. Çift etiketli virüs kullanarak ileriye taşıma hücre görüntüleme Canlı taşıma sırasında viral parçacıkların montaj durumunu görüntüler. Viral suşlar ifade Benzer florofor sayısı ve yayılma 12,13 aşağıdaki viral genomların çeşitliliği görselleştirmek için kullanılır. Floresan proteinleri özellikleri (14,15 gözden) büyük ölçüde etkileyebilirviral veya cep meclisleri görselleştirmek için yeteneği. Yabani tip işlevselliği korunması için yeni bir protein füzyonları, tasarımı ve test kendi kendine etkileşimleri ve kararlılığı dahil floresan protein içsel özellikleri, dikkate alınmalıdır.
Floresan proteini füzyon, iki in vitro hücre kültürü sistemlerinde iyi karakterize ile birlikte herpes virüsü enfeksiyonu canlı hücre görüntüleme için kullanılır: ayrışmış 16 ve 17 (Şekil 1A) sıçan üstün servikal ganglion (SCG) nöronlar bölümlere. Her iki sistemde de, embriyonik SCG en tek hücre gövdeleri için ayrışmış, disseke edilir ve in vitro kültür 18 için kaplama. SCG nöronlar otonom sinir sisteminin bir parçasıdır ve kolayca olgun bir polarize devlet ex vivo olarak kültür ve nöronal büyüme faktörü (NGF) ile ayırt edilebilir. Ayrışmış SCG nöronlar f sağlayan akson uzun bir ağ oluşturmakya da anterograd ulaşım 6 geçmesi gibi viral parçacıkların görselleştirme. Bölümlere SCG kültürler nöronal hücre gövdesi (S bölmesi) ve distal akson Termini (N bölmesi) 19 akışkan izolasyonu sağlar. Orijinal 20 veya modifiye Campenot odaları 17 ile bölümlere nöronların yapımı ve kullanımı için ayrıntılı protokoller bir dizi daha önce yayınlanmıştır. Akışkan izolasyon nöronal hücre gövdeleri ve izole akson Termini ulaşım sonra döl virionlar tespit seçici enfeksiyonu için izin verir. Enfeksiyon öncesi termini üzerinde epitel hücreleri kaplama viral enfeksiyonun yayılması için alıcı hücreler içerir.
Orada tüm canlı hücre görüntüleme deney için önemli birçok temel unsurlardır, ama bizim protokoller için en uygun olan: otomatik görüntü elde etme, floresan aydınlatma, görüntüleme hızı ve çevre kontrolü. Tüm görüntüleme deneyleri için, kullandığımızters, otomatik, Epifloresans aydınlatma mikroskobu (Şekil 1B). Mikroskop Nikon Eclipse Ti tabanı etrafında inşa ve hızlı bir şekilde yeniden otomatik görüntü alımı sırasında mikroskop için bilgisayar kontrollü motorlu sistemleri bir dizi istihdam etmektedir. Floresan aydınlatma için, aydınlatma yol boyunca nötral yoğunluk filtreleri ile zayıflatılmış olabilir geniş spektrumlu cıva ark lambası kullanın. Tahrik olma filtreleri floresan aydınlatma spektrum sınırlamak ve çok geçişli çift renkli aynalar ve floresan emisyon filtreleri özel floresan bileşikler görselleştirmek ile eşleştirilmiş. Uyarma ve emisyon filtreleri farklı floresan kanalların hızlı sıralı satın sağlamak için bağımsız, hızlı geçiş filtresi tekerlekler monte edilmiştir. Görüntü elde etme hızını daha düşük yoğunluklu sinyal ve kısa görüntü kez okundu tespiti için yararlı bir hassas ve hızlı EM-CCD kamera, ile geliştirilmiştir. Microsc üzerinde çevresel kontrolyerdir kuluçka ısıtılmış bir aşamada üst ve nemlendirilmiş bir CO2 ile zenginleştirilmiş bir atmosfer inkübatör içine geçirilir ise yüksek ısılarda örnekleri korumak için bir objektif lens ısıtıcı ile elde edilir. Mikroskop yakın 25 kadar muhafaza ortam sıcaklığı ile karanlık bir odada tutulur ° C ve tüm pencereler karartma perdeleri ile minimize dış ışık. Aşağıdaki protokoller ileriye taşıma ve yayılması deneyleri için bu sistemin kullanımını tarif eder.
Alternatif bir dizi canlı hücre görüntüleme değişkenleri kontrol etmek için var. Mikroskopi ayarları kontrol elle ya da özel bir yazılım bağımlı otomatik sistemleri ile yapılabilir. Floresan aydınlatma, halojen, LED veya lazer kaynağı ile elde edilebilir. Görüntüleme hızı filtre anahtarlama hızını ve eşleştirilmiş algılama sistemi ile sinyal görselleştirmek için zaman değiştirilir. Çevre kontrolü mi üzerindeki özel donanım ile elde edilebilircroscope sahne, tamamını veya bir ısıtmalı ve nemlendirilmiş kutusuna mikroskop bir parçası, ya da mikroskop yapılacaktır oda sıcaklığı yükseltmek yoluyla bir muhafaza. Bu alternatiflerin her biri maliyet ve performans ile ilgili avantajları ve dezavantajları vardır.
Sonraki protokol, detay rekombinant viral suşlar aracılığıyla hızlı ileriye taşıma ve alphaherpes virüslerin ileriye yayılmasını incelemek için canlı hücre görüntüleme kullanımı. Gerçek zamanlı canlı hücre görüntüleme kapsid, zar ve / veya akson 11 içinde ulaşım geçiren dinamik yapılara glikoprotein co-lokalizasyon görüntüler. Bölümlere nöronal kültürlerin bir gecede timelapse görüntüleme duyarlı hücrelerin 12 aksonal virionu çıkış ve enfeksiyon görüntüler. Burada sunulan protokolleri bizim özellikle görüntüleme sistemi ile kullanım için optimize edilmiş, ancak canlı hücre görüntüleme dört elementin göre geniş anlamda sunulmuştur. TartışmasındaDaha fazla ayrıntı deney başarılı için gerekli olan optimizasyon bazı olacaktır.
Protokol
Bölüm 1 - Canlı hücre Floresan Mikroskopi için Çevresel Kontrol Koşulları
- Herhangi bir görüntüleme deney öncesinde 30 dakika bağlanmak ve mikroskop sahne üst inkübatör ısınma başlar.
- Mikroskop, iletilen ve epifluorescent ışık kaynakları ve otomatik donanım kontrolleri açın. Mikroskop bağlanmak ve EM-CCD kamera soğutma başlamak için mikroskop kontrol yazılımı, NIS Elemanları, açın.
- . Lens uygun objektif (ya 60X veya 100X immersiyon yağı) için sıcak Not takın: deney türüne göre objektif lens seçin. 60X faz amacı ileriye yayılması görselleştirmek için uygundur ise 100X diferansiyel girişim kontrast (DIC) ileriye taşıma virion meclislerinin takibi için en iyisidir. Bu örnek ile doğrudan temas yok gibi düşük büyütme, petrol dışı daldırma hedefleri bir lens sıcak gerektirmez.
- Mi ve motorlu sahneye aşamasında üst inkübatör takın croscope. Örnek yerde tutacaktır uygun eklemek emin olun. Inkübatör kontrolünden sahne üst inkübatör üzerindeki giriş portuna nemlendirilmiş hava hattı takın.
- Inkübatör ve lens sıcak kontrolleri açın ve (tartışma) görüntülü olan objektif ve örnek için özel önceden doğrulanmış koşullarına sıcaklık ayarları.
- % 5 CO 2 / üst inkübatör sahneye CO 2 ilave hava sağlamak için% 95 atmosferik tankı üzerindeki kontrol vanasını açın. Akış hızı dakikada gaz 60 ila 80 ml olmalıdır. Daha hızlı oranları nemlendirme odası rağmen geniş örnek dehidratasyon neden olacaktır.
- Objektif lens için lens yağ ekleyin ve hemen sahne üst inkübatör içine yansıması olan kültür yerleştirin.
- 10 dakika içinde en az kültür sıcaklığının dengeleme izin verir. Bir saat, özellikle Bölüm 3'te açıklanan gece görüntüleme için, tercih edilir.
- Altı ile sekiz saat önce görüntüleme, Taylor ve de tarif edilen yöntem kullanılarak ilgi konusu virüs 1 x 10 6 plak oluşturan birim olgun, ayrışmış SCG nöron, bir 35 mm lamel alt çanak (örneğin virüsler için Tablo 1) hastalık ark. 2012A 11. 30-60 dakika tarafından birden fazla virüs, off-set aşılar test benzer zamanlarda, enfeksiyondan sıralı örneklerin görüntüleme sağlamak için eğer.
- Herhangi bir deney çalıştırmadan önce 10 dakika en az sahne üst inkübatör içine çanak yerleştirin. Sıcaklık equilibrates ise, odak düzlemi kayıyor ve olumsuz herhangi bir görüntüleme deneyleri etkileyecektir.
- Iletilen ışık ve mikroskop mercek kullanarak, açık bir şekilde izole akson uzantısı olan bir nöronal hücre gövdesi bulabilirsiniz. Alternatif olarak, algılama ifade eden bir hücre bulmak için uygun floresan aydınlatma kullanınfloresan proteinleri tablosu miktarda. Çünkü ışığın neden olduğu hücresel hasar ve floresan proteinleri beyazlatma, bu adım ve daha sonraki aşamalarda, floresan aydınlatma için bir örnek maruz kalmasını sınırlamak için önemlidir.
- Hücrelerin maruz kaldığı uyarma ışık yoğunluğunu azaltmak için floresan aydınlatma zayıflatır. Nötr Yoğunluk (ND) floresan aydınlatma ışık yolu filtre hafifletici ışık meşgul. Uzun 1 dakika, ND4 en az uzun süren film floresan proteinleri fotoğraf beyazlatma ve akson foto-hasarı geniş önlemek için kullanılmalıdır için. Yüksek floresan yapıları genellikle yerde bir ND8 filtresi ile görüntülenebilir.
- Mikroskop yazılım (Şekil 2 ve Ek Film 1A) kullanarak, EM-CCD kamera için ışık yolu açın.
- Her floresan kanal için en iyi görüntüleme süreleri ve koşulları belirler.
- "Play" düğmesini kullanarak bir canlı görüntü penceresi başlatın.
- Her floresan protein için en uygun kamera pozlama ayarları belirleyin. Hızlı hareket eden virion yapıların devinişsel sapmaları olarak kanal başına 300 milisaniye aşmayın meydana gelecektir. (Üretici maksimum kazanç önerilen), maruz kalma süresi en aza indirmek ve loş sinyallerin tespiti geliştirmek için 300 bir ayara kameranın EM kazanç yararlanın. Doğru pozlama süreleri düşük arka plan yoğunluğu ve yüksek özgül sinyalleri bir görüntü elde edilmelidir.
- Pozlama ayarı ve akson bir iyi tanımlanmış bir bölge bulduktan sonra, yazılım otomatik görüntü elde etme gerçekleştirmek için yapılandırılmalıdır. Ağartma örnek önlemek için canlı görüntüleme penceresi durdurun.
- NIS Elements yazılımı olarak, 6D seçin - Define / menü aşağı "Uygulamalar" açılan Deney uygulamasını çalıştırın.
- ND satın alma penceresinde, görüntü elde etme sıklığını belirleyecek Zaman sekmesini tıklatın. "Hayır Gecikme" ve süresi 5 dk için Aralığı ayarlayın. The yazılımı daha sonra 5 dakika süresi için mümkün olan en yüksek frekansta görüntü kareleri kazanacaklardır.
- Birden fazla floresan görüntü elde etmek için kullanılan önceden belirlenmiş donanım yapılandırmaları seçimi sağlar "Lambda" sekmesini seçin. Ilk kutusunu tıklatın ve menü aşağı sonraki açılan uygun bir donanım yapılandırması seçin. Yansıması için, flüoresan protein için tekrarlayın.
- "XY Pozisyonlar", "Z-serisi" ve "büyük resim" için sekmeleri de-seçilmiş olduğundan emin olun.
- Sekmeler üzerinde, işaretli kutusu otomatik olarak satın alma sırasında sabit diske görüntüleri kaydetmek için "Save to File" seçeneğini seçin. Deney çıktı dosyasının konumunu ve dosya adını yapılandırın. Sıralı deneyler olduğundan, yazılım belirlenen dosya adının sonunda bir sıra numarası ekler.
- Bir kez tüm sekmeleri seçilmiştir. "Run-Now" butonuna tıklayarak deneme başlatın.
- Pozlama ayarları ile görüntü elde etme oranı optimize ve image boyutu. Görüntü mümkün alan küçük bir bölge kullanarak genellikle kare elde etme oranları hızlandırır. % 25 ve toplam görüntü alanının% 50 arasında bir alan seçerek, NIS-Elements ROI aracını kullanarak İlgi Bölge tanımlayın. Alternatif olarak, daha kısa pozlama süreleri kare elde etme oranlarını artırmak, ama (tartışma) sinyal kalitesini düşürür olacaktır.
Bölüm 3 - İleriye spread Olayların Gecelik Time-lapse Görüntüleme
- Görüntüleme önce dört saat, bir 35 mm μ-Bulaşık üzerine inşa edilmiş bir bölümlere nöronal kültür bulaştırmak. Taylor ve ark tarif edilen yöntem kullanılarak (örneğin virüsler için Tablo 1) ilgi konusu virüs 1 x 10 6 plak oluşturan birim nöronal hücre gövdeleri inoküle. 2012b 12.
- Yavaşça sahne üst inkübatör içine kültür çanak yerleştirin. Nesnel yerini yemeğin tarafına ayarlandığından emin olun. Yavaş yavaş odak, ensur içine objektif getirmekamaç ing örnek içine itmek değildir. Odak alanı tespit edildikten sonra, yavaş yavaş akson bölmesinin iç tarafında demarking iç bariyer yakın, çanak merkezi haline amacı taşıyın. Hareket sırasında, odak derinliği korunmasını sağlamak ve örnek içine iterek kaçının. Amacı ile plastik yüzey sapma akson ve plastik zarar verir.
- Sıcak (~ 37 ° C) fosfat Teflon ring dışında kültür çanak tamponlu tuzlu. Yaklaşık 2 ml Bu örnek, dehidratasyon en aza indirmek ve ısı yalıtımı sağlamak için PBS bir halka ile nöronal kültür çevreler.
- Sıcaklığı otomatik görüntü elde etme (3.8) başlatmadan önce 1 saat en az gelmesini sağlayınız. 3.7 adımları 3.5 Bu süre içinde yapılandırılabilir.
- Tüm nötral yoğunluk filtreleri yaparak mümkün olan en düşük seviyeye aydınlatma yoğunluğunu kısıtlayın. Bu sık sık görüntü elde etme ove sağlayacakfotoğraf-zarar aşırı olmadan r uzun süreler. Aydınlatma azaltılması uzun pozlama (tartışma) gerektiren, düşük sinyal neden olur.
- Tarihsel pozlama ayarları veya set-up Bölüm 2.5 'te açıklandığı gibi hedef floresan proteinleri pozlama ayarlarını yapmak için ifade enfekte epitel hücrelerinin paralel bir tabak oluşturmak deneysel önce kullanın.
- Gerekli kanallar için pozlama ayarı sonra, otomatik görüntü elde etmek için yazılım yapılandırma zamanıdır. Ağartma örnek sınırlamak için canlı görüntüleme penceresi durdurun.
- Elements yazılımı (Şekil 2 ve tamamlayıcı film 2) olarak, 6D seçin - ND Toplama pencere açmak için aşağı "Uygulamalar" açılır menüsünden Deney uygulama tanımlayın / çalıştırın.
- ND Toplama penceresinde, Zaman sekmesini tıklatın. "5 dakika" için Aralığı ayarlayın. 20 saat için süre ayarlayın. Döngüler alanı otomatik olarak progra tekrar sayısı için hesaplanırm gerçekleştirir.
- "Lambda" sekmesini seçin. Ilk kutusunu tıklatın ve menü aşağı sonraki açılan Faz kontrast için uygun lambda yapılandırma seçin. Görüntülü her floresan protein için uygun konfigürasyonları seçerek, sonraki pozisyonlar için tekrarlayın.
- Bir görüş tek bir büyük alana birleştirilmek üzere birden fazla görüntü parametrelerini belirleyen "Büyük Resim" sekmesini seçin. İyi bir büyüklükte alan 7% dikiş üst üste kullanarak 5 x 2 görüntü oluşur. Bu görüntü elde etme sıklığını etkilemeden yansıması için pozisyon başına hücre sayısı için izin verir. Ayrıca, "Sahne hareketi sırasında Kapat Active Shutter" için onay kutusunu kaldırın. Bu seçenek görüntüler arasında kepenkleri kapatarak değil tarafından satın hızını artırır.
- , "XY Pozisyonlar" sekmesini seçin sırayla gecede filmin sırasında paralel olarak yansıması olacaktır birden fazla pozisyon belirlemek için. Merkezi po tanımlamak pozisyonları seçinher büyük resim aralıkları için int. Örnek 6-8 görüntü pozisyonları seçin. İyi bir görüntü alanı açıkça tanımlanmış akson yakın apozisyon hücrelerin küçük kümeler olacak. Hücreler en aza indirilmelidir birbirleriyle ve akson donatılacak üstüne yığılmış olmamalıdır. Odak noktası hücrenin çekirdeğini oluşturur. , Açık bir şekilde tanımlanmış çekirdek zarı hücrelerin çoğunluğu için görülür ki bu amaç yerleştirin.
- "Z-serisi" sekmesi seçili olduğundan emin olun.
- Yukarıda Bölüm 2.6.5 açıklandığı gibi otomatik kaydetme özelliği yapılandırın.
- "1 kez döngü" tıklayarak pozlama ve pozisyon ayarları test edin. Iletilen ışık aydınlatma, odak ve çerçeveleme için çıkan görüntüler değerlendirin. Yoğunlaştırdığını ise, XY sekmesi altında her pozisyon için odak sıfırlayın. 10 dakika bekleyin ve odak istikrarlı kadar bu adımı tekrarlayın.
- Tüm ayarları doğrulanmış ve test edildikten sonra, "Şimdi Çalıştır" butonuna tıklayarak otomatik deneme başlatmak.
Bölüm 4 - Görüntü İşleme ve İhracat
Data Export
- Taşıma veya yaymak olayların canlı hücre görüntüleme sırasında elde edilen veri setleri sunumlar ve yayınlar (Ek Film 3) daha sonra kullanmak için sık kullanılan dosya türlerini içine NIS Elements yazılımı ihraç edilmelidir. NIS Elements film uygun ham. ND2 dosyasını açın ihracat ve istenen floresan kanalları görselleştirmek için "bölünmüş bileşeni" görünümü seçin. Oynatma uygun bir hızda dosya; saniyede 5 kare hızlı ulaşım görselleştirme için iyi bir başlangıç noktasıdır.
- Film oynatma sırasında gerçek zamanlı saat temsil etmek için bir zaman damgası ekleyin. Resmin üzerine sağ tıklayın ve, ND-bilgiler kat. Dijital sayaç sol üst köşesinde görünür.
- Bilgileri görüntülemek için zaman damgası düzenleyin. Sağ tezgahın üzerine tıklayın ve Edit ND-bilgileri seçin. Sonraki açılan pencerede, Hü yansıtmak için metni düzenlemekönemlidir ng parametreleri. Netlik için düzenleme yazı tipi, renk ve boyut.
- "Düzenle" menüsüne gidin ve "görünümü anlık oluşturma" ya da "x" tuşuna basın bulabilirsiniz. Bu komut "görünümü anlık" penceresi açılır. Seçin bir 8-bit, RGB, tüm filmden floresan kanalları içeren ihracata hazır dosyası oluşturmak için "Tüm çerçeveler için geçerlidir".
- Çapraz platform uyumluluğu için bir. Avi dosyası olarak kaydedin. Kare başına 200 msn de oynatma hızını ayarlayın. NIS Elemanları tarafından oluşturulan. Avi dosyaları sonra daha fazla istediğiniz dosya türünü içine diğer dönüştürme yazılımı ile sıkıştırılmış olabilir.
Sonuçlar
Anterograd Taşıma
PRV 348 ile ayrışmış SCG kültürlerin enfeksiyonlara Bu protokolün uygulama, GFP-US9 ve gM-mCherry membran füzyon proteinleri ifade eden bir rekombinant PRV gerginlik, virionlar anterograd taşıma (Şekil 3 ve Ek Film 4) ve görselleştirme kolaylaştırmıştır. Puncta taşıma kendi algılama viral parçacıkların sonuçları ve söz konusu görüntüleme koşulları bu füzyon proteinlerin Ortaklığın filtre geçiş sırasında hareket eden bir parçacık her fluorofor ofset en aza indirmek. Üç dakikalık bir görüntüleme penceresinde, çok sayıda taşıma puncta sık görülen ve ko analizler için büyük çaplı hızla oluşturulur. Daha önce GFP US9 arasında ko sayısal sonra, alphaherpes virüs aksonal bu yaklaşım 11 ile diğer yapısal proteinler, protein hedefleme. Diğer çift recombinan Benzer analizlerit PRV suşları da 11 tarif edilmiştir, ve son çalışma bu protokol 21 bir başka uzantısı bir floresan etiketli ana motoru protein ile PRV proteinlerin ortak taşıma belgelemiştir. Hızlı geçiş filtre jantlar ve çift çok geçişli çift renkli aynalar kullanarak iki veya daha fazla floresan kanal hızlı sıralı satın sağlar. Şu anda saniyede 0,8 kareye kadar hızlarda iki kanallı sıralı edinme elde edebilirsiniz. Sadece Kameranın floresan maruz kalma süresi ve okuma-zaman ile sınırlıdır tek kanal video mikroskopi, için, saniyede 6 kare daha fazla satın alma oranları elde edebilirsiniz.
Anterograd Fark
Anterograd yayılmasını olayları görselleştirmek için, ilgi alanları zaman virionların aşağı taşıma ve aksonlar çıkışa, yakındaki epitel hücreleri enfekte hangi sırasında 20 saat süreyle her 5 ila 10 dakika, görselleştirilmektedir. Büyük resim bir temsilci çerçeve vardıra Şekil 4A ve Ek Film 5 'de gösterilmektedir. Aksonlardan primer enfeksiyonun göstergesi floresan protein ifade eden hücreler, mekânsal olarak ayrılmış doğası edin. Enfekte hücrelerin viral enfeksiyon başlatılan floresan capsids görselleştirmek için film boyunca geriye doğru takip edilebilir. Bunlar tek tek hücrelerin büyük bir çerçeve izole edildi ve ayrıntı önemli bir kayıp olmadan takip edilebilir. Ek Film 6 Örnek çerçeve (Şekil 4B) virionların sitoplazmaya floresan kapsid yatıran bir süre sonra göstermektedir.
Veri Analizi
Farklı analiz bir dizi parçacık izleme, ko çalışmaları ve virion yayılması olayların ölçümü de dahil olmak üzere canlı-hücre görüntüleme veri setleri üzerinde gerçekleştirilebilir. Biz sık sık doğrudan NIS Elements yazılımı bizim analizleri yapmak ya da bir plug-in kullanarak kullanılabilir uzantısı Ima içinBu Gej yazılım paketi sağlar. ND2 dosya türü desteği. Farklı hipotezler ve deneysel kurulumları benzersiz analitik yöntemler gerektirmektedir. Grubumuz dinamik yapıları 11,21 ve bireysel parçacık yayılması olaylar 10,12,22 zaman atlamalı miktar üzerinde floresan proteinlerin ko değerlendirilmesi için yöntemler nitelendirdi. Metodolojiler bu yazının içinde tarif ve önceki çalışmalar esnek ve farklı viral enfeksiyonlar gibi hücresel yapıların taşıma, örneğin, mitokondri 23 uygulanabilir.
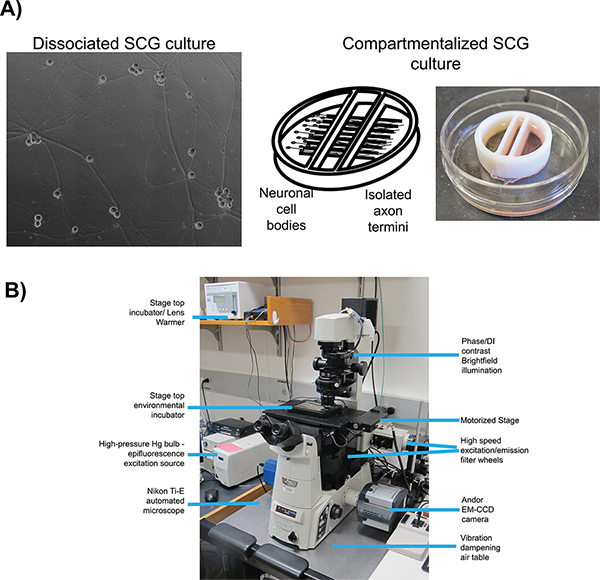
Şekil 1. Mikroskopi şematik canlı hücre görüntüleme için ayarlanmış. A) Kültür türleri ileriye taşıma (ayrışmış) ve ileriye yayılması (odacıklı) sırasıyla çalışmaları için istihdam. Panel 1 olgun bir, ayrışmış Üstün Servikal Ganglia (SCG) bir faz kontrast görüntü. Panel 2 sağ bölmesi. B) ters epifluorescent mikroskop ve kullanılan sahne üst inkübatör yapılandırma içine iç engelleri altında uzanan aksonal projeksiyonlar ile sol bölmesinde kaplama SCG nöronlar ile, panel 3 resimde bölümlere kültür sistemi şematik, bir video mikroskopi deneyler için. büyük rakam görmek için buraya tıklayın .
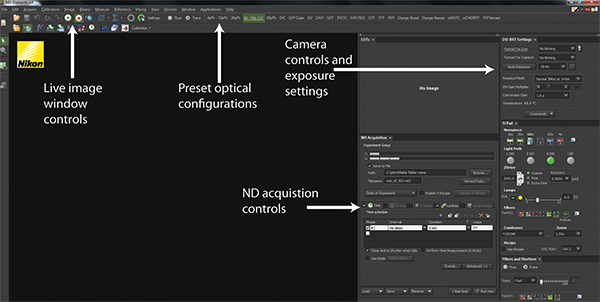
Şekil 2. NIS-Elements yazılımı arayüzü. NIS-Elements standart bir kullanıcı arayüzü bir ekran görüntülenir. Oyun ve Durdur düğmeleri canlı-resim penceresi de şu anda görüntülü olarak ne gibi görüntüleme için mevcut donanım yapılandırmaları gösteren kontrol. Üst paneldeki karşısında önceden donanım se uygulamak Optik Yapılandırmaları bir dizi vardırtrans-ışıklı veya floresan tespiti için mikroskop yapılandırmak için hazrl. Kamera kontrolü ve pozlama ayarları kamera algılama yapılandırma görüntü kalitesi ve hızı optimize etmek için izin verir. Tüm deneyler ND Toplama kontrolleri kullanılarak koordine edilmektedir. büyük rakam görmek için buraya tıklayın .

Şekil 3,. PRV 348 ile 8 saat sonrası enfeksiyon SCG akson hücre görüntüleme Canlı. PRV 348 enfekte nöronlar GFP-US9 ve gM-mCherry membran füzyon proteinleri ifade eder. Distal akson içinde anterograd-taşıma yapıları iki floresan kanal, GFP ve mCherry içinde görüntülendi. Ek Film 4 alınan sıralı görüntü tasvir gibi bir anterograd-taşıma yapısı (beyaz ok) akson içinde ilerler. Iki floresan proteinleri spati vardırittifak floresan kanalları ve viral yapıların hızlı hareket sıralı alımı nedeniyle off-set. büyük rakam görmek için buraya tıklayın .
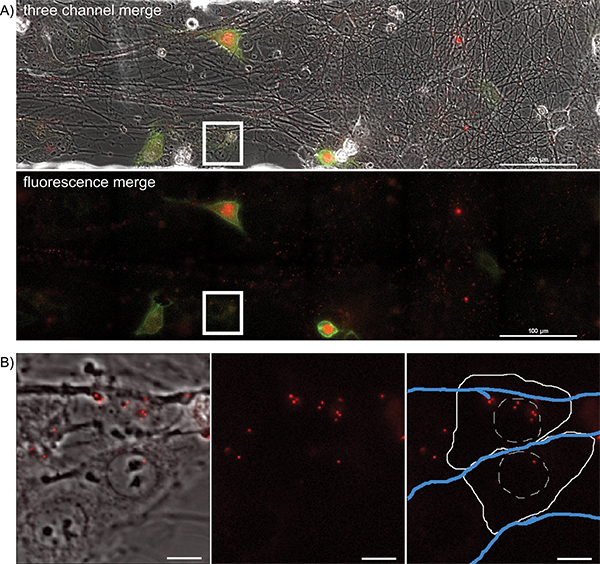
Şekil 4. Bir çok renkli enfeksiyon sırasında epitel hücre kümeleri için enfekte aksonlar ileriye yayılan olaylar gece timelapse görüntüleme. Tek pozisyon, alıcı epitel hücrelere PRV 427 enfekte aksonlar virion iletim büyük görüntü kiremitli zaman atlamalı film Temsilcisi görüntüler. A) alıcı hücreler YFP-CAAX ve VP26-MRFP füzyon proteinleri ifade başlıyor bir zaman sonrası enfeksiyon iletilen, YFP ve TTT floresan görüntülerin bir birleştirilmiş görüntü. İkinci panelde, YFP ve TTT kanalını birlikte gösterilir. MRFP puncta asso çok sayıda notakson yolları ile ilişkilidir. Bu akson içinde uzun mesafe taşımacılığı (Ek Film 2) geçiren monte virionlar vardır. Beyaz kutu) bulaşmasını kapsid meclisleri içeren alıcı epitel hücrelerinin Temsilcisi görüntü (Ek Film ayrıca 3 bakınız) parçası B. B vurgulanan ilgi alanı temsil eder. Panel 1 iletilen ve TTT kanalları bir birleştirme olduğunu. Panel 2 tek başına TTT kanalıdır. Panel 3 şematik hücre anahat (katı beyaz çizgi) gösterimi, çekirdeği (karma beyaz çizgi) ve aksonlar (mavi hat) ile TTT kanalıdır. büyük rakam görmek için buraya tıklayın .
Ek Film 1. Aksonal virionlar hızlı, sıralı edinimi için yazılım ayarları., Pozlama ayarları belirlemek ND satın alma kontrolleri yapılandırma ve hızlı bir çerçeve satın mo edinme ile ilgili adımlaraksonal taşıma geçiren floresan virionlar vie sunulmuştur. SCG nöron kültürü sekiz saat önce görüntüleme PRV 427 ile enfekte oldu. filmi görmek için buraya tıklayın .
Ek Film 2. Yazılım akson-hücre yayılması gecede görüntüleme ayarlarını. Akson-hücre yayılan olaylar gece görüntüleme için ND satın alma kontrolleri yapılandırma ile ilgili adımlar sunulmaktadır. filmi görmek için buraya tıklayın .
Ek Movie 3. Dönüşüm. Prezentabl film biçimleri içine ND2 dosyaları. Ham veri dönüştürme ile ilgili adımlar. Yaygın video oynatıcılar kullanarak sunum için ND2 dosyaları. Avi veya. Mov dosya formatları birine. onu tıklayınfilmi görmek için e.
Ek Film 4. PRV 348 ile 8 saat sonrası enfeksiyon akson SCG hücre görüntüleme Canlı. filmi görmek için buraya tıklayın .
Ek Film 5. Bir akson-hücre yayıldı. Gecede görüntüleme Büyük resim alanı filmi görmek için buraya tıklayın .
Ek Film 6. Bir akson-hücre yayıldı. Gecede timelapse görüntüleme Genişletilmiş alan filmi görmek için buraya tıklayın .
| Zorlanma | Genotip | Yarar |
| PRV 341 | GFP-US9 (membran) / MRFP-Vp26 (kapsid) | Virion taşıma deneyler 11 |
| PRV 348 | GFP-US9 (membran) / gM-mCherry (membran) | Virion taşıma deneyler 11 |
| PRV 427 | MRFP-VP26 (kapsid) / YFP-CAAX (hücresel plazma zarı) | Anterograd yayılma deneyleri 10 |
Tablo 1. Floresan füzyon proteinleri rekombinant Yararlı PRV suşları.
| Ad | Şirket | Katalog numarası |
| 35 mm cam alt kültür çanak | Mattek Kuruluşu; Ashland, MA | P35G-1,5-20-C |
| 35 mm μ-Bulaşık | Ibidi USA LLC, Verona, WI | 81156 |
| Mikroskop vücut | Nikon Instruments Inc | Nikon Eclipse Ti |
| Motorlu mikroskop XY aşamasında | Önce Bilimsel, Rockland, MA | H117 ProScan Flat Top |
| Motorlu filtre çarklarını | Önce Bilimsel | HF110 10 pozisyon filtre tekerleği |
| Floresan aydınlatma kaynağı | Lümen Dynamics, Mississauga, Ontario Kanada | 120Q X-Cite |
| Çok bant Floresan filtre ayarlar | Chroma Technology Corp, Bellows Falls, VT | 89000 Sedat Quad - ET 89006 ECFP / EYFP / mCherry - ET |
| EM-CCD kamera | Andor Teknoloji ABD, Güney Windsor, CT | iXon3 897 |
| Chamlide sahne üst çevresel inkübatör | Hücre Aletleri Canlı, Seoul, Güney Kore | TC-L-10 |
| Objektif lens ısıtıcı | Bioptecs, Butler, Pensilvanya | 150.803 Kontrol150819-12-08 Isıtıcı |
| Analiz yazılımı | Nikon Instruments Inc, Melville, NY | NIS Elemanları |
Tablo 2'de. Özel reaktifler ve ekipman.
Tartışmalar
Bu gözlem eylemi ile önemli değişiklik olmadan ortaya gibi canlı hücre görüntüleme amacı biyolojik süreçleri izlemektedir. Çevre kontrolü, görüntüleme hızı ve floresan aydınlatma: Bu amaç, üç değişken optimize ederek elde edilir. Bu arası bağımlı değişkenler uygun görüntüleme koşulları elde etmek için dengeli olmalıdır. Sunulan protokol temsili sonuçlar üretmek için özel koşullar kullanmaktadır. Biz kısaca sunulan özel yöntemler ayrıntılarına geçmeden önce çevresel kontroller ve gözlemsel zarar tartışacağız.
Mikroskop ilgili biyolojik koşulların oluşturulması ve bakımı hücresel olayların başarılı izlenmesi için çok önemlidir. Hedef koşulları sağlanması mikroskop ve inkübatör yapılandırma özgü değişken bir dizi bağlıdır. Tüm inkübatör ayarları alınan inkübatör sahte bir örnek bağımsız bir sıcaklık ölçümü kullanılarak valide edilmelidirobjektif temas noktası, kültür çanak ortasında ve kültür çanak kenarına; dahil olmak üzere birden pozisyonlarda. Ayarlar 1 'den daha fazla olan alanların en aza indirmek için optimize edilmelidir 37 ° C daha sıcak ° C hem de yakın 37 ° C amacı temas noktasında bir sıcaklık temin edilmesi. Görüntüleme için kullanılan her bir kültür çanak ve objektif yapılandırma test ve deney öncesinde doğrulanması gerekir. İdeal olarak, tüm örnekler görüntüleme sırasında sıcaklık için izlenen, ancak bu sistemleri bir dizi için pratik kanıtlıyor ve biyolojik olarak tehlikeli maddeler istihdam zaman karmaşıktır olacaktır. Kuluçka koşulları Doğrulama artefakt sonuçları veya hızlı hücresel bozulma neden olabilir çok düşük veya sıcaklık çok yüksek numune kuluçka gibi, önemlidir.
Belirlenmesi ve gözlemsel hasar kaynaklanan sonuçları en aza indirmek protokol geliştirme için önemlidir. Sık aydınlatma biyolojik süreçler, IRR değiştirebilireversibly floresan moleküller inaktive veya hücresel ölüm yollarının bir dizi neden. Sıcaklık doğrulama standart bir doku kültürü kuluçka edilenlere benzer aşamada üst biyolojik olarak benzer koşullar üretmek için önemlidir. Sık aydınlatma etkilerini kontrol daha zor ve çoğu zaman deneme yanılma uygulamaları tekrarlanan gerektirir. Morfolojik farklılıklar ya da biyolojik ilgili değişiklikler için doku kültürü inkübatör muhafaza paralel örnekleri karşılaştırarak belirleyebilirsiniz önemli hücresel toksisite canlı-hücre görüntüleme koşulları sonuçlar eğer. Burada anlatılan deneylerde, hücreler arasında viral yayılma viral titresi hem de kapsamı ile viral enfeksiyonun verimliliği takip var.
Akson içinde hızlı ulaşım gerçek zamanlı görüntüleme elde floresan aydınlatma yoğunluğu yanında görüntü elde etme hız optimizasyonu gerektirir. Görüntü elde etme hızının camer tarafından belirlenirsırayla birden fazla floresan kanal toplama özellikle ayarları ve mikroskop donanım,. Işık yoğunluğu floresan sinyallerin kalitesi ve satın alma oranını etkiler. Büyükşehir aydınlatma yoğunluğu özellikle küçük miktarlarda parçacıklar içine dahil olanlar için floresan proteinlerin daha kolay görselleştirme, sağlar. Ancak, örnek gelişmiş fototoksik hasar çamaşır suyu daha hızlı ve acı olacak. Nötral yoğunluk filtreleri ile aydınlatma azaltılması görüntü elde etme sıklığını azaltmak ve potansiyel olarak algılama sırasında hareketi nedeniyle floresan yapıların mekansal deformasyon neden, uzun pozlama süreleri gerektirir. Görüntü elde etme sıklığı ile aydınlatma yoğunluğu doğru dengeyi bulmak floresan protein sinyal ve çalışılan yapının motilite oranı büyük ölçüde bağlıdır. Bu arka plan üzerinde floresan yapıları ayırt etmek için yeterli sinyal elde etmek yerine, yapılması gereken tek şeyuzun pozlama süreleri gerektiren yüksek kontrastlı görüntüler üretir.
Gecelik timelapse görüntüleme gerçek zamanlı canlı hücre görüntüleme gibi benzer bir donanım yapılandırmasına kullanır ancak önemli ölçüde uzun vadeli, sık floresan aydınlatma ile ilgili birikmiş foto-hasar etkilenir. Gerçek zamanlı görüntüleme aksine, floresan aydınlatma yoğunluğu sınırlamak için gerek her şeyden önemlidir, ve diğer tüm değişkenler bu kısıtlama için hesaba değiştirilir. Maruziyetin yoğunluğu önemli ölçüde sınırlandırılması görüntülü hücrelere zarar vermeden çok flüoresan kanalları daha sık aydınlatma sağlar. Anterograd akson-hücre yayılması olaylar zamansal ve mekansal farklı olan, görüntüleme geniş bir alanda mümkün olduğunca bu nadir olaylar gibi birçok yakalamak için önemlidir bu yüzden.
Yayınların bir dizi canlı hücre görüntüleme uygulamaları 24-26 için kapsamlı genel bilgileri ve öneriler hazırladık. Burada ayrıntılı protokoller represent viral enfeksiyon temel özellikleri koruyarak viral replikasyon, ulaşım, ve yayılması floresan görüntüleme etkisini en aza indirmek için elimizden geleni girişimleri. Floresan füzyon proteinleri ve sağlam nöronal kültürlerin dikkatli gelişimi ile bu protokolleri birleştiren herpes enfeksiyonu ve patogenezi benim temel sorular yanıtladı.
Açıklamalar
Biz ifşa hiçbir şey yok.
Teşekkürler
LWE ve RK Sağlık hibe R37 NS033506-16 ve R01 NS060699-03, ABD Ulusal Sağlık Enstitüleri tarafından desteklenmektedir. MPT bir Amerikan Kanser Derneği Doktora Sonrası Araştırma Bursu (PF-10-057-01-MPC) tarafından desteklenmiştir. Dr Matthew Lyman ve Dr Oren Kobiler bir tavsiye ve bilgi mikroskop yapılandırma ve canlı hücre görüntüleme yöntemleri tasarımında etkili olmuştur. Ayrıca mikroskop satın alma, kurulum ve performans teknik yardım için Neal Barlow ve Nikon Araçların Brian T. Kain için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Name | Company | Catalogue number | |
| 35 mm glass bottom culture dish | MatTek Corporation; Ashland, MA | P35G-1.5-20-C | |
| 35 mm μ-Dish | Ibidi USA LLC, Verona, WI | 81156 | |
| Microscope body | Nikon Instruments Inc. | Nikon Eclipse Ti | |
| Motorized microscope X-Y stage | Prior Scientific; Rockland, MA | H117 ProScan Flat Top | |
| Motorized filter wheels | Prior Scientific | HF110 10 position filter wheel | |
| Fluorescent illumination source | Lumen Dynamics; Mississauga, Ontario Canada | X-Cite 120Q | |
| Multi-band Fluorescence filter sets | Chroma Technology Corp.; Bellows Falls, VT | 89000 Sedat Quad - ET 89006 ECFP/EYFP/mCherry - ET | |
| EM-CCD camera | Andor Technology USA; South Windsor, CT | iXon3 897 | |
| Chamlide stage top environmental incubator | Live Cell Instruments; Seoul, South Korea | TC-L-10 | |
| Objective lens heater | Bioptecs; Butler, PA | 150803 Controller 150819-12-08 Heater | |
| Analysis software | Nikon Instruments Inc.; Melville, NY | NIS Elements |
Referanslar
- Johnson, D. C., Baines, J. D. Herpesviruses remodel host membranes for virus egress. Nature reviews. Microbiology. 9 (5), 382-394 (2011).
- Mettenleiter, T. C., Klupp, B. G., Granzow, H. Herpesvirus assembly: a tale of two membranes. Current Opinion in Microbiology. 9 (4), 423-429 (2006).
- Saksena, M. M., Wakisaka, H., et al. Herpes simplex virus type 1 accumulation, envelopment, and exit in growth cones and varicosities in mid-distal regions of axons. Journal of Virology. 80 (7), 3592-3606 (2006).
- Snyder, A., Wisner, T. W., Johnson, D. C. Herpes Simplex Virus Capsids Are Transported in Neuronal Axons without an Envelope Containing the Viral Glycoproteins. Journal of Virology. 80 (22), 11165-11177 (2006).
- Snyder, A., Polcicova, K., Johnson, D. C. Herpes simplex virus gE/gI and US9 proteins promote transport of both capsids and virion glycoproteins in neuronal axons. Journal of Virology. 82 (21), 10613-10624 (2008).
- Tomishima, M. J. A conserved alpha-herpesvirus protein necessary for axonal localization of viral membrane proteins. The Journal of Cell Biology. 154 (4), 741-752 (2001).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. G. Immunolabeling artifacts and the need for live-cell imaging. Nature Methods. 9 (2), 152-158 (2012).
- Kratchmarov, R., Taylor, M. P., Enquist, L. W. Making the case: Married versus Separate models of alphaherpes virus anterograde transport in axons. Reviews in Medical Virology. 22 (6), 378-391 (2012).
- Antinone, S. E., Smith, G. A. Two modes of herpesvirus trafficking in neurons: membrane acquisition directs motion. Journal of Virology. 80 (22), 11235-11240 (2006).
- Del Rio, T., Ch'ng, T. H., Flood, E. A., Gross, S. P., Enquist, L. W. Heterogeneity of a fluorescent tegument component in single pseudorabies virus virions and enveloped axonal assemblies. Journal of Virology. 79 (7), 3903-3919 (2005).
- Taylor, M. P., Kramer, T., Lyman, M. G., Kratchmarov, R., Enquist, L. W. Visualization of an alphaherpesvirus membrane protein that is essential for anterograde axonal spread of infection in neurons. mBio. 3 (2), (2012).
- Taylor, M. P., Kobiler, O. Alphaherpesvirus axon-to-cell spread involves limited virion transmission. Proceedings of the National Academy of Sciences. , (2012).
- Kobiler, O., Brodersen, P., Taylor, M. P., Ludmir, E. B., Enquist, L. W. Herpesvirus replication compartments originate with single incoming viral genomes. mBio. 2 (6), (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nature Methods. 2 (12), 905-909 (2005).
- Snapp, E. L. Fluorescent proteins: a cell biologist's user guide. Trends in Cell Biology. 19 (11), 649-655 (2009).
- Ch'ng, T. H., Flood, E. A., Enquist, L. W. Culturing primary and transformed neuronal cells for studying pseudorabies virus infection. Methods in molecular biology (Clifton, N.J.). , 292-299 (2005).
- Curanovic, D., Ch'ng, T. H., Szpara, M., Enquist, L. Compartmented neuron cultures for directional infection by alpha herpesviruses. Current protocols in cell biology. Chapter 26 (Unit 26.4), (2009).
- Zareen, N., Greene, L. A. Protocol for culturing sympathetic neurons from rat superior cervical ganglia (SCG). J. Vis. Exp. (23), e988 (2009).
- Ch'ng, T. H., Enquist, L. W. Neuron-to-Cell Spread of Pseudorabies Virus in a Compartmented Neuronal Culture System. Journal of Virology. 79 (17), 10875-10889 (2005).
- Campenot, R. B., Lund, K., Mok, S. -. A. Production of compartmented cultures of rat sympathetic neurons. Nature Protocols. 4 (12), 1869-1887 (2009).
- Kramer, T., Greco, T. M., Taylor, M. P., Ambrosini, A. E., Cristea, I. M., Enquist, L. W. Kinesin-3 Mediates Axonal Sorting and Directional Transport of Alphaherpesvirus Particles in Neurons. Cell Host & Microbe. 12 (6), 806-814 (2012).
- Smith, G. A., Gross, S. P., Enquist, L. W. Herpesviruses use bidirectional fast-axonal transport to spread in sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 98 (6), 3466 (2001).
- Kramer, T., Enquist, L. W. Alphaherpesvirus Infection Disrupts Mitochondrial Transport in Neurons. Cell Host & Microbe. 11 (5), 504-514 (2012).
- Swedlow, J. R., Platani, M. Live cell imaging using wide-field microscopy and deconvolution. Cell Structure and Function. 27 (5), 335-341 (2002).
- Kaech, S., Huang, C. F., Banker, G. Short-Term High-Resolution Imaging of Developing Hippocampal Neurons in Culture. Cold Spring Harbor Protocols. 2012 (3), (2012).
- Frigault, M. M., Lacoste, J., Swift, J. L., Brown, C. M. Live-cell microscopy - tips and tools. Journal of Cell Science. 122 (6), 753-767 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır