Method Article
Alphaherpesウイルス順行性輸送とスプレッドの生細胞イメージング
要約
alphaherpesウイルス感染のライブセルイメージングに向け輸送と細胞間スプレッドの動的事象の分析を可能にします。ここでは、一次ニューロンのウイルス感染中にアセンブリの可視化を容易にするために、蛍光融合タンパク質を発現する組換えウイルス株を利用する手法を提案する。
要約
生細胞の蛍光顕微鏡技術と同様に、蛍光融合タンパク質を発現する組換えウイルス株の構築の進歩は、輸送およびニューロンのalphaherpesウイルス感染の広がりのリアルタイム可視化を有効にしている。ライブセルイメージングと一緒にウイルス膜、被包、およびキャプシドに新規蛍光融合タンパク質の有用性は、軸索内輸送を受けてウイルス粒子アセンブリを同定した。同様のツールが正常細胞との間で送信さビリオンの数と多様性を定量化するウイルス粒子の広がり細胞 - 細胞の分析に用いられてきた。重要なのは、順行性輸送と普及のライブセルイメージングの技術は、粒子輸送速度、粒子の分布、およびタンパク質の局在の時間的分析を含む豊富な情報を生成します。古典的なウイルスの遺伝子技術と並んで、これらの方法論は、重要な洞察を提供してきた重要な機械論的な質問へ。この記事では、詳細にalphaherpesウイルス輸送と広がりの基本的な質問に答えるために開発された撮像法について説明します。
概要
alphaherpesなどの単純ヘルペスウイルスなどのウイルス(HSV)-1、-2、および仮性狂犬病ウイルスによる末梢神経系(PNS)の感染(PRV)ウイルスのライフサイクル全体を通じて、いくつかの複雑かつ高度に規制の手順が必要。 PNSの神経細胞内の輸送は、プライマリウイルス感染とその後のホスト間の広がりの両方のイベント中に、非常に重要です。ウイルスのライフサイクルの二つの成分を調節する分子機構、感受性細胞へ離れて軸索内の細胞体(順行性輸送)からのウイルスアセンブリの監督輸送とビリオンのその後の送信(順行スプレッド)はヘルペスウイルスの病因を理解する上で重要です。
神経細胞におけるウイルス粒子の輸送と出口は、成熟感染性ビリオン1,2のアセンブリに依存しています。免疫蛍光法(IF)および電子顕微鏡(EM)を含む予め固定されたアッセイは、粒子の組立て状態とprotのを研究するために使用されたビリオン輸送と広がり3-6関連付けられたEINの相互作用。しかし輸送ビリオンおよび化学固定によって導入された実験的な成果物の動的な性質は、固定された画像7,8の解釈を混同。最近、ウイルスの蛍光融合タンパク質の数は、タンパク質の機能にほとんど影響を与えるHSVおよびPRVについて記載されている。キャプシド、被包、および糖タンパク質9-11:緑色蛍光タンパク質(GFP)及びレッド蛍光タンパク質(mCherryまたはmRFPを)フルオロフォアは、しばしば、成熟ビリオンの3つの構造構成要素のうちの2つの撮像を可能にするように対になっている。二重標識ウイルスを用いた順行性輸送の生細胞イメージングは輸送中のウイルス粒子の組立て状態を可視化する。ウイルス株を発現する同様の蛍光体は、数および拡散12,13に続くウイルスゲノムの多様性を可視化するために使用される。蛍光タンパク質の特性は(14,15で検討)が大きく影響しウイルスまたは細胞のアセンブリを視覚化する能力。野生型の機能性の保全のための新規なタンパク質融合を設計し、テストするときに、自己相互作用と安定性を含む蛍光タンパク質、、の本質的な特性を考慮する必要があります。
蛍光タンパク質融合と組み合わせて、二人はインビトロでの細胞培養系において十分に特徴付けヘルペスウイルス感染の生細胞のイメージングのために使用される( 図1A)16解離し、17区画ラット上頸神経節(SCG)ニューロン。両方のシステムでは、胚のSCGのは、単一の細胞体への解離、解剖され、in vitroで培養する18のためにメッキ。 SCGニューロンは、自律神経系の一部であり、容易に成熟した偏光状態を ex vivoで培養し、神経細胞への成長因子(NGF)によって区別することができる。解離SCGニューロンは、Fを可能に軸索の拡張されたネットワークを形成彼らは順行性輸送6を受けるようにウイルス粒子のか視覚化。区分SCG文化が神経細胞体(S区画)および遠位軸索末端(Nコンパートメント)19の流体分離を提供。原稿20又は変性Campenotチャンバ17を用いて区画ニューロンの構造及び使用のための詳細なプロトコルの数は、以前に公表されている。流体分離は、神経細胞体と孤立軸索末端への輸送後の子孫ビリオンの検出を選択的に感染することができます。感染前末端上の上皮細胞をメッキするとウイルス感染の広がりのためにレシピエント細胞を提供する。
そこにすべてのライブセルイメージング実験のための重要な多くの重要な要素がありますが、我々のプロトコルに最も関連性があります:自動画像取得、蛍光灯照明、画像処理の速度、および環境制御。すべてのイメージング実験のために、我々が使用する反転、自動化され、落射蛍光照明顕微鏡( 図1B)。顕微鏡はニコンエクリプスTiの基盤を中心に構築され、急速に再構成する自動画像取得中に顕微鏡を、コンピュータ制御電動システムの数を採用しています。蛍光照明のために、我々は、照明経路に沿って中性密度フィルタを減衰させることができる広域スペクトル水銀アークランプを使用する。励起フィルタは、蛍光照明のスペクトルを制限し、マルチパスダイクロイックミラーと蛍光発光フィルター特定の蛍光化合物を可視化と組み合わせた場合。励起および発光フィルターが異なる蛍光チャネルの急速順次取得を可能にするために独立した、高速スイッチングフィルターホイールに取り付けられている。画像取得速度が低い強度信号と短い画像の検出のための読み取り時間を有用な、高感度かつ高速のEM-CCDカメラではさらに向上する。 microsc上の環境制御OPEをインキュベーター加熱ステージ上と加湿CO 2に富んだ雰囲気をインキュベーターに渡されながら高温で試料を保持する対物レンズヒーターで達成される。顕微鏡は近い25までのすべての窓に遮光カーテンで最小化℃、外光を維持し、周囲温度と暗い部屋に保管されています。以下のプロトコルでは、順行性輸送及び拡散アッセイのための本システムの使用を記載している。
選択肢の数は、ライブセルイメージングの変数をコントロールするために存在します。顕微鏡の制御設定は、手動またはプロプライエタリ·ソフトウェアに依存して自動化システムを介して行うことができる。蛍光照明は、ハロゲン、LEDまたはレーザーソースで実現することができる。イメージング速度は、フィルタ切り替えの速度および一対の検出系と信号を可視化する時間によって修正される。環境制御は、マイルに専用のハードウェアで実現することができますcroscopeステージ全部または加熱および加湿ボックスで顕微鏡の一部、または顕微鏡検査が実行される部屋の温度を上げることによってのエンクロージャ。これらの選択肢の各々は、コストおよびパフォーマンスに関連する利点と欠点を有する。
その後のプロトコルでは、我々は詳細換えウイルス株を使用することにより迅速な順行性輸送とalphaherpesウイルスの順行広がりを研究するライブセルイメージングを使用すること。リアルタイムのライブセルイメージングは軸索11内輸送を受けて動的構造体上のカプシド、被包、および/ または糖タンパク質の共局在を可視化する。区分ニューロン培養の一夜タイムラプスイメージングは、感受性細胞の軸索のビリオン出口と感染12を可視化する。ここで提示プロトコルは、我々の特定のイメージング·システムと共に使用するために最適化されているが、生細胞のイメージングの四つの要素に対して大まかに示されている。議論では、私たち更に詳細は成功実験のために必要である最適化のいくつかの意志。
プロトコル
セクション1 - ライブセル蛍光顕微鏡のための環境制御条件
- 任意のイメージング実験前に30分接続し、顕微鏡ステージトップインキュベーターを温め始める。
- 顕微鏡、透過および落射蛍光光源、および自動化されたハードウェアコントロールをオンにします。顕微鏡に接続し、EM-CCDカメラの冷却を開始する顕微鏡制御ソフトウェア、NISの要素を開く。
- 適切な目標(どちら60Xまたは100X油浸)に暖かいレンズを取り付け注:実験の種類に基づいて対物レンズを選択します。 60X相目的は順行性の広がりを可視化するために適している間100X微分干渉コントラスト(DIC)は、順行性輸送ビリオンアセンブリの追跡のために最適です。彼らはサンプルに直接接触しないように低倍率、非油浸対物レンズは、レンズが暖かい必要としません。
- マイルの電動ステージ上にステージ天インキュベーターを取り付け croscope。サンプルが所定の位置にある保持する適切な挿入を確認してください。インキュベーターコントロールからステージトップインキュベーターの入力ポートに加湿空気ラインを取り付けます。
- インキュベーターとレンズ暖かいコントロールをオンにして、撮像されている客観的サンプルの特定以前に検証条件に温度設定を調整(説明を参照してください)。
- トップインキュベーターを上演するためにCO 2補足空気を提供するために、5%CO 2/95%大気のタンクに制御バルブを開きます。流量は毎分ガスの60〜80ミリリットルであるべきである。速い速度は、加湿チャンバーにもかかわらず、大規模なサンプルの脱水になります。
- 対物レンズにレンズオイルを追加し、すぐにステージ天インキュベーターに結像される文化を配置。
- 10分の最低文化の中での温度の平衡を許可します。一時間は、特に第3章で述べた一晩イメージングのため、好ましい。
- 6〜8時間前のイメージングに、テイラーらに記載された方法を使用して興味のあるウイルスの1×10 6プラーク形成単位を持つ成熟した、解離SCGニューロンの35ミリメートルカバースリップボトムディッシュ(例:ウイルスについては、表1を参照)感染ら 2012A 11。複数のウイルスをテストする場合は、30〜60分間でオフセット接種は、同様の回感染後に、順次サンプルのイメージングを可能にするために。
- どんな実験を実行する前に、10分の最低限の舞台トップインキュベーターに皿を挿入します。温度が平衡しながら、焦点面がシフトしていると否定的に任意のイメージング実験に影響を与えます。
- 透過光、顕微鏡の接眼レンズを使用して、はっきりと分離された軸索の拡張子を持つ神経細胞体を見つける。また、検出を発現する細胞を見つけることが、適切な蛍光照明を使用蛍光タンパク質の表の金額。それがために、光誘起される細胞の損傷のと蛍光タンパク質の漂白、このステップとその後のステップで、蛍光灯照明にサンプルの露出を制限することが重要である。
- 細胞が暴露される励起光の強度を低減する蛍光照明を減衰させる。蛍光照明光路中の中性密度(ND)フィルターを減衰させる光を従事。 1分よりも長く持続するムービーでは、ND4の最小は、光漂白蛍光タンパク質と軸索の光損傷広範囲を防ぐために使用しなければなりません。高い蛍光の構造は、一般的な場所にND8フィルターで可視化することができます。
- 顕微鏡ソフトウェア( 図2及び補足作品1A)を使用して、EM-CCDカメラへの光路を切り替える。
- 各蛍光チャネルに最適な画像処理時間と条件を決定する。
- "プレイ"ボタンを使用したライブ画像ウィンドウを開始します
- 各蛍光タンパク質のための最適なカメラの露出設定を決定します。高速移動ビリオン構造の運動収差が発生するようにチャネルあたり300ミリ秒を超えないようにしてください。 (メーカーが最大利得を示唆)、露光時間を短縮し、薄暗い信号の検出を強化するために300の設定にカメラのEMゲインを利用する。適正露出時間は、低いバックグラウンド強度の高い特定の信号で画像を生成する必要があります。
- エクスポージャーを設定し、軸索の明確に定義された領域を発見した後、ソフトウェアは、自動画像取得を実行するように構成されなければならない。漂白サンプルを防ぐために、ライブイメージングウィンドウを停止します。
- NISの要素ソフトウェアで、6Dを選択-定義/ダウンメニュー"アプリケーション"ドロップダウンから実験アプリケーションを実行します。
- ND取得ウィンドウで、画像取得の頻度を決定するであろう時間]タブをクリックします。 "遅延なし"と時間5分にする間隔を設定します。木曜日電子ソフトウェアは、5分間の間、可能な限り高い周波数で画像フレームを取得する。
- 複数の蛍光画像取得のために使用され、あらかじめ設定ハードウェア構成の選択を可能にする "ラムダ"のタブを選択します。最初のボックスをクリックし、メニューダウン続くドロップ適切なハードウェア構成を選択する。撮像されるすべての蛍光タンパク質について、この手順を繰り返します。
- "XY体位"、 "Zシリーズ"と "大画像"のタブが非選択であることを確認してください。
- タブの上に、マークされたボックスが自動的に取得中にハードディスクに画像を保存するには、 "ファイルに保存"を選択します。実験出力ファイルの場所とファイル名を設定する。シーケンシャルな実験が行われたように、ソフトウェアは、指定されたファイル名の末尾に連番が追加されます。
- 一度にすべてのタブが選択されています。 "実行今"ボタンをクリックして実験を開始します。
- 露出設定を介して画像取得速度を最適化し、IMAGEサイズ。イメージ可能領域の小さな領域を使用すると、多くの場合、フレーム取得率をスピードアップします。 25%、総画像面積の50%との間の領域を選択して、NIS-ElementsでROIツールを使用して、関心領域を定義する。あるいは、より短い露光時間がフレーム取得速度を増加させるが、信号の品質を低下させる(議論を参照)になる。
セクション3 - 順行スプレッドイベントの晩タイムラプスイメージング
- イメージングの前に四時間は、35ミリメートルμ-ディッシュ上に構築区画神経文化に感染。テイラーらに記載された方法を使用して(たとえば、ウイルスについては、表1を参照)興味のあるウイルスの1×10 6プラーク形成単位と神経細胞体を接種する。2012B 12。
- ゆっくりステージトップインキュベーターに培養皿を置きます。目的の位置が皿の側に設定されていることを確認。ゆっくり焦点、ensurに目的を持って目的をINGは、サンプルに押し上げていません。フォーカスフィールドが識別されると、徐々に軸索コンパートメントの内部側に境界を定める内部障壁の近傍に、皿の中心に対物レンズを移動させる。移動中に、焦点深度が維持されていることを確認し、試料中に押し上げ避ける。目的によってプラスチック表面のたわみは、軸索とプラスチックが破損します。
- 暖かいの約2 mlを加え(〜37°C)、リン酸はテフロンリングの外で培養皿に緩衝生理食塩水。これは、サンプル脱水を最小限に抑え、断熱を提供するために、PBSのリングと神経細胞培養物を取り囲んでいる。
- 温度が自動化された画像取得(3.8)を開始する前に1時間の最小平衡化することができます。 3.7〜ステップ3.5は、この期間中に設定することができます。
- すべてのNDフィルターを係合することにより、可能な限り低いレベルに照明の強度を制限します。これは、頻繁な画像取得がオベできるようになります過度の光損傷せずにrを長期間。照明を減らすことは(説明を参照してください)より長い露光を必要とする、低信号になります。
- 歴史的な露出設定を使用するか、前に実験のセットアップ2.5節で説明したように露出設定を確立するために、ターゲットの蛍光タンパク質を発現する感染上皮細胞のパラレルディッシュを生成します。
- 必要なチャネルに対してエクスポージャーを設定した後に、自動化された画像取得用のソフトウェアを構成するための時間である。漂白サンプルを制限するために、ライブイメージングウィンドウを停止します。
- 要素ソフトウェア( 図2および補足映画の2)において、6Dを選択- ND集録ウィンドウを表示するためにダウン"アプリケーション"ドロップダウンメニューから実験アプリケーションを定義/実行します。
- ND取得]ウィンドウで、[時間]タブをクリックします。 "5分"の間隔を設定します。 20時間の時間を設定します。ループフィールドが自動的にPROGRA繰り返し数について計算されるmは、実行されます。
- "ラムダ"タブを選択します。最初のボックスをクリックし、メニューダウン続くドロップ位相コントラストのための適切なラムダ構成を選択します。撮像される各蛍光タンパク質の適切な設定を選択すると、その後のポジションのために繰り返します。
- ビューの単一のより大きなフィールドに結合される複数の画像のパラメータを決定する "大画像"タブを選択します。良いサイズの面積は7%ステッチのオーバーラップを使用して5×2の画像で構成されています。これは、画像取得の周波数に影響を与えずに撮像される位置当たりのセル数の最大値を可能にする。また、 "ステージ移動中に閉じるアクティブシャッター"のチェックボックスを選択解除します。このオプションでは、画像間のシャッターを閉じていないことで買収の速度を向上させます。
- 順次一夜映画の過程で並行して画像化される複数の位置を識別するために、 "XY体位"タブを選択します。中心Poを定義する位置を選択してくださいそれぞれの大きな画像領域のint型。試料中に6-8画像位置を選択します。良好な画像領域は、明確に定義された軸索に近い並置内のセルの小さなクラスターを有する。細胞は最小化されるべきで互いに軸索同梱の上に積まれてはいけません。ピント位置は、細胞の核である。明確に定義された核膜は細胞の大多数のために見られるような目標を置きます。
- "Zシリーズ"のタブの選択が解除されていることを確認。
- セクション2.6.5に上記のような自動保存機能を設定します。
- "1時間のループ"をクリックすることで、露出や位置の設定をテストします。透過光照明、フォーカス、フレーミングの結果の画像を評価します。焦点がずれている場合は、XY]タブの下に、それぞれのポジションにフォーカスをリセットします。 10分待って、フォーカスが安定するまで、この手順を繰り返します。
- すべての設定が検証され、テストされた後、 "今すぐ実行"ボタンをクリックすることで、自動化された実験を開始する。
セクション4 - 画像処理とエクスポート
データのエクスポート
- 輸送やスプレッドのイベントのライブセルイメージングの間に得られたデータセットは、プレゼンテーションや出版物(補足ムービープレビュー3)後で使用するために一般的に使用されるファイルタイプにNISの要素ソフトウェアからエクスポートする必要があります。エクスポートするには映画はNISの要素に適切なRAW。ND2ファイルを開いて、目的の蛍光チャンネルを視覚化する "スプリット·コンポーネント"ビューを選択します。適切な速度で再生ファイル;毎秒5フレームは、高速輸送の可視化のための良い出発点です。
- 動画再生中にリアルタイムクロックを表現するためにタイムスタンプが含まれています。画像を右クリックして、選択して、ND-情報を追加します。デジタルカウンターは、左上隅に表示されます。
- 情報を表示するには、タイムスタンプを編集します。右カウンターの上にクリックし、[Edit] ND-情報を選択します。その後のポップアップウィンドウで、イマジを反映するためにテキストを編集重要なパラメータはNG。わかりやすくするためにフォント、色、サイズを編集します。
- "編集"メニューに移動し、 "ビューのスナップショットを作成します"または "X"キーを押して見つける。このコマンドは、 "ビューのスナップショット"ウィンドウが開きます。 8ビットを生成するために、RGB、ムービー全体からの蛍光チャンネルを含むエクスポート対応ファイル "すべてのフレームに適用"を選択します。
- クロスプラットフォーム互換性のために。aviファイルとして保存します。フレームあたり200ミリ秒で、再生速度を設定します。 NISの要素によって生成された。aviファイルは、その後、さらに目的のファイルの種類に他の変換ソフトで圧縮することができます。
結果
順行性輸送
PRV 348と解離SCG文化の感染症にこのプロトコルのアプリケーションでは、GFP-US9とGM-mCherry膜融合タンパク質を発現する組換えPRV株は、ビリオンの順行性輸送( 図3及び補足作品4)の可視化を促進してきた。涙点を輸送する上でそれらの検出でウイルス粒子の結果、および前述の撮像条件にこれらの融合タンパク質の取り込みは、フィルタ切替時の移動粒子の各蛍光体のオフセットを最小限に抑えます。 3分間の映像ウィンドウでは、多数の輸送涙点は、一般的に観察されると共局在解析のための大規模なサンプルサイズが急速に生成されます。我々は以前、このアプローチ11を使用して他の構造タンパク質で、タンパク質を標的alphaherpesウイルスは軸索、GFP-US9の共局在を定量化している。他のデュアルrecombinan同様の分析tのPRV株はまた11に記載されており、最近の研究は、このプロトコル21のさらなる拡張で蛍光標識ホストモータータンパク質とPRVタンパク質の共輸送を文書化している。高速スイッチングフィルターホイールとペアになってマルチパスダイクロイックミラーを利用するには、2つ以上の蛍光チャネルの急速な逐次取得することができます。我々は現在、毎秒0.8コマの速度で2チャネルの順次取得を達成することができます。カメラのみの蛍光露光時間と読み出し時間によって制限される単一チャネルのビデオ顕微鏡のために、我々は、毎秒6コマを超える捕捉率を達成することができる。
順行スプレッド
順行スプレッドイベントを視覚化するために、関心のある分野は、時間ビリオンがダウンして輸送し、軸索からの出力、近くの上皮細胞に感染される時に20時間の期間ごとに5〜10分、可視化されています。大きな画像から代表的なフレームです図4Aおよび補足ムービー5に示されている。軸索からの一次感染を示す蛍光タンパク質を発現する細胞の空間的に分離された性質に注意してください。感染した細胞は、ウイルス感染を開始した蛍光キャプシドを可視化する映画の中に後方追跡することができる。これらの個々のセルは、大きなフレームから単離し、細部の有意な損失なしに追跡することができる。 補足作品6から代表フレーム( 図4B)は、ビリオンが細胞質に蛍光カプシドを堆積した後の時間を示しています。
データ解析
異なる分析の範囲は、粒子の追跡、共局在研究、ビリオン拡散現象の定量化を含む、生細胞イメージングデータセットを行うことができる。私たちはしばしば、直接NISの要素ソフトウェアで我々の分析を実行するか、いまのために利用可能なプラグイン拡張を利用。ND2ファイルタイプのサポートを有効にGEJソフトウェアパッケージ。別の仮説と実験のセットアップは、ユニークな分析法が必要となる。当社グループは、動的構造体11,21と、個々の粒子の拡散イベント10,12,22のタイムラプス定量に蛍光タンパク質の共局在を評価するための方法を説明した。方法論は、この原稿に説明し、我々の以前の研究では、柔軟であり、ミトコンドリア23 例えば 、異なるウイルス感染と同様、細胞構造の輸送に適用することができます。
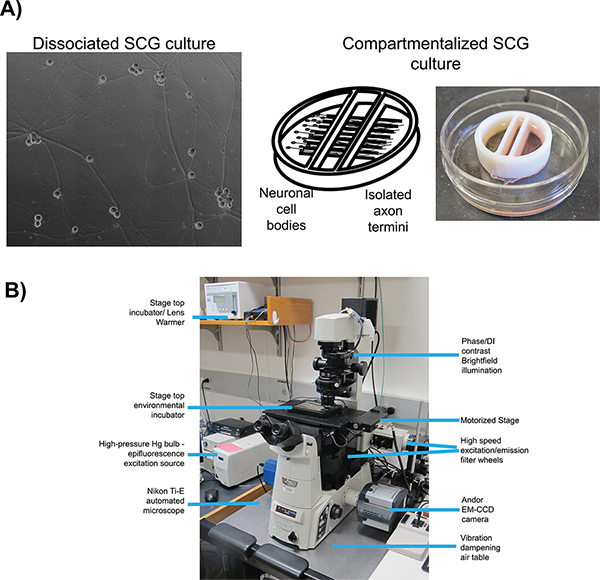
図1。顕微鏡の概略は、ライブセルイメージングのために設定。 A)文化タイプは順行性輸送(解離)と順行スプレッド(チャンバー)は、それぞれの研究のために採用した。パネル1は、成熟し、解離した優れた子宮頸神経節(SCG)の位相コントラスト画像である。パネル2は右端コンパートメントに内部障壁の下に延長軸索突起の左の区画に播種SCGニューロンとパネル3に描かコンパートメント文化システムの概略、、である。B)倒立落射蛍光顕微鏡とステージトップインキュベーターの設定が使用さビデオ顕微鏡実験のため。 大きい数字を表示するには、ここをクリックしてください 。
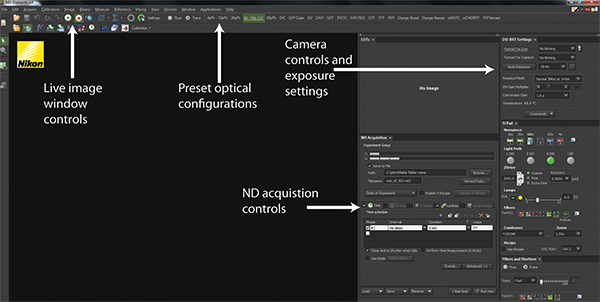
図2。 NIS-要素ソフトウェアインタフェース。NIS-Elementsで標準のユーザーインターフェイスのスクリーンショットが表示されます。プレイとストップボタンは、イメージングと同様に現在撮像されているもののために、現在のハードウェア構成を描いたライブ画像ウィンドウを制御します。トップパネル全体にプリセットハードウェア自体を実装する光学構成のシリーズですトランス照明や蛍光検出用の顕微鏡を構成するためのttings。カメラ制御や露出の設定は、画像の品質および速度を最適化するために、カメラの検出の構成を可能にする。全ての実験は、ND取得コントロールを使用して調整されます。 より大きい数字を表示するには、ここをクリックしてください 。

図3。 PRV 348と8時間後の感染でSCG軸索の細胞イメージングを生きる。PRV 348感染したニューロンがGFP-US9とGM-mCherry膜融合タンパク質を発現する。遠位軸索内で順行性輸送構造は、2つの蛍光チャンネル、GFPとmCherryで可視化する。補足ムービー4から取ら連続画像に示されているように順行性輸送構造(白い矢印)が軸索内で進行する。 2つの蛍光タンパク質はspatiです同盟蛍光チャネルとウイルス構造の急速な動きの連続取得のためにオフに設定します。 大きい数字を表示するには、ここをクリックしてください 。
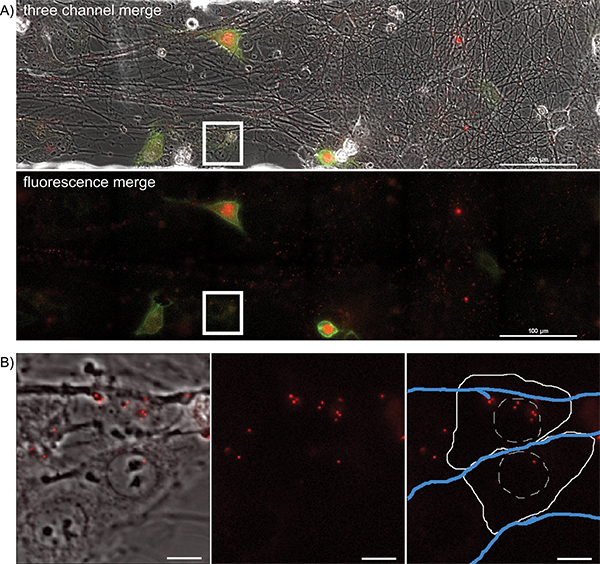
図4。マルチカラーの感染中に感染した軸索から上皮細胞クラスターに順行普及イベントの一夜タイムラプスイメージング。シングル位置から代表的な画像、PRVからビリオン伝送の大画像タイル張りのタイムラプスムービー427感染した軸索受け手上皮細胞に変換します。)受容細胞は、YFP-CAAXとVP26-mRFPを融合タンパク質を発現させるために始めている時間感染後で送信、YFP及びRFP蛍光画像の合成画像。 2番目のパネルで、YFP及びRFPのチャンネルが一緒に表示されます。 mRFPを涙点ASSOの多数の点に注意してください軸索路とciated。これらは軸索内の長距離輸送( 補足ムービープレビュー2)を受けて組み立てビリオンで す。ホワイトボックス)感染カプシドアセンブリが格納されている受信者上皮細胞の代表的なイメージ(補足作品も3参照)パートB Bで強調関心の領域を表します。パネル1は、送信およびRFPのチャネルのマージです。パネル2は単独のRFPチャネルです。パネル3は、RFP細胞輪郭の概略図(実線白線)のチャネル、核(白ラインをハッシュ化)し、軸索(青線)である。 より大きい数字を表示するには、ここをクリックしてください 。
補足ムービー1。軸索ビリオンの急速な、逐次取得のためのソフトウェアの設定。、露出設定を決定ND取得コントロールの設定、迅速なフレーム買収MOを取得するに関連付けられている手順軸索輸送を受けて蛍光ビリオンのVIEが提示される。 SCGニューロン培養は、8時間前にイメージングPRV 427に感染していた。 ムービーを表示するには、ここをクリック 。
補足ムービー2。軸索から細胞への広がりの一夜イメージングのためのソフトウェア設定。の晩イメージング用ND取得コントロールの設定に関連したステップ軸索から細胞へ拡散イベントが掲載されています。 ムービーを表示するには、ここをクリック 。
補足ムービープレビュー3。見苦しくムービーフォーマットに変換します。ND2ファイルの変換。生データを変換するに関連したステップ。一般的なビデオプレーヤーを使用してプレゼンテーション用。aviファイルや。movファイルフォーマットのどちらかにND2のファイルが。 彼女をクリックムービーを表示する電子。
補足ムービー4。 PRV 348で8時間、感染後に軸索をSCGの細胞イメージングを生きる。 ムービーを表示するには、ここをクリック 。
補足ムービー5。の軸索から細胞への広がり。晩イメージングの大きな画像エリアは 、ムービーを表示するには、ここをクリック 。
補足ムービー6。の軸索から細胞への広がり。晩タイムラプスイメージングの拡大された面積は 、ムービーを表示するには、ここをクリック 。
| 歪み | 遺伝子型 | ユーティリティ |
| PRV 341 | GFP-US9(膜)/ mRFPを-VP26(カプシド) | ビリオン輸送実験11 |
| PRV 348 | GFP-US9(膜)/ GM-mCherry(メンブレン) | ビリオン輸送実験11 |
| PRV 427 | mRFPを-VP26(カプシド)/ YFP-CAAX(携帯細胞膜) | 順行拡散実験10 |
表1。蛍光融合タンパク質を発現する組換え有用PRV株。
| 名前 | 会社 | カタログ番号 |
| 35ミリメートルのガラス底培養皿 | マテック株式会社、アッシュランド、マサチューセッツ州 | P35G-1.5-20-C |
| 35ミリメートルμ-ディッシュ | Ibidi USA LLCは、ベローナ、ウィスコンシン州 | 81156 |
| 顕微鏡本体 | ニコンインスツル株式会社 | ニッケルKONのEclipseのTi |
| 電動顕微鏡XYステージ | 以前は科学;ロックランド、マサチューセッツ州 | H117 PROSCANフラットトップ |
| 電動フィルターホイール | 事前の科学 | HF110 10ポジションフィルタホイール |
| 蛍光灯照明源 | ルーメンダイナミクス、ミシサガ、オンタリオカナダ | 120Q X-シテ |
| マルチバンド蛍光フィルターセット | クロマ·テクノロジー(株)、ベローズの滝、VT | 89000セダトクワッド - ET 89006 ECFP / EYFP / mCherry - ET |
| EM-CCDカメラ | アンドール·テクノロジー米国;サウスウィンザー、コネチカット州 | iXon3 897 |
| Chamlideステージ天環境インキュベーター | セル·インスツルメンツのライブ、ソウル、韓国 | TC-L-10 |
| 対物レンズヒータ | Bioptecs;バトラー、ペンシルバニア州 | 150803コントローラ150819-12-08ヒーター |
| 解析ソフトウェア | ニコンインスツル株式会社、メルヴィル、ニューヨーク州 | NISの要素 |
表2。特定の試薬 および機器。
ディスカッション
彼らは観察の行為によって重大な変更を加えること無く発生したライブセルイメージングの目的は、生物学的プロセスを観察している。環境制御、撮像速度、および蛍光照明:この目的は、3つの変数を最適化することによって達成される。これらの相互依存変数が実行可能な撮影条件を達成するためにバランスをとらなければなりません。提示プロトコルは、代表的な結果を生成するために特定の条件を利用する。我々は簡単に提示された具体的な方法を詳述する前に、環境コントロールと観察ダメージを説明します。
顕微鏡に関連する生物学的な条件を確立し、維持することは、携帯電話のイベントの成功を監視するために重要である。ターゲット条件を達成する顕微鏡インキュベータ構成に固有の変数の数に依存する。すべてのインキュベーターの設定は取らインキュベーター内でモックサンプルの独立した温度測定を使用して検証されるべきである客観的な接点、培養皿の真ん中に、培養皿の端;を含む複数の位置で。設定は1より37℃以上C暖かい°Cと同様℃で客観接触点で近い37の温度を維持している領域を最小化するために最適化する必要があります。イメージングのために使用される各培養皿と客観的構成はテスト済みであり、実験の前に検証する必要があります。理想的には、すべてのサンプルは、撮像時の温度を監視が、これはシステムの数は非実用的と生物学的に証明する危険剤が使用される場合に複雑になるであろう。温度が低すぎたり高すぎでインキュベートサンプルが人為的結果や急速な細胞の劣化につながることができるようにインキュベーション条件の検証は、重要です。
識別と観察損傷から生じる結果を最小化するプロトコル開発のために重要である。頻繁な照明が生物学的プロセス、IRRを変更することができますeversibly蛍光分子を不活性化する、または細胞死経路の数を誘導する。温度の検証は、標準組織培養インキュベーターのものに類似のステージ上に生物学的に同様の条件を再現することが重要です。頻繁な照明の影響を制御することはより困難であり、多くの試行錯誤実践を繰り返し必要とします。形態学的相違または生物学的に関連する変化のための組織培養インキュベーターに保管比較並列サンプルはかなりの細胞毒性で生細胞撮像条件の結果かどうかを判断することができます。ここで説明する実験では、ウイルス価を介してウイルス感染の生産性ならびに細胞間のウイルスの拡散の程度を監視している。
軸索内速い搬送リアルタイムイメージングを達成するには、蛍光照明の強度と一緒に画像取得速度の最適化を必要とする。画像取得速度はカマーによって決定される順次複数の蛍光チャネルを収集し、特に設定や顕微鏡のハードウェア、。照度は蛍光シグナルと集録レートの品質に影響を与える。グレーター·照度、特に少量の粒子に組み込むもののために、蛍光タンパク質を簡単に可視化することができます。しかし、サンプルの強化光毒性損傷から漂白速く、苦しむでしょう。 NDフィルターを介して照明を減らすことは、画像取得の頻度を低減し、潜在的に検出時にその移動による蛍光体の構造の空間的な変形を引き起こし、より長い露光時間が必要となる。画像取得頻度の照度の正しいバランスを見つけることは、蛍光タンパク質シグナルと研究されて構造体の運動の速度に大きく依存する。それよりむしろ、背景のみ上記蛍光構造を区別するのに十分な信号を取得することが必要である長い露出時間を必要とする高コントラスト画像を生成する。
一晩タイムラプス撮影をリアルタイム生細胞イメージングと同様のハードウェア構成を利用したが大幅に長期、頻繁な蛍光照明に関連付けられて蓄積された光損傷の影響を受ける。リアルタイムイメージングとは違って、蛍光照明強度を制限する必要性が最も重要であり、他のすべての変数が、この制限を考慮して修正される。曝露の強度を制限することが大幅画像化された細胞を損傷することなく、複数の蛍光チャンネルを頻繁に照明することができます。順行性軸索から細胞への広がりイベントが時間的·空間的に異種であるため、撮像大面積は、可能な限りこれらのまれなイベントの多くをキャプチャすることが不可欠である。
出版数は24-26ライブセルイメージングの実践のために徹底した概要と推奨事項を提供してきました。ここで詳述プロトコルはrepresENTウイルス感染の本質的な特徴を維持しながら、ウイルス複製、輸送、およびスプレッドに蛍光イメージングの影響を最小にするために全力をしようとします。蛍光融合タンパク質および堅牢なニューロン培養の慎重な開発と、これらのプロトコルを組み合わせることで、ヘルペスウイルス感染と発病の私の基本的な質問に答えました。
開示事項
我々は、開示することは何もありません。
謝辞
LWEとRKは健康補助R37 NS033506-16とR01 NS060699-03の米国の国立研究所によってサポートされています。 MPTは、アメリカ癌協会ポスドク研究フェローシップ(PF-10から057-01-MPC)によってサポートされていました。博士マシュー·ライマン博士とオレンKobilerのアドバイスや知識は、顕微鏡の構成と生細胞イメージング法を設計に尽力しました。また、顕微鏡の取得、インストール、およびパフォーマンスの彼らの技術支援のためにニール·バーロウとニコンインスツルメンツ社のブライアン·T·ケインのおかげで拡張します。
資料
| Name | Company | Catalog Number | Comments |
| Name | Company | Catalogue number | |
| 35 mm glass bottom culture dish | MatTek Corporation; Ashland, MA | P35G-1.5-20-C | |
| 35 mm μ-Dish | Ibidi USA LLC, Verona, WI | 81156 | |
| Microscope body | Nikon Instruments Inc. | Nikon Eclipse Ti | |
| Motorized microscope X-Y stage | Prior Scientific; Rockland, MA | H117 ProScan Flat Top | |
| Motorized filter wheels | Prior Scientific | HF110 10 position filter wheel | |
| Fluorescent illumination source | Lumen Dynamics; Mississauga, Ontario Canada | X-Cite 120Q | |
| Multi-band Fluorescence filter sets | Chroma Technology Corp.; Bellows Falls, VT | 89000 Sedat Quad - ET 89006 ECFP/EYFP/mCherry - ET | |
| EM-CCD camera | Andor Technology USA; South Windsor, CT | iXon3 897 | |
| Chamlide stage top environmental incubator | Live Cell Instruments; Seoul, South Korea | TC-L-10 | |
| Objective lens heater | Bioptecs; Butler, PA | 150803 Controller 150819-12-08 Heater | |
| Analysis software | Nikon Instruments Inc.; Melville, NY | NIS Elements |
参考文献
- Johnson, D. C., Baines, J. D. Herpesviruses remodel host membranes for virus egress. Nature reviews. Microbiology. 9 (5), 382-394 (2011).
- Mettenleiter, T. C., Klupp, B. G., Granzow, H. Herpesvirus assembly: a tale of two membranes. Current Opinion in Microbiology. 9 (4), 423-429 (2006).
- Saksena, M. M., Wakisaka, H., et al. Herpes simplex virus type 1 accumulation, envelopment, and exit in growth cones and varicosities in mid-distal regions of axons. Journal of Virology. 80 (7), 3592-3606 (2006).
- Snyder, A., Wisner, T. W., Johnson, D. C. Herpes Simplex Virus Capsids Are Transported in Neuronal Axons without an Envelope Containing the Viral Glycoproteins. Journal of Virology. 80 (22), 11165-11177 (2006).
- Snyder, A., Polcicova, K., Johnson, D. C. Herpes simplex virus gE/gI and US9 proteins promote transport of both capsids and virion glycoproteins in neuronal axons. Journal of Virology. 82 (21), 10613-10624 (2008).
- Tomishima, M. J. A conserved alpha-herpesvirus protein necessary for axonal localization of viral membrane proteins. The Journal of Cell Biology. 154 (4), 741-752 (2001).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. G. Immunolabeling artifacts and the need for live-cell imaging. Nature Methods. 9 (2), 152-158 (2012).
- Kratchmarov, R., Taylor, M. P., Enquist, L. W. Making the case: Married versus Separate models of alphaherpes virus anterograde transport in axons. Reviews in Medical Virology. 22 (6), 378-391 (2012).
- Antinone, S. E., Smith, G. A. Two modes of herpesvirus trafficking in neurons: membrane acquisition directs motion. Journal of Virology. 80 (22), 11235-11240 (2006).
- Del Rio, T., Ch'ng, T. H., Flood, E. A., Gross, S. P., Enquist, L. W. Heterogeneity of a fluorescent tegument component in single pseudorabies virus virions and enveloped axonal assemblies. Journal of Virology. 79 (7), 3903-3919 (2005).
- Taylor, M. P., Kramer, T., Lyman, M. G., Kratchmarov, R., Enquist, L. W. Visualization of an alphaherpesvirus membrane protein that is essential for anterograde axonal spread of infection in neurons. mBio. 3 (2), (2012).
- Taylor, M. P., Kobiler, O. Alphaherpesvirus axon-to-cell spread involves limited virion transmission. Proceedings of the National Academy of Sciences. , (2012).
- Kobiler, O., Brodersen, P., Taylor, M. P., Ludmir, E. B., Enquist, L. W. Herpesvirus replication compartments originate with single incoming viral genomes. mBio. 2 (6), (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nature Methods. 2 (12), 905-909 (2005).
- Snapp, E. L. Fluorescent proteins: a cell biologist's user guide. Trends in Cell Biology. 19 (11), 649-655 (2009).
- Ch'ng, T. H., Flood, E. A., Enquist, L. W. Culturing primary and transformed neuronal cells for studying pseudorabies virus infection. Methods in molecular biology (Clifton, N.J.). , 292-299 (2005).
- Curanovic, D., Ch'ng, T. H., Szpara, M., Enquist, L. Compartmented neuron cultures for directional infection by alpha herpesviruses. Current protocols in cell biology. Chapter 26 (Unit 26.4), (2009).
- Zareen, N., Greene, L. A. Protocol for culturing sympathetic neurons from rat superior cervical ganglia (SCG). J. Vis. Exp. (23), e988 (2009).
- Ch'ng, T. H., Enquist, L. W. Neuron-to-Cell Spread of Pseudorabies Virus in a Compartmented Neuronal Culture System. Journal of Virology. 79 (17), 10875-10889 (2005).
- Campenot, R. B., Lund, K., Mok, S. -. A. Production of compartmented cultures of rat sympathetic neurons. Nature Protocols. 4 (12), 1869-1887 (2009).
- Kramer, T., Greco, T. M., Taylor, M. P., Ambrosini, A. E., Cristea, I. M., Enquist, L. W. Kinesin-3 Mediates Axonal Sorting and Directional Transport of Alphaherpesvirus Particles in Neurons. Cell Host & Microbe. 12 (6), 806-814 (2012).
- Smith, G. A., Gross, S. P., Enquist, L. W. Herpesviruses use bidirectional fast-axonal transport to spread in sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 98 (6), 3466 (2001).
- Kramer, T., Enquist, L. W. Alphaherpesvirus Infection Disrupts Mitochondrial Transport in Neurons. Cell Host & Microbe. 11 (5), 504-514 (2012).
- Swedlow, J. R., Platani, M. Live cell imaging using wide-field microscopy and deconvolution. Cell Structure and Function. 27 (5), 335-341 (2002).
- Kaech, S., Huang, C. F., Banker, G. Short-Term High-Resolution Imaging of Developing Hippocampal Neurons in Culture. Cold Spring Harbor Protocols. 2012 (3), (2012).
- Frigault, M. M., Lacoste, J., Swift, J. L., Brown, C. M. Live-cell microscopy - tips and tools. Journal of Cell Science. 122 (6), 753-767 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved