Method Article
تصوير الخلايا الحية من الهربسي الألفائي الفيروسات النقل تقدمي وانتشارها
In This Article
Summary
تصوير الخلايا الحية من العدوى بالفيروس الهربسي الألفائي تمكن من تحليل للأحداث دينامية النقل الموجهة وانتشار بين الخلايا. هنا، فإننا نقدم المنهجيات التي تستخدم سلالات فيروسية المؤتلف معربا عن البروتينات الانصهار الفلورسنت لتسهيل التصور من الجمعيات الفيروسية خلال العدوى من الخلايا العصبية الأولية.
Abstract
وقد مكنت التطورات في تقنيات الخلية الحية المجهري مضان، فضلا عن بناء السلالات الفيروسية المؤتلف التي تعبر عن البروتينات الانصهار فلوري التصور في الوقت الحقيقي النقل وانتشار عدوى الفيروس الهربسي الألفائي من الخلايا العصبية. الأداة المساعدة من رواية البروتينات الانصهار الفلورسنت لغشاء الفيروسية، غشاء، وcapsids ألف، بالاشتراك مع التصوير الخلية الحية، حدد جمعيات الجسيمات الفيروسية تمر النقل داخل محاور عصبية. وقد استخدمت أدوات مشابهة بنجاح لتحليل خلية خلية انتشار الجسيمات الفيروسية لتحديد عدد وتنوع virions تنتقل بين الخلايا. الأهم من ذلك أن تقنيات تصوير الخلايا الحية النقل تقدمي وانتشار إنتاج ثروة من المعلومات بما في ذلك السرعات الجسيمات النقل والتوزيع من الجزيئات، والتحليلات الزمنية للتوطين البروتين. جنبا إلى جنب مع التقنيات الوراثية الفيروسية الكلاسيكية، وقد وفرت هذه المنهجيات رؤى الحرجةإلى أسئلة الآلية الهامة. في هذه المادة ونحن تصف بالتفصيل أساليب التصوير التي تم وضعها للإجابة على الأسئلة الأساسية للالهربسي الألفائي نقل الفيروس وانتشاره.
Introduction
إصابة الجهاز العصبي المحيطي (السندات الإذنية) عن طريق الفيروسات الهربسي الألفائي مثل فيروس الهربس البسيط (HSV) -1، -2، وفيروس داء الكلب الكاذب (PRV) ينطوي على عدة خطوات معقدة ودرجة عالية من التنظيم في جميع مراحل الحياة الفيروسية. النقل داخل الخلايا العصبية في الجهاز العصبي المحيطي أمر بالغ الأهمية خلال أحداث كلا العدوى الفيروسية الأولية واللاحقة انتشار بين المضيف. الآليات الجزيئية التي تعدل عنصرين من دورة الحياة الفيروسية؛ النقل الموجهة من الجمعيات الفيروسية بعيدا عن أجسام الخلايا ضمن محاور عصبية (النقل تقدمي) ونقل لاحقا إلى خلايا virions عرضة (انتشار تقدمي) مهمة لفهم المرضية هربس.
النقل والخروج من الجسيمات الفيروسية في الخلايا العصبية تعتمد على تجميع ناضجة المعدية 1،2 الفيريون. واستخدمت المقايسات ثابت سابقا، بما في ذلك المناعي (IF) والمجهر الإلكتروني (EM)، لدراسة حالة جمعية الجسيمات والبروتوكول الاضافيالتفاعلات عين المرتبطة بالنقل الفيريون وانتشار 3-6. إلا أن الطبيعة الديناميكية لنقل virions والتحف التجريبية التي أدخلتها التثبيت الكيميائية مرتبك تفسير الصور الثابتة 7،8. مؤخرا، قد تم وصفها عدد من البروتينات الانصهار الفيروسي الفلورسنت لفيروس الهربس البسيط وPRV التي لها تأثيرات ضئيلة على وظيفة البروتين. وغالبا ما يقترن بروتين الفلورية الخضراء (GFP) والبروتينات الفلورية الأحمر (mCherry أو mRFP) fluorophores للسماح التصوير لاثنين من المكونات الهيكلية ثلاثة من الفيريون ناضجة: قفيصة، غشاء، وبروتين سكري 9-11. يعيش التصوير الخلية النقل تقدمي استخدام مزدوج المسمى الفيروسات يتصور الدولة تجميع الجسيمات الفيروسية أثناء النقل. وتستخدم fluorophore مماثلة معربا عن سلالات فيروسية لتصور عدد وتنوع الجينوم الفيروسي بعد انتشار 12،13. خصائص البروتينات الفلورية (مراجعة في 14،15) تؤثر بشكل كبيرالقدرة على تصور جمعيات الفيروسية أو الخلوية. ينبغي النظر في الخصائص الذاتية للبروتين فلوري، بما في ذلك الذات التفاعلات والاستقرار، عند تصميم واختبار اندماج بروتين رواية للحفاظ على النوع البري وظيفة.
بالتزامن مع اندماج بروتين فلوري، وهما جيدا تتميز في أنظمة زراعة الخلايا في المختبر وتستخدم لتصوير الخلايا الحية من عدوى فيروس الهربس: فصل 16 و 17 مجزأة (الشكل 1A) الفئران متفوقة عنق الرحم العقد (SCG) الخلايا العصبية. في كلا النظامين، يتم تشريح الجنينية SCG، وفصلها إلى هيئات خلية واحدة، ومطلي لفي المختبر زراعة 18. الخلايا العصبية SCG هي جزء من الجهاز العصبي اللاإرادي ويمكن تربيتها بسهولة ومتباينة من قبل عامل نمو الخلايا العصبية (NGF) في ناضجة الاستقطاب فيفو السابقين الدولة. الخلايا العصبية SCG فصلها تشكل شبكة ممتدة من المحاور التي يسمح جمعةأو التصور من الجسيمات الفيروسية لأنها تمر بعملية انتقال تقدمي 6. الثقافات SCG مجزأة توفير العزلة فلويديك من جسم الخلية العصبية (S مقصورة) ومصطلحات محوار البعيدة (N مقصورة) 19. وقد تم نشر عدد من بروتوكولات وإجراءات تفصيلية لبناء واستخدام الخلايا العصبية باستخدام مجزأة الأصلي أو تعديل ل20 Campenot الغرف 17 سابقا. العزلة فلويديك يسمح للعدوى انتقائية من أجسام الخلايا العصبية والكشف عن virions ذرية بعد النقل إلى مصطلحات محوار معزولة. الطلاء الخلايا الظهارية على مصطلحات مسبق للإصابة توفر الخلايا المتلقية لانتشار عدوى فيروسية.
هناك العديد من العناصر الأساسية الهامة لجميع الخلايا الحية التجريب التصوير، ولكن الأكثر ملاءمة لبروتوكولات لدينا هي: اقتناء الآلي صورة، والإضاءة الفلورسنت، وسرعة التصوير والمراقبة البيئية. لجميع تجارب التصوير، ونحن نستخدممقلوب، الآلي، إضاءة المجهر epifluorescence (الشكل 1B). بنيت المجهر حول نيكون الكسوف تي قاعدة، وتوظف عددا من سيطرة النظم الآلية الكمبيوتر بسرعة إعادة تكوين المجهر خلال الحصول على الصور الآلي. لإضاءة مضان، ونحن نستخدم واسعة الطيف الزئبق مصباح القوس التي يمكن أن تكون مخففة مع مرشحات الكثافة محايدة على طول مسار إضاءة. مرشحات الإثارة لحد من الطيف من الإضاءة الفلورسنت وعندما يقترن مع المرايا مزدوج اللون متعددة تمرير والمرشحات الانبعاثات مضان تصور مركبات الفلورسنت محددة. هي التي شنت على مرشحات الإثارة وانبعاث في التحول بسرعة عجلات مستقلة، مرشح لتمكين اكتساب متتابعة السريع للقنوات الفلورسنت مختلفة. ومما يعزز من سرعة الحصول على الصور كذلك مع كاميرا EM-CCD حساسة وسريعة ومفيدة للكشف عن إشارات كثافة منخفضة وقصيرة صورة قراءة مرات. الرقابة البيئية على microscويتحقق مكتب مستشار رئيس الوزراء مع كبار مرحلة ساخنة الحاضنة وسخان عدسة الهدف للحفاظ على العينات عند درجات حرارة مرتفعة في حين يتم تمرير 2 المخصب جو مرطب وأول أكسيد الكربون في الحاضنة. يتم الاحتفاظ المجهر في غرفة مظلمة مع الحفاظ على درجة الحرارة المحيطة يقرب من 25 درجة مئوية، وضوء خارج الحد الأدنى مع ستائر التعتيم على جميع النوافذ. البروتوكولات التالية تصف استخدام هذا النظام لنقل تقدمي وانتشار المقايسات.
وهناك عدد من البدائل موجودة للسيطرة على متغيرات التصوير الخلية الحية. السيطرة على إعدادات المجهري يمكن القيام بها يدويا أو من خلال النظم الآلية تعتمد على البرمجيات الاحتكارية. ويمكن تحقيق إضاءة الهالوجين مع مضان، LED أو مصادر الليزر. يتم تعديل سرعة التصوير من سرعة تبديل فلتر والوقت لتصور إشارة مع نظام الكشف المقترنة. ويمكن تحقيق الرقابة البيئية مع الأجهزة المتخصصة على ميلالمرحلة croscope، الضميمة من كل أو جزء من المجهر في مربع ساخنة ومرطب، أو عن طريق رفع درجة حرارة الغرفة حيث سيتم تنفيذ المجهري. كل من هذه البدائل لديها مزايا وعيوب تتعلق التكلفة والأداء.
في بروتوكول لاحقة، ونحن من التفصيل استخدام التصوير الخلية الحية لدراسة النقل تقدمي السريع وانتشار تقدمي من الفيروسات الهربسي الألفائي من خلال استخدام سلالات فيروسية المؤتلف. في الوقت الحقيقي التصوير الخلية الحية يتصور قفيصة، غشاء، و / أو بروتين سكري شارك في التعريب على الهياكل الحيوية يمر النقل داخل محاور 11. التصوير تيميلابسي بين عشية وضحاها من الثقافات العصبية مجزأة يتصور محور عصبي الخروج الفيريون والعدوى من الخلايا عرضة 12. وقد تم تحسين البروتوكولات المعروضة هنا للاستخدام مع نظام التصوير خاصة لدينا، ولكن يتم عرض بعبارات عامة بالنسبة إلى العناصر الأربعة للتصوير الخلايا الحية. في المناقشة نحنسوف مزيد من التفاصيل بعض من التحسين ما هو ضروري لإجراء التجارب الناجحة.
Protocol
القسم 1 - الشروط التحكم البيئي لمضان المجهري تعيش خلية
- 30 دقيقة قبل أي تجربة التصوير التواصل وبدء ارتفاع درجة حرارة المجهر مرحلة أعلى حاضنة.
- بدوره على المجهر، ومصادر الضوء المنبعث وepifluorescent، والضوابط الأجهزة الآلية. فتح برنامج حاسوبي لمراقبة المجهر، عناصر شيكل، للاتصال المجهر ويبدأ تبريد كاميرا EM-CCD.
- إرفاق عدسة دفئا إلى الهدف المناسب (إما 60X أو الغمر النفط 100X) ملاحظة: حدد عدسة الهدف يعتمد على نوع التجربة. و100X الفرق المقابل تدخل (DIC) هو أفضل لتتبع تقدمي نقل جمعيات الفيريون بينما يناسب هدف المرحلة 60X لتصور انتشار تقدمي. انخفاض التكبير، أهداف الغمر غير النفطية لا تحتاج إلى عدسة دفئا لأنها لا تجعل الاتصال المباشر مع العينة.
- نعلق مرحلة أعلى حاضنة على خشبة المسرح الآلية من ميل croscope. ضمان إدراج المناسبة التي من شأنها الاستمرار على العينة في المكان. نعلق خط جوي مرطب من سيطرة الحاضنة إلى مدخل الميناء على المسرح الأعلى الحاضنة.
- تشغيل الحاضنة وعدسة ضوابط أكثر دفئا وضبط ضبط درجة الحرارة لظروف التحقق سابقا محددة لتحقيق الهدف وعينة التي يجري تصويرها (انظر المناقشة).
- فتح صمام التحكم على 5٪ CO 2 / خزان الغلاف الجوي 95٪ لتوفير CO 2 الهواء تستكمل لمرحلة أعلى حاضنة. يجب أن يكون معدل التدفق ما بين 60 و 80 مل من الغاز في الدقيقة الواحدة. سيؤدي معدلات أسرع في عينة الجفاف واسعة النطاق على الرغم من غرفة الرطوبة.
- إضافة زيت عدسة لعدسة الهدف ووضع على الفور الثقافة التي سيتم تصويرها في مرحلة أعلى حاضنة.
- تسمح موازنة درجة الحرارة في ثقافة مدة لا تقل عن 10 دقيقة. ويفضل ساعة واحدة، وخاصة للتصوير ليلة وضحاها وصفها في القسم 3.
- قبل ست إلى ثماني ساعات إلى التصوير، وتصيب 35 مم طبق ساترة القاع الناضجة وفصلها الخلايا العصبية SCG مع 1 × وحدة تشكيل 10 لوحة من 6 الفيروس من الفائدة (انظر الجدول 1 على سبيل المثال الفيروسات) باستخدام الطريقة الموصوفة في تايلور وآخرون آل. 2012A 11. إذا اختبار الفيروس أكثر من واحد، التطعيمات المقاصة من قبل 30-60 دقيقة للسماح للتصوير من عينات متتابعة في أوقات مماثلة إصابة آخر.
- إدراج الطبق إلى مرحلة أعلى حاضنة مدة لا تقل عن 10 دقيقة قبل تشغيل أي تجربة. في حين أن درجة الحرارة equilibrates، والمستوى البؤري يتحول وسوف تؤثر سلبا على أي تجارب التصوير.
- باستخدام الضوء المنقولة والعدسة من المجهر، والعثور على جسم الخلية العصبية له ملحق محور عصبي معزولة بشكل واضح. بدلا من ذلك، استخدام الإضاءة مضان مناسبة للعثور على خلية معربا عن DETECالمبالغ جدول البروتينات الفلورية. فمن المهم للحد من التعرض من عينة لإضاءة الفلورسنت، في هذه الخطوة والخطوات اللاحقة، بسبب ضوء تلف الخلايا الناجم عن وتبيض من البروتينات الفلورية.
- تخفيف الإضاءة مضان للحد من شدة الضوء الإثارة التي يتعرض لها الخلايا. الانخراط ضوء تخفيف الكثافة المحايدة (ND) مرشحات في مضان مسار الضوء إضاءة. للأفلام تدوم أطول من 1 دقيقة، كحد أدنى من ND4 يجب أن تستخدم لمنع الصور تبيض من البروتينات الفلورية واسعة الصور الضرر من المحاور. يمكن لهياكل الفلورسنت عالية تكون عادة تصور مع مرشح ND8 في المكان.
- باستخدام برنامج المجهر (الشكل 2 والتكميلي الفيلم 1A)، والتحول للمسار الضوء إلى الكاميرا EM-CCD.
- تحديد أوقات التصوير الأمثل وظروف لكل قناة الفلورسنت.
- الشروع في نافذة الصورة الحية باستخدام زر "تشغيل".
- تحديد إعدادات الكاميرا التعرض الأمثل لكل بروتين فلوري. لا تتجاوز 300 ميللي ثانية لكل قناة كما الانحرافات الحركي من الهياكل الفيريون سريع الحركة سوف يحدث. الاستفادة من مكاسب EM من الكاميرا إلى إعداد 300 (واقترح الصانع كسب كحد أقصى)، لتقليل زمن التعرض وتعزيز الكشف عن الإشارات الخافتة. مرات التعرض الصحيح ينبغي أن إنتاج صورة مع انخفاض كثافة الخلفية وإشارات عالية محددة.
- بعد تحديد التعرضات وإيجاد منطقة محددة جيدا من محور عصبي، يجب أن يتم تكوين البرنامج لأداء الحصول على الصور الآلي. وقف نافذة التصوير الحي لمنع عينة التبييض.
- في عناصر البرنامج شيكل، حدد 6D - تحديد / تشغيل تطبيق التجربة من "تطبيقات" القائمة المنسدلة.
- في إطار اكتساب ND، انقر فوق علامة التبويب الوقت الذي سيحدد وتيرة الحصول على الصور. تعيين الفاصل الزمني إلى "أي تأخير" والمدة إلى 5 دقائق. الوبرنامج البريد ثم الحصول على إطارات الصور على أعلى تردد ممكن لمدة 5 دقائق.
- حدد "لامدا" علامة التبويب، الذي يسمح للاختيار من تكوينات الأجهزة قبل مجموعة متعددة تستخدم لاكتساب صورة الفلورسنت. انقر فوق المربع الأول والهبوط اللاحق في أسفل القائمة لتحديد تكوين الأجهزة المناسبة. أكرر للجميع البروتينات الفلورية ليمكن تصوير.
- ضمان علامات التبويب ل "المراكز XY"، "Z-سلسلة" و "صورة كبيرة" هي دي اختيارها.
- فوق علامات التبويب، حدد خانة وضع علامة "حفظ إلى ملف" لحفظ الصور تلقائيا إلى القرص الثابت خلال الاستحواذ. تكوين موقع واسم الملف لملف الإخراج التجربة. كما يتم إجراء تجارب متتابعة، يقوم البرنامج بإضافة الرقم المتسلسل في نهاية اسم الملف المعين.
- مرة واحدة تم اختيارها كافة علامات التبويب. بدء التجربة من خلال النقر على زر "التشغيل الآن".
- تحسين معدل الحصول على الصور من خلال إعدادات التعرض وايماجحجم ه. وسوف تستخدم منطقة صغيرة من منطقة الصورة في كثير من الأحيان، وقادر على تسريع معدلات اقتناء الإطار. تحديد المنطقة ذات الاهتمام باستخدام أداة ROI في NIS-عناصر، واختيار منطقة تقع بين 25٪ و 50٪ من المساحة الكلية للصورة. بدلا من ذلك، سوف مرات التعرض أقصر زيادة معدلات اقتناء الإطار، ولكن يقلل من جودة الإشارة (انظر المناقشة).
القسم 3 - ليلة وضحاها الوقت الفاصل بين التصوير من الأحداث انتشار تقدمي
- أربع ساعات قبل التصوير، تصيب الخلايا العصبية ثقافة مجزأة شيدت على 35 ملم μ-الطبق. تطعيم أجسام الخلايا العصبية مع 1 × 10 6 وحدات تشكيل لوحة من الفيروس من الفائدة (انظر الجدول 1 على سبيل المثال الفيروسات) باستخدام الطريقة الموصوفة في تايلور وآخرون. 2012b 12.
- وضع بلطف الطبق الثقافة إلى مرحلة أعلى حاضنة. تأكد من تعيين موضع الهدف إلى جانب الطبق. جلب ببطء الهدف في التركيز، يكفل لجي الهدف لا دفع ما يصل إلى العينة. مرة واحدة وقد تم التعرف على مجال التركيز، تحرك ببطء موضوعي في وسط الطبق، بالقرب من حاجز الداخلية ترسيم الجانب الداخلي للمقصورة محوار. أثناء الحركة، وضمان الحفاظ على عمق التركيز وتجنب دفع ما يصل إلى العينة. سوف انحراف من سطح البلاستيك من الهدف تلف محاور عصبية والبلاستيك.
- أضف حوالي 2 مل من الحارة (~ 37 درجة مئوية) الفوسفات مخزنة المالحة إلى الطبق الثقافة خارج الحلبة تفلون. هذا يحيط ثقافة العصبية مع حلقة من برنامج تلفزيوني للحد من الجفاف عينة وتوفير العزل الحراري.
- تسمح درجة الحرارة لكي تتوازن مدة لا تقل عن 1 ساعة قبل الشروع في الحصول على الصور الآلي (3.8). خطوات 3.5 خلال 3.7 يمكن تكوين خلال هذا الوقت.
- تقييد شدة الإضاءة إلى أدنى مستوى ممكن من خلال إشراك جميع مرشحات الكثافة محايدة. وهذا سوف يسمح الحصول على الصور المتكررة اوفهR فترات زمنية طويلة دون المفرطة الصور الضرر. وسوف يؤدي تخفيض الإضاءة في إشارة منخفضة، وتتطلب التعرض لفترة أطول (انظر المناقشة).
- استخدام إعدادات التعرض التاريخية أو قبل التجريبية انشاء توليد طبق موازية للخلايا الظهارية المصابة التعبير عن البروتينات الفلورية الهدف لتأسيس إعدادات التعرض كما هو موضح في القسم 2.5.
- بعد تحديد التعرض للقنوات اللازمة، فقد حان الوقت لتكوين البرنامج لاقتناء الصورة الآلي. وقف نافذة التصوير الحي للحد من عينة التبييض.
- في مجال البرمجيات عناصر (الشكل 2 وفيلم تكميلية 2)، حدد 6D - تحديد / تشغيل تطبيق التجربة من "تطبيقات" القائمة المنسدلة لإظهار إطار اكتساب ND.
- ND في إطار اكتساب، انقر فوق علامة التبويب وقت. تعيين الفاصل الزمني إلى "5 دقائق". تعيين المدة إلى 20 ساعة. وسيتم احتساب مجال الحلقات تلقائيا لعدد من حالات التكرار في PROGRAم سوف تؤدي.
- حدد "لامدا" علامة التبويب. انقر فوق المربع الأول والهبوط اللاحق في أسفل القائمة حدد التكوين امدا المناسبة لالطوري. تكرار لمواقف لاحقة، واختيار التشكيلات المناسبة لكل بروتين فلوري ليمكن تصوير.
- اختر "صورة كبيرة" علامة التبويب، والذي يحدد معالم صور متعددة لتكون مجتمعة في حقل أكبر واحدة للعرض. تتكون منطقة جيدة بحجم 5 × 2 الصور باستخدام 7٪ التداخل خياطة. وهذا سوف يسمح لأكبر عدد ممكن من الخلايا في موقف ليمكن تصوير دون التأثير على وتيرة الحصول على الصور. أيضا، قم بإلغاء تحديد خانة الاختيار "إغلاق مصراع نشطة أثناء الحركة المرحلة". هذا الخيار من شأنه أن يعزز من سرعة اكتساب من خلال عدم إغلاق مصاريع بين الصور.
- حدد "المراكز XY" علامة التبويب، لتحديد المواقف المتعددة التي سيتم تصويرها بالتتابع بالتوازي خلال الفيلم بين عشية وضحاها. تحديد المواقف التي تحدد مركز بوالباحث في كل مجال صورة كبيرة. حدد 6-8 المناصب الصورة في العينة. وهناك منطقة صورة جيدة لها مجموعات صغيرة من الخلايا في بدل بالقرب من محاور محددة بوضوح. لا ينبغي أن تتراكم الخلايا على رأس كل منهما الأخرى تجميع واكسون ينبغي أن يكون الحد الأدنى. نقطة التركيز هي نواة الخلية. ضع الهدف بحيث مظروف النووية محددة بوضوح وينظر لغالبية الخلايا.
- تأكد من إلغاء تحديد "Z-سلسلة" علامة التبويب.
- تكوين ميزة الحفظ التلقائي كما هو موضح أعلاه في القسم 2.6.5.
- اختبار التعرض وضبط الموقف بالنقر على "1 حلقة وقت". تقييم الصور الناتجة عن إضاءة ضوء المنقولة، والتركيز، وتأطير. إذا فقد تحول التركيز، وإعادة التركيز لكل منصب تحت علامة التبويب XY. انتظر 10 دقيقة ثم كرر هذه الخطوة حتى يتم التركيز مستقرة.
- بعد أن تم التحقق من كافة الإعدادات واختبارها، والشروع في التجربة الآلي عن طريق النقر فوق "تشغيل الآن" زر.
الفرع 4 - تجهيز وتصدير صورة
تصدير البيانات
- يجب أن تصدر في مجموعات البيانات التي تم الحصول عليها أثناء التصوير الخلية الحية للأحداث النقل أو انتشار من عناصر البرنامج شيكل إلى أنواع الملفات استخداما لاستخدامها لاحقا في العروض والمنشورات (التكميلي فيلم 3). لتصدير الأفلام فتح المناسبة الخام. ND2 ملف في عناصر شيكل وحدد طريقة العرض "انقسام عنصر" لتصور قنوات الفلورسنت المطلوب. تشغيل ملف في سرعة مناسبة، 5 إطارات في الثانية الواحدة هي نقطة انطلاق جيدة لرؤية النقل السريع.
- وتشمل طابع زمني لتمثيل على مدار الساعة في الوقت الحقيقي أثناء تشغيل الفيلم. انقر بزر الماوس الأيمن على الصورة واختر، إضافة ND-المعلومات. سوف يظهر عداد رقمي في الزاوية اليسرى العليا.
- تحرير-الطابع الزمني لعرض المعلومات. انقر بزر الماوس الأيمن على العداد وحدد تحرير ND-المعلومات. في نافذة منبثقة لاحقة، تحرير النص لتعكس imagiالمعلمات نانوغرام التي تعتبر مهمة. الخط تحرير واللون والحجم من أجل الوضوح.
- انتقل إلى القائمة "تحرير" والعثور على "إنشاء لقطة عرض" أو اضغط على مفتاح "X". يفتح هذا الأمر "نظرة عامة" نافذة. حدد "تنطبق على جميع الأطر" لإنشاء 8 بت، RGB، ملف جاهزة للتصدير التي تحتوي على قنوات الفلورسنت من الفيلم بأكمله.
- حفظ كملف. ملف AVI من أجل التوافق عبر منصة. ضبط معدل التشغيل في 200 ميللي ثانية لكل إطار. و. ملفات AVI التي تم إنشاؤها بواسطة عناصر شيكل ويمكن بعد ذلك يتم ضغطها أيضا مع تحويل البرمجيات الأخرى إلى نوع الملف المطلوب.
النتائج
النقل تقدمي
تطبيق هذا البروتوكول إلى التهابات الثقافات SCG فصلها مع PRV 348، سلالة PRV المؤتلف معربا عن GFP-US9 وGM-mCherry البروتينات الانصهار الغشاء، يسرت التصور من النقل تقدمي من virions (الشكل 3 و 4 فيلم التكميلي). إدراج هذه البروتينات الانصهار في الجسيمات الفيروسية النتائج في الكشف عنها على نقل نقاط و، وظروف التصوير المذكور تقليل إزاحة كل fluorophore على الجسيمات تتحرك أثناء تبديل فلتر. في نافذة التصوير لمدة ثلاث دقائق، ويلاحظ عادة العديد من نقاط ونقل ويتم إنشاؤها بسرعة أحجام عينة كبيرة للتحليلات colocalization. لقد كميا سابقا colocalization من GFP-US9، فإن الفيروس الهربسي الألفائي محور عصبي استهداف بروتين، مع البروتينات الهيكلية الأخرى باستخدام هذا النهج 11. تحليلات مماثلة أخرى recombinan مزدوجكما تم وصفها ر سلالات PRV 11، ولقد وثقت الأعمال الأخيرة الرئيسين نقل البروتينات PRV مع محرك البروتين المضيف الموسومة fluorescently في تمديد هذا البروتوكول 21. استخدام التبديل السريع عجلات تصفية وتقرن المرايا مزدوج اللون متعدد تمريرة يسمح اقتناء متتابعة السريع لاثنين أو أكثر من القنوات الفلورسنت. نستطيع أن نحقق حاليا اثنين من قناة اكتساب متتابعة بسرعات تصل إلى 0.8 لقطة في الثانية. لقناة واحدة المجهر الفيديو، الذي يقتصر فقط من وقت التعرض مضان وقراءة الوقت من الكاميرا، يمكننا تحقيق معدلات اقتناء أكبر من 6 إطارات في الثانية الواحدة.
انتشار تقدمي
لتصور انتشار الأحداث تقدمي، وتصور المجالات ذات الاهتمام كل 5 إلى 10 دقيقة لمدة ساعة 20، وخلالها virions الوقت سوف نقل إلى أسفل والخروج من المحاور، تصيب الخلايا الظهارية المجاورة. A الإطار ممثل من الصورة الكبيرةويرد في الشكل 4A والسينما التكميلي 5. ملاحظة طبيعة فصل مكانيا من الفلورسنت الخلايا معربا عن البروتين، مما يدل على العدوى الأولية من محاور عصبية. يمكن تتبع الخلايا المصابة الى الوراء خلال الفيلم لتصور capsids ألف الفلورسنت التي بدأت عدوى فيروسية. هذه الخلايا الفردية يمكن أن تكون معزولة عن إطار كبير وتعقب دون خسارة كبيرة من التفاصيل. الإطار ممثل (الشكل 4B) من فيلم التكميلي 6 يصور فترة من الزمن بعد أودعت virions قفيصة الفلورسنت في السيتوبلازم.
تحليل البيانات
وهناك مجموعة من التحاليل المختلفة لا يمكن أن يؤديها على قواعد البيانات التصوير الخلية الحية بما في ذلك تتبع الجسيمات، دراسات colocalization، وتقدير حجم انتشار الأحداث الفيريون. ونحن في كثير من الأحيان إجراء تحاليل لدينا مباشرة في عناصر البرنامج شيكل أو الاستفادة من المكونات في تمديد المتاحة لإيماحزمة البرامج التي تمكن geJ. ND2 ملف نوع الدعم. الفرضيات المختلفة والاجهزة التجريبية تستلزم الأساليب التحليلية فريدة من نوعها. وقد وصفت مجموعتنا أساليب تقييم colocalization من البروتينات الفلورية على الهياكل الديناميكية 11،21 وتقدير الوقت الفاصل بين الجسيمات الفردية انتشار الأحداث 10،12،22. وصف المنهجيات في هذا المخطوط ودراساتنا السابقة هي مرنة ويمكن تطبيقها على الالتهابات الفيروسية المختلفة وكذلك نقل الهياكل الخلوية، مثل الميتوكوندريا 23.
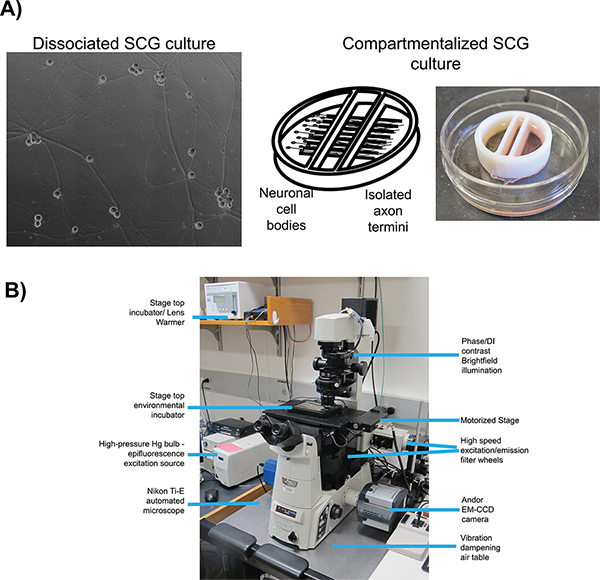
الشكل 1. تعيين التخطيطي المجهر يصل لتصوير الخلايا الحية. A) أنواع الثقافة المستخدمة لدراسات النقل تقدمي (فصل) وانتشار تقدمي (حجرات) على التوالي. لوحة 1 هي صورة النقيض مرحلة ناضجة، فصلها العقد عنق الرحم فخمة (SCG). لوحة 2 هو التخطيطي للنظام ثقافة مجزأة، المصورة في لوحة 3، مع الخلايا العصبية SCG مطلي في المقصورة اليسرى مع التوقعات محور عصبي يمتد تحت الحواجز الداخلية في مقصورة اليمين المتطرف. B) المجهر epifluorescent مقلوب ومرحلة أعلى حاضنة التكوين المستخدمة للتجارب المجهري الفيديو. انقر هنا لعرض أكبر شخصية .
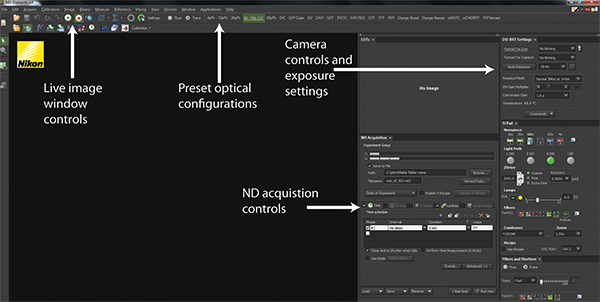
الشكل 2. NIS-عناصر واجهة البرنامج. يتم عرض لقطة من واجهة المستخدم القياسية في NIS-عناصر. ولعب وأزرار إيقاف السيطرة على نافذة حية للصورة التي تصور تكوينات الأجهزة الحالية للتصوير وكذلك ما يجري حاليا تصوير. عبر اللوحة العلوية هي سلسلة من التشكيلات البصرية التي تنفذ مسبقا الأجهزة SEttings لتكوين المجهر للكشف عبر مضيئة أو مضان. مراقبة الكاميرا وإعدادات التعرض تسمح التكوين من كشف الكاميرا لتحسين جودة الصورة والسرعة. ويتم تنسيق جميع التجارب باستخدام ضوابط اكتساب ND. انقر هنا لعرض أكبر شخصية .

الشكل (3). يعيش التصوير خلية من المحاور SCG في 8 ساعات ما بعد الإصابة بفيروس PRV 348. PRV 348 الخلايا العصبية المصابة تعبر عن GFP-US9 وGM-mCherry البروتينات الانصهار الغشاء. تقدمي-نقل الهياكل ضمن محاور القاصي وتصور في قناتين الفلورسنت، وGFP mCherry. هيكل تقدمي-نقل (أبيض السهم) تقدم ضمن محور عصبي كما هو مبين في الصور متسلسلة مأخوذة من الفيلم التكميلي 4. البروتينات الفلورية هما spatiيتحالف المقاصة بسبب اكتساب متتابعة من القنوات الفلورسنت والحركة السريعة للهياكل الفيروسية. انقر هنا لعرض أكبر شخصية .
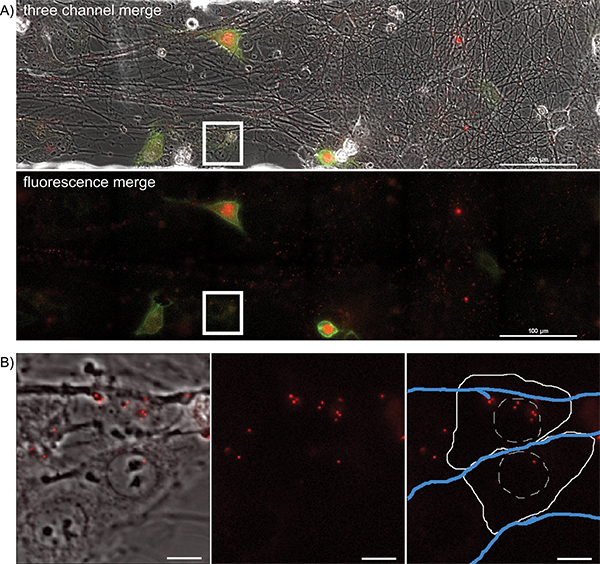
الشكل 4. التصوير بين عشية وضحاها تيميلابسي من انتشار الأحداث تقدمي من المحاور المصابة إلى مجموعات الخلايا الظهارية خلال عدوى متعددة الألوان. صور الممثل من موقف واحد، صورة كبيرة مبلطة فيلم الوقت الفاصل بين نقل الفيريون من PRV 427 محاور المصابة في الخلايا الظهارية المتلقي. A) A الصورة المدمجة من الصور المرسلة، وطلب تقديم العروض YFP الفلورسنت في إصابة آخر مرة حيث بدأت الخلايا المتلقية للتعبير عن YFP-CAAX والبروتينات الانصهار VP26-mRFP. في لوحة ثانية، تظهر قنوات YFP وRFP معا. لاحظ عدد كبير من mRFP نقاط وأسوتصاحب مساحات محوار. هذه هي virions تجميعها يخضع النقل لمسافات طويلة داخل محاور عصبية (التكميلي فيلم 2). المربع الأبيض يمثل مجال الاهتمام سلط عليها الضوء في الجزء باء B) صورة الممثل من الخلايا الظهارية التي تحتوي على المتلقي اصابة جمعيات قفيصة (انظر أيضا الفيلم التكميلي 3). لوحة 1 هو دمج القنوات المنقولة وطلب تقديم العروض. لوحة (2) هي قناة RFP وحدها. لوحة (3) هي قناة RFP مع التمثيل التخطيطي للمخطط الخلية (خط أبيض الصلبة)، نواة (تجزئته خط أبيض)، ومحاور عصبية (الخطوط الزرقاء). انقر هنا لعرض أكبر شخصية .
تكميلية الفيلم 1. ضبط برنامج سريع، واقتناء متتابعة من virions محور عصبي. الخطوات المرتبطة تحديد إعدادات التعرض، وتكوين ضوابط الاستحواذ ND، والحصول على الإطار السريع اقتناء موويرد تتنافس من virions الفلورسنت تمر النقل محور عصبي. كانت مصابة ثقافة العصبية SCG مع PRV 427 قبل ثماني ساعات إلى التصوير. انقر هنا لمشاهدة الفيلم .
تكميلية فيلم 2. إعدادات برنامج للتصوير ليلة وضحاها من انتشار محوار الى خلية. وتعرض الخطوات المرتبطة تكوين الضوابط اكتساب ND للتصوير ليلة وضحاها من محور عصبي الى خلية انتشار الأحداث. انقر هنا لمشاهدة الفيلم .
تكميلية فيلم 3. تحويل. ND2 الملفات إلى صيغ فيلم أنيق. الخطوات المرتبطة تحويل البيانات الخام. ND2 الملفات إلى سواء. افي أو سائل التحقق تنسيقات الملفات للعرض باستخدام مشغلات الفيديو الشائعة. اضغط لهاه لعرض الفيلم.
تكميلية الفيلم 4. يعيش التصوير خلية من SCG محاور عصبية في 8 ساعات ما بعد الإصابة بفيروس PRV 348. اضغط هنا لمشاهدة الفيلم .
تكميلية الفيلم 5. منطقة الصورة الكبيرة من التصوير بين عشية وضحاها من محور عصبي الى خلية انتشار. انقر هنا لمشاهدة الفيلم .
تكميلية الفيلم 6. منطقة الموسع من التصوير تيميلابسي بين عشية وضحاها من محور عصبي الى خلية انتشار. انقر هنا لمشاهدة الفيلم .
| توتر | التركيب الوراثي | فائدة |
| PRV 341 | GFP-US9 (غشاء) / mRFP-Vp26 (قفيصة) | التجارب النقل الفيريون 11 |
| PRV 348 | GFP-US9 (غشاء) / GM-mCherry (غشاء) | التجارب النقل الفيريون 11 |
| PRV 427 | mRFP-VP26 (قفيصة) / YFP-CAAX (الخلوي غشاء البلازما) | تجارب انتشار تقدمي 10 |
الجدول 1. سلالات PRV المؤتلف مفيدا معربا عن البروتينات الانصهار فلوري.
| اسم | شركة | عدد كتالوج |
| 35 مم الزجاج طبق ثقافة القاع | شركة ماتيك؛ آشلاند، MA | P35G 1.5-20-C |
| 35 ملم μ-الصحن | Ibidi USA LLC، فيرونا، WI | 81156 |
| جسم المجهر | نيكون الآلات شركة | نيكون الكسوف تي |
| بمحركات المجهر مرحلة XY | العلم قبل؛ روكلاند، MA | H117 شقة ProScan للأعلى |
| تصفية العجلات بمحركات | العلم قبل | HF110 10 موقف عجلة تصفية |
| مصدر إضاءة الفلورسنت | دايناميكس التجويف؛ ميسيسوجا، أونتاريو كندا | X-سايت 120Q |
| يحدد الإسفار متعدد الفرقة فلتر | شركة تكنولوجيا صفاء؛ الخوار فولز، VT | 89000 سدات رباعية - ET 89006 ECFP / EYFP / mCherry - ET |
| كاميرا EM-CCD | ANDOR تكنولوجيا الولايات المتحدة الأمريكية، وجنوب وندسور، CT | iXon3 897 |
| Chamlide مرحلة أعلى البيئية الحاضنة | يعيش الادوات الخليوي؛ سيول، كوريا الجنوبية | TC-L-10 |
| الهدف سخان عدسة | Bioptecs؛ بتلر، PA | 150803 وحدة تحكم150819-12-08 سخان |
| برامج التحليل | نيكون الآلات وشركة؛ ميلفيل، نيويورك | عناصر شيكل |
الجدول 2. الكواشف محددة والمعدات.
Discussion
الهدف من تصوير الخلايا الحية ومراقبة العمليات البيولوجية لأنها تحدث دون تغيير كبير بفعل المراقبة. ويتم تحقيق هذا الهدف عن طريق الاستفادة المثلى ثلاثة متغيرات: مراقبة البيئة، وسرعة التصوير، والإضاءة مضان. يجب أن يكون متوازنا بين هذه المتغيرات التي تعتمد لتحقيق ظروف التصوير قابلة للحياة. البروتوكولات قدم الاستفادة شروط محددة لتحقيق النتائج ممثل. وسوف نناقش بإيجاز الضوابط البيئية والأضرار الرصد قبل بالتفصيل أساليب محددة المقدمة.
إنشاء وصيانة الظروف البيولوجية ذات الصلة على المجهر أمر بالغ الأهمية لرصد الأحداث الناجحة الخلوية. تحقيق شروط الهدف يعتمد على عدد من المتغيرات المحددة لالمجهر وتكوين الحاضنة. وينبغي التحقق من صحة كافة الإعدادات حاضنة باستخدام قياس درجة الحرارة مستقل لعينة وهمية في الحاضنة المتخذةفي مواقف متعددة بما في ذلك؛ نقطة الاتصال الهدف، وسط الطبق الثقافة، وحافة الطبق الثقافة. ينبغي أن يكون الأمثل الإعدادات لتقليل المناطق التي هي أكثر من 1 درجة مئوية أكثر دفئا من 37 درجة مئوية وكذلك الحفاظ على درجة حرارة قريبة من 37 درجة مئوية عند نقطة اتصال موضوعية. يجب أن يتم اختبار كل طبق الثقافة والتكوين الهدف المستخدمة في التصوير والتحقق من صحتها قبل التجريب. من الناحية المثالية، سيتم رصد جميع العينات لدرجة الحرارة أثناء التصوير، ولكن هذا غير عملي يثبت لعدد من النظم ومعقد عندما يتم توظيف العوامل الخطرة بيولوجيا. التحقق من شروط الحضانة هو المهم، واحتضان العينات في منخفضة جدا أو مرتفعة جدا من الحرارة يمكن أن يؤدي إلى نتائج مصطنعة أو تدهور الخلوية السريعة.
تحديد وتقليل النتائج الناشئة عن الضرر الرصد المهم لتطوير البروتوكول. إضاءة متكررة يمكن أن يغير العمليات البيولوجية، IRRتعطيل eversibly جزيئات الفلورسنت، أو حث عدد من مسارات الموت الخلوي. التحقق من صحة درجة الحرارة مهم لإعادة إنتاج ظروف مماثلة بيولوجيا في أعلى مرحلة مماثلة لتلك التي من زراعة الأنسجة حاضنة قياسية. السيطرة على لآثار الإضاءة المتكررة هو أكثر صعوبة وغالبا ما يتطلب التكرارية محاكمة والممارسات الخطأ. يمكن مقارنة عينات موازية يوضع في حاضنات زراعة الأنسجة للاختلافات المورفولوجية أو التعديلات ذات الصلة بيولوجيا تحديد إذا كانت الظروف التصوير الخلية الحية النتائج في السمية الخلوية كبيرة. في التجارب المذكورة هنا، لدينا مراقبة إنتاجية عدوى فيروسية من خلال عيار الفيروسية وكذلك مدى انتشار الفيروس بين خلايا.
تحقيق التصوير في الوقت الحقيقي من النقل السريع في غضون المحاور يتطلب الاستفادة المثلى من الصورة سرعة اكتساب جنبا إلى جنب مع شدة الإضاءة مضان. يتم تحديد سرعة الحصول على الصور من قبل CAMERوالإعدادات والأجهزة المجهر، وخصوصا عندما جمع القنوات فلوري متعددة بالتتابع. شدة الإضاءة يؤثر على نوعية إشارات الفلورسنت ونسبة الاستحواذ. شدة الإضاءة أكبر يسمح التصور أسهل من البروتينات الفلورية، وخاصة لتلك التي تدرج في جزيئات بكميات صغيرة. ومع ذلك، فإن التبييض أسرع ويعانون من زيادة الضرر الضوئية العينة. خفض الإضاءة من خلال مرشحات الكثافة محايدة يتطلب مرات التعرض لفترة أطول، وخفض وتيرة الحصول على الصور ويحتمل أن تسبب تشوه المكاني للهياكل الفلورية بسبب حركتهم أثناء عملية الكشف. العثور على التوازن الصحيح من شدة الإضاءة مع تردد الحصول على الصور يعتمد إلى حد كبير على إشارة بروتين فلوري ومعدل الحركة للهيكل التي تجري دراستها. فمن الضروري فقط للحصول على إشارة كافية للتمييز بين الهياكل الفلورسنت فوق الخلفية، بدلا منإنتاج صور عالية التباين التي تتطلب التعرض مرات لفترة أطول.
التصوير تيميلابسي بين عشية وضحاها يستخدم تكوين أجهزة مماثلة كما في الوقت الحقيقي التصوير الخلية الحية ولكن يتأثر بشكل كبير من تراكم الصور والأضرار المرتبطة المدى الطويل، وكثرة الإضاءة مضان. على عكس التصوير في الوقت الحقيقي، والحاجة للحد من شدة الإضاءة مضان هو الهدف الأسمى، ويتم تعديل جميع المتغيرات الأخرى لحساب هذا التقييد. الحد من شدة التعرض يسمح للإضاءة أكثر تواترا من قنوات متعددة الفلورسنت دون الإضرار بشكل كبير من الخلايا المصورة. انتشار الأحداث محوار الى خلية تقدمي هي زمانيا ومكانيا المتباينة، لذلك التصوير مساحة كبيرة أمر ضروري لالتقاط أكبر عدد ممكن من هذه الأحداث نادرة ممكن.
وقد قدم عدد من المنشورات لمحات عامة وتوصيات شاملة للممارسات تصوير الخلايا الحية 24-26. البروتوكولات بالتفصيل هنا represوالأنف والحنجرة أفضل محاولاتنا لتقليل تأثير التصوير مضان على تكاثر الفيروس، والنقل، وانتشار مع الحفاظ على السمات الأساسية للعدوى الفيروسية. الجمع بين هذه البروتوكولات مع وضع دقيق من البروتينات الانصهار فلوري والثقافات العصبية قوية قد أجاب على أسئلتي الأساسية للعدوى هربس والمرضية.
Disclosures
ليس لدينا شيء في الكشف عنها.
Acknowledgements
معتمدة LWE وRK من قبل المعاهد الوطنية الأميركية للصحة منح R37 NS033506-16 و R01 NS060699-03. كان مدعوما من قبل المجتمع MPT لسرطان زمالة أبحاث ما بعد الدكتوراه الأمريكية (PF-10-057-01-MPC). كانت المشورة والمعرفة من الدكتور ماثيو ليمان والدكتور أورين Kobiler دور أساسي في تصميم التكوين المجهر وأساليب التصوير الخلية الحية. كما نتقدم بالشكر لنيل بارلو وبرايان كين T. من نيكون الأجهزة للمساعدة التقنية في اقتناء وتركيب وأداء المجهر.
Materials
| Name | Company | Catalog Number | Comments |
| 35 mm glass bottom culture dish | MatTek Corporation; Ashland, MA | P35G-1.5-20-C | |
| 35 mm μ-Dish | Ibidi USA LLC, Verona, WI | 81156 | |
| Microscope body | Nikon Instruments Inc. | Nikon Eclipse Ti | |
| Motorized microscope X-Y stage | Prior Scientific; Rockland, MA | H117 ProScan Flat Top | |
| Motorized filter wheels | Prior Scientific | HF110 10 position filter wheel | |
| Fluorescent illumination source | Lumen Dynamics; Mississauga, Ontario Canada | X-Cite 120Q | |
| Multi-band Fluorescence filter sets | Chroma Technology Corp.; Bellows Falls, VT | 89000 Sedat Quad - ET 89006 ECFP/EYFP/mCherry - ET | |
| EM-CCD camera | Andor Technology USA; South Windsor, CT | iXon3 897 | |
| Chamlide stage top environmental incubator | Live Cell Instruments; Seoul, South Korea | TC-L-10 | |
| Objective lens heater | Bioptecs; Butler, PA | 150803 Controller 150819-12-08 Heater | |
| Analysis software | Nikon Instruments Inc.; Melville, NY | NIS Elements |
References
- Johnson, D. C., Baines, J. D. Herpesviruses remodel host membranes for virus egress. Nature reviews. Microbiology. 9 (5), 382-394 (2011).
- Mettenleiter, T. C., Klupp, B. G., Granzow, H. Herpesvirus assembly: a tale of two membranes. Current Opinion in Microbiology. 9 (4), 423-429 (2006).
- Saksena, M. M., Wakisaka, H., et al. Herpes simplex virus type 1 accumulation, envelopment, and exit in growth cones and varicosities in mid-distal regions of axons. Journal of Virology. 80 (7), 3592-3606 (2006).
- Snyder, A., Wisner, T. W., Johnson, D. C. Herpes Simplex Virus Capsids Are Transported in Neuronal Axons without an Envelope Containing the Viral Glycoproteins. Journal of Virology. 80 (22), 11165-11177 (2006).
- Snyder, A., Polcicova, K., Johnson, D. C. Herpes simplex virus gE/gI and US9 proteins promote transport of both capsids and virion glycoproteins in neuronal axons. Journal of Virology. 82 (21), 10613-10624 (2008).
- Tomishima, M. J. A conserved alpha-herpesvirus protein necessary for axonal localization of viral membrane proteins. The Journal of Cell Biology. 154 (4), 741-752 (2001).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. G. Immunolabeling artifacts and the need for live-cell imaging. Nature Methods. 9 (2), 152-158 (2012).
- Kratchmarov, R., Taylor, M. P., Enquist, L. W. Making the case: Married versus Separate models of alphaherpes virus anterograde transport in axons. Reviews in Medical Virology. 22 (6), 378-391 (2012).
- Antinone, S. E., Smith, G. A. Two modes of herpesvirus trafficking in neurons: membrane acquisition directs motion. Journal of Virology. 80 (22), 11235-11240 (2006).
- Del Rio, T., Ch'ng, T. H., Flood, E. A., Gross, S. P., Enquist, L. W. Heterogeneity of a fluorescent tegument component in single pseudorabies virus virions and enveloped axonal assemblies. Journal of Virology. 79 (7), 3903-3919 (2005).
- Taylor, M. P., Kramer, T., Lyman, M. G., Kratchmarov, R., Enquist, L. W. Visualization of an alphaherpesvirus membrane protein that is essential for anterograde axonal spread of infection in neurons. mBio. 3 (2), (2012).
- Taylor, M. P., Kobiler, O. Alphaherpesvirus axon-to-cell spread involves limited virion transmission. Proceedings of the National Academy of Sciences. , (2012).
- Kobiler, O., Brodersen, P., Taylor, M. P., Ludmir, E. B., Enquist, L. W. Herpesvirus replication compartments originate with single incoming viral genomes. mBio. 2 (6), (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nature Methods. 2 (12), 905-909 (2005).
- Snapp, E. L. Fluorescent proteins: a cell biologist's user guide. Trends in Cell Biology. 19 (11), 649-655 (2009).
- Ch'ng, T. H., Flood, E. A., Enquist, L. W. Culturing primary and transformed neuronal cells for studying pseudorabies virus infection. Methods in molecular biology (Clifton, N.J.). , 292-299 (2005).
- Curanovic, D., Ch'ng, T. H., Szpara, M., Enquist, L. Compartmented neuron cultures for directional infection by alpha herpesviruses. Current protocols in cell biology. Chapter 26 (Unit 26.4), (2009).
- Zareen, N., Greene, L. A. Protocol for culturing sympathetic neurons from rat superior cervical ganglia (SCG). J. Vis. Exp. (23), e988 (2009).
- Ch'ng, T. H., Enquist, L. W. Neuron-to-Cell Spread of Pseudorabies Virus in a Compartmented Neuronal Culture System. Journal of Virology. 79 (17), 10875-10889 (2005).
- Campenot, R. B., Lund, K., Mok, S. -. A. Production of compartmented cultures of rat sympathetic neurons. Nature Protocols. 4 (12), 1869-1887 (2009).
- Kramer, T., Greco, T. M., Taylor, M. P., Ambrosini, A. E., Cristea, I. M., Enquist, L. W. Kinesin-3 Mediates Axonal Sorting and Directional Transport of Alphaherpesvirus Particles in Neurons. Cell Host & Microbe. 12 (6), 806-814 (2012).
- Smith, G. A., Gross, S. P., Enquist, L. W. Herpesviruses use bidirectional fast-axonal transport to spread in sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 98 (6), 3466 (2001).
- Kramer, T., Enquist, L. W. Alphaherpesvirus Infection Disrupts Mitochondrial Transport in Neurons. Cell Host & Microbe. 11 (5), 504-514 (2012).
- Swedlow, J. R., Platani, M. Live cell imaging using wide-field microscopy and deconvolution. Cell Structure and Function. 27 (5), 335-341 (2002).
- Kaech, S., Huang, C. F., Banker, G. Short-Term High-Resolution Imaging of Developing Hippocampal Neurons in Culture. Cold Spring Harbor Protocols. 2012 (3), (2012).
- Frigault, M. M., Lacoste, J., Swift, J. L., Brown, C. M. Live-cell microscopy - tips and tools. Journal of Cell Science. 122 (6), 753-767 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved