Method Article
Alphaherpes 바이러스 선행 성 전송 및 확산의 라이브 셀 이미징
요약
alphaherpes 바이러스 감염의 라이브 셀 이미징 직접 수송 및 간 스프레드의 동적 이벤트 분석을 할 수 있습니다. 여기, 우리는 차 신경의 감염시 바이러스 어셈블리의 시각화를 촉진하기 위해 형광 융합 단백질을 발현하는 재조합 바이러스의 변종을 활용 방법론을 제시한다.
초록
살아있는 세포 형광 현미경 기술뿐만 아니라 형광 융합 단백질을 표현하는 재조합 바이러스 변종의 건설의 발전은 수송과 뉴런의 alphaherpes 바이러스 감염의 확산을 실시간으로 시각화를 가능하게했다. 라이브 셀 이미징과 함께 바이러스 성 막, 외피 및 캡시드에 새로운 형광 융합 단백질의 유틸리티, 축삭 내에서 전송을 겪고 바이러스 입자 어셈블리를 확인했다. 비슷한 도구가 성공적으로 세포 사이에 전송 비리의 수와 다양성을 정량화하는 바이러스 입자의 확산 세포 - 세포의 분석에 사용되어왔다. 중요한 것은, 선행 성 수송과 확산의 라이브 셀 이미징 기술은 입자의 전송 속도, 입자 분포, 단백질 지방화의 시간적 분석 등 다양한 정보를 생성합니다. 클래식 바이러스 성 유전자 기술과 함께, 이러한 방법론 중요한 통찰력을 제공하고 있습니다중요한 기계적인 문제에. 이 문서에서 우리는 자세히 alphaherpes 바이러스 수송과 확산의 기본적인 질문에 대답하기 위해 개발 된 이미징 방법을 설명합니다.
서문
alphaherpes와 같은 단순 포진 바이러스와 같은 바이러스 (HSV) -1, -2, 그리고 pseudorabies 바이러스에 의한 말초 신경계 (PNS)의 감염 (PRV) 바이러스 라이프 사이클 전반에 걸쳐 여러 가지 복잡하고 규제가 심한 단계를 포함한다. PNS의 뉴런 내에서의 운반은 기본 바이러스 감염 및 후속 호스트 간 스프레드 모두의 이벤트 기간 동안 중요합니다. 바이러스 생활주기의 두 가지 구성 요소를 조절 분자 메커니즘, 멀리 축삭 (선행 성 전송) 및 감염 세포 (선행 성 확산)에 비리의 연속 전송에서 세포 기관에서 바이러스 어셈블리를 직접 전송 이해 헤르페스 바이러스 병인에 중요하다.
신경에 바이러스 입자의 전송과 송신은 성숙한 감염 virion의 1,2의 집합에 따라 달라집니다. 면역 (IF)과 전자 현미경 (EM)를 포함하여 이전에 고정 된 분석은, 입자의 조립 상태와 제자를 연구하는 데 사용되었다EIN 상호 작용 virion의 수송 및 확산 3-6와 관련. 그러나 화학 고정에 의해 도입 운반 비리 실험 유물의 동적 특성은 고정 된 이미지 7,8의 해석을 혼동. 최근 바이러스 형광 융합 단백질의 수는 단백질 기능의 무시할만한 영향을 미칠 HSV와 PRV에 대해 설명하고있다. 캡시드, 외피 및 당 단백질 9-11 : 녹색 형광 단백질 (GFP), 레드 형광 단백질 (mCherry 또는 MRFP) 형광체는 종종 성숙한 virion의 세 가지 구조 구성 요소의 두 가지 영상을 허용 한 쌍이된다. 이중 라벨 바이러스를 사용하여 선행 성 교통 세포 이미징을 살고는 수송 도중 바이러스 입자의 조립 상태를 시각화. 바이러스 변종을 표현 유사 형광은 수와 확산 12,13 다음 바이러스 게놈의 다양성을 시각화하는 데 사용됩니다. 형광 단백질의 특성 (14,15에 리뷰) 크게 영향을바이러스 또는 휴대 어셈블리를 시각화 할 수있는 능력. 야생형 기능의 보존을위한 새로운 단백질 융합을 설계하고 테스트 할 때 자기 상호 작용과 안정성 등 형광 단백질의 고유 특성이 고려되어야한다.
형광 단백질의 융합, 두 체외 세포 배양 시스템에서 잘 특성화와 함께 헤르페스 바이러스 감염의 라이브 셀 이미징에 대한 사용된다 : 해리 16, 17 (그림 1A) 쥐 우수 자궁 경부 신경절 (SCG) 뉴런을하게 구분. 두 시스템에서 배아 SCG의는 하나의 세포 기관에 해리, 해부, 체외 배양 18에 대한 도금. SCG 신경은 자율 신경계의 일부이며 쉽게 성숙한 편광 상태 전직 생체에 배양 신경 성장 인자 (NGF)으로 구분 될 수있다. 해리 SCG 뉴런은 F 수 축색 돌기의 확장 된 네트워크를 형성또는 그들이 선행 성 교통 6를 받아야로 바이러스 입자의 시각화. 구획화 SCG 문화는 신경 세포체 (S 구획) 및 원위부 축삭 말단 (N 칸) 19의 유체 절연을 제공합니다. 원래 20 수정 Campenot 챔버 17를 사용하여 구획 된 뉴런의 건설 및 사용에 대한 자세한 프로토콜의 수는 이전에 다음 ID로 출판되었다. 유체 분리는 신경 세포 기관 및 격리 된 축삭 말단에 전송 한 후 자손 비리의 탐지를 선택적으로 감염 할 수 있습니다. 감염 전에 말단에 상피 세포를 도금하는 것은 바이러스 감염의 확산을 위해받는 세포를 제공합니다.
이 모든 라이브 셀 이미징 실험을위한 중요한 많은 필수 요소가 있지만, 우리의 프로토콜에 가장 관련이 있습니다 : 자동 이미지 수집, 형광등 조명, 영상의 속도 및 환경 제어. 모든 이미징 실험을 위해, 우리는 사용거꾸로, 자동화, epifluorescence에 조명 현미경 (그림 1B). 현미경은 니콘 이클립스 티베이스 중심으로 빠르게 재구성 자동화 이미지 수집하는 동안 현미경의 컴퓨터 제어 자동화 시스템의 숫자를 채택하고 있습니다. 형광 조명을 위해, 우리는 조명 경로를 따라 중립적 인 밀도 필터 감쇠 할 수 있습니다 광범위한 스펙트럼 수은 아크 램프를 사용합니다. 여기 필터는 형광 조명의 스펙트럼을 제한하고 멀티 패스 이색 거울과 형광 방출 필터 특정 형광 물질을 시각화와 결합 할 때. 여기 및 방출 필터는 서로 다른 형광 채널의 빠른 연속 획득을 가능하게하는 독립적 인 고속 스위칭 필터 휠에 장착되어 있습니다. 이미지 수집의 속도는 더욱 낮은 강도 신호와 짧은 이미지 번 읽어 검출에 유용 민감하고 빠른 EM-CCD 카메라로 향상됩니다. microsc의 환경 제어OPE는 인큐베이터 가열 스테이지 위쪽 및 가습 및 CO 2 농축 분위기 인큐베이터로 전달되는 동안 고온에서 샘플을 유지하기 위해 대물 렌즈 히터로 이루어집니다. 현미경 있으며 25 유지 온도와 어두운 방에 보관 ° C 모든 창에 암막 커튼을 최소화 외부 빛. 다음 프로토콜은 선행 성 전송 및 확산 분석이 시스템의 사용을 설명합니다.
대안의 숫자는 라이브 셀 이미징의 변수를 제어하기 위해 존재합니다. 현미경 설정의 제어는 수동으로 또는 독점 소프트웨어에 따라 자동화 된 시스템을 통해 수행 할 수 있습니다. 형광 조명은 할로겐, LED 또는 레이저 소스를 얻을 수 있습니다. 영상의 속도는 필터 전환의 속도와 짝을 탐지 시스템에 신호를 시각화하는 시간으로 변경됩니다. 환경 제어 마일에 특수 하드웨어를 얻을 수 있습니다croscope 단계 전부 또는 가열 가습 상자에서 현미경의 일부, 또는 현미경을 수행 할 실내의 온도를 상승으로의 인클로저. 이러한 대안 각각의 비용 및 성능과 관련된 장점과 단점이 있습니다.
다음 프로토콜, 우리는 당신에게 세부 사항을 재조합 바이러스 변종의 사용을 통해 빠른 선행 성 전송 및 alphaherpes 바이러스의 선행 성 확산을 연구하는 라이브 셀 이미징을 사용합니다. 실시간 라이브 셀 이미징 캡시드 (capsid), 외피 및 / 또는 축삭 11에서 전송받은 동적 구조에서 당 단백질의 공동 지방화를 시각화. 구획화의 연결을 문화의 하룻밤 인터벌 영상은 감염 세포 12의 축삭 virion의 탈출구 감염을 시각화. 여기에 제시된 프로토콜은 우리의 특정 이미징 시스템에 사용하도록 최적화되어 있지만, 라이브 셀 이미징의 네 가지 요소에 상대적으로 넓은 의미로 표시됩니다. 토론 우리더 세부 사항이 성공적으로 실험에 필요한 최적화의 일부 것이다.
프로토콜
제 1 항 - 라이브 세포 형광 현미경을위한 환경 제어 조건
- 모든 영상 실험에 앞서 30 분에 연결하고 현미경 스테이지 위에 인큐베이터을 따뜻하게 시작합니다.
- 현미경, 전송되고 epifluorescent 광원, 자동화 하드웨어 컨트롤을 켭니다. 현미경에 연결하고 EM-CCD 카메라를 냉각하기 위해 현미경 제어 소프트웨어, NIS 요소를 엽니 다.
- . 렌즈 적합한 목적 (하나 60X 나 100X 기름 침지)에 따뜻한 참고 첨부 : 실험 유형에 따라 대물 렌즈를 선택합니다. 60X 단계의 목적은 선행 성 확산을 시각화하기 적합하는 동안 100X 미분 간섭 대비 (DIC)은 선행 성 수송 virion의 어셈블리 추적에 가장 적합합니다. 그들은 샘플과 직접 접촉하지 않기 때문에 낮은 배율, 비 기름 침지 목표 렌즈 따뜻한 필요하지 않습니다.
- 마일의 전동 무대에 무대 위로 보육을 연결 croscope. 샘플이 자리에 개최 적절한 삽입을 보장합니다. 인큐베이터 컨트롤에서 무대 위에 인큐베이터의 입력 포트에 가습 공기 라인을 연결합니다.
- 인큐베이터와 렌즈 따뜻한 컨트롤을 설정하고 (설명 참조) 몇 군데되는 목적과 샘플에 대한 구체적인 이전에 확인 된 상태로 온도 설정을 조정합니다.
- 5 % CO 2 / 최고 배양기를 준비하는 CO 2 보충 공기를 제공하기 위해 95 % 대기 탱크 제어 밸브를 엽니 다. 유량은 분당 가스의 60 내지 80 ML해야합니다. 빠른 속도는 가습 챔버에도 불구하고 광범위한 샘플 탈수가 발생합니다.
- 대물 렌즈에 렌즈 오일을 추가하고 바로 무대 위에 인큐베이터로 이미지화되는 문화를 놓습니다.
- 10 분의 최소 문화의 온도 평형을 허용합니다. 한 시간 특히 3 장에서 설명 하룻밤 이미징 바람직하다.
- 6 ~ 8 시간 전에 이미징, 테일러 등에 설명 된 방법을 사용하여 관심있는 바이러스 1 X 10 6 플라크 형성 단위와 성숙, 해리 SCG 뉴런의 35mm coverslip에 바닥 접시를 (예를 들어 바이러스를 표 1 참조) 감염 알. 2012A 11. 30 ~ 60 분에 한 개 이상의 바이러스, 오프 세트 접종을 테스트하는 유사한 시간 후 감염에 순차적으로 샘플 이미징을 허용하는 경우.
- 어떤 실험을 실행하기 전에 10 분 최소 무대 위에 인큐베이터에 접시를 삽입합니다. 온도가 평형을하는 동안 초점면이 이동하고 부정적인 모든 이미징 실험에 영향을 미칠 것입니다.
- 전송 빛과 현미경의 접안 렌즈를 사용하여 명확하게 고립 된 축삭 확장명을 가진 신경 세포의 시체를 찾을 수 있습니다. 또한, 검출을 표현하는 세포를 찾아 적절한 형광 조명을 사용형광 단백질의 테이블 양. 그것은 빛 때문에 유도 된 세포 손상의과 형광 단백질의 표백,이 단계와 이후 단계에서 형광등 조명에 시료의 노출을 제한하는 것이 중요합니다.
- 세포가 노출하는 여기 빛의 강도를 줄이기 위해 형광 조명을 약하게. 중성 농도 (ND) 형광 조명 빛의 경로에 필터를 감쇠 빛을 갖습니다. 이상 1 분, ND4의 최소값보다 지속 동영상이 형광 단백질의 사진 - 표백 및 축삭의 사진 손상 광범위을 방지하기 위해 사용되어야합니다. 높은 형광 구조는 일반적으로 장소에 ND8 필터를 시각화 할 수 있습니다.
- 현미경 소프트웨어 (그림 2 및 보충 영화 1A)를 사용하여 EM-CCD 카메라에 빛의 경로를 전환합니다.
- 각각의 형광 채널에 대한 최적의 이미징 시간과 조건을 결정합니다.
- "재생"버튼을 사용하여 라이브 이미지 창을 시작합니다.
- 각 형광 단백질을위한 최적의 카메라 노출 설정을 확인합니다. 빠르게 움직이는 virion의 구조 운동의 수차로 채널당 300 밀리 초를 초과하지 마십시오 발생합니다. (제조 업체의 최대 이득 제안), 노출 시간을 최소화하고 희미한 신호의 검출을 향상시키기 위해 300의 설정으로 카메라의 EM 게인을 사용합니다. 정확한 노출 시간이 낮은 배경 강도 높은 특정 신호 이미지를 생성합니다.
- 노출을 설정하고 축삭의 잘 정의 된 영역을 찾은 후, 소프트웨어는 자동으로 이미지 수집을 수행하도록 구성해야합니다. 표백 샘플을 방지하기 위해 라이브 영상 창을 중지합니다.
- NIS 요소 소프트웨어에서 6D 선택 - 정의 / 다운 메뉴에서 "응용 프로그램"드롭에서 실험 응용 프로그램을 실행합니다.
- ND 수집 창에서 이미지 수집의 빈도를 결정하는 시간 탭을 클릭합니다. "아니 지연"및 지속 시간 5 분까지의 간격을 설정합니다. 목전자 소프트웨어는 5 분 동안 가능한 최고 주파수에서 이미지 프레임을 습득합니다.
- 여러 형광 이미지 획득에 사용되는 사전 설정 하드웨어 구성을 선택할 수있는 "람다"탭을 선택합니다. 첫 번째 상자를 클릭하고 다운 메뉴에서 다음 드롭 적절한 하드웨어 구성을 선택합니다. 이미지에 표시 할 모든 형광 단백질에 대해이 단계를 반복합니다.
- "XY 위치 위치", "Z 시리즈"와 "큰 이미지"에 대한 탭이 선택 취소되어 있는지 확인합니다.
- 탭 위에 표시된 상자가 자동으로 수집하는 동안 하드 디스크에 이미지를 저장하기 위해 "파일에 저장"을 선택합니다. 실험 출력 파일의 위치와 파일 이름을 구성합니다. 연속적인 실험이 수행되면, 소프트웨어는 지정된 파일 이름 끝에 일련 번호를 추가합니다.
- 일단 모든 탭이 선택되었습니다. "실행 - 이제"버튼을 클릭하여 실험을 시작합니다.
- 노출 설정을 통해 이미지 수집 속도를 최적화하고 IMAG전자 크기입니다. 이미지 수 영역의 작은 영역을 사용하면 종종 프레임 수집 속도를 빠르게합니다. 25 % 전체 이미지 영역의 50 % 사이의 영역을 선택 NIS-요소 ROI 도구를 사용하여 관심 영역을 정의합니다. 또는 짧은 노출 시간은 프레임 수집 속도를 증가하지만 (설명 참조) 신호의 품질을 저하 할 것이다.
제 3 항 - 선행 성 확산 이벤트 밤새 시간 경과 영상
- 이미징 이전에 네 시간, 35mm μ-접시에 건설 구획화의 연결 문화를 감염. 테일러 등에 설명 된 방법을 사용하여 (예를 들어 바이러스를 표 1 참조) 그 바이러스의 1 X 10 6 플라크 형성 단위와 신경 세포 기관을 접종한다. 2012b 12.
- 조심스럽게 무대 위로 인큐베이터에 배양 접시를 놓습니다. 목표의 위치를 접시의 측면에 설정되어 있는지 확인합니다. 천천히 초점 ensur에에 목적을 가지고목표를 ING하면 샘플로 밀어하지 않습니다. 포커스 필드가 확인되면, 천천히 축삭 구획의 내부면을 demarking 내부 장벽 근처 접시의 중앙에 목표를 이동합니다. 운동을하는 동안, 초점 심도가 유지되도록하고 샘플로 밀어하지 마십시오. 목적에 의한 플라스틱 표면의 변형은 축삭과 플라스틱을 손상 될 수 있습니다.
- 따뜻한 (~ 37 ° C) 인산 테프론 링 밖에서 배양 접시에 식염수 버퍼. 약 2 ML을 추가합니다 이 샘플 탈수를 최소화하고 단열을 제공하기 위해 PBS의 반지와의 연결 문화를 둘러싸고 있습니다.
- 온도가 자동 이미지 수집 (3.8)을 시작하기 전에 1 시간의 최소 평형 수 있습니다. 3.7 단계 3.5이 시간 동안 구성 할 수 있습니다.
- 모든 중립적 인 밀도 필터를 참여하여 낮은 수준으로 조명의 강도를 제한 할 수 있습니다. 이 빈번한 이미지 수집을 비켜 수사진 손상 과도한없이 R 오랜 시간 동안. 조명을 줄이는 것은 더 이상 노출 (토론 참조) 요구, 낮은 신호가 발생합니다.
- 역사적 노출 설정이나 셋업 2.5 절에 설명 된대로 대상 형광 단백질이 노출 설정을 구성하는 표현 감염된 상피 세포의 병렬 접시를 생성 실험하기 전에를 사용합니다.
- 필요한 채널에 대한 노출을 설정 한 후, 그것은 자동으로 이미지 수집 용 소프트웨어를 구성 할 때입니다. 표백 샘플을 제한하는 라이브 영상 창을 중지합니다.
- 요소 소프트웨어 (그림 2 및 보충 영화 2)에서 6D 선택 - ND 취득 창을 가지고 아래 "응용 프로그램"드롭 메뉴에서 실험 응용 프로그램을 정의 / 실행합니다.
- ND 취득 창에서 시간 탭을 클릭합니다. "5 분"으로 간격을 설정합니다. 20 시간의 지속 시간을 설정합니다. 루프 필드가 자동으로 PROGRA 반복의 수를 계산합니다남성 수행합니다.
- "람다"탭을 선택합니다. 첫 번째 상자를 클릭하고 다운 메뉴에서 다음 드롭 위상차에 해당하는 람다 구성을 선택합니다. 이미지에 표시 할 각 형광 단백질에 대한 적절한 구성을 선택, 다음의 위치에 대해 반복합니다.
- 보기의 큰 하나의 필드로 결합 할 여러 이미지의 매개 변수를 결정하는 "큰 이미지"탭을 선택합니다. 좋은 크기의 면적은 7 % 바느질 중복을 사용하여 5 × 2 이미지로 구성되어 있습니다. 이 이미지 수집의 빈도에 영향을주지 않고 이미지에 표시 할 위치 당 세포의 최대 수를 허용합니다. 또한, "무대 이동 중 닫기 액티브 셔터"확인란을 선택 취소합니다. 이 옵션은 이미지 사이의 셔터를 닫는하여 인수의 속도를 향상시킵니다.
- , "XY 위치 위치"탭을 선택 순차적으로 밤새 영화의 과정에서 병렬로 이미지를 만들 여러 위치를 식별 할 수 있습니다. 센터 포를 정의 할 위치를 선택합니다각 큰 이미지 영역으로 int로. 예제 6-8 이미지 위치를 선택합니다. 좋은 이미지 영역은 명확하게 정의 된 축삭에 가까운 동격의 세포의 작은 클러스터를해야합니다. 세포는 최소화해야 서로 축삭 번들의 상단에 쌓여 할 수 없습니다. 초점 포인트는 세포의 핵이다. 명확하게 정의 된 핵 봉투 세포의 대부분을 볼 수 있도록 목표를 놓습니다.
- "Z 시리즈"탭이 선택 해제되어 있는지 확인합니다.
- 위의 2.6.5 절에 설명 된대로 자동 저장 기능을 구성합니다.
- "1 회 루프"를 클릭하여 노출 및 위치 설정을 테스트합니다. 투과광 조명, 초점, 및 프레임에 대한 결과 이미지를 평가합니다. 초점이 이동 한 경우, XY 탭에서 각 위치에 대해 초점을 다시 설정합니다. 10 분을 기다린 후 초점이 안정 될 때까지이 단계를 반복합니다.
- 모든 설정을 확인 및 테스트 한 후 "지금 실행"버튼을 클릭하여 자동화 실험을 시작합니다.
제 4 항 - 이미지 프로세싱 및 수출
데이터 내보내기
- 운송 또는 스프레드 이벤트의 라이브 세포 이미징 동안 얻어진 데이터 세트는 프레 젠 테이션 및 출판물 (보충 영화 3)에서 나중에 사용하기 위해 일반적으로 사용되는 파일 형식으로 NIS 요소 소프트웨어에서 내 보낸되어야한다. NIS 요소에 영화 적절한 원시. ND2 파일을 열 내보내고 원하는 형광 채널을 시각화하기 위해 "분할 구성 요소"보기를 선택합니다. 재생이 적절한 속도로 파일, 초당 5 프레임은 빠른 전송의 시각화를위한 좋은 출발점입니다.
- 동영상 재생 중에 실시간 클럭을 나타내는 타임 스탬프를 포함합니다. 이미지를 마우스 오른쪽 버튼으로 클릭하고, ND-정보를 추가합니다. 디지털 카운터는 왼쪽 상단에 표시됩니다.
- 정보를 표시하는 타임 스탬프를 편집합니다. 오른쪽 카운터에 클릭하고 편집 ND-정보를 선택합니다. 다음 팝업 창에서, 이마 기를 반영하기 위해 텍스트를 편집중요 NG 매개 변수입니다. 명확성을 위해 편집 글꼴, 색상 및 크기.
- "편집"메뉴로 가서 "보기 스냅 샷 만들기"또는 "X"키를 누르면 찾을 수 있습니다. 이 명령은 "보기 스냅 샷"창을 엽니 다. 선택은 8 비트, RGB, 전체 영화의 형광 채널을 포함하는 수출 준비 파일을 생성하기 위해 "모든 프레임에 적용됩니다."
- 크로스 플랫폼 호환성을 위해. AVI 파일로 저장합니다. 프레임 당 200 밀리 초에서 재생 속도를 설정합니다. NIS 요소에 의해 생성 된. AVI 파일은 다음 추가 원하는 파일 형식으로 다른 변환 소프트웨어를 사용하여 압축 할 수 있습니다.
결과
선행 성 전송
PRV 348와 해리 SCG 문화의 감염이 프로토콜의 응용 프로그램은 GFP-US9와 GM-mCherry 막 융합 단백질을 발현하는 재조합 PRV의 변형, 비리의 선행 성 전송 (그림 3 및 보충 영화 4)의 시각화를 촉진했다. 눈물 점을 운반에 자신의 검출 바이러스 입자 결과, 앞서 언급 한 이미징 조건으로 이러한 융합 단백질의 결합은 필터 전환 중에 움직이는 입자의 각 형광의 오프셋을 최소화합니다. 3 분 영상 창에서 수많은 운반 눈물 점은 일반적으로 관찰하고 colocalization을 분석을위한 큰 샘플 크기가 빠르게 생성됩니다. 우리는 이전에 GFP-US9의 colocalization을을 정량화 한, alphaherpes 바이러스 축삭이 방법 11을 사용하는 다른 구조 단백질과 단백질을 대상으로. 다른 듀얼 recombinan 유사한 분석T PRV의 변종도 11 설명하고 있고, 최근의 연구는이 프로토콜 21의 추가 확장에서 찬란 태그 호스트 모터 단백질과 PRV 단백질의 공동 수송을 문서화했습니다. 고속 스위칭 필터 휠 페어링 된 멀티 패스 이색 거울을 활용하여 두 개 이상의 형광 채널의 빠른 순차적으로 획득 할 수 있습니다. 우리는 현재 초당 0.8 프레임의 속도로 2 채널 연속 획득을 달성 할 수있다. 단지 카메라의 형광 노출 시간 및 읽기 시간에 의해 제한됩니다 싱글 채널 비디오 현미경, 위해, 우리는 초당 10 프레임보다 큰 수집 속도를 얻을 수 있습니다.
선행 성 확산
선행 성 확산 이벤트를 시각화하기 위해, 관심 분야는 시간이 비리 아래로 수송하고 축삭에서 탈출구, 근처의 상피 세포를 감염되는 동안 20 시간 기간마다 5 ~ 10 분을 구상하고 있습니다. 큰 이미지에서 대표 프레임은그림 4A 및 보충 영화 5에 제시되어있다. 축삭에서 차 감염을 나타내는 형광 단백질 발현 세포의 공간적 분리 특성을 확인합니다. 감염된 세포는 바이러스 감염을 시작한 형광 캡시드를 시각화하는 영화 중에 거꾸로 추적 할 수 있습니다. 이들 각각의 세포는 큰 틀에서 분리 및 세부 사항의 상당한 손실없이 추적 할 수 있습니다. 보충 영화 6에서 대표 프레임 (그림 4B)는 비리가 세포질에 형광 캡시드를 입금 한 후 시간을 보여줍니다.
데이터 분석
다른 분석의 범위는 입자 추적, colocalization을 연구 및 virion의 확산 이벤트의 정량화 등의 라이브 세포 이미징 데이터 집합을 수행 할 수 있습니다. 우리는 종종 직접 NIS 요소 소프트웨어에서 우리의 분석을 수행하거나 플러그인을 활용 가능한 확장 이마에 대한그 geJ 소프트웨어 패키지가 있습니다. ND2 파일 형식을 지원합니다. 다른 가설과 실험 설정은 고유 한 분석 방법을 필요. 우리 그룹은 동적 구조 11,21 개별 입자의 확산 이벤트 10,12,22의 시간 경과 정량화에 형광 단백질의 colocalization을을 평가하기위한 방법을 설명하고있다. 방법론이 원고에 대해 설명하고 우리의 이전 연구는 유연하고 다양한 바이러스 감염뿐만 아니라 세포 구조의 수송, 예를 들면 미토콘드리아 23에 적용 할 수 있습니다.
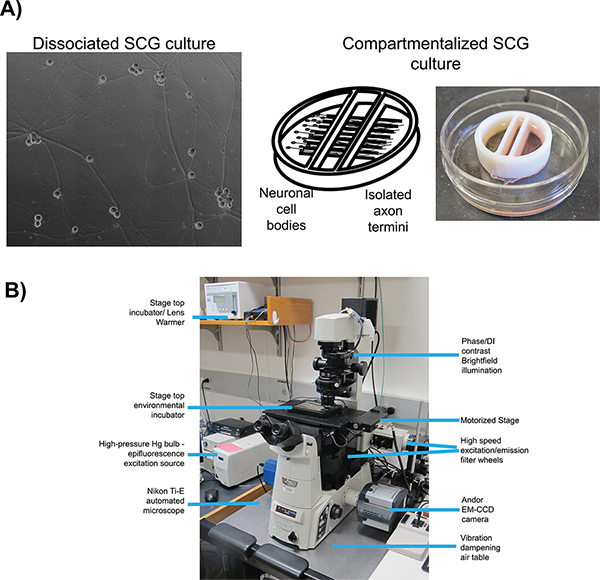
그림 1. 현미경의 개략도 라이브 셀 이미징 설정합니다. ) 문화 유형은 선행 성 전송 (해리)와 선행 성 확산 (챔버) 각각의 연구에 대한 고용. 패널 1 성숙, 해리 우수한 경부 신경절 (SCG)의 위상 콘트라스트 이미지. 패널 2는 오른쪽 함. B) 거꾸로 epifluorescent 현미경 및 사용 단계 최고 인큐베이터 구성에 내부 장벽 아래 확장 축삭 돌기의 왼쪽 구획에 도금 SCG 뉴런 패널 3 그림 구획 된 배양 시스템의 개략도이다 비디오 현미경 실험. 큰 그림을 보려면 여기를 클릭하십시오 .
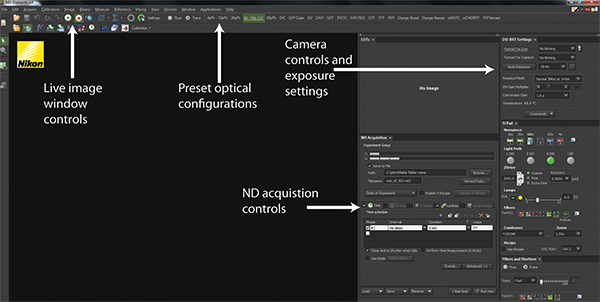
그림 2. NIS-요소 소프트웨어 인터페이스. NIS - 요소의 표준 사용자 인터페이스의 스크린 샷이 표시됩니다. 재생 및 정지 버튼은 라이브 이미지 창뿐만 아니라 현재 몇 군데되는 것과 이미징 현재 하드웨어 구성을 묘사 제어 할 수 있습니다. 상단 패널을 통해 사전 하드웨어 자체를 구현하는 광학 구성의 시리즈는트랜스 조명이나 형광 검출을위한 현미경을 구성하는 ttings. 카메라 제어 및 노출 설정은 카메라 탐지 구성 이미지 품질과 속도를 최적화 할 수 있습니다. 모든 실험은 ND 취득 컨트롤을 사용하여 조정됩니다. 큰 그림을 보려면 여기를 클릭하십시오 .

그림 3. PRV 348 8 시간 게시물 감염에서 SCG 축삭 세포 이미징을 살고있다. PRV 348 감염된 신경 세포가 GFP-US9와 GM-mCherry 막 융합 단백질을 표현. 원위부 축삭 내에서 선행 성 - 수송 구조는 두 개의 형광 채널, GFP 및 mCherry의 시각입니다. 보충 영화 4에서 찍은 순차 이미지에 묘사 된대로 선행 성 - 수송 구조 (흰색 화살표) 축삭 내에서 진행됩니다. 두 형광 단백질 spati 있습니다동맹 형광 채널과 바이러스 구조의 빠른 움직임의 연속적인 인수로 인해 오프로 설정합니다. 큰 그림을 보려면 여기를 클릭하십시오 .
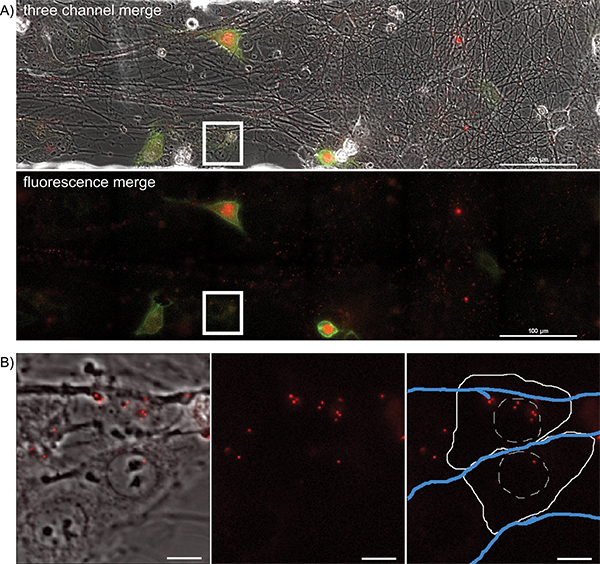
그림 4. 멀티 컬러 감염시 상피 세포 클러스터에 감염된 축삭에서 선행 성 확산 이벤트의 하룻밤 인터벌 영상. 하나의 위치,받는 사람 상피 세포에 PRV 427 감염된 축삭에서 virion의 전송의 큰 이미지 타일 시간 경과 영화의 대표 이미지.) 받는 사람 세포가 YFP - CAAX와 VP26-MRFP 융합 단백질을 표현하기 시작 시간 후 감염의 전송 YFP 및 RFP 형광 이미지의 병합 된 이미지. 두 번째 패널에서 YFP 및 RFP 채널이 함께 표시됩니다. MRFP 눈물 점 Asso의의 큰 번호를 기록합니다축삭 책자와 ciated. 이러한 축삭 내에서 장거리 수송 (보충 영화 2)를 받고 조립 비리 있습니다. 흰색 상자)는 감염 캡시드 어셈블리가 포함 된받는 사람 상피 세포의 대표 이미지 (보충 영화도 3 참조) 부분 B. B에서 강조 관심의 영역을 나타냅니다. 패널 1은 송신 및 RFP 채널의 병합이다. 패널 2 만 RFP 채널입니다. 패널 3 회로도 셀 개요 (단단한 백색 선)의 표현, 핵 (해시 흰색 선) 및 축삭 (파란색 선)와 RFP 채널입니다. 큰 그림을 보려면 여기를 클릭하십시오 .
보충 영화 1. 축삭 비리 신속, 연속 수집을위한 소프트웨어 설정., 노출 설정을 결정 ND 수집 컨트롤을 구성, 빠른 프레임 인수 미주리 취득과 관련된 단계축삭 수송을 받고 형광 비리의 경쟁이 표시됩니다. SCG 신경 세포 배양은 8 시간 전에 이미징 PRV 427에 감염되었다. 동영상을 보려면 여기를 클릭하십시오 .
보충 영화 2. 소프트웨어 축삭 간 세포 확산의 하룻밤 이미지의 설정. 축삭 간 세포의 확산 이벤트의 하룻밤 이미징 ND 수집 제어 구성과 관련된 단계를 제시가. 동영상을 보려면 여기를 클릭하십시오 .
보충 영화 3. 변환. 흉 영화 형식으로 ND2 파일. 원시 데이터를 변환과 관련된 단계. 일반적인 비디오 플레이어를 사용하여 프레 젠 테이션을위한 ND2 파일. AVI 또는. mov 파일 포맷 중 하나에이. 그녀를 클릭하십시오동영상을 볼 수있는 전자.
보충 영화 4. PRV 348에 8 시간 후 감염에서 축삭을 SCG의 세포 이미징을 살고 있습니다. 동영상을 보려면 여기를 클릭하십시오 .
보충 영화 5. 의 축삭 간 세포의 확산. 하룻밤 이미지의 큰 이미지 영역은 동영상을 보려면 여기를 클릭하십시오 .
보충 영화 6. 의 축삭 간 세포의 확산. 하룻밤 인터벌 영상의 확대 영역은 동영상을 보려면 여기를 클릭하십시오 .
| 변형 | 유전자형 | 유틸리티 |
| PRV 341 | GFP-US9 (막) / MRFP-Vp26 (캡시드) | virion의 전송 실험 11 |
| PRV 348 | GFP-US9 (막) / GM-mCherry (막) | virion의 전송 실험 11 |
| PRV 427 | MRFP-VP26 (캡시드) / YFP - CAAX (세포 원형질막) | 선행 성 확산 실험 10 |
표 1. 형광 융합 단백질을 표현하는 유용한 유전자 재조합 PRV의 변종.
| 이름 | 회사 | 카탈로그 번호 |
| 35mm 유리 바닥 문화 요리 | MatTek 공사, 애슐 랜드, MA | P35G - 1.5-20-C |
| 35mm μ-접시 | Ibidi USA LLC, 베로나, 위스콘신 | 81156 |
| 현미경 본체 | 니콘 인스트루먼트 주식회사 | 니켈콘 이클립스 티 |
| 전동 현미경 XY 스테이지 | 이전 과학, 록클 랜드, MA | H117 ProScan 플랫 톱 |
| 동력 여과기 바퀴 | 이전 과학 | HF110 10 위치 필터 휠 |
| 형광 조명 소스 | 루멘 역학, 미시 소거, 온타리오 캐나다 | 120Q X-인용 |
| 멀티 밴드 형광 필터 설정 | 채도 기술 공사, 벨로 우스 폴스, 버몬트 | 89000 Sedat 쿼드 - ET 89006 ECFP / EYFP / mCherry - ET |
| EM-CCD 카메라 | 도르 기술 미국, 사우스 윈저, 코네티컷 | iXon3 897 |
| Chamlide 무대 위에 환경 인큐베이터 | 셀 악기 살고 서울, 한국 | TC-L-10 |
| 대물 렌즈 히터 | Bioptecs, 버틀러, 펜실베이니아 | 150,803 컨트롤러150819-12-08 히터 |
| 분석 소프트웨어 | 니콘 인스트루먼츠, 멜빌, 뉴욕 | NIS 요소 |
표 2. 특정 시약 및 장비.
토론
그들은 관찰의 행위에 의한 중요한 변경없이 발생할 라이브 셀 이미징의 목표는 생물 학적 과정을 관찰합니다. 환경 제어, 영상의 속도 및 형광 조명이 목표는 세 가지 변수를 최적화하여 달성된다. 이러한 상호 종속 변수는 가능한 이미징 조건을 달성하기 위해 균형을해야합니다. 제시된 프로토콜은 대표적인 결과를 생성하는 특정 조건을 사용합니다. 우리는 간략하게 제시하는 특정 방법을 자세히 설명하기 전에 환경 제어 및 관측 손상을 설명합니다.
현미경에 관련된 생물학적 조건을 설정하고 유지하는 것은 세포 사건의 성공적인 모니터링에 매우 중요합니다. 대상 조건을 달성하면 현미경 보육 구성에 특정 변수의 수에 따라 달라집니다. 모든 인큐베이터 설정은 촬영 인큐베이터에서 모의 시료의 독립적 인 온도 측정을 사용하여 유효성을 검사해야목표의 접점, 문화 접시의 중간, 그리고 문화 접시의 가장자리, 등 여러 위치에서. 설정은 1 이상이다 영역을 최소화하도록 최적화되어야한다 37 ° C보다 따뜻한 ° C뿐만 아니라 가까운 37 ° C 목표의 접점에서 온도를 유지. 이미징에 사용되는 각 문화 요리와 목표 설정을 테스트하고 실험하기 전에 확인해야합니다. 이상적으로, 모든 샘플 이미지 중 온도 모니터링,하지만이 시스템의 수에 대한 허무 증명 및 생물학적 유해 에이전트를 고용하는 경우 복잡 할 수있다. 배양 조건의 유효성 검사는 인공적인 결과 또는 빠른 세포의 저하가 발생할 수 있습니다 너무 낮거나 온도가 너무 높은에서 샘플을 배양으로 중요합니다.
확인 및 관측 손상으로 인한 결과를 최소화하는 프로토콜 개발을 위해 중요합니다. 자주 조명 생물 학적 과정, IRR을 변경할 수 있습니다eversibly 형광 분자를 비활성화하거나, 세포 죽음 경로의 수를 유도. 온도 유효성 검사 표준 조직 문화 인큐베이터의 것과 유사한 무대 위에 생물학적으로 유사한 조건을 재현하는 것이 중요합니다. 자주 조명의 효과를 제어하는 것은 더 어렵고 종종 시행 착오 사례를 반복적 필요합니다. 형태 학적 차이 또는 생물학적으로 관련 변경에 대한 조직 문화 인큐베이터에 보관 병렬 샘플을 비교하면 확인할 수 있습니다 중요한 세포 독성 라이브 세포 이미징 조건 결과가 같은 경우. 여기에 설명 된 실험에서, 우리는 세포 사이 바이러스 확산 바이러스 역가뿐만 아니라 범위를 통해 바이러스 감염의 생산성을 모니터링했다.
축삭 내에서 빠른 전송의 실시간 영상을 달성하는 것은 형광 조명의 강도와 함께 이미지 수집 속도의 최적화가 필요합니다. 이미지 수집의 속도는 camer를에 의해 결정됩니다순차적으로 여러 개의 형광 채널을 수집, 특히 설정 및 현미경 하드웨어. 조도 형광 신호의 품질과 수집 속도에 영향을 미칩니다. 큰 조도 특히 소량의 입자에 통합하는 사람들을위한 형광 단백질보다 쉽게 시각화를 할 수 있습니다. 그러나, 샘플 향상된 광독성 손상 표백제 신속하고 고통을 것입니다. 중성 농도 필터를 통해 조명을 줄이면 이미지 수집의 빈도를 줄이고 잠재적으로 감지하는 동안 자신의 움직임에 의한 형광 구조의 공간적 변형을 일으키는 긴 노출 시간을 필요로합니다. 이미지 수집 주파수 조도의 올바른 균형을 찾는 것은 형광 단백질 신호와 연구되고 구조물의 운동의 속도에 크게 의존한다. 그것은 배경 위에 형광 구조를 구별하기에 충분한 신호를 얻기보다는에만 필요합니다긴 노출 시간을 필요로 높은 콘트라스트 이미지를 생성합니다.
하룻밤 인터벌 영상 실시간 라이브 세포 이미징과 비슷한 하드웨어 구성을 사용하지만 상당히 오랜 기간 자주 형광 조명과 관련된 축적 된 사진 손상에 의해 영향을받습니다. 실시간 영상과는 달리, 형광 조명 강도를 제한 할 필요가 중요하고, 다른 모든 변수가이 제한을 고려하여 수정됩니다. 노출의 강도를 제한하는 것은 상당히 군데 세포를 손상시키지 않고 여러 개의 형광 채널을 더 자주 조명을 할 수 있습니다. 선행 성 축삭 - 투 - 셀 스프레드 이벤트가 시간적 및 공간적으로 분산되어, 영상 넓은 지역에 가능한 한 이러한 간헐적 이벤트의 많은을 캡처하는 것이 필수적입니다 그래서.
출판물의 숫자는 라이브 셀 이미징 관행 24-26에 대한 철저한 개요 및 권장 사항을 제공하고 있습니다. 여기에 설명 된 프로토콜은 REPRESENT 바이러스 감염의 필수 기능을 유지하면서 바이러스 복제, 전송 및 확산에 형광 이미징의 영향을 최소화하기 위해 최선을하려고합니다. 형광 융합 단백질과 강력한 연결을 문화주의의 발전과 함께 이러한 프로토콜을 결합하면 헤르페스 바이러스 감염과 발병의 나의 근본적인 질문에 대답하고있다.
공개
우리는 공개 아무것도 없어.
감사의 말
LWE와 RK는 건강 보조금 R37 NS033506-16 R01 NS060699-03의 미국 국립 연구소에 의해 지원됩니다. MPT는 미국 암 협회 박사후 연구 원정대 (PF-10-057-01-MPC)에 의해 지원되었다. 박사 매튜 리먼 박사 오렌 Kobiler의 조언과 지식 현미경 구성과 라이브 셀 이미징 방법을 설계에 쓸모 있었다. 우리는 또한 현미경의 취득, 설치 및 성능에서의 기술 지원 닐 발로과 니콘 인스트루먼트의 브라이언 T. 케인 덕분에 확장 할 수 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| Name | Company | Catalogue number | |
| 35 mm glass bottom culture dish | MatTek Corporation; Ashland, MA | P35G-1.5-20-C | |
| 35 mm μ-Dish | Ibidi USA LLC, Verona, WI | 81156 | |
| Microscope body | Nikon Instruments Inc. | Nikon Eclipse Ti | |
| Motorized microscope X-Y stage | Prior Scientific; Rockland, MA | H117 ProScan Flat Top | |
| Motorized filter wheels | Prior Scientific | HF110 10 position filter wheel | |
| Fluorescent illumination source | Lumen Dynamics; Mississauga, Ontario Canada | X-Cite 120Q | |
| Multi-band Fluorescence filter sets | Chroma Technology Corp.; Bellows Falls, VT | 89000 Sedat Quad - ET 89006 ECFP/EYFP/mCherry - ET | |
| EM-CCD camera | Andor Technology USA; South Windsor, CT | iXon3 897 | |
| Chamlide stage top environmental incubator | Live Cell Instruments; Seoul, South Korea | TC-L-10 | |
| Objective lens heater | Bioptecs; Butler, PA | 150803 Controller 150819-12-08 Heater | |
| Analysis software | Nikon Instruments Inc.; Melville, NY | NIS Elements |
참고문헌
- Johnson, D. C., Baines, J. D. Herpesviruses remodel host membranes for virus egress. Nature reviews. Microbiology. 9 (5), 382-394 (2011).
- Mettenleiter, T. C., Klupp, B. G., Granzow, H. Herpesvirus assembly: a tale of two membranes. Current Opinion in Microbiology. 9 (4), 423-429 (2006).
- Saksena, M. M., Wakisaka, H., et al. Herpes simplex virus type 1 accumulation, envelopment, and exit in growth cones and varicosities in mid-distal regions of axons. Journal of Virology. 80 (7), 3592-3606 (2006).
- Snyder, A., Wisner, T. W., Johnson, D. C. Herpes Simplex Virus Capsids Are Transported in Neuronal Axons without an Envelope Containing the Viral Glycoproteins. Journal of Virology. 80 (22), 11165-11177 (2006).
- Snyder, A., Polcicova, K., Johnson, D. C. Herpes simplex virus gE/gI and US9 proteins promote transport of both capsids and virion glycoproteins in neuronal axons. Journal of Virology. 82 (21), 10613-10624 (2008).
- Tomishima, M. J. A conserved alpha-herpesvirus protein necessary for axonal localization of viral membrane proteins. The Journal of Cell Biology. 154 (4), 741-752 (2001).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. G. Immunolabeling artifacts and the need for live-cell imaging. Nature Methods. 9 (2), 152-158 (2012).
- Kratchmarov, R., Taylor, M. P., Enquist, L. W. Making the case: Married versus Separate models of alphaherpes virus anterograde transport in axons. Reviews in Medical Virology. 22 (6), 378-391 (2012).
- Antinone, S. E., Smith, G. A. Two modes of herpesvirus trafficking in neurons: membrane acquisition directs motion. Journal of Virology. 80 (22), 11235-11240 (2006).
- Del Rio, T., Ch'ng, T. H., Flood, E. A., Gross, S. P., Enquist, L. W. Heterogeneity of a fluorescent tegument component in single pseudorabies virus virions and enveloped axonal assemblies. Journal of Virology. 79 (7), 3903-3919 (2005).
- Taylor, M. P., Kramer, T., Lyman, M. G., Kratchmarov, R., Enquist, L. W. Visualization of an alphaherpesvirus membrane protein that is essential for anterograde axonal spread of infection in neurons. mBio. 3 (2), (2012).
- Taylor, M. P., Kobiler, O. Alphaherpesvirus axon-to-cell spread involves limited virion transmission. Proceedings of the National Academy of Sciences. , (2012).
- Kobiler, O., Brodersen, P., Taylor, M. P., Ludmir, E. B., Enquist, L. W. Herpesvirus replication compartments originate with single incoming viral genomes. mBio. 2 (6), (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nature Methods. 2 (12), 905-909 (2005).
- Snapp, E. L. Fluorescent proteins: a cell biologist's user guide. Trends in Cell Biology. 19 (11), 649-655 (2009).
- Ch'ng, T. H., Flood, E. A., Enquist, L. W. Culturing primary and transformed neuronal cells for studying pseudorabies virus infection. Methods in molecular biology (Clifton, N.J.). , 292-299 (2005).
- Curanovic, D., Ch'ng, T. H., Szpara, M., Enquist, L. Compartmented neuron cultures for directional infection by alpha herpesviruses. Current protocols in cell biology. Chapter 26 (Unit 26.4), (2009).
- Zareen, N., Greene, L. A. Protocol for culturing sympathetic neurons from rat superior cervical ganglia (SCG). J. Vis. Exp. (23), e988 (2009).
- Ch'ng, T. H., Enquist, L. W. Neuron-to-Cell Spread of Pseudorabies Virus in a Compartmented Neuronal Culture System. Journal of Virology. 79 (17), 10875-10889 (2005).
- Campenot, R. B., Lund, K., Mok, S. -. A. Production of compartmented cultures of rat sympathetic neurons. Nature Protocols. 4 (12), 1869-1887 (2009).
- Kramer, T., Greco, T. M., Taylor, M. P., Ambrosini, A. E., Cristea, I. M., Enquist, L. W. Kinesin-3 Mediates Axonal Sorting and Directional Transport of Alphaherpesvirus Particles in Neurons. Cell Host & Microbe. 12 (6), 806-814 (2012).
- Smith, G. A., Gross, S. P., Enquist, L. W. Herpesviruses use bidirectional fast-axonal transport to spread in sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 98 (6), 3466 (2001).
- Kramer, T., Enquist, L. W. Alphaherpesvirus Infection Disrupts Mitochondrial Transport in Neurons. Cell Host & Microbe. 11 (5), 504-514 (2012).
- Swedlow, J. R., Platani, M. Live cell imaging using wide-field microscopy and deconvolution. Cell Structure and Function. 27 (5), 335-341 (2002).
- Kaech, S., Huang, C. F., Banker, G. Short-Term High-Resolution Imaging of Developing Hippocampal Neurons in Culture. Cold Spring Harbor Protocols. 2012 (3), (2012).
- Frigault, M. M., Lacoste, J., Swift, J. L., Brown, C. M. Live-cell microscopy - tips and tools. Journal of Cell Science. 122 (6), 753-767 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유