Method Article
Rekabetçi bir mürin Kemik İliği Transplantasyon Modelinde Donör Hücre Aşı belirleme Kantitatif Gerçek-zamanlı PCR kullanarak
Bu Makalede
Özet
Donör hücre engraftman belirleme iyi tanımlanmış fenotipik belirteçlerin yoksun fare kemik iliği nakli modelleri bir meydan okuma sunuyor. Biz kadın transplant alıcı fareler erkek donör hücre uyumunu ölçmek için bir metodoloji tanımlamıştır. Bu yöntem, HSC fonksiyonların çalışması için tüm fare suşu olarak da kullanılabilir.
Özet
Mürin kemik iliği nakli modelleri hematopoetik kök hücre (HSC) fonksiyonları ve belirleyici gen / HKH'lerin düzenleyen molekülleri ölçen önemli bir araç sağlar. Bu transplant modeli sistemlerinde HKH'lerin fonksiyonu sokmak ve sulandırmak öldürücü ışınlanmış alıcı fareler için bu hücrelerinin yeteneği belirlenir. Genellikle, verici katkı hücre / melezleşmesi akış sitometrisi kullanılarak özel bir verici-hücre yüzey proteinleri, antikorlar tarafından ölçülür. Ancak, bu yöntem ağır özgüllük ve tüm fare suşları için geçerli olmayabilir alıcının kaynaklı hücreler, gelen donör kaynaklı hücreler ayırt etmek için hücre yüzey belirteci yeteneğine bağlıdır. Piyasada genetiği değiştirilmiş fare suşlarının çeşitli geçmişlere dikkate alındığında, bu hücre yüzey / akım sitometri tabanlı yöntem özellikle congenic alıcı ce ayrı donör hücreleri iyi tanımlanmış yüzey belirteçleri yoksun fare suşları önemli sınırlamaları vardırlls. Burada, transplant alıcıları farelerde donör hücre engraftman / katkısını belirlemek için PCR-temelli teknik bildirdi. Biz lethally ışınlanmış congenic dişi farelere erkek donörün kemik iliği HKH'lerin nakledilen. Periferal kan numuneleri farklı zaman noktalarında, nakil sonrası toplandı. Kemik iliği örnekleri deneyler sonunda elde edildi. Genomik DNA izole edildi ve Y kromozom özgü gen, Zfy1, kantitatif Gerçek zamanlı PCR ile amplifiye edildi. Dişi alıcı farelerde erkek donör kaynaklı hücrelerinin aşılanması erkek vs kadın DNA'ların bilinen yüzdesi, standart bir eğriye karşı hesaplanır edildi. Bcl2 toplam DNA miktarının normale döndürmek için bir gen referans olarak kullanılmıştır. Bizim verilerimiz bu yaklaşım güvenilir donör hücre uyumunu belirler ve fare kemik iliği nakli modelleri hematopoetik hücre sulandırma ölçmede yararlı, henüz basit bir yöntem sağlar önerdi. Bizim yöntemi rutin en laboratuarlarda yapılabilir çünkü hiçbirgibi flow sitometri gibi pahalı ekipman gereklidir.
Giriş
Mürin kemik iliği (Kİ) nakli model ilk 1960 1 geliştirilmiştir. Bu model yaygın donör hematopoetik kök hücre (HSC) bir ana alıcı fare biyoloji çalışma için kullanılır olmuştur. Mürin kemik iliği nakli modeli HSC fonksiyonları ve düzenlenmesi ile ilgili değerli bilgi ile bize sağladı ve HSC araştırma vazgeçilmezdir. C56Bl/6J CD45.2-B6.SJL CD45.1 gibi C57BL/6J H2b-Balb / C H2d veya congenic nakli modeli gibi Allojenik kemik iliği nakli modelinin etkisi, HSC aktivitesi 2 geninin işlevini incelemek için birçok laboratuarlarda kullanılmaktadır graft-versus-host hastalığı (GVHH) 4 olarak HSC fonksiyonu 3 veya transplantasyon ilişkili hastalıklar üzerinde ilaç tedavisi.
Bu tür MHC haplotip veya CD45.1 gibi hücre yüzey belirteçleri yaygın olarak alıcı kökenli hücrelerden ayırt verici türetilmiş hücreler için kullanılmaktadır. C57BL/6J H2b, CD45.2 vs CD45.2 veya H2b vs ölçüm akım sitometri ile tespit edilebilir, çünkü p>, Balb / C H2d ve B6.SJL CD45.1 kemik iliği nakli en yaygın olarak kullanılan fare suşları vardır H2d. Bununla birlikte, bu tür FVB / NJ 5 ve C3H gibi birçok diğer bakteriler aynı zamanda sık sık genetik mühendisliği transjenik fareler veya nakavt üretmek için kullanılır. Bu fareler, doğuştan bir hat için backcrossed ve bir karışık MHC / genetik arka plan içinde muhafaza edilebilir. Donör spesifik hücre yüzey belirteçleri mevcut olmayabilir bu durumda, donör hücre uyumunu ve HSC fonksiyonu belirlenmesi zor olabilir.
Sex-uyumsuz kemik iliği nakli güney blot donör erkek hücrelerini saptamak için Y-kromozomu-spesifik DNA prob kullanarak ilk Dr Miwa grubu 6 tarafından geliştirilmiştir. Daha sonra, cinsiyet belirleyici bölge Y için bir gerçek-zamanlı PCR ma miktarının belirlenmesi için bir doğru ve büyük ölçüde belirli bir yöntem olduğu bulundumaternal kan sistemi 7 le fetal hücreler. Bu kavram, donör hücre uyumunu 8 belirlemek için bir kemirgen kemik iliği nakli modelinde, bir gerçek-zamanlı PCR tekniğinin geliştirilmesi için Dr Schwarzenberger grubu tarafından adapte edilmiştir. Biz daha FVB / NJ fare kemik iliği nakli modelinde donör hücre engraftman ölçümü için bu yöntemi değiştirilmiş. Bu yöntem, şu anda geniş olarak HSC biyoloji Pim1 kinaz rolünü incelemek için, grup halinde kullanılmaktadır.
Protokol
1. Kemik İliği Hücre İzolasyonu
- Erkek donör FVB / NJ fareler ve servikal dislokasyon ile takip CO2 yöntemi kullanılarak dişi FVB / NJ fareler Euthanize. Dişi FVB / NJ kemik iliği hücreleri rekabetçi hücreler olarak kullanılır.
- Farelerin femur ve tibiaes üzerinden incelemek ve% 5 ısı inaktive FBS ile 6 ml buz-soğuk RPMI1640 içeren 60 mm doku kültür kaplarına koyun, küçük bir makas ve forseps kullanın. Kas ve diğer dokuları kaldırmak için Kimwipe doku kullanın. Her bir çanak içinde kemik şaftın her iki ucuna kes.
- 3 cc şırınga 23G iğne ile kemik ucunu, yemeğin içine% 5 ısı inaktive FBS ile RPMI1640 ile kemik iliği dışarı floş. Aynı iğne kullanılarak tekrarlanmalıdır özlemleri tarafından kemik iliği doku Ayrık. 15 ml'lik bir santrifüj tüpüne hücre süspansiyonu aktarın.
- 400 x g'de 5 dakika için hücreler aşağı Spin, süpernatanın kaldırmak (155 mM p oda sıcaklığında kırmızı kan hücresi lizis tamponu, 1 ml hücre tekrar süspansiyonotassium bikarbonat, 10 mM amonyum klorid, EDTA, pH = 7.4, 0.1 mM) ve 5 dakika boyunca oda sıcaklığında inkübe edilir ve sonra% 5 ısı ile aktifliği giderilmiş FBS içeren RPMI 1640 5-10 ml eklenir.
- Bir hücre süzgecinden hücreleri geçirir. Yeni bir tüp aracılığıyla akış toplayın. 400 x g'de 5 dakika boyunca aşağı spin. Süpernatantı; hücre pelletini herhangi bir kırmızı renk içermemelidir. Kırmızı renk yokluğu, kırmızı kan hücrelerinin bir tam olarak çıkarılması gösterir. % 5 ısı ile aktifliği giderilmiş FBS RPMI1640 10 ml hücre pelet yeniden süspanse edin. Emin olmak için yavaşça girdap hücre süspansiyonu tamamen üniforma olduğunu. Bir kısım alın ve bir hemasitometre hücreleri saymak. Hesapla ne kadar kemik iliği transplantasyonu ve kısım yeterli hücre için gerekli hücrelerin hacim ve 05:02 oranında rakip dişi hücreleri erkek donör hücreleri karıştırın. 400 x g'de 5 dakika boyunca aşağı Spin, 2, 5 x 10 6 / ml, ve rakip hücrelerini verici hücrelerin nihai konsantrasyon ile PBS içinde, PBS ile tekrar süspansiyon yıkama x 10 6 / ml.
2. Rekabetçi Kemik İliği Transplantasyonu
- Kemik iliği nakli öncesi 11Gy 4-6 saat tek bir dozda 137Cs gama ışınları radyatör ile saçmak dişi alıcı fareler (yaş 8-12 hafta).
- Bir fare süzgeç olarak ışınlanmış dişi fareler yerleştirin. Her fare 5 × 10 5 donör hücreleri ve 2 × 10 5 yarışmacı kemik iliği hücreleri aldığı gibi toplam hacminin 0,1 ml kuyruk veni yoluyla karışık donör ve rakip hücreleri enjekte edilir.
3. Örnek Toplama
Çift hafta kemik iliği transplantasyonu sonrası, anestezi koşulu altında retroorbital kanama kadın alıcı fare periferal kan örnekleri (~ 50 ul) toplamak. Örnekleri EDTA kaplı tüpler içerisine toplanır. BM örnekleri de açıklandığı önceki aynı prosedürleri (Adım 1) ile, genellikle en az 4 ay transplantasyon sonrası, deney sonunda tahsil edilebilir; genellikle% 20-401 tibiada BM hücrelerinin DNA yeterli miktarda yapmak için yeterli. Kan veya BM örneklerinde yaş eşleştirilmiş normal dişi ve erkek farelerde de standart eğrisi hazırlamak için toplanır.
4. Genomik DNA İzolasyonu
- Her kan örneği oda sıcaklığında RBC lizis tamponu 4 × hacmi (~ 200 ul) ekleyin. İyice karıştırın ve 5 dakika oda sıcaklığında inkübe edin. PBS 1 ml ekleyin, daha sonra parçalanan RBC çoğunu kaldırmak için aşağı doğru döndürün.
- Bir kan DNA ekstraksiyon kiti (QIAmp DNA Kan ekstraksiyon kiti) kullanılarak DNA izole edin. 37 Pre-sıcak elüsyon tampon (AE) ° C Elüsyonlanan DNA verimi artırmak için. Standart eğri için Erkek ve kadın DNA'ları benzer izole edilmiştir.
- (İsteğe bağlı) Genomik DNA, daha ileri saflaştırıldı ve 3 M sodyum asetat (pH = 5.5) varlığında, EtOH çökeltme yöntemi kullanılarak konsantre edilebilir. DNA pelletleri hemen sonra analiz için 40-50 ul damıtık su içinde tekrar süspanse edilir veya ileride kullanılmak üzere -20 ° C'de saklanır.
- DNA concentr ölçünNanodrop ND-1000 spektrumları fotometre ile ation. OD 260 / 1.8-2.0 arası 280 numuneler daha fazla analiz için kullanılır.
- 50 ul toplam hacim içinde 4ng/μl için DNAase serbest H2O ile DNA seyreltin.
5. Standart Eğri Hazırlama
4 ng / ml 'lik bir konsantrasyon ile DNA erkek ve dişi DNA seyreltilir, ve Table1 göre DNA karışım yapmak
| Kadın Arkaplan erkek DNA'sının% | 4ng/μl erkek DNA'sının hacmi (ul) | 4ng/μl kadın DNA hacmi (ul) | Toplam hacim (ul) |
| 0.2 | 1 | 499 | 500 |
| 0.5 | 1 | 199 | 200 |
| 2.5 | 5 | 195 | 200 |
| 12.5 | 25 | 175 | 200 |
| 50 | 100 | 100 | 200 |
| 87.5 | 175 | 25 | 200 |
| 100 | 200 | 0 | 200 |
Standart eğri için Tablo 1. Numune hazırlama. 8-12wks çağındaki Normal erkek ve dişi FVB / NJ fareler sakrifiye edildi. Kan ve BM hücrelerinin toplanmıştır. Erkek ve dişi hücreler hücrelerden DNA 4ng/μl 'lik bir konsantrasyonda izole edildi ve yeniden süspansiyon haline getirildi. Erkek ve dişi DNA'lar DNA standardının örneği karışımları üretmek için çeşitli oranlarda karıştırılmıştır.
6. Real-time PCR
- Astar ve genomik DNA ile SYBR Green Supermix reaktifi karıştırılarak PCR reaksiyonu plakasını yukarı ayarlayın. Reaksiyon hacmi (20 ul), her reaksiyon bölgesindeki her bir primer ve kan hücresi genomik DNA (4ng/μl x5 ul = 20 ng) 5 ul 400 nM içerir. DNA samples ve standartları üç tekrarlı olarak kurulmuştur. Primerlerin dizileri Tablo 2 'de gösterilmiştir.
| Gene adı | Ileri | Ters |
| Bcl2 | 5'-AAGCTGTCACAGAGGGGCTA | 5'-CAGGCTGGAAGGAGAAGATG |
| Zfy1 | 5-TGGAGAGCCACAAGCTAACCA | 5'-CCCAGCATGAGAAAGATTCTTC |
Mürin Bcl2 ve Zfy1 için Tablo 2. RT-PCR primer sekans.
- Aşağıdaki koşullara BioRad iQ5 PCR makinesi kullanılarak PCR reaksiyonu gerçekleştirin: 95 ° C'de 3 dakika, 95 42 amplifikasyon döngüleri ° 10 sn için C, 58 ° 15 sn 25 sn ve 72 ° C'de, bir erime eğrisi izledi adım.
- Bio-Rad iQ5 2.1 Standard Edition Optik Sistem tarafından Cycle threshold (Ct) değerleri elde edilir. Hesapla δCt (Ct Zfy1 </) Değeri>-Ct Bcl2 sup ve Zfy1 ekspresyon seviyesi 2-δ Ct değeri olarak hesaplanır.
- Bilinen kadın / erkek standart karışımlarından 2-δCt okuma kullanarak her reaksiyon serisi için standart eğrileri oluşturmak. Standart eğriler doğrusal regresyon uydurma ile karışım içinde% bilinen erkek DNA, kopyalardaki 2-δCt değer ortalama çizim tarafından oluşturulur.
Sonuçlar
Şekil 1 ve 2 standart eğri örnekleri erkek DNA yüzdeleri karşı 2-δCt ortalama değerleri ile çizilen gösterdi. Şekil 1A, sırasıyla 78.5 ° C'de ve 88.5 ° C'de lokalize Bcl2 ve Zfy1 amplikonlar için spesifik erime sıcaklığı göstermiştir. Bcl2 her bir PCR reaksiyonu içinde yüklenmiş DNA'nın toplam miktarı normalleştirmek için bir referans gen olarak kullanılır. Her standart numune için Bcl2 amplifikasyon eğrileri (Log görünümü) yüklü DNA (Şekil 1B) eşit miktarda belirterek, erkek DNA konsantrasyonu bağımsız birbirleri ile birleştirmek. Ancak, Zfy1 amplifikasyon eğrisi örneği DNA erkek artan miktarda (Şekil 1C) ile sol göç. Bizim yöntemi doğrulamak için, farklı zaman noktalarında sonrası transplantasyon sırasındaki WT vs Pim üçlü nakavt (TKO) farelerden alınan BM hücrelerini aldıktan nakledilen farelerde erkek donör hücre uyumunu test. Periferik kan (6wks) ve BM örnekleri (16wks) w Hem ere analiz. Pim TKO farelerin HKH'lerin lethally ışınlanmış farelerde (An, N ve ark., Revizyon altında elyazması) sulandırılması kusurları var. Beklendiği gibi, Pim TKO hücreler nakledildi alıcı farelerde WT hücreleri (Şekil 3) ile birlikte nakledilen fareler ile karşılaştırıldığında erkek hücrelerin çok daha düşük bir oranda vardı.
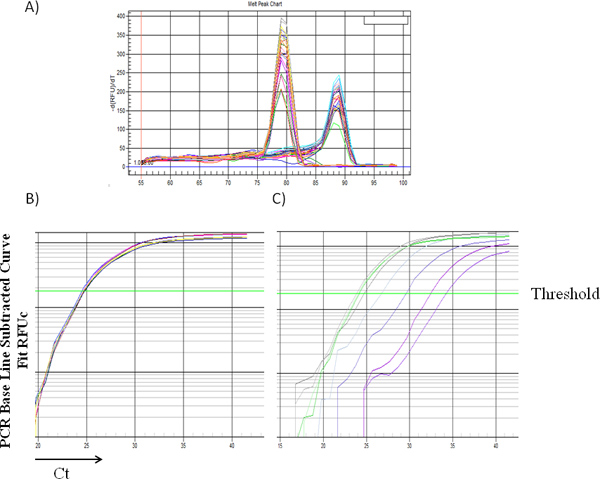
Şekil 1. Farklı DNA erkek oranları ile birden fazla numune (A) Temsilcisi erime eğrisi. 88.5 doruk ° C Zfy-1 amplifikasyon gösterir iken 78.5 tepe noktasının, Bcl2 amplifikasyonu gösterir. Cycle threshold: Bcl2 (B) ve Zfy1 (C), Ct için farklı DNA erkek yüzdesi ile birden fazla numune Temsilcisi amplifikasyon eğrisi.= "Http://www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/50193/50193fig1large.jpg" target = "_blank"> büyük bir rakam görmek için buraya tıklayın.

DNA erkek yüzdesi Şekil 2. RT-PCR standart eğri. Kemik iliği hücreleri elde edilen erkek ve dişi DNA karışımları örnekleri (20 ul toplam hacim içinde 20 ng DNA) olarak tanımlanan protokol RT-PCR için işleme tabi tutulmuştur. Bireysel numuneler için δCt ortalama değerleri (Ct Zfy1-Ct Bcl2) hesaplandı ve 2-δ Ct (Y ekseni) lineer regresyon ile (% 0,2 ila% 100 arasında değişen) (X-ekseni) DNA erkek yüzdesi karşı grafiğe geçirildi uydurma. R2 belirleme katsayısı temsil eder.
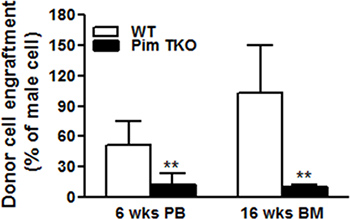
Şekil 3. Rekabetçi kemik iliği nakli Expedeney * yapılan örneğin. 2 x 10 5 kadın yarışmacı kemik iliği hücreleri ile birlikte erkek Pim üçlü KO (TKO) fareler eşleşen erkek WT veya yaşından itibaren 5 x 10 5 toplam BM hücreleri ışınlanmış kadın ana içine transplante edildi. Protokolde kınamış olarak 16 hft az 6 hafta ve BM kimerizm de periferik kan (PK) kimerizm transplantasyon sonrası (* p <0.05, ** p <0.01) RT-PCR ile DNA erkek yüzdesi ile tahmin edilmiştir.
Tartışmalar
Mevcut çalışmanın amacı, izleyicilere rekabetçi bir kemirgen kemik iliği nakli modelinde donör hücre uyumunu ölçmek için PCR temelli bir yöntem sağlamaktır. Çeşitli çalışmalarda, transplantasyonu modelleri 9-10 donör hücrelerini saptamak için RT-PCR kullanılarak bildirilmiştir. Dr Schwarzenberger grubunun ilk y kromozomu özgü 8 yükseltmek için real-time PCR kullanarak bir kemirgen kemik iliği nakli modeli geliştirilmiştir. Bu yöntem, HSC etkinlik 11 Gli-1 fonksiyonu incelemek için kullanılmıştır. Biz o zaman daha da protokol değiştirilmiş ve görselleştirildiği formatında ayrıntılı, adım adım deney protokolünde sağladı. Bizim protokol görüntülenmiştir sunum izleyicilerin kolayca bizim protokol izlemenizi sağlar. Ayrıca periferik kandan BM örnekleri vs DNA genomik DNA kullanarak bizim PCR sonuçları karşılaştırılmıştır. BM ve kan örneklerinden donör engraftman veriler temelde tutarlı, ancak genellikle daha az varyasyon BM örneklerinde bulunmuştur. Bu,muhtemelen kan örneklerinde genomik DNA'nın saflık / kalite bozabilir periferik kanda RBC parçalama sonrası rezidüel hemoglobin nedeniyle.
Donör hücre engraftman ölçmek için PCR tabanlı tekniği ile çeşitli avantajları vardır. İlk olarak; Bu teknik laboratuar en gerçekleştirilebilir. Gerçek zamanlı PCR makine dışındaki özel ve pahalı ekipman için gerek yoktur. Biz daha PCR reaksiyon bileşeni değiştirilmiş ve yerine Taqman ve SYBR Green Supermix kullanılır. Bu değişiklik, daha biz floresan etiketli prob ortadan kaldırmak gibi masrafları azaltır. İkincisi, bizim teknik güvenilir ve yüksek tekrarlanabilir olduğunu. Biz DNA kantitatif kiti karşı toplam DNA miktarı normale Bcl2 referans gen kullanılır. 1) bu gen Y-kromozomu üzerinde yer değildir çünkü: Bcl2 geni kullanılmıştır. Bu nedenle, bu ifade erkek donör hücre uyumunu tarafından etkilenmez. 2). Bcl2 akım transplantasyon koşullar altında düzenlenmiş değildir. Sh gibiŞekil 1'de kendi, Bcl2 gen yüklü erkek DNA miktarı bağımsız toplam DNA yükleme için güvenilir ve son derece tutarlı kontrolü üretir. Zfy1 bölgede 12 belirlenmesinde testis içinde çinko parmak gendir ve Y kromozomu üzerinde yer almaktadır. Bu Zfy1 gen ekspresyonu seviyesi, bir fare transplantasyon örnek 8 de erkek hücre DNA miktarı ile iyice tekabül ettiği rapor edilmiştir. Üçüncüsü, PCR tabanlı tekniği çok hassas olduğunu ve <% 1 donör hücre engraftman algılayabilir. Ayrıca örneklerin daha sonra analiz için uzun süre saklanabilir. Buna karşılık, geleneksel akış sitometrisi tabanlı bir yöntem hemen örnek işlem gerektirmektedir. Son olarak, teknik bağımsız fare soyu ve alıcı hücrelerin ayrı verici hücreler için iyi-tanımlanmış yüzey işaretleri yoksun genetik arka plan için de kullanılabilir. Bu, bu yöntem en çok önemli bir avantajdır.
Mevcut deneysel koşul altında (donör / competitveya oranı) 5/2, biz PCR bazlı yöntem kullanılarak 16 hafta etrafında% 80-90 donör engraftman görülmektedir. Bizim verilerimiz 16 hafta sonrası donör nakli (CD45.2) / yarışmacı (CD45.1) 4:1 2'de oranı ~% 95 donör hücre engraftman gösterdi konvansiyonel, flow sitometri bazlı yöntemi ile oldukça benzerdir. Alıcı verici farelerde hücrelerin tespit etmek için hücre yüzey işaretleyici kullanan geleneksel yöntem ile karşılaştırıldığında, yöntemin başlıca dezavantajı, bu tür B hücreleri, T hücreleri veya Granülositler gibi çeşitli kan hücrelerinin alt popülasyonlar melezleşmesi analiz yetersizliğidir. Bununla birlikte gerekirse, her bir hücre popülasyonu içinde donör hücre katkı belirlemek için hücre ayırma tekniği ve sonra tabi RT-PCR için numuneler kullanılarak hücrelerin her biri nüfus toplamak mümkündür. Donör hücre engraftman standart eğri dayalı olarak hesaplanmış olduğundan, örnek okuma eğim ve standart eğrinin y kesişim tümüyle bağlıdır. Biz off-aralık rea almak olasıdırdout (engraftman yani% 100'ün üzerinde). Ancak, bu "yanlış pozitif veya yanlış negatif" sonuç eğer önlenebilir: 1) test örnekleri ve standart eğri örnekleri DNA izolasyonu prosedürleri aynıdır, ve 2) Standart eğrinin seçilen aralık beklenen örnek okuma yakındır. Her bir PCR reaksiyonunda, PCR makine ayarı durumunu farklılıklar olabilir çünkü ek olarak, standart eğri örnekleri her bir PCR reaksiyonu arasında farklılıklar önlemek için her bir PCR levha yer almalıdır.
Son olarak, bizim Pim üçlü KO fareler kullanarak bizim teknik doğrulanır. Önceki raporun 13 ile uyumlu olarak, biz Pim üçlü KO fareler donör HKH'lerin lethally ışınlanmış alıcı fareler sulandırılması kusurlu olduğunu buldu.
Açıklamalar
Biz hiçbir mali çıkarlarının ifşa rekabet var.
Teşekkürler
Biz onun Real Time PCR makine kullanımı için Dr Charles Greenberg ederim. Bu çalışma MUSC Hollings Kanser Merkezi Başlangıç Fonu, Hollings Kanser Merkezi ACS IRG, ASCO Kanseri Vakfı Kariyer Geliştirme Ödülü Conquer, NIH 1K08HL 103780-01A1 ve NIH 3P30CA138313-01S3 tarafından desteklenmektedir. Içeriği sadece yazarların sorumluluğundadır ve mutlaka Sağlık veya diğer finansman ajanlar Ulusal Enstitüleri resmi görüşlerini temsil etmemektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
| RPMI 1640 | Hyclone | SH30255.01 | |
| FBS | Invitrogen | 16140-017 | Inaktive Isı |
| Amonyum klorid | MP Biomedicaals | 194806 | |
| Potasyum Bikarbonat | Balıkçı | P184-500 | |
| QIAamp DNA Kan MINIKIT | Qiagen | 51106 | |
| Hücre süzgeç | Biyobilim BD | ||
| iQ SYBR Green Supermix | BioRad | 170-8882 | |
| iQ5 gerçek zamanlı PCR makinesi | BioRad | ||
| Spectra fotometre | ND-1000 Nanodrop | ND-1000 |
Referanslar
- McCulloch, E. A., Till, J. E. The radiation sensitivity of normal mouse bone marrow cells, determined by quantitative marrow transplantation into irradiated mice. Radiat. Res. 13, 115-125 (1960).
- Xiao, N., et al. Hematopoietic stem cells lacking Ott1 display aspects associated with aging and are unable to maintain quiescence during proliferative stress. Blood. 119, 4898-4907 (2012).
- Kang, Y., Chen, B. J., Deoliveira, D., Mito, J., Chao, N. J. Selective enhancement of donor hematopoietic cell engraftment by the CXCR4 antagonist AMD3100 in a mouse transplantation model. PLoS One. 5, e11316(2010).
- Sadeghi, B., et al. GVHD after chemotherapy conditioning in allogeneic transplanted mice. Bone Marrow Transplant. 42, 807-818 (2008).
- Taketo, M., et al. FVB/N: an inbred mouse strain preferable for transgenic analyses. Proc. Natl. Acad. Sci. U.S.A. 88, 2065-2069 (1991).
- Morisaki, H., et al. Genotypic analysis using a Y-chromosome-specific probe following bone marrow transplantation. Am. J. Hematol. 27, 30-33 (1988).
- Lo, Y. M., et al. Quantitative analysis of fetal DNA in maternal plasma and serum: implications for noninvasive prenatal diagnosis. Am. J. Hum. Genet. 62, 768-775 (1998).
- Byrne, P., et al. Chimerism analysis in sex-mismatched murine transplantation using quantitative real-time PCR. Biotechniques. 32, 279-280 (2002).
- Ma, X., et al. Contribution of recipient-derived cells in allograft neointima formation and the response to stent implantation. PLoS One. 3, e1894(2008).
- Bosio, E., et al. A comparison between real-time quantitative PCR and DNA hybridization for quantitation of male DNA following myoblast transplantation. Cell Transplant. 13, 817-821 (2004).
- Merchant, A., Joseph, G., Wang, Q., Brennan, S., Matsui, W. Gli1 regulates the proliferation and differentiation of HSCs and myeloid progenitors. Blood. 115, 2391-2396 (2010).
- Nagamine, C. M., Chan, K., Hake, L. E., Lau, Y. F. The two candidate testis-determining Y genes (Zfy-1 and Zfy-2) are differentially expressed in fetal and adult mouse tissues. Genes & development. 4, 63-74 (1990).
- Grundler, R., et al. Dissection of PIM serine/threonine kinases in FLT3-ITD-induced leukemogenesis reveals PIM1 as regulator of CXCL12-CXCR4-mediated homing and migration. J. Exp. Med. 206, 1957-1970 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır