Method Article
경쟁 손쥐 골수 이식 모델에서 기증자 세포 Engraftment를 확인하려면 수량 실시간 PCR을 사용하여
요약
기증자 세포 engraftment을 결정하는 것은 잘 정의 phenotypical 마커를 부족 마우스 골수 이식 모델에서 도전을 선물한다. 우리는 여성 이식받는 마우스의 남성 기증자 세포 engraftment을 수량화하는 방법을 설명했다. 이 방법은 HSC 기능의 연구에 대한 모든 마우스 변종에 사용할 수 있습니다.
초록
손쥐 골수 이식 모델은 조혈 줄기 세포 (HSC) 기능과 결정 유전자 / HSCs를 조절 분자를 측정에 중요한 도구를 제공합니다. 이러한 이식 모델 시스템에서 HSCs의 기능이 합치다 및 reconstitute lethally 방사능받는 마우스에 이러한 세포의 능력에 의해 결정됩니다. 일반적으로, 기증자 세포 기여 / engraftment는 유동 세포 계측법을 사용하여 기증자 특정 세포 표면 단백질에 대한 항체에 의해 측정됩니다. 그러나,이 방법은 크게 특이성 및 모든 마우스 변종을 사용할 수 없습니다 수신자 - 유래 세포에서 기증자 파생 세포를 차별화 할 수있는 세포 표면 마커의 능력에 따라 달라집니다. 시장에서 유전자 변형 마우스 변종의 다양한 배경을 고려,이 세포 표면 / 흐름 세포 계측법 기반의 방법은 특히 congenic받는 CE에서 별도의 기증자 세포에 잘 정의 된 표면 마커를 결여 마우스 변종에 상당한 한계를 가지고있다재편. 여기, 우리는 이식받는 마우스에 기증자 세포 engraftment / 공헌을 결정하는 PCR 기반 기술을 발표했다. 우리는 lethally 방사능 congenic 여성 마우스로 남성 기증 골수 HSCs를 이식. 주변 혈액 샘플은 다른 시간 지점 게시물 이식에서 수집되었다. 골수 샘플은 실험의 끝에 획득했다. 게놈 DNA의 고립 된와 Y 염색체 특정 유전자 Zfy1은 정량 실시간 PCR을 사용하여 증폭되었다. 여성받는 쥐 남성 기증자 파생 세포의 engraftment는 남성 대 여성 DNAs의 알려진 비율과 표준 곡선으로부터 계산되었다. Bcl2은 전체 DNA 금액을 정상화 할 수있는 참조 유전자로 사용되었다. 우리의 데이터는 접근이 안정적으로 공여 세포 engraftment을 결정하고 손쥐 골수 이식 모델에서 조혈 세포 reconstitution을 측정에 유용하면서도 간단한 방법을 제공합니다 것을 제안했습니다. 우리의 방법은 정기적으로 대부분의 실험실에서 수행 할 수 있기 때문에 더이러한 유동 세포 계측법과 같은 비용이 많이 드는 장비가 필요합니다.
서문
손쥐 골수 (BM) 이식 모델이 처음 1960 년대 1 개발되었습니다. 이 모델은 광범위하게 기증 조혈 줄기 세포 (HSC) 호스트받는 마우스 생물학 연구에 사용되었습니다. 손쥐 골수 이식 모델은 HSC 기능과 규제에 대한 귀중한 지식으로 우리를 제공하고 HSC 연구에 필수 불가결합니다. C56Bl/6J CD45.2 - B6.SJL CD45.1 같은 C57Bl/6J H2b-Balb / C H2d 또는 congenic 이식 모델 같은 Allogeneic 골수 이식 모델은 효과, HSC 활동 2 유전자 기능을 연구하기 위해 여러 실험실에서 사용되는 이러한 이식 - 대 - 호스트 질병 (GvHD) 4 등 HSC 기능 3 이식 관련 질환에 대한 약물 치료.
이러한 MHC haplotype 또는 CD45.1 등의 세포 표면 마커는 일반적으로받는 사람 - 유래 세포에서 구별 기증자 파생 셀에 사용됩니다. C57Bl/6J H2b, CD45.2 대 CD45.2 또는 H2b 대를 측정 유동 세포 계측법에 의해 평가 될 수 있기 때문에 P는>, Balb / C H2d 및 B6.SJL CD45.1는 골수 이식에서 가장 일반적으로 사용되는 마우스 변종 아르 H2d. 그러나, 이러한 FVB / NJ 5 C3H 등 여러 다른 변종은 종종 유전 공학 유전자 변형 또는 녹아웃 마우스를 생성하는 데 사용됩니다. 이 마우스는 타고난 줄에 backcrossed와 혼합 MHC / 유전 배경에서 유지 될 수 있습니다. 기증자 특정 세포 표면 마커를 사용할 수 없습니다 이러한 경우에는 기증자 세포 engraftment 및 HSC 기능을 결정하는 것은 어려울 수 있습니다.
섹스 일치하지 않는 골수 이식의 남부 얼룩으로 기증자 남성 세포를 감지하는 Y-염색체 특정 DNA 프로브를 사용하면 첫째 박사 미와의 그룹 6 개발되었습니다. 그런 다음 섹스를 결정 지역 Y에 대한 실시간 PCR은 교장 quantitate 할 수있는 정확하고 구체적인 방법으로 발견되었다산모 혈액 시스템 7 르 태아 세포. 이 개념은 공여 세포 engraftment 8 결정하는 손쥐 골수 이식 모델에서 실시간 PCR 기술의 개발을위한 박사 Schwarzenberger의 그룹에 의해 조정되었다. 우리는 더 FVB / NJ 마우스 골수 이식 모델에서 기증자 세포 engraftment의 측정을 위해이 방법을 수정했습니다. 이 방법은 현재 광범위하게 HSC 생물학 Pim1 키나제의 역할을 공부에 대한 우리의 그룹에 사용된다.
프로토콜
1. 골수 세포 절연
- 남성 기증자 FVB / NJ 마우스와 경부 전위 다음 CO 2 방법을 사용하여 여성 FVB / NJ 쥐를 안락사시켜야. 여성 FVB / NJ 골수 세포 경쟁 세포로 사용됩니다.
- 마우스의 대퇴골과 tibiaes을 해부 5 % 열 inactivated FBS 6 ML 얼음처럼 차가운 RPMI1640을 포함하는 60mm 조직 배양 접시에 넣고, 작은 가위와 집게를 사용하십시오. 근육과 다른 조직을 제거 kimwipe 조직을 사용합니다. 접시에 각각의 뼈 샤프트의 양쪽 끝을 잘라.
- 3 CC의 주사기에 23G 바늘로 뼈의 끝을 연결 그릇에 5% 열 inactivated FBS와 RPMI1640과 골수를 제거. 같은 바늘을 사용하여 반복 열망에 의해 골수 조직을 Disaggregate. 15 ML의 원심 분리기 튜브에 세포 현탁액을 전송합니다.
- 400 XG에서 5 분 동안 세포를 스핀 다운, 표면에 뜨는을 제거, (155 MM P 상온 적혈구 용해 버퍼 1 ML에있는 세포를 resuspendotassium 중탄산염, 10 밀리미터 염화 암모늄, EDTA (에틸렌 다이아 민 테트라 초산), = 7.4 PH 0.1 ㎜)와 5 분 동안 실온에서 배양 한 다음 5% 열 inactivated FBS와 RPMI 1640의 5-10 ML를 추가합니다.
- 셀 스트레이너를 통해 세포를 전달합니다. 새로운 튜브에 이르기까지의 흐름을 수집합니다. 400 X g에서 5 분을 위해 스핀 다운. 표면에 뜨는을 제거하고, 세포 펠렛은 붉은 색이 포함되어서는 안됩니다. 붉은 색의 부재는 적혈구의 전체 제거를 나타냅니다. 5% 열 inactivated FBS와 RPMI1640의 10 ML에있는 세포 펠렛을 Resuspend. 확인을 부드럽게 소용돌이 세포 현탁액은 완전히 균일입니다. 나누어지는 가지고 hemacytometer에서 셀을 계산합니다. 계산 얼마나 많은 골수 이식과 나누어지는 충분한 세포에 필요한 세포의 볼륨과 5시 2분의 비율에서 경쟁 암 세포를 가지고 남성 기증자 세포를 섞는다. 400 XG에서 5 분을 위해 스핀 다운, 2에서 5 × 10 6 / ML 및 경쟁 세포에 공여 세포의 최종 농도로 PBS에 PBS로 resuspend을 씻어 × 10 6 / ML.
2. 경쟁 골수 이식
- 골수 이식 전에 11Gy 4-6 시간의 단일 복용에 137Cs 감마 선 방열기로 비추다 여성받는 마우스 (세 8-12 wks).
- 마우스 restrainer의 방사능 여성 마우스를 놓습니다. 각 마우스가 5 × 10 5 기증자 세포 2 × 10 5 경쟁자 골수 세포를받는 등 총 볼륨의 0.1 ML의 꼬리 정맥을 통해 혼합 기증자와 경쟁 세포를 주입.
3. 샘플 수집
커플 주 골수 이식 후 마취 상태에서 역 궤도 출혈에 의해 여성받는 마우스의 말초 혈액 샘플 (~ 50 μl)를 수집합니다. 샘플은 EDTA (에틸렌 다이아 민 테트라 초산) 코팅 튜브로 수집하고 있습니다. BM 샘플도 설명 이전과 동일한 절차 (1 단계)로, 보통 최소 4 개월 후 이식, 실험의 끝에서 수집 될 수있다;의 보통 20~40%한 경골 BM 세포는 DNA의 충분한 양을 만들 정도로 수 있습니다. 혈액 또는 BM 샘플 시대의 검색 일반 여성과 남성 생쥐는 표준 곡선을 준비하기 위해 수집됩니다.
4. 게놈 DNA 절연
- 각 혈액 샘플에 방 온도 RBC 용해 버퍼의 4 × 볼륨 (~ 200 μl)를 추가합니다. 잘 섞은 후 5 분 동안 실온에서 알을 품다. PBS 1 ML을 추가 한 다음 lysed RBC의 대부분을 제거하는 스핀 다운.
- 혈액 DNA 추출 키트 (QIAmp의 DNA 혈액 추출 키트)를 사용하여 DNA를 분리합니다. 37 번 프리 따뜻한 용출 버퍼 (AE) ° C 용출 DNA의 수율을 향상 할 수 있습니다. 표준 곡선에 대한 남성과 여성의 DNAs은 마찬가지로 격리되어 있습니다.
- (선택 사항) 게놈의 DNA가 더 정화 또는 3 M의 아세트산 나트륨 (산도 = 5.5)의 존재에 EtOH 침전 방법을 사용하여 집중 할 수 있습니다. DNA 알약은 다음 즉시 분석을 위해 40-50 μl 증류수에 resuspended하거나 나중에 사용하기 위해 -20 ° C에 저장됩니다.
- DNA의 concentr를 측정Nanodrop ND-1000 스펙트럼의 측광과 ation. OD 260 / 1.8-2.0 사이의 280과 샘플은 추가적인 분석을 위해 사용됩니다.
- 50 μl의 총 볼륨에 4ng/μl 할 DNAase 무료 H 2 O와 DNA를 희석.
5. 표준 곡선 준비
4 NG / μl의 농도에 남성 DNA와 여자 DNA를 희석하고, Table1에 따르면 DNA 혼합물을
| 여성 배경에서 남성의 DNA의 비율 (%) | 4ng/μl 남성 DNA의 양 (μl) | 4ng/μl 여성 DNA의 양 (μl) | 총 볼륨 (μl) |
| 0.2 | 1 | 499 | 500 |
| 0.5 | 1 | 199 | 200 |
| 2.5 | 5 | 195 | 200 |
| 12.5 | 25 | 175 | 200 |
| 50 | 100 | 100 | 200 |
| 87.5 | 175 | 25 | 200 |
| 100 | 200 | 0 | 200 |
표준 곡선에 대한 표 1. 샘플 준비. 8 12wks 세의 나이에 일반 남성과 여성의 FVB / NJ 쥐들이 희생되었습니다. 혈액 및 BM 세포가 수집되었습니다. 남성 셀과 여성 셀에서 DNAs은 4ng/μl의 농도에서 분리하고 다시 중지되었습니다. 남성과 여성의 DNAs은 DNA 표준 샘플 혼합물을 생성하기 위해 다양한 비율로 혼합되었다.
6. 실시간 PCR
- 프리 머와 게놈 DNA와 SYBR 그린 supermix 시약을 혼합하여 PCR 반응 판을 설정합니다. 반응 볼륨 (20 μl)는 각 반응의 각 프라이머 및 혈액 세포 게놈의 DNA (4ng/μl X5의 μl = 20 NG)의 5 μl 400 nm의가 포함되어 있습니다. DNA samp레와 기준은 세중의에 설립되었습니다. 프리 머의 시퀀스는 표 2에 표시됩니다.
| 유전자 이름 | 앞으로 | 역 |
| Bcl2 | 5'-AAGCTGTCACAGAGGGGCTA | 5'-CAGGCTGGAAGGAGAAGATG |
| Zfy1 | 5 TGGAGAGCCACAAGCTAACCA | 5'-CCCAGCATGAGAAAGATTCTTC |
손쥐 Bcl2 및 Zfy1에 대한 표 2. RT-PCR의 프라이머 순서.
- 다음 조건 Biorad iQ5 PCR 기계를 사용하여 PCR 반응을 수행 95 ° C 3 분, 95의 42 증폭 사이클 ° 10 초에 C, 58 ° 15 초 25 초 72 ° C에 대한 C, 녹는 곡선 다음 단계.
- 바이오 RAD iQ5 2.1 일반용 광학 시스템에 의해 순환 임계 값 (CT) 값을 가져옵니다. 계산 δCt (CT Zfy1 </) 값을> - CT Bcl2를 한모금하고, Zfy1 표현 수준은 2 δ CT의 값으로 계산됩니다.
- 알려진 여성 / 남성 표준 혼합물로부터 2 δCt 읽기를 사용하여 각 반응 시리즈 표준 곡선을 설정합니다. 표준 곡선은 선형 회귀 피팅과 혼합에 알려져 % 남성 DNA에 triplicates의 2 δCt 값의 평균을 플로팅에 의해 생성됩니다.
결과
그림 1과 2는 표준 곡선의 예는 남성 DNA의 비율에 대한 2 δCt의 평균 값으로 꾸몄다 보여 주었다. 그림 1A는 각각, 78.5 ° C와 88.5 ° C에서 지역화 Bcl2 및 Zfy1 amplicons에 특정 녹는 온도를 보여 주었다. Bcl2는 각 PCR 반응에로드 DNA의 총 양을 정상화 할 수있는 참조 유전자로 사용됩니다. 각 표준 시료에 대한 Bcl2 증폭 곡선 (로그보기)로드의 DNA (그림 1B)의 동등한 양을 나타내는 남성 DNA 농도의 독립적 인 서로 병합합니다. 그러나, Zfy1 증폭 곡선은 샘플에서 남성의 DNA의 증가 금액 (그림 1C)와 왼쪽으로 마이그레이션. 우리의 방법의 유효성을 검사하기 위해, 우리는 다른 시간 지점 게시물 이식에 WT 대 핌 트리플 한방 (망가) 마우스에서 BM 세포를받을 이식 생쥐에서 남성 기증자 세포 engraftment을 테스트. 말초 혈 (6wks)와 BM 샘플 (16wks) w 모두 오히려이 분석했다. 핌 망가 마우스의 HSCs는 lethally 방사능 쥐 (, N 외., 개정에 따라 원고) reconstituting에 결함이 있습니다. 예상대로, 핌 망가 세포와 이식받는 마우스는 WT 세포 (그림 3)에 이식 마우스에 비해 남성 세포의 훨씬 낮은 비율을했다.
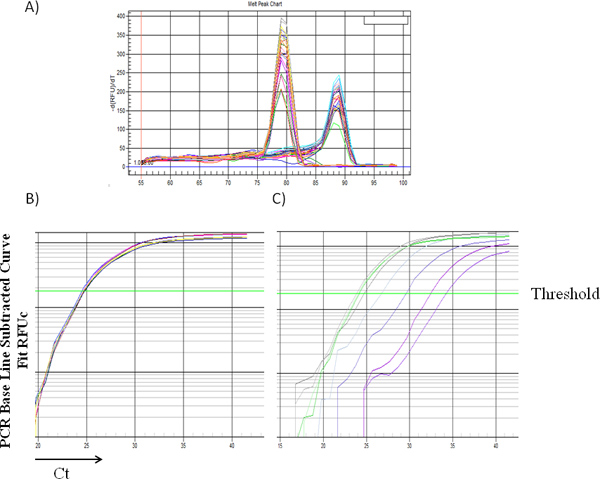
그림 1. 다른 남성 DNA 비율 여러 샘플의 (A) 대표 용해 곡선. 88.5에서 피크가 ° C가 Zfy-1의 증폭을 나타냅니다 동안 78.5의 피크는 Bcl2의 증폭을 나타냅니다. 사이클 임계 값 : Bcl2 (B)와 Zfy1 (C), CT에 대해 서로 다른 남성 DNA 비율 여러 샘플의 대표 증폭 곡선.= "https://www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/50193/50193fig1large.jpg"대상 = "_blank"> 큰 그림을 보려면 여기를 클릭하십시오.

남성 DNA 비율에 대한 그림 2. RT-PCR 표준 곡선. 골수 세포에서 얻은 남성과 여성의 DNA 혼합물의 샘플은 (20 μl 총 볼륨에 20 NG DNA)와 같은 프로토콜에 설명 된 RT-PCR에 대한 처리되었습니다. 개별 샘플 δCt의 평균 값 (CT Zfy1-CT Bcl2)가 계산되었으며, 2-δ CT (Y 축)은 선형 회귀와 함께 (0.2 % 100 %에서 범위) (X-축) 남성 DNA 비율에 역모를 꾸몄다되었습니다 피팅. R2는 결정의 계수를 나타냅니다.
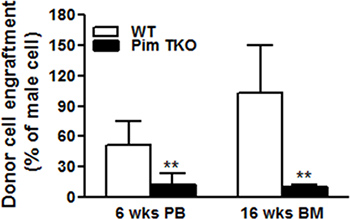
그림 3. 경쟁 골수 이식 experiments. 2 × 10 5 여성 경쟁자 골수 세포와 함께 남성 핌 트리플 KO (망가) 쥐를 일치 남성 WT 또는 세에서 5 × 10 5 총 BM 세포는 방사능 여성 호스트로 이식되었다. 프로토콜에 decried으로 16 wks 6 주 BM chimerism에서 말초 혈 (PB) chimerism이 게시물 이식은 (* P <0.05, ** P <0.01) RT-PCR에 의해 남성 DNA의 비율로 추정되었다.
토론
현재 연구의 목적은 고객에게 경쟁력있는 손쥐 골수 이식 모델에서 기증자 세포 engraftment을 수량화 할 수있는 PCR 기반 기술을 제공하는 것입니다. 여러 연구 이식 모델 9-10에 공여 세포를 감지 할 수 RT-PCR을 사용하여보고되었습니다. 박사 Schwarzenberger의 그룹은 먼저 Y-염색체 별 8 증폭하기 위해 실시간 PCR을 사용하여 손쥐 골수 이식 모델을 개발했습니다. 이 방법은 HSC 활동 11 Gli-1 기능을 연구하는 데 사용되었습니다. 우리는 더 프로토콜을 수정 및 시각화 형식으로 상세한 단계별로 실험 프로토콜을 제공했습니다. 우리 프로토콜의 시각화 프레젠테이션은 청중이 쉽게 우리의 프로토콜을 수행 할 수 있습니다. 우리는 또한 말초 혈에서 BM 샘플을 비교 DNA의 게놈 DNA를 사용하여 PCR 결과를 비교했다. BM 및 혈액 샘플에서 기증 engraftment 데이터는 기본적으로 일관성이 있지만, 보통 덜 변화는 BM 샘플에서 발견되었다. 입니다가능성이 혈액 샘플에 게놈 DNA의 순도 / 품질을 손상시킬 수 있습니다 말초 혈액에서 적혈구 용해 후 잔여 헤모글로빈 때문입니다.
기증자 세포 engraftment을 수량화하기위한 PCR 기반 기술을 몇 가지 장점이 있습니다. 첫째, 우리의 기술은 실험실의 대부분을 수행 할 수 있습니다. 실시간 - PCR 기계가 아닌 전문 비싼 장비에 대한 필요가 없습니다. 우리는 더 PCR 반응 구성 요소를 수정하고 대신 Taqman의 SYBR 녹색 supermix를 사용했습니다. 이 변경 사항은 더 이상 우리가 형광등 라벨 프로브를 제거로 비용 및 경비를 줄일 수 있습니다. 둘째, 우리의 기술은 신뢰성과 높은 재현합니다. 우리는 DNA의 quantitation 키트가 아닌 전체 DNA 금액을 정상화하기 위해 Bcl2 참조 유전자를 사용했습니다. 1)이 유전자가 Y-염색체에 위치하고되지 않습니다 때문에 Bcl2 유전자가 사용되었습니다. 따라서, 그 표현은 남성 기증자 세포 engraftment에 영향을받지 않습니다. 2). Bcl2는 현재 이식 조건 하에서 규제되지 않습니다. 쉬로그림 1의, Bcl2 유전자는로드 남성 DNA 양의 독립적 인 총 DNA를로드하기위한 안정적이고 높은 일관성 제어를 생산하고 있습니다. Zfy1이 지역 12 결정 testis에서 아연 손가락 유전자이며, Y 염색체에 자리 잡고 있습니다. 그것은 Zfy1의 유전자 발현 수준을 마우스 이식 모델 8 남성 셀 DNAs의 양에 잘 일치하는 것으로보고되었습니다. 셋째, 우리의 PCR 기반 기술은 매우 민감하며, <1 %의 공여 세포 engraftment를 검색 할 수 있습니다. 또한, 샘플 나중에 분석을 위해 오랜 기간 동안 저장 될 수 있습니다. 대조적으로, 종래의 흐름 세포 계측법 기반의 방법은 바로 샘플 처리가 필요합니다. 마지막으로, 우리의 기술은 독립적 인 마우스 긴장하고받는 사람 세포에서 별도의 기증자 세포에 잘 정의 된 표면 마커를 결여 유전 배경에 대한 사용하실 수 있습니다. 이이 방법의 가장 중요한 장점이 될 것이다.
현재 실험 조건 (기증자 / competit또는 비율)이 2분의 5이며, 우리는 PCR 기반 방법을 사용 16주에서 약 80~90% 기증 engraftment을 관찰했다. 우리의 데이터는 16 주 후 기증자와 이식 (CD45.2) / 경쟁 (CD45.1) 4시 1분 2시에 비율 ~ 95 %의 기증자 세포 engraftment을 보여 기존, 유동 세포 계측법 기반의 방식과 매우 비교합니다. 받는 마우스에 공여 세포를 감지 할 수 세포 표면 마커를 사용하는 기존의 방법에 비해 우리의 방법의 주요 단점은 B 세포, T 세포 또는 과립 성 백혈구와 같이 혈액 세포의 다양한 subpopulations에 engraftment를 분석 할 수 없다는 것입니다. 필요한 경우, 각각의 세포 인구의 기증자 세포 기여를 결정하는 셀 정렬 기술과 다음 주제 RT-PCR에 대한 샘플을 사용하여 셀의 각 인구를 수집 할 수 있습니다. 기증자 세포 engraftment는 표준 곡선을 기준으로 계산 된 이후, 샘플 판독은 슬로프 및 표준 곡선의 Y 도청에 전적으로 의존합니다. 우리가 오프 범위 정말이에요를 수도 있습니다dout (engraftment의 예 100 %). 그러나, 이러한 '거짓 긍정적 또는 허위 부정적인'결과는 경우에 방지 할 수 있습니다 : 1) 테스트 샘플과 표준 곡선 샘플의 DNA 분리 절차는 동일하며, 2) 표준 곡선의 선택 범위는 예상 샘플 판독 가까운 거리에 있습니다. 각 PCR 반응과 PCR 기계의 교정 상태의 차이가있을 수 있기 때문에 또한, 표준 곡선 샘플은 각 PCR 반응 사이의 변형을 방지하기 위해 각 PCR 플레이트에 포함되어야한다.
마지막으로, 우리는 우리의 핌 트리플 KO 마우스를 사용하여 기술을 검증. 이전 보고서 13에 의거하여, 우리는 핌 트리플 KO 마우스에서 기증 HSCs는 lethally 방사능받는 쥐를 reconstituting에 결함이 것으로 나타났습니다.
공개
우리는 금융 이익은 공개 경쟁 없습니다.
감사의 말
우리는 그의 실시간 PCR 기계의 사용 찰스 박사 그린버그 감사드립니다. 이 작품은 MUSC 홀 링스 암 센터 시작 기금, 홀 링스 암 센터 ACS IRG, ASCO 암 재단 경력 개발 상을 정복, NIH 1K08HL 103780-01A1, 그리고 NIH 3P30CA138313-01S3에 의해 지원됩니다. 내용은 전적으로 저자의 책임이며 반드시 건강 또는 다른 기금 대리인의 국립 연구소의 공식 전망을 대표하지 않습니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 코멘트 (선택 사항) |
| RPMI 1640 | Hyclone | SH30255.01 | |
| FBS | Invitrogen | 16140-017 | inactivated 열 |
| 염화 암모늄 | MP Biomedicaals | 194806 | |
| 칼륨 중탄산염 | 어부 | P184-500 | |
| QIAamp DNA 혈액 minikit | Qiagen | 51,106 | |
| 셀 스트레이너 | bioscience BD | ||
| iQ의 SYBR 그린 supermix | Biorad | 170-8882 | |
| iQ5 실시간 PCR 기계 | Biorad | ||
| 스펙트럼 측광 | ND-1000 Nanodrop | ND-1000 |
참고문헌
- McCulloch, E. A., Till, J. E. The radiation sensitivity of normal mouse bone marrow cells, determined by quantitative marrow transplantation into irradiated mice. Radiat. Res. 13, 115-125 (1960).
- Xiao, N., et al. Hematopoietic stem cells lacking Ott1 display aspects associated with aging and are unable to maintain quiescence during proliferative stress. Blood. 119, 4898-4907 (2012).
- Kang, Y., Chen, B. J., Deoliveira, D., Mito, J., Chao, N. J. Selective enhancement of donor hematopoietic cell engraftment by the CXCR4 antagonist AMD3100 in a mouse transplantation model. PLoS One. 5, e11316(2010).
- Sadeghi, B., et al. GVHD after chemotherapy conditioning in allogeneic transplanted mice. Bone Marrow Transplant. 42, 807-818 (2008).
- Taketo, M., et al. FVB/N: an inbred mouse strain preferable for transgenic analyses. Proc. Natl. Acad. Sci. U.S.A. 88, 2065-2069 (1991).
- Morisaki, H., et al. Genotypic analysis using a Y-chromosome-specific probe following bone marrow transplantation. Am. J. Hematol. 27, 30-33 (1988).
- Lo, Y. M., et al. Quantitative analysis of fetal DNA in maternal plasma and serum: implications for noninvasive prenatal diagnosis. Am. J. Hum. Genet. 62, 768-775 (1998).
- Byrne, P., et al. Chimerism analysis in sex-mismatched murine transplantation using quantitative real-time PCR. Biotechniques. 32, 279-280 (2002).
- Ma, X., et al. Contribution of recipient-derived cells in allograft neointima formation and the response to stent implantation. PLoS One. 3, e1894(2008).
- Bosio, E., et al. A comparison between real-time quantitative PCR and DNA hybridization for quantitation of male DNA following myoblast transplantation. Cell Transplant. 13, 817-821 (2004).
- Merchant, A., Joseph, G., Wang, Q., Brennan, S., Matsui, W. Gli1 regulates the proliferation and differentiation of HSCs and myeloid progenitors. Blood. 115, 2391-2396 (2010).
- Nagamine, C. M., Chan, K., Hake, L. E., Lau, Y. F. The two candidate testis-determining Y genes (Zfy-1 and Zfy-2) are differentially expressed in fetal and adult mouse tissues. Genes & development. 4, 63-74 (1990).
- Grundler, R., et al. Dissection of PIM serine/threonine kinases in FLT3-ITD-induced leukemogenesis reveals PIM1 as regulator of CXCL12-CXCR4-mediated homing and migration. J. Exp. Med. 206, 1957-1970 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유