Method Article
Bir Aracı Olarak Korelatif Işık ve Elektron Mikroskobu (CLEM) microinjected Moleküller ve Ökaryotik Alt hücresel Hedefler Visualize'a
Bu Makalede
Özet
CLEM tekniği enjekte edilen moleküller tarafından etkilenen membranlar, organeller ve hücre içi yapıların ultrastrüktürel morfolojisini analiz etmek için adapte edilmiştir. Bu yöntem çok nanometre çözünürlükte milimetre izin mikromanipülasyon / mikroenjeksiyon güçlü teknikleri, konfokal floresan mikroskopi ve elektron mikroskopi birleştirir. Bu teknik, uygulamaların geniş bir çeşitliliği için müsait.
Özet
Ökaryotik hücre, kompleks dayanan son derece düzenlenir ve uygun hücre fonksiyonu için gerekli olan biyokimyasal polarite koruma işlevsel farklı membrana bağlı bölmeleri. Enzimler, proteinler ve hücre iskelet yapısı bu biyokimyasal segregasyon yöneten ve bakımını nasıl anlamak büyük önem taşımaktadır. Floresan etiketli moleküllerin kullanımı veya perturb Subselüler bölmeleri bilgi hazinesi vermiştir ve hücresel düzenleme anlayışımızı ilerlemiştir ve / yerelleştirilmesine. Böyle floresan ve konfokal mikroskopi gibi görüntüleme teknikleri nispeten basit bir floresan etiketli küçük molekülün konumunu ascertaining olun, çok küçük yapıların ancak çözünürlük 1 sınırlıdır.
Diğer taraftan, elektron mikroskobu çok yüksek çözünürlükte Subselüler morfoloji detayları ortaya koymuştur, ancak statik doğa zor derece dinamik yanlısı ölçmek için yaparHassas 2,3 ile lerle. Böylece, aynı numunenin elektron mikroskobu, adlandırılır Korelatif Işık ve Elektron Mikroskobu (CLEM) 4,5 ile ışık mikroskobu birleşimi, elektron mikroskobu 6 yüksek çözünürlüklü ultrafast floresan görüntüleme ikili avantajları tanıyor. Bu güçlü teknik hücre biyolojisi 5,7 birçok yönlerini incelemek amacıyla uygulamaya konmuştur. Kuruluşundan bu yana, bu prosedür yüksek çözünürlükte Subselüler mimarileri ve morfolojileri ayırt yeteneğimizi artmıştır.
Burada, CLEM (Şekil 1), ardından hızlı mikroenjeksiyon gerçekleştirilmesi için düzenlenmiş bir yöntem sunulmaktadır. Mikroenjeksiyon CLEM işlem doğrudan ökaryotik hücre sitoplazması içine küçük molekülleri ve / ya da proteinlerin spesifik miktarlarda tanıtmak ve (Şek. 2), çok nm çözünürlüğe kadar milimetre olan etkilerini incelemek için kullanılabilir. Bu teknik, microinjecting dayanmaktadırhücreler hem konfokal floresan ve elektron mikroskobu ile canlı hücre yemekleri ve görüntüleme altına yapıştırılmıştır lazer kazınmış cam gridded lamelleri üzerine büyüdü. İlgi hücre lokalizasyonu (ler) kolaylıkla (Şek. 3) örneklerinin immobilizasyon için kullanılan EPON Reçine, ilgi hücreleri ile birlikte, transfer edilen önceki ve elektron mikroskopi ile analiz kesit bir ızgara deseni ile kolaylaştırılır. Floresan ve EM görüntü Kaplama kullanıcı hücre içi lokalizasyonu hem de ilgi enjekte edilen molekül (Şekil 4) tarafından oluşturulan herhangi bir morfolojik ve / veya yapısal değişikliklerin belirlemesini sağlar. Bu teknik, enjekte edilen örnek doğasına bağlı olarak, birkaç saat ≤ 5 sn kadar değişen zaman noktaları için müsait.
Protokol
1. Memeli Hücre Kültürü
- Normal Sıçan Böbrek (NRK), (herhangi bir reaktif için Tablo 1'e bakınız veya hücre yemekleri yaşamak yapıştırılmış photoetched cam gridded lamelleri üzerine serviks kanseri (HeLa), ya da diğer uygun memeli hücre hatları 37 kültüre ° C,% 5 CO 2, ölümsüzleştirdi aparatı DMEM +% 10 FBS) Bu protokolde kullanılan ve% 1 Kalem / Strep. Önlemler kültürlü memeli hücreleri ile çalışırken steril bir ortam sağlamak için alınmalıdır.
- Deneme zaman hat (0-5 saat vs 1-2 gün sonra enjeksiyon) bağlı olarak, hücrelerin ~% 50 oranında konfluent için ayarlanabilir ya da sırasıyla,% 25 ~ olmalıdır.
2. Mikroenjeksiyon
- ~ 50 ul son hacim için, hücre kültürü için kendi amenability bağlı olarak, tampon tercih istenilen protein, DNA, veya küçük moleküller hazırlayın. Gibi Texas Kırmızı veya Cascade Blue olarak İnert floresan boyalarenjekte edilen hücreleri işaretlemek için dahil edilir; enjeksiyon boya ve floresan prob seçimi örtüşmeyen eksitasyon ve emisyon dalga boylarında olmalıdır. Mikroenjeksiyon için ihtiyaç duyulan ilgi, molekülün konsantrasyon ampirik olarak tespit edilmesi gerekmektedir ve floresan boyalar genel olarak takip 0.5-1.0 mg / ml 'de kullanılmıştır. Tipik olarak, rodamin ya da başka bir florofor ile kovalent bağ tespit ancak diğer yöntemler hassasiyetine bağlı olarak kullanılabilecek, ticari bir kit kullanılarak, ilgi molekülüne bağlanır. Daha fazla bilgi için, aşağıdaki kritik konuları.
- 0.22 mikron santrifüj filtre yoluyla enjektör (~ 50 ul) filtreleyin. Santrifüj filtreleri vakum ve / veya ölü cilt ilişkilendirdiğiniz şırınga filtrasyon tercih edilir.
- Mikroenjeksiyon iğne oluşturmak için, borosilikat cam pipetler bir Flaming-Brown Mikropipet Çektirme aşağıdaki üreticilerin yönergeleri kullanarak çekilir. Alternatif olarak, mikroenjeksiyoniğneler femtotip mikroenjeksiyon iğne yapar Eppendorf dahil satıcılardan satın alınabilir.
- Dikkatlice Eppendorf 20 Femtotips kullanılarak mikroenjeksiyon iğnenin ucunu içine rahat bırakılmış enjektör 4 ul pipetle. Hava kabarcığı çekti mikroenjeksiyon iğne içinde mevcut olduğundan emin olun. Bir inverted mikroskop bağlı Eppendorf FemptoJet InjectMan arasında mikromanipülatör kolu içine mikroenjeksiyon iğne yerleştirin. Mikroenjeksiyon işlemi iyi bir inceleme için, okuyucu görüntülenmiştir Deneyler Madde 8 önceki Dergisi yönlendirilir.
- Ters Zeiss mikroskop çanak tutucu içine gridded lamel ve kültür hücrelerinin canlı hücre tabak koyun. Bir photoetched ızgara içinde büyüyen hücreleri bulun ve ızgaralar alfanümerik tanımlayıcı unutmayın, bu sonraki tüm adımlarda kullanılacaktır. Daha sonraki adımlar lamel kenarlarında örnek transferi sınırlar İdeal olarak, lamel merkezinde hücreleri bulun.
- Elle düşük enjeksiyon lamel üzerinde yerine kol ve ucu hafifçe kültür hücreleri ve bu noktanın ötesinde iğne hareketini önlemek için basın 'Limit yüzeyine temas edene kadar mikromanipülatör joystick ve kontrolleri, düşük enjeksiyon iğne aşağı kullanarak ve böylece kırılgan kırılma borosilikat cam çekti. Hücre mikroenjeksiyon tüm diğer yönleri Eppendorf FemtoJet InjectMan kullanım kılavuzuna göre yapılır. Mikroenjeksiyon tekniği son zamanlarda bakteri 9, tek tek salgılanan proteinleri ölümcüllük anlamak için kullanılmıştır.
- Seçilen ızgara içinde her iki hücreden Microinject. Hücreler konfluense ~% 50 yetiştirilen ile, bir 600 mikron 2 ızgara başına ~ 80 hücreleri (örneğin Şek. 3A) beklenebilir. Bu nedenle, floresans ve elektron mikroskopi incelenmesi üzerine, ~ 30-40 deney ve kontrol hücresi, bir n olacaktır.
- İstenilen için memeli hücre kültürü inkübatör içine geri canlı hücre tabak koyunzaman olarak deney düzeneği tarafından dikte. Alternatif olarak, bir önceki fiksasyon ilgi özellikle hücre içi yapıların görünümünü bekleyecektir mikroenjeksiyon zaman atlamalı mikroskopi analizi doğrudan geçebilirsiniz.
3. Floresan Mikroskopi
- Eğer istenirse, enjekte edilen hücrelerin canlı hücre hızlandırılmış floresans ölçümleri gerçekleştirmek, bundan sonra, 0.1 M cacodylate tampon maddesi (pH 7.4) içinde% 2.5 glutaraldehid ile medya değiştirmek ve oda sıcaklığında 10 dakika inkübe edilir. Canlı hücre ölçümlerinin gerekli değildir, ancak hücre büyüme ortamı olarak atmak ve 10 dakika için oda sıcaklığında 1xPBS içinde 5 ml% 3.7 formaldehit ile hücrelerin düzeltmek. Sabitleştirici atın ve 5 ml 1xPBS ile değiştirin, 3.2 adıma geçin. Not: floresan mikroskobu tamamlanana kadar sonra glutaraldehit eklemek değil önemlidir.
- Bir floresan mikroskop photoetched gridded lamel ile canlı hücre tabak koyun (konfokal thi için gerekli değildirs adım) ve hücrelerin düzenlenmesi (Şekil 4A) belgelemek için 5-10 parlak alan ve uygun ızgara floresan görüntüler toplamak. Atıl enjeksiyon boya (Şekil 4B) ve eksitasyon ve emisyon dalga boyları kullanılarak mikroenjeke edilmiş olan hücrelerin belirlenmesi. Bu elektron mikroskobu içeren sonraki adımlarda enjekte edilen hücrelerin tanımlanması kolaylaştırmak için farklı büyütme (örneğin 10x ve 65X) de görüntüler elde etmek için önemlidir.
- Bir konfokal floresan mikroskop kullanarak yukarıdaki adımı 2,5 tanımlanan ızgara içinde enjekte edilen hücrelerin bir Z-yığın toplamak. Yüksek büyütme (100x) elektron mikroskobu ile tespit edilecek Subselüler yapılar floresan görüntüler korele için gereklidir.
- Lamelleri ticari olarak temin lamel kaldırma sıvı ile canlı hücre yemekler alt çıkarıldı ve 5 ml'lik bir işlenmemiş hücre kültürü çanağı içinde hücre tarafı yukarıya yerleştirilir1xPBS. Aşağıda ayrıntılı olarak lamel sonra elektron mikroskobu için işlenir.
4. Transmisyon Elektron Mikroskobu
- 0.1 M cacodylate tampon maddesi (pH 7.4) içinde 2 ml% 2.5 glutaraldehid ile 1xPBS tampon değiştirin ve 10 dakika boyunca oda sıcaklığında inkübe edilir. Uzun inkübasyon, gerekli değil ise, hücre içi yapıların bakım yardımcı olacaktır. Not: yalnız formaldehit EM analiz için yeterli bir sabitleştirici değildir.
- Cacodylate tampon ile üç yıkamadan ve ardından 30 dakika süre ile 0.1 M cacodylate tampon içinde 2 ml% 1 osmiyum tetroksit ilavesi ile sabitleştirici ve leke hücreleri çıkartmak ve son olarak GKD 2 O. Tüm tampon değiştirmek
- Standart EM protokoller sonrasında, etanol kademeli (% 70 ila% 100) seri numune kurutmak. Bir EPON reçine dolu tüpün üstüne EPON reçine ve yer lamel hücre tarafı aşağı hazırlayın. 60 saat için 24 ° C polimerizasyon sahip Photoetched gridded lamel hücre tarafı do yerleştirerekEPON Reçine üzerine WN, ilgi duymaları nedeniyle ızgara deseni hücrelerinin her ikisi de (örneğin, Şek. 3B), polimerizasyon sırasında EPON Reçine aktarılır.
- Hızlı bir şekilde sıvı azot ve / veya kaynar su içine batırılarak EPON reçine lamelleri çıkarın. Ilgi ızgara (: ızgara kalıbında bir ayna görüntüsü olarak yönlendireceğiz notu) bulmak için bir binoküler diseksiyon kapsamında reçine yüzeyini inceleyin. Ilgi sadece ızgara EPON reçine bloğun tepesinde olduğu gibi aşağı steril bir jilet veya neşter, Döşeme EPON bloğu kullanma.
- Bir ultramicrotome kullanarak, istenilen kalınlıkta (tomografik TEM için konvansiyonel TEM ve ~ 250 nm kalınlık için ~ 70 nm kalınlığında) de kesilmiş blok seri kesitler elde. Standart protokoller izleyerek uranil asetat ve kurşun sitrat ile Kontrast bölümleri.
5. Korelatif Işık ve Elektron Mikroskobu
- Ilgi hücreleri konumlandırmakgörüntüler kullanan elektron mikroskobu önceki adımda elde. İlgi kez microinjected hücreleri bulunan sonra, ilgi vardı hücre içindeki bölgeleri tanımlamak için yüksek çözünürlüklü konfokal floresan görüntülerini kullanın. TEM kullanarak yüksek çözünürlükte görüntü bu. Böyle hücre periferinde ve floresan z-yığını görüntüsü EM dilim karşılık belirlemek için nükleer zarf gibi önemli noktalara kullanın.
- Seçtiğiniz görüntüleme programı (örneğin, Resim J, Adobe Photoshop, vb) kullanarak,% 50 floresan görüntü opacity azaltmak ve ilişkilendirir hangi ile TEM görüntünün üstüne yerleştirir. Ölçeği ayarlama (oranlarını ve alıkoymak için unutmayın) ve TEM görüntü maç konfokal görüntü dönüşü ile görüntüleri hizalayın. Floresan görüntüde kontrast, keskinlik, vb İnce ayarlamalar uyum yardımcı olabilir. Not: bu Heterokromatin, nükleer zarf, ve hücre çevre yardımcı olmak için iyi bir görülecek temsil olduğunu buldukİki görüntünün yönde.
6. Eleştirel Düşünceler
- Büyük ölçüde enjekte küçük molekül bulma yardımcı olmak için, bu tür Rodamin veya floresein gibi bir floresan etiketi kovalent ticari kitler kullanılarak eklenebilir. Ek bilgi ektopik öncesinde mikroenjeksiyon için floresan hücre içi lokalizasyonu belirteç proteini ifade ederek kazanılır. Bu nedenle, floroforlar ve atıl mikroenjeksiyon izleme boya seçimi önemlidir.
- Yakın lamel merkezine yapışmış olan mikroenjeksiyon için hücreleri seçin ve kenarına yakın bir tablo seçerek kaçının. Bu ilgi hücreleri elektron mikroskopi için kullanılan EPON Reçine aktarılır olduğu en büyük ihtimal sunacaktır.
- Hücrelerin konfluense iun önemli bir tamamen konfluent plaka çok zor elektron mikroskobu enjekte edilen hücrelerin tanımlama yapmak gibi. Aksine, tohum hücreleri gibi kısa bir deney günü ~ 50% konfluent ulaşmak veya daha uzun gün (1-2 gün) deney üzerinde ~ 25% konfluent. Olduğunu Konum ve şekil hücrelerin yanı sıra yönlendirmek için işareti olarak "boş alan elektron mikroskop görüntüsü kullanın.
- Konfokal optik kesit kalınlığı deney ihtiyaçlarına ayarlanmış olmalıdır ve bu nedenle deneysel olarak 10 tespit edilmesi gerekmektedir.
- Fiksatif formaldehit ve gluteraldehit mevcut en yüksek saflıkta olmalıdır. Formaldehit proteinleri ve küçük floresan molekülü (örneğin Rodamin veya FITC gibi) hem de floresans özellikleri korumak, henüz hücreleri çözecektir. Bununla birlikte, bu yapıların yüksek EM çözünürlüğe izin vermek için korumaz. Glutaraldehit analy EM için yüksek derecede membranları ve hücre içi yapıları korursis, ancak önemli ölçüde floresans engel olacaktır. Bu nedenle, iki aşamalı bir tespit iki floresan için büyük önem taşımaktadır ve EM mikroskopisi. Nihai fiksasyon glutaraldehit tedavi ile yapılabilir gibi formaldehit fiksasyon adım, canlı hücre ölçümleri gerçekleştirilirken atlanabilir.
7. Temsilcisi Sonuçlar
Bu işlem doğrudan ökaryotik hücre sitoplazma içine ilgi bir molekül teslim ve çok nanometre çözünürlükte milimetre gelen hücresel ve organeller mimarlığa lokalizasyonu ve / veya etkilerini izlemek olanağı tanıyor. Deneysel düzenek ve işlem şematik bir resmidir Şekil 2 'de gösterilmiştir. Bu teknik (Şek. konfokal mikroskopi sonra, EPON Reçine ilgi gibi ızgara deseni hücrelerinin her iki transfer etmek için mümkün olan bir lazer kazınmış cam lamel ızgara (Şekil 3A), yetişen hücre mikroenjeksiyon üzerine dayanır3B).
Tipik bir mikroenjeksiyon CLEM prosedürü edildiği zaman, hücre içi lokalizasyonu ve ultrastrüktürel analizi hem izin floresans görüntüleri ve elektron mikroskop, verir. Bir photoetched cam lamel ızgara üzerinde yetiştirilen hücreler parlak alan görüntüleri elde edilmektedir sonra ilgi çekici bir molekül (Şekil 4A) ile mikroenjeke edilir. Bir atıl izleme boya olmayan enjekte edilen hücreleri (Şekil 4B) dan enjekte edilen hücre ayırt etmek için dahil edilmiştir. Konfokal z-yığınları bir florofor ya da ilgi enjekte edilen küçük molekül (Şek. 4C) bağlı başka bir tanımlayıcı ile elde edilir. Örnek glutaraldehit ile tespit ve elektron mikroskobu için işlenir. Elektron mikroskop karşılık geldikleri hücreleri (Şekil 4D) üzerine elde edilen ve üst üste. Floresan sinyallerini barındıran bölgeleri (Şekil 4E yüksek büyütmede daha detaylı olarak incelenir ).

Şekil 1. Mikroenjeksiyon CLEM prosedürü Timeline. Deney düzeneği bağlı olarak, mikroenjeksiyon ve floresans ölçümleri aynı gün içinde gerçekleştirilebilir. Elektron mikroskobu için numune hazırlama uzun inkübasyonlar adımlara en zaman alıcı nedeniyle ve 2-3 gün sürecek. TEM analiz ve elektron mikroskopi ile görüntü flöresan sinyalleri korele bir gün içinde gerçekleştirilebilir.
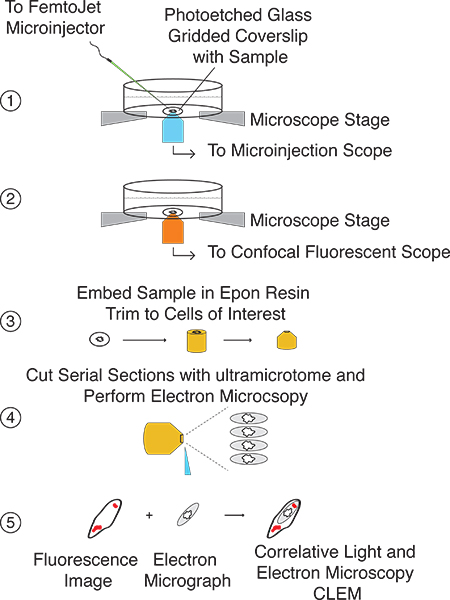
Şekil 2 mikroenjeksiyon CLEM prosedürü Genel illüstrasyon Adım 1:.. Lazer kazınmış cam gridded lamel üzerinde büyüyen hücreleri bulup ilgi molekülü microinject Adım 2:.. Parlak bir alan görüntüler ve enjekte edilen hücrelerin konfokal floresan z yığınları hem Yakalama Adım 3: hazırlamakEM için lamel analiz ve EPON reçine gömün. Transfer ızgara deseni kullanarak, ilgi öyle ki hücreler bloke Döşeme apekste şunlardır Adım 4:. Ultramicrotome ile seri kesitler Cut Adım 5:. EM görüntüleri ile floresan görüntüler ilişkilendirir.
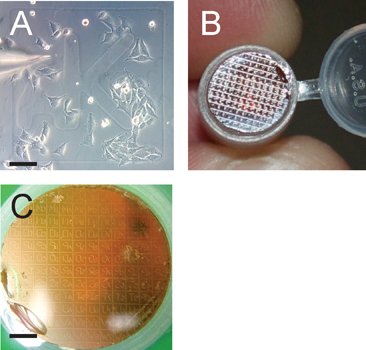
. Şekil 3. Izgara desen ilgi hücrelerinin belirlenmesini kolaylaştıran Panel A ~ 50% konfluent yetiştirilen hücreler mikroenjeksiyon gösteriyor;. Izgara tanımlayıcı aK unutmayın. Ölçek çubuğu 100 mikron. Panel B ilgi ızgara bir diseksiyon mikroskobu tespit edildikten sonra seri kesitli olacaktır polimerize EPON reçine blok üzerine lamel gelen transfer ızgara deseni gösterir. Panel C kesit için hazırlık transfer ızgara deseni gösterir . Transfer ızgara patter reçine blok üzerinde ters olduğunu unutmayın; scale bar 1200 mikron.

.. Şekil 4 mikroenjeksiyon korelatif ışık ve elektron mikroskobu Temsilcisi sonuçları Panel A lazer kazınmış cam gridded lamel üzerinde büyüyen NRK hücreleri aydınlık alan mikrografı gösterir; ok paneller CD CLEM tarafından görüntülenmiştir iki hücre göstermektedir Panel B floresans gösterir. atıl izleme boya, bu durumda Cascade Blue, microinjected hücreleri belirlemek için kullanılır. Panel C parlak saha tabakasını ve bir Rodamin-etiketli küçük molekülün flüoresan imza göstermektedir. Burada gösterilen iki hücre A ve B. Panel D parlak alan, floresan ve elektron mikroskobu CLEM temsil panellerinde oklarla gösterilir;. Ok başı floresan punktumlarda Panosu E yüksek büyütmede görüntülü işaret Ölçek çubuklar fol gibidiralçak: Paneller A & B, 100 mikron; C & D, 50 um, E, 100 nm.
Tartışmalar
Burada sunulan yöntem ökaryotik sitoplazmaya saflaştırılmış proteinler, nükleik asitler, veya küçük moleküllerin doğrudan teslim edilmesini sağlayan ve floresan ve elektron mikroskobu korelasyon yoluyla ultra yüksek çözünürlük analizi tanıyor. Bu yöntemin kullanılması basit ama sağlam ve çok sayıda mevcut temel tesisleri ve / veya uygun bir alet elektron mikroskopisi laboratuarları ile in-house gerçekleştirilebilir. Tekniği kullanıcının gerçek zamanlı floresan etiketli moleküllerin dinamiğinin izlemek ve böylece zaman atlamalı mikroskopi ile kullanılan ve tomografik elektron mikroskobu ile korele edilebilir sağlayan, ayrıca canlı hücreye tâbidir.
Ön ampirik çalışmalarda elektron MICR için optimal confluency, mikroenjeksiyon verimlilik ve enjektör, floroforlar optimizasyonu ve enjeksiyon / boya (lar) izleme uygun miktarlarda teslim ve uygunluk ve / veya uzmanlık belirlemek için deney tüm aşamalarında yapılmalıdıroscopy analizi. CLEM prosedürünün tüm adımları enjekte hücre Konumlandırılması bu protokolü için önemlidir ve bu nedenle lamel merkezine yakın bir alfasayısal ızgara büyüyen hücreler hem konfokal olarak numune belgelenmiş olacak olasılığını artırmak için tercih edilmesi önerilir ve elektron mikroskobu. İlgi hücreleri yerini yardımcı olmak için, çevreleyen hücrelere parçasının göreli konumlarını görülecek EM analiz esnasında örnekte uygun yerini yardımcı olmak için olduğu gibi kullanılır. Nihayet, kesit kalınlığı istenilen ölçüm uygun olmalıdır. Kalın bir bölümü (~ 250-300 nm) EM tomografi için tavsiye edilir iken ~ 70 nm kalınlıkta bir seri bölümüne TEM için tavsiye edilir.
Mikroenjeksiyon CLEM tekniği öncelikle Tip III salgılanan bakteriyel efektör proteinleri teslim taklit ve ökaryotik hücre Subselüler ultrastrüktür üzerindeki etkilerini analiz etmek laboratuvarımızda kullanılmaktadır. Bununla birlikte, plastiklik ve EASCLEM ardından mikroenjeksiyon kullanılması e inceleme birçok başka yollar tanıyor.
Açıklamalar
Çıkar çatışması ilan edilir.
Teşekkürler
Biz yararlı tartışmalar için Alto laboratuar üyelerine teşekkür. Biz de teknik uzmanlık ve danışmanlık için UT Southwestern Tıp Merkezi, özellikle Dr Chris Gilpin, Tom Januszewski, ve Laurie Mueller de Moleküler ve Hücresel Görüntüleme Tesis ederim. Biz de elyazmasının eleştirel okuma için Dr Xionan Dong ederim. Bu çalışma NMA için NIH hibe AI083359 tarafından desteklenmektedir
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog Numarası | Yorumlar |
| Photoetched lamel ve Canlı hücre Plakalı | Mattek | P35G-2-14-CGRD | |
| Texas Red | Invitrogen | D3329 | |
| Cascade Mavi | Invitrogen | D7132 | |
| Rodamin Etiketleme Kiti | Thermo Scientific | 53002 | |
| 0.22 mikron santrifüj ile filtrasyon ünitesi | Millipore | UFC30GV00 | |
| Borosilikat Cam Pipetler | Sutter Aletleri | BF100-50-10 | |
| Mikropipet Çektirme | Sutter Aletleri | Model P-97 | Rampa testi yaptıktan sonra programı # 4 kullanın |
| FemtoJet Mikroenjeksiyon Sistemi | Eppendorf | InjectMan NI2 | |
| Lamel Temizleme Sıvısı | Mattek | PDCF OS 30 | |
| Technai Transmisyon Elektron Mikroskobu | FEI | Technai G2 BioTWIN | |
| Ultramicrotombe | Leica | EM UC6 |
Referanslar
- Schmolze, D. B., Standley, C., Fogarty, K. E., Fischer, A. H. Advances in microscopy techniques. Arch. Pathol. Lab Med. 135, 255-263 (2011).
- Giepmans, B. N. Bridging fluorescence microscopy and electron microscopy. Histochem. Cell Biol. 130, 211-217 (2008).
- Mayhew, T. M., Muhlfeld, C., Vanhecke, D., Ochs, M. A review of recent methods for efficiently quantifying immunogold and other nanoparticles using TEM sections through cells, tissues and organs. Ann. Anat. 191, 153-170 (2009).
- Razi, M., Tooze, S. A. Correlative light and electron microscopy. Methods Enzymol. 452, 261-275 (2009).
- Svitkina, T. M., Borisy, G. G. Correlative light and electron microscopy of the cytoskeleton of cultured cells. Methods Enzymol. 298, 570-592 (1998).
- van Weering, J. R. Intracellular membrane traffic at high resolution. Methods Cell Biol. 96, 619-648 (2010).
- Polishchuk, R. S. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. J. Cell Biol. 148, 45-58 (2000).
- Lim, J., Danuser, G. Live Cell Imaging of F-actin Dynamics via Fluorescent Speckle Microscopy (FSM). J. Vis. Exp. (30), e1325 (2009).
- Selyunin, A. S. The assembly of a GTPase-kinase signalling complex by a bacterial catalytic scaffold. Nature. 469, 107-111 (2011).
- Semwogerere, D., Weeks, E. R. . Confocal Microscopy in Encyclopedia of Biomaterials and Biomedical Engineering. , (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır