Method Article
Lumière corrélative et microscopie électronique (CLEM) comme un outil pour visualiser des molécules et de leurs microinjecté eucaryotes Sous-cellulaires cibles
Dans cet article
Résumé
La technique CLEM a été conçu pour analyser la morphologie ultrastructurale des membranes, les organites subcellulaires, et des structures affectées par micro-injection des molécules. Cette méthode combine les techniques puissantes de micromanipulation / microinjection, microscopie confocale à fluorescence et microscopie électronique pour permettre millimètre à résolution nanométrique multi-. Cette technique se prête à une grande variété d'applications.
Résumé
La cellule eucaryote dépend complexe, très réglementé, et fonctionnellement distinctes compartiments membranaires liés à préserver une polarité biochimique nécessaire à la fonction cellulaire adéquate. Comprendre comment les enzymes, les protéines et les composants du cytosquelette gouverner et maintenir cette séparation biochimique est donc d'une importance primordiale. L'utilisation de molécules marquées par fluorescence de localiser et / ou perturbent compartiments subcellulaires a révélé une mine de connaissances et de faire progresser notre compréhension de la régulation cellulaire. Les techniques d'imagerie telles que la microscopie confocale fluorescente et faire déterminer la position d'une molécule fluorescente marqués petite relativement simple, mais la résolution de très petites structures est limitée 1.
D'autre part, la microscopie électronique a révélé les détails de la morphologie subcellulaire à très haute résolution, mais son caractère statique, il est difficile de mesurer très dynamique processus avec précision 2,3. Ainsi, la combinaison de la microscopie optique à la microscopie électronique d'un même échantillon, appelé Lumière corrélative et microscopie électronique (CLEM) 4,5, offre le double avantage de l'imagerie de fluorescence ultra-rapide avec la haute résolution de la microscopie électronique 6. Cette technique puissante a été mis en place pour étudier de nombreux aspects de 5,7 biologie cellulaire. Depuis sa création, cette procédure a accru notre capacité à distinguer les architectures subcellulaires et des morphologies à haute résolution.
Ici, nous présentons une méthode simplifiée pour la réalisation de micro-injection rapide suivie d'CLEM (Fig. 1). La procédure CLEM micro-injection peut être utilisé pour introduire des quantités spécifiques de petites molécules et / ou des protéines directement dans le cytoplasme de cellules eucaryotes et étudier les effets du millimètre à plusieurs nanomètres résolution (Fig. 2). La technique est basée sur la micro-injectioncellules cultivées sur des lamelles en verre gravé au laser par maille fixé au fond de vaisselle de cellules vivantes et l'imagerie par microscopie confocale à la fois fluorescent et d'électrons. Localisation de la cellule (s) d'intérêt est facilitée par la configuration de grille, qui est facilement transférable, avec des cellules d'intérêt, de la résine Epon utilisé pour l'immobilisation des échantillons et de sectionnement avant analyse par microscopie électronique (fig. 3). Superposition des images fluorescentes et EM permet à l'utilisateur de déterminer la localisation subcellulaire ainsi que les modifications morphologiques et / ou ultrastructurales induites par la molécule d'intérêt microinjecté (Fig. 4). Cette technique se prête à des points de temps allant de ≤ 5 s jusqu'à plusieurs heures, selon la nature de l'échantillon microinjectés.
Protocole
1. Culture des cellules de mammifères
- Rein de rat normal (NRK), immortalisé cancer du col utérin (HeLa), ou d'autres lignées cellulaires de mammifères appropriées sont mises en culture à 37 ° C, 5% de CO 2, sur des lamelles de verre photodécoupe maillées apposées à vivre plats cellulaires (voir le tableau 1 pour n'importe quel réactif ou appareil utilisé dans ce protocole) dans FBS DMEM + 10% et 1% Pen / Strep. Des précautions doivent être prises pour maintenir un environnement stérile lorsque vous travaillez avec des cultures de cellules de mammifères.
- En fonction de votre temps en ligne expérimentale (0-5 heures après l'injection vs 1-2 jours), la confluence de cellules doit être réglée à ~ 50% ou ~ 25%, respectivement.
2. La micro-injection
- Préparer protéine désirée, de l'ADN ou de petites molécules dans votre choix de tampon, en fonction de la perméabilité à la culture cellulaire, à un volume final de 50 pl ~. Inertes colorants fluorescents tels que Texas Red ou Bleu Cascadesont inclus afin de marquer les cellules micro-injection, le choix du colorant injection et sonde fluorescente doit avoir une excitation non-recouvrement et des longueurs d'onde d'émission. La concentration de votre molécule d'intérêt nécessaire pour la micro-injection devrait être déterminée de manière empirique, et les colorants fluorescents de suivi sont couramment utilisés à 0,5-1,0 mg / ml. En règle générale, la rhodamine ou un autre fluorophore est lié de façon covalente à votre molécule d'intérêt en utilisant un kit commercial, cependant d'autres méthodes de détection peuvent être utilisés en fonction de la sensibilité. Pour plus d'informations, consultez Considérations critiques ci-dessous.
- Filtrer la solution injectée (~ 50 pi) à travers un filtre de 0,22 um centrifuge. Filtres centrifuges sont préférées à vide et / ou la filtration de seringue qui sont associés à des volumes morts.
- Pour générer l'aiguille microinjection, pipettes en verre borosilicate sont retirés à l'aide d'un Flaming-Brown Micropipette Puller suivants les directives du fabricant. Alternativement, la micro-injectionaiguilles peuvent être achetés auprès de fournisseurs, y compris Eppendorf qui rend aiguilles de microinjection Femtotip.
- Pipeter de 4 pi de produit injecté dans l'extrémité de l'aiguille sans encombre à l'aide de micro-injection Eppendorf 20 Femtotips. Assurez-vous qu'aucun des bulles sont présentes au sein de l'aiguille microinjection tiré. Chargez aiguille micro-injection dans le bras micromanipulateur de la InjectMan Eppendorf FemptoJet relié à un microscope inversé. Pour un bon examen de la procédure de micro-injection, le lecteur est invité à un journal précédente de l'article expériences visualisé 8.
- Placez plat cellule vivante avec lamelle quadrillée et des cellules cultivées dans le support plat du microscope Zeiss inversé. Trouvez des cellules en croissance dans une grille de photodécoupe et notez le code alphanumérique grilles, il sera utilisé dans toutes les étapes ultérieures. L'emplacement des cellules au centre de la lamelle couvre-objet comme étapes subséquentes limiter le transfert de l'échantillon au niveau des bords de la lamelle couvre-objet.
- Bras d'injection manuelle inférieure en place sur la lamelle, et en utilisant le joystick micromanipulateur et les contrôles, l'aiguille d'injection plus faible jusqu'à ce que la pointe effleure la surface des cellules cultivées et limites appuyez sur 'pour empêcher le mouvement de l'aiguille au-delà de ce point et ainsi briser le fragile tiré en verre de borosilicate. Tous les autres aspects de la micro-injection de cellules sont réalisées selon Eppendorf FemtoJet manuel de l'utilisateur InjectMan. La technique de micro-injection a été récemment utilisée pour comprendre individuels protéines de virulence sécrétés par les bactéries 9.
- Micro-injection toutes les autres cellules dans le réseau choisi. Avec les cellules cultivées à ~ 50% de confluence, on peut s'attendre ~ 80 cellules par 600 um grille 2 (exemple illustré sur la Fig. 3A). Par conséquent, lors de l'inspection microscopie par fluorescence et électronique, il y aura un n ~ expérimentale de 30-40 et les cellules témoins.
- Placez des cellules vivantes plat de nouveau dans la culture de cellules de mammifères incubateur pour souhaitéetemps comme dicté par le dispositif expérimental. Alternativement, on peut passer directement de la micro-injection d'analyse par microscopie time-lapse d'attendre l'apparition de certaines structures subcellulaires d'intérêt avant la fixation.
3. Microscopie fluorescente
- Si vous le souhaitez, effectuer des cellules vivantes time-lapse mesures de fluorescence de cellules micro-injection, après quoi, remplacez le support avec du glutaraldéhyde à 2,5% en tampon cacodylate 0,1 M (pH 7,4) et incuber pendant 10 min à température ambiante. Toutefois, si cellules vivantes mesures ne sont pas nécessaires, jetez un milieu de croissance des cellules et fixer les cellules avec 5 ml de formaldéhyde à 3,7% en 1xPBS à température ambiante pendant 10 minutes. Jeter fixateur et remplacer avec 5 ml 1xPBS, passez à l'étape 3.2. Remarque: il est essentiel de ne pas ajouter glutaraldéhyde qu'après la microscopie à fluorescence est terminée.
- Placer le plat des cellules vivantes avec lamelle quadrillée photodécoupe dans un microscope à fluorescence (confocale n'est pas nécessaire pour thil'étape d) recueillir et 5-10 de champ lumineux et des images fluorescentes de la grille appropriée pour documenter l'agencement des cellules (Fig. 4A). Identifier les cellules qui ont été micro-injectés à l'aide des longueurs d'ondes d'excitation et d'émission du colorant inerte injection (Fig. 4B). Il est important d'obtenir des images à des grossissements différents (par exemple 10x et 65x) afin de faciliter l'identification des cellules micro-injectés dans les étapes ultérieures impliquant la microscopie électronique.
- En utilisant un microscope confocal à fluorescence, prélever un Z-stack de cellules micro-injection dans le réseau identifié à l'étape 2.5 ci-dessus. Fort grossissement (100x) est nécessaire afin de corréler des images fluorescentes avec des structures subcellulaires qui seront identifiés en microscopie électronique.
- Les lamelles sont retirés du fond des boîtes de cellules vivantes avec un fluide lamelle enlèvement disponible dans le commerce et placée cellule vers le haut dans une boîte de culture cellulaire contenant 5 ml vierge1xPBS. La lamelle est ensuite traitée pour la microscopie électronique tel que décrit ci-dessous.
4. Transmission Electron Microscopy
- Remplacer tampon 1xPBS avec du glutaraldéhyde à 2 ml de 2,5% en tampon cacodylate 0,1 M (pH 7,4) et incuber à température ambiante pendant 10 minutes. Incubation plus longue, tout en n'étant pas nécessaire, aideront à l'entretien des structures subcellulaires. Remarque: le formaldéhyde seul n'est pas suffisant pour un fixateur EM analyse.
- Éliminer les cellules fixatrices et tache avec l'addition de 2 ml tétroxyde d'osmium à 1% dans 0,1 M de tampon cacodylate pendant 30 min suivie de trois lavages avec le tampon cacodylate et enfin remplacer tous tampon avec ddH 2 O.
- Suite à des protocoles standard EM, déshydrater l'échantillon dans un graduée (70% à 100%) série de l'éthanol. Préparer la résine Epon et lamelle lieu cellule vers le bas au-dessus d'une résine Epon tube rempli. Permettre la polymérisation pendant 24 heures à 60 ° C. En plaçant la lamelle photodécoupe quadrillé côté cellule newn sur la résine Epon, à la fois les cellules d'intérêt, ainsi que le motif de grille est transférée à la résine pendant la polymérisation Epon (exemple représenté sur la Fig. 3B).
- Retirer des lamelles de résine Epon par immersion rapide dans l'azote liquide et / ou de l'eau bouillante. Inspectez la surface de la résine sous un champ binoculaire à dissection pour localiser la grille d'intérêt (note: le crépitement grille de transférer une image miroir). Une lame de rasoir ou un scalpel stérile, de l'assiette du bloc Epon vers le bas de sorte que seule la grille d'intérêt est au sommet du bloc de résine Epon.
- L'aide d'un ultramicrotome, acquérir des coupes en série du bloc compensé à l'épaisseur souhaitée (~ 70 nm d'épaisseur pour TEM conventionnelle et une épaisseur ~ 250 nm pour tomographique TEM). Contraste des sections avec de l'acétate d'uranyle et au citrate de plomb suivant des protocoles standard.
5. Lumière corrélative et microscopie électronique
- Relocaliser les cellules d'intérêt dansle microscope électronique à partir d'images obtenues dans les étapes précédentes. Une fois que les cellules micro-injectés d'intérêt ont été localisés, utilisez les confocale à haute résolution des images fluorescentes pour identifier les régions à l'intérieur de la cellule qui sont d'intérêt. Image de celles-ci à haute résolution en utilisant TEM. Utiliser les sites d'intérêt tels que la périphérie de la cellule et l'enveloppe nucléaire pour déterminer fluorescent z pile d'image correspond à la tranche EM.
- Utilisation du programme d'imagerie de votre choix (par exemple, l'image J, Adobe Photoshop, etc), réduire l'opacité de l'image fluorescente de 50% et la superposer à l'image TEM avec laquelle il correspond. Aligner les images en réglant l'échelle (à retenir les proportions) et la rotation de l'image confocale pour correspondre à l'image de TEM. Les ajustements précis de contraste, la netteté, etc dans l'image fluorescente peut aider à l'alignement. Remarque: nous avons constaté que l'hétérochromatine, l'enveloppe nucléaire, et la périphérie de la cellule d'excellents points de repère représentent un pour aiderdans l'orientation des deux images.
6. Considérations critiques
- Pour grandement faciliter la localisation de la molécule injectée petite, un marqueur fluorescent comme la fluorescéine ou la rhodamine peut être lié de manière covalente en utilisant des kits disponibles dans le commerce. Des informations complémentaires sont acquises par ectopique exprimant une protéine fluorescente subcellulaire marqueur de localisation avant la microinjection. Par conséquent, le choix de fluorophores et inerte colorant suivi microinjection est important.
- Choisir des cellules de micro-injection qui sont adhérentes à proximité du centre de la lamelle couvre-objet et éviter de choisir une grille à proximité du bord. Vous présente la plus grande probabilité pour que les cellules d'intérêt sont transférés à la résine Epon utilisé pour la microscopie électronique.
- Confluence des cellules iest important, comme une plaque complètement confluentes rendra l'identification des cellules micro-injectés dans le microscope électronique à très difficile. Au contraire, les cellules de graines telles qu'elles atteignent environ 50% de confluence le jour d'une courte expérience, ou environ 25% de confluence le jour de la plus longue (1-2 jours) expérience. Utilisez la position et la forme des cellules ainsi que l'espace «vide comme point de repère pour orienter l'image microscopie électronique.
- Confocale épaisseur de coupe optique doit être à l'écoute des besoins de l'expérience et doit donc être déterminée de manière empirique 10.
- Le formaldéhyde et le glutaraldéhyde fixateurs doivent être de la plus haute qualité disponible. Le formaldéhyde se fixer les cellules, tout en préservant les propriétés de fluorescence des deux protéines et de petites molécules fluorescentes (telles que la rhodamine ou FITC). Cependant, il ne conservera pas les structures pour permettre à haute résolution EM. Glutaraldéhyde préserve les membranes et les structures subcellulaires à un haut degré d'analyse EMsis, mais entraver de manière significative la fluorescence. Par conséquent, la fixation en deux étapes est essentielle à la fois pour la fluorescence et la microscopie EM. L'étape de fixation du formaldéhyde peut être omis si l'exécution en temps réel de cellules de mesures, comme la fixation finale peut être effectuée par traitement au glutaraldéhyde.
7. Les résultats représentatifs
Cette procédure offre la possibilité de fournir une molécule d'intérêt directement dans le cytoplasme cellulaire eucaryote et surveiller sa localisation et / ou des effets sur l'architecture cellulaire et organeller de millimètre en multi-résolution nanométrique. Une représentation schématique du dispositif expérimental et la procédure est montré dans la figure 2. Cette technique repose sur la micro-injection de cellules cultivées sur une lamelle de verre gravé au laser quadrillé (fig. 3A), qui, après la microscopie confocale, est capable de transférer les cellules d'intérêt, ainsi que le motif de grille à la résine Epon (Fig.3B).
Une procédure typique microinjection CLEM donne des images de fluorescence et micrographies électroniques, que lorsqu'elles sont corrélées, permettant à la fois la localisation subcellulaire et l'analyse ultrastructurale. Les cellules cultivées sur une lamelle de verre quadrillé photodécoupe sont micro-injecté avec une molécule d'intérêt après lequel les images à fond clair sont obtenus (figure 4A). Un colorant de repérage inerte est constituée de distinguer les cellules de micro-injection des cellules non micro-injection (figure 4B). Confocaux z piles sont obtenus en utilisant un fluorophore ou un autre identificateur attaché à la molécule d'intérêt microinjectées petit (Fig. 4C). L'échantillon est fixé avec du glutaraldéhyde et traitées pour la microscopie électronique. Les micrographies électroniques sont obtenues et se superpose sur les cellules auxquelles ils correspondent (figure 4D). Les zones qui abritent des signaux fluorescents sont inspectés de façon plus détaillée à plus fort grossissement (Fig. 4E ).

Figure 1. Chronologie de la procédure CLEM microinjection. En fonction de la configuration expérimentale, la micro-injection et les mesures de fluorescence peut être effectuée sur le même jour. Préparation de l'échantillon pour la microscopie électronique est plus de temps en raison de la consommation de longues incubations étapes et durera 2-3 jours. L'analyse par MET et la corrélation des signaux de fluorescence avec des images de microscopie électronique peut être effectuée en une seule journée.
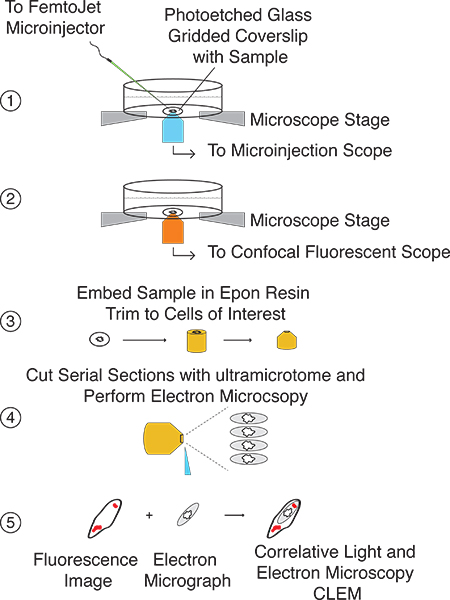
La figure 2 illustre la procédure générale de CLEM microinjection Etape 1:.. Repérez les cellules en croissance sur lamelle de verre gravé au laser quadrillé et micro-injection molécule d'intérêt. Étape 2:. Capturez les deux images à fond clair et confocale fluorescentes z piles de cellules microinjectés Étape 3: préparerlamelle pour EM analyse et d'incorporer dans la résine Epon. Utilisation grille transféré, couper bloquer de sorte que les cellules d'intérêt sont au sommet. Étape 4: Faites des coupes en série avec ultramicrotome. Etape 5: Corrélation des images fluorescentes avec EM images.
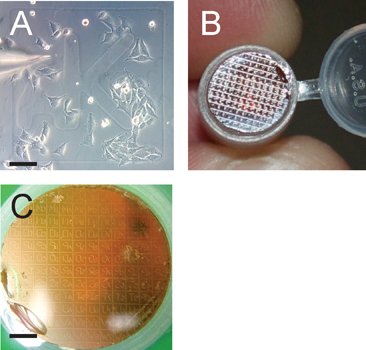
. Figure 3 en grille facilite l'identification des cellules d'intérêt panneau A représente la micro-injection de cellules cultivées à ~ 50% de confluence;. Noter la grille identifiant aK. Barre d'échelle est de 100 um. Panneau B montre le quadrillage transféré à partir de la lamelle couvre-objet sur le bloc polymérisé résine Epon qui sera coupée en série après la grille d'intérêt est identifié dans un microscope à dissection. Groupe C représente le motif de grille en vue de transférer de sectionnement . Notez que le crépitement grille de transfert est en marche arrière sur le bloc de résine; scalbar e est de 1200 um.

.. Figure 4 résultats représentatifs de la lumière corrélative micro-injection et la microscopie électronique Le panneau A montre la micrographie en champ clair de cellules NRK qui poussent sur une lamelle de verre gravé au laser quadrillé, les flèches indiquent deux cellules qui sont visualisés par CLEM en CD panneaux panneau B montre la fluorescence. du colorant inerte suivi, dans ce cas Cascade Blue, utilisé pour identifier des cellules qui ont été microinjectés. Groupe C montre la superposition du champ lumineux et la signature de fluorescence de la rhodamine-petite molécule marquée. Les deux cellules présentées ici sont indiqués par des flèches sur les panneaux A et B. La partie D représente CLEM sur fond clair, microscopie à fluorescence et électronique;. Tête de flèche indique fluorescente lacrymaux imagée à un grossissement supérieur dans Panneau E barres d'échelle sont les suibas: Panneaux A et B, 100 um; C et D, 50 um; E, 100 nm.
Discussion
La méthode présentée ici permet la livraison directe des protéines, des acides nucléiques purifiés, ou des petites molécules dans le cytoplasme eucaryote et offre ultra-haute résolution grâce à l'analyse de la corrélation de la microscopie à fluorescence et électronique. L'utilisation de cette méthode est simple mais robuste et peut être réalisée en interne avec de nombreuses installations de base existantes et / ou des laboratoires convenablement équipés en microscopie électronique. La technique est également prête à des cellules vivantes, ce qui permet à l'utilisateur de contrôler la dynamique des molécules marquées par fluorescence en temps réel et peut donc être utilisé avec time-lapse de microscopie tomographique et corrélée à la microscopie électronique.
Les premiers essais empiriques doivent être menées à tous les stades de l'expérience pour déterminer la confluence optimale, l'efficacité micro-injection et la livraison de quantités appropriées de produit injecté, l'optimisation des fluorophores et d'injection / de suivi colorant (s), et la disponibilité et / ou d'expertise pour électrons micranalyse oscopy. Localisation de la cellule injectée dans toutes les étapes de la procédure CLEM est essentiel à ce protocole, et par conséquent, il est recommandé que la croissance de cellules dans une grille alphanumérique près du centre de la lamelle être choisi pour augmenter la probabilité que l'échantillon sera documentée dans les deux confocale et la microscopie électronique. Pour faciliter la localisation des cellules d'intérêt, les positions relatives des cellules environnantes devraient être utilisées comme points de repère pour faciliter la localisation de l'échantillon approprié au cours de l'analyse EM. Enfin, l'épaisseur de coupe doit être adaptée à la mesure souhaitée. Une section de série de l'épaisseur ~ nm 70 est recommandé pour les TEM alors une section plus épaisse (~ 250-300 nm) est recommandé pour la tomographie par EM.
La technique de micro-injection CLEM est principalement utilisé dans notre laboratoire pour simuler la livraison de type III sécrétées par des bactéries protéines effectrices et analyser leurs effets sur l'ultrastructure subcellulaire de la cellule eucaryote. Cependant, la plasticité et l'EASe de l'utilisation de la micro-injection suivie par CLEM offre de nombreuses autres moyens d'enquête.
Déclarations de divulgation
Pas de conflit d'intérêts sont déclarés.
Remerciements
Nous tenons à remercier les membres du laboratoire Alto pour des discussions utiles. Nous remercions également le Fonds pour l'imagerie moléculaire et cellulaire à l'UT Southwestern Medical Center, en particulier le Dr Chris Gilpin, Tom Januszewski, et Laurie Mueller pour l'expertise technique et des conseils. Nous remercions également le Dr Dong Xionan pour la lecture critique du manuscrit. Ce travail est soutenu par le NIH subvention AI083359 à NMA
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| Lamelles en photodécoupe et cellules vivantes Plate | MatTek | P35G-2-14-CGRD | |
| Texas Red | Invitrogen | D3329 | |
| Cascade Blue | Invitrogen | D7132 | |
| Rhodamine kit de marquage | Thermo Scientific | 53002 | |
| 0,22 um unité de filtration centrifuge | Millipore | UFC30GV00 | |
| Pipettes en verre borosilicate | Sutter Instruments | BF100-50-10 | |
| Micropipette Puller | Sutter Instruments | Modèle P-97 | Utilisez le programme n ° 4 après l'exécution de test de rampe |
| Système de micro-injection FemtoJet | Eppendorf | InjectMan NI2 | |
| Fluide Retrait lamelle | MatTek | PDCF OS 30 | |
| Technai microscope électronique à transmission | FEI | Technai G2 BioTWIN | |
| Ultramicrotombe | Leica | EM UC6 |
Références
- Schmolze, D. B., Standley, C., Fogarty, K. E., Fischer, A. H. Advances in microscopy techniques. Arch. Pathol. Lab Med. 135, 255-263 (2011).
- Giepmans, B. N. Bridging fluorescence microscopy and electron microscopy. Histochem. Cell Biol. 130, 211-217 (2008).
- Mayhew, T. M., Muhlfeld, C., Vanhecke, D., Ochs, M. A review of recent methods for efficiently quantifying immunogold and other nanoparticles using TEM sections through cells, tissues and organs. Ann. Anat. 191, 153-170 (2009).
- Razi, M., Tooze, S. A. Correlative light and electron microscopy. Methods Enzymol. 452, 261-275 (2009).
- Svitkina, T. M., Borisy, G. G. Correlative light and electron microscopy of the cytoskeleton of cultured cells. Methods Enzymol. 298, 570-592 (1998).
- van Weering, J. R. Intracellular membrane traffic at high resolution. Methods Cell Biol. 96, 619-648 (2010).
- Polishchuk, R. S. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. J. Cell Biol. 148, 45-58 (2000).
- Lim, J., Danuser, G. Live Cell Imaging of F-actin Dynamics via Fluorescent Speckle Microscopy (FSM). J. Vis. Exp. (30), e1325 (2009).
- Selyunin, A. S. The assembly of a GTPase-kinase signalling complex by a bacterial catalytic scaffold. Nature. 469, 107-111 (2011).
- Semwogerere, D., Weeks, E. R. . Confocal Microscopy in Encyclopedia of Biomaterials and Biomedical Engineering. , (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon