Method Article
Microscópio óptico e Eletrônica (CLEM) como uma ferramenta para visualizar moléculas microinjetados e seus eucarióticas Sub-celulares Metas
Neste Artigo
Resumo
A técnica CLEM foi adaptado para analisar a morfologia ultraestrutural de membranas, organitos e estruturas subcelulares afectados por moléculas microinjectados. Este método combina as técnicas poderosas de micromanipulação / microinjeção, microscopia confocal, fluorescentes e microscopia eletrônica para permitir milímetros de multi-resolução nanométrica. Esta técnica é susceptível a uma grande variedade de aplicações.
Resumo
A célula eucariótica depende complexo, altamente regulado, e compartimentos da membrana acoplados funcionalmente distintos que preservam a polaridade bioquímico necessário para a função celular adequada. Entender como as enzimas, proteínas e componentes do citoesqueleto governar e manter esta segregação bioquímica é, portanto, de suma importância. A utilização de moléculas fluorescentes marcadas para localizar e / ou perturbam compartimentos subcelulares rendeu uma riqueza de conhecimentos e avanços na compreensão da regulação celular. Técnicas de imagiologia tais como a microscopia de fluorescência confocal e fazer a determinar a situação de uma molécula fluorescente etiquetado pequeno relativamente simples, no entanto a resolução de estruturas muito pequenas é limitada 1.
Por outro lado, a microscopia electrónica revelou detalhes da morfologia subcelular com resolução muito elevada, mas a sua natureza estática torna mais difícil de medir pró altamente dinâmicosos com precisão 2,3. Assim, a combinação de microscopia de luz por microscopia de electrões de uma mesma amostra, denominado microscópio óptico e electrões (CLEM) 4,5, proporciona as vantagens duplas de ultra imagem fluorescente com a alta resolução de microscopia electrónica de 6. Esta poderosa técnica foi implementada para estudar vários aspectos da biologia celular 5,7. Desde a sua criação, este procedimento tem aumentado a nossa capacidade de distinguir arquiteturas subcelulares e morfologias em alta resolução.
Aqui, apresentamos um método simplificado para a realização de microinjeção rápida seguida de CLEM (Fig. 1). O procedimento CLEM microinjecção pode ser utilizado para introduzir quantidades específicas de moléculas pequenas e / ou proteínas directamente para o citoplasma da célula eucariótica e estudar os efeitos de milímetro a nanometros de multi-resolução (Fig. 2). A técnica baseia-se na microinjectingcélulas cultivadas em lamínulas gravadas a laser de vidro grade aposta para o fundo de pratos de células vivas e de imagem com tanto microscopia confocal fluorescente e eletrônica. Localização da célula (s) de interesse é facilitado pelo padrão de grade, a qual é facilmente transferido, juntamente com as células de interesse, para a resina Epon utilizado para imobilização de amostras e de corte antes da análise por microscopia de electrões (fig. 3). Sobreposição de imagens de fluorescência e EM permite ao utilizador determinar a localização subcelular, assim como quaisquer alterações morfológicas e / ou induzidos por ultra-estrutural da molécula de interesse microinjectados (Fig. 4). Esta técnica é passível de pontos de tempo variando de ≤ 5 s até várias horas, dependendo da natureza da amostra microinjectados.
Protocolo
1. Cultura de Células de mamífero
- Rim de Rato Normal (NRK), imortalizada cancro cervical (HeLa), ou outras linhas celulares de mamífero adequadas são cultivadas a 37 ° C, 5% CO 2, em lamelas de vidro em grade photoetched afixados viver pratos de células (ver Tabela 1 para qualquer reagente ou aparelho utilizado neste protocolo) em DMEM + 10% FBS e 1% de Pen / Strep. Precauções devem ser tomadas para manter um ambiente estéril quando se trabalha com cultura de células de mamíferos.
- Dependendo da sua linha de tempo experimental (0-5 horas após a injecção vs 1-2 dias), a confluência das células deve ser ajustado para ~ 50% ou ~ 25%, respectivamente.
2. Microinjeção
- Preparar proteína desejada, o DNA, ou de moléculas pequenas na sua escolha de tampão, de acordo com a sua receptividade para cultura celular, para um volume final de 50 ul ~. Inertes corantes fluorescentes como o Texas vermelho ou azul Cascadeestão incluídos, a fim de marcar as células microinjectados; escolha do corante de injecção e sonda fluorescente deve ter excitação não sobrepostos e comprimentos de onda de emissão. A concentração da molécula de interesse o necessário para microinjecção devem ser determinados empiricamente, e os corantes de rastreamento fluorescentes são comumente utilizados em 0,5-1,0 mg / ml. Tipicamente, rodamina ou outro fluoróforo é ligado de forma covalente à sua molécula de interesse utilizando um kit comercial, no entanto, outros métodos de detecção podem ser utilizados dependendo da sensibilidade. Para mais informações, consulte Considerações críticas abaixo.
- Filtra-se a injectant (~ 50 ul) através de um filtro de 0,22 uM centrífuga. Filtros centrífugos são preferidos em relação a vácuo e / ou filtração de seringa, que tem associado volumes mortos.
- Para gerar a agulha microinjeção, pipetas de vidro de borosilicato são puxados usando um Flaming-Brown Micropipeta Puller seguintes orientações dos fabricantes. Alternativamente microinjecção,agulhas podem ser adquiridos de fornecedores como Eppendorf que torna as agulhas microinjeção femtotip.
- Cuidadosamente pipetar 4 ul de injectant no final unmolested da agulha microinjeção usando Eppendorf 20 Femtotips. Verifique se não há bolhas de ar no interior da agulha microinjeção puxado. Carregar agulha de microinjecção para o braço do micromanipulador Eppendorf FemptoJet InjectMan ligado a um microscópio invertido. Para uma boa revisão do procedimento de microinjeção, o leitor é direcionado para um Jornal anterior do artigo Experimentos visualizada 8.
- Coloque prato de células vivas com lamela grade e células cultivadas no suporte prato do microscópio Zeiss invertido. Encontrar células em crescimento dentro de uma grade photoetched e observe o identificador alfanumérico grades, este será utilizado em todas as etapas subsequentes. Idealmente, localizar as células no centro da lamela como passos subsequentes irá limitar a transferência da amostra para as extremidades da lamela.
- Braço injecção manualmente inferior no lugar sobre a lamela, e usando o joystick micromanipulador e controles, agulha de injecção inferior para baixo até que a ponta toque suavemente a superfície das células em cultura e do limite de press "para impedir o movimento da agulha para além deste ponto e, assim, quebrar a frágil puxou o vidro de borosilicato. Todos os outros aspectos da microinjecção celular são realizados como por Eppendorf manual FemtoJet InjectMan. A técnica de microinjecção foi recentemente utilizada para compreender individuais de proteínas segregadas a partir de bactérias de virulência 9.
- Microinject todas as outras células no interior da grelha escolhida. Com as células que cresceram em ~ 50% de confluência, pode-se esperar ~ 80 células por 600 | iM de grade 2 (exemplo mostrado na fig. 3A). Assim, após uma inspeção de microscopia de fluorescência e de electrões, haverá um n ~ experimental de 30-40 e células de controlo.
- Coloque vivo de células prato de volta para a cultura de células de mamífero para a incubadora desejadotempo como ditado pela configuração experimental. Alternativamente, pode-se prosseguir directamente a partir de micro-injecção de lapso de tempo para análise por microscopia de aguardar o aparecimento de estruturas subcelulares particulares de interesse antes da fixação.
3. Microscopia fluorescente
- Se se desejar, realizar-vivo de células de lapso de tempo medições de fluorescência de células microinjectados, após o que, substituir o meio com glutaraldeído a 2,5% em tampão cacodilato 0,1 M (pH 7,4) e incubar durante 10 min à temperatura ambiente. No entanto, se as medições em directo de células não são necessários, descartar meios de crescimento celular e de fixar as células com 5 ml de formaldeído a 3,7% em 1xPBS à temperatura ambiente durante 10 minutos. Descarte fixador e substituir com 5 ml 1xPBS, vá para o passo 3.2. Nota: Não é crítico para adicionar glutaraldeído até depois de microscopia de fluorescência é completa.
- Colocar a cápsula ao vivo das células com a lamela gridded photoetched num microscópio fluorescente (confocal não é necessário para this passo) e recolher campo brilhante e as imagens fluorescentes 5-10 da grade apropriada para documentar a disposição das células (Fig. 4A). Identificar as células que foram microinjectados utilizando os comprimentos de onda de excitação e emissão do corante inerte injecção (Fig. 4B). É importante para obtenção de imagens em diferentes ampliações (por exemplo, 10x e 65x), a fim de facilitar a identificação de células microinjectados em passos subsequentes envolvendo microscopia electrónica.
- Usando um microscópio confocal de fluorescência, recolher uma pilha de Z-microinjectados de células dentro da grade identificado no passo 2.5. Grande aumento (100x) é necessária de modo a correlacionar as imagens fluorescentes com as estruturas subcelulares que serão identificados em microscopia electrónica.
- As lamelas de cobertura são removidas do fundo dos pratos de células vivas com o fluido disponível comercialmente lamela remoção de células e colocou-se de lado numa placa de cultura de células virgem contendo 5 ml1xPBS. A lamela é então processado para microscopia electrónica, como detalhado abaixo.
4. Microscopia Eletrônica de Transmissão
- Substituir 1xPBS tampão com 2 ml de 2,5% de glutaraldeído em tampão de cacodilato 0,1 M (pH 7,4) e incuba-se à temperatura ambiente durante 10 minutos. De incubação mais longo, enquanto que não é necessário, ajudará a manutenção das estruturas subcelulares. Nota: formaldeído por si só não é suficiente para um fixador de análise por ME.
- Remover as células do fixador e da mancha, com a adição de 2 ml de tetróxido de ósmio a 1% em tampão cacodilato 0,1 M, durante 30 min seguido de três lavagens com tampão cacodilato e, finalmente, substituir todo o tampão com DDQ 2 O.
- Seguindo protocolos padrão EM, desidratar a amostra de uma série (70% a 100%) graduada de etanol. Prepare Epon resina e lamínula lugar célula lado para baixo em cima de um tubo de resina Epon-cheia. Permitir que a polimerização durante 24 horas a 60 ° C. Ao colocar a lamela photoetched grade de células-side fazerwn sobre a resina Epon, tanto as células de interesse, bem como o padrão de grade é transferida para a resina Epon durante a polimerização (exemplo mostrado na fig. 3B).
- Remover lamínulas de resina Epon por rapidamente imersão em nitrogênio líquido e / ou água fervente. Inspeccionar a superfície da resina no âmbito de um escopo de dissecação binocular para localizar a grelha de interesse (nota: o padrão de grade irá transferir como uma imagem de espelho). Usando uma lâmina de barbear esterilizada ou de bisturi, o corte de blocos Epon para baixo de tal forma que apenas a grelha de interesse está no vértice do bloco de resina Epon.
- Usando um ultramicrótomo, adquirir cortes seriados do bloco recortada na espessura desejada (~ 70 nm de espessura por TEM convencional e espessura ~ nm 250 para tomografia TEM). Contraste das secções com acetato de uranilo e citrato de chumbo seguindo protocolos padrão.
5. Luz correlativa e Microscopia Eletrônica
- Realocar as células de interesse emo microscópio eletrônico utilizando imagens obtidas em etapas anteriores. Uma vez que as células de interesse microinjectados foram localizados, use as high-resolution confocal imagens fluorescentes para identificar regiões no interior da célula que eram de interesse. Imagem estes em alta resolução usando TEM. Use monumentos como a periferia da célula e do envelope nuclear para determinar qual imagem z-stack fluorescente corresponde à EM cortar.
- Usando o programa de imagem de sua escolha (por exemplo, Image J, Adobe Photoshop, etc), reduzir a opacidade da imagem fluorescente de 50% e sobrepô-lo para a imagem TEM com o qual se correlaciona. Alinhar as imagens através do ajuste da escala (lembra a restringir as proporções) e a rotação da imagem confocal para coincidir com a imagem TEM. Os ajustes finos na nitidez, contraste, etc na imagem fluorescente pode ajudar no alinhamento. Nota: descobrimos que heterocromatina, o envelope nuclear, ea periferia das células representam uma marcos excelentes para ajudarna orientação das duas imagens.
6. Considerações críticas
- Para grande ajuda na localização da molécula de injecção pequeno, uma etiqueta fluorescente, tais como fluoresceína ou rodamina podem ser covalentemente ligados utilizando kits disponíveis comercialmente. A informação adicional é obtida por ectopicamente expressa uma proteína marcadora fluorescente localização subcelular antes da microinjecção. Por isso, a escolha de fluoróforos e de corantes de rastreamento inerte microinjecção é importante.
- Escolha de células que estão aderentes a microinjecção, perto do centro da lamela e evitar a escolha de uma grelha perto da borda. Isto vai apresentar a maior probabilidade de que as células de interesse são transferidos para a resina Epon utilizado para microscopia electrónica.
- Confluência de células is importante, tal como uma placa totalmente confluente vai fazer a identificação de células microinjectados no microscópio electrónico muito difícil. Em vez disso, as células semente de tal forma que eles atingem ~ 50% de confluência no dia da experiência de um curto, ou ~ 25% de confluência no dia de um tempo (1-2 dias) experimento. Utilizar a posição e forma das células, bem como o espaço vazio "como pontos de referência para orientar a imagem de microscopia electrónica.
- Espessura de corte óptica confocal deve ser sintonizado com as necessidades da experiência e deve, portanto, ser determinado empiricamente 10.
- O formaldeído e glutaraldeído fixadores devem ser da mais alta qualidade disponível. Formaldeído irá fixar as células, no entanto, preservar as propriedades de fluorescência de ambas as proteínas e pequenas moléculas fluorescentes (tais como FITC ou rodamina). No entanto, ele não irá preservar as estruturas para permitir a resolução EM elevada. Glutaraldeído preserva membranas e estruturas subcelulares a um elevado grau de EM anásis, mas irá prejudicar significativamente a fluorescência. Portanto, a fixação de duas etapas é crítico para a fluorescência e microscopia de EM. O passo de fixação do formaldeído pode ser omitido se apresentar ao vivo de células medidas, como a fixação final pode ser realizada por tratamento com glutaraldeído.
7. Resultados representativos
Este procedimento proporciona a capacidade de proporcionar uma molécula de interesse directamente para o citoplasma celular eucariótica e monitorizar a sua localização e / ou efeitos na arquitectura celular e organeller de milímetro a nanometros de multi-resolução. Uma ilustração esquemática da instalação experimental e procedimento é mostrado na Figura 2. Esta técnica baseia-se na micro-injecção de células crescidas em lâminas de vidro de laser gravado em grade (Fig. 3A), que depois de microscopia confocal, é capaz de transferir ambos as células de interesse, bem como o padrão de grelha para a resina Epon (Fig.3B).
Um procedimento típico CLEM microinjeção produz imagens de fluorescência e micrografia eletrônica, que, quando correlacionados, permitem que tanto a localização subcelular e análise ultra-estrutural. As células cultivadas sobre uma lamela de vidro photoetched reticulada são microinjectados com uma molécula de interesse, após o que as imagens de campo brilhante são obtidos (Fig. 4A). Um corante de rastreio inerte é incorporada para distinguir as células a partir de não-microinjectados microinjectados células (Fig. 4B). Confocal z pilhas são obtidos utilizando um fluoróforo ou outro identificador ligado à molécula de interesse microinjectados pequeno (Fig. 4C). A amostra é fixado em glutaraldeído e processados para microscopia eletrônica. Eletromicrografias são obtidos e colocado sobre as células para as quais eles correspondem (Fig. 4D). Áreas abrigam sinais fluorescentes são inspecionados em maior detalhe com maior ampliação (Fig. 4E ).

Figura 1. Cronograma de procedimento CLEM microinjeção. Dependendo da configuração experimental, microinjecção e as medições de fluorescência podem ser realizadas no mesmo dia. Preparação da amostra para microscopia eletrônica é mais devido tempo consumindo a passos longos de incubação e irá durar 2-3 dias. TEM análise e correlação de sinais de fluorescência, com imagens de microscopia electrónica pode ser feita em um dia.
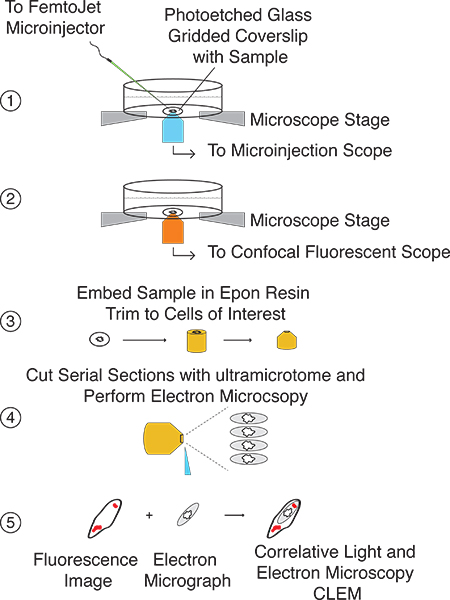
Figura 2 ilustração geral do método de microinjeção CLEM Passo 1:.. Localize células de crescimento em laser lamela de vidro jateado grade e microinject molécula de interesse Passo 2:.. Captura duas imagens de campo claro e confocal fluorescentes z pilhas de células microinjetados Passo 3: prepararlamela para EM análise e incorporar em resina Epon. Usando padrão de grade transferido, aparar bloquear tais que as células de interesse são o ápice Passo 4:. Corte cortes seriados com ultramicrótomo Passo 5:. Correlacionar imagens fluorescentes com EM imagens.
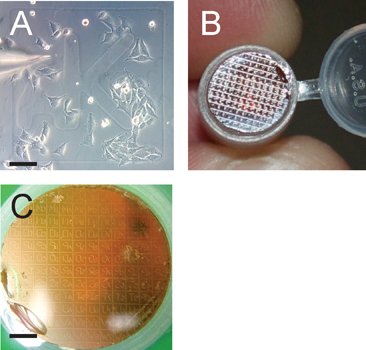
. Figura 3 padrão de grade facilita a identificação das células de interesse O painel A mostra a micro-injecção de células cultivadas para ~ 50% de confluência,. Observe a grade identificador aK. Barra de escala é 100 um. Painel B mostra o padrão de grade transferido da lamela para o bloco de resina polimerizada Epon que serão seccionados seriadamente após a grelha de interesse é identificado com um microscópio de dissecção. Painel C mostra o padrão de grade transferido, em preparação para o seccionamento . Note-se que o padrão de grade é transferido no sentido inverso sobre o bloco de resina; scalbar e é de 1200 m.

.. Figura 4 Os resultados representativos de luz microinjecção correlativa e microscopia electrónica O painel A mostra a micrografia de campo claro de células NRK em crescimento sobre uma lamela de vidro do laser gravado reticulada; setas indicam duas células que são visualizadas por CLEM em CD painéis O painel B mostra a fluorescência. de o corante de rastreio inerte, neste caso, Cascade Blue, usado para identificar as células que foram microinjectados. Painel C mostra a sobreposição do campo luminoso e a assinatura de fluorescência de uma molécula marcada com rodamina pequena. As duas células mostradas aqui são indicados por setas nos painéis A e B. O painel D representa CLEM de campo claro, microscopia de fluorescência e de electrões;. Cabeça da seta indica puncta fluorescente fotografada na maior ampliação em Painel E barras de escala são como folforma: Os painéis A e B, 100 um, c & D, 50 mm; E, a 100 nm.
Discussão
O método aqui apresentado permite a entrega directa de proteínas purificadas, ácidos nucleicos, ou moléculas pequenas para o citoplasma eucariótico e permite a análise de alta resolução ultra através da correlação de microscopia de fluorescência e de electrões. A utilização deste método é simples e robusto e pode ser realizado in-house com muitas instalações nucleares existentes e / ou laboratórios adequadamente equipados de microscopia electrónica. A técnica é também passível de live-célula, que permite ao utilizador controlar a dinâmica de moléculas marcadas por fluorescência em tempo real e, consequentemente, pode ser usado com lapso de tempo a microscopia e correlacionados com tomográfica microscopia electrónica.
Testes preliminares empíricos deve ser conduzida em todas as fases do experimento para determinar confluência ideal, eficiência microinjeção e entrega de quantidades apropriadas de otimização injectant, de fluoróforos e injeção / rastreamento corante (s), e disponibilidade e / ou experiência para elétron micranálise oscopy. Localizando a célula injectada em todos os passos do procedimento de CLEM é crítico para este protocolo e, por conseguinte, recomenda-se que as células que crescem em uma grade alfanumérico, perto do centro da lamela ser escolhidas para aumentar a probabilidade de que o espécime será documentada tanto em confocal e microscopia eletrônica. Para auxiliar na localização de células de interesse, as posições relativas das células vizinhas devem ser utilizados como pontos de referência para ajudar na localização apropriada da amostra durante a análise por ME. Finalmente, espessura de corte deve ser adaptado para a medida desejada. Uma secção em série de espessura ~ 70 nm é recomendado para TEM enquanto uma secção mais espessa (~ 250-300 nm) é recomendado para tomografia EM.
A técnica CLEM microinjecção é utilizado principalmente no nosso laboratório para simular a entrega de Tipo III bacterianas secretadas proteínas efectoras e analisar os seus efeitos sobre a ultra-estrutura subcelular da célula eucariótica. No entanto, a plasticidade e ease de uso de microinjeção seguido por CLEM oferece muitas outras vias de investigação.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Agradecemos a membros do laboratório Alto para discussões úteis. Agradecemos também a Facilidade Imagem Molecular e Celular da UT Southwestern Medical Center, especificamente o Dr. Chris Gilpin, Januszewski Tom, e Mueller Laurie para perícia técnica e aconselhamento. Agradecemos também o Dr. Xionan Dong para a leitura crítica do manuscrito. Este trabalho é apoiado pelo NIH concessão AI083359 a NMA
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de Catálogo | Comentários |
| Coverslip Photoetched e Live-célula Placa | MatTek | P35G-2-14-CGRD | |
| Texas Red | Invitrogen | D3329 | |
| Cascata Azul | Invitrogen | D7132 | |
| Rodamina Labeling Kit | Thermo Scientific | 53002 | |
| 0,22 unidade de filtração centrífuga uM | Millipore | UFC30GV00 | |
| Pipetas de vidro de borosilicato | Sutter Instruments | BF100-50-10 | |
| Micropipeta Puller | Sutter Instruments | Modelo P-97 | Utilize o programa # 4 após a realização de teste de rampa |
| FemtoJet Sistema Microinjeção | Eppendorf | InjectMan NI2 | |
| Lamela Fluid Remoção | MatTek | PDCF OS 30 | |
| Technai microscópio eletrônico de transmissão | FEI | Technai G2 BioTWIN | |
| Ultramicrotombe | Leica | EM UC6 |
Referências
- Schmolze, D. B., Standley, C., Fogarty, K. E., Fischer, A. H. Advances in microscopy techniques. Arch. Pathol. Lab Med. 135, 255-263 (2011).
- Giepmans, B. N. Bridging fluorescence microscopy and electron microscopy. Histochem. Cell Biol. 130, 211-217 (2008).
- Mayhew, T. M., Muhlfeld, C., Vanhecke, D., Ochs, M. A review of recent methods for efficiently quantifying immunogold and other nanoparticles using TEM sections through cells, tissues and organs. Ann. Anat. 191, 153-170 (2009).
- Razi, M., Tooze, S. A. Correlative light and electron microscopy. Methods Enzymol. 452, 261-275 (2009).
- Svitkina, T. M., Borisy, G. G. Correlative light and electron microscopy of the cytoskeleton of cultured cells. Methods Enzymol. 298, 570-592 (1998).
- van Weering, J. R. Intracellular membrane traffic at high resolution. Methods Cell Biol. 96, 619-648 (2010).
- Polishchuk, R. S. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. J. Cell Biol. 148, 45-58 (2000).
- Lim, J., Danuser, G. Live Cell Imaging of F-actin Dynamics via Fluorescent Speckle Microscopy (FSM). J. Vis. Exp. (30), e1325 (2009).
- Selyunin, A. S. The assembly of a GTPase-kinase signalling complex by a bacterial catalytic scaffold. Nature. 469, 107-111 (2011).
- Semwogerere, D., Weeks, E. R. . Confocal Microscopy in Encyclopedia of Biomaterials and Biomedical Engineering. , (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
Usamos cookies para melhorar sua experiência em nosso site.
Ao continuar usando nosso site ou clicando em 'continuar', você concorda em aceitar nossos cookies.
