Method Article
Корреляционный световой и электронной микроскопии (CLEM) как инструмент для визуализации микроинъекции молекул и их Эукариотические Sub-клеточных мишеней
В этой статье
Резюме
Техника CLEM была адаптирована для анализа ультраструктурным морфологии мембран, органеллы, и субклеточных структур, пострадавших от микроинъекции молекул. Этот метод сочетает в себе мощные методы микроманипуляция / микроинъекции, конфокальной флуоресцентной микроскопии и электронной микроскопии, чтобы миллиметра до нескольких нанометровым разрешением. Этот метод поддается широкий спектр приложений.
Аннотация
The eukaryotic cell relies on complex, highly regulated, and functionally distinct membrane bound compartments that preserve a biochemical polarity necessary for proper cellular function. Understanding how the enzymes, proteins, and cytoskeletal components govern and maintain this biochemical segregation is therefore of paramount importance. The use of fluorescently tagged molecules to localize to and/or perturb subcellular compartments has yielded a wealth of knowledge and advanced our understanding of cellular regulation. Imaging techniques such as fluorescent and confocal microscopy make ascertaining the position of a fluorescently tagged small molecule relatively straightforward, however the resolution of very small structures is limited 1.
On the other hand, electron microscopy has revealed details of subcellular morphology at very high resolution, but its static nature makes it difficult to measure highly dynamic processes with precision 2,3. Thus, the combination of light microscopy with electron microscopy of the same sample, termed Correlative Light and Electron Microscopy (CLEM) 4,5, affords the dual advantages of ultrafast fluorescent imaging with the high-resolution of electron microscopy 6. This powerful technique has been implemented to study many aspects of cell biology 5,7. Since its inception, this procedure has increased our ability to distinguish subcellular architectures and morphologies at high resolution.
Here, we present a streamlined method for performing rapid microinjection followed by CLEM (Fig. 1). The microinjection CLEM procedure can be used to introduce specific quantities of small molecules and/or proteins directly into the eukaryotic cell cytoplasm and study the effects from millimeter to multi-nanometer resolution (Fig. 2). The technique is based on microinjecting cells grown on laser etched glass gridded coverslips affixed to the bottom of live cell dishes and imaging with both confocal fluorescent and electron microscopy. Localization of the cell(s) of interest is facilitated by the grid pattern, which is easily transferred, along with the cells of interest, to the Epon resin used for immobilization of samples and sectioning prior to electron microscopy analysis (Fig. 3). Overlay of fluorescent and EM images allows the user to determine the subcellular localization as well as any morphological and/or ultrastructural changes induced by the microinjected molecule of interest (Fig. 4). This technique is amenable to time points ranging from ≤5 s up to several hours, depending on the nature of the microinjected sample.
протокол
1. Млекопитающие культуре клеток
- Нормальные почки крысы (NRK), увековеченный рака шейки матки (HeLa), или других соответствующих линий клеток млекопитающих культивируют при 37 ° C, 5% CO 2, на фототравленые стекла покровные сетке прикреплены к живой клетке блюд (см. Таблицу 1 для любых реагентов или аппарат, используемый в данном протоколе) в DMEM + 10% FBS и 1% Pen / Strep. Меры предосторожности должны быть приняты для поддержания стерильных условий при работе с культивируемых клетках млекопитающих.
- В зависимости от вашей экспериментальной линии времени (0-5 часов против 1-2 дней после инъекции) слияния клеток должен быть настроен на ~ 50% и ~ 25% соответственно.
2. Микроинъекция
- Подготовьте нужный белок, ДНК или малых молекул в выборе буфера, в зависимости от его податливость к клеточной культуры, в конечном объеме ~ 50 мкл. Инертные флуоресцентных красителей, таких как Texas красный или синий Cascadeвключены для того, чтобы отметить микроинъекции клетки, выбор красителя впрыска и флуоресцентный зонд должен иметь непересекающиеся возбуждения и испускания волн. Концентрация вашего интерес молекулы необходимы для микроинъекции должны быть определены эмпирически, и флуоресцентных красителей слежения обычно используется в 0.5-1.0 мг / мл. Как правило, родамина или другого флуорофора ковалентно связан с вашим интерес молекулы, используя коммерческий набор, однако другие методы обнаружения могут быть использованы в зависимости от чувствительности. Для получения дополнительной информации см. Критические соображения ниже.
- Фильтр впрыскиваемое вещество (~ 50 мкл) через 0,22 мкм центробежного фильтра. Центробежные фильтры предпочтительнее вакуум и / или шприцев фильтрации, которые связаны мертвых объемов.
- Для создания микроинъекции иглы, пипетки боросиликатного стекла тянут помощью Flaming-Brown микропипетки съемник следующими рекомендациями производителей. Кроме того, микроинъекциииглы можно приобрести у производителей, включая Eppendorf, что делает иглы femtotip микроинъекции.
- Осторожно пипеткой 4 мкл впрыскиваемое вещество беспрепятственно в конце микроинъекции иглы использованием Eppendorf 20 Femtotips. Убедитесь, что нет пузырьков присутствуют в микроинъекции вытащил иглу. Загрузите микроинъекции иглы в микроманипулятора руку Eppendorf FemptoJet InjectMan прикреплены к инвертированным микроскопом. Для хорошего обзора микроинъекции процедуры, читатель может обратиться к предыдущему журнал Визуализация статьи Эксперименты 8.
- Поместите блюдо живой клетки с сеткой покровное и культивируемых клеток в блюдо держатель инвертированный микроскоп Zeiss. Найти клеток, растущих в фототравленые сетки и обратите внимание на идентификатор сети буквенно-цифровой, это будет использоваться во всех последующих шагов. В идеале, найти клетки в центр покровного также последующие шаги будут ограничивать переноса образца по краям покровного стекла.
- Вручную нижней инъекций руки на месте по покровное, и с помощью джойстика микроманипулятора и управления, снижение инъекционной иглой вниз, пока кончик слегка касается поверхности культивируемых клеток и предельные прессы ", чтобы предотвратить движение иглы за этой точкой и тем самым нарушая хрупкий вытащил из боросиликатного стекла. Все другие аспекты клеточных микроинъекций осуществляется в соответствии с Eppendorf FemtoJet руководство пользователя InjectMan. Микроинъекции техника была недавно использована для понимания отдельных секретируемых белков вирулентности бактерий из 9.
- Microinject все другие клетки в пределах выбранной сетки. С клетки, выращенные на ~ 50% слияния, можно ожидать, ~ 80 клеток на 600 мкм 2 сетки (пример, показанный на рис. 3А). Таким образом, на флуоресценцию и электронную микроскопию инспекции, будет п ~ 30-40 экспериментальных и контрольных клеток.
- Поместите живых клеток блюдо обратно в клетки млекопитающих культуры инкубатор для желаемоговремя, как диктует экспериментальной установки. Кроме того, можно исходить непосредственно от микроинъекции для покадровой микроскопии анализа дождаться появления частности субклеточных структур интереса до фиксации.
3. Флуоресцентной микроскопии
- При необходимости, выполнить живых клеток замедленной флуоресценции измерений микроинъекции клетки, после чего, заменить средах с 2,5% глутарового альдегида в 0,1 М какодилатном буфером (рН 7,4) и инкубировать в течение 10 мин при комнатной температуре. Однако, если живых клеток измерений не требуется, отказаться от средств массовой информации клеточный рост и зафиксировать клетки с 5 мл 3,7% формальдегида в 1xPBS при комнатной температуре в течение 10 минут. Удалите фиксатор и заменить с 5 мл 1xPBS, переходите к шагу 3.2. Примечание: очень важно, чтобы не добавить глутаральдегида только после флуоресцентной микроскопии завершена.
- Поместите живых клеток блюдо с фототравленые сетке покровное в флуоресцентный микроскоп (конфокальной не требуется для Тхис шагом) и собрать 5-10 светлого поля и флуоресцентных изображений соответствующей сетке, чтобы задокументировать расположение клеток (рис. 4а). Определить те клетки, которые были микроинъекции помощью возбуждение и излучение длиной волны инертного красителя инъекции (рис. 4В). Это важно для получения изображения при различных увеличениях (например, 10x и 65x) для того, чтобы облегчить идентификацию микроинъекции клетки в последующих шагах с использованием электронного микроскопа.
- С помощью конфокальной флуоресцентной микроскопии, собирать Z-стек микроинъекции клетки в сетке, определенных в шаге 2.5 выше. Высокое увеличение (100x) необходима для того, чтобы соотнести флуоресцентные изображения с субклеточных структур, которые будут определены в электронной микроскопии.
- Покровные удаляются из нижней части живой клетки блюд с помощью коммерчески доступных удаления жидкости покровным и поместили клетки на стороне в девственных блюдо клеточной культуры, содержащей 5 мл1xPBS. Покровное затем обрабатываются для электронной микроскопии как описано ниже.
4. Просвечивающей электронной микроскопии
- Заменить 1xPBS буфера с 2 мл 2,5% глутарового альдегида в 0,1 М какодилатном буфером (рН 7,4) и инкубировать при комнатной температуре в течение 10 минут. Более инкубации, в то время как не надо, будет способствовать поддержанию субклеточных структур. Примечание: формальдегид само по себе не является достаточным фиксатор для EM анализа.
- Удалите фиксатор окраски и клетки с добавлением 2 мл 1% осмия в 0,1 М какодилатном буфере в течение 30 мин с последующим трех промывок с какодилатном буфера и, наконец, заменить все буфера с DDH 2 O.
- После стандартных протоколов EM, обезвоживают образца в градуированную (70% до 100%) Серия этанола. Подготовка Epon смолы и место покровное ячейки стороной вниз на вершине Epon смолы заполненной трубе. Разрешить полимеризации в течение 24 ч при температуре 60 ° C. Размещая фототравленые сетке покровное клетки на стороне делатьWn на смолу Epon, как клетки интерес, а также сетка передается в смоле Epon в процессе полимеризации (пример показан на рис. 3В).
- Удалить покровные из смолы Epon за счет быстрого погружения в жидкий азот и / или кипящей воде. Проверьте поверхность смолы под бинокулярным сферы рассечение, чтобы найти сетку интерес (примечание: сетка скороговоркой будет передавать как зеркальное отображение). С помощью стерильного лезвия бритвы или скальпелем, отделка блок Epon вниз, так что только сетку интерес на вершине блока смолы Epon.
- Использование ультрамикротомом, приобретают серийный разделы отделан блок в нужной толщины (~ 70 нм, толщина обычного ТЕА и ~ 250 нм, толщина томографического TEM). Контраст секции уранилацетатом и цитратом свинца в соответствии со стандартными протоколами.
5. Корреляционный световой и электронной микроскопии
- Переезд клетки интересэлектронный микроскоп с использованием изображений, полученных в предыдущих шагах. После микроинъекции клетки интересом были расположены, используйте высокое разрешение конфокальной флуоресцентной изображений для идентификации областей внутри клетки, которые представляют интерес. Изображение этих высокого разрешения с помощью ПЭМ. Используйте такие достопримечательности, как на периферии клетки и ядерной оболочки, чтобы определить, какие флуоресцентные Z-Stack изображения соответствует EM нарезать.
- Использование изображений программу по вашему выбору (например, изображения J, Adobe Photoshop и т.д.), уменьшите непрозрачность флуоресцентных изображений на 50% и наложить его на ПЭМ-изображение, с которым он соотносится. Совместите изображения путем регулировки шкалы (помните, чтобы сохранить пропорции) и вращение конфокальной изображения в соответствии с ПЭМ-изображение. Точная настройка контрастности, резкости и т.д. В флуоресцентное изображение может помочь в выравнивании. Примечание: мы обнаружили, что гетерохроматина, ядерная оболочка, и периферии клетки представляют собой отличный ориентиры, чтобы помочьв ориентации двух изображений.
6. Критические соображения
- Чтобы значительно помочь в поиске впрыском небольшие молекулы, флуоресцентной метки, такие как родамина и флуоресцеина может быть ковалентно связаны с использованием коммерчески доступных наборов. Дополнительная информация накопленный эктопически выражения флуоресцентных белков субклеточных маркер локализации до микроинъекции. Таким образом, выбор флуорофоров и инертного красителя отслеживания микроинъекции важно.
- Выберите ячейки для микроинъекции, что придерживаются близких к центру покровное и избежать выбора сетки близко к краю. Это будет представлять наибольшую вероятность, что клетки интерес передаются в смоле Epon использовать для электронной микроскопии.
- Слияния клеток яВажно, как полностью вырожденная пластины сделает идентификации микроинъекции клеток в электронном микроскопе очень трудно. Скорее всего, семена клетки так, что они достигают ~ 50% слияния в день короткий эксперимент, или ~ 25% слияния на день дольше (1-2 день) эксперимент. Используйте положение и форму клеток, а также "пустое пространство в качестве ориентиров для ориентации электронного микроскопа изображение.
- Конфокальной оптической толщины среза должна быть настроена на потребности эксперимента и поэтому должны быть определены эмпирически 10.
- Фиксаторов формальдегида и глутарового альдегида должна быть высшего сорта в наличии. Формальдегид будет исправить клетки, но сохранить флуоресцентные свойства обоих белков и малых флуоресцентных молекул (например, родамина или FITC). Тем не менее, он не будет сохранять структуры, чтобы позволить высоким разрешением EM. Глутаральдегид сохраняет мембран и внутриклеточных структур с высокой степенью для EM анализеSIS, но значительно затруднить флуоресценции. Таким образом, два шага фиксации имеет решающее значение для обеих флуоресценции и EM микроскопии. Шаг формальдегида фиксации можно опустить, если выполнение живых клеток измерений, а окончательной фиксации может быть выполнена глутаральдегида лечения.
7. Представитель Результаты
Эта процедура дает возможность доставить интерес молекулы непосредственно в цитоплазме клеток эукариот и следить за его локализации и / или эффекты на клеточном и organeller архитектуры от миллиметра до нескольких нанометровым разрешением. Схематическое изображение экспериментальной установки и процедура показана на рисунке 2. Этот метод основывается на микроинъекции клетки, выращенные на стеклянной лазером сетке покровное (рис. 3А), который после конфокальной микроскопии, способен передавать как клетки интерес, а также сетка на Epon смолы (рис.3В).
Типичная процедура CLEM микроинъекции дает флуоресцентных изображений и электронных микрофотографий, что, когда корреляции, позволяющие как внутриклеточной локализации и ультраструктурные анализа. Клетки, выращенные на фототравленые стекло сеткой покровное которые микроинъекции с молекулой интерес, после чего яркая, получают изображения области (рис. 4). Инертного красителя отслеживание включено отличить микроинъекции клетки от не-микроинъекции клетки (рис. 4В). Конфокальной Z-стеки, полученные с использованием флуорофором или другой идентификатор прикреплены к микроинъекции небольшой интерес молекулы (рис. 4в). Образец фиксируется и обрабатывается глутаральдегида для электронной микроскопии. Электронные микрофотографии получены и обложил на ячейки, к которым они соответствуют (рис. 4). Районы укрывательство флуоресцентные сигналы проверяются более подробно при большем увеличении (рис. 4E ).

Рисунок 1. Хронология процедуры микроинъекции Клем. В зависимости от экспериментальной установки, микроинъекции и флуоресцентных измерений могут быть выполнены в тот же день. Подготовка образцов для электронной микроскопии является наиболее трудоемким в связи с большими шагами инкубации и будет длиться 2-3 дней. TEM анализ и корреляцию сигналов флуоресценции с электронной микроскопии изображение может быть выполнена в один день.
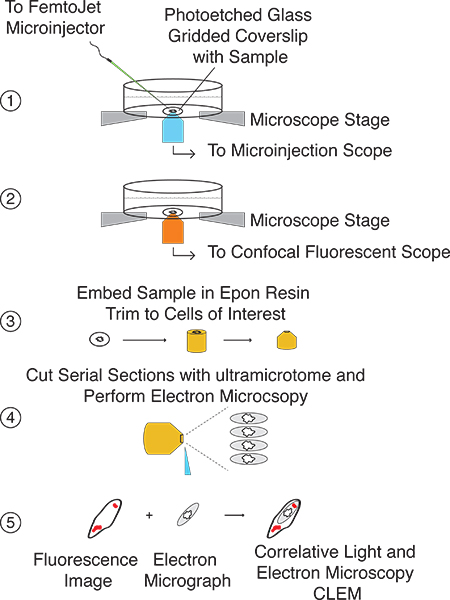
Рисунок 2 Общая картина процедура CLEM микроинъекции. Шаг 1:. Найдите клетки, растущие на лазерных травления стекла сетке покровное и microinject интерес молекулы. Шаг 2:. Захват и яркие образы поле и конфокальной флуоресцентной Z-стеки микроинъекции клетки Шаг 3: готовитьпокровное для EM анализа и вставлять в смоле Epon. Использование переданы сетки, отделка блокировать такие, что клетки интерес представляют на вершине Шаг 4:. Cut серийных срезов с ультрамикротомом Шаг 5. Корреляция флуоресцентные изображения с EM изображений.
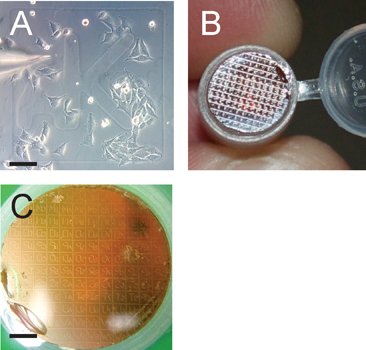
На рис. 3 сетки облегчает идентификацию клеток интереса панели изображен микроинъекции клетки, выращенные на ~ 50% слияния;. Отметим сетки идентификатор ак. Шкала бар 100 мкм. Группа B показывает, переданных сетка из покровного на смол блок полимеризованный Epon, которая будет серийно разрезе за сеткой интереса, определенных в рассечение микроскопом. Группа C показывает переданы сетки в рамках подготовки к секционирования . Обратите внимание, что передается сетки скороговоркой в обратном на смолу блока; масштабируемостьэлектронной панели составляет 1200 мкм.

. Рис. 4 представителя Результаты корреляционного микроинъекции света и электронной микроскопии панели показывает яркий микрофотография области NRK клеток, растущих на стекле лазером сетке покровное; стрелки указывают на две клетки, которые визуализируются с помощью CLEM в CD панелей Группа B показывает флуоресценцию. инертного красителя слежения, в этом случае Cascade Blue, используется для идентификации клеток, которые были микроинъекции. Группа C показывает наложение светлого поля и флуоресценции подпись родамин-меченого небольшие молекулы. Две клетки, показанные здесь показано стрелками на панели & B. Группа D представляет CLEM ярких поле, флуоресцентная и электронная микроскопия;. Стрелки указывает флуоресцентные puncta отображаемого при большем увеличении на панели E Шкала баров следуМинусы: Панели & B, 100 мкм, C и D, 50 мкм, E, 100 нм.
Обсуждение
Метод, представленный здесь, дает прямую поставку очищенных белков, нуклеиновых кислот, или небольших молекул в цитоплазме эукариотической и обеспечивает сверхвысокое разрешение анализу на основе соотношения люминесцентных и электронной микроскопии. Использование этого метода является простой, но надежной и может быть выполнена в дом с существующих объектов основных и / или соответствующим образом оборудованных лабораториях электронного микроскопа. Техника также поддаются живых клеток, что позволяет пользователю отслеживать динамику флуоресцентно отметил молекул в режиме реального времени и, следовательно, может быть использована с покадровой микроскопии и коррелирует с микроскопией томографических электрона.
Предварительные эмпирические исследования должны проводиться на всех этапах эксперимента для определения оптимального слияния, микроинъекции эффективности и поставки соответствующих объемов впрыскиваемое вещество, оптимизация флуорофоров и инъекции / слежение красителя (ы), а также наличие и / или опыта для электронных микрoscopy анализа. Доступ вводили клетки на всех этапах процедуры CLEM имеет решающее значение для данного протокола, и поэтому рекомендуется клеток, растущих в буквенно-цифровой сетки недалеко от центра покровное быть выбраны для увеличения вероятности того, что образцы будут представлены в обоих конфокальной и электронной микроскопии. Для помощи в поиске интересующих клеток, относительного положения окружающие клетки должны использоваться в качестве ориентиров для оказания помощи в поиске соответствующего образца в процессе EM анализа. Наконец, в разделе толщина должна быть адаптирована к желаемой измерений. Серийный раздел ~ 70 нм толщиной рекомендуется для TEM в то время как более толстая часть (~ 250-300 нм) рекомендуется для томографии EM.
Техники микроинъекции CLEM в основном используется в нашей лаборатории для моделирования поставки Тип III секретируемых бактериальных эффекторных белков и проанализировать их влияние на субклеточном ультраструктуры эукариотической клетки. Тем не менее, пластичность и EASе использованием микроинъекций следует CLEM дает много других направлений расследования.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарны сотрудникам лаборатории Alto за полезные обсуждения. Мы также благодарим Молекулярная и клеточная изображений объекта в UT Юго-западного медицинского центра, в частности, д-р Крис Гилпин, Том Янушевский, и Лори Мюллер на техническую экспертизу и консультации. Мы также благодарим доктора Xionan Dong за критическое прочтение рукописи. Эта работа выполнена при поддержке гранта NIH AI083359 в NMA
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Фототравленые Покровные и Live-клеточной пластинки | Маттек | P35G-2-14-CGRD | |
| Texas Red | Invitrogen | D3329 | |
| Каскад синий | Invitrogen | D7132 | |
| Родамина маркировки Kit | Thermo Scientific | 53002 | |
| 0,22 мкм центробежные блок фильтрации | Millipore | UFC30GV00 | |
| Боросиликатного стекла Пипетки | Sutter Instruments | BF100-50-10 | |
| Микропипетки съемник | Sutter Instruments | Модель P-97 | Используйте программу № 4 после выполнения теста рампы |
| FemtoJet Микроинъекция системы | Eppendorf | InjectMan Ni2 | |
| Покровные удаления жидкости | Маттек | PDCF OS 30 | |
| Technai просвечивающего электронного микроскопа | FEI | Technai G2 BioTWIN | |
| Ultramicrotombe | Leica | EM UC6 |
Ссылки
- Schmolze, D. B., Standley, C., Fogarty, K. E., Fischer, A. H. Advances in microscopy techniques. Arch. Pathol. Lab Med. 135, 255-263 (2011).
- Giepmans, B. N. Bridging fluorescence microscopy and electron microscopy. Histochem. Cell Biol. 130, 211-217 (2008).
- Mayhew, T. M., Muhlfeld, C., Vanhecke, D., Ochs, M. A review of recent methods for efficiently quantifying immunogold and other nanoparticles using TEM sections through cells, tissues and organs. Ann. Anat. 191, 153-170 (2009).
- Razi, M., Tooze, S. A. Correlative light and electron microscopy. Methods Enzymol. 452, 261-275 (2009).
- Svitkina, T. M., Borisy, G. G. Correlative light and electron microscopy of the cytoskeleton of cultured cells. Methods Enzymol. 298, 570-592 (1998).
- van Weering, J. R. Intracellular membrane traffic at high resolution. Methods Cell Biol. 96, 619-648 (2010).
- Polishchuk, R. S. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. J. Cell Biol. 148, 45-58 (2000).
- Lim, J., Danuser, G. Live Cell Imaging of F-actin Dynamics via Fluorescent Speckle Microscopy (FSM). J. Vis. Exp. (30), e1325 (2009).
- Selyunin, A. S. The assembly of a GTPase-kinase signalling complex by a bacterial catalytic scaffold. Nature. 469, 107-111 (2011).
- Semwogerere, D., Weeks, E. R. . Confocal Microscopy in Encyclopedia of Biomaterials and Biomedical Engineering. , (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены