Method Article
Germ Hücre Nakli ve Testis Dokusu Farelerde Xenografting
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Germ hücre nakli ve testis dokusu xenografting için Protokoller açıklanmıştır. Germ hücre nakli alıcı testiste donör kaynaklı spermatogenez ve spermatogonial kök hücreler (DGM) belirlenmesi için fonksiyonel bir sulandırma tahlil sonuçları temsil eder. Xenografting Testis dokusu alıcı farelerde testis gelişimini ve spermatogenezi çeşitli donör türleri üretir.
Özet
Germ hücre transplantasyonu 1994 1,2 Pennsylvania Üniversitesi'nden Dr., Ralph Brinster ve arkadaşları tarafından geliştirilmiştir. Bu çığır açan çalışmalar alıcının hayvan 2 donör kaynaklı spermatogenez ve sperm üretimi, infertil alıcı fareler sonuçları seminifer tübüller içine bereketli donör farelerin germ hücreleri bu mikroenjeksiyon gösterdi. Kullanımı alıcı hayvanların 1 yavrular, donör haplotypein donör kaynaklı spermatogenez ve iletim bakteriyel β-galaktosidaz gen izin kimlik taşıyan donör erkek. Şaşırtıcı, seminifer tübül lümenine naklinden sonra, nakledilen germ hücreleri, spermatogonium 3 yer vardır bazal membran luminal bölmesini taşımak için başardık. Genellikle sadece DGM'lerden alıcı testis ve spermatogenez yeniden kurmak niş kolonize olduğu kabul edilir. Bu nedenle, germ hücrelitransplantasyonu,, testisinde kök hücre niş okumak için ve olası spermatogonial kök hücre karakterize fonksiyonel bir yaklaşım sağlar. Bugüne kadar, germ hücre transplantasyonu, temel kök hücre biyolojisi aydınlatmak için önce germ hücrelerinin genetik manipülasyon yoluyla nakli 4,5 transgenik hayvanlar üretmek için, Sertoli cell-germ hücreli etkileşimi 6,7, SSC homing ve kolonizasyon 3 çalışmak için kullanılır. 8, yanı sıra gibi SSC kendi kendine-yenilenmesini değişiklik yapmış ve diferansiyasyon 9,10.
Germ hücre nakli 11 iri türlere de mümkündür. Bu, ana uygulamalar doğurganlığın korunması, hayvan popülasyonlarının elit genetik yayılması ve bu teknik ile, spermatogenez ve SSC biyoloji çalışma lojistik, kemirgenlerde göre daha zor ve pahalı olduğu gibi, transgenik hayvan üretimi vardır. Farelerde colonizat sonuçları seminifer tübüller içine iri türlere germ hücrelerinin naklidonör hücrelerinin iyon ve spermatogonial genişleme değil, muhtemelen, filogenetik olarak uzak türler 12 germ hücreleri ile alıcı somatik hücre bölmesi uyumsuzluk nedeniyle tam farklılaşma. Alternatif bir yaklaşım çevreleyen somatik bölmesi ile birlikte büyük türlerinin germ hücre naklidir. Biz ilk dorsal deri altında bağışık yetmezliği olan farelere nakledilen olgunlaşmamış erkek testis dokusu küçük parçaları 13 döllenme yetkili sperm üretimi ile tam gelişmesi ancak hayatta geçmesi mümkün olduğunu, 2002 yılında bildirilmiştir. O zamandan beri birçok türün başarılı olmak için xenografting testis dokusunda gösterilmiştir ve farelerin 14 büyük hayvanların testis gelişimi ve spermatogenez incelemek için değerli bir alternatif olarak ortaya çıkmıştır.
Protokol
BÖLÜM farelerde A. Germ hücre nakli
1. , Alıcının fareler of Hazırlanışı
- Alıcılar donör testis hücreleri (donörlerden ya da bağışıklık eksikliği ya da genetik olarak uyumlu) bağışıksal hoşgörülü olmalıdır.
- Alıcılar ya doğal olarak spermatogenez yoksun (örneğin W / W v fareler) veya endojen germ hücrelerinin tüketilmiş olması gerekir. Germ hücre tükenmesi,, ışınlama ya da bu tür Myleran Film Tablet'ın gibi kemoterapötik uyuşturucular kullanıcısı tarafından başarılabilir uygulanmaz edebilirsiniz. , Bu protokol In, biz,,, Myleran Film Tablet'ın ile birlikte alıcının fareler hazırlarken of yöntemini açıklamak.
- 4-6 hafta boyunca yaş ip busulfandan enjeksiyonu alıcılara davranın. Busulfandan optimal doz suşu bağlıdır. , Olarak, yaygın olarak olarak kullanılan alıcının suşlar In, 40-50 mg / kg 'dan' of, bir doz,,,,, endojen germ hücreleri (örn.: 44, nude fareler için mg / kg ', 50 mg /, B6/129 F1 alıcıların için kg'). Deplete etmek yeterli bir konumundadır
- DMSO Busulfan Tozun erimesi ve daha sonra steril distile su t eşit hacimde ekleyinyapmak Kullanıcısına, 4 mg / ml '' of, bir nihai bir bir konsantrasyon kaçınılır. 35-40 ° C daha önce yağış busulfandan önlemek için kullanabileceğiniz çözüm sıcak tutun. Yağış görülür çözüm atın.
- Olarak, Myleran Film Tablet'ın tedavi sonra,,, en azından at birini ayın alıcıların kullanmadan önce, izin vermek. Recipients,, 1 ayın, ve 3 ay önce yazılan mesaja-Myleran Film Tablet'ın tedavi. Tarihleri arasında kullanılan uygulanmaz edebilirsiniz.
2. Mikroenjeksiyon pipetler hazırlanması
- 1,0 mm dış çapı, 0,75 mm iç çap ve 3 inç uzunluğu ile borosilikat cam pipetler (kılcal tüpler) seçin.
- Cam pipetler Sigmacote Siliconize, metanol ile pipetler çalkalayın ve kuru bir darbe.
- Pipetler bir pipetle Fuari'ndaki kullanarak çekin. , Farklı pipettir çektirmenin makinelerde,, farklı ayarlarını, bu nedenle, bir birkaç ayarlarını,, sınamak, var. Genellikle olarak,,,,, enükleasyon operasyonu uygulandı pipetlerimiz yaptıktan için kullanılan olduğunu etmek 'e benzer, bir ayarı, çalışmak olabilir.
- ,,, Yaklaşık olarak 50 mikron of, bir çapı başarmak etmek kullanmak etmek, öncesinde,, dissekan mikroskop altında pipettir bir ip uçları Breakucunda.
3. Nakli için donör hücrelerinin hazırlanması
- Donör suşu Choise çalışılan deneysel soru üzerine bağlıdır. Spermatogenez ölçümü son nokta olarak kullanılması durumunda, Lac-Z gibi kolayca tanımlanabilen genetik işaretleyici ile donörlerin (örneğin B6.129S7 Gt (ROSA) Jackson Laboratory 26Sor / J) veya GFP (örneğin C57BL/6-Tg ( Jackson Laboratory CAG-EGFP in) 1Osb / J).
- 7 mg / ml '' at,, DMEM in, DNase of, mg / ml ', Şu (4), tripsin-EDTA ile of ml' (% 0.25 'lik, tripsin plus 1mM valdecoxib ile yapılan EDTA ile), ve 2 adet ml' 1 - at, (7), DMEM in collagenase of ml 'hazırlayın. Bu miktar 2 donör fare testis sindirerek içindir.
- Aseptik testis toplayın ve tunika albuginea kaldırmak. Yayılma seminifer enzimatik sindirimi kolaylaştırmak için ince forseps ile yavaşça tübüller.
- 5-10 dakika, ve sık sık ajitasyon için 37 ° C'de inkübe kollajenaz içine transfer tübüller.
- Temizlik tübüllerin, iplik eğirme (3 min için: 200-300 g) ve, #, PBS w / o Ca 2 bölgesindeki re-süspansiyona alma kullanıcısı tarafından iki kat daha yıkayın.. + + kadar.
- Tripsin-EDTA tübüller yeniden askıya alma ve yapışkan ve bulanık hale gelene kadar salla. Tübüllerin 1-2 dakika içinde meydana gelen 37 ° C gibi sindirim izleyin.
- DNaz ekleyin ve iyice çalkalanır. 1-2 dakika boyunca inkübe edin.
- ,,, Enzimler of eylem durdurmak etmek 3 ml 'of FBS ekle.
- Hücre / doku parçalarını kaldırmak için, 40-70 mikron gözenek büyüklüğüne sahip bir naylon mesh kullanarak Filtre hücre süspansiyonu.
- ,, 5 min Şu aramanız için 600 g için at hücreleri Collect. Ve bu konuda kurulacak güçlü,, DMEM (<100 ul'lik) of, bir küçük bir bir miktarını in re-askıya alma hücreleri.
- Hücreleri saymak ve istenen nihai konsantrasyonu (genellikle 100 x 10 6) ses seviyesini ayarlamak. Kullanmadan önce buz üzerinde hücre süspansiyonu tutun.
- Her, busulfan-tedavi edilen fare testisi hücre süspansiyonu sadece 10-15 ul dolacaktır. Potansiyel atık ve sızıntı nedeniyle, testis başına 30-50 ul hedefliyoruz.
4. Nakli işlem (Şekil 1)
- Onaylı protokolleri takip alıcıları uyuşturan.
- Dorsal içinde Yeripozisyonda ve cerrahi karın bölgesi hazırlamak. Karın duvarı açığa çıkarmak için bir ~ 1cm orta hat karın kesisi olun. Yanlışlıkla karın içi organların zarar vermekten kaçınmak ve periton boşluğuna maruz karın duvarı orta hattan ~ 0.5 cm kesi yapmaya devam beyaz çizgi noktada küçük forseps kullanarak karın duvarı kaldırın.
- Karın duvarı tutmak için bir iris forseps kullanın ve yağ pedleri, periton boşluğuna epididim ve testis bağlı aramak için iris forsepsinin başka bir çifti kullanmak. Testis yavaşça dışarıya alınır kadar yağ yastığı, testiküler arter ve epididim çekin ve net bir şekilde görülebiliyor. Bir anda bir testis üzerine çalışın.
- Daha iyi bir görsel kimlik (isteğe bağlı) yağ yastığı / testis altında otoklavlanmış indeks kartları ile yapılan ince bir steril örtüyü yerleştirin. Drape Ayrıca sıvı absorbe etmek için çalışır.
- ,,,, Hücre süspansiyon içine internetin Tripan Blue dye ile of, bir drop ekle ve dikkatli bir şekilde,, Polietilen içine hücre süspansiyon da yüklenemedi.lene hortumunu,, bir 1 ml 'şırınga etmek bağlandığında. Tüp içine çekti pipet pipet içine hücre süspansiyonu enjektöre basınç uygulayarak takın ve hafifçe zorlamak.
- Efferent kanalları (testisin epididim bağlayan) belirlenmesi ve yavaşça kanalları çevresinde yağ doku kaldırmak. Çevrelerindeki kanalları ve membran saydam dikkatli bir şekilde çalışın.
- Efferent kanalların paket içinde dikkatlice bir kanal içine pipet eklemek, yavaşça, testis doğru birkaç mm geçiriniz.
- , Enjeksiyon pipet hareket kaçınarak ulaşmak için şırınga, yavaşça doldurmaya başlar askıya rete testis ve seminifer tübül içine akar sağlamak için şırınga pistonu bastırın.
- Hücre süspansiyonu enjeksiyon hızı ve akış parmak basıncı ile düzenlenir. Basıncındaki ani artış kaçının; tübüllerinde süspansiyon hareketini izlemek.
- Testis bec başlamadan önce hemen hemen tüm yüzey tübüller doldurulmuş enjeksiyon Durduriskemik Ome.
- Testis karın boşluğuna getirin. Kontralateral testis üzerine işlemi tekrarlayın. 6-0 ipek sütür ile karın duvarı dikerek ve deri metal yara klipler ile kapatın. Tam iyileşme kadar bir ısınma pad üzerinde fareler izleyin.
5. Alıcı testislerin analizi
- Analizden önce transplantasyon sonrası 2-4 ay izin verin.
- Hayvan bakımı ve kullanım yönergelerine göre, alıcı fare Euthanize, PBS içine testis ve epididim toplamak. , It,, endojen bir beta-galactosidase aktivitesi sahiptir gibi,, bir Lac-Z arasından transgenic donör strain, kullanılan> edilmiştir> gelmiştir Ne zaman, epididimis,,, bir pozitif bir bir boyanma kontrolü gibi kullanılmalıdır edebilirsiniz.
- Lac-Z boyama ile donör hücrelerinin varlığı tespiti için 1-2 saat, 4 testis düzeltmek ° C PBS içinde% 4 paraformaldehit (PFA). ,, LacZ şehrindeki In-room sıcaklık at 3 x 30, min durulayın buffer durulama.
- ,, LacZ boyanma bir çözüm in, (37) ° C at bir gecede inkübe edin. Testis,,, bir, bütünün gibi ya da dispersleme sonra, boyand uygulanmaz edebilirsiniztübüller.
- Saptamak ve% 10 nötr tamponlu formalin depolamak. Bölümleri gerekiyorsa karşı leke olarak nötr hızlı kırmızı kullanın.
KISIM B. Ektopik farelerde xenografting
(Dobrinski ve rathi 15, 2008 da, ve Rodriguez-Sosa ve ark. Ark, Yorumdan ... 2011 16 kişi).
1. Donör doku toplanması
- Hadım testis dokusu elde etmek ya da bir bağış erkek biyopsi yapıldı.
- PBS veya biyopsi kültür ortamında steril şartlarda muhafaza Yer testis.
- Buz ve laboratuvar taşıma toplanan doku tutun.
2. , Donör doku of Hazırlanışı
- Sterilite korumak için doku kültürü kaputu gerçekleştirin.
- 2-3 kez PBS ile bir kültür kabına aktarmadan önce buz gibi soğuk PBS içeren antibiyotikler her testisteki yıkayın. Biyopsi durumda, buz kültürü medi testis parçaları ile 2-3 kez yıkamakum,, 2 min at 150 g for iplik eğirme ve,, taze - buz-soğuk algınlığı bir kültürü medium in resuspending kullanıcısı tarafından antibiyotikler ihtiva eden ve eğitimi.
- Sağlam testis için, yüzeyi boyunca bir kesi yaparak tunika vaginalis testis kaldırmak ve a'ya. Testis tüm ek yapılar (spermatik kordon, epididim, bağ dokusu) çıkar. PBS ile bir kültür kabına soğuk PBS ve transfer testisler bir kez yıkayın.
- Testisin tunika albuginea, bir neşter bıçak ve bir makas kullanarak dikkatlice çıkarın. Testis çok küçükse, tunika diğer ucunda küçük forseps bir çift ile tunika tutarken, bir ucunda yapılan küçük bir kesi yoluyla tunika testis dokusu sıkma kaldırılabilir.
- , Testisin büyüklüğüne bağlı olarak ya da tüm testis dokusu yaklaşık 1 küçük parçalar halinde kesilir. Kavisli bir forseps ve bir neşter bıçağı, ya da testis dokusu büyük parçalar kullanarak boyutu 2 mm 3 ilk testisten kaldırılır ve olabilir küçük içine kesinparçalar. All, bu,,, ice-soğuk algınlığı bir kültürü medium in ve,,, bir küçük bir bir kültürü çanağı (60 X15 mm), in steril bir koşullar altında yapılabilir uygulanmaz gerektiğini.
- Aşılama kadar buz üzerinde küçük kültür-yemekleri buz gibi kültür ortamına hazırlanan doku parçaları aktarın.
3. Kastrasyon ve alıcı fare
- Yukarıdaki gibi fare uyuşturan ve% 70 Etanol ve Betadine solüsyonu ile silinerek, saç (çıplak farelerin gerekli değildir) takarak, steril cerrahi saha hazırlamak.
- Karın duvarı açığa çıkarmak için 0.5 -1 cm ventral orta hat cilt insizyonu olun.
- Dikkatle, Parta, 4,2-4,3 açıklanan olarak testis, testis arter ve epididim maruz kalmaktadır.
- Künt diseksiyon ile, gubernakulum Epididimisin kuyruğu ayırın.
- Testiküler arter Ligate ve ipek ile kan damarları ile birlikte vas deferens ve testis ve ligatür arasındaki kesim tarafından bağlanan yapılar bölümü.
- Seco için aynı işlemi tekrarlayın.nd testis.
- Karın duvarı, bir ya da iki cerrahi dikiş ile dikin.
- Bir ya da iki Michel klipler ile cilt kesisi kapatın.
4. Xenografting Ektopik
- Fare ventral pozisyonda yerleştirin ve yukarıdaki gibi sırtında bir steril cerrahi alan hazırlamak.
- Ekleneceği (genellikle 4-8/mouse) kaç greft bağlı olarak, geri fare orta çizginin her iki tarafında ~ 0.5 cm uzunluğunda cilt insizyonu olun.
- Cilt kesisi bir sınır tutmak için forseps kullanın ve makas kullanırken bağ dokusu dışında alay subkutan boşluğu yapmak.
- Başka bir iris forseps ile cilt kesisi sınır tutarak, bir iris forseps yerde derin subkutan boşluğuna testis dokusu bir parça kullanma.
- Bir Michel klibi ile cilt kesisi kapatın ve anestezi kurtarmak başlayıncaya kadar ısıtma pedi fare tutmak.
- Ek izolasyon ve işbirliği ile bir kafes fare aktarınver ve monitör fareler kadar tamamen iyileşti.
5. , Testis analizi ve sperm toplama xenogreftler Koleksiyonu
- Hayvan bakımı ve kullanım yönergelerine göre ana fare Euthanize ve kuyruk ve boyun açık cilt için çalışan arka cilt üzerinde orta hat cilt kesi yapmak. Bu,, subkutan doku on, ya da olarak şuradadır ya da,, cilt etmek iliştirilmiş edilebilir greftler açýklar.
- Bir çift forseps ve bir makas kullanarak greft dikkatlice çıkarın.
- Greft kurtarıldı, bireysel greftlerin büyüklüğü ve ağırlığı da rekor sayıda.
- Farenin karın seminal veziküllerin Al ve aşılı doku testosteron üretiminin bir göstergesi olarak kendi ağırlığı kaydetmek.
- Histolojik analiz için
- Hacminde Bouin çözümü (ya da diğer fiksatif) içeren örnek şişesine xenogreftler askıya almasını xenograftlarının, 10x ~~ ve Flakon uygun etiket.
- Üretmek% 70 etanol içinde tercihen 24 saat aralıklarla en az 3 kez yıkama ardından buzdolabında bir gece.
- Işleme ve parafine gömülmesi için devam edin.
- Sperm toplama için
- 300g az 1 dakika için onları aşağı eğirme ve kültür ortamı içeren antibiyotikler onları resuspending xenogreftler yıkayın.
- Küçük parçalar halinde greftler 3 içeren bir doku kültürü çanak forseps ile dikkatlice kesin ve kıyma - 5 ml kültür ortamı.
- 40 mikron hücre süzgecinden Filtre kıyılmış doku.
BÖLÜM C. Temsilcisi Sonuçlar
1. Germ hücreli Transplantation
X-gal boyama gibi, alıcı testiste donör DGM'lerden kolonizasyon lacZ transgen gibi genetik bir marker taşıyan spermatogonial kök hücreleri nakledilen donör hücre süspansiyonu varsa sem ayırt edici mavi bölümleri ile görülebilmesiiniferous 2-3 ay sonra transplantasyon sonrası 3 (Şekil 2A) tübüller. , Eşleştirilmiş tek veya küçük gruplar mavi hücreleri bir ağ, iyi kurulmuş bir koloni biter hem de iki veya daha fazla, daha merkeze yakın mavi hücre katmanları ve lekeli bölgelerde göreceli olarak daha zayıf kesimlerinin tamamen dolu uzun bir koyu mavi streç olmalıdır. , 3 (Şekil 2B) görünürdeki konumundadır. Koyu mavi seminifer tübül bölgenin köklü bir kesit ortaya çıkarmak ve çeşitli farklılaşma aşamaları (Şekil 2C) mavi germ hücreleri ile iyi organize spermatogenez.
2. Xenografting testis dokusu
Transplantasyonu sonrası testis dokusu canlılığını donör gelişimsel aşaması ile ters orantılıdır; yetişkin doku 17-21 dejenere ve ölmek için yüksek bir eğilim gösterirken, en iyi sonucu, yeni doğan erkek doku kullanıldığı zaman elde edilir. Genellikle, xenograft başarısı azalır donör doku bana uğrar gibispermatogenez ilk dalga iosis. Olgunlaşmamış donör doku ve tam spermatogenez tam gelişmesini Zaman türe özgü olup, in situ testis ile karşılaştırıldığında genellikle biraz daha kısa. Seminifer tübüller tam spermatogenez sayısı türlere göre değişkendir. Koyun iken, keçi ve domuz sayısı sığır ve kedilerde% 50 daha büyük olduğunu,% 15 den az 14 (Şekil 3).
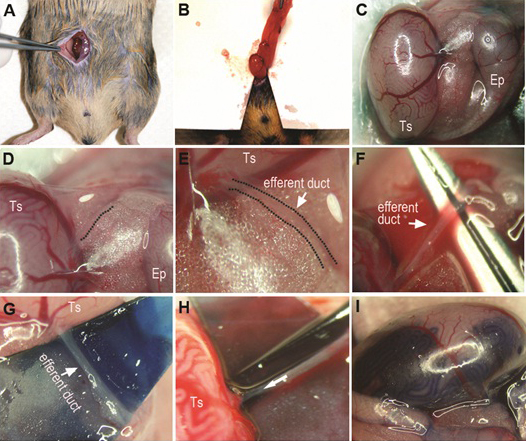
Şekil 1. Germ hücre nakli prosedürü Yer anestezi sonrası dorsal pozisyonda alıcılar ve bir ~ 0.4-inç orta hat karın kesisi (A) yapmak. Testis, epididim ve testis bağlı yağ yastığı çekildiğini ortaya çıkarmak ve daha iyi bir görsel kimlik (B) yağ yastığı / testis altında ince bir steril örtüyü yerleştirin. Testis ve epididim, yağ yastığı gömülü efferent kanalları (C, D, E) görülebilir böylece yerleştirin. Kimlikvarlık efferent kanalları ve yavaşça kanalları çevresinde yağ doku kaldırmak. Renkli kağıt veya plastik bir parça daha iyi görselleştirme (G) kanalları altına yerleştirilebilir. ,,,, Içine the pipettir (H) kanallarında ve load cell süspansiyon of boyutu etmek göre,,, pipettir bahşiş Break ya da öğütmek. Efferent kanalların paket içinde dikkatlice bir kanal içine pipet eklemek testis (H ok pipet enjeksiyon ve iş parçacığı yönünü gösterir) doğru, yavaşça birkaç mm geçiriniz. Seminifer tübüller içine başarılı bir enjeksiyon ile testis (I) gösterilir. Ts: Testis; Ep: epididimden.

Şekil 2. Germ hücre transplantasyonu A) X-gal ile boyanmış bir enjekte testis Temsilcisi sonuç bulundu. ,, Seminifer tubüllerin mavi segmentleri, transgenik donör DGM'lerden (lacZ transgeni) kurulan koloniler temsil eder. 3 ay transplantasyon sonrası bir SSC koloni B) Yüksek büyütme. The merkezi koyu mavi bölge ucunda tam spermatogenez ve soluk mavi bölgeleri temsil büyüyen uzantısı koloninin temsil eder. C), koyu mavi seminifer tübül histolojik bölüm (3 ay transplantasyon sonrası) iyi organize spermatogenez gösterir. B ve C Ölçek bar 200 mikron ve 30 mikron. (Şekil, Annu Rev Hücre Dev Biol adapte 2008;. 24:263-86 ve Biol REPROD 1999 Haz. 60 (6) :1429-36).
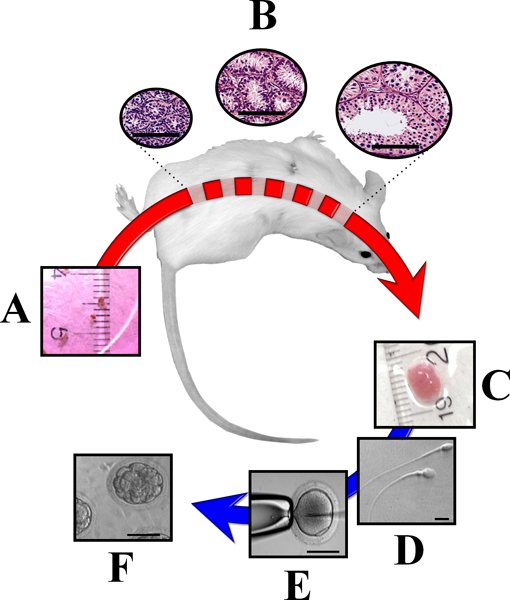
Şekil 3,. Ektopik bağışık yetmezliği olan farelere içine büyük hayvanlardan elde edilen olgunlaşmamış testis dokusu xenografting, bağışık yetmezliği olan farelere dorsal cilt altında (A) nakledilen olgunlaşmamış donör testis Fragments (~ 1 mm 3) hayatta ve fare Gonadotropinlerle cevap mümkün. Bir sonucu As, testis dokusundaki değişikliklerin,,,,,, fertilizasyon, yetkili sperm (Yatak-), of formasyonu de dahil olmak üzere, komple kalkınma undergoes. , Testis xenogreftler topladıktan sonra (C)onlar,,,, analizi için ya da,,,, ICSI (E) ve embriyo üretim (F) için sperm (-Ge) edinme etmek. kullanılan uygulanmaz edebilirsiniz. Barlar eşit 50 mikron (B, E ve F) veya 10 mikron (D). (Modifiye Rodriguez-Sosa ve Dobrinksi 14, 2009).
Tartışmalar
1. Germ hücreli Transplantation
Germ hücre transplantasyonu (DGM) bir hücre popülasyonu spermatogonial kök hücrelerin varlığı kesin onay için sadece fonksiyonel ölçüm sağlar. Sadece DGM'lerden ve ev bazal membran SSC niş kolonize ve donör kaynaklı spermatogenez başlatmak. Germ hücre transplantasyonu, DGM'lerden benzeri görülmemiş bir şekilde çalışmak ve işlemek için mümkün kıldı. Teknik, DGM'lerden 4, genetik manipülasyon yoluyla transgenik hayvanlar üretmek için kullanılan;, SSC kolonizasyon 3,8 desen, verimlilik ve kinetik aydınlatmak için;, SSC kendini yenileme ve farklılaşma 9,10 düzenleyen sinyalizasyon yolları incelemek için; karakterize etmek kendi kimlik 22,23 DGM'lerden yüzey belirteçleri;, DGM'lerden 6,7,24 için niş çevre okumak için. Ayrıca, karşılıklı nakli araştırmak için istihdam edilmiş olup infertilit bir fenotipy Sertoli hücreleri bir kusur ya da germ hücreleri 25,26 çıkmıştır.
Transplantasyonu etkin bir şekilde çalışması için, alıcı hayvanların seçimi ve tedavisi önemlidir. Alıcılar donörlerden ya da bağışıklık baskılı ya da genetik olarak uyumlu olmalıdır. , Ya da,, W / W v fareler in olduğu gibi, bir mutasyon etmek nedeniyle ya da,,,, ışınlama ya da bu tür Myleran Film Tablet'ın gibi kemoterapötik uyuşturucular kullanıcısı tarafından, germ hücre tükenmesi of, bir sonucudur gibi infertil render: Recipients aynı zamanda, endojen spermatogenez bulunan yoksundurlar gerektiğini. Ayrıca, donör hücre süspansiyonları transplantasyonu yeterlilik ve iyi bir hazırlık yanı sıra tekniğin başarısı için önemlidir.
Germ hücre transplantasyonu, kendi sınırlamaları vardır. Sonuçlar için herhangi bir hızlı okuma-yoktur. Alıcı testislerin analizi, aksi takdirde infertil alıcıların tam spermatogenez yeniden kazanılmasından, transplantasyonu 3 ay sonra iki ay olduğu gibi en az iki ay beklemek gerekiyor. Bu ihücre sayısı enjekte ve alıcı germ hücreli bastırma derecesi büyük farklılıklar nedeniyle kalitatif veya yarı kantitatif analiz. Germ hücre transplantasyonu kavramı, diğer hayvan türlerine adapte olmasına rağmen, prosedür kendisi teknik olarak farklı ve kemirgen olmayan türlerde 11 türleri arasında anatomik farklılıkların bir sonucu olarak biraz daha zorlu.
2. Xenografting testis dokusu
Testis dokusu, eserleri birçok memeli donör türler arasında xenografting ve nispeten basit bir tekniktir. Transplantasyon diğer türleri gibi, er sonra toplanması doku başarı daha büyük bir şans naklediliyor. Bu nedenle, toplama ve nakli için korunması ve doku taşıma önemlidir. Ancak, deneyimlerimiz testis dokusu soğuk tutuluyor dışında özel işlem gerektirmez. 36 saat 24 Testis dokusu, buzdolabı sıcaklığında muhafaza edilmelidir.ve sonra da fragmanları transplantasyonu için hazırlanabilir uygulanmaz edebilirsiniz. Ayrıca, aşılama sonucu 27 taze testis parçaları üzerinde gözle görülür bir etkisi olmadan, 4 ° C de bir gece önceden nakli standart kültür ortamı sağlanmalıdır. Testis dokusu, uzun süreli depolama istenirse de donduruldu. 13 keçi, domuz 13,27, ve 28 maymun yapılan çalışmalar testis dokusu dondurma ve çözdürme sonraki sperm, farelerde ektopik xenografting sonra geliştirmek ve üretmek için kapasitesini önemli ölçüde etkilemez göstermiştir. , Testis doku of Başarılı bir bir kriyoprezervasyon,,,,, DMSO, standart bir bir doku kültürü medium FBS içeren, in Kriyoprotektan gibi kullanarak,, bir alkol bath (13,27), in otomatikleştirilmiş-donma noktasının 28 ya da konvansiyonel bir yavaş bir sistemleri-donma noktasının kullanıcısı tarafından elde uygulanmaz edebilirsiniz. Kriyoprezerve testis dokusu nakli için, daha sonra standart yöntemlerle çözülmüş ve daha sonra 27 transplantasyonu öncesi kültür orta yıkanır. Bir kez tissue alıcı fare in vivo kuvöz ve hiçbir önemli müdahaleler gerekli olarak hizmet vermektedir nakil edilmiştir. Ancak, bazı durumlarda ekzojen gonadotropinler ile takviyesi gerekli olabilir; testis dokusu 6 aylık rhesus türü maymunlar 6-7 ay 29 tam spermatogenez ulaşmak için haftada iki kez 10 IU hCG ile subkutan alıcı farelere enjekte gereklidir.
, Yukarıda de belirttiğimiz gibi, yenidoğan erkeklerde from doku kullanılan edilir ne zaman,, olan en iyi sonucun,,, elde edilen edilir. Postmeiotic germ hücreleri mevcut olan erkekler doku dejenere bir eğilim gösterir. Ancak testis gelişimi tam rekapitülasyon, olgunlaşmamış hayvanlar ile mümkündür ve çok sayıda klinik ve araştırma uygulamaları vardır. Xenografting testis dokusu bir klinik ortamda, özellikle olgunlaşmamış sperm bir seçenek değildir hangi erkeklerde fertilitenin korunması için kullanılan edilebilir. Uzun süreli depolama için toplanan ve biyopsi şeklinde küçük parçalar dondurularak muhafaza edilebilir. Zaman desfragmanları ired çalışarak, Çözündürülen ve fareler 27,28 'içine greftlenmiş uygulanmaz edebilirsiniz. Başka bir alternatif xenogreftler hasat edilir sperm kriyoprezervasyon. Ek bileşenini dondurulmuş domuz testis xenogreftler gelen sperm ile mikroenjeksiyon, testis, epididim kıyasla daha düşük bir verimlilik düzeyinde olsa, morfolojik olarak normal embriyo nesil sonuçlandı, ya da sperm 27 ejaculated. Doku geliştirilen gelmiştir sonra,,, it, sperm hasat edilmesi için toplanan edilebilir ve sperm, in-vitro 13,16,30 in embriyoların üretmek. Etmek kullanılan uygulanmaz edebilirsiniz. Ancak, Bunun bir sınırlaması, epididimal olgunlaşma sonucu sperm geçmesi ve bu nedenle döllenme ICSI gerektiren yok olduğu bir gerçektir. Bu nedenle olarak,,, fertilizasyon için, xenograft-derived sperm of kullanılmak,,, ICSI kurulmuş edilmiştir gelmiştir türlerin etmek sınırlıdır edilir.
Araştırmada, xenografting testis dokusu iri türlere testis gelişimi ve spermatogenez bir kemirgen modelinde çalışmak için cazip bir alternatif. Örne ¤ For,, birtek donör testis birden fazla farelere transplante edilebilir. Alıcı fareler sonra xenograft toplanması için farklı zaman noktalarında kurban farklı tedaviler ve / veya maruz kalabilirler. Bu donör etkilerini ortadan kaldırır, hem de belirli bir deney ya da araştırma için gerekli büyük erkeklerin sayısını azaltır sadece. Bu büyük hayvanların çok sayıda erkek ilgilendiren çalışmalarda lojistik zor ve pahalı özellikle önemlidir ve özellikle primatlarda, etik sınırlamalar yapabilir. Ancak, testis dokusu xenografting uygulamaları nakli kolay kolay mümkün olmuyor ve spermatogenez belirli donör türlerin 14 verimlilik düşüktür önce, belirli bir hücre türleri manipülasyonu olarak sınırlıdır.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Yazarlar laboratuvar İş USDA-/ CSREES / NRICGP (2007-35203-18213) tarafından desteklenen; NIH / NCRR (2 R01 RR17359-06), NIH / NIEHS (1 R21 ES014856-01A2) ve Alberta yenilikler yaratır - Sağlık Çözümleri.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | |
| Kollajenaz (tip IV) | Sigma | C5138 | |
| Tripsin-EDTA | Invitrogen | 25200-056 | |
| DNaseI | Sigma | DN25 | |
| DMEM | Invitrogen | 31053-028 | |
| Tripan mavisi KORUYUCU | Invitrogen | 15250-061 | |
| Naylon örgü hücre süzgecinden | BD biyoloji | 352.340 (40μm) 352.350 (70μm) | |
| Busulfan | Sigma | B2635 | |
| İnce Wall Cam kılcal | Dünya Hassas Çalgı | TW 100-3 | |
| BD intramedic plyethylene boru (PE100) | BD | CA-63018-725 | |
| Ethicon 6-0 İpek Sütür | Ethicon | 706g | |
| Yara klipler | BD | 427631 | |
| Sigmacote | Sigma | SL2 | |
| X-gal | Sigma | B4252 | |
| Ferrocyanide Potasyum | Sigma | P9387 | |
| Potasyum ferrisiyanürle | Sigma | P3667 | |
| magnezyum klorür | Sigma | 208337 | |
| sodyum deoksikolat | Sigma | D6750 | |
| , N, N-Dimethylformamide | Sigma | D4551 | |
| Igepal CA-630 | Sigma | 18896 |
Referanslar
- Brinster, R. L., Avarbock, M. R. Germline transmission of donor haplotype following spermatogonial transplantation. Proceedings of the National Academy of Sciences of the United States of America. 91 (24), 11303-11303 (1994).
- Brinster, R. L., Zimmermann, J. W. Spermatogenesis following male germ-cell transplantation. Proceedings of the National Academy of Sciences of the United States of America. 91 (24), 11298-11298 (1994).
- Nagano, M., Avarbock, M. R., Brinster, R. L. Pattern and kinetics of mouse donor spermatogonial stem cell colonization in recipient testes. Biology of Reproduction. 60 (6), 1429-1429 (1999).
- Nagano, M., Brinster, C. J., Orwig, K. E. Transgenic mice produced by retroviral transduction of male germ-line stem cells. Proceedings of the National Academy of Sciences of the United States of America. 98 (23), 13090-13090 (2001).
- Ryu, B. Y., Orwig, K. E., Oatley, J. M. Efficient generation of transgenic rats through the male germline using lentiviral transduction and transplantation of spermatogonial stem cells. Journal of Andrology. 28 (2), 353-353 (2007).
- Hess, R. A., Cooke, P. S., Hofmann, M. C. Mechanistic insights into the regulation of the spermatogonial stem cell niche. Cell Cycle. 5 (11), 1164-1164 (2006).
- Oatley, M. J., Racicot, K. E., Oatley, J. M. Sertoli cells dictate spermatogonial stem cell niches in the mouse testis. Biology of Reproduction. 84 (4), 639-639 (2011).
- Nagano, M. C. Homing efficiency and proliferation kinetics of male germ line stem cells following transplantation in mice. Biology of Reproduction. 69 (2), 701-701 (2003).
- Kubota, H., Avarbock, M. R., Brinster, R. L. Growth factors essential for self-renewal and expansion of mouse spermatogonial stem cells. Proceedings of the National Academy of Sciences of the United States of America. 101 (47), 16489-16489 (2004).
- Oatley, J. M., Avarbock, M. R., Telaranta, A. I. Identifying genes important for spermatogonial stem cell self-renewal and survival. Proceedings of the National Academy of Sciences of the United States of America. 103 (25), 9524-9524 (2006).
- Dobrinski, I. Germ cell transplantation and testis tissue xenografting in domestic animals. Animal Reproduction Science. 89 (1-4), 137-137 (2005).
- Dobrinski, I., Avarbock, M. R., Brinster, R. L. Transplantation of germ cells from rabbits and dogs into mouse testes. Biology of Reproduction. 61 (5), 1331-1331 (1999).
- Honaramooz, A., Snedaker, A., Boiani, M. Sperm from neonatal mammalian testes grafted in mice. Nature. 418 (6899), 778-778 (2002).
- Rodriguez-Sosa, J. R., Dobrinski, I. Recent developments in testis tissue xenografting. Reproduction. 138 (2), 187-187 (2009).
- Dobrinski, I., Rathi, R. Ectopic grafting of mammalian testis tissue into mouse hosts. Methods in Molecular Biology. 139, Clifton, N.J. 450-450 (2008).
- Rodriguez-Sosa, J. R., Schlatt, S., Dobrinski, I. Testicular tissue transplantation for fertility preservation. Fertility Preservation: Emerging Technologies and Clinical Applications. Seli, E., Agarwal, A. , Springer. New York, NY. 331-331 (2011).
- Rathi, R., Honaramooz, A., Zeng, W. Germ cell fate and seminiferous tubule development in bovine testis xenografts. Reproduction. 130 (6), 923-923 (2005).
- Rathi, R., Honaramooz, A., Zeng, W. Germ cell development in equine testis tissue xenografted into mice. Reproduction. 131 (6), 1091-1091 (2006).
- Kim, Y., Selvaraj, V., Pukazhenthi, B. Effect of donor age on success of spermatogenesis in feline testis xenografts. Reproduction, Fertility, and Development. 19 (7), 869-869 (2007).
- Arregui, L., Rathi, R., Zeng, W. Xenografting of adult mammalian testis tissue. Animal Reproduction Science. 106 (1-2), 65-65 (2008).
- Schlatt, S., Honaramooz, A., Ehmcke, J. Limited survival of adult human testicular tissue as ectopic xenograft. Human Reproduction. 21 (2), 384-384 (2006).
- Shinohara, T., Avarbock, M. R., Brinster, R. L. beta1- and alpha6-integrin are surface markers on mouse spermatogonial stem cells. Proceedings of the National Academy of Sciences of the United States of America. 96 (10), 5504-5504 (1999).
- Kanatsu-Shinohara, M., Toyokuni, S., Shinohara, T. CD9 is a surface marker on mouse and rat male germline stem cells. Biology of Reproduction. 70 (1), 70-70 (2004).
- Ryu, B. Y., Orwig, K. E., Oatley, J. M. Effects of aging and niche microenvironment on spermatogonial stem cell self-renewal. Stem Cells. 24 (6), 1505-1505 (2006).
- Costoya, J. A., Hobbs, R. M., Barna, M. Essential role of Plzf in maintenance of spermatogonial stem cells. Nature Genetics. 36 (6), 653-653 (2004).
- Morrow, C. M., Hostetler, C. E., Griswold, M. D. ETV5 is required for continuous spermatogenesis in adult mice and may mediate blood testes barrier function and testicular immune privilege. Annals of the New York Academy of Sciences. 1120, 144-144 (2007).
- Zeng, W., Snedaker, A. K., Megee, S. Preservation and transplantation of porcine testis tissue. Reproduction, Fertility and Development. 21 (3), 489-489 (2009).
- Jahnukainen, K., Ehmcke, J., Hergenrother, S. D. Effect of cold storage and cryopreservation of immature non-human primate testicular tissue on spermatogonial stem cell potential in xenografts. Human Reproduction. 22 (4), 1060-1060 (2007).
- Rathi, R., Zeng, W., Megee, S. Maturation of testicular tissue from infant monkeys after xenografting into mice. Endocrinology. 149 (10), 5288-5288 (2008).
- Honaramooz, A., Li, M. W., Penedo, M. C. Accelerated maturation of primate testis by xenografting into mice. Biology of Reproduction. 70 (5), 1500-1500 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır