Method Article
マウスでXenografting胚細胞移植と精巣組織
要約
xenografting生殖細胞移植と精巣組織のためのプロトコルが記述されています。生殖細胞移植レシピエント精巣におけるドナー由来の精子形成の結果、精原幹細胞(SSCS)を同定するための機能の再構成アッセイを表しています。 xenografting精巣組織は、レシピエントマウスの様々なドナー種の精巣発達と精子形成を再現します。
要約
生殖細胞移植は、1994年1,2ペンシルベニア大学で博士ラルフBrinsterらによって開発されました。これらの画期的な研究では、レシピエント動物2でドナー由来の精子形成と精子の生産に不妊のレシピエントマウスの結果の精細管に肥沃なドナーマウスから生殖細胞のマイクロインジェクションを示した。レシピエント動物を1つ子孫にドナーハプロタイプのドナー由来の精子形成とトランスミッションの同定を可能に細菌性β-ガラクトシダーゼ遺伝子を有するドナーの男性の使用。驚くべきことに、精細管の内腔に移植後、移植した生殖細胞は精原細胞が3に位置している基底膜に内腔の区画から移動することができました。それは一般のみのSSCは、受信者の精巣におけるニッチと再確立する精子形成コロニーを形成することができることを受け入れられている。したがって、生殖細胞移植は、精巣の幹細胞ニッチを勉強すると推定される精原幹細胞を特徴づけるために機能的なアプローチを提供しています。現在までに、生殖細胞の移植は、基本的な幹細胞生物学を解明するために移植前4,5に生殖細胞の遺伝子操作を介してトランスジェニック動物を生成するために、セルトリ細胞の生殖細胞の相互作用6,7、SSCホーミングと植民地3を勉強するために使用されます8と同様に、SSCの自己複製と分化9,10。
生殖細胞の移植は大種11にも可能である。これらは、メインアプリケーションでは、妊孕性の保全、動物の個体数のエリート遺伝学の普及と、この手法で精子形成およびSSC生物学の研究では、ロジスティックげっ歯類ではより困難かつ高価であるとしてトランスジェニック動物の世代です。 colonizatのマウスの結果の精細管に大きな種から生殖細胞の移植ドナー細胞と精子の拡大ではなく、系統的に遠い種12からの生殖細胞とレシピエントの体細胞コンパートメントの非互換性によるものであろう彼らの完全に分化におけるイオン。代替的アプローチは、その周囲の体細胞コンパートメントと一緒に大規模な種から生殖細胞の移植である。まず、免疫不全マウスの背部皮膚の下に移植した未熟な雄の精巣組織の小さな断片が受精有能な精子13の生産に完全に開発を生き残るためには、受けることができていることを、2002年に報告した。それ以来xenografting精巣組織は、多くの種で成功するために示されており、マウス14の大型動物の精巣発達と精子形成を研究する貴重な代替手段として浮上した。
プロトコル
マウスではPART Aの生殖細胞移植
1。レシピエントマウスの準備
- 受信者はドナー精巣細胞に(いずれかの遺伝的にドナーにマッチした、または免疫不全)、免疫学的に寛容でなければなりません。
- 受信者のいずれか自然に精子を欠いている(例えば、W / W Vマウス)または内因性の生殖細胞が枯渇しなければなりません。生殖細胞の枯渇は、照射またはブスルファンなどの化学療法薬によって達成することができる。このプロトコルでは、ブスルファンとレシピエントマウスを調製する方法を説明します。
- ブスルファンのip注射を介して年齢の4〜6週間で受取人を扱う。ブスルファンの至適投与量は、ひずみに依存しています。一般的に使用される受信者の株で、40〜50 mg / kgの用量は、内因性の生殖細胞(例えば、ヌードマウスに44 mg / kgで、B6/129 F1の受信者に対して50 mg / kg)を枯渇させるのに十分である。
- DMSO中のブスルファン粉末を溶解し、滅菌蒸留水Tの等量を追加する4 mg / mlの最終濃度を行うO。ブスルファンの沈殿を避けるために使用する35から40℃で前にソリューションを暖かく保つ。沈殿が観察された場合には解決策を破棄します。
- ブスルファン処理後、受信者を使用する前に、少なくとも一ヶ月ができます。受信者は1ヶ月と3ヶ月後にブスルファン処理の間で使用することができます。
2。マイクロインジェクションピペットの作製
- 1.0ミリメートル、外径、0.75ミリメートル、内径、と3インチの長さとホウケイ酸ガラスピペット(キャピラリーチューブ)を選択します。
- Sigmacoteたガラスピペットをシリコーンで覆う、メタノール、ブロードライでピペットをすすぐ。
- ピペットプラーを使用して、ピペットを引き出します。別のピペットプラーマシンが異なる設定を持っているため、いくつかの設定をテストします。一般的に、摘出ピペットを作るために使用されるものと同様の設定が動作する可能性があります。
- 約50μmの直径を達成するために使用する前に解剖顕微鏡下でピペットチップを破る先端に。
3。移植用のドナー細胞の調製
- ドナー系統のチョイスは、研究実験の問題に依存しています。精子形成の定量化は、エンドポイントなど、ラック-Z(例えばB6.129S7-GT(ROSA)26Sor / Jジャクソン研究所から)またはGFP(例えばC57BL/6-Tg(同じように簡単に識別可能な遺伝子マーカーを持つドナーの使用として使用されている場合ジャクソン研究所からCAG-EGFP)1Osb / J)。
- mg / mlのトリプシン-EDTA(0.25%トリプシンを加えた1mMのEDTA)、および7 mg / mlのDMEMでDNaseの2mlの4ミリリットルは1から始まりDMEM中でコラゲナーゼ7mlの準備をします。この量は2ドナーマウスの精巣を消化するためのものです。
- 無菌的に精巣を収集し、白膜を除去します。スプレッド精は酵素消化を促進するために微細なピンセットでそっと細管。
- 5-10分、頻繁に攪拌、37℃でインキュベートするコラゲナーゼへの転送細管、。
- 紡績(3分間200〜300グラム)とPBS W / OのCa 2で再懸濁することによって倍管を洗浄します+ + アップ。
- トリプシン-EDTAで細管を再懸濁すると彼らは粘着性や曇りになるまで振る。それは1から2分以内に発生したとして、37℃で管の消化を監視します。
- DNaseを加え、よく振る。 1〜2分間インキュベートします。
- 酵素の作用を停止するには、FBSの3ミリリットルを追加します。
- 細胞/組織の塊を除去するために40から70μmの孔径ナイロンメッシュを使用してフィルタ細胞懸濁液。
- DMEMの少量(<100μL)で5分間再懸濁細胞に600グラムの細胞を収集します。
- 細胞をカウントし、所望の最終濃度(通常は100×10 6)にボリュームを調整します。使用前に氷上で細胞懸濁液を保持します。
- 各ブスルファン処理マウスの精巣には細胞懸濁液の10〜15μlで入力されます。潜在的な廃棄物漏洩による、精巣あたり30から50μlを持っていることを目指しています。
4。移植の手順(図1)
- 承認されたプロトコルは以下の受信者をAnaesthetize。
- 背の場所横臥と外科的に腹部を準備します。腹壁を露出させる〜1センチメートル正中腹部切開を行います。誤って腹部臓器を傷つけ回避し、腹腔を公開するために腹壁の正中線で、〜0.5 cmの切開を行うに進むために白いラインの時点で小さな鉗子を使用して腹壁を持ち上げます。
- 腹壁を保持するために1つアイリス鉗子を使用して、腹腔内精巣上体および精巣に接続された脂肪パッドを検索するためにアイリス鉗子の別のペアを使用しています。そっと睾丸が体外にされるまで、脂肪パッドを引き出し、精巣動脈と精巣上体がはっきりとわかります。一度精巣に取り組んでいます。
- 優れた視覚的識別(オプション)脂肪パッド/精巣の下にオートクレーブ処理したインデックスカードから作られた薄い滅菌ドレープを配置します。ドレープはまた、流体を吸収するために動作します。
- 細胞懸濁液にトリパンブルー染料のドロップを追加して、慎重にpolyethyに細胞懸濁液を読み込むレネ·チューブは、1mlのシリンジに接続されています。チューブに引き込まピペットを取り付け、ゆっくりとシリンジに圧力を適用することにより、ピペットに細胞懸濁液を強制します。
- 遠心管を(精巣上体に精巣を接続している)を識別し、ゆっくりと胆管周囲脂肪組織を除去する。周りのダクトと膜が透明であるため慎重に作業。
- 慎重に遠心管のバンドルにダクトにピペットを挿入し、ゆっくりと精巣に向かって数mmを通します。
- インジェクションピペットを移動回避しながら、注射器を手に取り、優しく埋めるために始め懸濁液は精巣網と精細管に流れ込むことを保証するために注射器のピストンを押し下げる。
- 細胞懸濁液の注入速度とフローは、親指の圧力によって規制されています。圧力の急激な増加を避けるために、尿中の懸濁液の動きを監視します。
- 精巣は、BECを開始するまでに、ほとんどすべての表面細管が満たされている注入を停止します。虚血性青梅。
- 腹腔内に精巣を返します。対側精巣に手順を繰り返します。 6から0絹縫合糸で腹壁を縫合し、金属の傷クリップで皮膚を閉じます。完全に回復するまで、地球温暖化パッドのマウスを監視することができます。
5。レシピエントの精巣の解析
- 分析の前に2〜4ヶ月移植後のことができます。
- 動物のケアと使用のガイドラインに従って、レシピエントマウスを安楽死させるとPBSに精巣および精巣上体を収集します。それは内因性β-ガラクトシダーゼ活性を有するラック-Zトランスジェニックドナー系統が使用されている場合は、精巣上体は、陽性コントロールとして使用することができます。
- ラック-Z染色によるドナー細胞の検出のために、4℃で1〜2時間のために精巣を固定℃のPBS中4%パラホルムアルデヒド(PFA)で。 lacZを室温で3×30分間すすぎは、バッファをすすいでください。
- lacZの染色液に37℃で一晩インキュベートします。精巣は、全体として、または分散した後に染色することができます細管。
- 修正し、中性緩衝ホルマリン10%で保管してください。セクションが必要な場合は、カウンター染色としてニュートラル速い赤を使用しています。
マウスでxenografting PART B.異所性
(DobrinskiとRathi 2008 15、ロドリゲス·ソーサらから、2011 16)。
1。ドナー組織のコレクション
- 去勢による精巣組織を取得したり、ドナーの男性からの生検。
- 無菌状態を維持し、培地中にPBSまたは生検で精巣を配置します。
- 氷と実験室への輸送に採取した組織を保持します。
2。ドナー組織の準備
- 無菌性を維持するために組織培養フード内で実行します。
- 2〜3回PBSで培養皿に転送する前に、氷冷PBSを含む抗生物質の各精巣を洗ってください。生検の場合には、氷冷文化メディで精巣の断片を2〜3回洗浄ええと、2分間150グラムで回転し、新鮮な氷冷培地中で再懸濁することにより抗生物質を含有する。
- 無傷の精巣では、表面に沿って切開することにより、鞘膜を除去し、精巣を押し出す。精巣すべての別館構造(精索、副睾丸、結合組織)から削除します。 PBSで培養皿に冷PBSおよび転送に一度精巣を洗ってください。
- 慎重に手術用メスの刃とハサミを用いて精巣白膜を除去します。精巣が非常に小さい場合、精巣は、もう一方の端に小さな鉗子のペアと中膜を保持しながら、一方の端に作られた小さな切開を通して精巣の精巣組織をつまんで削除することができます。
- その後、2ミリメートルの3サイズで曲がったピンセットと手術用メスの刃、あるいは精巣組織の大部分を使用して最初の精巣から削除することができ、 -精巣の大きさに応じて、全体の精巣組織は、1程度の小片に切断することができます小型にカットピース。このすべてが氷冷培地中で、小さな培養皿(60×15 mm)の中の無菌条件下で行われる必要があります。
- 移植まで氷上で小さな文化皿の氷冷培養液に調製した組織フラグメントを転送します。
3。レシピエントマウスの去勢
- 上記のようにマウスをAnaesthetize、70%エタノールとBetadine溶液を用いて拭き、髪を(ないヌードマウスに必要な)クリッピングによる無菌手術野を準備します。
- 腹壁を露出する0.5 -1センチメートル腹側正中皮膚切開を行います。
- 慎重にPartA、4.2から4.3で説明したように精巣、精巣動脈と精巣上体を公開します。
- 鈍的切開によって導帯からepidydimisの尾を切断します。
- 精巣動脈を結紮し、VASは、精巣と字の間で切断することによって絹、セクション連結した構造を持つ血管と一緒に精。
- セコの手順を繰り返します。ND精巣。
- 1つまたは2つの手術の縫い目と腹壁を縫合。
- 1つまたは2つのミッシェル·クリップで皮膚切開を閉じます。
4。 xenografting異所性
- 腹横臥でマウスを置き、上記のように、その裏に無菌手術野を準備します。
- (一般的に4-8/mouse)を挿入する方法を多くの移植に応じて、マウスの背中の中間線の両側に約0.5センチの皮膚切開を行います。
- 皮膚切開の境界を保持するために鉗子を使用して、はさみを使用して結合組織を離れてからかうことで皮下の空洞を作る。
- 別の虹彩ピンセットで皮膚切開の境界を保持している、アイリス鉗子場所に皮下空洞の奥深く精巣組織の一部を使用します。
- 1ミシェル·クリップで皮膚切開を閉じて、それが麻酔からの回復を開始するまで加熱パッド上でマウスを保持します。
- 付加絶縁と共同でケージにマウスを転送バージョン、モニタ、マウスになるまで完全に回復されています。
5。分析および精子の収穫のための精巣移植のコレクション
- 動物のケアと使用のガイドラインに従って、ホストマウスを安楽死させると、末尾から首とオープン肌に実行している背部皮膚に正中皮膚切開を行います。これは、皮下組織のいずれかで配置したり、皮膚に付着することができます移植を公開します。
- 慎重にペアの鉗子とハサミを使って移植を削除します。
- 回復した移植片のレコード番号は、個々の移植片のサイズと重量。
- マウスの腹部から精嚢を取得し、グラフトされた組織によるテストステロン産生の指標として自分の体重を記録します。
- 組織学的分析のために
- 適切にブアン体積の溶液(または他の固定)〜10倍の異種移植片のそれとラベルバイアルを含むサンプルバイアルに移植を中断します。
- インキュベート好ましくは24時間の間隔で、70%エタノールで少なくとも3回洗浄し、続いて冷蔵庫で一晩。
- 処理し、パラフィン包埋のために進んでください。
- 精子の収穫のために
- 1分間300グラムでそれらをスピンダウンし、抗生物質を含む培地でそれらを再懸濁することにより異種移植片を洗浄します。
- 小片移植をカットし、3を含む組織培養皿の中でピンセットで慎重にミンチ - 培養液5 mlの。
- フィルタは、40μmのセルストレイナーを通して組織をみじん切り。
PART C.代表結果
1。生殖細胞移植
移植ドナー細胞懸濁液などLacZの遺伝子などの遺伝マーカーを運ぶ精子幹細胞が含まれている場合は、受信者の精巣におけるドナーSSCの植民地化は、SEMの特徴的な青色のセグメントとして、X-gal染色で可視化することができます。iniferousは2-3ヶ月後の移植3(図2A)の後細管。十分に確立されたコロニーは、両方に近い中心地に青のセルの2以上の層で完全に満たされたセグメントの長いダークブルーストレッチ、比較的弱い染色された領域を持っているべき場所青い細胞の単一、ペアや小グループのネットワークが終了3(図2B)は明らかである。ダークブルーの精細管領域の断面は、様々な分化段階(図2C)で青の生殖細胞とよく確立され、よく組織化精子形成を明らかにする必要があります。
2。 xenografting精巣組織
移植後の精巣組織の生存率は反比例して、ドナーの発達段階と相関している。新生児男性から組織を使用する場合は最善の結果が得られ、成人の組織は17から21を縮退し、死ぬに高い傾向を示している。ドナーの組織は私を受けるとして一般的に、異種移植の成功は減少精子形成の最初の波のiosis。未熟なドナー組織と完全な精子形成の完全な開発への時間は、種特異的であり、その場で精巣と比較して、しばしばやや短くなります。完全な精子を持つ精細管の数は、種に応じて可変である。ヒツジ、ヤギ、その数は50%以上であること、豚の間、牛や猫では15%未満で14(図3)。
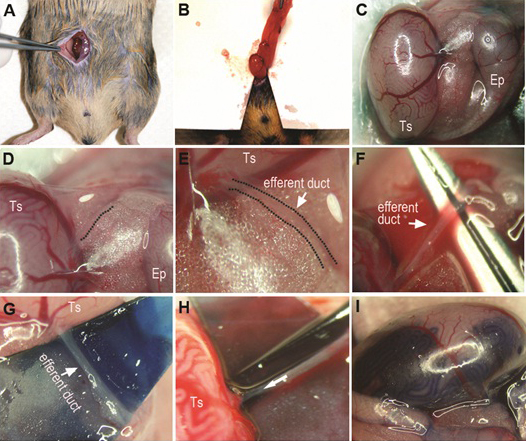
図1。生殖細胞移植の手順を実行します。配置麻酔後の背側横臥の受信者と約0.4インチの正中腹部切開()を行う。精巣上体および精巣に接続された脂肪パッドを引き出すことによって精巣を公開し、優れた視覚的に識別(B)の脂肪パッド/精巣の下に薄い滅菌ドレープを配置します。脂肪体に埋もれて遠心管は(C、D、E)識別可能になるように、精巣および精巣上体の位置を調整します。イドエンティティ遠心管をゆっくりと胆管周囲脂肪組織を除去する。色付きの紙やプラスチックの部分は、より良い視覚化(G)のためのダクトの下に配置することができます。ピペット(H)にダクトおよび負荷細胞懸濁液のサイズに応じてピペットチップを破壊または粉砕。慎重に遠心管のバンドルにダクトにピペットを挿入し、ゆっくりと精巣(Hの矢印は、ピペット注入およびスレッドの方向を示しています)に向かって数mmを通します。精細管に成功した注入と精巣(I)が表示されます。 TS:精巣、EP:精巣上体。

図2。生殖細胞移植の代表的な結果 )をX-galで染色した注入精巣。精細管の青色のセグメントは、トランスジェニックドナーのSSC(LacZの遺伝子)から確立されたコロニーを表しています。 3ヶ月後の移植ではSSCのコロニーB)高倍率。番目のセンター内の電子暗い青色領域は、完全な精子形成を表しており、両端の淡いブルーの領域は、コロニーの成長の拡張子を表しています。 C)ダークブルー精細管の組織切片(3ヶ月後の移植)は、よく組織され精子を示しています。 BとCのスケールバーはそれぞれ、200μmと30μmである。 (アンヌ牧師細胞Dev Biolから改作図2008;。24:263-86とBiol Reprod 1999年6月、60(6):1429-36)。
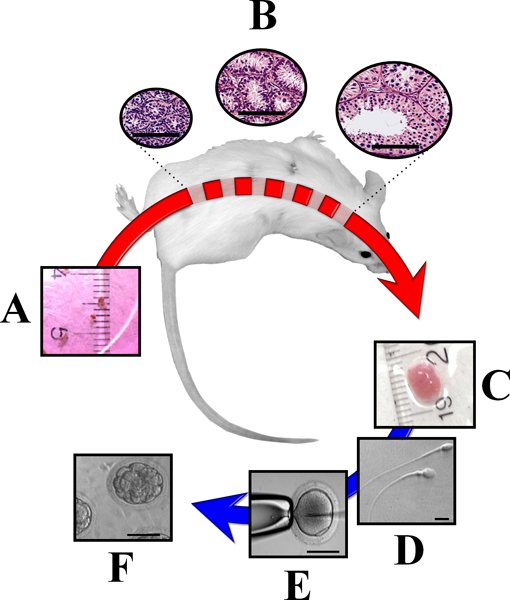
図3。免疫不全マウスの背部皮膚の下に移植した未熟なドナー精巣の異所性免疫不全マウスに大型動物から未熟な精巣組織のxenografting。フラグメント(〜1ミリメートル3)(a)生き残るためには、マウスの性腺刺激ホルモンに応答することができます。その結果、精巣組織は有能な精子受精(B)の形成を含む、完全な開発を受ける。精巣移植片が収集されたら、(C)彼らは分析に使用することができますまたはICSIのために精子(D)(E)と胚の生産を(F)を取得する。バーに等しい50μmの(B、EおよびF)または10μmの(D)。 (ロドリゲス·ソーサとDobrinksi 2009 14から変更)。
ディスカッション
1。生殖細胞移植
生殖細胞移植は、細胞集団中の精子幹細胞の存在(SSCS)の明確な確認のための唯一の機能的アッセイを提供しています。唯一のSSCはに家庭や基底膜でのSSCのニッチを植民地化とドナー由来の精子形成を開始することができます。生殖細胞移植は、前例のない形でSSCを勉強して操作することが可能になりました。技術は、SSCの4の遺伝子操作を介してトランスジェニック動物を生成するために使用されています。SSC植民3,8のパターンは、効率と動力学を解明するために、SSCの自己複製と分化9,10を調節するシグナル伝達経路を研究するために、特徴づけるためにその識別22,23のためにSSCの表面マーカー、SSCの6,7,24のためのニッチ環境を研究する。さらに、相互移植がinfertilitの表現かどうかを調べるために採用されているyは、セルトリ細胞や生殖細胞25,26の欠陥に由来する。
効率的に動作するように移植のために、レシピエント動物の選択と治療が重要です。受信者はどちらか遺伝的にドナーまたは免疫抑制を考慮する必要があります。 W / W vマウスのように突然変異に起因するか、または照射またはブスルファンなどの化学療法薬による生殖細胞の枯渇の結果として不妊レンダリング:受信者はまた、内因性の精子形成を欠いている必要があります。また、ドナー細胞懸濁液と移植手順の習熟の良い準備だけでなく技術の成功のために重要である。
生殖細胞移植は、独自の制限があります。結果を得るために、高速の読み出しはありません。レシピエントの精巣の分析は、そうでなければ不妊の受信者の完全な精子形成の回復は2月移植3の後に起こるように少なくとも2ヶ月待つ必要があります。それは私細胞数の注入および受信者の生殖細胞の抑制の度合いに大きなばらつきに起因SA定性的または半定量的分析。生殖細胞移植の概念が他の動物種に適応されていますが、手順自体は技術的に異なる種11を越え解剖の違いの結果として、非げっ歯類でやや困難である。
2。 xenografting精巣組織
精巣組織は、多くの哺乳類のドナー種間で作品をxenograftingと比較的単純な手法です。移植の他のタイプのように、より早く収集した後に組織が成功の大きなチャンスを移植されています。したがって、コレクションから移植までの保存と組織の取り扱いが重要である。しかし、我々の経験の精巣組織で冷蔵保存されている以外の特別な処理を必要としません。精巣組織は24に冷蔵庫の温度にまで維持することができます - 36時間、その後の断片は移植のために準備することができます。また、新鮮な精巣の断片は、移植の結果27日に顕著な影響を与えずに4℃で一晩移植前に標準的な培地中で維持することができます。長期保管が必要な場合は精巣組織はまた、凍結保存することができます。ヤギ13、13,27豚、サル28に行われた研究では、精巣組織の凍結融解、後続が大幅にマウスでxenografting子宮後、精子の開発·生産する能力に影響を及ぼさないことが示されている。精巣組織の成功した凍結保存は、FBSを含む標準組織培養培地中で凍結保護剤としてDMSOを用いたアルコールバス13,27、の自動凍結28または従来の遅い冷凍することによって達成することができます。移植のために、凍結保存精巣組織は、標準の方法で解凍され、その後移植27前培養培地中で洗浄した。一度TISスーは、レシピエントマウスは、in vivoインキュベーターとしない主要な介入の必要があるとして移植されています。しかし、いくつかのケースでは、外因性性腺刺激ホルモンの補充が必要になることがあります。6-7ヶ月29で完全に精子形成を達成するために週二回hCGの10 IU皮下レシピエントマウスを注入する必要があり生後6ヶ月のアカゲザルから精巣組織。
前述のように新生児の男性から組織を使用する場合は、最善の結果が得られます。 postmeiotic生殖細胞が存在している男性から組織が退化する傾向を示しています。しかし、未熟な動物との精巣開発の完全な要約が可能であり、多数の臨床および研究のアプリケーションを持っています。臨床の現場で、xenografting精巣組織は、特に精子の回復はオプションではありませんである未熟な男性で、妊孕性温存のために使用することができます。生検の形の小片は、長期保存のために収集し、凍結することができます。ときに、DES赤外LED、フラグメントを解凍し、マウスの27,28に移植することができます。別の方法としては、異種移植片から採取される精子の凍結保存です。豚精巣移植からスナップ凍結精子のマイクロインジェクションは、精巣、精巣上体に比べて低効率であるが、形態的に正常な胚の生成をもたらしたか、精子の27射精。組織が 開発した後は、精子と精子を採取するために収集することができるin vitroで 13,16,30 に胚を生産するために使用することができます。この制限は、しかし、その結果精子は精巣上体成熟するため、受精のためにICSIを必要としないという事実である。したがって、受精のために異種由来の精子の使用はICSIが確立されている種に限定されています。
研究では、xenografting精巣組織は、齧歯類モデルにおける大規模な種の精巣発達と精子形成を研究する魅力的な代替手段です。たとえば、単一のドナー精巣は、複数のマウスに移植することができる。レシピエントマウスは、その後さまざまな治療にさらされる、および/または異種コレクションごとに異なる時点で屠殺することができます。これは、ドナーの影響を排除するだけでなく、特定の実験や研究に必要な大規模な男性の数を減らすだけでなく。これは、多数の男性を含む研究は、特に霊長類では、ロジスティック困難かつ高価であり、倫理的な制限を行うことができる大型の動物では特に重要です。移植が容易に可能ではなく、精子形成の効率が一定のドナー種14のローになる前にしかし、xenografting精巣組織のアプリケーションは、特定の細胞型の操作に制限されています。
開示事項
利害の衝突が宣言されません。
謝辞
著者の研究室からの作業はUSDA / CSREES / NRICGP(2007-35203-18213)によってサポートされている。NIH / NCRR(2 R01 RR17359-06)、NIH / NIEHS(1 R21 ES014856-01A2)とアルバータ州革新 - 健康ソリューション。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
| コラゲナーゼ(タイプIV) | シグマ | C5138 | |
| トリプシン-EDTA | インビトロジェン | 25200-056 | |
| DNaseIを | シグマ | DN25 | |
| DMEM | インビトロジェン | 31053-028 | |
| トリパンブルー染色 | インビトロジェン | 15250-061 | |
| ナイロンメッシュのセルストレーナー | BDバイオサイエンス | 352340(40μmの) 352350(70μm) | |
| ブスルファン | シグマ | B2635 | |
| 薄い壁ガラスキャピラリー | 世界の精密機器 | TW 100から3 | |
| BD intramedic plyethyleneチューブ(PE100) | BD | CA-63018-725 | |
| エチコン6から0シルク縫合糸 | エチコン | 706G | |
| 創傷クリップ | BD | 427631 | |
| Sigmacote | シグマ | SL2 | |
| X-galを | シグマ | B4252 | |
| フェロシアン化カリウム | シグマ | P9387 | |
| フェリシアン化カリウム | シグマ | P3667 | |
| 塩化マグネシウム | シグマ | 208337 | |
| デオキシコール酸ナトリウム | シグマ | D6750 | |
| N、N-ジメチルホルムアミド | シグマ | D4551 | |
| IGEPAL CA-630 | シグマ | 18896 |
参考文献
- Brinster, R. L., Avarbock, M. R. Germline transmission of donor haplotype following spermatogonial transplantation. Proceedings of the National Academy of Sciences of the United States of America. 91 (24), 11303-11303 (1994).
- Brinster, R. L., Zimmermann, J. W. Spermatogenesis following male germ-cell transplantation. Proceedings of the National Academy of Sciences of the United States of America. 91 (24), 11298-11298 (1994).
- Nagano, M., Avarbock, M. R., Brinster, R. L. Pattern and kinetics of mouse donor spermatogonial stem cell colonization in recipient testes. Biology of Reproduction. 60 (6), 1429-1429 (1999).
- Nagano, M., Brinster, C. J., Orwig, K. E. Transgenic mice produced by retroviral transduction of male germ-line stem cells. Proceedings of the National Academy of Sciences of the United States of America. 98 (23), 13090-13090 (2001).
- Ryu, B. Y., Orwig, K. E., Oatley, J. M. Efficient generation of transgenic rats through the male germline using lentiviral transduction and transplantation of spermatogonial stem cells. Journal of Andrology. 28 (2), 353-353 (2007).
- Hess, R. A., Cooke, P. S., Hofmann, M. C. Mechanistic insights into the regulation of the spermatogonial stem cell niche. Cell Cycle. 5 (11), 1164-1164 (2006).
- Oatley, M. J., Racicot, K. E., Oatley, J. M. Sertoli cells dictate spermatogonial stem cell niches in the mouse testis. Biology of Reproduction. 84 (4), 639-639 (2011).
- Nagano, M. C. Homing efficiency and proliferation kinetics of male germ line stem cells following transplantation in mice. Biology of Reproduction. 69 (2), 701-701 (2003).
- Kubota, H., Avarbock, M. R., Brinster, R. L. Growth factors essential for self-renewal and expansion of mouse spermatogonial stem cells. Proceedings of the National Academy of Sciences of the United States of America. 101 (47), 16489-16489 (2004).
- Oatley, J. M., Avarbock, M. R., Telaranta, A. I. Identifying genes important for spermatogonial stem cell self-renewal and survival. Proceedings of the National Academy of Sciences of the United States of America. 103 (25), 9524-9524 (2006).
- Dobrinski, I. Germ cell transplantation and testis tissue xenografting in domestic animals. Animal Reproduction Science. 89 (1-4), 137-137 (2005).
- Dobrinski, I., Avarbock, M. R., Brinster, R. L. Transplantation of germ cells from rabbits and dogs into mouse testes. Biology of Reproduction. 61 (5), 1331-1331 (1999).
- Honaramooz, A., Snedaker, A., Boiani, M. Sperm from neonatal mammalian testes grafted in mice. Nature. 418 (6899), 778-778 (2002).
- Rodriguez-Sosa, J. R., Dobrinski, I. Recent developments in testis tissue xenografting. Reproduction. 138 (2), 187-187 (2009).
- Dobrinski, I., Rathi, R. Ectopic grafting of mammalian testis tissue into mouse hosts. Methods in Molecular Biology. 139, Clifton, N.J. 450-450 (2008).
- Rodriguez-Sosa, J. R., Schlatt, S., Dobrinski, I. Testicular tissue transplantation for fertility preservation. Fertility Preservation: Emerging Technologies and Clinical Applications. Seli, E., Agarwal, A. , Springer. New York, NY. 331-331 (2011).
- Rathi, R., Honaramooz, A., Zeng, W. Germ cell fate and seminiferous tubule development in bovine testis xenografts. Reproduction. 130 (6), 923-923 (2005).
- Rathi, R., Honaramooz, A., Zeng, W. Germ cell development in equine testis tissue xenografted into mice. Reproduction. 131 (6), 1091-1091 (2006).
- Kim, Y., Selvaraj, V., Pukazhenthi, B. Effect of donor age on success of spermatogenesis in feline testis xenografts. Reproduction, Fertility, and Development. 19 (7), 869-869 (2007).
- Arregui, L., Rathi, R., Zeng, W. Xenografting of adult mammalian testis tissue. Animal Reproduction Science. 106 (1-2), 65-65 (2008).
- Schlatt, S., Honaramooz, A., Ehmcke, J. Limited survival of adult human testicular tissue as ectopic xenograft. Human Reproduction. 21 (2), 384-384 (2006).
- Shinohara, T., Avarbock, M. R., Brinster, R. L. beta1- and alpha6-integrin are surface markers on mouse spermatogonial stem cells. Proceedings of the National Academy of Sciences of the United States of America. 96 (10), 5504-5504 (1999).
- Kanatsu-Shinohara, M., Toyokuni, S., Shinohara, T. CD9 is a surface marker on mouse and rat male germline stem cells. Biology of Reproduction. 70 (1), 70-70 (2004).
- Ryu, B. Y., Orwig, K. E., Oatley, J. M. Effects of aging and niche microenvironment on spermatogonial stem cell self-renewal. Stem Cells. 24 (6), 1505-1505 (2006).
- Costoya, J. A., Hobbs, R. M., Barna, M. Essential role of Plzf in maintenance of spermatogonial stem cells. Nature Genetics. 36 (6), 653-653 (2004).
- Morrow, C. M., Hostetler, C. E., Griswold, M. D. ETV5 is required for continuous spermatogenesis in adult mice and may mediate blood testes barrier function and testicular immune privilege. Annals of the New York Academy of Sciences. 1120, 144-144 (2007).
- Zeng, W., Snedaker, A. K., Megee, S. Preservation and transplantation of porcine testis tissue. Reproduction, Fertility and Development. 21 (3), 489-489 (2009).
- Jahnukainen, K., Ehmcke, J., Hergenrother, S. D. Effect of cold storage and cryopreservation of immature non-human primate testicular tissue on spermatogonial stem cell potential in xenografts. Human Reproduction. 22 (4), 1060-1060 (2007).
- Rathi, R., Zeng, W., Megee, S. Maturation of testicular tissue from infant monkeys after xenografting into mice. Endocrinology. 149 (10), 5288-5288 (2008).
- Honaramooz, A., Li, M. W., Penedo, M. C. Accelerated maturation of primate testis by xenografting into mice. Biology of Reproduction. 70 (5), 1500-1500 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved