Method Article
Transplante de células germinativas e Tecidos Testículo xeno em Ratos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Protocolos para transplante de células germinativas e xeno tecidos testiculares são descritos. Germinativas resultados de células de transplante em doador-derivado espermatogênese em testículos beneficiárias, bem como representa um ensaio de reconstituição funcional para identificação de células-tronco espermatogónias (SSCS). Testículo tecido xeno reproduz o desenvolvimento dos testículos e espermatogênese de espécies doadoras diferentes em camundongos receptores.
Resumo
Gérmen de transplante de células foi desenvolvido pelo Dr. Ralph Brinster e colegas da Universidade da Pensilvânia, em 1994, 1,2. Estes estudos inovadores mostraram que a microinjeção de células germinativas de camundongos doadores férteis no interior dos túbulos seminíferos de ratos inférteis receptor resulta em doador-derivado espermatogênese e produção de espermatozóides pelo animal destinatário 2. O uso de machos dadores que transportem a identificação gene bacteriano β-galactosidase permitido de doador-derivado espermatogênese e transmissão de o haplótipo o dador até ao a prole, pelos animais, destinatário 1. Surpreendentemente, após o transplante para dentro do lúmen dos túbulos seminíferos, as células germinativas transplantados eram capaz de se mover a partir do compartimento luminal para a membrana cave, onde espermatogônias estão localizados 3. É geralmente aceite que SSCs só são capazes de colonizar o nicho e restabelecer a espermatogênese nos testículos beneficiários. Portanto células germinativas,transplante oferece uma abordagem funcional para estudar o nicho de células-tronco nos testículos e caracterizar supostas células-tronco espermatogônias. Até à data, o transplante de células de gérmen é usado para elucidar a biologia célula básica do caule, para produzir animais transgénicos através da manipulação genética de células germinais antes do transplante 4,5, para estudar de Sertoli interação célula a célula de gérmen de 6,7, SSC homing e colonização 3, 8, bem como SSC auto-renovação e diferenciação 9,10.
Transplante de células germinativas é também viável em grandes espécies 11. Nestes, as principais aplicações são a preservação da fertilidade, a divulgação da genética nas populações animais de elite, e geração de animais transgênicos como o estudo da espermatogênese ea biologia SSC com esta técnica é logisticamente mais difícil e caro do que em roedores. Transplante de células germinais de espécies de grande porte no interior dos túbulos seminíferos de ratos resulta em colonizatíon de células doadoras e de expansão das espermatogónias, mas não na sua plena diferenciação presumivelmente devido à incompatibilidade do compartimento da célula destinatário somática com as células germinativas a partir de espécies filogeneticamente distantes 12. Uma abordagem alternativa é o transplante de células germinativas a partir de espécies de grandes juntamente com o seu compartimento de somática circundante. Nós relatada pela primeira vez em 2002, de que pequenos fragmentos de tecido testículo a partir de machos imaturos transplantados sob a pele dorsal de camundongos imunodeficientes são capazes de sobreviver e submetidos a um desenvolvimento pleno com a produção de esperma fertilização competente 13. Desde que, em seguida, tecido testículo xeno-enxerto tem sido mostrado para ser bem sucedido em muitas espécies e emergiu como uma alternativa valiosa para estudar o desenvolvimento dos testículos e espermatogênese de animais de grande porte em camundongos 14.
Protocolo
PARTE A. transplante de células germinativas em camundongos
1. Preparação de camundongos de destinatário
- Destinatários deve ser imunologicamente tolerante (quer seja geneticamente combinados a doadores ou imuno-deficientes) para as células testiculares dos doadores.
- Destinatários deve ser ou naturalmente desprovido de espermatogênese (por exemplo, W / W v camundongos) ou empobrecido de células germinais endógenas. Depleção de células Germ pode ser alcançado por irradiação ou drogas quimioterápicas, tais como O busulfan. Neste protocolo, descrevemos o método de preparação de ratos receptores com busulfan.
- Trate os destinatários em 4-6 semanas de idade através da injeção ip de busulfan. A dose óptima de O busulfan é a estirpe dependente. Em cepas de destinatário comumente usados, uma dose de 40-50 mg / kg é suficiente para empobrecem células germinativas endógena (por exemplo, 44 mg / kg para ratinhos nus, 50 mg / kg para B6/129 destinatários F1).
- Dissolver O busulfan em pó em DMSO e em seguida, adicionar um volume igual de t de água destilada estérilÓ, façam uma concentração final de 4 mg / ml. Mantenha solução quente a 35-40 ° C antes de usar para evitar a precipitação dos O busulfan. Eliminar a solução que se precipitação é observado.
- Após o tratamento O busulfan, permitir que, pelo menos, um mês antes de usar destinatários. Os destinatários podem ser utilizadas entre 1 mês e 3 meses pós-tratamento com busulfan.
2. Preparação de pipetas de microinjecção
- Escolha pipetas de vidro de borosilicato (tubos capilares) com um diâmetro 1,0 milímetros exterior, uma 0,75 mm de diâmetro interior, e um comprimento de 3 polegadas.
- Siliconize pipetas de vidro com Sigmacote, enxaguar pipetas com metanol e secar com ar.
- Puxe as pipetas usando um extrator da pipeta. Máquinas diferentes extratores da pipeta ter configurações diferentes, portanto, testar algumas configurações. Geralmente, uma configuração semelhante ao utilizado para a tomada de pipetas de enucleação pode trabalhar.
- Quebre os pontas de pipeta sob microscópio de dissecação antes de usar para alcançar um diâmetro de aproximadamente 50 iMna ponta.
3. Preparação de células do doador para o transplante
- Choise da estirpe doador é dependente sobre a questão experimental estudada. Se quantificação da espermatogênese é usado como ponto de extremidade, o uso de doadores com um marcador facilmente identificável genética, tais como Lac-Z (por exemplo, B6.129S7-Gt (ROSA) 26Sor / J a partir de Jackson Laboratory) ou GFP (por exemplo, C57BL/6-Tg ( CAG-EGFP) 1Osb / J a partir de Jackson Laboratory).
- Prepare a 7 ml de colagenase em DMEM menos 1 mg / ml, 4 ml de tripsina-EDTA (0,25% de tripsina acrescido de 1 mM de EDTA), e 2 ml de DNase em DMEM às 7 mg / ml. Este montante é para digerir 2 testículos camundongo doador.
- Coletar assepticamente testículos e remover a túnica albugínea. Spread túbulos seminíferos delicadamente com uma pinça fina para facilitar a digestão enzimática.
- Túbulos de transferência em colagenase, incubar a 37 ° C durante 5-10 min, e agitar freqüentemente.
- Lave túbulos duas vezes por fiação (200-300 g para 3 min) e re-que suspende em PBS w / o Ca 2 + + .
- Re-suspender túbulos em tripsina-EDTA e agitar até que se torne pegajoso e nublado. Monitore a digestão de túbulos a 37 ° C como que ela deverá ocorrer no prazo de 1-2 min.
- Adicionar DNase e agite bem. Incubar durante 1-2 min.
- Adicionar 3 ml de FBS para parar a ação de enzimas.
- Suspensão de células filtro usando uma malha de nylon com 40-70 mM tamanho dos poros para remover células / tecido pedaços.
- Coletar as células a 600 g para 5 min e re-suspender as células em uma pequena quantidade de DMEM (
- Contar as células e ajustar o volume para uma concentração final desejada (geralmente 100 x 10 6). Mantenha suspensão de células em gelo antes de usar.
- Cada testículo O busulfan-tratados de mouse será preenchido com apenas 10-15 uL de suspensão de células. Devido ao potencial de desperdício e perdas, ter por objectivo a 30-50 ul por testículo.
4. Transplante de procedimento (Figura 1)
- Anestesiar os destinatários seguintes protocolos aprovados.
- Coloque em decúbito dorsaldecúbito e cirurgicamente preparar a área abdominal. Faça um ~ 1 centímetro incisão na linha média abdominal para expor a parede abdominal. Levante parede abdominal pelo uso de fórceps pequenas no ponto de a linha branca para evitar que acidentalmente ferindo órgãos abdominais, e proceder para fazer uma ~ incisão centímetros 0,5 menos da linha mediana da parede abdominal para expor a cavidade peritoneal.
- Use uma pinça íris para segurar a parede abdominal, e usar outro par de fórceps íris para procurar as bolsas de gordura ligados ao epidídimo e do testículo na cavidade peritoneal. Puxe delicadamente a almofada de gordura até que o testículo é exteriorizado e da artéria testicular e epidídimo são claramente visíveis. Os trabalhos sobre um testículo em um tempo.
- Coloque uma cortina fina estéril feita a partir de cartões de índice autoclavados debaixo da almofada de gordura / testículos para melhor identificação visual (opcional). A cortina também trabalha para absorver o líquido.
- Adicionar uma gota de Trypan corante Azul em a suspensão de células e, cuidadosamente, carregar o suspensão de células para o polyethytubagem de lene conectado a uma seringa de 1 ml. Anexar a pipeta puxado para dentro da tubulação e gentilmente forçar a suspensão de células para a pipeta através da aplicação de pressão para a seringa.
- Identificar os ductos eferentes (que liga o testículo ao epidídimo) e remova cuidadosamente tecido adiposo ao redor dos ductos. Trabalhe com cuidado, as condutas e da membrana ao redor deles são translúcidas.
- Insira com cuidado a pipeta em um duto no feixe dos dutos eferentes, gentilmente enrosque poucos milímetros em direção ao testículo.
- Evitando ao mesmo tempo movendo o pipeta de injeção, o alcance para a seringa, suavemente deprimir o êmbolo da seringa para garantir que a suspensão flui para o rete testis e nos túbulos seminíferos começam a encher.
- A taxa de injecção e de fluxo de suspensão de células é regulada por pressão do dedo polegar. Evitar o aumento súbito da pressão; monitorar o movimento de suspensão de túbulos.
- Pare a injeção quando quase todos os túbulos de superfície foram preenchidos antes do testículo começa a become isquêmica.
- Retorne o testículo para a cavidade abdominal. Repita o procedimento com o testículo contralateral. Suture a parede abdominal com 6-0 de sutura de seda e feche a pele com clips de feridas de metal. Monitorar camundongos em uma almofada de aquecimento até a recuperação completa.
5. Análise dos testículos de destinatário
- Permitir que de 2-4 meses após o transplante antes da análise.
- Euthanize o mouse destinatário de acordo com o cuidado com os animais e as diretrizes de uso e recolher o testículo e epidídimo em PBS. Quando um Lac-Z estirpe doador transgênico tem sido utilizado, o epidídimo pode ser usado como um controle de coloração positiva como ele tem atividade beta-galactosidase endógena.
- Para a detecção de células do doador por Lac-Z de coloração, resolver o problema o testículo para 1-2 horas a 4 ° C em paraformaldeído a 4% (PFA) em PBS. Enxágüe 3 x 30 min à temperatura ambiente em lacZ enxaguar buffer.
- Incubar durante a noite a 37 ° C em lacZ solução de coloração. Testículo pode ser manchado como um todo ou depois de dispersantedos túbulos.
- Corrigir e armazenar em 10% formalina tamponada neutra. Se seções são necessários usar o vermelho neutro rápido como contra-mancha.
PARTE B. ectópica xeno em camundongos
(De Dobrinski e Rathi 2008 15, e Rodriguez-Sosa et al. 2011 16).
1. Coleta de tecido de um doador
- Obter o tecido testículo por castração ou biópsia a partir de um do sexo masculino doador.
- Testículo Coloque em PBS ou biópsias em meio de cultura, mantendo condições estéreis.
- Mantenha o tecido coletadas em gelo e transporte para o laboratório.
2. Preparação de tecido do doador
- Realiza-se em o capô de cultura de tecido para manter a esterilidade.
- Lave cada testículo em antibióticos gelo-frios PBS contendo duas a três vezes antes de transferir o em uma cultura-prato com PBS. No caso de biópsias, lave fragmentos de testículo duas a três vezes com gelo-frio Medi culturauhm contendo antibióticos por girando em 150g para 2 min e ressuspensão em meio de cultura fresco gelo-frio.
- Para testículos intactos, remova túnica vaginal por fazer uma incisão ao longo da superfície e extrudar os testículo. Retire do testículo todas as estruturas Anexo (cordão espermático, epidídimo, o tecido conjuntivo). Lave testículos uma vez em PBS frio e transferência em uma cultura-prato com PBS.
- Cuidadosamente remova a túnica albugínea do testículo usando uma lâmina de bisturi e um par de tesouras. Se o testículo é muito pequena, da túnica pode ser removido por espremendo o tecido testicular para fora da túnica através de uma pequena incisão feita em uma extremidade enquanto segura a túnica com um par de fórceps pequenas sobre a outra extremidade.
- Dependendo do tamanho do testículo, quer o tecido testículo todo pode ser cortado em pequenos pedaços de em torno de 1 - 2 mm 3 em tamanho usando fórceps curvadas e uma lâmina de bisturi, ou de peças a grandes do tecido do testículo pode primeiro ser removidos a partir do testículo e, em seguida, cortadas em pequenospeças. Tudo isto deveria ser feito em gelo-frio meio de cultura e sob condições estéreis em um prato de cultura pequena (60 x15 mm).
- Transfira os fragmentos de tecido preparadas para o gelo-frio meio de cultura em pequenas culture-pratos em gelo até enxertia.
3. Castração de destinatário do mouse
- Anestesie do mouse como acima e preparar campo cirúrgico estéril por de grampeamento o cabelo (não é necessário em ratinhos nus), limpando-o com Etanol 70% e solução de Betadine.
- Faça um 0,5 -1 centímetros incisão da pele ventral linha mediana para expor a parede abdominal.
- Cuidadosamente expor o testículo, a artéria testicular e epidídimo tal como descrito no ParteA, 4,2-4,3.
- Retire a cauda da epididime do gubernáculo por dissecção romba.
- Ligadura a artéria testicular, e os ducto deferente de rato juntamente com o vaso sanguíneo com seda, e secção as estruturas com ligadura através do corte entre o testículo e a ligadura.
- Repita o procedimento para o secotestículo ª.
- Suture a parede abdominal com um ou dois pontos cirúrgicos.
- Feche a incisão da pele com um ou dois clips de Michel.
4. Ectópica xeno
- Posicione o mouse em decúbito ventral e preparar um campo cirúrgico estéril em sua parte traseira como acima.
- Dependendo de quantos enxertos são para ser inserido (geralmente 4-8/mouse), fazer do ~ 0,5 cm incisões na pele longos em cada lado da linha de meados de parte de trás do mouse.
- Use uma pinça para segurar uma borda da incisão na pele, e faça uma cavidade subcutânea por provocando além do tecido conjuntivo com uma tesoura.
- Usando um íris o local de fórceps um pedaço de testículo profunda do tecido para dentro da cavidade subcutânea, segurando a borda da incisão da pele com um outro fórceps íris.
- Feche a incisão na pele com um clipe de Michel e manter o mouse sobre almofada de aquecimento até que ele começa a se recuperar da anestesia.
- Transfira o mouse para uma gaiola com isolamento adicional e cover e monitor até que os ratos são totalmente recuperado.
5. Recolha de xenoenxertos testículos para análise e colheita de esperma
- Euthanize o mouse host de acordo com cuidados com os animais e as diretrizes de uso, e fazer uma incisão na pele na linha média sobre a pele running back da cauda para o pescoço e pele aberta. Isto expõe os enxertos quais podem ser localizadas, quer por o tecido subcutâneo ou anexado para a pele.
- Retire cuidadosamente os enxertos com uma pinça par e um par de tesouras.
- Número recorde de tamanho enxertos recuperados, e peso de enxertos individuais.
- Recuperar as vesículas seminais do abdome do rato e registar o seu peso como um indicador da produção de testosterona pelo tecido enxertado.
- Para análise histológica
- Suspender xenoenxertos em frasco para injectáveis amostra contendo solução de Bouin (ou fixador de outro) em um volume ~~~V 10x que a do xenoenxerto, e frasco para injectáveis rótulo de forma apropriada.
- Incubarnoite para o dia na geladeira seguida por lavagem pelo menos 3 vezes em etanol 70% em intervalos de 24 horas de preferência.
- Prossiga para o processamento e inclusão em parafina.
- Para a colheita de esperma
- Lave xenoenxertos por fiação-los para baixo, para 300g para 1 min e de ressuspender-los em meio de cultura contendo antibióticos.
- Cortar enxertos em pedaços pequenos e mince cuidadosamente com o fórceps em um prato de cultura de tecido contendo 3 - 5 ml de meio de cultura.
- Tecido picada filtro através do filtro da célula 40 mM.
PARTE resultados representativos C.
1. Gérmen de transplante de células
Se a suspensão de células transplantado doador contém células-tronco espermatogónias que transportem um marcador genético, tais como o transgene LacZ, a colonização do SSCs doadoras em que o testículo de destinatário pode ser visualizada por X-gal coloração como distintivos segmentos azuis do MEViniferous túbulos após 2-3 meses pós-transplante de 3 (Figura 2A). Uma colônia bem-estabelecida deve ter um trecho escuro de longo azul de segmentos de completamente cheios com duas ou mais camadas de células azuis mais estreitas para o centro, e as regiões coradas relativamente mais fracas em ambas as extremidades onde uma rede de único, emparelhado ou pequenos grupos de células azuis é aparente 3 (Figura 2B). A seção transversal do escuro região túbulo seminífero azul deveria revelar bem estabelecida e bem organizada espermatogênese com células germinativas azuis em vários estágios de diferenciação (Figura 2C).
2. Testículo tecido xeno
A viabilidade do tecido testicular após o transplante é inversamente correlacionado com o estágio de desenvolvimento do doador, o melhor resultado é obtido quando o tecido de machos recém-nascidos é usado, enquanto o tecido adulto mostra uma tendência de alta para se degeneram e morrem 17-21. Geralmente, o sucesso xenoenxerto diminui à medida que tecido do doador sofre-meiosis da primeira onda da espermatogênese. Tempo para a pleno desenvolvimento de tecido do doador imaturo e espermatogênese completo é específico da espécie, e muitas vezes um pouco mais curto em comparação com testículos em situ. O número de túbulos seminíferos com espermatogênese completo é variável conforme a espécie. Enquanto em ovinos, caprinos e suínos esse número é maior do que 50%, em bovinos e gatos ela é menos do que 15% 14 (Figura 3).
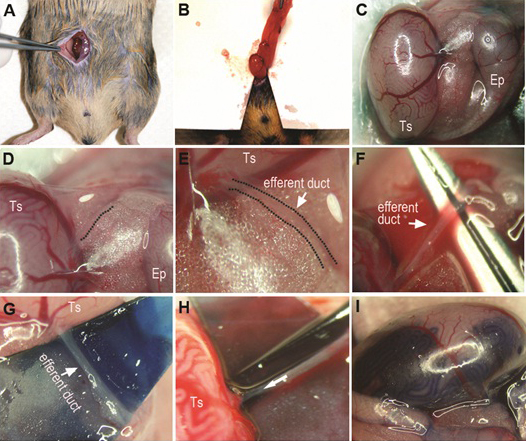
Figura 1. Germ procedimento de transplante de células. Coloque destinatários em decúbito dorsal após a anestesia e fazer uma ~ 0.4 polegadas incisão mediana abdominal (A). Exponha testículo mediante a retirada do almofada de gordura anexado a do epidídimo e do testículo e coloque um drape fina estéril debaixo da almofada de gordura / testículo, para melhor identificação visual (B). Posicione o testículo e epidídimo de modo que os dutos eferentes, enterrados em a almofada de gordura são discerníveis (C, D, E). Identidade dos dutos eferentes e remova cuidadosamente tecido adiposo ao redor dos ductos. Um pedaço de papel colorido ou de plástico podem ser colocadas por debaixo das dutos para melhor visualização (G). Ruptura de ou moer a ponta da pipeta de acordo com o tamanho dos ductos e suspensão célula de carga para a pipeta (H). Insira com cuidado a pipeta em um duto no feixe dos dutos eferentes, gentilmente enrosque poucos milímetros em direção ao testículo (a seta em H mostra a direção da pipeta de injeção e threading). Um testículo com injeção de sucesso em túbulos seminíferos é mostrada (I). Ts: Testículo; Ep: epidídimo.

Figura 2. Os resultados representativos para o transplante de células germinativas A) Um testículo injetados coradas com X-gal. Os segmentos azuis dos túbulos seminíferos representam colônias estabelecidas a partir de doadores transgênicos SSC (lacZ transgene). B) Maior ampliação de uma colônia SSC em 3 meses pós-transplante. Thde e região azul-escuro no centro representa a espermatogênese completa e as regiões pálidos azuis nas extremidades representam extensão crescente de a colônia. C) Um corte histológico do escuro túbulo seminífero azul (3 meses pós-transplante) mostra espermatogênese bem organizado. Barras de escala em B e C são 200 mM e 30 æM, respectivamente. (Figuras adaptado a partir Annu Célula Rev Dev Biol 2008;. 24:263-86 e Biol Reprod 1999 junho;. 60 (6) :1429-36).
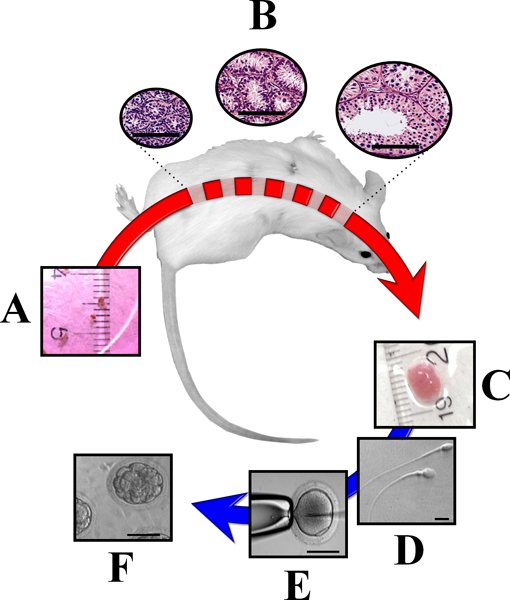
Figura 3. Xeno ectópica de tecido dos testículos imaturos de animais de grande porte em ratos imunodeficientes. Fragmentos de testículo doadores imaturos (~ 1 mm 3) transplantados sob a pele dorsal de ratos imunodeficientes (A) são capazes de sobreviver e responder às gonadotrofinas do rato. Como resultado, o tecido testículo sofre de desenvolvimento completo, incluindo a formação de esperma fertilização competente (B). Uma vez xenoenxerto de testículo são coletados (C)eles podem ser usados para a análise ou para obter esperma (D) para ICSI (E) e de produção de embriões (F). Bares igualdade de 50 um (B, E e F) or 10 iM (D). (Modificado de Rodriguez-Sosa e Dobrinksi 2009 14).
Discussão
1. Gérmen de transplante de células
Gérmen de transplante de células fornece o ensaio somente funcional para a confirmação inequívoca de a presença de células-tronco espermatogónias (SSCs) em uma população de células. SSC só pode casa e colonizar o nicho SSC na membrana basal e iniciar doador-derivado espermatogênese. Gérmen de transplante de células tornou possível para estudar e manipular SSCs em uma forma sem precedentes. A técnica tem sido utilizada para produzir animais transgénicos através da manipulação genética de SSCs 4; para elucidar o padrão de eficiência, e da cinética do SSC colonização 3,8; para estudar as vias de sinalização que regulam SSC auto-renovação e diferenciação 9,10; para caracterizar marcadores de superfície em SSC para a sua identificação 22,23; para estudar o ambiente nicho para SSCs 6,7,24. Além disso, o transplante de recíproca tem sido empregada para investigar se um fenótipo de infertility originado a partir de um defeito em células de Sertoli ou em células germinativas 25,26.
Para o transplante para trabalhar de forma eficiente, a escolha e tratamento dos animais receptores é importante. Os beneficiários devem ser ou geneticamente combinados a doadores ou imuno-suprimidos. Os destinatários deveriam também carecem de espermatogênese endógena: ou devido a uma mutação como em camundongos W / W V, ou renderizado infértil como um resultado de depleção de células de gérmen por irradiação ou drogas quimioterápicas, tais como O busulfan. Além disso, uma boa preparação de suspensões de doadoras de células e de aptidão, em procedimento de transplante são importantes para o sucesso da técnica como bem.
Gérmen de transplante de células tem suas próprias limitações. Não há nenhuma rápido de leitura-para fora para resultados. A análise dos testículos destinatário precisa esperar pelo menos dois meses como restabelecimento de espermatogênese completo nos receptores de outra forma inférteis acontece dois meses após o transplante 3. É isa ensaio qualitativo ou semi-quantitativa devido a grandes variações de injeção de células número e grau de destinatário supressão de células germinativas. Embora o conceito de transplante de células de gérmen tenha sido adaptado a outras espécies animais, o procedimento em si é tecnicamente diferente e um tanto mais desafiador em espécies não roedoras como um resultado das diferenças anatômicas em toda a espécies 11.
2. Testículo tecido xeno
Tecido testicular xeno funciona em muitas espécies de mamíferos e doadores é uma técnica relativamente simples. Tal como em outros tipos de transplantes, a coleção mais cedo após o tecido é transplantados, o maior chance de sucesso. Portanto, a preservação e manuseio do tecido a partir de coleção para o transplante é importante. No entanto, no nosso tecido testicular experiência não necessita de tratamento especial que não está sendo mantido refrigerado. Tecido Testículo pode ser mantida a temperatura de refrigerador até 24-36 hr,e, em seguida, fragmentos podem ser preparados para o transplante. Além disso, fragmentos de testículo frescos pode ser mantida em meio de cultura padrão a 4 ° C transplante de noite para o dia prévio, sem que um efeito perceptível sobre o resultado enxertia 27. Tecido Testículo também pode ser criopreservados se armazenamento a longo prazo é desejada. Estudos realizados em caprinos 13, suínos 13,27, e macaco 28 demonstraram que o congelamento e posterior descongelamento do tecido testicular não afeta significativamente a sua capacidade de desenvolver e produzir espermatozóides após ectópica xeno em camundongos. Criopreservação bem-sucedida de tecido de testículo pode ser alcançado por automatizado de congelamento de 28 ou convencional lento-congelamento em um banho de álcool 13,27, utilizando-se DMSO como crioprotetor em meio de padrão de tecido de cultura contendo de FBS. Para o transplante, o tecido testículo criopreservado é, então, descongeladas por métodos padrão e, subsequentemente, lavou-se em meio de cultura antes do transplante 27. Uma vez que o tisSue tem sido transplantada o mouse destinatário serve como um in vivo incubadora e nenhum grandes intervenções são obrigatórios. No entanto, em alguns casos, a suplementação com gonadotrofinas exógenas podem ser exigidos; tecido testículo partir de 6-meses-old macacos rhesus exigido injetando camundongos de destinatário por via subcutânea com 10 UI de hCG duas vezes por uma semana para atingir a espermatogênese completo de menos 6-7 meses 29.
Como mencionado acima, o melhor resultado é obtido quando o tecido a partir de machos recém-nascidos é usado. Tecido a partir de machos em que as células germinativas postmeiotic estão presentes mostra uma tendência a degenerar. No entanto, com animais imaturos recapitulação completa de o desenvolvimento dos testículos é possível e tem inúmeras aplicações clínicas e de pesquisa. Em um ambiente clínico, testículos tecido xeno-enxerto pode ser usado para a fertilidade preservação, particularmente nos machos imaturos em qual a recuperação esperma não é uma opção. Pequenos pedaços sob a forma de biópsias podem ser coletados e congelados para armazenamento a longo prazo. Quando desIred, os fragmentos podem ser descongeladas e enxertado em camundongos 27,28. Outra alternativa é a criopreservação de o esperma que é colhida a partir de xenoenxertos. Microinjeção com snap-congelado esperma a partir de xenoenxertos de testículo de suínos resultou em geração de embriões morfologicamente normais, embora a um menor eficiência em comparação com testicular, epididimal, ou ejaculou esperma 27. Depois de tecido tem desenvolvido, ele pode ser coletadas para a colheita de esperma e de esperma pode ser usado para produzir embriões in vitro 13,16,30. A limitação deste, no entanto, é o fato de que resulta o esperma não sofrem maturação epididimária e ICSI, portanto, exigem para a fertilização. Portanto, uso de xenoenxerto-derivada de esperma para a fertilização é limitado a espécies onde o ICSI tem sido estabelecidos.
Na pesquisa, testículos tecido xeno é uma alternativa atraente para estudar o desenvolvimento dos testículos e espermatogênese de espécies de grande porte em um modelo de roedor. Por exemplo, umtestículo único doador podem ser transplantadas para camundongos múltiplas. Camundongos de Destinatário pode, então, ser exposto a diferentes tratamentos, e / ou sacrificado em pontos de tempo diferentes para a recolha de xenoenxerto. Isto não só elimina os efeitos dos doadores, mas também reduz o número de machos grandes exigidos para um experimento em particular ou de estudo. Isto é particularmente importante em animais de grande porte onde os estudos que envolvam os machos numerosos são logisticamente difícil e caro, e pode transportar limitações éticas, particularmente em primatas. No entanto, as aplicações de xeno-enxerto de tecidos testículo são limitados como a manipulação de tipos de células específicas antes do transplante não é facilmente possível e eficiência da espermatogênese é baixa em espécies doadoras certas 14.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Trabalho de laboratório autores tem sido apoiada pela USDA / CSREES / NRICGP (2007-35203-18213); NIH / NCRR (2 R01 RR17359-06), NIH / NIEHS (1 R21 ES014856-01A2) e Alberta Inova - Health Solutions.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| Colagenase (tipo IV) | Sigma | C5138 | |
| Tripsina-EDTA | Invitrogen | 25200-056 | |
| DNaseI | Sigma | DN25 | |
| DMEM | Invitrogen | 31053-028 | |
| Trypan azul | Invitrogen | 15250-061 | |
| Filtro de nylon de malha celular | BD Biosciences | 352340 (40μm) 352350 (70μm) | |
| Busulfan | Sigma | B2635 | |
| De parede fina capilares de vidro | Instrumento de precisão Mundial | TW 100-3 | |
| BD tubulação plyethylene intramedic (PE100) | BD | CA-63018-725 | |
| Ethicon fio de seda 6-0 | Ethicon | 706G | |
| Grampos de sutura | BD | 427631 | |
| Sigmacote | Sigma | SL2 | |
| X-gal | Sigma | B4252 | |
| Ferrocianeto de potássio | Sigma | P9387 | |
| Ferricianeto de potássio | Sigma | P3667 | |
| cloreto de magnésio | Sigma | 208337 | |
| desoxicolato de sódio | Sigma | D6750 | |
| N, N-Dimetilformamida | Sigma | D4551 | |
| Igepal CA-630 | Sigma | 18896 |
Referências
- Brinster, R. L., Avarbock, M. R. Germline transmission of donor haplotype following spermatogonial transplantation. Proceedings of the National Academy of Sciences of the United States of America. 91 (24), 11303-11303 (1994).
- Brinster, R. L., Zimmermann, J. W. Spermatogenesis following male germ-cell transplantation. Proceedings of the National Academy of Sciences of the United States of America. 91 (24), 11298-11298 (1994).
- Nagano, M., Avarbock, M. R., Brinster, R. L. Pattern and kinetics of mouse donor spermatogonial stem cell colonization in recipient testes. Biology of Reproduction. 60 (6), 1429-1429 (1999).
- Nagano, M., Brinster, C. J., Orwig, K. E. Transgenic mice produced by retroviral transduction of male germ-line stem cells. Proceedings of the National Academy of Sciences of the United States of America. 98 (23), 13090-13090 (2001).
- Ryu, B. Y., Orwig, K. E., Oatley, J. M. Efficient generation of transgenic rats through the male germline using lentiviral transduction and transplantation of spermatogonial stem cells. Journal of Andrology. 28 (2), 353-353 (2007).
- Hess, R. A., Cooke, P. S., Hofmann, M. C. Mechanistic insights into the regulation of the spermatogonial stem cell niche. Cell Cycle. 5 (11), 1164-1164 (2006).
- Oatley, M. J., Racicot, K. E., Oatley, J. M. Sertoli cells dictate spermatogonial stem cell niches in the mouse testis. Biology of Reproduction. 84 (4), 639-639 (2011).
- Nagano, M. C. Homing efficiency and proliferation kinetics of male germ line stem cells following transplantation in mice. Biology of Reproduction. 69 (2), 701-701 (2003).
- Kubota, H., Avarbock, M. R., Brinster, R. L. Growth factors essential for self-renewal and expansion of mouse spermatogonial stem cells. Proceedings of the National Academy of Sciences of the United States of America. 101 (47), 16489-16489 (2004).
- Oatley, J. M., Avarbock, M. R., Telaranta, A. I. Identifying genes important for spermatogonial stem cell self-renewal and survival. Proceedings of the National Academy of Sciences of the United States of America. 103 (25), 9524-9524 (2006).
- Dobrinski, I. Germ cell transplantation and testis tissue xenografting in domestic animals. Animal Reproduction Science. 89 (1-4), 137-137 (2005).
- Dobrinski, I., Avarbock, M. R., Brinster, R. L. Transplantation of germ cells from rabbits and dogs into mouse testes. Biology of Reproduction. 61 (5), 1331-1331 (1999).
- Honaramooz, A., Snedaker, A., Boiani, M. Sperm from neonatal mammalian testes grafted in mice. Nature. 418 (6899), 778-778 (2002).
- Rodriguez-Sosa, J. R., Dobrinski, I. Recent developments in testis tissue xenografting. Reproduction. 138 (2), 187-187 (2009).
- Dobrinski, I., Rathi, R. Ectopic grafting of mammalian testis tissue into mouse hosts. Methods in Molecular Biology. 139, Clifton, N.J. 450-450 (2008).
- Rodriguez-Sosa, J. R., Schlatt, S., Dobrinski, I. Testicular tissue transplantation for fertility preservation. Fertility Preservation: Emerging Technologies and Clinical Applications. Seli, E., Agarwal, A. , Springer. New York, NY. 331-331 (2011).
- Rathi, R., Honaramooz, A., Zeng, W. Germ cell fate and seminiferous tubule development in bovine testis xenografts. Reproduction. 130 (6), 923-923 (2005).
- Rathi, R., Honaramooz, A., Zeng, W. Germ cell development in equine testis tissue xenografted into mice. Reproduction. 131 (6), 1091-1091 (2006).
- Kim, Y., Selvaraj, V., Pukazhenthi, B. Effect of donor age on success of spermatogenesis in feline testis xenografts. Reproduction, Fertility, and Development. 19 (7), 869-869 (2007).
- Arregui, L., Rathi, R., Zeng, W. Xenografting of adult mammalian testis tissue. Animal Reproduction Science. 106 (1-2), 65-65 (2008).
- Schlatt, S., Honaramooz, A., Ehmcke, J. Limited survival of adult human testicular tissue as ectopic xenograft. Human Reproduction. 21 (2), 384-384 (2006).
- Shinohara, T., Avarbock, M. R., Brinster, R. L. beta1- and alpha6-integrin are surface markers on mouse spermatogonial stem cells. Proceedings of the National Academy of Sciences of the United States of America. 96 (10), 5504-5504 (1999).
- Kanatsu-Shinohara, M., Toyokuni, S., Shinohara, T. CD9 is a surface marker on mouse and rat male germline stem cells. Biology of Reproduction. 70 (1), 70-70 (2004).
- Ryu, B. Y., Orwig, K. E., Oatley, J. M. Effects of aging and niche microenvironment on spermatogonial stem cell self-renewal. Stem Cells. 24 (6), 1505-1505 (2006).
- Costoya, J. A., Hobbs, R. M., Barna, M. Essential role of Plzf in maintenance of spermatogonial stem cells. Nature Genetics. 36 (6), 653-653 (2004).
- Morrow, C. M., Hostetler, C. E., Griswold, M. D. ETV5 is required for continuous spermatogenesis in adult mice and may mediate blood testes barrier function and testicular immune privilege. Annals of the New York Academy of Sciences. 1120, 144-144 (2007).
- Zeng, W., Snedaker, A. K., Megee, S. Preservation and transplantation of porcine testis tissue. Reproduction, Fertility and Development. 21 (3), 489-489 (2009).
- Jahnukainen, K., Ehmcke, J., Hergenrother, S. D. Effect of cold storage and cryopreservation of immature non-human primate testicular tissue on spermatogonial stem cell potential in xenografts. Human Reproduction. 22 (4), 1060-1060 (2007).
- Rathi, R., Zeng, W., Megee, S. Maturation of testicular tissue from infant monkeys after xenografting into mice. Endocrinology. 149 (10), 5288-5288 (2008).
- Honaramooz, A., Li, M. W., Penedo, M. C. Accelerated maturation of primate testis by xenografting into mice. Biology of Reproduction. 70 (5), 1500-1500 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados