Method Article
Зародышевых клеток и трансплантации тканей яичка Xenografting у мышей
* Эти авторы внесли равный вклад
В этой статье
Резюме
Протоколы для половых клеток и трансплантации xenografting ткани яичка описаны. Зародышевых клеток трансплантации приводит к донорам производных сперматогенез в яичках и получатель представляет собой функциональный анализ восстановления для идентификации сперматогониальные стволовых клеток (SSC). Ткани яичка xenografting воспроизводит развитие семенников и сперматогенез различных видов донора в реципиент мышей.
Аннотация
Germ cell transplantation was developed by Dr. Ralph Brinster and colleagues at the University of Pennsylvania in 19941,2. These ground-breaking studies showed that microinjection of germ cells from fertile donor mice into the seminiferous tubules of infertile recipient mice results in donor-derived spermatogenesis and sperm production by the recipient animal2. The use of donor males carrying the bacterial β-galactosidase gene allowed identification of donor-derived spermatogenesis and transmission of the donor haplotype to the offspring by recipient animals1. Surprisingly, after transplantation into the lumen of the seminiferous tubules, transplanted germ cells were able to move from the luminal compartment to the basement membrane where spermatogonia are located3. It is generally accepted that only SSCs are able to colonize the niche and re-establish spermatogenesis in the recipient testis. Therefore, germ cell transplantation provides a functional approach to study the stem cell niche in the testis and to characterize putative spermatogonial stem cells. To date, germ cell transplantation is used to elucidate basic stem cell biology, to produce transgenic animals through genetic manipulation of germ cells prior to transplantation4,5, to study Sertoli cell-germ cell interaction6,7, SSC homing and colonization3,8, as well as SSC self-renewal and differentiation9,10.
Germ cell transplantation is also feasible in large species11. In these, the main applications are preservation of fertility, dissemination of elite genetics in animal populations, and generation of transgenic animals as the study of spermatogenesis and SSC biology with this technique is logistically more difficult and expensive than in rodents. Transplantation of germ cells from large species into the seminiferous tubules of mice results in colonization of donor cells and spermatogonial expansion, but not in their full differentiation presumably due to incompatibility of the recipient somatic cell compartment with the germ cells from phylogenetically distant species12. An alternative approach is transplantation of germ cells from large species together with their surrounding somatic compartment. We first reported in 2002, that small fragments of testis tissue from immature males transplanted under the dorsal skin of immunodeficient mice are able to survive and undergo full development with the production of fertilization competent sperm13. Since then testis tissue xenografting has been shown to be successful in many species and emerged as a valuable alternative to study testis development and spermatogenesis of large animals in mice14.
протокол
ЧАСТЬ А. трансплантации половых клеток у мышей
1. Подготовка получателей мышей
- Получатели должны быть терпимы иммунологически (или генетически соответствуют доноров или иммунной недостаточности) к клеткам донора яичка.
- Получатели должны быть либо естественным лишенный сперматогенеза (например, W / W у мышей) или обедненный эндогенных половых клеток. Истощение зародышевых клеток может быть достигнуто путем облучения или химиотерапии препаратами, такими как бусульфан. В этом протоколе описываются способ получения получателем мышей с бусульфана.
- Лечить получателей в 4-6 недельного возраста через IP-инъекции бусульфана. Оптимальная доза бусульфана является штамм зависимы. В широко используются штаммы получателя дозе 40-50 мг / кг достаточно, чтобы исчерпать эндогенных половых клеток (например, 44 мг / кг для голых мышей, 50 мг / кг для B6/129 F1 получателей).
- Растворите порошок в Бусульфан ДМСО, а затем добавить равный объем дистиллированной водой тО окончательного концентрации 4 мг / мл. Хранить раствор теплой на 35-40 ° C перед использованием, чтобы избежать выпадения бусульфана. Отменить решение, если осадков не наблюдается.
- После лечения бусульфан, чтобы по крайней мере один месяц, прежде чем использовать получателей. Получатели могут использоваться от 1 месяца до 3 месяцев после лечения бусульфан.
2. Подготовка микроинъекции пипетки
- Выберите из боросиликатного стекла пипетки (капилляры) с 1,0 мм наружный диаметр, 0,75 мм внутреннего диаметра и длиной 3 дюйма.
- Силиконизированная стеклянные пипетки с Sigmacote, промыть пипетки с метанолом и сушить.
- Потяните пипетки помощью съемника пипетки. Различные машины съемник пипетки имеют различные параметры, поэтому, проверить свои настройки. Вообще, установка же, используются для изготовления пипеток энуклеации может работать.
- Перерыв наконечники под микроскопом до вскрытия использовать для достижения диаметром около 50 мкмна конце.
3. Подготовка донорских клеток для трансплантации
- Choise донорской деформации в зависимости от экспериментальных вопрос изучен. Если количественное сперматогенеза используется в качестве конечной точки, использование доноров с легко идентифицировать генетический маркер, таких как Lac-Z (например, B6.129S7-GT (РОСА) 26Sor / J из лаборатории Джексона) или GFP (например, C57BL/6-Tg ( CAG-EGFP) 1Osb / J из лаборатории Джексона).
- Подготовить 7 мл коллагеназы в DMEM в дозе 1 мг / мл, 4 мл трипсина-ЭДТА (0,25% трипсина плюс 1 мМ ЭДТА), 2 мл ДНКазы в DMEM на 7 мг / мл. Эта сумма предназначена для переваривания 2 яички доноров мыши.
- Соберите яички и асептически удалить белочной оболочки. Распространение семенных канальцев мягко с тонким пинцетом для облегчения ферментативного пищеварения.
- Передача канальцев в коллагеназы, инкубировать при 37 ° С в течение 5-10 мин, и агитировать часто.
- Вымойте канальцев дважды прядения (200-300 г в течение 3 мин) и повторно приостановления в PBS без Ca 2 + + .
- Повторно приостанавливать канальцев в трипсин-ЭДТА и трясти, пока они не становятся липкими и облачность. Мониторинг усвоения канальцев при 37 ° С, как это должно произойти в течение 1-2 мин.
- Добавить ДНКазы и хорошо взболтать. Выдержите в течение 1-2 мин.
- Добавьте 3 мл ФБС, чтобы остановить действие ферментов.
- Фильтры суспензии клеток помощью нейлоновой сетки с 40-70 мкм, размер пор для удаления клеток / тканей куски.
- Сбор клеток в 600 г в течение 5 минут и повторно приостанавливать клеток в небольшом количестве DMEM (<100 мкл).
- Граф клеток и регулировать громкость на желаемый конечной концентрации (обычно 100 х 10 6). Хранить суспензию клеток на лед перед использованием.
- Каждый Бусульфан обработанных семенников мышей будут заполнены лишь на 10-15 мкл клеточной суспензии. Из-за потенциальных потерь и утечки, стремиться к тому, 30-50 мкл на яичко.
4. Трансплантация процедуры (рис. 1)
- Анестезировать получателей после утвержденных протоколов.
- Место в спиннойлежачее положение и хирургическим путем подготовки брюшной области. Сделать ~ 1 см средней линии разреза брюшной полости, чтобы разоблачить брюшной стенки. Поднимите брюшной стенки с помощью небольшого пинцета в точке белой линии, чтобы избежать случайного ранения брюшной полости, и продолжить, чтобы ~ 0,5 см разрез в средней линии передней брюшной стенки, чтобы выставить в брюшную полость.
- Используйте один ирис щипцы держать брюшную стенку, и использовать другую пару щипцов диафрагмы поиск жировых отложений придает придатка и яичка в брюшной полости. Осторожно потяните жировой ткани, пока яичка экстериоризируется и яичка и придатка яичка артерии четко видны. Работа на одном яичке за один раз.
- Поместите тонкий стерильный драпировка из автоклавного карточек под жировой ткани / яичка для улучшения визуальной идентификации (опционально). Драпировка также работает для поглощения жидкости.
- Добавить капли красителя Трипановый синий в клеточной суспензии и старательно грузить клеточной суспензии в сумкиЛене трубки подключены к 1 мл шприц. Прикрепите вытащил пипетки в трубку и мягко заставить клеточной суспензии в пипетку, применяя давление на шприц.
- Определить выводных протоков (которые соединяют яичка в придатке яичка) и аккуратно удалить жировой ткани вокруг протоков. Работа же тщательно, как и каналы мембраны вокруг них прозрачный.
- Аккуратно вставьте пипетку в канал в комплекте из выводных протоков, мягко нитку в несколько миллиметров в сторону яичка.
- Избегая перемещения инъекции пипетки, дотянуться до шприца, слегка нажмите на поршень шприца, чтобы убедиться, что подвеска поступает в сеть яичка и семенных канальцев начать заполнять.
- Скорость впрыска и расхода суспензии клеток регулируется большим давлением. Избегайте резкого увеличения давления, контроль движения суспензии в канальцах.
- Остановить инъекции, когда почти все поверхности канальцев были заполнены до яичко начинает ОЦКекоторые ишемический.
- Вернуться яичка в брюшной полости. Повторите процедуру на противоположной яичка. Ушивания брюшной стенки с 6-0 шелковых шва и закройте кожи металлических клипс раны. Мониторинг мыши на панели потепление до полного выздоровления.
5. Анализ получателей яички
- Позвольте 2-4 месяцев после трансплантации перед анализом.
- Усыпить получателя мыши по ухода за животными и использованию принципов и собирать яичка и придатка яичка в PBS. Когда Лак-Z трансгенных доноров штамма был использован, придатки могут быть использованы в качестве положительного контроля окрашивания, как это имеет эндогенное бета-галактозидазы.
- Для выявления доноров клеток Lac-Z окрашивания, исправить яичка в течение 1-2 часов при температуре 4 ° С в 4% параформальдегид (PFA) в PBS. Промыть 3 х 30 мин при комнатной температуре в LacZ промыть буфера.
- Выдержите в течение ночи при 37 ° C в красящий раствор LacZ. Яичка могут быть окрашены в целом или после диспергированияканальцев.
- Исправлено и хранить в 10% нейтральном буферном растворе формалина. Если части необходимо использовать нейтральные быстро красный как борьба с пятном.
ЧАСТЬ B. Внематочная xenografting у мышей
(Из Добрински и Рати 2008 15, а Родригес Соса и соавт. 2011 16).
1. Коллекция донорских тканей
- Получение ткани яичка путем кастрации или биопсии у донора мужского пола.
- Место яичка в PBS или биопсии в культуральной среде, поддержания стерильных условиях.
- Хранить собранную ткани на льду и транспортировки в лабораторию.
2. Подготовка донорских тканей
- Выполнить в капюшоне культуры ткани для поддержания стерильности.
- Вымойте каждого яичка в ледяной PBS, содержащего антибиотики два-три раза до передачи в культуре блюдо с PBS. В случае биопсии яичка фрагменты мыть два-три раза с ледяной медицинские культурымкм, содержащие антибиотики, крутя на 150 г в течение 2 минут и суспендирования в свежей ледяной культуральной среде.
- Для нетронутыми яичек, удалить влагалищной оболочки, сделав надрез вдоль поверхности и выдавливания яичка. Удалить из яичка все структуры приложения (семенного канатика, придатка яичка, соединительной ткани). Вымойте яички раз в холодной PBS и передачи в культуре блюдо с PBS.
- Осторожно снимите белочной оболочки яичек, используя лезвие скальпеля и ножниц. Если яички очень мало, оболочка может быть удалена, сжимая ткани яичка из оболочки через небольшой разрез, сделанный на одном конце, держа оболочки с парой маленьких щипцов на другом конце.
- В зависимости от размера яичек или всей ткани яичка можно разрезать на небольшие кусочки по 1 - 2 мм, 3 размера, используя изогнутый пинцет и лезвие скальпеля, или большие куски ткани яичка можно сначала удалить из яичка, а затем разрезать на более мелкиештук. Все это должно быть сделано в ледяной культуральной среде и в стерильных условиях в небольшое блюдо культуры (60 x15 мм).
- Передача подготовленных фрагментов ткани ледяной культуральной среде в небольшом культуры блюда на льду до прививки.
3. Кастрация получателя мыши
- Анестезировать мышь, как выше, и подготовить стерильные хирургические поля обрезки волос (не обязательно в мышах), уничтожив при этом 70% этанола и Бетадин раствор.
- Сделать 0,5 -1 см вентральной средней линии разрез кожи, чтобы разоблачить брюшной стенки.
- Тщательно подвергать яичка, яичка и придатка яичка артерии, как описано в Парта, 4.2-4.3.
- Снимите хвост epidydimis от рулька от тупой диссекции.
- Перевязывать артерию яичек и семявыносящих протоков вместе с кровеносный сосуд с шелком, а в разделе перевязанной структуры, сокращая между яичка и лигатуры.
- Повторите процедуру для SECOй яичка.
- Ушивания брюшной стенки с одной или двух хирургических швов.
- Закройте разрез кожи с одним или двумя клипами Мишель.
4. Внематочная xenografting
- Наведите указатель мыши на вентральной лежачее положение и подготовить стерильный операционного поля на спине, как указано выше.
- В зависимости от того, сколько прививок должны быть вставлены (как правило, 4-8/mouse), убедитесь, ~ 0,5 см разрезы кожи по обе стороны от средней линии в задней части мыши.
- Используйте пинцет, чтобы провести границу разрез кожи и сделать подкожную полость от дразнить друг от друга соединительной ткани с помощью ножниц.
- Использование место диафрагмы щипцы кусок ткани яичка глубоко в подкожную полость, держа границу разрез кожи с другой диафрагмой щипцами.
- Закройте разрез кожи с одного клипа Мишель и держать мышь на грелку, пока она не начнет восстанавливаться после наркоза.
- Передача мышь в клетку с дополнительной изоляции и сотрудничестваверсии и монитора, пока мыши полностью выздоровели.
5. Коллекция яичка ксенотрансплантаты для анализа и сбора спермы
- Усыпить хозяин мыши по ухода за животными и использованию руководящих принципов, и сделать срединный разрез кожи на кожу спины, идущие от хвоста к шее и открытой кожи. Это подвергает трансплантаты, которые могут быть расположены как на подкожную ткань, либо прикрепляться к коже.
- Осторожно снимите трансплантатов с помощью пары щипцов и ножниц.
- Рекордное число трансплантатов восстановлены, размеры и вес отдельных трансплантатов.
- Получить семенные пузырьки из брюшной полости мыши и записывать свой вес как показатель тестостерона в пересаженной ткани.
- Для гистологического анализа
- Приостановить ксенотрансплантаты в пузырек с раствором Буэна (или другой фиксирующий) в объеме ~~~V 10x, что в ксенотрансплантата и этикетке флакона соответственно.
- Высиживатьна ночь в холодильник, с последующей промывкой по крайней мере 3 раза в 70% этанола с интервалом в 24 часов предпочтительнее.
- Выполните для обработки и внедрения в парафин.
- Для сбора спермы
- Вымойте ксенотрансплантаты вращая их вниз на 300 в течение 1 мин и суспендирования их в культуральной среде, содержащей антибиотики.
- Вырезать трансплантатов на мелкие кусочки и пропустить через мясорубку осторожно пинцетом в блюдо культуре ткани, содержащей 3 - 5 мл культуральной среды.
- Фильтры измельченной ткани через сито 40 мкм клетки.
Часть результатов С. представитель
1. Зародышевых клеток трансплантации
Если пересаженные суспензии клеток донора содержит сперматогониальные стволовых клеток проведения генетических маркеров, таких как LacZ трансгена колонизации доноров ГНЦ у реципиента яичка могут быть визуализированы на X-гал окрашивания как отличительный голубой сегменты семiniferous трубочек, через 2-3 месяца после трансплантации 3 (рис. 2A). Устоявшейся колонии должен иметь длинный темно-синий участок полностью заполненные сегменты с двумя или более слоев синей клетки ближе к центру, и относительно слабыми регионами окрашенных на обоих концах, где сеть одного, в паре или небольшими группами синих клеток Очевидно, 3 (рис. 2В). Сечение темно-синей зоне семенных канальцев должны выявить устоявшиеся и хорошо организованной сперматогенез с голубыми половых клеток на разных стадиях дифференцировки (рис. 2).
2. Ткани яичка xenografting
Жизнеспособности ткани яичка после пересадки обратно коррелирует с развитием стадии донор, лучший результат получается, когда ткани новорожденного мужчин используется, в то время как взрослые ткань имеет высокую тенденцию к перерождению и умирают 17-21. Как правило, ксенотрансплантата успеха уменьшается донорской ткани подвергается меняIosis первой волны сперматогенеза. Время полного развития незрелых тканей донора и полный сперматогенез является видовой, а зачастую и несколько короче по сравнению с яичками на месте. Число семенных канальцев с полным сперматогенеза является варьироваться в зависимости от вида. В то время как у овец, коз и свиней, число превышает 50%, крупного рогатого скота и кошек меньше чем на 15% 14 (рис. 3).
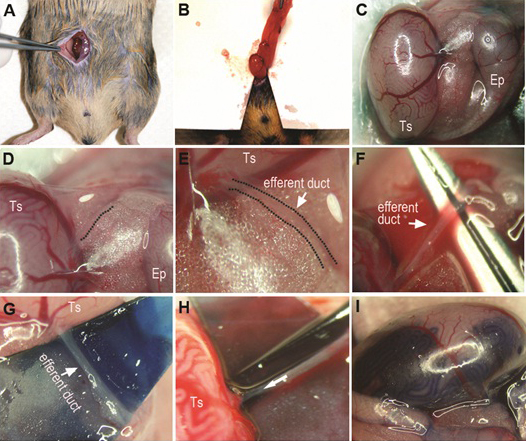
Рисунок 1. Зародышевых клеток трансплантации процедуры. Место получателей в лежачее положение спины после наркоза и сделать ~ 0,4-дюймовый средней линии разреза брюшной полости (А). Выставьте яичка путем изъятия жировой ткани придает придатка и яичка и поместить тонкий стерильный драпировка под жировой ткани / яичка для улучшения визуальной идентификации (B). Установите яичка и придатка яичка, чтобы выводные протоки похоронен в жировой ткани являются заметным (C, D, E). Idлица выводных протоков и аккуратно удалить жировой ткани вокруг протоков. Кусок цветной бумаги или пластика могут быть помещены под каналы для лучшей визуализации (G). Перерыв или размолоть пипетки в соответствии с размером каналов и подвески датчика в пипетку (H). Аккуратно вставьте пипетку в канал в комплекте из выводных протоков, мягко нитку в несколько миллиметров в сторону яичка (стрелка на H показывает направление пипетки впрыска и резьбы). Яичка с успешной закачки в семенных канальцев показано (I). Ц.: яичка; ЕР: придатка.

Рисунок 2. Представитель результаты трансплантации половых клеток) вводят яичка окрашивали X-гал. Синий сегментов семенных канальцев представляет основали колонии трансгенных ГНЦ донора (LacZ трансгенов). B) Высшее увеличения колонии SSC на 3 месяца после трансплантации. Thэлектронной темно-синей зоне в центре представляет полный сперматогенез и бледно-голубой области на концах представляют растущую расширение колонии. C) гистологические части темно синий семенных канальцах (3 месяца после трансплантации) показывает хорошо организованный сперматогенеза. Масштаб баров B и C, 200 мкм и 30 мкм соответственно. (Рис. адаптированный Анну Rev Сотовые Dev Biol 2008. 24:263-86 и биологии Reprod 1999 июнь;. 60 (6) :1429-36).
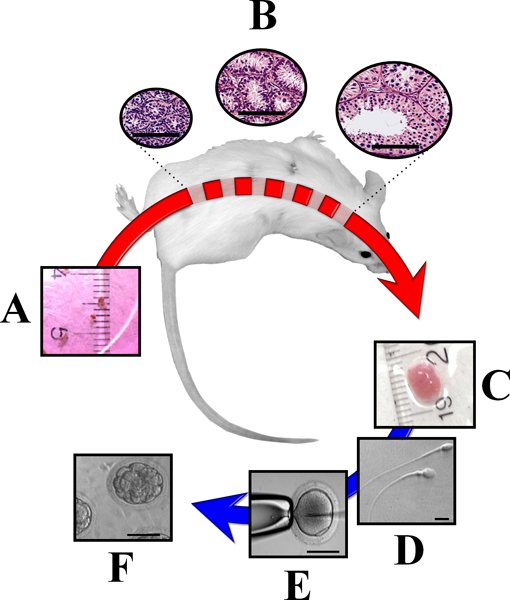
Рисунок 3. Внематочная xenografting незрелой ткани яичка от крупных животных в иммунодефицитных мышей. Фрагменты незрелые яички доноров (~ 1 мм 3) пересадили в спинной кожи иммунодефицитных мышей (A) в состоянии выжить и реагировать на мышь гонадотропинов. В результате ткань яичка подвергается полному развитию, в том числе формирование компетентного оплодотворения спермой (B). После яичка ксенотрансплантаты собираются (С)они могут быть использованы для анализа или получения спермы (D) для ИКСИ (E) и эмбрионов производства (F). Бары равный 50 мкм (B, E и F) и 10 мкм (D). (По материалам Родригес Соса и Dobrinksi 2009 14).
Обсуждение
1. Зародышевых клеток трансплантации
Зародышевых клеток трансплантация дает только функциональный анализ для однозначного подтверждения наличия сперматогониальные стволовых клеток (SSC) в клеточной популяции. Только ГНЦ может дома и колонизировать ниши SSC на базальной мембране и инициирует доноров производных сперматогенеза. Зародышевых клеток Трансплантация позволило изучать и манипулировать ГНЦ беспрецедентным образом. Техника была использована для получения трансгенных животных с помощью генной манипуляции ГНЦ 4; выяснить модель, эффективность и кинетика SSC колонизации 3,8; для изучения сигнальных путей, которые регулируют SSC самообновлению и дифференцировке 9,10; для характеристики поверхностных маркеров на КСЭ для их идентификации 22,23; изучить нишу среды ГНЦ 6,7,24. Кроме того, взаимное трансплантация была использована для расследования ли фенотип infertilitу возник из дефектов в клетках Сертоли или в половых клетках 25,26.
Для трансплантации работать эффективно, выбор и лечения животных получатель имеет важное значение. Получатели должны быть либо генетически соответствуют доноров или подавленной иммунной. Получатели также отсутствие эндогенного сперматогенеза: либо из-за мутации, как и в W / W у мышей, или оказали бесплодными в результате истощения зародышевой клетке при облучении или химиотерапии препаратами, такими как бусульфан. Кроме того, хорошая подготовка доноров клеточных суспензий и знание процедуры трансплантации имеют важное значение для успеха техники, а также.
Зародышевых клеток трансплантация имеет свои ограничения. Существует нет быстрого считывания результатов. Анализ яички получатель должен ждать по крайней мере два месяца, как восстановление полного сперматогенеза в противном случае бесплодной получателей происходит через два месяца после трансплантации 3. Это яса качественные или полуколичественного анализа в связи с большим изменениям в клетке введенный номер и степень подавления получателя клетки зародыша. Хотя концепция зародыш клеточной трансплантации была адаптирована для других видов животных, сама процедура технически отличается и несколько более сложной, не связанных с грызунов в результате анатомических различий между видами 11.
2. Ткани яичка xenografting
Ткани яичка xenografting работы во многих млекопитающих донора и относительно простой метод. Как и в других видах трансплантации, тем скорее после сбора ткань пересаживается больше шансов на успех. Таким образом, сохранение и обработку ткани из коллекции для трансплантации важно. Однако, на наш ткани яичка опыт не требуют специальной обработки, не держат в холодильнике. Ткани яичка могут быть сохранены в холодильнике температуру до 24 - 36 ч,, а затем фрагменты могут быть готовы к трансплантации. Кроме того, фрагменты свежих яичка могут быть сохранены в стандартной питательной среде при температуре 4 ° С в течение ночи до трансплантации без заметного влияния на результат прививки 27. Ткани яичка могут быть заморожены, если длительного хранения требуется. Исследования, проведенные в козьем 13, 13,27 свиньи, обезьяны и 28 показали, что замораживание и последующее оттаивание тканей яичка не оказывает существенного влияния его способность разрабатывать и производить сперму после внематочной xenografting у мышей. Успешное криоконсервации ткани яичка может быть достигнуто путем автоматизированного замораживания 28 или обычной медленной заморозки в ванной 13,27 алкоголь, используя в качестве криопротектора ДМСО в стандартной питательной среде ткани, содержащей FBS. Для трансплантации криоконсервированных тканей яичка, то талые стандартными методами, а затем промывают в культуральной среде перед трансплантацией 27. После того, тисСью была пересажена получателя мыши служит в живом инкубаторе, и никаких серьезных вмешательств не требуется. Тем не менее, в некоторых случаях добавок экзогенных гонадотропинов могут потребоваться; ткани яичка с 6-месячного макак-резусов требуется инъекционных получателя мышам подкожно 10 МЕ ХГЧ в два раза в неделю, чтобы добиться полного сперматогенеза на 6-7 месяцев 29.
Как было сказано выше, лучший результат получается, когда ткани новорожденного мужчины используют. Ткани из мужчин, в которой постмейотическая половых клеток присутствуют имеет тенденцию к вырождению. Тем не менее, с незрелыми животных полное повторение развития яичка возможно, и имеет множество клинических и научных исследований. В клинических условиях, ткани яичка xenografting может быть использован для сохранения фертильности, особенно в незрелые мужчины, в которой сперматозоиды восстановления это не вариант. Маленькие кусочки в виде биопсии может быть собрана и заморожена для длительного хранения. Когда деIRED, фрагменты могут быть разморожены и привитые мышам 27,28. Другой альтернативой является криоконсервация спермы, что собирается с ксенотрансплантаты. Микроинъекция с оснасткой замороженной спермы свиней ксенотрансплантаты яичка в результате поколение морфологически нормальных эмбрионов, хотя и в меньшей эффективностью по сравнению с яичка, придатка, или эякуляции спермы 27. После того, как ткань разработана, она может быть собрана для сбора спермы и может быть использован для создания эмбрионов в пробирке 13,16,30. Ограничение этого, однако, является тот факт, что в результате сперма не подвергаются придатка созревания и поэтому требуют ИКСИ для оплодотворения. Таким образом, использование ксенотрансплантата производных спермы для оплодотворения ограничивается видами, где ИКСИ был создан.
В исследовании, ткани яичка xenografting является привлекательной альтернативой для изучения развития семенников и сперматогенез крупных видов в грызунах. Например,одно яичко доноров могут быть перенесены на несколько мышей. Мыши-реципиенты могут подвергаться воздействию различных методов лечения и / или пожертвовать в различные моменты времени для ксенотрансплантата коллекции. Это не только устраняет эффект доноров, но и уменьшает количество крупных самцов, необходимых для конкретного эксперимента или исследования. Это особенно важно в больших животных, где многочисленные исследования с участием мужчин являются технически сложно и дорого, и могут иметь этические ограничения, в частности приматов. Тем не менее, применение xenografting ткани яичка ограничены как манипуляция специфические типы клеток перед трансплантацией не просто возможно, и эффективность сперматогенеза низка у некоторых видов доноров 14.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Работа в лаборатории авторов была поддержана Министерством сельского хозяйства США / CSREES / NRICGP (2007-35203-18213); NIH / NCRR (2 R01 RR17359-06), NIH / NIEHS (1 R21 ES014856-01A2) и Альберта инновационную - Решения здравоохранения.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | |
| Коллагеназы (тип IV) | Сигма | C5138 | |
| Трипсин-EDTA | Invitrogen | 25200-056 | |
| DNaseI | Сигма | DN25 | |
| DMEM | Invitrogen | 31053-028 | |
| Трипановый синие пятна | Invitrogen | 15250-061 | |
| Нейлоновый фильтр ячейки сетки | BD Biosciences | 352 340 (40 мкм) 352350 (70μm) | |
| Бусульфан | Сигма | B2635 | |
| Тонкие стены стеклянные капилляры | Инструмент Всемирной Precision | TW 100-3 | |
| BD intramedic plyethylene трубки (PE100) | BD | CA-63018-725 | |
| Ethicon 6-0 Шелковые шовные | Ethicon | 706G | |
| Рана клипы | BD | 427631 | |
| Sigmacote | Сигма | SL2 | |
| X-гал | Сигма | B4252 | |
| Ферроцианида калия | Сигма | P9387 | |
| Калий феррицианида | Сигма | P3667 | |
| Хлорид магния | Сигма | 208337 | |
| дезоксихолата натрия | Сигма | D6750 | |
| N, N-диметилформамид | Сигма | D4551 | |
| Igepal CA-630 | Сигма | 18896 |
Ссылки
- Brinster, R. L., Avarbock, M. R. Germline transmission of donor haplotype following spermatogonial transplantation. Proceedings of the National Academy of Sciences of the United States of America. 91 (24), 11303-11303 (1994).
- Brinster, R. L., Zimmermann, J. W. Spermatogenesis following male germ-cell transplantation. Proceedings of the National Academy of Sciences of the United States of America. 91 (24), 11298-11298 (1994).
- Nagano, M., Avarbock, M. R., Brinster, R. L. Pattern and kinetics of mouse donor spermatogonial stem cell colonization in recipient testes. Biology of Reproduction. 60 (6), 1429-1429 (1999).
- Nagano, M., Brinster, C. J., Orwig, K. E. Transgenic mice produced by retroviral transduction of male germ-line stem cells. Proceedings of the National Academy of Sciences of the United States of America. 98 (23), 13090-13090 (2001).
- Ryu, B. Y., Orwig, K. E., Oatley, J. M. Efficient generation of transgenic rats through the male germline using lentiviral transduction and transplantation of spermatogonial stem cells. Journal of Andrology. 28 (2), 353-353 (2007).
- Hess, R. A., Cooke, P. S., Hofmann, M. C. Mechanistic insights into the regulation of the spermatogonial stem cell niche. Cell Cycle. 5 (11), 1164-1164 (2006).
- Oatley, M. J., Racicot, K. E., Oatley, J. M. Sertoli cells dictate spermatogonial stem cell niches in the mouse testis. Biology of Reproduction. 84 (4), 639-639 (2011).
- Nagano, M. C. Homing efficiency and proliferation kinetics of male germ line stem cells following transplantation in mice. Biology of Reproduction. 69 (2), 701-701 (2003).
- Kubota, H., Avarbock, M. R., Brinster, R. L. Growth factors essential for self-renewal and expansion of mouse spermatogonial stem cells. Proceedings of the National Academy of Sciences of the United States of America. 101 (47), 16489-16489 (2004).
- Oatley, J. M., Avarbock, M. R., Telaranta, A. I. Identifying genes important for spermatogonial stem cell self-renewal and survival. Proceedings of the National Academy of Sciences of the United States of America. 103 (25), 9524-9524 (2006).
- Dobrinski, I. Germ cell transplantation and testis tissue xenografting in domestic animals. Animal Reproduction Science. 89 (1-4), 137-137 (2005).
- Dobrinski, I., Avarbock, M. R., Brinster, R. L. Transplantation of germ cells from rabbits and dogs into mouse testes. Biology of Reproduction. 61 (5), 1331-1331 (1999).
- Honaramooz, A., Snedaker, A., Boiani, M. Sperm from neonatal mammalian testes grafted in mice. Nature. 418 (6899), 778-778 (2002).
- Rodriguez-Sosa, J. R., Dobrinski, I. Recent developments in testis tissue xenografting. Reproduction. 138 (2), 187-187 (2009).
- Dobrinski, I., Rathi, R. Ectopic grafting of mammalian testis tissue into mouse hosts. Methods in Molecular Biology. 139, 450-450 (2008).
- Rodriguez-Sosa, J. R., Schlatt, S., Dobrinski, I., Seli, E., Agarwal, A. Testicular tissue transplantation for fertility preservation. Fertility Preservation: Emerging Technologies and Clinical Applications. , 331-331 (2011).
- Rathi, R., Honaramooz, A., Zeng, W. Germ cell fate and seminiferous tubule development in bovine testis xenografts. Reproduction. 130 (6), 923-923 (2005).
- Rathi, R., Honaramooz, A., Zeng, W. Germ cell development in equine testis tissue xenografted into mice. Reproduction. 131 (6), 1091-1091 (2006).
- Kim, Y., Selvaraj, V., Pukazhenthi, B. Effect of donor age on success of spermatogenesis in feline testis xenografts. Reproduction, Fertility, and Development. 19 (7), 869-869 (2007).
- Arregui, L., Rathi, R., Zeng, W. Xenografting of adult mammalian testis tissue. Animal Reproduction Science. 106 (1-2), 65-65 (2008).
- Schlatt, S., Honaramooz, A., Ehmcke, J. Limited survival of adult human testicular tissue as ectopic xenograft. Human Reproduction. 21 (2), 384-384 (2006).
- Shinohara, T., Avarbock, M. R., Brinster, R. L. beta1- and alpha6-integrin are surface markers on mouse spermatogonial stem cells. Proceedings of the National Academy of Sciences of the United States of America. 96 (10), 5504-5504 (1999).
- Kanatsu-Shinohara, M., Toyokuni, S., Shinohara, T. CD9 is a surface marker on mouse and rat male germline stem cells. Biology of Reproduction. 70 (1), 70-70 (2004).
- Ryu, B. Y., Orwig, K. E., Oatley, J. M. Effects of aging and niche microenvironment on spermatogonial stem cell self-renewal. Stem Cells. 24 (6), 1505-1505 (2006).
- Costoya, J. A., Hobbs, R. M., Barna, M. Essential role of Plzf in maintenance of spermatogonial stem cells. Nature Genetics. 36 (6), 653-653 (2004).
- Morrow, C. M., Hostetler, C. E., Griswold, M. D. ETV5 is required for continuous spermatogenesis in adult mice and may mediate blood testes barrier function and testicular immune privilege. Annals of the New York Academy of Sciences. 1120, 144-144 (2007).
- Zeng, W., Snedaker, A. K., Megee, S. Preservation and transplantation of porcine testis tissue. Reproduction, Fertility and Development. 21 (3), 489-489 (2009).
- Jahnukainen, K., Ehmcke, J., Hergenrother, S. D. Effect of cold storage and cryopreservation of immature non-human primate testicular tissue on spermatogonial stem cell potential in xenografts. Human Reproduction. 22 (4), 1060-1060 (2007).
- Rathi, R., Zeng, W., Megee, S. Maturation of testicular tissue from infant monkeys after xenografting into mice. Endocrinology. 149 (10), 5288-5288 (2008).
- Honaramooz, A., Li, M. W., Penedo, M. C. Accelerated maturation of primate testis by xenografting into mice. Biology of Reproduction. 70 (5), 1500-1500 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены