Method Article
Pseudomonas aeruginosa ve Saccharomyces cerevisiae Biyofilm Akış Hücreler
Özet
Protokolü Konfokal Lazer Tarama Mikroskobu (CLSM) mikrobiyal biyofilm büyüyen ve analiz etmek için bir akış hücresi sistemi uygulama nitelendirdi.
Özet
Birçok mikrobiyal hücrelerin serbest yaşayan mikroorganizmaların göre fizyolojik ve patolojik özelliklerini değiştirmiştir biyofilm olarak tanımlanan sesil mikrobiyal topluluklar oluşturmak için yeteneği var. Doğada Biyofilmler genellikle kötü tanımlanan koşulları 1 altında incelemek ve ikamet zor. Şeffaf bir alt tabaka kullanarak cihaza basit bir biyofilm tahribatsız bir şekilde gerçek zamanlı olarak kontrol edilebilir bir sistem mümkün: burada, in vitro 3D mikrobiyal biyofilm çalışmalarda, bir akış hücresi modeli sistemi montaj ve işletme göstermek 2,3 iyi tanımlanmış koşulları altında yüksek tekrarlanabilirlik üreten.
Biyofilm büyüme odası olarak hizmet veren bir akış hücresi sistemi oluşur. Akış hücresi peristaltik bir pompa yoluyla besin ve oksijen ile orta şişesi verilir ve harcanan orta atık kapta toplanır. Bu inşaat akış sisteminin akış odasında yetiştirilen hücreler minimal rahatsızlık ile örneğin antibiyotik besin ve yönetim sürekli bir kaynağı sağlar. Ayrıca, akış hücresi içinde akış koşulları kesme strese maruz biyofilm çalışmaları izin verir. Bir kabarcık, aksi takdirde, akış hücresi biyofilm yapısını bozabilir boru cihaz sınırları hava kabarcıkları yakalama.
Akış hücresi sistemi Konfokal Lazer Tarama Mikroskobu (CLSM) ile uyumludur ve böylece mikrobiyal biyofilm geliştirme hakkında son derece detaylı 3D bilgiler sağlayabilir. Biyofilm hücreler floresan probları veya CLSM analizi ile uyumlu proteinler etiketli olabilir. Bu online görselleştirme sağlar ve gelişmekte olan biyofilm nişler soruşturma sağlar. Mikrobiyal ilişkiler, antimikrobiyal ajanların incelenmesi veya spesifik genlerin ifadesi, birçok deney düzeneklerinin akış hücresi sistemi araştırılmalıdır.
Protokol
1. Tüm bileşenler Akış Hücre Sistemi Meclisi
Monte akış sistemi içerir: otoklavlanabilir borular, kabarcık tuzakları, orta / atık şişe ve Şekil 1'de gösterildiği gibi akış hücreleri. Bütün bu parçalar deneyler arasında yeniden kullanılabilir.
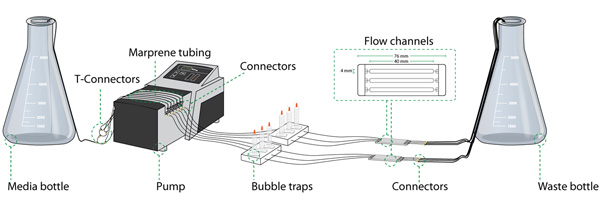
Şekil 1 akış hücresi sistemi kurulumu (setup temel bileşenler). Orta şişesi, bir peristaltik pompa, kabarcık tuzakları, akış hücresi, atık şişe, tüp ve çeşitli konektörler birbirine çeşitli bölümleri: akış hücresi sistemi birkaç bileşenden oluşur. Şekil nazik Rune Lyngklip tarafından sağlanmaktadır.
2. Akış Hücre Meclisi
- Akış hücresi (Şekil 2a) (Şekil 3) bir şırınga kullanılarak ince şerit, silikon yapıştırıcı ile tedavi edilir.
- Silikon hatları (Şekil 3) üstüne bir kapak kayma yerleştirin. Cam kapak slipleri P. için alt tabaka olarak kullanılan aeruginosa, S. PVC kapak fişleri için uygulanır cerevisiae biyofilm
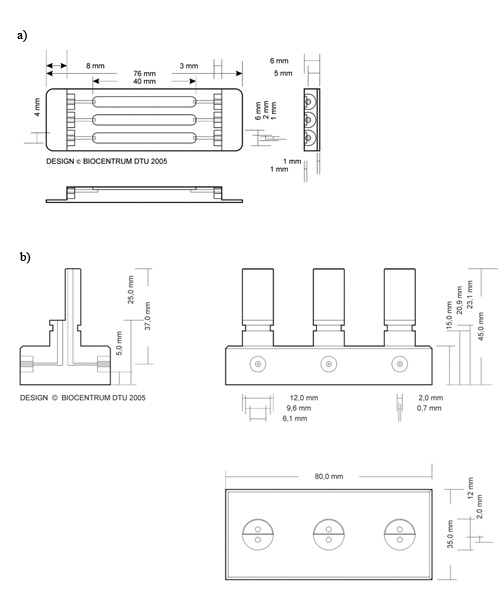
Şekil 2 akış hücresi ve kabarcık tuzak 2 şematik çizimi. A) akış hücresi b) kabarcık tuzak, DTU Sistemleri Biyoloji üretimi için kullanılan boyutları ayrıntılı bir açıklama. John Wiley & Sons, Inc (DTU Sistemleri Biyoloji eskiden figürü tasvir gibi, Biocentrum hak kazandı) izni ile yayımlanmaktadır

Şekil 3 tutturmak için cam alt tabaka silikon tutkal uygulama hatlarının çizimi. Akış hücresi eklemek belirtilen kapak cam silikon tutkal üzerine yerleştirilir.
- Akış hücresi ters çevirin ve kapağı aşağı kayma yüzü düz bir yüzey üzerine yerleştirin. Akışını hücrenin tabanına kapak kayma itmek için akış hücresi arka hafifçe basın. Akış hücresi ters çevirin ve silikon mühürlü olmayan alanlarda olup olmadığını kontrol edin. Bir şırınga kolu (piston) kısmını hafifçe cam ve akış hücresi birlikte basın için bir araç olarak kullanılabilir.
3. Orta Şişe
- Orta bir şişe içinde bir beslenme silikon tüp (2 mm iç çap) ve diğer ucunda düz bir bağlantı eklemek.
- (Orta içerik için "medya" paragrafına bakınız) şişe orta
Konnektör ve şişe metal görünümlü folyo ile örtün ve orta otoklavda. Otoklav zaman orta şişe boş tedarik tüp sonuna orta şişe veya bir sifon etkisi sıvı seviyesinden sabit olduğundan emin olun.
4. Bubble Trap, Akış Hücre ve Pompa bağlama
Şekil 1'de anahat göre tüm boru birleştirin. Marprene tüp uygulanan peristaltik pompa geçer parçası dışında silikon tüp kullanın.
- Tüm bireysel akış odalarına orta şişe tüp bağlanmak için gerekli sayıda deneyde uygulanan girişler bir tüp ayrıldı. T-konnektör (bkz. Şekil 1, T-konnektör) pompa Marprene tüplerine besleme tüpü istenilen sayıda bağlantı tüpleri yapmak için kullanın. Genellikle sisteminde arızalar durumunda bileşenlerinin belirlenmesi kolaylaştırmak için, sistem boyunca, boru ve akış hücreleri aynı sırasına tutmak iyi bir fikirdir.
- Düz bağlantılar kullanarak pompa tüpler Marprene her bireyin beslenme tüpü (çapı 2 mm) bağlayın. Bir baloncuk kapanı Marprene boru (Şekil 2b), orta silikon tüp (çapı 1 mm) ile bağlayın. Pompa balonu tuzak en yüksek kısmında girişine bağlı olduğundan emin olun.
- Akış hücresi girişi (çapı 1 mm) balonu tuzakları çıkış borusunun bağlayın, bu borulama uzunluğunun akış hücresi konfokal mikroskop (genellikle 1 m) sahneye taşınacak izin verdiğinden emin olun.
- Balonu tuzakların üstüne yerleştirin 5 ml şırınga. Üstleri uygun kapaklarla kapatın.
- Kısa, yaklaşık 40 mm parça (çapı 1 mm), boru akış hücresi çıkışına bağlamak ve gerekli uzunluğu (2 mm çapında) bir atık tüpü takmak için düz konnektör "indirgeyici" kullanabilirsiniz. Atık kabını atık tüpleri yerleştirin.
- Önemlisi, atık konteyneri her zaman asla akış hücre düzeyinde aşağıda akış hücreleri gibi aynı düzeyde yer olmalıdır. Ayrıca, atık boru sonuna akış hücreleri işlerken gömme bir sifon etkisi nedeniyle geri önlemek için beklenen atık sıvı seviyesinden sabit olduğundan emin olun.
5. AKIŞ SİSTEMİ STERİLİZASYON VE YIKAMA
- Kabarcık tuzak kapaklarını çıkartın ve onları steril tutmak için% 70 etanol koyun.
- % 0.5 (v / v) suda sodyum hipoklorit ile doldurmak için en yüksek pompa hızında çalıştırın.
- , Kabarcık tuzakları tamamen dolu olduğunda geri kabarcık tuzak kapakları yerleştirin.
- Akış odasında kabarcıkları akış hücreleri dokunun. Kırılgan cam kapak zarar vermemeye özen gösterin.
- 3 ml / h / kanal (0.2 mm / s lineer akış hızı) bir akış hızında 3-4 saat süreyle sterilize etmek için izin verin.
- Sistemi tüm hipoklorit yıkamak için 2-3 kez yıkayın. Sistem steril su ile doldurun ve boş. Kabarcık tuzaklar her yıkama arasında tamamen boşaltılmalıdır. Bu kabarcık tuzakları boşaltılmış kadar hava pompalama tarafından yapılabilir. Boşalttıktan sonra, sistem doldurmadan önce balonu tuzakları kapaklarını çıkarın. Balonu tuzakları tamamen sıvı ile doldurulmuş sonra kapaklarını değiştirin. Gerektiği gibi tekrarlayın.
- Gece boyunca düşük akış hızı (1-3 ml / h / kanal) sistemi aracılığıyla Run steril su ya da bir sonraki adıma geçin.
- Orta şişe girişine bağlayın ve deney yapılacaktır sıcaklığında düşük akış hızı (3 ml / h / kanal) gece boyunca orta ile yıkayın. Not: Sistemin orta dolu önce kabarcık tuzakları su boşaltılmalıdır.
6. AKIŞ HÜCRESİ inokülasyonu
- Bir gecede kültürden istenen bir optik yoğunluk seyreltme (P. aeruginosa örneğin 0.001 OD 600Nm ve S. cerevisiae 0.1 OD 600Nm).
- 27G iğne ile 0.5 ml şırınga odasına doldurmak için yeterli inokulum yüklemek için kullanın. 250 mcL (Şekil 2 x 4 mm x 1 mm, 40 mm) bu çalışmada belirtilen boyutlar akış odaları için yeterli.
- Peristaltik pompa durdurun.
- Kelepçe sistemine geri akışı önlemek için akış hücresi önde gelen silikon tüp.
- % 70 etanol ile silerek silikon tüp aşılama sitesi sterilize edin.
- Silikon tüp içine iğne takın ve akış hücresi giriş ucu tanıtmak. Yavaş yavaş odasına inokulum enjekte (hava kabarcıkları enjekte etmek için dikkatli olmak).
- İğneyi çıkarın ve enjeksiyon sitesi üzerinden silikon yapıştırıcı kullanarak delik hemen mühürleme suretiyle% 70 etanol ile enjeksiyon yerinde silin.
- Akış hücresi ters çevirin ve mikro-organizmalar altyapısını uygun akış hücresi akışı olmadan 1 saat izin verin.
- Akış hücresi açın, orta pompa başlatmak (3 ml / h / kanal) ve silikon tüp kapalı kelepçe.
- Sistem 37, inkübasyon için konur ° C P. durumda aeruginosa ve 30 ° C S. durumda cerevisiae.
- Akışını odaları Biyofilm CLSM tarafından görüntülenmiştir olabilir.
7. MİKROSKOBİSİ İÇİN biyofilm boyama
- Uygun boyama bir seyreltme (örneğin 1:1000 Syto 9 leke canlı S. cerevisiae)
- Peristaltik pompa durdurun.
- Kelepçe akış hücresi önde gelen silikon boru.
- % 70 etanol ile silerek silikon tüp aşılama sitesi sterilize edin.
- 27G iğne ile 0.5 ml şırınga odasına doldurmak için yeterli boyama çözüm yüklemek için kullanın. 250 mcL Burada kullanılan akış odaları için yeterli.
- Silikon tüp içine iğne takın ve akış hücresi giriş ucu tanıtmak. Yavaş yavaş odasına boyama solüsyonu (baloncuklar enjekte etmek için değil dikkatli) enjekte edilir.
- İğneyi çıkarın ve enjeksiyon anında mühürleme suretiyle% 70 etanol ile enjeksiyon yerinde silin.
- Akış hücresi, 15 dakika boyunca akışı olmadan bekletin.
- Kelepçe çıkarın ve akışını başlatmak (3 ml / h / kanal)
- CLSM veri elde
Tartışmalar
Biz güçlü bir araç biyofilm soruşturmalarda temsil eden bir akış hücresi sistemi ortaya koymuştur. Konfokal mikroskobu ile 3D görüntüleme ile birlikte, sistem, daha geleneksel mikroskobik teknikler yoluyla mikrobiyal biyofilm analiz diğer yöntemlere göre avantajları bir dizi vardır. Bu sistem, 3 boyutlu görselleştirme mikrobiyal biyofilm toplulukların toplum rahatsız olmadan yaşam sağlar. Işık mikroskobu biyofilm nişler hakkında ayrıntılı bilgi sağlar ve biyofilm elektron mikroskobu nano ölçekli çözünürlüğü sağlarken, canlı hücre görüntüleme izin vermez.
, Biz daha önce, birçok antibiyotiğe 5-8 (Şekil 4a) duyarlı bakteriyel hücreler, ekstrasellüler bileşiklerin dağılımı mekansal dağılımının aydınlatmıştır açıklanan akış kanal sistemi kullanarak, örneğin, DNA 9-11, hareketli ve hareketsiz olmayan hücrelerin dağılımı bir bakteri topluluğu 4,6,9 (Şekil 4c) içinde aynı türün. Biz akış hücresi sisteminin maya biyofilmlerin yönlerini incelemek amacıyla kullanılabilir olması öngörülüyor. Bu alansal ve zamansal dağılımı, maya biyofilm gelişimi alan genlerin belirlenmesi yanı sıra, mantar ilaçları gibi çevresel faktörlere yanıt maya biyofilm olabilir. Maya, hareketli ve hareketsiz olmayan hücrelerin içine ayırt bilinen olmasa da, biyofilm çeşitlendirme diğer yönleri gibi, maya pseudohyphal hücreleri morfolojik değişim ve diploid hücrelerinde haploid vardiya olarak çalışmalarına olabilir.
Biz bazı mikrop türlerinin uymak ve çeşitli boyama teknikleri ile çalışacak bir sistem ortaya koymuştur. Gibi GFP gibi farklı boyama probları ve floresan proteinleri çeşitli, gelişmekte olan biyofilm belirli niş soruşturma etkinleştirmek ve antimikrobiyal ajanların veya diğer çevresel faktörlerin etkisi analiz etmede etkili bir araçtır. Bilgi elde edilebilir (Şekil 4) çok detaylı ve biyofilm özellikleri COMSTAT 12,13 gibi bilgisayar programları ile sayısal olabilir.
Genel olarak, protokolün en kritik yönü, zaman alıcı bir süreç olduğu bir gerçektir. Aynı zamanda hücreler bir floresan olmayan, şeffaf yüzey üzerinde yükselmeye edebilmek için ihtiyaç duyduğu bir sınırlama yoktur. Sistem deneyimli bir araştırmacı olarak, yüksek verim tarama için uygun değildir: oluşturduğu biyofilm, birkaç yüz mikrometre 14 ile sınırlı araştırılmalıdır derinliği bir konfokal mikroskop kullanılarak analiz tasarım doğasında olduğundan daha fazla teknik sınırlamalar vardır buna hazırlanmak için birkaç gün sürebilir deney başına en fazla 15 kanal işleyebilir. Ancak, antibiyotik veya biyofilm çalışmaları ile ilgili olarak kabul edilir mutantlar başlangıçta en ilginç adaylar akış hücresi sistemine aktarılmadan önce kristal viyole boyama gibi diğer yöntemler ile tarandı kitle olabilir. Kapak cam levhalar çok ince ve kolay kırılabilir ve sistemleri işlerken dikkat edilmelidir. Buna ek olarak tüp günlük bir deney çalışması sırasında incelenebilir; giriş tüpler sadece yukarı akış hücrelerinin önemli "back-büyüme" oluşabilir. Böyle bir kirlenme steril tekniği kullanılarak, akış hücreleri giriş tarafında ortadan kaldırarak silikon tüp birkaç santimetre çözülebilir.

Şekil 4) 4 gün eski PAO1 ölü boyama (kırmızı leke) b) üç günlük bir 3D sunum eski P. Kolistin ve Propidium iyodür ile 24 saat tedavi GFP biyofilm aeruginosa PAO1 (P. aeruginosa vahşi tip) - GFP biyofilm 6 c) bir PAO1 3D resim sunumu - CFP Pila mutant bir PAO1 vahşi tip YFP (sarı) d (mavi)) 5 gün eski PAO1 - GFP biyofilm 3D olarak sunulan resim e) 26 saat S. cerevisiae (CEN.PK arka planda PTR3 mutant) biyofilm Syto-9 (15) ile boyandı.
Açıklamalar
Malzemeler
- Kabarcık tuzakları, polietilen (DTU Sistemleri Biyoloji, Danimarka Teknik Üniversitesi,% 20Center/Resources/Biofilm% 20Setup.aspx http://www.csm.bio.dtu.dk/Instrument)
- Clear polipropilen plastik bağlantıları ve T-konnektör (Cole Parmer, 1 / 8 inç (3.175 mm) ve 1 / 16 inç (1.588 mm))
- Kelepçe
- Konfokal mikroskobu (Zeiss, Meta LSM510)
- Lameller, cam (Knittel'in Gläser) 50 x 24 mm
- Lameller, PVC lamelleri (Rinzl) 50 x 24 mm
- Akış hücreleri, polietilen (DTU Sistemleri Biyoloji, Danimarka Teknik Üniversitesi,% 20Center/Resources/Biofilm% 20Setup.aspx http://www.csm.bio.dtu.dk/Instrument
- Orta şişe (Schott)
- Peristaltik Pompa (Watson-Marlow, 205S)
- Sepeti Rolling akış sistemleri ve pompalar
- Silikon tutkal (3M Super Silikon sifresiz)
- Şırınga 5 ml (Terumo)
- Syto 9 (Moleküler Problar)
- 0,5 mL Şırınga, iğne ile (27G, Terumo LU-100)
- Çöp konteyneri
Boru:
- Silikon, 3 mm dış çapı 1 mm iç çapı (Ole Dich)
- Silikon, 4 mm, dış çapı 2 mm, iç çapı (Ole Dich)
- Marprene, 3 mm dış çapı 1 mm iç çapı (Watson-Marlow)
Medya
| Name | Company | Catalog Number | Comments |
| P. aeruginosa orta | |||
| A10 | g / L | ||
| (NH 4) 2 SO4 | 2,0 | ||
| Na 2 HPO 4 X 2H 2 O | 6,0 | ||
| KH 2 PO 4 | 3,0 | ||
| NaCl | 3,0 | ||
| Otoklav | |||
| FB | |||
| MgCl 2 6H 2 O | 0,20 | ||
| 1 mL 1 M CaCl 2 | 0,01 | ||
| 100 mcL / L İz metaller (P. aeruginosa-biyofilm için) 4 | |||
| Otoklav | |||
| 1:10 'lik bir oran A10 ve FB karıştırın. | |||
| Istenen konsantrasyon karbon kaynağı ekleyin. | |||
| S. cerevisiae "adlı sentetik tam (SC) orta | |
| g / L | |
| Adenin sülfat | 0,02 |
| L-triptofan | 0,02 |
| L-histidin-HCL | 0,02 |
| L-arjinin-HCL | 0,04 |
| L-metiyonin | 0,02 |
| L-tirozin | 0,05 |
| L-lösin | 0,06 |
| L-izolösin | 0,06 |
| L-lizin-HCL | 0,05 |
| L-fenilalanin | 0,05 |
| L-aspartik asit | 0,10 |
| L-glutamik asit | 0,10 |
| L-valin | 0,15 |
| L-treonin | 0,20 |
| L-serin | 0,40 |
| Maya Nitstresin baz w / o amino asitler ve amonyum (Bacto) | 1,6 |
| Amonyum sülfat | 5,0 |
| NaOH | 6,0 |
| Süksinik asit | 10,0 |
| Otoklav | |
| Glikoz (ayrı ayrı otoklava) | 0,20 |
Referanslar
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Sternberg, C., Tolker-Nielsen, T. Growing and analyzing biofilms in flow cells. Curr Protoc Microbiol. Chapter 1, 2-2 (2006).
- Heydorn, A. Experimental reproducibility in flow-chamber biofilms. Microbiology. 146, 2409-2415 (2000).
- Pamp, S. J., Tolker-Nielsen, T. Multiple roles of biosurfactants in structural biofilm development by Pseudomonas aeruginosa. J Bacteriol. 189, 2531-2539 (2007).
- Haagensen, J. A. Differentiation and distribution of colistin- and sodium dodecyl sulfate-tolerant cells in Pseudomonas aeruginosa biofilms. J Bacteriol. 189, 28-37 (2007).
- Klausen, M., Aaes-Jorgensen, A., Molin, S., Tolker-Nielsen, T. Involvement of bacterial migration in the development of complex multicellular structures in Pseudomonas aeruginosa biofilms. Mol Microbiol. 50, 61-68 (2003).
- Pamp, S. J., Gjermansen, M., Johansen, H. K., Tolker-Nielsen, T. Tolerance to the antimicrobial peptide colistin in Pseudomonas aeruginosa biofilms is linked to metabolically active cells, and depends on the pmr and mexAB-oprM genes. Mol Microbiol. 68, 223-240 (2008).
- Pamp, S. J., Sternberg, C., Tolker-Nielsen, T. Insight into the microbial multicellular lifestyle via flow-cell technology and confocal microscopy. Cytometry Part A. 75A, 90-103 (2009).
- Barken, K. B. Roles of type IV pili, flagellum-mediated motility and extracellular DNA in the formation of mature multicellular structures in Pseudomonas aeruginosa biofilms. Environ Microbiol. 10, 2331-2343 (2008).
- Qin, Z. Role of autolysin-mediated DNA release in biofilm formation of Staphylococcus epidermidis. Microbiology. 153, 2083-2092 (2007).
- Allesen-Holm, M. A characterization of DNA release in Pseudomonas aeruginosa cultures and biofilms. Mol Microbiol. 59, 1114-1128 (2006).
- Heydorn, A. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146, 2395-2407 (2000).
- COMSTAT2, a semi-automated java-based quantification program for the analysis of microbial biofilms [Internet]. , Available from: http://www.comstat.dk/ (2010).
- Palmer, R. J., Haagensen, J. A., Neu, T. R., Sternberg, C. Handbook of Biological Confocal Microscopy. Palmer, J. B. , Springer. 882-900 (2006).
- Haagensen, J. A., Regenberg, B., Sternberg, C. High Resolution Microbial Single Cell Analytics Advances in Biochemical Engineering and Biotechnology. Müller, S., Bley, T. , Springer. (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır