Method Article
Pseudomonas aeruginosa e biofilm Saccharomyces cerevisiae in celle di flusso
In questo articolo
Riepilogo
Protocollo che descrive l'applicazione di un sistema di cella di flusso per la coltivazione e l'analisi biofilm microbici per la microscopia confocale a scansione laser (CLSM).
Abstract
Cellule microbiche Molti hanno la capacità di formare comunità microbiche sessili definito come biofilm che hanno modificato le proprietà fisiologiche e patologiche rispetto ai microrganismi che vivono liberi. Biofilm in natura sono spesso difficili da indagare e di soggiornare in condizioni di scarsa definite 1. Utilizzando un substrato trasparente è possibile al dispositivo di un sistema in cui biofilm semplici possono essere esaminate in maniera non distruttiva in tempo reale: qui dimostriamo il montaggio e il funzionamento di un sistema di modello di flusso di cellule, per studi in vitro 3D dei biofilm microbici generando alta riproducibilità sotto ben definite condizioni di 2,3.
Il sistema è costituito da una cella di flusso che funge da camera di crescita per il biofilm. La cella di flusso è fornito con sostanze nutritive e ossigeno da una fiaschetta di media tramite una pompa peristaltica e medio speso è raccolto in un contenitore dei rifiuti. Questa costruzione del sistema di flusso consente un approvvigionamento continuo di sostanze nutritive e la somministrazione di antibiotici ad esempio, con il minimo disturbo delle cellule coltivate in camera di flusso. Inoltre, le condizioni di flusso all'interno della cella di flusso consentono studi di biofilm esposti a sollecitazioni di taglio. Una bolla cattura confini dispositivo di bolle d'aria dal tubo che altrimenti potrebbe disturbare la struttura di biofilm nella cella di flusso.
Il sistema di cella di flusso è compatibile con microscopio confocale a scansione laser (CLSM) e può quindi fornire informazioni molto dettagliate 3D sullo sviluppo biofilm microbici. Cellule del biofilm possono essere etichettati con sonde fluorescenti o proteine compatibile con l'analisi CLSM. Ciò consente la visualizzazione on-line e permette di indagine di nicchie nel biofilm via di sviluppo. Interrelazione microbica, indagine degli agenti antimicrobici o l'espressione di specifici geni, sono delle configurazioni molti sperimentale che può essere indagato nel sistema di cella di flusso.
Protocollo
1. Assemblea del Cell System flusso con tutti i componenti
Il sistema a flusso assemblato comprende: tubi autoclavabile, trappole bolla, medio / scarto e celle di flusso, come mostrato nella Figura 1. Tutte queste parti possono essere riutilizzate tra esperimenti.
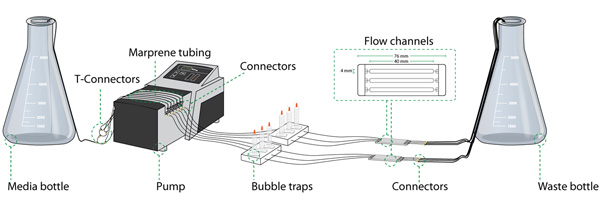
Figura 1. La cella di configurazione del flusso di sistema (componenti essenziali del setup). Il sistema di cella di flusso è composto da diversi componenti: una bottiglia di media, una pompa peristaltica, trappole bolla, la cella di flusso, una bottiglia di rifiuti, e diverse sezioni di tubi collegati tra loro da vari connettori. Figura gentilmente fornito da Rune Lyngklip.
2. Assemblea della cella di flusso
- La cella di flusso (Figura 2a) è trattata con corsie sottile di colla di silicone, con una siringa (Figura 3).
- Inserire una copertura antiscivolo sulla parte superiore delle linee di silicone (Figura 3). Scivola copertura in vetro vengono utilizzati come substrato per P. aeruginosa, mentre scivola copertura in PVC vengono applicate per S. Saccharomyces biofilm.
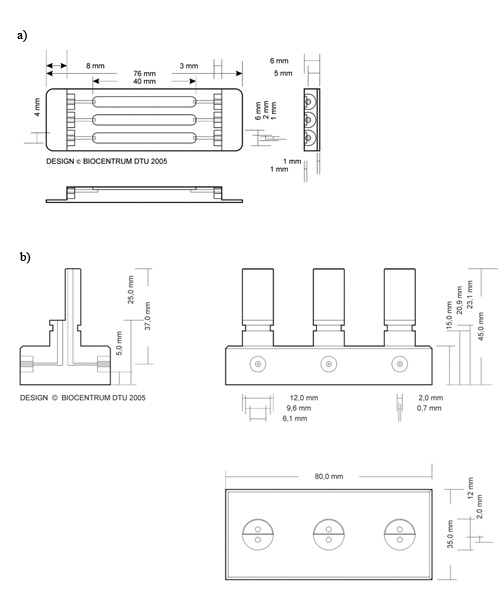
Figura 2. Schema di cella a flusso e gorgogliatore 2. Descrizione dettagliata delle dimensioni utilizzate per la produzione di: a) flusso bolla trappola cellulare b), DTU Systems Biology. Ristampato con il permesso di John Wiley & Sons, Inc. (DTU Systems Biology era precedentemente intitolato Biocentrum, come illustrato in figura)

Figura 3. Illustrazione delle linee di silicone applicazione della colla per il montaggio del substrato di vetro. Il vetro di copertura indicata è posizionato sopra la colla siliconica per fissarlo alla cella di flusso.
- Girare la cella di flusso e posizionarlo su una superficie piana con il lato antiscivolo coperchio verso il basso. Premere delicatamente sulla parte posteriore della cella di flusso per spingere la polizza di copertura sulla base della cella di flusso. Girare la cella di flusso più e per ispezionare le zone che non sono sigillate dal silicone. L'(pistone) gestire parte di una siringa può essere utilizzato come uno strumento per premere delicatamente la cella di vetro e il flusso insieme.
3. Bottiglia di media
- Posizionare un tubo in silicone alimentare (2 mm di diametro interno) in una bottiglia di medie e inserire un connettore dritto all'altra estremità.
- Aggiungi medio della bottiglia (per il contenuto medio vedi paragrafo "media")
Coperchio del connettore e bottiglia con un foglio di metallo e autoclave del mezzo. Assicurarsi che l'estremità del tubo di alimentazione è fisso al di sopra del livello del liquido nella bottiglia medio o un effetto sifone può svuotare la bottiglia di media quando autoclave.
4. Collegamento del gorgogliatore, cella di flusso e Pompa
Montare tutti i tubi secondo lo schema in Figura 1. Utilizza tubi al silicone, tranne per la parte che passa attraverso la pompa peristaltica in cui viene applicato tubi Marprene.
- Al fine di collegare il tubo dalla bottiglia medio-tutte le camere flusso individuali, dividere un tubo nel numero di ingressi applicati durante l'esperimento. Utilizzare connettori a T per rendere il numero auspicabile di tubi di collegamento dal tubo di alimentazione per i tubi Marprene nella pompa (vedi Figura 1, connettore a T). E 'generalmente una buona idea per mantenere lo stesso ordine sequenza di tubi e celle di flusso in tutto il sistema, per facilitare l'identificazione dei componenti in caso di guasti nel sistema.
- Collegare ogni singolo tubo di alimentazione (2 mm di diametro) a Marprene tubi nella pompa utilizzando connettori diritti. Collegare il tubo Marprene ad un gorgogliatore (Figura 2b) tramite un tubo in silicone intermedio (1 mm di diametro). Assicurarsi che la pompa è collegata all'ingresso nella parte più alta del gorgogliatore.
- Collegare il tubo di uscita risultante delle trappole bolla per l'ingresso cella di flusso (1 mm di diametro), assicurarsi che la lunghezza di questi tubi permette la cella di flusso per essere trasferito alla fase del microscopio confocale (in genere 1 m).
- Mettere 5 ml siringhe in cima alla trappole bolla. Chiudere la parte superiore con tappi idonei.
- Sulla presa di cella di flusso collegare un breve, circa 40 pezzi mm (1 mm di diametro), tubi e utilizzare una "riduzione" connettore dritto per collegare un tubo di scarico (2 mm di diametro) della lunghezza necessaria. Posizionare i tubi dei rifiuti nel contenitore dei rifiuti.
- È importante sottolineare che il contenitore dei rifiuti deve essere sempre posizionato allo stesso livello come le cellule di flusso, mai al di sotto del flusso delle cellule livello. Inoltre, assicurarsi che la fine del tubo di scarico è fissato al di sopra del livello previsto di rifiuti liquidi per evitare la filo-back a causa di un effetto sifone quando si maneggiano le celle di flusso.
5. STERILIZZAZIONE E LAVAGGIO DEL SISTEMA DI FLUSSO
- Togliere i tappi gorgogliatore e metterli in etanolo al 70% per tenerli sterili.
- Marcia a velocità massima della pompa per riempire il sistema con il 0,5% (v / v) di ipoclorito di sodio in acqua.
- Posizionare i tappi bolla trappola indietro quando la bolla trappole sono completamente riempiti.
- Toccare il flusso di cellule per rimuovere le bolle nella camera di flusso. Fare attenzione a non danneggiare il vetro fragile coperchio.
- Consentono al sistema di sterilizzare per 3-4 ore ad un flusso di 3 ml / h / canale (portata 0,2 mm / s lineare).
- Lavare il sistema 2-3 volte a lavare tutte le ipoclorito. Riempire e svuotare l'impianto con acqua sterile. Trappole bolla deve essere svuotato completamente tra ogni lavaggio. Questo può essere fatto mediante pompaggio in aria fino trappole bolla sono stati svuotati. Dopo lo svuotamento, togliere i tappi dalle trappole bolla prima di ricaricare il sistema. Rimettere i tappi dopo la bolla trappole sono state completamente riempita di liquido. Ripetere se necessario.
- Esegui acqua sterile attraverso il sistema con un flusso basso (1-3 ml / h / canale) durante la notte o passare alla fase successiva.
- Collegare la bombola di medie e di aspirazione e lavare il sistema con il mezzo durante la notte a bassa portata (3 ml / h / canale) alla temperatura in cui l'esperimento verrà eseguito. Nota: le trappole bolla deve essere svuotato per l'acqua prima che il sistema è pieno di media.
6. SEMINA DEL la cella di flusso
- Da un giorno all'altro cultura fare una diluizione di una densità ottico desiderato (per esempio, P. aeruginosa 0,001 OD 600 nm e 0,1 OD 600nm per S. cerevisiae).
- Utilizzare una siringa da 0,5 ml con un ago 27G per caricare inoculo sufficiente a riempire la camera. 250 microlitri è sufficiente per le camere di flusso che presentano le dimensioni specificate nel presente lavoro (Figura 2., 40 mm x 4 mm x 1 mm).
- Fermare la pompa peristaltica.
- Morsetto fuori il tubo di silicone che porta alla cella di flusso per impedire il riflusso nel sistema.
- Sterilizzare l'inoculazione sul tubo in silicone strofinandola con etanolo al 70%.
- Inserire l'ago nel tubo di silicone e introdurre la punta nella presa della cella di flusso. Iniettare lentamente l'inoculo nella camera (attenzione a non iniettare bolle d'aria).
- Rimuovere l'ago e pulire la sede di iniezione con etanolo al 70% seguita da immediata sigillatura del foro con colla siliconica sul sito di iniezione.
- Capovolgere la cella a flusso e lasciare che i microrganismi aderiscono al substrato per 1 ora senza che il flusso attraverso la cella di flusso.
- Girare la cella di flusso, avviare la pompa di media (3 ml / h / canale) e prendere la pinza dal tubo di silicone.
- Il sistema è posto per l'incubazione, a 37 ° C nel caso di P. aeruginosa e 30 ° C nel caso di S. cerevisiae.
- Biofilm nelle camere a flusso possono ora essere visualizzati da CLSM.
7. COLORAZIONE di biofilm per la microscopia
- Fai una diluizione della colorazione appropriata (ad esempio 1:1000 Syto 9 vivere macchia di S. cerevisiae)
- Fermare la pompa peristaltica.
- Fascetta del tubo di silicone che porta alla cella a flusso.
- Sterilizzare inoculazione sul tubo in silicone strofinandola con etanolo al 70%.
- Utilizzare una siringa da 0,5 ml con un ago 27G per caricare soluzione abbastanza colorazione a riempire la camera. 250 microlitri è sufficiente per le camere flusso usato qui.
- Inserire l'ago nel tubo di silicone e introdurre la punta nella presa della cella di flusso. Iniettare lentamente la soluzione colorante nella camera (attenzione a non iniettare bolle).
- Rimuovere l'ago e pulire la sede di iniezione con etanolo al 70% seguita da sigillatura immediata del sito di iniezione.
- Lasciare la cella di flusso senza flusso per 15 minuti.
- Togliere il morsetto e avviare il flusso (3 ml / h / canale)
- Acquisire dati con il CLSM
Discussione
Abbiamo dimostrato un sistema a celle di flusso che rappresenta un potente strumento nelle indagini biofilm. In combinazione con immagini 3D con la microscopia confocale, il sistema ha una gamma di vantaggi rispetto ad altri metodi di analisi dei biofilm microbici mediante tecniche microscopiche più tradizionali. Questo sistema permette la visualizzazione in 3D di comunità vive biofilm microbico senza disturbo della comunità. Microscopia ottica non fornirà informazioni dettagliate sulle nicchie del biofilm e, mentre la microscopia elettronica fornisce una risoluzione nanometrica del biofilm, non permette l'imaging dal vivo delle cellule.
Utilizzando il sistema descritto canale di flusso abbiamo già chiarito la distribuzione spaziale delle cellule batteriche sensibili ai diversi antibiotici 5-8 (Figura 4a), la distribuzione dei composti extracellulari, come ad esempio il DNA 9-11 e la distribuzione di cellule mobili e non mobili di la stessa specie all'interno di una comunità batterica 4,6,9 (Figura 4c). Prevediamo che il sistema di cella di flusso possono essere utilizzati per studiare gli aspetti di biofilm lievito. Questa potrebbe essere la distribuzione spazio temporale dei biofilm lievito in risposta a fattori ambientali come fungicidi così come l'identificazione di geni coinvolti nello sviluppo di lievito biofilm. Anche se il lievito non è noto a differenziarsi in cellule mobili e non mobili, altri aspetti di diversificazione biofilm possono essere studi come il cambiamento morfologico dal lievito alle cellule pseudohyphal e il passaggio da aploide a cellule diploidi.
Abbiamo dimostrato un sistema che rispettano diverse specie microbiche e lavorerà con tecniche di colorazione diverse. Una varietà di sonde di colorazione diversa e proteine fluorescenti, come GFP, consentono indagini specifica nicchia nel biofilm di sviluppo ed è uno strumento efficace per analizzare l'effetto degli agenti antimicrobici o di altri fattori ambientali. Le informazioni che si possono ottenere è molto dettagliata (Figura 4) e le caratteristiche nel biofilm può essere quantificato con programmi per computer come COMSTAT 12,13.
Nel complesso, l'aspetto più critico del protocollo è il fatto che si tratta di un processo che richiede tempo. E 'anche una limitazione che le cellule devono essere in grado di crescere in modo non fluorescente, superficie trasparente. . Dato che il biofilm formato viene analizzato con un microscopio confocale, la profondità che può essere indagato è limitata a qualche centinaio di micrometri 14 Ci sono ulteriori limitazioni tecniche inerenti alla progettazione: il sistema non è adatto per screening ad alto rendimento, come un ricercatore esperto in grado di gestire al massimo circa 15 canali per esperimento, che a sua volta può richiedere diversi giorni per prepararsi. Tuttavia, gli antibiotici o mutanti che sono considerati rilevanti per gli studi di biofilm può inizialmente essere messa a screening con altri metodi come macchie di cristallo viola prima che i candidati più interessanti sono trasferite al sistema di cella di flusso. Le lamiere di copertura in vetro sono molto sottili e si rompono facilmente, e si deve prestare attenzione durante la manipolazione del sistema. Inoltre i tubi dovrebbero essere esaminati ogni giorno durante la corsa di un esperimento, come una notevole "back-crescita" nei tubi di aspirazione a monte delle cellule flusso può verificarsi. Tale contaminazione può essere risolto rimuovendo diversi centimetri di tubo di silicone dal lato ingresso delle cellule di flusso, con tecnica sterile.

Figura 4 a) quattro giorni PAO1 vecchia -. Biofilm GFP trattati per 24 ore con colistina e ioduro di propidio per la colorazione morti (macchia rossa) b) presentazione in 3D di una tre giorni di vecchio P. PAO1 aeruginosa (P. aeruginosa tipo selvatico) - GFP biofilm 6 c) immagine di presentazione in 3D di un PAO1 - CFP pila mutante (blu) con un tipo di PAO1 YFP selvatico (giallo), d) 5 giorno di vita PAO1 - GFP biofilm presentato come un 3D e immagine) 26 h S. cerevisiae (PTR3 mutante in CEN.PK sfondo) biofilm colorate con Syto-9 15.
Divulgazioni
Materiali
- Trappole Bubble, polietilene (DTU Systems Biology, Università Tecnica di Danimarca, http://www.csm.bio.dtu.dk/Instrument 20Center/Resources/Biofilm 20Setup.aspx%%)
- Connettori in plastica trasparente in polipropilene e T-connettori (Cole Parmer, 1 / 8 pollici (3,175 mm) e 1 / 16 pollici (1.588 mm))
- Morsetti
- Microscopio confocale (Zeiss, Meta LSM510)
- Coprioggetto, vetro (Knittel Gläser) 50 x 24 mm
- Coprioggetto, PVC coprioggetti (Rinzl) 50 x 24 mm
- Celle di flusso, il polietilene (DTU Systems Biology, Università Tecnica di Danimarca, http://www.csm.bio.dtu.dk/Instrument 20Center/Resources/Biofilm 20Setup.aspx%%
- Bottiglie Media (Schott)
- Pompa peristaltica (Watson-Marlow, 205S)
- Rotolamento carrello per i sistemi di flusso e pompe
- Silicone colla (3M Super Sigillante siliconico trasparente)
- Siringa da 5 ml (Terumo)
- Syto 9 (Molecular Probes)
- 0,5 ml siringhe con aghi (27G, Terumo LU-100)
- Contenitore dei rifiuti
Tubi:
- Silicone, 3 mm di diametro esterno, 1 mm di diametro interno (Ole Dich)
- Silicone, 4 mm di diametro esterno, 2 mm diametro interno (Ole Dich)
- Marprene, 3 mm di diametro esterno, 1 mm di diametro interno (Watson-Marlow)
Media
| Name | Company | Catalog Number | Comments |
| P. aeruginosa media | |||
| A10 | g / L | ||
| (NH 4) 2 SO4 | 2,0 | ||
| Na 2 HPO 4 x 2H 2 O | 6.0 | ||
| KH 2 PO 4 | 3,0 | ||
| NaCl | 3,0 | ||
| Autoclave | |||
| FB | |||
| MgCl 2 6H 2 O | 0,20 | ||
| 1 ml di 1 M CaCl 2 | 0,01 | ||
| 100 l / L metalli in tracce (per P. aeruginosa-biofilm) 4 | |||
| Autoclave | |||
| Mescolare A10 e FB in un rapporto di 1:10. | |||
| Aggiungere la sorgente di carbonio ad una concentrazione desiderata. | |||
| S. cerevisiae sintetico completo (SC) di media | |
| g / L | |
| Solfato di adenina | 0,02 |
| L-triptofano | 0,02 |
| L-istidina-HCL | 0,02 |
| L-arginina-HCL | 0,04 |
| L-metionina | 0,02 |
| L-tirosina | 0,05 |
| L-leucina | 0,06 |
| L-isoleucina | 0,06 |
| L-lisina HCL | 0,05 |
| L-fenilalanina | 0,05 |
| L-acido aspartico | 0,10 |
| Acido L-glutammico | 0,10 |
| L-valina | 0,15 |
| L-treonina | 0,20 |
| L-serina | 0,40 |
| Lievito NitRogen Base w / o aminoacidi e di ammonio (Bacto) | 1,6 |
| Solfato di ammonio | 5.0 |
| NaOH | 6.0 |
| Acido succinico | 10,0 |
| Autoclave | |
| Glucosio (autoclavato a parte) | 0,20 |
Riferimenti
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Sternberg, C., Tolker-Nielsen, T. Growing and analyzing biofilms in flow cells. Curr Protoc Microbiol. Chapter 1, 2-2 (2006).
- Heydorn, A. Experimental reproducibility in flow-chamber biofilms. Microbiology. 146, 2409-2415 (2000).
- Pamp, S. J., Tolker-Nielsen, T. Multiple roles of biosurfactants in structural biofilm development by Pseudomonas aeruginosa. J Bacteriol. 189, 2531-2539 (2007).
- Haagensen, J. A. Differentiation and distribution of colistin- and sodium dodecyl sulfate-tolerant cells in Pseudomonas aeruginosa biofilms. J Bacteriol. 189, 28-37 (2007).
- Klausen, M., Aaes-Jorgensen, A., Molin, S., Tolker-Nielsen, T. Involvement of bacterial migration in the development of complex multicellular structures in Pseudomonas aeruginosa biofilms. Mol Microbiol. 50, 61-68 (2003).
- Pamp, S. J., Gjermansen, M., Johansen, H. K., Tolker-Nielsen, T. Tolerance to the antimicrobial peptide colistin in Pseudomonas aeruginosa biofilms is linked to metabolically active cells, and depends on the pmr and mexAB-oprM genes. Mol Microbiol. 68, 223-240 (2008).
- Pamp, S. J., Sternberg, C., Tolker-Nielsen, T. Insight into the microbial multicellular lifestyle via flow-cell technology and confocal microscopy. Cytometry Part A. 75A, 90-103 (2009).
- Barken, K. B. Roles of type IV pili, flagellum-mediated motility and extracellular DNA in the formation of mature multicellular structures in Pseudomonas aeruginosa biofilms. Environ Microbiol. 10, 2331-2343 (2008).
- Qin, Z. Role of autolysin-mediated DNA release in biofilm formation of Staphylococcus epidermidis. Microbiology. 153, 2083-2092 (2007).
- Allesen-Holm, M. A characterization of DNA release in Pseudomonas aeruginosa cultures and biofilms. Mol Microbiol. 59, 1114-1128 (2006).
- Heydorn, A. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146, 2395-2407 (2000).
- Palmer, R. J., Haagensen, J. A., Neu, T. R., Sternberg, C., Palmer, J. B. . Handbook of Biological Confocal Microscopy. , 882-900 (2006).
- Haagensen, J. A., Regenberg, B., Sternberg, C., Müller, S., Bley, T. . High Resolution Microbial Single Cell Analytics Advances in Biochemical Engineering and Biotechnology. , (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon