Method Article
フローセル内の緑膿菌と出芽酵母のバイオフィルム
要約
プロトコルは、共焦点レーザー走査顕微鏡(CLSM)のために微生物膜を成長し、分析するためのフローセルシステムのアプリケーションを記述する。
要約
多くの微生物細胞は自由生活微生物に比べて生理学的および病理学的特性を変更したバイオフィルムのように定義されて付着微生物群集を形成する能力を持っている。自然の中でバイオフィルムは、しばしば不十分な定義された条件1の下で調査し、存在することは困難です。透明な基層を使用して、それはデバイスへの簡単なバイオフィルムをリアルタイムに非破壊的方法で調べることのできるシステムが可能です:ここでは、微生物バイオフィルムの in vitro 3D での研究のために、フローセルのモデルシステムの組み立てと動作を実証明確に定義された条件2,3の下で高い再現性を生成する。
システムは、バイオフィルムの成長チャンバーとして機能するフローセルで構成されています。フローセルは、蠕動ポンプを介して培地フラスコから栄養と酸素を供給され、使用済み培地は、廃棄物の容器に集めている。フローシステムのこの構造は、フローチャンバーで培養した細胞の軽微な障害を持つ栄養素と例えば抗生物質の投与を継続的に供給することができます。また、フローセル内の流れの条件は、せん断応力にさらされるバイオフィルムの研究を可能にする。そうでない場合はフローセル内のバイオフィルムの構造を破壊することができるチューブからデバイスの範囲の気泡をトラップする泡。
フローセルシステムでは、共焦点レーザー走査顕微鏡(CLSM)と互換性があり、それによって微生物のバイオフィルムの開発についての非常に詳細な3D情報を提供することができます。バイオフィルム中の細胞を蛍光プローブまたはCLSM分析と互換性のあるタンパク質で標識することができます。これはオンラインで可視化を可能にし、開発するバイオフィルムのニッチの調査を可能にします。微生物の相互関係、抗菌剤の調査や特定の遺伝子の発現は、フローセルシステムで調べることができる多くの実験装置のものである。
プロトコル
1。すべてのコンポーネントとフローセルシステムの組立
組み立てたフローシステムが含まれています:図1に示すように、オートクレーブ可能なチューブ、バブルトラップ、ミディアム/廃棄物ボトルとフローセルを。これらすべての部分は実験間で再利用することができます。
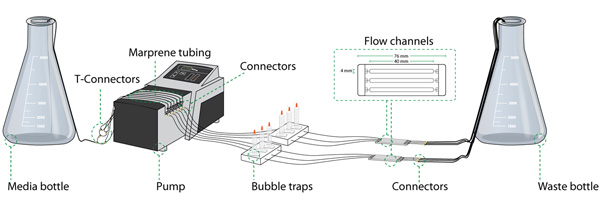
図1のフローセルシステムのセットアップ(セットアップの基本的なコンポーネント)。培地ボトル、蠕動ポンプ、バブルトラップ、フローセル、廃液ボトル、および各種コネクタによって相互接続されたチューブの様々なセクション:フローセルシステムは、いくつかのコンポーネントで構成されています。親切にルーンLyngklipで提供される図。
2。フローセルの組み立て
- フローセル(図2a)は、注射器(図3)を使用して、シリコンの接着剤の薄い車線で扱われます。
- シリコンライン(図3)の上にカバースリップを置きます。ガラスカバースリップは、Pの基層として使用されていますPVCカバースリップがSで適用されている間緑膿菌出芽酵母のバイオフィルム。
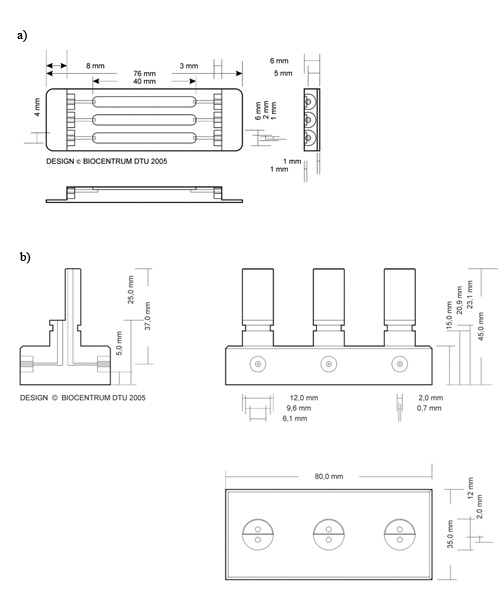
図2。フローセルと気泡のトラップ2の模式図。 )フローセルB)バブルトラップ、DTUシステム生物学の生産に使用されるディメンションの詳細な説明。ジョンワイリー&サンズ社(DTUシステムバイオロジーは、以前のような図に示すように、Biocentrum題された)の許可を得て転載

図3。ガラス基質の結合のためのシリコーンの接着剤のアプリケーションの線のイラスト。指定されたカバーガラスは、フローセルに取り付けるためのシリコーンの接着剤を介して配置されます。
- フローセルを裏返しにして、側を下にスリップカバーを平らな面に置きます。フローセルのベース上にカバースリップをプッシュするフローセルの後ろを軽く押してください。フローセルを裏返しにして、シリコンで密封されていない領域に対して検査します。注射器のハンドル(ピストン)の部分を穏やかに一緒にガラスとフローセルを押すためのツールとして使用することができます。
3。培地ボトル
- 培地ボトルで供給シリコンチューブ(2内径)を配置し、もう一方の端に直線コネクタを挿入します。
- 瓶に培地を加え(培地のコンテンツを"メディア"の段落を参照)
金属箔付きコネクタとボトルをカバーし、培地をオートクレーブ。高圧蒸気滅菌時に培地ボトルやサイホン効果で液面が培地ボトルを空にすることが、上記供給管の端が固定されていることを確認します。
4。バブルトラップ、フローセルとポンプを接続する
図1のアウトラインに従って、すべてのチューブを組み立てます。 Marpreneチューブが適用される蠕動ポンプを通過する部分を除いてシリコンチューブを使用してください。
- すべての個々のフローチャンバーへの培地ボトルからチューブを接続するために、実験に適用される入り江の必要数にチューブを分割する。フィードチューブからポンプでMarpreneチューブに接続管の望ましい数を作るためにT -コネクタを使用します(図1、T -コネクタを参照)。それはシステムの故障の場合にはコンポーネントの識別を容易にするために、一般的にシステム全体の管とフローセルの同じシーケンスの順序を維持することをお勧めします。
- ストレートコネクタを使用してポンプにチューブをMarpreneする個々の栄養チューブ(直径2 mm)を接続します。中間のシリコンチューブ(直径1mm)を経由して泡のトラップ(図2b)にMarpreneチューブを接続します。ポンプが気泡トラップの一番高い部分でのインレットに接続されていることを確認します。
- フローセルのインレット(直径1mm)にバブルトラップの結果として排出管を接続し、これらのチューブの長さは、フローセルを共焦点顕微鏡(通常は1メートル)のステージに移動することを可能にすることを確認してください。
- バブルトラップの上に場所5 mLシリンジ。適当なキャップでトップを閉じます。
- フローセルの出口での短い、約40 mmの片(直径1mm)、チューブを接続し、必要な長さの廃液チューブ(直径2 mm)を添付する"還元"ストレートコネクタを使用してください。廃棄物コンテナに廃棄物のチューブを置きます。
- 重要なことは、廃棄物の容器は常に決してフローセルレベルの下で、フローセルと同じレベルに配置する必要があります。また、廃液チューブの端がフローセルを取り扱う際サイフォン効果によるフラッシュバックを避けるために廃液の期待されるレベルより上に固定されていることを確認します。
5。フローシステムを殺菌、洗濯
- バブルトラップのキャップを取り外し、それらを無菌に保つために70%エタノールの中に置いてください。
- 0.5%(v / v)の水に次亜塩素酸ナトリウムを使用してシステムを埋めるために最高のポンプの速度で動作します。
- バックバブルトラップが完全に埋められたときにバブルトラップのキャップを置きます。
- フローチャンバーに気泡を除去するために、フローセルをタップします。壊れやすいカバーガラスを傷つけないように注意してください。
- システムは、3 mLの/ H /チャネル(0.2 mm / sの線流速)の流量で3〜4時間のために殺菌することができます。
- システムのすべての次亜塩素酸塩を洗い流すために2〜3回洗浄する。滅菌水を使用してシステムを記入し、空にしてください。バブルトラップは、それぞれの洗浄の間に完全に空にする必要があります。これは、バブルトラップが空にされるまで、空気でポンピングすることによって行うことができます。空にした後、システムを再充填する前にバブルトラップからキャップを取り外します。バブルトラップが完全に液体で満たされた後キャップを交換してください。必要に応じて繰り返します。
- 一晩の低流量(1-3 mLの/ H /チャンネル)でシステムを介して滅菌水を実行したり、次のステップに進みます。
- 入口に培地ボトルを接続し、実験が行われる温度で、低流量(3 mLの/ H /チャネル)で一晩培地を使用してシステムをフラッシュします。注:システムは、媒体が充填される前に、バブルトラップが水のために空にする必要があります。
6。フローセルの接種
- 一晩培養液から所望の光学濃度( 緑膿菌などは0.001 OD 600nmの 、0.1 OD 600nmの S.セレビシエのため)に希釈を行う。
- チャンバーを満たすのに十分な接種をロードするために27G針を0.5mLの注射器を使用してください。 250μL(図2。、× 4㎜× 1ミリメートル40ミリメートル)この作業で指定された寸法を有するフローチャンバーには十分です。
- 蠕動ポンプを停止します。
- システムへの逆流を防ぐためにフローセルにつながるシリコンチューブをオフにクランプ。
- 70%エタノールでそれを拭いてシリコンチューブで接種部位を滅菌する。
- シリコンチューブに針を挿入し、フローセルの入口に先端を導入する。ゆっくり(気泡を注入しないように注意してください)チャンバー内に接種を注入する。
- 針を外し、注射部位を介してシリコン接着剤を使用して穴の直接のシールに続いて70%エタノールで注射部位を拭きます。
- フローセルを裏返しにして、微生物がフローセルをフローすることなく1時間基層に付着することができます。
- 、フローセルを回し培地ポンプ(3 mLの/ H /チャンネル)を起動して、シリコンチューブからクランプを取る。
- システムは37℃、インキュベーションのために配置され° CをPの場合には緑膿菌と30 ° Sの場合のC 出芽酵母 。
- フローチャンバー内のバイオフィルムは、現在、CLSM可視化することができる。
7。顕微鏡用バイオフィルムの染色
- 適切な染色の希釈を行う(例えば1:1000 SYTO 9は、S.セレビシエのために染色生きる)
- 蠕動ポンプを停止します。
- フローセルにつながるシリコンチューブをクランプする。
- 70%エタノールでそれを拭いてシリコンチューブで接種部位を滅菌する。
- 室を埋めるのに十分な染色液をロードするために27G針を0.5mLの注射器を使用してください。 250μLはここで使用されるフローチャンバーには十分です。
- シリコンチューブに針を挿入し、フローセルの入口に先端を導入する。ゆっくり(気泡を注入しないように注意してください)チャンバー内に染色液を注入する。
- 針を外し、注射部位の直接のシールに続いて70%エタノールで注射部位を拭きます。
- 15分間流すことなくフローセルにしておきます。
- クランプを外し、(3 mLの/ H /チャンネル)フローを開始
- CLSMでデータを取得する
ディスカッション
我々は、バイオフィルムの調査の強力なツールを表すフロー電池システムを実証している。共焦点顕微鏡による3Dイメージングとの組み合わせにより、システムはより伝統的な顕微鏡技術を用いて微生物のバイオフィルムを分析する他の方法と比較して優位性の範囲を持っています。このシステムは、地域の障害なく微生物のバイオフィルムのコミュニティの生活の3D可視化することができます。光学顕微鏡は、バイオフィルムのニッチについての詳細な情報を提供することはありませんし、電子顕微鏡は、バイオフィルムのナノスケールの分解能を提供しますが、それは、生細胞イメージングを許可しません。
、我々は以前にいくつかの抗生物質5-8(図4a)、細胞外化合物の分布に敏感な細菌細胞の空間的分布を解明している説明に従って流路システムを用いたDNA 9月11日などと、の運動性と非運動性細胞の分布細菌群集4,6,9(図4c)内で同じ種。我々は、フローセルシステムは、酵母のバイオフィルムの側面を研究するために使用できることを想像する。これは、殺菌剤だけでなく、酵母のバイオフィルム形成に関与する遺伝子の同定などの環境要因に応答して、酵母のバイオフィルムの時空間的な分布になることがあります。酵母は、運動性と非運動性の細胞に分化することが知られていないものの、バイオフィルムの多様化の他の側面は、そのような酵母から偽菌糸細胞に形態学的変化と一倍から二倍体細胞へのシフトなどの研究があります。
我々は、いくつかの微生物種を遵守し、いくつかの染色技術で動作するシステムを示している。異なる染色プローブやGFPなどの蛍光タンパク質、様々な、発展途上バイオフィルム内の特定のニッチの調査を有効にして、抗菌剤または他の環境要因の影響を分析する効果的なツールです。得ることができる情報は非常に詳しいです(図4)とバイオフィルムの特徴は、犯罪統計システム12,13のようなコンピュータプログラムを使用して定量することができる。
全体的に、プロトコルの最も重要な側面は、それは時間のかかるプロセスであるという事実である。また、細胞は非蛍光、透明な表面上に成長できるようにするために必要な制限です。このシステムは、経験豊富な研究者として、ハイスループットスクリーニングに適していない。形成されたバイオフィルムは、共焦点顕微鏡、数百ミクロン14に制限されて調査することができる深さを用いて分析されるので、設計に内在するさらなる技術的な制限があります。順番に準備するために数日かかることが実験で、あたりのほとんどの約15チャンネルで扱うことができます。最も興味深いの候補者がフローセルシステムに転送される前に、しかし、バイオフィルムの研究のために適切と見なされている抗生物質や変異体は、当初の質量などのクリスタルバイオレット染色など他の方法でスクリーニングすることができる。カバーガラスのシートは非常に細く、壊れやすい、とシステムを取り扱う際は注意が必要です。さらに、チューブは、実験の実行中に毎日検査されるべきである。フローセルのすぐ上流インレットチューブでかなりの"バック成長"としては、発生する可能性があります。そのような汚染は、無菌操作を使用して、フローセルの入口側からシリコンチューブの数センチを削除すれば解決することができます。

図4)4日目のPAO1 - 。死んだ染色(赤色染色)b)の三日間の3Dプレゼンテーション古いP.用コリスチンおよびヨウ化プロピジウムで24時間の治療を受けてGFPのバイオフィルム緑膿菌 PAO1( 緑膿菌野生型) - GFPバイオフィルムC 6)PAO1の3D画像のプレゼンテーション- PAO1野生型YFP(黄色)DとCFP pilumの複数形変異体(青))5日齢のPAO1 - GFPバイオフィルムは3Dとして提示画像E)26時間S.出芽酵母 (CEN.PKのバックグラウンドでPTR3変異体)SYTO - 9 15で染色したバイオフィルム。
開示事項
資料
- バブルトラップ、ポリエチレン(DTUシステム生物学、デンマーク工科大学、%の20Center/Resources/Biofilm%の20Setup.aspxをhttp://www.csm.bio.dtu.dk/Instrument)
- 透明なポリプロピレンのプラスチックコネクタとT -コネクタ(コールパーマー、1 / 8インチ(3.175ミリメートル)と1 / 16インチ(1.588ミリメートル))
- クランプ
- 共焦点顕微鏡(Zeiss、メタLSM510)
- カバーグラス、ガラス(クニッテルグレイザー)50 × 24ミリメートル
- カバーガラス、PVCカバースリップ(Rinzl)50 × 24ミリメートル
- フローセル、ポリエチレン(DTUシステム生物学、デンマーク工科大学、%の20Center/Resources/Biofilm%の20Setup.aspxをhttp://www.csm.bio.dtu.dk/Instrument
- 培地ボトル(ショット)
- ペリスタルティックポンプ(ワトソン - マーロウ、205S)
- フローシステムやポンプ用のローリングカート
- シリコン接着剤(3Mスーパーシリコーンシーラントクリア)
- シリンジ5mLの(テルモ)
- SYTO 9(Molecular Probes社)
- 針(27G、テルモLU - 100)0.5 mLシリンジ
- 廃棄物コンテナ
チューブ:
- シリコンは3ミリメートル、外径は、1mm内径(オレDich)
- シリコンの4 mm、外径は2mm内径(オレDich)
- Marpreneは3ミリメートル、外径は、1mm内径(ワトソン - マーロウ)
メディアの
| Name | Company | Catalog Number | Comments |
| 緑膿菌の培地 | |||
| A10 | G / L | ||
| (NH 4)2 SO 4 | 2.0 | ||
| のNa 2 HPO 4 X 2H 2 O | 6.0 | ||
| KH 2 PO 4 | 3.0 | ||
| NaClの | 3.0 | ||
| オートクレーブ | |||
| FB | |||
| のMgCl 2 · 6H 2 O | 0.20 | ||
| 1 mLの1 M CaCl 2を | 0.01 | ||
| 100μL/ L微量金属( 緑膿菌 -バイオフィルム用)4 | |||
| オートクレーブ | |||
| 1:10の比率でA10とFBを混ぜる。 | |||
| 所望の濃度に炭素源を追加。 | |||
| S. cerevisiaeの合成完全(SC)培地 | |
| G / L | |
| 硫酸アデニン | 0.02 |
| L -トリプトファン | 0.02 |
| L -ヒスチジンHCL | 0.02 |
| L -アルギニンHCL | 0.04 |
| L -メチオニン | 0.02 |
| L -チロシン | 0.05 |
| L -ロイシン | 0.06 |
| L -イソロイシン | 0.06 |
| L -リジンHCL | 0.05 |
| L -フェニルアラニン | 0.05 |
| L -アスパラギン酸 | 0.10 |
| L -グルタミン酸 | 0.10 |
| L -バリン | 0.15 |
| L -トレオニン | 0.20 |
| L -セリン | 0.40 |
| 酵母NITロゲンベースW / Oアミノ酸とアンモニウム(バクト) | 1.6 |
| 硫酸アンモニウム | 5.0 |
| NaOHで | 6.0 |
| コハク酸 | 10.0 |
| オートクレーブ | |
| グルコース(別々にオートクレーブ処理) | 0.20 |
参考文献
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Sternberg, C., Tolker-Nielsen, T. Growing and analyzing biofilms in flow cells. Curr Protoc Microbiol. Chapter 1, 2-2 (2006).
- Heydorn, A. Experimental reproducibility in flow-chamber biofilms. Microbiology. 146, 2409-2415 (2000).
- Pamp, S. J., Tolker-Nielsen, T. Multiple roles of biosurfactants in structural biofilm development by Pseudomonas aeruginosa. J Bacteriol. 189, 2531-2539 (2007).
- Haagensen, J. A. Differentiation and distribution of colistin- and sodium dodecyl sulfate-tolerant cells in Pseudomonas aeruginosa biofilms. J Bacteriol. 189, 28-37 (2007).
- Klausen, M., Aaes-Jorgensen, A., Molin, S., Tolker-Nielsen, T. Involvement of bacterial migration in the development of complex multicellular structures in Pseudomonas aeruginosa biofilms. Mol Microbiol. 50, 61-68 (2003).
- Pamp, S. J., Gjermansen, M., Johansen, H. K., Tolker-Nielsen, T. Tolerance to the antimicrobial peptide colistin in Pseudomonas aeruginosa biofilms is linked to metabolically active cells, and depends on the pmr and mexAB-oprM genes. Mol Microbiol. 68, 223-240 (2008).
- Pamp, S. J., Sternberg, C., Tolker-Nielsen, T. Insight into the microbial multicellular lifestyle via flow-cell technology and confocal microscopy. Cytometry Part A. 75A, 90-103 (2009).
- Barken, K. B. Roles of type IV pili, flagellum-mediated motility and extracellular DNA in the formation of mature multicellular structures in Pseudomonas aeruginosa biofilms. Environ Microbiol. 10, 2331-2343 (2008).
- Qin, Z. Role of autolysin-mediated DNA release in biofilm formation of Staphylococcus epidermidis. Microbiology. 153, 2083-2092 (2007).
- Allesen-Holm, M. A characterization of DNA release in Pseudomonas aeruginosa cultures and biofilms. Mol Microbiol. 59, 1114-1128 (2006).
- Heydorn, A. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146, 2395-2407 (2000).
- COMSTAT2, a semi-automated java-based quantification program for the analysis of microbial biofilms [Internet]. , Available from: http://www.comstat.dk/ (2010).
- Palmer, R. J., Haagensen, J. A., Neu, T. R., Sternberg, C. Handbook of Biological Confocal Microscopy. Palmer, J. B. , Springer. 882-900 (2006).
- Haagensen, J. A., Regenberg, B., Sternberg, C. High Resolution Microbial Single Cell Analytics Advances in Biochemical Engineering and Biotechnology. Müller, S., Bley, T. , Springer. (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved