Method Article
والزائفة الزنجارية السكيراء بيوفيلم في خلايا خميرة تدفق
In This Article
Summary
بروتوكول يصف تطبيق نظام تدفق لزراعة الخلايا والأغشية الحيوية الميكروبية تحليل ليزر متحد البؤر المجهر الضوئي (CLSM).
Abstract
العديد من الخلايا الجرثومية لديهم القدرة على تكوين المجتمعات الميكروبية لاطئة على النحو المحدد الأغشية الحيوية التي غيرت الخصائص الفيزيولوجية المرضية ومقارنة الكائنات الحية المجهرية الحرة. الأغشية الحيوية في الطبيعة وغالبا ما يصعب التحقيق فيها ويقيمون في ظل ظروف سيئة تعريف 1. باستخدام التحتية شفافة فمن الممكن أن الجهاز نظام حيث يمكن فحص بسيط الأغشية الحيوية بطريقة غير المدمرة في الوقت الحقيقي : نحن هنا لشرح تجميع وتشغيل نموذج نظام تدفق الخلية ، لفي الدراسات 3D المختبر من الأغشية الحيوية الميكروبية توليد استنساخ عالية في ظل ظروف محددة جيدا 2،3.
ويتكون النظام من خلية تدفق التي هي بمثابة حجرة النمو للبيوفيلم. ويتم تزويد الخلية مع تدفق المواد الغذائية والأكسجين من قارورة المتوسطة عن طريق مضخة تمعجية والمتوسطة التي يتم جمعها في وعاء قضى النفايات. هذا البناء للنظام يسمح تدفق إمدادات مستمرة من المواد الغذائية والإدارة من المضادات الحيوية مثل اضطراب مع الحد الأدنى من الخلايا المزروعة في غرفة التدفق. وعلاوة على ذلك ، فإن ظروف تدفق داخل الخلية تدفق تسمح دراسات بيوفيلم تتعرض لإجهاد القص. فقاعة محاصرة فقاعات الهواء حدود الجهاز من الأنابيب التي على خلاف ذلك قد يعطل هيكل بيوفيلم في الخلية التدفق.
نظام تدفق الخلية متوافق مع ليزر متحد البؤر المجهر الضوئي (CLSM) ، ويمكن بالتالي توفير المعلومات 3D مفصلة للغاية حول تطوير الأغشية الحيوية الميكروبية. ويمكن تسمية الخلايا في بيوفيلم مع تحقيقات أو البروتينات الفلورية متوافق مع تحليل CLSM. هذا التصور يمكن على الانترنت ويسمح التحقيق في محاريب في بيوفيلم النامية. الترابط الميكروبية ، والتحقيق في العوامل المضادة للجراثيم أو التعبير عن جينات محددة ، هي من الاجهزة التجريبية العديدة التي يمكن أن يتم التحقيق في تدفق نظام الخلية.
Protocol
1. التجمع من تدفق النظام الخليوي مع جميع مكونات
نظام تدفق تجميعها ويشمل : أنابيب autoclavable والفخاخ فقاعة ، وزجاجة المتوسطة / النفايات وخلايا تدفق كما هو مبين في الشكل 1. ويمكن إعادة استخدام جميع هذه الأجزاء بين التجارب.
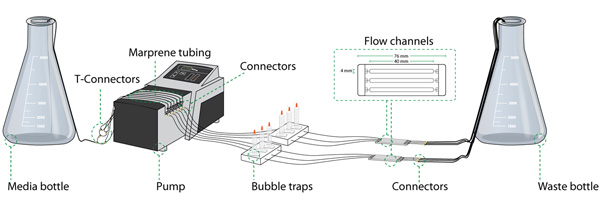
الشكل 1. الإعداد لنظام خلية تدفق (المكونات الأساسية من الإعداد). نظام تدفق خلية تتكون من عدة عناصر : زجاجة المتوسطة ومضخة تمعجية ، والفخاخ فقاعة ، الخلية التدفق ، وزجاجة من النفايات ، ومختلف القطاعات من الأنابيب المترابطة بواسطة الروابط المختلفة. الرقم المقدم من قبل تتكرم Lyngklip رون.
2. جمعية خلية تدفق
- يتم التعامل مع تدفق الخلية (الشكل 2A) مع ممرات رقيقة من السيليكون الغراء ، وذلك باستخدام المحاقن (الشكل 3).
- مكان زلة تغطية على رأس خطوط سيليكون (الشكل 3). وتستخدم ينزلق الغطاء الزجاجي كما التحتية للP. الزنجارية بينما يتم تطبيق زلات لتغطية البلاستيكية S. الجعوية بيوفيلم.
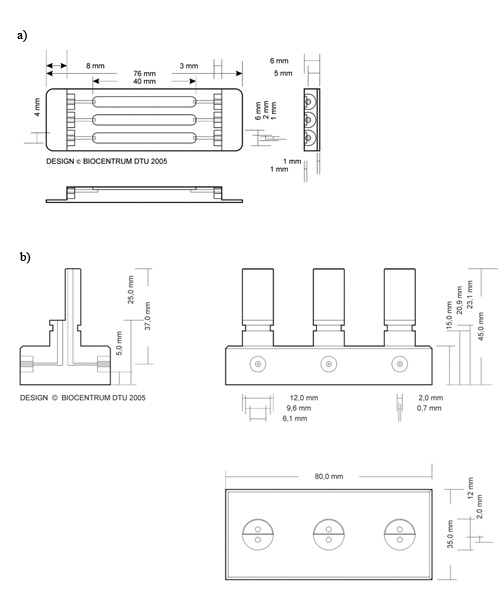
الشكل 2. رسم تخطيطي لخلية تدفق وفخ فقاعة 2. وصف تفصيلي للأبعاد المستخدمة لإنتاج فخ التدفق) فقاعة الخلية ب) ، DTU بيولوجيا الأنظمة. طبع بإذن من جون وايلي وأولاده المحدودة ، (وكان عنوانه سابقا DTU Biocentrum بيولوجيا الأنظمة ، كما هو مبين في الشكل)

الشكل 3. توضيحات من خطوط سيليكون تطبيق الغراء لتعلق التحتية الزجاج. يتم وضع غطاء من الزجاج وأشار خلال الغراء سيليكون لإرفاقه الخلية التدفق.
- بدوره الخلية تدفق أكثر من وضعه على سطح مستو مع تغطية الجانب الانزلاق إلى أسفل. اضغط برفق على الجزء الخلفي للخلية تدفق لدفع زلة تغطية على قاعدة الخلية التدفق. بدوره على تدفق الخلية وتفتيش للمناطق التي لا مختومة بختم السيليكون. ويمكن استخدام مقبض (مكبس) جزءا من حقنة كأداة للضغط برفق الخلية الزجاجية وتدفق معا.
3. زجاجة المتوسطة
- وضع أنبوب السيليكون التغذية (2 مم الداخلية) في زجاجة والمتوسطة وإدراج رابط مباشرة في الطرف الآخر.
- إضافة إلى الزجاجة المتوسطة (انظر المتوسطة للمحتوى "وسائل الاعلام" الفقرة)
موصل غطاء الزجاجة وبرقائق معدنية والأوتوكلاف المتوسط. قد تأكد من أن يتم إصلاح نهاية أنبوب إمداد فوق مستوى السائل في زجاجة المتوسطة أو تأثير سيفون الزجاجة الفارغة المتوسطة عند التعقيم.
4. ربط فقاعة خلية فخ التدفق ، ومضخة
تجميع كل الأنابيب وفقا للمخطط في الشكل 1. استخدام أنابيب من السيليكون ، باستثناء الجزء الذي يمر عبر مضخة تمعجية حيث يتم تطبيق أنابيب Marprene.
- من أجل توصيل أنبوب من الزجاجة المتوسطة لجميع غرف تدفق الفردية ، وتقسيم أنبوب إلى العدد المطلوب من المنافذ التي طبقت في التجربة. استخدام T - الموصلات لجعل عدد مرغوب فيه من أنابيب اتصال من أنبوب تغذية للأنابيب Marprene في مضخة (انظر الشكل 1 ، T - الموصل). ومن المسلم به عموما فكرة جيدة للحفاظ على النظام نفس تسلسل الأنابيب وتدفق الخلايا في جميع أنحاء النظام ، لتسهيل التعرف على المكونات في حالة من الخلل في النظام.
- ربط كل أنبوب تغذية الفردية (2 مليمتر في القطر) لMarprene الأنابيب في المضخة باستخدام موصلات مستقيمة. توصيل أنابيب Marprene إلى فخ فقاعة (الشكل 2B) عبر أنبوب السيليكون الوسيطة (1 مليمتر في القطر). تأكد من أن يتم توصيل المضخة إلى مدخل على أطول جزء من فخ الفقاعة.
- توصيل أنبوب مخرج الناتجة من الفخاخ فقاعة لتدفق مدخل الخلية (1 مليمتر في القطر) ، تأكد من أن طول هذه الأنابيب يسمح بنقل خلية تدفق إلى مرحلة المجهر مبائر (عادة 1 م).
- مكان الحقن 5 مل على رأس الفخاخ الفقاعة. وثيق مع قمم القبعات مناسبة.
- على تدفق منفذ توصيل الخلية باختصار ، ما يقرب من 40 ملم قطعة من (1 مليمتر في القطر) ، وأنابيب واستخدام "خفض" موصل مباشرة إلى نعلق أنبوب النفايات (2 مم في القطر) بطول الحاجة. مكان أنابيب النفايات في حاوية النفايات.
- الأهم ، يجب دائما أن تكون حاوية النفايات وضعها في نفس مستوى تدفق الخلايا ، أبدا دون تدفق الخلايا المستوى. أيضا ، تأكد من أن يتم إصلاح في نهاية أنابيب النفايات فوق المستوى المتوقع من النفايات السائلة لتجنب تدفق الى الوراء بسبب تأثير سيفون عند التعامل مع تدفق الخلايا.
5. تعقيم وغسل نظام تدفق
- إزالة القبعات فخ فقاعة ووضعها في الإيثانول 70 ٪ لإبقائها عقيمة.
- يعمل بسرعة أعلى مضخة لملء النظام مع 0.5 ٪ (V / V) هيبوكلوريت الصوديوم في المياه
- وضع القبعات فخ فقاعة الخلف على عندما تمتلئ تماما الفخاخ الفقاعة.
- الاستفادة من تدفق لإزالة الخلايا فقاعات في غرفة التدفق. الحرص على عدم الاضرار الزجاج غطاء هشا.
- يسمح هذا النظام لتعقيم لح 3-4 في معدل التدفق من 3 مل / ح / قناة (0.2 مم / ثانية معدل التدفق الخطية).
- يغسل النظام 2-3 مرات لغسل كل هيبوكلوريت. ملء وتفريغ النظام مع الماء المعقم. يجب أن تفرغ تماما فقاعة الفخاخ بين كل غسل. ويمكن القيام بذلك عن طريق الضخ في الهواء حتى يتم تفريغ الفخاخ الفقاعة. بعد تفريغ وإزالة الحدود القصوى من الفخاخ فقاعة قبل إعادة تعبئتها النظام. استبدال قبعات بعد الفخاخ فقاعة مملوءة تماما مع السائل. كرر كما هو مطلوب.
- تشغيل المياه المعقمة من خلال النظام في معدل تدفق منخفض (1-3 مل / ح / القناة) خلال الليل أو الانتقال إلى الخطوة التالية.
- الاتصال الزجاجة المتوسطة على مدخل ومطاردة النظام مع أكثر من ليلة المتوسطة في معدل تدفق منخفض (3 مل / ح / القناة) في درجة الحرارة ، حيث سيتم تنفيذ التجربة. ملاحظة : يجب إفراغ فقاعة الفخاخ للمياه قبل ملء النظام مع المتوسط.
6. تلقيح من CELL FLOW
- بين عشية وضحاها من ثقافة إلى جعل تخفيف كثافة ضوئية المطلوب (على سبيل المثال لالزنجارية P. OD ل 600Nm 0.001 و 0.1 OD ل 600Nm للخميرة س).
- استخدام حقنة 0.5 مل مع إبرة 27G لتحميل قيحة ما يكفي لملء الغرفة. 250 ميكرولتر كافية لغرف تدفق جود أبعاد المحددة في هذا العمل (الشكل 2. و 40 ملم x 4 مم × 1 مم).
- وقف ضخ تمعجية.
- المشبك قبالة أنابيب السيليكون مما أدى إلى تدفق الخلية لمنع تدفق الظهر في النظام.
- تعقيم الموقع على التلقيح بواسطة أنبوب السيليكون المسح مع الايثانول 70 ٪.
- ادخال الإبرة في أنبوب السيليكون وإدخال طرف في مدخل الخلية التدفق. حقن اللقاح ببطء الى غرفة (يجب الحرص على عدم ضخ فقاعات الهواء).
- إزالة الإبرة ويمسح مكان الحقن مع الايثانول 70 ٪ تليها الختم على الفور ثقب سيليكون باستخدام الغراء على موقع الحقن.
- بدوره على تدفق الخلية ، والسماح للالكائنات الدقيقة التمسك التحتية لمدة 1 ساعة دون تدفق من خلال الخلية التدفق.
- بدوره الخلية التدفق ، وبدء ضخ المتوسطة (3 مل / ح / قناة) واتخاذ المشبك قبالة أنبوب السيليكون.
- يتم وضع نظام للحضانة ، على 37 درجة مئوية في حالة P. الزنجارية و 30 درجة مئوية في حالة س. خميرة.
- يمكن بيوفيلم في غرف تدفق تكون الآن تصور عن طريق CLSM.
7. تلون بيوفيلم للفحص المجهري
- جعل التخفيف من تلطيخ المناسب (على سبيل المثال 1:1000 Syto 9 يعيش وصمة عار للخميرة س.)
- وقف ضخ تمعجية.
- المشبك لانابيب سيليكون المؤدية إلى الخلية التدفق.
- تعقيم موقع التلقيح في الأنبوب سيليكون بواسطة المسح مع الايثانول 70 ٪.
- استخدام حقنة 0.5 مل مع إبرة 27G لتحميل ما يكفي لملء حل تلوين الغرفة. 250 ميكرولتر كافية لغرف تدفق المستخدمة هنا.
- ادخال الإبرة في أنبوب السيليكون وإدخال طرف في مدخل الخلية التدفق. حقن ببطء الحل تلطيخ في الغرفة (يجب الحرص على عدم ضخ فقاعات).
- إزالة الإبرة ويمسح مكان الحقن مع الايثانول 70 ٪ تليها الختم على الفور في موقع الحقن.
- ترك الخلية دون تدفق تدفق لمدة 15 دقيقة.
- خلع المشبك وبدء تدفق (3 مل / ح / قناة)
- الحصول على البيانات مع CLSM
Discussion
لقد أثبتنا نظام تدفق الخلية ، التي تمثل أداة قوية في التحقيقات بيوفيلم. جنبا إلى جنب مع التصوير 3D بواسطة الفحص المجهري متحد البؤر ، ونظام لديها مجموعة من المزايا بالمقارنة مع غيرها من أساليب تحليل الأغشية الحيوية الميكروبية عن طريق التقنيات المجهرية أكثر تقليدية. هذا النظام يسمح التصور 3D معيشة المجتمعات بيوفيلم الجرثومية دون اضطراب في المجتمع. وسوف المجهر الضوئي لم تقدم معلومات مفصلة حول منافذ للبيوفيلم وبينما يوفر القرار المجهر الإلكتروني النانو من بيوفيلم ، فإنه لا يسمح يعيش التصوير الخلية.
استخدام قناة تدفق وصف النظام لدينا سابقا توضيح التوزيع المكاني للالخلايا البكتيرية للمضادات الحيوية الحساسة عدة 5-8 (الشكل 4A) ، وتوزيع المركبات خارج الخلية ، مثل الحمض النووي 11/09 ، وتوزيع خلايا متحركة وغير متحركة ، من نفس النوع داخل المجتمع البكتيرية 4،6،9 (الشكل 4C). ونحن نتصور أنه يمكن استخدام نظام تدفق خلية لدراسة جوانب من الأغشية الحيوية الخميرة. قد يكون هذا التوزيع المكانية الزمانية للبيوفيلم الخميرة استجابة لعوامل بيئية مثل الفطريات ، وكذلك التعرف على الجينات المسؤولة عن التنمية بيوفيلم الخميرة. رغم أنها ليست معروفة الخميرة على التمايز إلى خلايا متحركة وغير متحركة ، قد جوانب أخرى من تنويع بيوفيلم أن مثل هذه الدراسات حيث أن التحول المورفولوجي لخلايا الخميرة من الكاذبة ، والتحول إلى خلايا من فرداني ضعفاني.
لقد أظهرنا النظام الذي يتوافق مع العديد من الأنواع الميكروبية ، وسوف تعمل مع عدة تقنيات التلوين. مجموعة متنوعة من تلطيخ تحقيقات مختلفة والبروتينات الفلورية ، مثل GFP ، تمكين التحقيقات مكانة معينة في بيوفيلم النامية وأداة فعالة في تحليل تأثير العوامل المضادة للميكروبات أو عوامل بيئية أخرى. المعلومات التي يمكن الحصول عليها هو مفصل جدا (الشكل 4) ، ويمكن أن يكون كميا الميزات في بيوفيلم مع برامج الكمبيوتر مثل COMSTAT 12،13.
عموما ، فإن الجانب الأكثر أهمية من البروتوكول هو حقيقة أنها هي عملية تستغرق وقتا طويلا. بل هو أيضا وجود قيود على الخلايا التي تحتاج إلى أن تكون قادرة على النمو على سطح غير الفلورسنت شفافة. . منذ يتم تحليل بيوفيلم تشكيلها باستخدام المجهر متحد البؤر ، وعمق التحقيق التي يمكن أن يقتصر على بضع مئات ميكرومتر 14 هناك مزيد من القيود التقنية المتأصلة في التصميم : ليست مناسبة لنظام الفرز إنتاجية عالية ، وخبرة الباحث يمكن التعامل في معظم القنوات نحو 15 في التجربة ، والتي بدورها يمكن أن تستغرق عدة أيام للاستعداد. ومع ذلك ، يمكن للمضادات الحيوية أو المسوخ التي تعتبر ذات صلة للدراسات بيوفيلم في البداية فحص شامل لأساليب أخرى مثل تلطيخ البنفسجي الكريستال قبل أن يتم نقل المرشحين الأكثر إثارة للاهتمام لتدفق نظام الخلية. الأوراق والزجاج غطاء هي رقيقة جدا وكسر بسهولة ، وينبغي توخي الحذر عند التعامل مع النظم. وينبغي أن تدرس بالإضافة الأنبوب اليومية خلال تشغيل للتجربة ، لأن قدرا كبيرا من "العودة الى تحقيق النمو" في أنابيب مدخل المنبع فقط من الخلايا يمكن أن يحدث تدفق. يمكن حلها عن طريق إزالة هذا التلوث عدة سنتيمترات من أنبوب السيليكون من الجانب مدخل تدفق الخلايا ، وذلك باستخدام تقنية معقمة.

الرقم 4 (أ) PAO1) 4 ايام العمر -- GFP بيوفيلم للتعامل مع 24H كوليستين ويوديد Propidium لتلطيخ القتلى (الأحمر وصمة عار) ب) العرض 3D لمدة ثلاثة أيام P. القديمة PAO1 الزنجارية (P. الزنجارية نوع البرية) -- GFP بيوفيلم 6 ج) 3D عرض صورة لPAO1 -- بيلا CFP متحولة (الأزرق) مع YFP PAO1 نوع البرية (الصفراء) د) 5 ايام PAO1 القديمة -- GFP بيوفيلم قدمت بوصفها 3D ه صورة) 26 ح س. البيرة (PTR3 متحولة في الخلفية CEN.PK) بيوفيلم ملطخة Syto - 9 15.
Disclosures
Materials
- فقاعة الفخاخ والبولي ايثلين (DTU بيولوجيا الأنظمة والتقنية جامعة الدنمارك ، http://www.csm.bio.dtu.dk/Instrument 20Setup.aspx 20Center/Resources/Biofilm ٪)
- واضح الموصلات البلاستيكية من البولي بروبلين وT - الموصلات (كول Parmer ، 1 / 8 بوصة (3.175 ملم) و 1 / 16 بوصة (1.588 ملم))
- المشابك
- مبائر المجهر (زايس ، وميتا LSM510)
- Coverslips والزجاج (Knittel جلاسر) 50 × 24 مم
- Coverslips ، بولي كلوريد الفينيل coverslips (Rinzl) 50 × 24 مم
- تدفق الخلايا والبولي ايثلين (DTU بيولوجيا الأنظمة والتقنية جامعة الدنمارك ، http://www.csm.bio.dtu.dk/Instrument 20Setup.aspx ٪ 20Center/Resources/Biofilm
- متوسطة الزجاجات (شوت)
- مضخة تمعجية (واطسون ، مارلو ، 205S)
- المتداول السلة للنظم ومضخات التدفق
- سيليكون الغراء (3M سيليكون مانع التسرب السوبر واضح)
- حقنة 5 مل (Terumo)
- Syto 9 (المسابر الجزيئية)
- 0.5 مل المحاقن مع الإبر (27G ، Terumo LU - 100)
- حاوية النفايات
أنابيب :
- السيليكون ، 3 مم الخارجي ، 1 مم الداخلية (أولي ديتش)
- سيليكون ، 4 القطر الخارجي ملم ، 2 ملم القطر الداخلي (OLE ديتش)
- Marprene ، 3 مم الخارجي ، 1 مم الداخلية (واطسون ، مارلو)
وسائل الاعلام
| Name | Company | Catalog Number | Comments |
| P. الزنجارية المتوسطة | |||
| A10 | ز / L | ||
| (NH 4) 2 SO4 | 2.0 | ||
| غ 2 هبو 4 X 2H 2 O | 6.0 | ||
| KH 2 PO 4 | 3.0 | ||
| كلوريد الصوديوم | 3.0 | ||
| الأوتوكلاف | |||
| FB | |||
| MgCl 2 6H 2 O | 0.20 | ||
| 1 مل 1 م 2 CaCl | 0.01 | ||
| 100 المعادن تتبع ميكرولتر / L (على الأغشية الحيوية ، P. الزنجارية) 4 | |||
| الأوتوكلاف | |||
| مزيج وFB A10 في نسبة 1:10. | |||
| مصدر الكربون إضافة إلى التركيز المطلوب. | |||
| S. الجعوية الاصطناعية كاملة (SC) المتوسطة | |
| ز / L | |
| سلفات الأدينين | 0.02 |
| L - التربتوفان | 0.02 |
| L - هيستيدين - HCL | 0.02 |
| L - أرجينين - HCL | 0.04 |
| L - ميثيونين | 0.02 |
| L - التيروزين | 0.05 |
| L - يسين | 0.06 |
| L - آيسولوسين | 0.06 |
| L - يسين - HCL | 0.05 |
| L - فينيلالاناين | 0.05 |
| L - حمض الأسبارتيك | 0.10 |
| L - حمض الغلوتاميك | 0.10 |
| L - حمض أميني أساسي | 0.15 |
| L - ثريونين | 0.20 |
| L - سيرين | 0.40 |
| الخميرة الصأبةروجين قاعدة ث / س الأحماض الأمينية والأمونيا (Bacto) | 1.6 |
| كبريتات الامونيوم | 5.0 |
| هيدروكسيد الصوديوم | 6.0 |
| حمض السكسينيك | 10.0 |
| الأوتوكلاف | |
| الجلوكوز (تعقيمها بشكل منفصل) | 0.20 |
References
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Sternberg, C., Tolker-Nielsen, T. Growing and analyzing biofilms in flow cells. Curr Protoc Microbiol. Chapter 1, 2-2 (2006).
- Heydorn, A. Experimental reproducibility in flow-chamber biofilms. Microbiology. 146, 2409-2415 (2000).
- Pamp, S. J., Tolker-Nielsen, T. Multiple roles of biosurfactants in structural biofilm development by Pseudomonas aeruginosa. J Bacteriol. 189, 2531-2539 (2007).
- Haagensen, J. A. Differentiation and distribution of colistin- and sodium dodecyl sulfate-tolerant cells in Pseudomonas aeruginosa biofilms. J Bacteriol. 189, 28-37 (2007).
- Klausen, M., Aaes-Jorgensen, A., Molin, S., Tolker-Nielsen, T. Involvement of bacterial migration in the development of complex multicellular structures in Pseudomonas aeruginosa biofilms. Mol Microbiol. 50, 61-68 (2003).
- Pamp, S. J., Gjermansen, M., Johansen, H. K., Tolker-Nielsen, T. Tolerance to the antimicrobial peptide colistin in Pseudomonas aeruginosa biofilms is linked to metabolically active cells, and depends on the pmr and mexAB-oprM genes. Mol Microbiol. 68, 223-240 (2008).
- Pamp, S. J., Sternberg, C., Tolker-Nielsen, T. Insight into the microbial multicellular lifestyle via flow-cell technology and confocal microscopy. Cytometry Part A. 75A, 90-103 (2009).
- Barken, K. B. Roles of type IV pili, flagellum-mediated motility and extracellular DNA in the formation of mature multicellular structures in Pseudomonas aeruginosa biofilms. Environ Microbiol. 10, 2331-2343 (2008).
- Qin, Z. Role of autolysin-mediated DNA release in biofilm formation of Staphylococcus epidermidis. Microbiology. 153, 2083-2092 (2007).
- Allesen-Holm, M. A characterization of DNA release in Pseudomonas aeruginosa cultures and biofilms. Mol Microbiol. 59, 1114-1128 (2006).
- Heydorn, A. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146, 2395-2407 (2000).
- COMSTAT2, a semi-automated java-based quantification program for the analysis of microbial biofilms [Internet]. , Available from: http://www.comstat.dk/ (2010).
- Palmer, R. J., Haagensen, J. A., Neu, T. R., Sternberg, C. Handbook of Biological Confocal Microscopy. Palmer, J. B. , Springer. 882-900 (2006).
- Haagensen, J. A., Regenberg, B., Sternberg, C. High Resolution Microbial Single Cell Analytics Advances in Biochemical Engineering and Biotechnology. Müller, S., Bley, T. , Springer. (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved