Method Article
В естественных условиях Мониторинг транскрипционной активности при метаболическом переходе с помощью биолюминесцентного репортера у дрожжей
В этой статье
Резюме
В этом протоколе используется биолюминесцентный репортер, позволяющий измерять транскрипционную активность у Saccharomyces eubayanus для мониторинга перехода от глюкозы к мальтозе, что позволяет анализировать метаболические адаптации в режиме реального времени и поддерживает оптимизацию штамма для промышленной ферментации в различных условиях.
Аннотация
Последовательное потребление сахара, от предпочтительного источника сахара к менее предпочтительному, представляет собой критическую метаболическую адаптацию дрожжей, которая особенно важна для выживания в колеблющихся средах, таких как те, которые обнаруживаются при брожении пива. Тем не менее, переход сахара — это переменная окружающей среды, которую сложно предсказать и обнаружить, что влияет на исход брожения пива. Этот протокол описывает систему in vivo для мониторинга активации транскрипции, связанной с метаболическим сдвигом глюкозы в мальтозу у Saccharomyces eubayanus , который применяется к различным диким штаммам дрожжей Saccharomyces .
Система использует эписомальный биолюминесцентный транскрипционный репортер для метаболизма мальтозы, фокусируясь на MAL32, поскольку он обеспечивает хорошее считывание метаболических сдвигов, изученных у S. cerevisiae. Для этого штаммы дрожжей трансформировали с помощью плазмид, содержащих регуляторную область MAL32 от S. eubayanus, контролирующую экспрессию гена, кодирующего дестабилизированную версию люциферазы светлячка1, и гена устойчивости к гигромицину, используемого исключительно во время трансформации для обеспечения приобретения плазмид. После отбора трансформированные дрожжевые клетки могут быть культивированы в неселективных условиях, так как эписомальная плазмида остается стабильной в условиях культивирования до 7 дней.
Эта система была валидирована в сложной сахарной среде в анализах микроферментации, подтвердив эффективность репортера люциферазы в информировании метаболических переходов. Образцы регулярно собирали и анализировали с помощью люминометра, что обеспечивало непрерывное понимание реакции дрожжей. Несмотря на широкое применение, этот протокол особенно ценен для оценки производительности дрожжей в условиях брожения, где метаболические изменения представляют собой значительную проблему. Кроме того, эта методология может быть адаптирована путем выбора альтернативных промоторов для изучения более широкого спектра реакций на изменения окружающей среды, что позволяет характеризировать и оптимизировать штаммы диких дрожжей для различных промышленных применений.
Введение
Микроорганизмы, такие как дрожжи, должны постоянно адаптироваться к динамическим условиям окружающей среды, чтобы поддерживать физическую форму и выживать1. Эти адаптации часто включают в себя сложные генные регуляторные цепи, интегрирующие множественные внеклеточные сигналы для организации точных метаболических реакций 2,3. В промышленных условиях эффективность этих метаболических переходов имеет решающее значение, особенно в процессах ферментации, где сбои могут привести к неоптимальным выходам или незавершенной ферментации3. Ключевой метаболической проблемой, которую необходимо преодолеть, является переход клеток от предпочтительного к вторичному источнику углерода, например, сдвиг глюкозы в мальтозу. Этот процесс вводит фазу задержки, во время которой гены, необходимые для метаболизма вторичных источников углерода, подавляются, что позволяет возобновитьрост4,5.
В пивоварении дрожжи Saccharomyces должны эффективно переходить от метаболизма глюкозы к метаболизму мальтозы. В частности, S. eubayanus, холодоустойчивый родительский вид лагерных дрожжей, демонстрирует существенную фенотипическую изменчивость в своей способности приспосабливаться к таким переходам6. Дикие изоляты, такие как изоляты из Патагонии, часто демонстрируют более длительные фазы задержки и более медленное потребление мальтозы по сравнению с одомашненными сортами, которые были отобраны за их оптимизированные ферментативные способности 7,8. В то время как одомашненные штаммы адаптировались к эффективной ферментации в смешанной сахарной среде, дикие штаммы часто демонстрируют более медленный метаболический переход, потенциально из-за более сильного подавления глюкозы и вариабельной регуляции локуса MAL 6,9.
В этом исследовании используется естественная изменчивость S. eubayanus в качестве модели для изучения метаболических адаптаций в условиях глюкозо-мальтозы, используя эписомальный дестабилизированный репортер люциферазы для мониторинга экспрессии генов in vivo путем отслеживания люминесценции1. Выбранный репортер MAL32 кодирует белок мальтазу, ключевой фермент для катаболизма мальтозы во время переходов от глюкозы к мальтозе10,11. Примечательно, что промотор MAL32 представляет собой успешный маркер для оценки индукции метаболизма мальтозы послеистощения глюкозы. Внедрив эту систему отчетности, мы стремились выяснить специфические для штамма адаптивные механизмы и определить потенциальные цели для оптимизации производительности ферментации. Кроме того, этот протокол может быть расширен за пределы пивоварения, предлагая применение в биотехнологиях и экологических исследованиях, где сложные сахарные среды играют значительную роль. Понимание генетических и регуляторных детерминант флуктуантных реакций окружающей среды у S. eubayanus расширяет наши знания в области физиологии дрожжей, способствуя разработке надежных штаммов для различных промышленных и исследовательских применений.
протокол
1. Построение эпизодических репортеров
ПРИМЕЧАНИЕ: Мы выбрали репортерную регуляторную область на основе дрожжевой литературы для построения эписомальной плазмиды для мониторинга потребления мальтозы 6,11,12. Промотор гена-репортера-кандидата определяли как регуляторную последовательность, находящуюся непосредственно перед кандидатом ORF до нуклеотида, фланкирующего соседний ORF вверх по потоку. Этот участок был амплифицирован из геномной ДНК S. eubayanus CBS12357 референсного штаммаT 10. Такой подход обеспечивает высокоточное конструирование эписомальных плазмид, пригодных для последующих применений, включая изучение других интересных условий в дрожжах.
- Спроектируйте фрагменты ДНК и перекрывающиеся праймеры таким образом, чтобы они включали 30 нуклеотидных парных последовательностей между фрагментами для бесшовной сборки с помощью рекомбинационного клонирования дрожжей13 (рис. 1). Последовательности праймеров см. в Дополнительной таблице S1 .
- Чтобы избежать мутаций, амплифицируйте промоторную область (см. выше), а также дестабилизированную люциферазу (LUC-PEST) и кассеты hphMX 1 с помощью высокоточной ДНК-полимеразы (подробности протокола см. у производителя полимеразы). Установите термоамплификатор на 98 °C на 10 минут для начальной денатурации, затем 30 циклов денатурации при 98 °C, отжига при 60 °C и удлинения при 72 °C; завершите протокол окончательным продлением при температуре 72 °C в течение 10 минут.
ПРИМЕЧАНИЕ: При использовании дрожжевых челночных плазмид в качестве матриц для ПЦР рекомендуется подвергать ампликонные реакции перевариванию DpnI (см. протокол производителя фермента) для устранения любых следов матричной плазмиды, которые могут препятствовать трансформации дрожжей. - Расщепите остов pRS426 плазмиды14 с помощью ферментов рестрикции EcoRI и XhoI, чтобы линеаризировать вектор, разрезая его в месте множественного клонирования, и подготовить его к рекомбинации (см. протокол производителя фермента).
- Смешайте линеаризованный остов pRS426 с амплифицированными фрагментами ДНК и преобразуйте смесь в Saccharomyces cerevisiae BY4741 с использованием дрожжевого рекомбинационного клонирования13,15, чтобы позволить гомологичному рекомбинационному механизму дрожжей собрать плазмидную конструкцию in vivo.
- Пластинировать трансформированные дрожжи на синтетическую полную (SC) среду без урацила (SC-URA) для выбора ауксотрофных трансформантов, содержащих новую сконструированную векторную плазмиду pRS426-MAL32-LUC-hphMX.
- Извлеките плазмиды из дрожжей с помощью набора для мини-подготовки дрожжей в соответствии с инструкциями производителя и преобразуйте извлеченную плазмиду в Escherichia coli DH5α для амплификации конструкции для дальнейших анализов.
- Проведите скрининг бактериальных колоний с помощью ПЦР, чтобы подтвердить правильность сборки конструкций.
- Очистите плазмидную ДНК с помощью стандартного набора для очистки плазмид и выполните секвенирование по Сэнгеру для проверки целостности и последовательности собранных плазмид.
2. Трансформация штаммов дрожжей
ПРИМЕЧАНИЕ: Протокол трансформации дрожжей был адаптирован из ранее разработанного метода для S. eubayanus16 и успешно применен к другим видам Saccharomyces и ферментативным штаммам дрожжей. Этот протокол был получен на основе традиционного метода трансформации дрожжей из лаборатории Гица15. Этот подход обеспечивает эффективную интеграцию и отбор плазмид в различных экспериментальных условиях, предлагая надежный и гибкий метод трансформации различных штаммов дрожжей. Он обеспечивает надежный выбор и поддержание эписомальной плазмиды под давлением гигромицина.
- Предварительно культивируйте одну колонию свежевыращенных дрожжей в 5 мл YPD (1% w/v экстракта дрожжей, 2% w/v пептон, 2% w/v глюкозы) при 20 °C при 200 об/мин при перемешивании в течение ночи.
- Разведите культуру до наружного диаметра620 0,2 в свежей среде YPD и инкубируйте при 20 °C с перемешиванием при 200 об/мин до середины логарифмической фазы (наружный диаметр620 0,4-0,6). В зависимости от штамма дрожжей на это обычно уходит 3-4 часа.
- Соберите клетки центрифугированием при температуре 21 380 × г в течение 1 минуты при комнатной температуре, выбросьте надосадочную жидкость и промойте гранулу 3 раза стерильной водой.
- Повторно суспендируйте промытые элементы в 100 мкл 0,1 М ацетата лития, центрифугируйте, как описано в шаге 2.3, и повторите процесс 2 раза.
- Добавьте в клетки следующие компоненты в следующем порядке: 240 мкл 50% w/v PEG-4000, 35 мкл 1 М LiAc, 5 мкл плазмидной ДНК (100 нг/мкл), 20 мкл одноцепочечной ДНК-носителя (ссДНК), предварительно нагретую при 98 °C в течение 10 мин. Аккуратно перемешайте, чтобы гомогенизировать смесь для трансформации.
- Инкубируйте смесь при температуре 20 °C в течение 30 минут, а затем испытайте тепловой шок при 34 °C в течение 55 минут. После теплового шока добавьте 38 мкл 100% этанола до конечной концентрации почти 0,1% и инкубируйте еще 5 минут при 34 °C.
ПРИМЕЧАНИЕ: Температуры, используемые в этом протоколе, оптимизированы для Saccharomyces eubayanus, криотолерантного штамма, выделенного из лесов умеренного пояса.
Использование 100% этанола необходимо для индуцирования клеточного стресса, что повышает эффективность протокола трансформации. - Добавьте 600 мкл YPD в трансформированные клетки, центрифугируйте как на шаге 2.3 и выбросьте надосадочную жидкость.
- Повторно суспендируйте клеточную гранулу в 600 μл свежего YPD и инкубируйте суспензию без перемешивания в течение ночи при 4 °C для восстановления.
- Трансформированные клетки наносят на агар YPD с добавлением гигромицина в концентрации 200 мкг/мл и инкубируют при 20-30 °С в течение 48-72 ч.
- Выберите 10-12 колоний из трансформационных планшетов и повторно нанесите их на агар YPD, содержащий 200 мкг/мл гигромицина, чтобы обеспечить присутствие плазмиды и создать смешанный участок выбранных колоний для дальнейшего использования.
3. Валидация люминесценции
Примечание: Для проверки функциональности люминесцентных репортеров трансформированные штаммы были протестированы в условиях, предназначенных для индуцирования дифференциальной экспрессии люциферазного репортера. Эта ступенчатая валидация позволяет оценить функциональность репортера в условиях колебания сахара, используя надежность люминесцентных анализов для регистрации метаболических реакций в режиме реального времени.
- Выберите образец из участка трансформированного штамма дрожжей и инокулируйте его в среду YP (1% w/v дрожжевого экстракта, 2% w/v пептон), содержащую 5% w/v глюкозы и 200 μМ гигромицина. Выдерживать при температуре 25 °C без встряхивания в течение 24 ч. Освежите культуры в свежей среде в соотношении 1:10 и инкубируйте в тех же условиях еще 24 ч.
- Промойте клетки средой YP без сахара и инокулируйте их в тестовую среду в соотношении 1:10. Исследуемая среда дополнена люциферином до конечной концентрации 3 мМ и содержит 200 мкМ гигромицина для поддержания стабильности плазмид.
- Для тестирования роста со смешанным сахаром используйте глюкозо-мальтозную матрицу со следующими концентрациями (% по объему): глюкоза (0%, 0,5%, 1%, 2%) и мальтоза (0%, 2%, 5%, 10%, 20%, 30%) в среде YP. Каждое состояние дополняют люциферином (конечная концентрация 3 мМ) и 200 мкМ гигромицина. Дозируйте по 200 мкл культуры в каждую лунку 96-луночного планшета (рис. 2).
- Измеряйте люминесценцию и наружный диаметр620 каждые 30 минут в течение 72 часов с помощью планшетного считывателя люминометра, без затухания и времени интегрирования 1 с, обеспечивая непрерывный мониторинг активности репортера и плотности ячеек.
4. Отбор проб ферментации и мониторинг люминесценции
Трансформированные штаммы подвергали контролируемым условиям микроферментации для оценки активации люминесценции во время брожения. Это позволяет сравнивать активацию люминесценции в различных условиях брожения, что дает представление о метаболических реакциях дрожжей в течение длительных периодов брожения.
- Приготовьте среду для солодового экстракта (12 °Plato), растворив солодовый экстракт в воде, и стерилизуйте при 100 °C в течение 20 минут. Перед инокуляцией дайте среде остыть до комнатной температуры.
- Прекультура трансформировала штаммы дрожжей в 5 мл YPD (1% w/v дрожжевого экстракта, 2% w/v пептон, 2% w/v глюкозы) при 20 °C с перемешиванием при 200 об/мин в течение 24 ч. Переложите прекультуру в 50 мл солодовой экстрактивной среды. Инкубировать культуру при 20 °C с перемешиванием при 200 об/мин в течение 24 ч.
- Соберите клетки центрифугированием при 21 380 × г в течение 1 минуты при комнатной температуре и повторно суспендируйте их для приготовления тройного микроброжения 50 мл в среде солодового экстракта 12 °Plato9. Для повышения эффективности ферментации добавьте в среду 0,3 мг/л ZnCl2.
- Чтобы обеспечить постоянную плотность клеток среди репликатов, рассчитайте объем инокулюма по формуле:
Объем посевного материала = (1,5 × 106) × объем (мл) × градусов Платона - Подготовленную среду инокулировать и инкубировать культуры при температуре 20 °С без встряхивания в течение 14 дней. Контролируйте ход ферментации, ежедневно регистрируя потериCO2 . Взвешивайте сосуды одновременно каждый день, чтобы измерить совокупную потерю веса как показатель производстваCO2 .
- Для мониторинга люминесценции периодически отбирайте 200 мкл при каждой микроферментации. Добавьте люциферин в образцы для достижения конечной концентрации 3 мМ и измерьте люминесценцию и внешний диаметр620 с помощью люминометра без затухания и времени интегрирования 1 с. Проводите измерения через определенные промежутки времени в течение всего периода брожения (Рисунок 3).
Результаты
Следующие результаты демонстрируют возможность использования недавно созданного люминесцентного репортера для мониторинга перехода от глюкозы к мальтозе в дрожжевых клетках в процессе ферментации. Репортерные плазмиды первоначально собирают с помощью дрожжевого рекомбинационного клонирования13 для получения эписомальных репортерных конструкций. Этот процесс требует перекрытия нуклеотидных последовательностей не менее чем на 30 нуклеотидов между различными ампликонами, все они изображены на рисунке 1. Регуляторные области, содержащие 858.о. выше начального сайта гена ATG для MAL32, амплифицировали из геномной ДНК с использованием штамма S. eubayanus CBS12357T7. Геном S. eubayanus содержит два функциональных гена MAL32, закодированных в полных локусах MAL в хромосомах V и XVI11. Основываясь на литературе11, мы выбрали его промоутера в качестве нашего эписомального репортера. Дестабилизированные кассеты люциферазы ORF и hphMX амплифицировали из ранее зарегистрированных плазмид pRS426-P TDH3-Luc и pRS426-mCherry 1, имеющих размер ампликона 1,901 и 1,951.о. соответственно. Эти ампликоны требовали дополнительного этапа с использованием рестрикции фермента DpnI для расщепления любых следов матричной плазмиды. Все эти фрагменты были объединены с открытой плазмидой pRS426 для получения эпизодического репортера для MAL32, известного как pRS426-PMAL32-LUC-hphMX (предоставляется по запросу). Впоследствии три различных штамма S. eubayanus, CBS12357T, CL467.1 и QC18, которые демонстрируют дифференциальный рост в условиях мальтозы6, были преобразованы с помощью этой репортерной конструкции. Впоследствии мы отобрали успешные трансформанты с помощью устойчивости к антибиотикам гигромицина, чтобы обеспечить включение плазмидного репортера.
Мы протестировали каждый трансформированный штамм в условиях превращения глюкозы в мальтозу, чтобы подтвердить транскрипционную активность репортера. Мы измерили активность промотора MAL32 при различных концентрациях глюкозы и мальтозы (рис. 2). Активность люциферазы варьировала по интенсивности сигнала и временной реакции среди трех штаммов (p < 0,05, ANOVA), что свидетельствует о дифференциальной активации в каждом генетическом фоне. Например, активация репортера в фоновом режиме QC18 происходила только при концентрации глюкозы выше 1%. Напротив, два фенотипически сходных штамма, CBS12357T и CL467.1, демонстрировали высокие уровни активации транскрипции, когда глюкоза изначально не присутствовала в среде6. Интересно, что репортерная система эффективно отражала дифференциальную транскрипционную активацию в этих двух генетических фонах, где мы обнаружили транскрипционную активацию репортерного гена через 6 ч и 24 ч роста в условиях отсутствия глюкозы в CBS12357T и CL467.1 соответственно. Эти результаты демонстрируют, что фенотипически сходные исходы могут различаться в регуляции транскрипции у разных штаммов.
Чтобы оценить эффективность репортерных систем в условиях пивоварения, мы провели анализ микроферментации в условиях сусла с использованием трех трансформированных штаммов. Для этого собирали 100 мкл ежедневных проб в течение 7 дней от каждой микроферментации. Затем в каждом случае измеряли активность люциферазы и OD620 для оценки транскрипционной активации метаболических переходных реакций во время ферментации (рис. 3). Все три штамма продемонстрировали сильную люминесценцию от pRS426-PMAL32-LUC-hphMX, которая отсутствовала у штаммов дикого типа. Штамм CL467.1 показал самые высокие значения, достигнув пика через четыре дня (p < 0,05, ANOVA). Напротив, оба CBS12357T и QC18 достигли пика в 24 часа, при этомCBS12357 T показал значительно более высокие уровни, чем QC18 (p < 0,05, ANOVA). Эти результаты сопоставимы с результатами, полученными в условиях микрокультивирования (рис. 2), демонстрируя более высокую активацию транскрипции у CL467.1 по сравнению с двумя другими штаммами и отсроченную активацию промотора у QC18. Эти результаты подчеркивают способность люминесцентных репортеров динамически контролировать экспрессию генов в ответ на метаболические изменения в дрожжах. Этот подход хорошо согласуется с предыдущими исследованиями, такими как использование дрожжей в качестве шасси для разработки функциональных анализов.
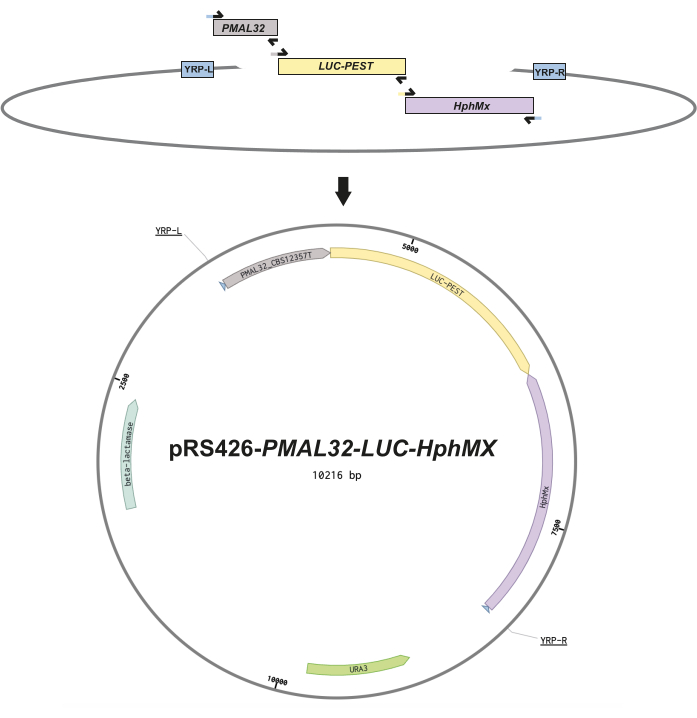
Рисунок 1: Конструкция эпизодических репортеров. Этот схематический рисунок иллюстрирует конструкцию каждой плазмиды. (А) фрагменты ДНК, изображающие перекрывающиеся праймеры (черные стрелки), включающие 30 нуклеотидных гомологичных последовательностей между фрагментами для облегчения бесшовной сборки с помощью гомологичной рекомбинации дрожжей. (B) Векторная карта эписомального репортера с использованием промоторной области MAL32 (PMAL32) из штамма CBS12357T , дестабилизированной люциферазы (LUC-PEST) и гигромициновой кассеты (hphMX) после LUC-PEST в обратной ориентации. Эти фрагменты включаются в множественные сайты клонирования pRS426 в соответствии с праймером рекомбинации дрожжей слева и справа (YPR-L и YRP-R), указанным на векторной карте. Наконец, показаны открытые рамки считывания устойчивости к бактериальным антибиотикам (бета-лактамазам) и урациловой ауксотрофии (URA3). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
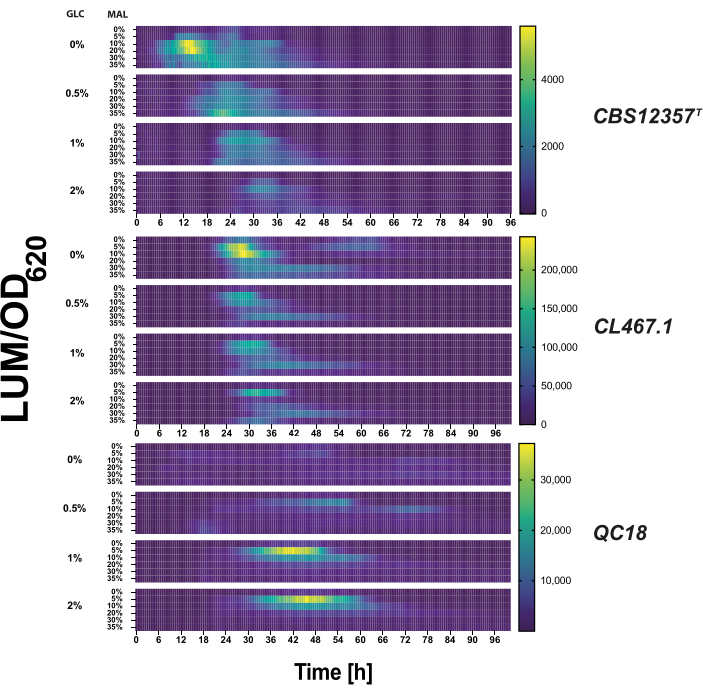
Рисунок 2: Репортерный тест метаболического перехода в условиях микрокультивирования. Используя матрицу различных концентраций глюкозы (0%, 0,5%, 1%, 2%) и мальтозы (0%, 2%, 5%, 10%, 20%, 30%) в среде YP, мы оценили транскрипционную активацию pMAL32 в штаммах Saccharomyces eubayanus CBS12357T (верхний), CL467.1 (средний) и QC18 (ниже). Активность люциферазы отображается на тепловой карте в виде средней люминесценции, нормированной по оптической плотности при длине волны 620 нм (LUM/OD620) в произвольных единицах для каждого трансформированного штамма в глюкозо-мальтозной матрице за 100 ч. Самая высокая люминесценция (или активация промотора) отображается ярко-желтым цветом, а инактивация — темно-синим цветом на тепловой карте. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
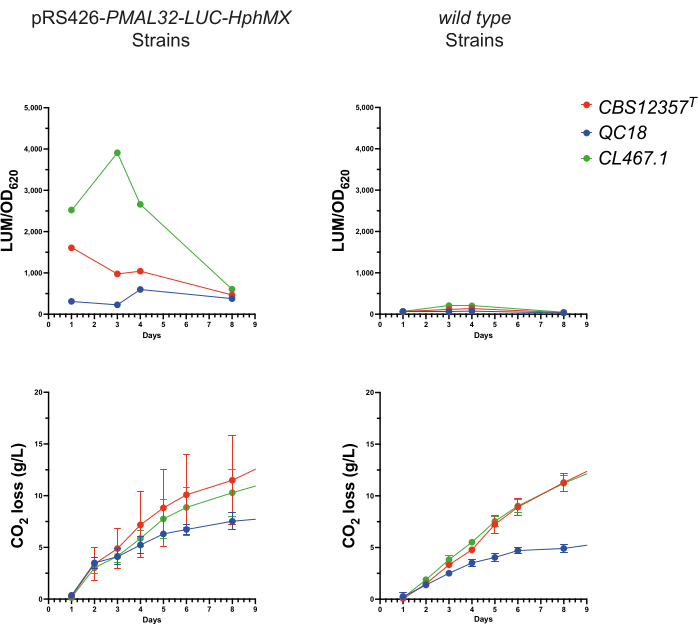
Рисунок 3: Контроль люминесценции во время брожения. Оценка производительности репортера pRS426-PMAL32-LUC-hphMX в процессе ферментации. На верхних панелях показан сигнал люминесценции (LUM/OD620) в течение 7-дневного периода ферментации в трансформированных и диких сортах. На нижних панелях изображены графики потерьCO2 (г/л) во время ферментации, показывающие схожие показатели между обеими группами. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительная таблица S1: Грунтовки, используемые для изготовления репортера. В этой таблице представлена подробная информация о праймерах, использованных в этом исследовании, включая их названия, последовательности (от 5' до 3') и длины. Праймеры были разработаны для усиления целевых областей при построении эписомальных репортеров и проверки их функциональности у Saccharomyces eubayanus. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Это исследование демонстрирует эффективность эписомального биолюминесцентного репортера для мониторинга транскрипционной активации у S. eubayanus при метаболических переходах. Используя MAL32 в качестве транскрипционного репортера11, мы смогли отслеживать ключевые метаболические переходы в режиме реального времени, обеспечивая надежную основу для понимания адаптаций, специфичных для штамма. Этот репортер, выбранный за их роль в метаболизме мальтозы, предлагает явные преимущества в оценке метаболической гибкости дрожжей, такие как мониторинг in vivo, точная идентификация метаболических сдвигов и подробная фенотипическая характеристика различных генетических фонов. Анализы в условиях смешанных сахаров выявили значительную вариабельность активации репортеров среди протестированных штаммов S. eubayanus, что подчеркивает фенотипическое разнообразие внутри этого вида. Эта изменчивость, вероятно, обусловленная генетическими различиями в активации транскрипции MAL, подчеркивает потенциал диких штаммов S. eubayanus в качестве ресурса для выявления признаков, которые могут улучшить производительность промышленной ферментации. Примечательно, что изоляты S. eubayanus из Патагонии демонстрируют наибольшее генетическое разнообразие, включающее несколько линий в пределах одного географического региона 6,17, что может способствовать наблюдаемой фенотипической изменчивости. Длительные метаболические сдвиги, наблюдаемые у некоторых штаммов, предполагают возможности для оптимизации штамма, в основном с помощью генетических или адаптивных подходов лабораторной эволюции. Понимание этой реакции имеет решающее значение для оптимизации промышленных процессов ферментации.
Заметным преимуществом описываемого протокола является его адаптивность. Система может быть адаптирована для исследования более широкого спектра транскрипционных реакций или метаболических путей путем замены альтернативных промоторов, расширяя ее применимость за пределы пивоварения в других биотехнологических процессах. Кроме того, эписомальная природа плазмидной системы обеспечивает стабильную экспрессию без необходимости геномной интеграции, упрощая создание штаммов и экспериментальные рабочие процессы. Открытие S. eubayanus в качестве холодостойкого родителя дрожжей для лагерпивоварения дало представление об одомашнивании и эволюции этих промышленных гибридов 7,9,16. Наши результаты подчеркивают полезность S. eubayanus в качестве модельного организма для изучения сложных метаболических адаптаций. Его естественная изменчивость и значимость для пивоварения лагера делают его идеальным кандидатом для исследования генетических и регуляторных механизмов, лежащих в основе ферментации. Будущая работа может быть сосредоточена на расширении панели тестируемых штаммов, включая одомашненные штаммы или новые дикие штаммы с потенциалом пивоварения, чтобы напрямую сравнить их метаболическую эффективность в аналогичных условиях.
Несмотря на то, что этот протокол имеет множество преимуществ, следует учитывать некоторые ограничения. Эписомальные репортеры, например, могут демонстрировать вариабельность числа копий плазмид, что может повлиять на согласованность измерений экспрессии генов между штаммами18. Кроме того, транскрипционные реакции, наблюдаемые у S. eubayanus, могут не транслироваться напрямую на другие организмы из-за различий в совместимости промоторов или клеточныхмеханизмах. Адаптация этого протокола требует тщательной калибровки условий роста и отбора для обеспечения стабильности плазмид и поддержания селективного давления, что имеет решающее значение для получения воспроизводимых результатов18. Кроме того, оптимизация эффективности трансформации и адаптация параметров роста к конкретным штаммам или отчетным лицам имеет важное значение для успешноговнедрения20. Аналогичные подходы у S. cerevisiae, такие как использование промоторной системы MAL32 в сочетании с флуоресцентными маркерами для изучения уровней транскрипции в условиях глюкозы и мальтозы, подчеркивают актуальность и полезность репортерных инструментов для исследования транскрипционной активности и метаболических путей. В целом, эти соображения сосредоточены на тщательной адаптации протокола к различным биологическим системам, подчеркивая при этом его универсальность и широкую применимость.
В заключение следует отметить, что использование биолюминесцентных репортеров является мощным инструментом для анализа реакции пивных дрожжей на изменения окружающей среды. Такой подход не только улучшает наше понимание физиологии S. eubayanus , но и способствует разработке надежных штаммов дрожжей, адаптированных к промышленным потребностям. Гибкость и эффективность этого протокола делают его ценным активом как для исследований, так и для биотехнологических приложений.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Это исследование финансировалось Agencia Nacional de Investigación y Desarrollo (ANID), FONDECYT (1220026) и ANID-Programa Iniciativa Científica Milenio ICN17_022 и NCN2024_040. FM был поддержан грантом ANID FONDECYT Postdoctorado N°3220597. PQ был поддержан грантом ANID N°21201057. Финансовая поддержка также выражается Centro Ciencia & Vida, FB210008, Financiamiento Basal para Centros Científicos y Tecnológicos de Excelencia de ANID.
Материалы
| Name | Company | Catalog Number | Comments |
| Ampicillin, sodium salt | ThermoFisher Scientific | 11593027 | |
| D-Glucose | Sigma-Aldrich | G8270 | |
| DpnI | New England Biolabs | R0176S | |
| EcoRI | New England Biolabs | R0101S | |
| Hygromycine B | Gold Biotechnology | H-270-1 | |
| L-Luciferine | Gold Biotechnology | L-127-10 | |
| Maltose monohydrate | Sigma-Aldrich | 47288 | |
| Phusion Plus PCR Master Mix | ThermoFisher Scientific | F631S | |
| Tecan Infinite 200 PRO M | Tecan | ||
| Wizard Plus SV Minipreps DNA Purirfication System | Promega | A1330 | |
| XhoI | New England Biolabs | R0146S | |
| Zymoprep Yeast Plasmid Miniprep I | Zymo Research | D2001 |
Ссылки
- Salinas, F., Rojas, V., Delgado, V., López, J., Agosin, E., Larrondo, L. F. Fungal light-oxygen-voltage domains for optogenetic control of gene expression and flocculation in yeast. mBio. 9 (4), e00626-e00718 (2018).
- Jacob, F., Monod, J. Genetic regulatory mechanisms in the synthesis of proteins. J Mol Biol. 3, 318-356 (1961).
- Perez-Samper, G., et al. The Crabtree Effect shapes the Saccharomyces cerevisiae lag phase during the switch between different carbon sources. mBio. 9 (5), e01331-e01418 (2018).
- Vermeersch, L., et al. On the duration of the microbial lag phase. Curr Genet. 65 (3), 721-727 (2019).
- New, A. M., et al. Different levels of catabolite repression optimize growth in stable and variable environments. PLoS Biol. 12 (1), e1001764 (2014).
- Molinet, J., et al. Natural variation in diauxic shift between Patagonian Saccharomyces eubayanus Strains. mSystems. 7 (6), e0064022 (2022).
- Libkind, D., et al. Microbe domestication and the identification of the wild genetic stock of lager-brewing yeast. Proc Natl Acad Sci USA. 108 (35), 14539-14544 (2011).
- Peris, D., et al. Complex ancestries of lager-brewing hybrids were shaped by standing variation in the wild yeast Saccharomyces eubayanus. PLoS Genet. 12 (7), e1006155 (2016).
- Mardones, W., et al. Molecular profiling of beer wort fermentation diversity across natural Saccharomyces eubayanus isolates. Microb Biotechnol. 13 (4), 1012-1025 (2020).
- Brickwedde, A., et al. physiological and regulatory analysis of maltose transporter genes in Saccharomyces eubayanus CBS 12357T. Front Microbiol. 9, 1786 (2018).
- Brouwers, N., et al. In vivo recombination of Saccharomyces eubayanus maltose-transporter genes yields a chimeric transporter that enables maltotriose fermentation. PLoS Genet. 15 (4), e1007853 (2019).
- Meurer, M., Chevyreva, V., Cerulus, B., Knop, M. The regulatable MAL32 promoter in Saccharomyces cerevisiae: characteristics and tools to facilitate its use. Yeast. 34 (1), 39-49 (2017).
- Mashruwala, A. A., Boyd, J. M. De novo assembly of plasmids using yeast recombinational cloning. Methods Mol Biol. 1373, 33-41 (2016).
- Sikorski, R. S., Hieter, P. A system of shuttle vectors and yeast host strains designed for efficient manipulation of DNA in Saccharomyces cerevisiae. Genetics. 122 (1), 19-27 (1989).
- Gietz, R. D., Schiestl, R. H. High-efficiency yeast transformation using the LiAc/SS carrier DNA/PEG method. Nat Protoc. 2 (1), 31-34 (2007).
- Baker, E. P., Hittinger, C. T. Evolution of a novel chimeric maltotriose transporter in Saccharomyces eubayanus from parent proteins unable to perform this function. PLoS Genet. 15 (4), e1007786 (2019).
- Nespolo, R. F., et al. An Out-of-Patagonia migration explains the worldwide diversity and distribution of Saccharomyces eubayanus lineages. PLoS Genet. 16 (5), e1008777 (2020).
- Hohnholz, R., Pohlmann, K. J., Achstetter, T. Impact of plasmid architecture on stability and yEGFP3 reporter gene expression in a set of isomeric multicopy vectors in yeast. Appl Microbiol Biotechnol. 101 (23-24), 8455-8463 (2017).
- Wu, Y., et al. Engineering an efficient expression using heterologous GAL promoters and transcriptional activators in Saccharomyces cerevisiae. ACS Synth Biol. 12 (6), 1859-1867 (2023).
- Calvey, C. H., Willis, L. B., Jeffries, T. W. An optimized transformation protocol for Lipomyces starkeyi. Curr Genet. 60 (3), 223-230 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены