Method Article
In vivo Monitoraggio dell'attività trascrizionale durante la transizione metabolica mediante un reporter bioluminescente nel lievito
In questo articolo
Riepilogo
Questo protocollo utilizza un reporter bioluminescente, che consente di misurare l'attività trascrizionale in Saccharomyces eubayanus per monitorare la transizione da glucosio a maltosio, consentendo l'analisi in tempo reale degli adattamenti metabolici e supportando l'ottimizzazione del ceppo per la fermentazione industriale in diverse condizioni.
Abstract
Il consumo sequenziale di zucchero, da una fonte di zucchero preferita a una meno preferita, rappresenta un adattamento metabolico critico nel lievito, che è particolarmente rilevante per la sopravvivenza in ambienti fluttuanti come quelli che si trovano nella fermentazione della birra. Tuttavia, le transizioni zuccherine sono una variabile ambientale difficile da prevedere e rilevare, che influisce sull'esito delle fermentazioni della birra. Questo protocollo descrive un sistema in vivo per monitorare l'attivazione trascrizionale associata al cambiamento metabolico da glucosio a maltosio in Saccharomyces eubayanus che si applica a diversi ceppi di lievito selvatico Saccharomyces .
Il sistema impiega un reporter trascrizionale bioluminescente episomiale per il metabolismo del maltosio, concentrandosi su MAL32, poiché fornisce una buona lettura dei cambiamenti metabolici, come studiato in S. cerevisiae. Per questo, i ceppi di lievito sono stati trasformati con plasmidi contenenti la regione regolatoria MAL32 di S. eubayanus, controllando l'espressione di un gene che codifica per una versione destabilizzata della luciferasi 1 della lucciolae di un gene di resistenza all'igromicina utilizzato esclusivamente durante la trasformazione per garantire l'acquisizione del plasmide. Dopo la selezione, le cellule di lievito trasformate possono essere coltivate in condizioni non selettive, poiché il plasmide episomiale rimane stabile in condizioni di coltura per un massimo di 7 giorni.
Questo sistema è stato convalidato in un ambiente zuccherino complesso in saggi di microfermentazione, confermando l'efficacia del reporter luciferasi nell'informare le transizioni metaboliche. I campioni sono stati raccolti regolarmente e analizzati con un luminometro, fornendo informazioni continue sulle risposte del lievito. Sebbene ampiamente applicabile, questo protocollo è particolarmente utile per valutare le prestazioni del lievito in condizioni di fermentazione, dove i cambiamenti metabolici rappresentano una sfida significativa. Inoltre, questa metodologia può essere adattata selezionando promotori alternativi per esplorare una gamma più ampia di risposte ai cambiamenti ambientali, consentendo la caratterizzazione e l'ottimizzazione dei ceppi di lievito selvatico per diverse applicazioni industriali.
Introduzione
I microrganismi come i lieviti devono adattarsi costantemente alle condizioni ambientali dinamiche per mantenere la forma fisica e sopravvivere1. Questi adattamenti spesso coinvolgono complessi circuiti di regolazione genica che integrano più segnali extracellulari per orchestrare risposte metaboliche precise 2,3. In ambito industriale, l'efficienza di queste transizioni metaboliche è fondamentale, in particolare nei processi di fermentazione in cui le interruzioni possono portare a rese non ottimali o fermentazioni incomplete3. Una sfida metabolica chiave da superare è quando le cellule passano da una fonte di carbonio preferita a una secondaria, come il passaggio dal glucosio al maltosio. Questo processo introduce una fase di ritardo durante la quale i geni necessari per il metabolismo delle fonti secondarie di carbonio vengono derepressi, consentendo la ripresa della crescita 4,5.
Nella produzione della birra, i lieviti Saccharomyces devono passare in modo efficiente dal metabolismo del glucosio a quello del maltosio. In particolare, S. eubayanus, la specie parentale tollerante al freddo dei lieviti lager, mostra una sostanziale variabilità fenotipica nella sua capacità di adattarsi a tali transizioni6. Gli isolati selvatici, come quelli della Patagonia, mostrano spesso fasi di ritardo prolungate e un consumo di maltosio più lento rispetto ai ceppi domestici, che sono stati selezionati per le loro capacità fermentative ottimizzate 7,8. Mentre i ceppi domestici si sono adattati a fermentare in modo efficiente gli ambienti di zucchero misto, i ceppi selvatici mostrano spesso una transizione metabolica più lenta, potenzialmente a causa di una maggiore repressione del glucosio e della regolazione variabile del locusMAL 6,9.
Questo studio utilizza la variabilità naturale di S. eubayanus come modello per studiare gli adattamenti metabolici in condizioni di glucosio-maltosio, sfruttando un reporter di luciferasi destabilizzata episomiale per monitorare l'espressione genica in vivo, tracciando la luminescenza1. Il reporter selezionato MAL32 codifica per una proteina maltasi, un enzima cardine per il catabolismo del maltosio durante le transizioni da glucosio a maltosio10,11. Sorprendentemente, il promotore MAL32 rappresenta un marcatore di successo per valutare l'induzione del metabolismo del maltosio dopo la deplezione del glucosio12. Incorporando questo sistema reporter, abbiamo mirato a chiarire i meccanismi adattativi specifici del ceppo e a identificare potenziali obiettivi per ottimizzare le prestazioni di fermentazione. Inoltre, questo protocollo può essere ampliato oltre la produzione di birra, offrendo applicazioni nelle biotecnologie e negli studi ambientali in cui gli ambienti zuccherini complessi svolgono un ruolo significativo. La comprensione dei determinanti genetici e regolatori delle risposte fluttuanti dell'ambiente in S. eubayanus migliora la nostra conoscenza della fisiologia del lievito, supportando lo sviluppo di ceppi robusti per diverse applicazioni industriali e di ricerca.
Protocollo
1. Costruzione di reporter episomiali
NOTA: Abbiamo selezionato una regione regolatoria reporter basata sulla letteratura sui lieviti per costruire il plasmide episomiale per il monitoraggio del consumo di maltosio 6,11,12. Il promotore del gene reporter candidato è stato definito come la sequenza regolatoria immediatamente a monte dell'ORF candidato fino al nucleotide che fiancheggia l'ORF adiacente a monte. Questa regione è stata amplificata dal DNA genomico di S. eubayanus CBS12357 ceppodi riferimento T 10. Questo approccio garantisce la costruzione ad alta fedeltà di plasmidi episomiali adatti per applicazioni a valle, compreso lo studio di altre condizioni interessanti nel lievito.
- Progettare i frammenti di DNA e i primer sovrapposti in modo da includere 30 sequenze di accoppiamento nucleotidico tra i frammenti per un assemblaggio senza soluzione di continuità tramite clonazione ricombinante del lievito13 (Figura 1). Vedere la Tabella supplementare S1 per le sequenze di primer.
- Per evitare mutazioni, amplificare la regione del promotore (vedi sopra), così come la luciferasi destabilizzata (LUC-PEST) e le cassette hphMX 1 utilizzando una DNA polimerasi ad alta fedeltà (fare riferimento al produttore della polimerasi per i dettagli del protocollo). Impostare il termociclatore a 98 °C per 10 minuti per la denaturazione iniziale, seguita da 30 cicli di denaturazione a 98 °C, ricottura a 60 °C ed estensione a 72 °C; completare il protocollo con un'estensione finale a 72 °C per 10 min.
NOTA: Quando si utilizzano plasmidi navetta di lievito come modelli per la PCR, si raccomanda di sottoporre le reazioni degli ampliconi a una digestione di DpnI (vedere il protocollo del produttore dell'enzima) per eliminare eventuali tracce di plasmide stampo che potrebbero interferire con la trasformazione del lievito. - Digerire la spina dorsale del plasmide14 pRS426 con gli enzimi di restrizione EcoRI e XhoI per linearizzare il vettore, tagliandolo nel sito di clonazione multipla, e prepararlo per la ricombinazione (fare riferimento al protocollo del produttore dell'enzima).
- Mescolare la spina dorsale linearizzata di pRS426 con i frammenti di DNA amplificati e trasformare la miscela in Saccharomyces cerevisiae BY4741 utilizzando il clonaggio ricombinante del lievito13,15 per consentire al meccanismo di ricombinazione omologa del lievito di assemblare il costrutto plasmidico in vivo.
- Piastra del lievito trasformato su un terreno sintetico completo (SC) privo di uracile (SC-URA) per selezionare i trasformanti auxotrofici contenenti il nuovo vettore costruito pRS426- MAL32-LUC-hphMX plasmide.
- Estrarre i plasmidi dal lievito utilizzando un mini-kit di preparazione del lievito secondo le istruzioni del produttore e trasformare il plasmide estratto in Escherichia coli DH5α per amplificare il costrutto per ulteriori analisi.
- Screening delle colonie batteriche tramite PCR per confermare il corretto assemblaggio dei costrutti.
- Purificare il DNA plasmidico utilizzando un kit standard di purificazione dei plasmidi ed eseguire il sequenziamento Sanger per verificare l'integrità e la sequenza dei plasmidi assemblati.
2. Trasformazione dei ceppi di lievito
NOTA: Il protocollo di trasformazione del lievito è stato adattato da un metodo precedentemente stabilito per S. eubayanus16 e applicato con successo ad altre specie di Saccharomyces e ceppi di lievito fermentativi. Questo protocollo è stato derivato dal tradizionale metodo di trasformazione del lievito del Gietz Lab15. Questo approccio consente un'efficiente integrazione e selezione dei plasmidi in diverse condizioni sperimentali, offrendo un metodo robusto e flessibile per trasformare diversi ceppi di lievito. Garantisce una selezione e un mantenimento affidabili del plasmide episomiale sotto pressione di igromicina.
- Precoltura di una singola colonia di lievito appena coltivato in 5 mL di YPD (1% p/v estratto di lievito, 2% p/v peptone, 2% p/v glucosio) a 20 °C a 200 giri/min di agitazione durante la notte.
- Diluire la coltura a un OD620 di 0,2 in terreno YPD fresco e incubare a 20 °C con agitazione a 200 giri/min fino alla fase di metà log (OD620 0,4-0,6). A seconda del ceppo di lievito, questo richiede in genere 3-4 ore.
- Raccogliere le cellule mediante centrifugazione a 21.380 × g per 1 minuto a temperatura ambiente, scartare il surnatante e lavare il pellet 3 volte con acqua sterile.
- Risospendere le celle lavate in 100 μl di acetato di litio 0,1 M, centrifugare come descritto al punto 2.3 e ripetere il processo 2 volte.
- Aggiungere i seguenti componenti alle cellule in questo ordine: 240 μL di PEG-4000 al 50% p/v, 35 μL di 1 M LiAc, 5 μL di DNA plasmidico (100 ng/μL), 20 μL di DNA vettore a filamento singolo (ssDNA) precedentemente riscaldato a 98 °C per 10 minuti. Mescolare delicatamente per omogeneizzare la miscela di trasformazione.
- Incubare la miscela a 20 °C per 30 minuti, seguita da shock termico a 34 °C per 55 minuti. Dopo lo shock termico, aggiungere 38 μL di etanolo al 100% a una concentrazione finale di quasi lo 0,1% e incubare per altri 5 minuti a 34 °C.
NOTA: Le temperature utilizzate in questo protocollo sono ottimizzate per Saccharomyces eubayanus, un ceppo criotollerante isolato dalle foreste temperate.
L'uso di etanolo al 100% è necessario per indurre lo stress cellulare, migliorando l'efficienza del protocollo di trasformazione. - Aggiungere 600 μl di YPD alle cellule trasformate, centrifugare come al punto 2.3 e scartare il surnatante.
- Risospendere il pellet cellulare in 600 μL di YPD fresco e incubare la sospensione senza agitazione per una notte a 4 °C per consentire il recupero.
- Piastra le cellule trasformate su agar YPD integrato con 200 μg/mL di igromicina e incubazione a 20 °C-30 °C per 48-72 ore.
- Selezionare 10-12 colonie dalle piastre di trasformazione e riavvitarle su agar YPD contenente 200 μg/mL di igromicina per garantire la presenza del plasmide e generare un patch misto delle colonie selezionate per un ulteriore utilizzo.
3. Validazione della luminescenza
NOTA: Per convalidare la funzionalità dei reporter luminescenti, i ceppi trasformati sono stati testati in condizioni progettate per indurre l'espressione differenziale del reporter della luciferasi. Questa convalida graduale consente di valutare la funzionalità del reporter in condizioni di zucchero fluttuante, sfruttando la robustezza dei saggi luminescenti per acquisire risposte metaboliche in tempo reale.
- Prelevare un campione da un cerotto di ceppo di lievito trasformato e inocularlo in un terreno YP (1% p/v di estratto di lievito, 2% p/v di peptone) contenente il 5% p/v di glucosio e 200 μM di igromicina. Incubare a 25 °C senza agitare per 24 ore. Rinfrescare le colture in terreno fresco a una diluizione 1:10 e incubare nelle stesse condizioni per altre 24 ore.
- Lavare le cellule con terreno YP senza zucchero e inocularele nel terreno di prova a una diluizione di 1:10. Il terreno di prova è integrato con luciferina fino a una concentrazione finale di 3 mM e contiene 200 μM di igromicina per mantenere la stabilità del plasmide.
- Per i test di crescita con zuccheri misti, utilizzare una matrice glucosio-maltosio con le seguenti concentrazioni (% p/v): glucosio (0%, 0,5%, 1%, 2%) e maltosio (0%, 2%, 5%, 10%, 20%, 30%) in terreno YP. Ogni condizione è integrata con luciferina (concentrazione finale di 3 mM) e 200 μM di igromicina. Erogare 200 μL di coltura in ciascun pozzetto di una piastra a 96 pozzetti (Figura 2).
- Misura la luminescenza e l'OD620 ogni 30 minuti per 72 ore utilizzando un lettore di piastre luminometro, senza attenuazione e 1 s di tempo di integrazione, garantendo l'attività continua del reporter e il monitoraggio della densità cellulare.
4. Campionamento delle fermentazioni e monitoraggio della luminescenza
NOTA: I ceppi trasformati sono stati sottoposti a condizioni di micro-fermentazione controllate per valutare l'attivazione della luminescenza durante la fermentazione. Ciò consente di confrontare l'attivazione della luminescenza in diverse condizioni di fermentazione, fornendo informazioni sulle risposte metaboliche del lievito durante periodi di fermentazione prolungati.
- Preparare il terreno di estrazione di malto (12 °Plato) sciogliendo l'estratto di malto in acqua e sterilizzare a 100 °C per 20 min. Lasciare raffreddare il terreno a temperatura ambiente prima dell'inoculazione.
- Ceppi di lievito trasformati in precoltura in 5 mL di YPD (1% p/v estratto di lievito, 2% p/v peptone, 2% p/v glucosio) a 20 °C con agitazione a 200 giri/min per 24 ore. Trasferire la precoltura in 50 ml di terreno di estrazione di malto. Incubare la coltura a 20 °C con agitazione a 200 giri/min per 24 ore.
- Raccogliere le cellule per centrifugazione a 21.380 × g per 1 min a temperatura ambiente e risospenderle per preparare microfermentazioni triplicate da 50 mL in terreno estratto di malto Plato12 °Plato 9. Per migliorare le prestazioni di fermentazione, integrare il terreno con 0,3 mg/L di ZnCl2.
- Per garantire densità cellulari coerenti tra le repliche, calcolare il volume dell'inoculo utilizzando la formula:
Volume dell'inoculo = (1,5 × 106) × Volume (mL) × gradi Plato - Inoculare il terreno preparato e incubare le colture a 20 °C senza agitare per 14 giorni. Monitora l'andamento della fermentazione registrando quotidianamente la perdita di CO2 . Pesare i recipienti contemporaneamente ogni giorno per misurare la perdita di peso cumulativa come indicatore della produzione di CO2 .
- Per il monitoraggio della luminescenza, prelevare periodicamente 200 μl da ogni microfermentazione. Aggiungere luciferina ai campioni per ottenere una concentrazione finale di 3 mM e misurare la luminescenza e l'OD620 utilizzando un lettore di piastre luminometrico senza attenuazione e 1 s di tempo di integrazione. Eseguire le misurazioni a intervalli definiti durante il periodo di fermentazione (Figura 3).
Risultati
I seguenti risultati dimostrano l'usabilità del reporter luminescente di nuova costruzione per monitorare la transizione da glucosio a maltosio nelle cellule di lievito in un processo fermentativo. I plasmidi reporter vengono inizialmente assemblati utilizzando il clonaggio ricombinante del lievito13 per generare costrutti reporter episomiali. Questo processo richiede la sovrapposizione di sequenze nucleotidiche di almeno 30 nucleotidi tra i diversi ampliconi, tutti illustrati nella Figura 1. Le regioni regolatorie che comprendono 858 bp a monte del sito di inizio del gene ATG per MAL32 sono state amplificate dal DNA genomico utilizzando il ceppo di S. eubayanus CBS12357T7. Il genoma di S. eubayanus contiene due geni funzionali MAL32, codificati all'interno di loci MAL completi nei cromosomi V e XVI11. Sulla base della letteratura11, abbiamo scelto il promotore di quest'ultimo per il nostro reporter episomiale. Le cassette destabilizzate di luciferasi ORF e hphMX sono state amplificate dai plasmidi pRS426-P TDH3-Luc e pRS426-mCherry 1, aventi una dimensione dell'amplicone rispettivamente di 1.901 e 1.951 bp. Questi ampliconi hanno richiesto un passaggio aggiuntivo, utilizzando la restrizione enzimatica DpnI per digerire qualsiasi traccia di plasmide stampo. Tutti questi frammenti sono stati combinati con il plasmide aperto pRS426 per ottenere un reporter episomiale per MAL32 noto come pRS426-PMAL32-LUC-hphMX (disponibile su richiesta). Successivamente, tre distinti ceppi di S. eubayanus, CBS12357T, CL467.1 e QC18, che mostrano una crescita differenziale in condizioni di maltosio6, sono stati trasformati con questo costrutto reporter. Successivamente, abbiamo selezionato trasformanti di successo tramite l'igromicina antibiotica resistenza per garantire l'incorporazione del reporter plasmidico.
Abbiamo testato ogni ceppo trasformato in condizioni di glucosio-maltosio per convalidare l'attività trascrizionale del reporter. Abbiamo misurato l'attività del promotore MAL32 sotto una serie di concentrazioni di glucosio e maltosio (Figura 2). L'attività della luciferasi variava nell'intensità del segnale e nella risposta temporale tra i tre ceppi (p < 0,05, ANOVA), evidenziando l'attivazione differenziale in ciascun background genetico. Ad esempio, l'attivazione del reporter nel background QC18 si è verificata solo al di sopra dell'1% delle concentrazioni di glucosio. Al contrario, i due ceppi fenotipicamente simili, CBS12357T e CL467.1, mostravano alti livelli di attivazione trascrizionale quando inizialmente non era presente glucosio nel terreno6. È interessante notare che il sistema reporter ha effettivamente riflesso l'attivazione trascrizionale differenziale in questi due background genetici, dove abbiamo rilevato l'attivazione trascrizionale del gene reporter dopo 6 ore e 24 ore di crescita in condizioni senza glucosio rispettivamente in CBS12357T e CL467.1. Questi risultati dimostrano che esiti fenotipicamente simili possono differire nella regolazione trascrizionale tra i ceppi.
Per valutare l'efficacia dei sistemi reporter in condizioni di produzione della birra, abbiamo eseguito un saggio di microfermentazione in condizioni di mosto utilizzando i tre ceppi trasformati. Per questo, sono stati raccolti 100 μL di campioni giornalieri per 7 giorni da ogni microfermentazione. Quindi, l'attività della luciferasi e OD620 sono stati misurati in ciascun caso per valutare l'attivazione trascrizionale delle risposte di transizione metabolica durante la fermentazione (Figura 3). Tutti e tre i ceppi hanno mostrato una robusta luminescenza da pRS426-PMAL32-LUC-hphMX, che era assente nei ceppi wild type. Il ceppo CL467.1 ha mostrato i valori più alti, raggiungendo il picco dopo quattro giorni (p < 0,05, ANOVA). Al contrario, sia CBS12357T che QC18 hanno raggiunto il picco a 24 ore, con CBS12357T che mostrava livelli significativamente più alti di QC18 (p < 0,05, ANOVA). Questi risultati sono paragonabili a quelli ottenuti in condizioni di microcoltura (Figura 2), mostrando una maggiore attivazione trascrizionale in CL467.1 rispetto agli altri due ceppi e un'attivazione ritardata del promotore in QC18. Questi risultati sottolineano la capacità dei reporter luminescenti di monitorare dinamicamente l'espressione genica in risposta ai cambiamenti metabolici nel lievito. Questo approccio si allinea bene con studi precedenti, come l'utilizzo del lievito come telaio per lo sviluppo di saggi funzionali.
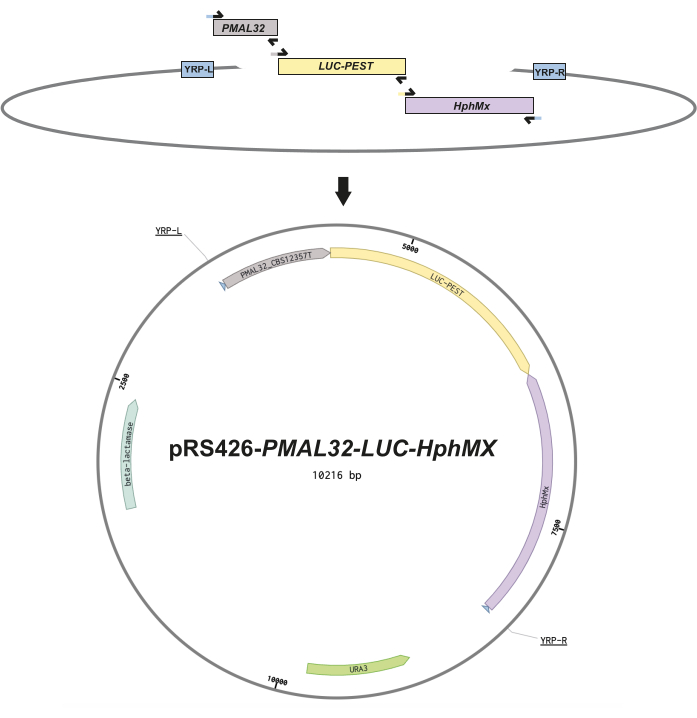
Figura 1: Progettazione costruttiva dei reporter episomiali. Questa figura schematica illustra il design di ciascun plasmide. (A) Frammenti di DNA raffiguranti i primer sovrapposti (frecce nere), che incorporano 30 sequenze omologhe nucleotidiche tra i frammenti per facilitare l'assemblaggio senza soluzione di continuità tramite la ricombinazione omologa del lievito. (B) Mappa vettoriale per il reporter episomiale utilizzando la regione del promotore MAL32 (PMAL32) dal ceppoT CBS12357, la luciferasi destabilizzata (LUC-PEST) e la cassetta igromicina (hphMX) a valle del LUC-PEST in un orientamento invertito. Questi frammenti sono incorporati nei siti di clonazione multipli di pRS426 seguendo il Primer di Ricombinazione del Lievito sinistro e destro (YPR-L e YRP-R) indicato nella mappa vettoriale. Infine, vengono mostrati i frame di lettura aperti per la resistenza batterica agli antibiotici (beta-lattamasi) e l'auxotrofia dell'uracile (URA3). Clicca qui per visualizzare una versione più grande di questa figura.
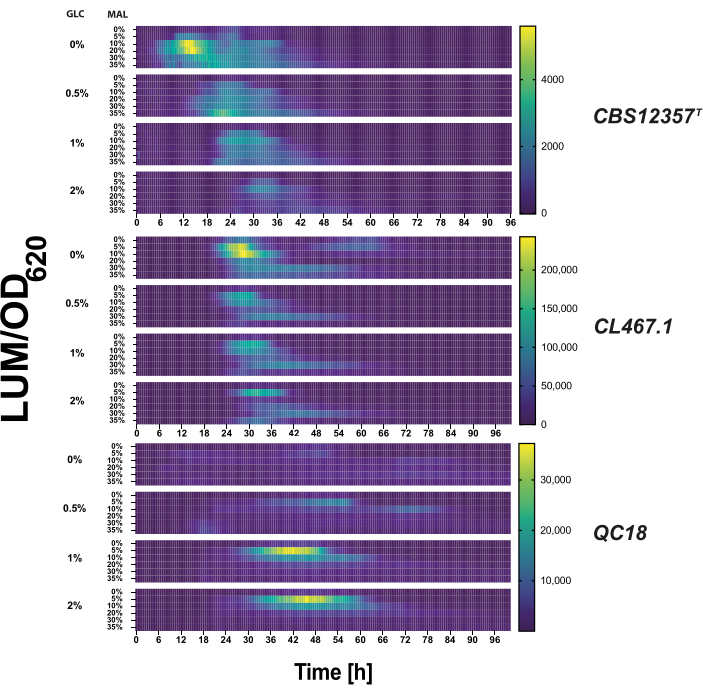
Figura 2: Test del reporter di transizione metabolica in condizioni di microcoltivazione. Utilizzando una matrice di diverse concentrazioni di glucosio (0%, 0,5%, 1%, 2%) e maltosio (0%, 2%, 5%, 10%, 20%, 30%) nel terreno YP, abbiamo valutato l'attivazione trascrizionale di pMAL32 nei ceppi CBS12357T (superiore), CL467.1 (medio) e QC18 (inferiore) Saccharomyces eubayanus . L'attività della luciferasi è mostrata in una heatmap come la luminescenza media normalizzata dalla densità ottica a 620 nm (LUM/OD620) in unità arbitrarie per ogni ceppo trasformato nella matrice glucosio-maltosio per 100 ore. La luminescenza più alta (o attivazione del promotore) è mostrata in giallo brillante e l'inattivazione è mostrata in blu scuro nella mappa di calore. Clicca qui per visualizzare una versione più grande di questa figura.
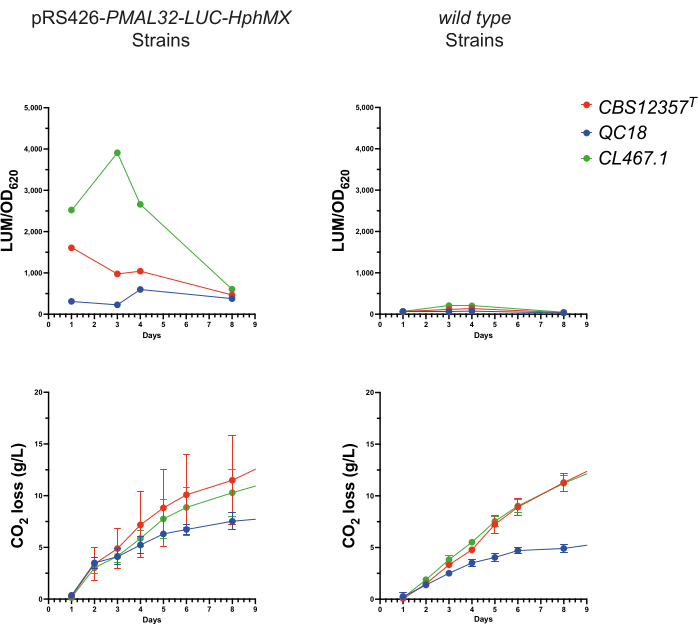
Figura 3: Monitoraggio della luminescenza durante la fermentazione. Valutazione delle prestazioni del reporter pRS426-PMAL32-LUC-hphMX durante un processo fermentativo. Nei pannelli superiori, viene mostrato il segnale di luminescenza (LUM/OD620) per un periodo di fermentazione di 7 giorni nei ceppi trasformati rispetto a quelli di tipo selvatico . I pannelli inferiori mostrano i grafici della perdita di CO2 (g/L) prodotta durante la fermentazione, mostrando prestazioni simili tra i due gruppi. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella supplementare S1: Primer utilizzati per la costruzione di reporter. Questa tabella fornisce informazioni dettagliate sui primer utilizzati in questo studio, inclusi i loro nomi, le sequenze (da 5' a 3') e le lunghezze. I primer sono stati progettati per amplificare le regioni target durante la costruzione di reporter episomiali e convalidare la loro funzionalità in Saccharomyces eubayanus. Clicca qui per scaricare questo file.
Discussione
Questo studio dimostra l'efficacia di un reporter bioluminescente episomiale per il monitoraggio dell'attivazione trascrizionale in S. eubayanus durante le transizioni metaboliche. Utilizzando MAL32 come reporter trascrizionale11, abbiamo potuto tracciare le transizioni metaboliche chiave in tempo reale, fornendo un solido quadro per comprendere gli adattamenti specifici del ceppo. Questo reporter, selezionato per il suo ruolo nel metabolismo del maltosio, offre vantaggi distinti nella valutazione della flessibilità metabolica nel lievito, come il monitoraggio in vivo, l'identificazione precisa dei cambiamenti metabolici e la caratterizzazione fenotipica dettagliata di diversi background genetici. I test in condizioni di zucchero misto hanno rivelato una significativa variabilità nell'attivazione del reporter tra i ceppi testati di S. eubayanus, sottolineando la diversità fenotipica all'interno di questa specie. Questa variabilità, probabilmente guidata da differenze genetiche nell'attivazione trascrizionale del MAL, evidenzia il potenziale dei ceppi selvatici di S. eubayanus come risorsa per l'identificazione di tratti che potrebbero migliorare le prestazioni della fermentazione industriale. In particolare, gli isolati di S. eubayanus della Patagonia mostrano la più grande diversità genetica, comprendente più lignaggi all'interno di una singola regione geografica 6,17, che può contribuire alla variabilità fenotipica osservata. I cambiamenti metabolici prolungati osservati in alcuni ceppi suggeriscono opportunità per l'ottimizzazione dei ceppi, principalmente attraverso approcci genetici o di evoluzione di laboratorio adattativa. Comprendere questa risposta è fondamentale per ottimizzare i processi di fermentazione industriale.
Un notevole vantaggio del protocollo descritto è la sua adattabilità. Il sistema può essere adattato per studiare una gamma più ampia di risposte trascrizionali o vie metaboliche sostituendo promotori alternativi, espandendo la sua applicabilità oltre la produzione di birra ad altri processi biotecnologici. Inoltre, la natura episomiale del sistema plasmidico garantisce un'espressione stabile senza la necessità di integrazione genomica, semplificando la costruzione del ceppo e i flussi di lavoro sperimentali. La scoperta di S. eubayanus come genitore tollerante al freddo dei lieviti per la produzione di birra chiara ha fornito informazioni sull'addomesticamento e l'evoluzione di questi ibridi industriali 7,9,16. I nostri risultati evidenziano l'utilità di S. eubayanus come organismo modello per lo studio di complessi adattamenti metabolici. La sua naturale variabilità e la sua rilevanza per la produzione di birra chiara la rendono un candidato ideale per studiare i meccanismi genetici e regolatori alla base delle prestazioni di fermentazione. Il lavoro futuro potrebbe concentrarsi sull'espansione del pannello di ceppi testati, incorporando ceppi domestici o nuovi ceppi selvatici con potenziale di produzione per confrontare direttamente la loro efficienza metabolica in condizioni simili.
Sebbene questo protocollo offra numerosi vantaggi, è necessario considerare alcune limitazioni. I reporter episomiali, ad esempio, possono mostrare variabilità nel numero di copie plasmidiche, che può influire sulla coerenza delle misurazioni dell'espressione genica tra i ceppi18. Inoltre, le risposte trascrizionali osservate in S. eubayanus potrebbero non tradursi direttamente in altri organismi a causa di differenze nella compatibilità del promotore o del macchinario cellulare19. L'adattamento di questo protocollo richiede un'attenta calibrazione delle condizioni di crescita e selezione per garantire la stabilità dei plasmidi e mantenere la pressione selettiva, che è fondamentale per ottenere risultati riproducibili18. Inoltre, l'ottimizzazione dell'efficienza della trasformazione e l'adattamento dei parametri di crescita a ceppi o reporter specifici sono essenziali per un'implementazione di successo20. Approcci simili in S. cerevisiae, come l'utilizzo del sistema di promotori MAL32 accoppiato a marcatori fluorescenti per studiare i livelli trascrizionali in condizioni di glucosio e maltosio, evidenziano la rilevanza e l'utilità degli strumenti reporter per studiare l'attività trascrizionale e le vie metaboliche12. Nel complesso, queste considerazioni si concentrano sull'attento adattamento del protocollo a diversi sistemi biologici, sottolineandone al contempo la versatilità e l'ampia applicabilità.
In conclusione, l'utilizzo di reporter bioluminescenti fornisce un potente strumento per sezionare le risposte del lievito di birra ai cambiamenti ambientali. Questo approccio non solo migliora la nostra comprensione della fisiologia di S. eubayanus, ma supporta anche lo sviluppo di ceppi di lievito robusti su misura per le esigenze industriali. La flessibilità e l'efficacia di questo protocollo lo posizionano come una risorsa sia per la ricerca che per le applicazioni biotecnologiche.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questa ricerca è stata finanziata dall'Agencia Nacional de Investigación y Desarrollo (ANID), FONDECYT (1220026) e ANID-Programa Iniciativa Científica Milenio ICN17_022 and NCN2024_040. FM è stato sostenuto dalla borsa di studio post-dottorato ANID FONDECYT N°3220597. PQ è stato sostenuto dalla sovvenzione ANID N°21201057. Il sostegno finanziario è riconosciuto anche al Centro Ciencia & Vida, FB210008, Financiamiento Basal para Centros Científicos y Tecnológicos de Excelencia de ANID.
Materiali
| Name | Company | Catalog Number | Comments |
| Ampicillin, sodium salt | ThermoFisher Scientific | 11593027 | |
| D-Glucose | Sigma-Aldrich | G8270 | |
| DpnI | New England Biolabs | R0176S | |
| EcoRI | New England Biolabs | R0101S | |
| Hygromycine B | Gold Biotechnology | H-270-1 | |
| L-Luciferine | Gold Biotechnology | L-127-10 | |
| Maltose monohydrate | Sigma-Aldrich | 47288 | |
| Phusion Plus PCR Master Mix | ThermoFisher Scientific | F631S | |
| Tecan Infinite 200 PRO M | Tecan | ||
| Wizard Plus SV Minipreps DNA Purirfication System | Promega | A1330 | |
| XhoI | New England Biolabs | R0146S | |
| Zymoprep Yeast Plasmid Miniprep I | Zymo Research | D2001 |
Riferimenti
- Salinas, F., Rojas, V., Delgado, V., López, J., Agosin, E., Larrondo, L. F. Fungal light-oxygen-voltage domains for optogenetic control of gene expression and flocculation in yeast. mBio. 9 (4), e00626-e00718 (2018).
- Jacob, F., Monod, J. Genetic regulatory mechanisms in the synthesis of proteins. J Mol Biol. 3, 318-356 (1961).
- Perez-Samper, G., et al. The Crabtree Effect shapes the Saccharomyces cerevisiae lag phase during the switch between different carbon sources. mBio. 9 (5), e01331-e01418 (2018).
- Vermeersch, L., et al. On the duration of the microbial lag phase. Curr Genet. 65 (3), 721-727 (2019).
- New, A. M., et al. Different levels of catabolite repression optimize growth in stable and variable environments. PLoS Biol. 12 (1), e1001764 (2014).
- Molinet, J., et al. Natural variation in diauxic shift between Patagonian Saccharomyces eubayanus Strains. mSystems. 7 (6), e0064022 (2022).
- Libkind, D., et al. Microbe domestication and the identification of the wild genetic stock of lager-brewing yeast. Proc Natl Acad Sci USA. 108 (35), 14539-14544 (2011).
- Peris, D., et al. Complex ancestries of lager-brewing hybrids were shaped by standing variation in the wild yeast Saccharomyces eubayanus. PLoS Genet. 12 (7), e1006155 (2016).
- Mardones, W., et al. Molecular profiling of beer wort fermentation diversity across natural Saccharomyces eubayanus isolates. Microb Biotechnol. 13 (4), 1012-1025 (2020).
- Brickwedde, A., et al. physiological and regulatory analysis of maltose transporter genes in Saccharomyces eubayanus CBS 12357T. Front Microbiol. 9, 1786 (2018).
- Brouwers, N., et al. In vivo recombination of Saccharomyces eubayanus maltose-transporter genes yields a chimeric transporter that enables maltotriose fermentation. PLoS Genet. 15 (4), e1007853 (2019).
- Meurer, M., Chevyreva, V., Cerulus, B., Knop, M. The regulatable MAL32 promoter in Saccharomyces cerevisiae: characteristics and tools to facilitate its use. Yeast. 34 (1), 39-49 (2017).
- Mashruwala, A. A., Boyd, J. M. De novo assembly of plasmids using yeast recombinational cloning. Methods Mol Biol. 1373, 33-41 (2016).
- Sikorski, R. S., Hieter, P. A system of shuttle vectors and yeast host strains designed for efficient manipulation of DNA in Saccharomyces cerevisiae. Genetics. 122 (1), 19-27 (1989).
- Gietz, R. D., Schiestl, R. H. High-efficiency yeast transformation using the LiAc/SS carrier DNA/PEG method. Nat Protoc. 2 (1), 31-34 (2007).
- Baker, E. P., Hittinger, C. T. Evolution of a novel chimeric maltotriose transporter in Saccharomyces eubayanus from parent proteins unable to perform this function. PLoS Genet. 15 (4), e1007786 (2019).
- Nespolo, R. F., et al. An Out-of-Patagonia migration explains the worldwide diversity and distribution of Saccharomyces eubayanus lineages. PLoS Genet. 16 (5), e1008777 (2020).
- Hohnholz, R., Pohlmann, K. J., Achstetter, T. Impact of plasmid architecture on stability and yEGFP3 reporter gene expression in a set of isomeric multicopy vectors in yeast. Appl Microbiol Biotechnol. 101 (23-24), 8455-8463 (2017).
- Wu, Y., et al. Engineering an efficient expression using heterologous GAL promoters and transcriptional activators in Saccharomyces cerevisiae. ACS Synth Biol. 12 (6), 1859-1867 (2023).
- Calvey, C. H., Willis, L. B., Jeffries, T. W. An optimized transformation protocol for Lipomyces starkeyi. Curr Genet. 60 (3), 223-230 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon