Method Article
في الجسم الحي مراقبة نشاط النسخ أثناء الانتقال الأيضي باستخدام مراسل الإضاءةالأحيا في الخميرة
In This Article
Summary
يستخدم هذا البروتوكول مراسلا حيويا ، مما يسمح بقياسات نشاط النسخ في خميرة الخميرة eubayanus لمراقبة انتقال الجلوكوز إلى المالتوز ، مما يتيح التحليل في الوقت الفعلي للتكيفات الأيضية ودعم تحسين الإجهاد للتخمير الصناعي في ظل ظروف متنوعة.
Abstract
يمثل الاستهلاك المتسلسل للسكر ، من مصدر السكر المفضل إلى مصدر أقل تفضيلا ، تكيفا استقلابيا حاسما في الخميرة ، وهو أمر مهم بشكل خاص للبقاء على قيد الحياة في البيئات المتقلبة مثل تلك الموجودة في تخمير البيرة. ومع ذلك ، فإن تحولات السكر هي متغير بيئي يصعب التنبؤ به واكتشافه ، مما يؤثر على نتيجة تخمير البيرة. يصف هذا البروتوكول نظاما في الجسم الحي لمراقبة تنشيط النسخ المرتبط بالتحول الأيضي من الجلوكوز إلى المالتوز في خميرة الخميرة eubayanus التي تنطبق على سلالات خميرة الخميرة البرية المختلفة.
يستخدم النظام مراسل نسخ عرضي للضوء الحيوي لعملية التمثيل الغذائي المالتوز ، مع التركيز على MAL32 ، لأنه يوفر قراءة جيدة للتحولات الأيضية ، كما تمت دراستها في S. cerevisiae. لهذا الغرض ، تم تحويل سلالات الخميرة مع البلازميدات التي تحتوي على المنطقة التنظيمية MAL32 من S. eubayanus ، مما يتحكم في التعبير عن ترميز الجين لنسخة غير مستقرة من اليراع لوسيفيراز1 ، وجين مقاومة للهيجروميسين يستخدم حصريا أثناء التحول لضمان اكتساب البلازميد. بعد الاختيار ، يمكن زراعة خلايا الخميرة المحولة في ظل ظروف غير انتقائية ، حيث يظل البلازميد العرضي مستقرا في ظروف الثقافة لمدة تصل إلى 7 أيام.
تم التحقق من صحة هذا النظام في ظل بيئة سكر معقدة في فحوصات التخمير الدقيق ، مما يؤكد فعالية مراسل لوسيفيراز في إعلام التحولات الأيضية. تم جمع العينات بانتظام وتحليلها باستخدام مقياس الإضاءة ، مما يوفر رؤى مستمرة لاستجابات الخميرة. على الرغم من أن هذا البروتوكول قابل للتطبيق على نطاق واسع ، إلا أنه ذو قيمة خاصة لتقييم أداء الخميرة في ظل ظروف التخمير ، حيث تشكل التغيرات الأيضية تحديا كبيرا. بالإضافة إلى ذلك ، يمكن تكييف هذه المنهجية عن طريق اختيار مروجين بدائل لاستكشاف مجموعة واسعة من الاستجابات للتغيرات البيئية ، مما يسمح بتوصيف سلالات الخميرة البرية وتحسينها للتطبيقات الصناعية المتنوعة.
Introduction
يجب أن تتكيف الكائنات الحية الدقيقة مثل الخمائر باستمرار مع الظروف البيئية الديناميكية للحفاظ على اللياقة البدنية والبقاءعلى قيد الحياة 1. غالبا ما تتضمن هذه التعديلات دوائر تنظيمية جينية معقدة تدمج إشارات متعددة خارج الخلية لتنسيق الاستجابات الأيضية الدقيقة2،3. في البيئات الصناعية ، تعد كفاءة هذه التحولات الأيضية أمرا بالغ الأهمية ، لا سيما في عمليات التخمير حيث يمكن أن تؤدي الاضطرابات إلى عوائد دون المستوى الأمثل أو تخمير غير مكتمل3. يتمثل التحدي الأيضي الرئيسي الذي يجب التغلب عليه في عندما تنتقل الخلايا من مصدر الكربون المفضل إلى مصدر الكربون الثانوي ، مثل تحول الجلوكوز إلى المالتوز. تقدم هذه العملية مرحلة تأخر يتم خلالها تقليل الجنات المطلوبة لعملية التمثيل الغذائي لمصادر الكربون الثانوية ، مما يتيح استئناف النمو4،5.
في التخمير ، يجب أن تنتقل خميرة الخميرة بكفاءة من استقلاب الجلوكوز إلى استقلاب المالتوز. على وجه الخصوص ، S. eubayanus ، الأنواع الأبوية التي تتحمل البرد من خمائر الجعة ، تظهر تباينا ظاهريا كبيرا في قدرتها على التكيف مع مثل هذه التحولات6. غالبا ما تظهر العزلات البرية ، مثل تلك الموجودة في باتاغونيا ، مراحل تأخر طويلة واستهلاك أبطأ للمالتوز مقارنة بالسلالات المستأنسة ، والتي تم اختيارها لقدراتها التخميرية المحسنة7،8. في حين أن السلالات المستأنسة قد تكيفت لتخمير بيئات السكر المختلط بكفاءة ، غالبا ما تظهر السلالات البرية تحولا أيضيا أبطأ ، ربما بسبب قمع أقوى للجلوكوز والتنظيم المتغير لموضع MAL 6،9.
تستخدم هذه الدراسة التباين الطبيعي ل S. eubayanus كنموذج للتحقيق في التكيفات الأيضية في ظل ظروف الجلوكوز إلى المالتوز ، والاستفادة من مراسل لوسيفيراز غير مستقر لمراقبة التعبير الجيني في الجسم الحي ، من خلال تتبع اللمعان1. يقوم المراسل المختار MAL32 بتشفير بروتين المالتاز ، وهو إنزيم محوري لتقويض المالتوز أثناء انتقالات الجلوكوز إلى المالتوز10،11. من اللافت للنظر أن محفز MAL32 يمثل علامة ناجحة لتقييم تحريض استقلاب المالتوز بعد استنفاد الجلوكوز12. من خلال دمج نظام المراسل هذا ، هدفنا إلى توضيح آليات التكيف الخاصة بالسلالة وتحديد الأهداف المحتملة لتحسين أداء التخمير. علاوة على ذلك ، يمكن توسيع هذا البروتوكول إلى ما هو أبعد من التخمير ، ويقدم تطبيقات في التكنولوجيا الحيوية والدراسات البيئية حيث تلعب بيئات السكر المعقدة دورا مهما. إن فهم المحددات الجينية والتنظيمية للاستجابات البيئية المتقلبة في S. eubayanus يعزز معرفتنا بفسيولوجيا الخميرة ، مما يدعم تطوير سلالات قوية للتطبيقات الصناعية والبحثية المتنوعة.
Protocol
1. بناء المراسلين العرضيين
ملاحظة: اخترنا منطقة تنظيمية للمراسلين بناء على أدبيات الخميرة لبناء البلازميد العرضي لمراقبة استهلاك المالتوز6،11،12. تم تعريف محفز الجين المراسل المرشح على أنه التسلسل التنظيمي مباشرة من المنبع المرشح إلى النيوكليوتيدات التي تحيط ب ORF المجاور. تم تضخيم هذه المنطقة من الحمض النووي الجيني ل S. eubayanus CBS12357 سلالةمرجعية T 10. يضمن هذا النهج البناء عالي الدقة للبلازميدات العرضية المناسبة للتطبيقات النهائية ، بما في ذلك دراسة الظروف الأخرى المثيرة للاهتمام في الخميرة.
- صمم شظايا الحمض النووي والبادئات المتداخلة لتشمل 30 تسلسلا من تسلسل إقران النيوكليوتيدات بين الأجزاء لتجميع سلس عبر استنساخ إعادة تركيب الخميرة13 (الشكل 1). انظر الجدول التكميلي S1 للحصول على تسلسلات التمهيدي.
- لتجنب الطفرات ، قم بتضخيم منطقة المروج (انظر أعلاه) ، بالإضافة إلى أشرطة لوسيفيراز غير المستقرة (LUC-PEST) و hphMX 1 باستخدام بوليميراز الحمض النووي عالي الدقة (راجع الشركة المصنعة للبوليميراز للحصول على تفاصيل البروتوكول). اضبط جهاز التدوير الحراري على 98 درجة مئوية لمدة 10 دقائق للتمسخ الأولي ، متبوعا ب 30 دورة من التمسخ 98 درجة مئوية ، والتلدين 60 درجة مئوية ، وتمديد 72 درجة مئوية ؛ أكمل البروتوكول بتمديد نهائي عند 72 درجة مئوية لمدة 10 دقائق.
ملاحظة: عند استخدام بلازميدات مكوك الخميرة كقوالب ل PCR ، يوصى بإخضاع تفاعلات Amplicon لهضم DpnI (انظر بروتوكول الشركة المصنعة للإنزيم) للتخلص من أي آثار لقالب البلازميد التي قد تتداخل مع تحول الخميرة. - قم بهضم العمود الفقري pRS426 البلازميد14 باستخدام إنزيمات تقييد EcoRI و XhoI لخطية الناقل ، وقطعه في موقع الاستنساخ المتعدد ، وإعداده لإعادة التركيب (راجع بروتوكول الشركة المصنعة للإنزيم).
- امزج العمود الفقري الخطي pRS426 مع شظايا الحمض النووي المضخم وقم بتحويل الخليط إلى خميرة الخميرة BY4741 باستخدام استنساخ إعادة تركيب الخميرة13،15 للسماح لآلية إعادة التركيب المتماثلة للخميرة بتجميع بنية البلازميد في الجسم الحي.
- قم بلوحة الخميرة المحولة على وسط اصطناعي كامل (SC) يفتقر إلى اليوراسيل (SC-URA) لاختيار المحولات التي تحتوي على المتجه الجديد pRS426- MAL32-LUC-hphMX البلازميد.
- استخرج البلازميدات من الخميرة باستخدام مجموعة تحضير الخميرة المصغرة وفقا لتعليمات الشركة المصنعة وقم بتحويل البلازميد المستخرج إلى الإشريكية القولونية DH5α لتضخيم البناء لمزيد من التحليلات.
- فحص المستعمرات البكتيرية عبر تفاعل البوليميراز المتسلسل لتأكيد التجميع الصحيح للتركيبات.
- قم بتنقية الحمض النووي البلازميد باستخدام مجموعة تنقية البلازميد القياسية وقم بإجراء تسلسل سانجر للتحقق من سلامة وتسلسل البلازميدات المجمعة.
2. تحويل سلالات الخميرة
ملاحظة: تم تكييف بروتوكول تحويل الخميرة من طريقة تم إنشاؤها مسبقا ل S. eubayanus16 وتم تطبيقه بنجاح على أنواع الخميرة الأخرى وسلالات الخميرة المخمرة. تم اشتقاق هذا البروتوكول من طريقة تحويل الخميرة التقليدية من Gietz Lab15. يتيح هذا النهج تكامل البلازميد الفعال والاختيار في ظل ظروف تجريبية متنوعة ، مما يوفر طريقة قوية ومرنة لتحويل سلالات الخميرة المختلفة. إنه يضمن اختيارا موثوقا وصيانة للبلازميد العرضي تحت ضغط الهيغروميسين.
- استزراع مستعمرة واحدة من الخميرة الطازجة في 5 مل من YPD (1٪ وزن / حجم مستخلص الخميرة ، 2٪ وزن / حجم البيبتون ، 2٪ وزن / حجم الجلوكوز) عند 20 درجة مئوية عند 200 دورة في الدقيقة من التحريك بين عشية وضحاها.
- قم بتخفيف المزرعة إلى OD620 من 0.2 في وسط YPD الطازج واحتضانه عند 20 درجة مئوية مع التحريك عند 200 دورة في الدقيقة حتى منتصف مرحلة السجل (OD620 0.4-0.6). اعتمادا على سلالة الخميرة ، يتطلب هذا عادة 3-4 ساعات.
- احصد الخلايا عن طريق الطرد المركزي عند 21,380 × جم لمدة 1 دقيقة في درجة حرارة الغرفة ، وتخلص من المادة الطافية ، واغسل الحبيبات 3x بالماء المعقم.
- أعد تعليق الخلايا المغسولة في 100 ميكرولتر من أسيتات الليثيوم 0.1 M ، جهاز طرد مركزي كما هو موضح في الخطوة 2.3 ، وكرر العملية 2x.
- أضف المكونات التالية إلى الخلايا بهذا الترتيب: 240 ميكرولتر من 50٪ وزن / حجم PEG-4000 ، 35 ميكرولتر من 1 M LiAc ، 5 ميكرولتر من الحمض النووي البلازميد (100 نانوغرام / ميكرولتر) ، 20 ميكرولتر من الحمض النووي الحامل أحادي الشريطة (ssDNA) تم تسخينه مسبقا عند 98 درجة مئوية لمدة 10 دقائق. تخلط بلطف لتجانس خليط التحول.
- احتضان الخليط على حرارة 20 درجة مئوية لمدة 30 دقيقة ، متبوعا بصدمة حرارية عند 34 درجة مئوية لمدة 55 دقيقة. بعد الصدمة الحرارية ، أضف 38 ميكرولتر من الإيثانول بنسبة 100٪ إلى التركيز النهائي بنسبة 0.1٪ تقريبا واحتضنه لمدة 5 دقائق إضافية عند 34 درجة مئوية.
ملاحظة: تم تحسين درجات الحرارة المستخدمة في هذا البروتوكول ل Saccharomyces eubayanus ، وهي سلالة متحملة للتبريد معزولة عن الغابات المعتدلة.
مطلوب استخدام الإيثانول بنسبة 100٪ للحث على الإجهاد الخلوي ، مما يعزز كفاءة بروتوكول التحول. - أضف 600 ميكرولتر من YPD إلى الخلايا المحولة ، وجهاز الطرد المركزي كما في الخطوة 2.3 ، وتخلص من المادة الطافية.
- أعد تعليق حبيبات الخلية في 600 ميكرولتر من YPD الطازج واحتضان التعليق دون تحريض طوال الليل عند 4 درجات مئوية للسماح بالاسترداد.
- قم بلوحة الخلايا المحولة على أجار YPD المكملة ب 200 ميكروغرام / مل هيغروميسين واحتضانها عند 20 درجة مئوية -30 درجة مئوية لمدة 48-72 ساعة.
- حدد 10-12 مستعمرة من ألواح التحويل وأعد خطها على أجار YPD الذي يحتوي على 200 ميكروغرام / مل من hygromycin لضمان وجود البلازميد وإنشاء رقعة مختلطة من المستعمرات المختارة لمزيد من الاستخدام.
3. التحقق من صحة التلألؤ
ملاحظة: للتحقق من صحة وظائف المراسلين المضيئين ، تم اختبار السلالات المحولة في ظل ظروف مصممة للحث على التعبير التفاضلي لمراسل لوسيفيراز. يسمح هذا التحقق التدريجي بتقييم وظائف المراسل في ظل ظروف السكر المتقلبة ، والاستفادة من متانة المقايسات المضيئة لالتقاط الاستجابات الأيضية في الوقت الفعلي.
- اختر عينة من رقعة سلالة الخميرة المحولة وقم بتلقيحها في وسط YP (1٪ وزن / حجم مستخلص الخميرة ، 2٪ وزن / حجم بيبتون) تحتوي على 5٪ وزن / حجم جلوكوز و 200 ميكرومتر هيجروميسين. احتضان عند 25 درجة مئوية دون اهتزاز لمدة 24 ساعة. قم بتحديث الثقافات في وسط طازج عند تخفيف 1:10 واحتضانها في نفس الظروف لمدة 24 ساعة أخرى.
- اغسل الخلايا بوسط YP بدون سكر وقم بتلقيحها في وسائط الاختبار عند تخفيف 1:10. يتم استكمال وسائط الاختبار باللوسيفيرين إلى تركيز نهائي يبلغ 3 ملي مولار وتحتوي على 200 ميكرومتر هيغروميسين للحفاظ على استقرار البلازميد.
- لاختبار نمو السكر المختلط ، استخدم مصفوفة الجلوكوز والمالتوز بالتركيزات التالية (٪ وزن / حجم): الجلوكوز (0٪ ، 0.5٪ ، 1٪ ، 2٪) والمالتوز (0٪ ، 2٪ ، 5٪ ، 10٪ ، 20٪ ، 30٪) في وسط YP. يتم استكمال كل حالة باللوسيفيرين (التركيز النهائي 3 ملي مولار) و 200 ميكرومتر هيغروميسين. قم بتوزيع 200 ميكرولتر من الثقافة في كل بئر من صفيحة 96 بئرا (الشكل 2).
- قم بقياس اللمعان و OD620 كل 30 دقيقة لمدة 72 ساعة باستخدام قارئ لوحة مقياس الإضاءة ، دون توهين و 1 ثانية من وقت التكامل ، مما يضمن نشاط المراسل المستمر ومراقبة كثافة الخلية.
4. أخذ عينات التخمير ومراقبة التلألؤ
ملاحظة: تعرضت السلالات المحولة لظروف تخمير دقيق خاضعة للرقابة لتقييم تنشيط التلألؤ أثناء التخمير. يتيح ذلك مقارنة تنشيط التلألؤ عبر ظروف التخمير المختلفة ، مما يوفر رؤى حول استجابات التمثيل الغذائي للخميرة خلال فترات التخمير الممتدة.
- تحضير وسط مستخلص الشعير (12 درجة أفلاطون) عن طريق إذابة مستخلص الشعير في الماء وتعقيمه عند 100 درجة مئوية لمدة 20 دقيقة. اترك الوسط يبرد إلى درجة حرارة الغرفة قبل التلقيح.
- سلالات الخميرة المحولة قبل الزراعة في 5 مل من YPD (1٪ وزن / حجم مستخلص الخميرة ، 2٪ وزن / حجم البيبتون ، 2٪ وزن / حجم الجلوكوز) عند 20 درجة مئوية مع التحريك عند 200 دورة في الدقيقة لمدة 24 ساعة. انقل الزراعة المسبقة إلى 50 مل من وسط مستخلص الشعير. احتضان المزرعة عند 20 درجة مئوية مع التحريك عند 200 دورة في الدقيقة لمدة 24 ساعة.
- احصد الخلايا عن طريق الطرد المركزي عند 21،380 × جم لمدة 1 دقيقة في درجة حرارة الغرفة وأعد تعليقها لتحضير ثلاث نسخ 50 مل من التخمير الدقيق في 12 درجة وسط مستخلص الشعيرأفلاطون 9. لتحسين أداء التخمير ، استكمل الوسط ب 0.3 مجم / لتر ZnCl2.
- لضمان كثافة الخلايا المتسقة عبر التكرارات ، احسب حجم اللقاح باستخدام الصيغة:
حجم اللقاح = (1.5 × 106) × الحجم (مل) × درجة أفلاطون - تلقيح الوسط المحضر واحتضان المزارع عند 20 درجة مئوية دون رج لمدة 14 يوما. راقب تقدم التخمير عن طريق تسجيل فقدان ثاني أكسيد الكربون2 يوميا. قم بوزن الأوعية في وقت واحد كل يوم لقياس فقدان الوزن التراكمي كمؤشرلإنتاج ثاني أكسيد الكربون.
- لمراقبة التلألؤ ، قم بأخذ عينة دورية من 200 ميكرولتر من كل تخمير دقيق. أضف لوسيفيرين إلى العينات لتحقيق تركيز نهائي قدره 3 ملي مولار وقياس اللمعان و OD620 باستخدام قارئ لوحة مقياس الإضاءة دون توهين و 1 ثانية من وقت التكامل. قم بإجراء القياسات على فترات زمنية محددة طوال فترة التخمير (الشكل 3).
النتائج
توضح النتائج التالية قابلية استخدام مراسل الإنارة الذي تم إنشاؤه حديثا لمراقبة انتقال الجلوكوز إلى المالتوز في خلايا الخميرة في عملية تخميرية. يتم تجميع بلازميدات المراسل في البداية باستخدام استنساخ إعادة تركيب الخميرة13 لإنشاء تركيبات مراسل عرضي. تتطلب هذه العملية تداخلا لتسلسل النيوكليوتيدات لما لا يقل عن 30 نيوكليوتيد بين المضخمات المختلفة ، وكلها موضحة في الشكل 1. تم تضخيم المناطق التنظيمية التي تضم 858 نقطة أساس من موقع بدء الجين ATG ل MAL32 من الحمض النووي الجيني باستخدام سلالة S. eubayanus CBS12357T7. يحتوي S. eubayanus الجينوم على جينين وظيفيين MAL32 ، مشفرين داخل مواقع MAL كاملة في الكروموسومات V و XVI11. بناء على الأدبيات11 ، اخترنا مروج الأخير لمراسلنا الأسقفي. تم تضخيم أشرطة luciferase ORF و hphMX غير المستقرة من البلازميدات التي تم الإبلاغ عنها سابقا pRS426-P TDH3-Luc و pRS426-mCherry 1 ، بحجم أمبليكون يبلغ 1,901 و 1,951 نقطة أساس ، على التوالي. تطلبت هذه الأمبليكونات خطوة إضافية ، باستخدام تقييد إنزيم DpnI لهضم أي أثر لبلازميد القالب. تم دمج كل هذه الأجزاء مع البلازميد المفتوح pRS426 للحصول على مراسل عرضي ل MAL32 المعروف باسم pRS426-PMAL32-LUC-hphMX (متاح عند الطلب). بعد ذلك ، تم تحويل ثلاث سلالات متميزة من S. eubayanus ، CBS12357T و CL467.1 و QC18 ، والتي تظهر نموا تفاضليا في ظل ظروف المالتوز6 ، مع بناء المراسل هذا. بعد ذلك ، اخترنا المحولات الناجحة عن طريق مقاومة المضادات الحيوية للهيغروميسين لضمان دمج مراسل البلازميد.
اختبرنا كل سلالة محولة في ظل ظروف الجلوكوز إلى المالتوز للتحقق من صحة نشاط النسخ للمراسل. قمنا بقياس نشاط محفز MAL32 تحت مجموعة من تركيزات الجلوكوز والمالتوز (الشكل 2). تباين نشاط اللوسيفيراز في شدة الإشارة واستجابة التوقيت بين السلالات الثلاث (ص < 0.05 ، ANOVA) ، مما يدل على التنشيط التفاضلي في كل خلفية جينية. على سبيل المثال ، حدث تنشيط المراسل في خلفية QC18 فقط فوق تركيزات الجلوكوز بنسبة 1٪. في المقابل ، أظهرت السلالتان المتشابهتان ظاهريا ، CBS12357T و CL467.1 ، مستويات تنشيط نسخ عالية عندما لم يكن الجلوكوز موجودا في البداية في الوسائط6. ومن المثير للاهتمام أن نظام المراسل يعكس بشكل فعال تنشيط النسخ التفاضلي في هاتين الخلفيتين الجينيتين ، حيث اكتشفنا التنشيط النسخي لجين المبلغ بعد 6 ساعات و 24 ساعة من النمو في ظروف بدون جلوكوز في CBS12357T و CL467.1 ، على التوالي. توضح هذه النتائج أن النتائج المتشابهة ظاهريا قد تختلف في تنظيم النسخ عبر السلالات.
لتقييم فعالية أنظمة المراسل في ظل ظروف التخمير ، أجرينا اختبار تخمير دقيق في ظل ظروف نقيع الشعير باستخدام السلالات الثلاثة المحولة. لهذا الغرض ، تم جمع 100 ميكرولتر من العينات اليومية لمدة 7 أيام من كل تخمير دقيق. بعد ذلك ، تم قياس نشاط لوسيفيراز و OD620 في كل حالة لتقييم التنشيط النسخي لاستجابات الانتقال الأيضي أثناء التخمير (الشكل 3). أظهرت جميع السلالات الثلاث لمعانا قويا من pRS426-PMAL32-LUC-hphMX ، والذي كان غائبا في السلالات البرية. أظهرت سلالة CL467.1 أعلى القيم ، وبلغت ذروتها بعد أربعة أيام (ص < 0.05 ، ANOVA). في المقابل ، بلغ كل من CBS12357T و QC18 ذروته عند 24 ساعة ، حيث أظهر CBS12357T مستويات أعلى بكثير من QC18 (ص < 0.05 ، ANOVA). هذه النتائج قابلة للمقارنة مع تلك التي تم الحصول عليها في ظل ظروف الزراعة الدقيقة (الشكل 2) ، حيث تظهر تنشيط نسخ أعلى في CL467.1 مقابل السلالتين الأخريين وتنشيط المحفز المتأخر في QC18. تؤكد هذه النتائج على قدرة المراسلين المضيئين على مراقبة التعبير الجيني ديناميكيا استجابة للتغيرات الأيضية في الخميرة. يتماشى هذا النهج بشكل جيد مع الدراسات السابقة ، مثل استخدام الخميرة كهيكل لتطوير المقايسات الوظيفية.
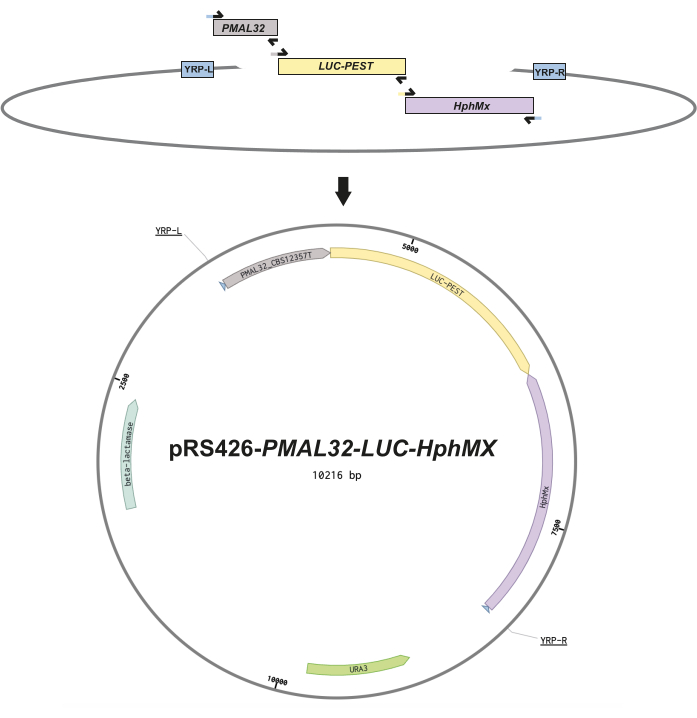
الشكل 1: تصميم البناء للمراسلين العرضيين. يوضح هذا الشكل التخطيطي تصميم كل بلازميد. (أ) شظايا الحمض النووي التي تصور البادئات المتداخلة (الأسهم السوداء) ، والتي تتضمن 30 تسلسلا متجانسا من النيوكليوتيدات بين الأجزاء لتسهيل التجميع السلس عبر إعادة تركيب الخميرة المتجانسة. (ب) خريطة متجهة للمبلغ العرضي باستخدام منطقة محفز MAL32 (PMAL32) من سلالة CBS12357T ، واللوسيفيراز غير المستقر (LUC-PEST) ، وكاسيت hygromycin (hphMX) في اتجاه عكسي تم دمج هذه الأجزاء في مواقع استنساخ pRS426 المتعددة بعد التمهيدي لإعادة تركيب الخميرة إلى اليسار واليمين (YPR-L و YRP-R) المشار إليه في خريطة المتجه. أخيرا ، يتم عرض إطارات القراءة المفتوحة لمقاومة المضادات الحيوية البكتيرية (بيتا لاكتامازي) وضمور اليوراسيل (URA3). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
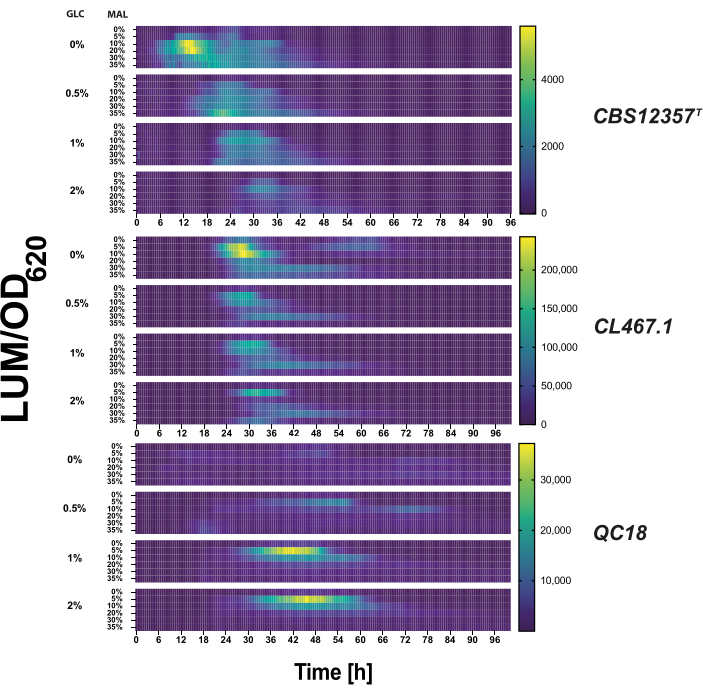
الشكل 2: اختبار مراسل الانتقال الأيضي في ظل ظروف الزراعة الدقيقة. باستخدام مصفوفة من تركيزات الجلوكوز المختلفة (0٪ ، 0.5٪ ، 1٪ ، 2٪) والمالتوز (0٪ ، 2٪ ، 5٪ ، 10٪ ، 20٪ ، 30٪) في وسط YP ، قمنا بتقييم تنشيط النسخ pMAL32 في سلالات CBS12357T (العلوي) و CL467.1 (الوسط) و QC18 (أدناه) سلالات خميرة eubayanus . يظهر نشاط اللوسيفيراز في خريطة حرارية على أنه متوسط اللمعان الذي تم تطبيعه بواسطة الكثافة البصرية عند 620 نانومتر (LUM / OD620) في وحدات تعسفية لكل سلالة محولة في مصفوفة الجلوكوز والمالتوز لمدة 100 ساعة. يظهر أعلى تلألؤ (أو تنشيط المروج) باللون الأصفر الفاتح ، ويظهر التعطيل باللون الأزرق الداكن في خريطة التمثيل اللوني. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
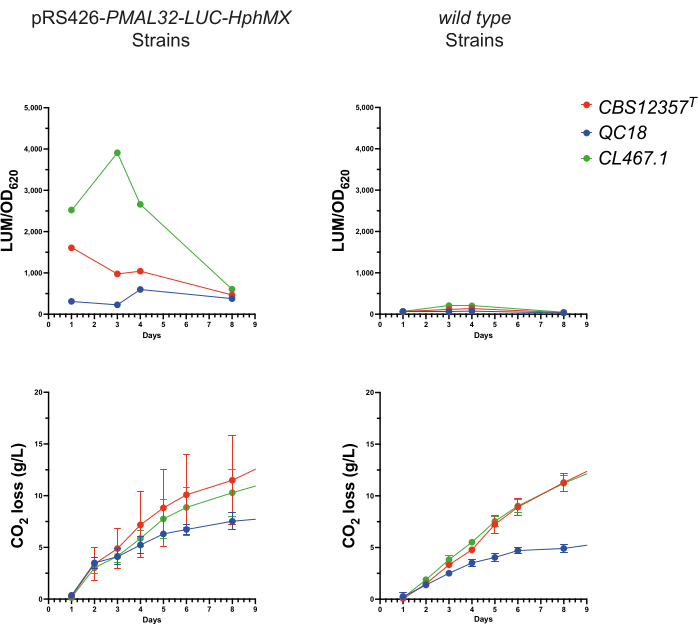
الشكل 3: مراقبة التلألؤ أثناء التخمير. تقييم أداء مراسل pRS426-PMAL32-LUC-hphMX أثناء عملية التخمير. في اللوحات العلوية ، يتم عرض إشارة التلألؤ (LUM / OD620) على مدى فترة تخمير مدتها 7 أيام في السلالات المحولة مقابل السلالات البرية . تصور الألواح السفلية رسوما بيانيةلإخراج فقدان ثاني أكسيد الكربون (جم / لتر) أثناء التخمير ، مما يدل على أداء مماثل بين كلتا المجموعتين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول التكميلي S1: الاشعال المستخدمة في بناء المراسل. يوفر هذا الجدول معلومات مفصلة عن البادئات المستخدمة في هذه الدراسة ، بما في ذلك أسمائها وتسلسلها (5 إلى 3) وأطوالها. تم تصميم البادئات لتضخيم المناطق المستهدفة عند إنشاء مراسلين عرضيين والتحقق من صحة وظائفهم في خميرة الخميرة. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
توضح هذه الدراسة فعالية مراسل التلألؤ الحيوي العرضي لمراقبة تنشيط النسخ في S. eubayanus تحت التحولات الأيضية. من خلال استخدام MAL32 كمراسل نسخ11 ، يمكننا تتبع التحولات الأيضية الرئيسية في الوقت الفعلي ، مما يوفر إطارا قويا لفهم التكيفات الخاصة بالسلالة. يقدم هذا المراسل ، الذي تم اختياره لدوره في استقلاب المالتوز ، مزايا مميزة في تقييم المرونة الأيضية في الخميرة ، مثل المراقبة في الجسم الحي ، والتحديد الدقيق للتحولات الأيضية ، والتوصيف الظاهري التفصيلي للخلفيات الجينية المختلفة. كشفت المقايسات في ظل ظروف السكر المختلط عن تباين كبير في تنشيط المراسل بين سلالات S. eubayanus المختبرة ، مما يؤكد التنوع الظاهري داخل هذا النوع. يسلط هذا التباين ، الذي من المحتمل أن يكون مدفوعا بالاختلافات الجينية في تنشيط النسخ MAL ، الضوء على إمكانات S. eubayanus البرية كمورد لتحديد السمات التي يمكن أن تحسن أداء التخمير الصناعي. والجدير بالذكر أن S. eubayanus تظهر العزلات من باتاغونيا أكبر تنوع جيني ، وتضم سلالات متعددة داخل منطقة جغرافية واحدة6،17 ، مما قد يساهم في تباين النمط الظاهري المرصود. تشير التحولات الأيضية المطولة التي لوحظت في بعض السلالات إلى فرص لتحسين الإجهاد ، بشكل أساسي من خلال مناهج التطور المختبري الجيني أو التكيفي. يعد فهم هذه الاستجابة أمرا بالغ الأهمية لتحسين عمليات التخمير الصناعي.
من المزايا البارزة للبروتوكول الموصوف قدرته على التكيف. يمكن تصميم النظام للتحقيق في مجموعة واسعة من الاستجابات النسخية أو مسارات التمثيل الغذائي عن طريق استبدال المروجين البديلين ، وتوسيع قابليته للتطبيق إلى ما هو أبعد من التخمير لعمليات التكنولوجيا الحيوية الأخرى. علاوة على ذلك ، تضمن الطبيعة العرضية لنظام البلازميد تعبيرا مستقرا دون الحاجة إلى التكامل الجيني ، وتبسيط بناء السلالة وسير العمل التجريبي. إن اكتشاف S. eubayanus باعتباره الوالد الذي يتحمل البرد للخمائر التي تخمر الجعة قد قدم نظرة ثاقبة حول تدجين وتطور هذه الأنواع الهجينة الصناعية7،9،16. تسلط نتائجنا الضوء على فائدة S. eubayanus ككائن حي نموذجي لدراسة التكيفات الأيضية المعقدة. إن تنوعها الطبيعي وأهميتها لتخمير الجعة تجعلها مرشحا مثاليا للتحقيق في الآليات الجينية والتنظيمية الكامنة وراء أداء التخمير. يمكن أن يركز العمل المستقبلي على توسيع لوحة السلالات التي تم اختبارها ، ودمج السلالات المستأنسة ، أو السلالات البرية الجديدة ذات القدرة على التخمير لمقارنة كفاءتها الأيضية في ظل ظروف مماثلة مباشرة.
في حين أن هذا البروتوكول يوفر العديد من المزايا ، يجب مراعاة بعض القيود. قد يظهر المراسلون العرضيون ، على سبيل المثال ، تباينا في عدد نسخ البلازميد ، مما قد يؤثر على اتساق قياسات التعبير الجيني عبر السلالات18. علاوة على ذلك ، فإن استجابات النسخ التي لوحظت في S. eubayanus قد لا تترجم مباشرة إلى كائنات أخرى بسبب الاختلافات في توافق المروج أو الآلية الخلوية19. يتطلب تكييف هذا البروتوكول معايرة دقيقة لظروف النمو والاختيار لضمان استقرار البلازميد والحفاظ على الضغط الانتقائي ، وهو أمر بالغ الأهمية للحصول على نتائج قابلة للتكرار18. بالإضافة إلى ذلك ، يعد تحسين كفاءات التحول وتكييف معايير النمو لسلالات أو مراسلين محددين أمرا ضروريا للتنفيذ الناجح20. مناهج مماثلة في S. cerevisiae ، مثل استخدام نظام المحفز MAL32 المقترن بعلامات الفلورسنت لدراسة مستويات النسخ في ظل ظروف الجلوكوز والمالتوز ، تسلط الضوء على أهمية وفائدة أدوات المراسل للتحقيق في نشاط النسخ ومسارات التمثيل الغذائي12. بشكل عام ، تركز هذه الاعتبارات على تكييف البروتوكول بعناية مع الأنظمة البيولوجية المتنوعة مع التأكيد على تعدد استخداماته وقابليته للتطبيق على نطاق واسع.
في الختام ، يوفر استخدام مراسلي الإضاءة الحيوية أداة قوية لتشريح استجابات الخميرة المخمرة للتغيرات البيئية. لا يعزز هذا النهج فهمنا لفسيولوجيا S. eubayanus فحسب ، بل يدعم أيضا تطوير سلالات خميرة قوية مصممة خصيصا لتلبية الاحتياجات الصناعية. إن مرونة وفعالية هذا البروتوكول تجعله أحد الأصول لكل من تطبيقات البحث والتكنولوجيا الحيوية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم تمويل هذا البحث من قبل الوكالة الوطنية للأبحاث والتنمية (ANID) و FONDECYT (1220026) و ANID-Programa Iniciativa Científica Milenio ICN17_022 و NCN2024_040. تم دعم FM من قبل منحة ANID FONDECYT Postdoctorado رقم 3220597. تم دعم PQ من قبل منحة ANID رقم 21201057. كما يتم الاعتراف بالدعم المالي ل Centro Ciencia & Vida, FB210008, Financiamiento Basal para Centros Científicos y Tecnológicos de Excelencia de ANID.
Materials
| Name | Company | Catalog Number | Comments |
| Ampicillin, sodium salt | ThermoFisher Scientific | 11593027 | |
| D-Glucose | Sigma-Aldrich | G8270 | |
| DpnI | New England Biolabs | R0176S | |
| EcoRI | New England Biolabs | R0101S | |
| Hygromycine B | Gold Biotechnology | H-270-1 | |
| L-Luciferine | Gold Biotechnology | L-127-10 | |
| Maltose monohydrate | Sigma-Aldrich | 47288 | |
| Phusion Plus PCR Master Mix | ThermoFisher Scientific | F631S | |
| Tecan Infinite 200 PRO M | Tecan | ||
| Wizard Plus SV Minipreps DNA Purirfication System | Promega | A1330 | |
| XhoI | New England Biolabs | R0146S | |
| Zymoprep Yeast Plasmid Miniprep I | Zymo Research | D2001 |
References
- Salinas, F., Rojas, V., Delgado, V., López, J., Agosin, E., Larrondo, L. F. Fungal light-oxygen-voltage domains for optogenetic control of gene expression and flocculation in yeast. mBio. 9 (4), e00626-e00718 (2018).
- Jacob, F., Monod, J. Genetic regulatory mechanisms in the synthesis of proteins. J Mol Biol. 3, 318-356 (1961).
- Perez-Samper, G., et al. The Crabtree Effect shapes the Saccharomyces cerevisiae lag phase during the switch between different carbon sources. mBio. 9 (5), e01331-e01418 (2018).
- Vermeersch, L., et al. On the duration of the microbial lag phase. Curr Genet. 65 (3), 721-727 (2019).
- New, A. M., et al. Different levels of catabolite repression optimize growth in stable and variable environments. PLoS Biol. 12 (1), e1001764 (2014).
- Molinet, J., et al. Natural variation in diauxic shift between Patagonian Saccharomyces eubayanus Strains. mSystems. 7 (6), e0064022 (2022).
- Libkind, D., et al. Microbe domestication and the identification of the wild genetic stock of lager-brewing yeast. Proc Natl Acad Sci USA. 108 (35), 14539-14544 (2011).
- Peris, D., et al. Complex ancestries of lager-brewing hybrids were shaped by standing variation in the wild yeast Saccharomyces eubayanus. PLoS Genet. 12 (7), e1006155 (2016).
- Mardones, W., et al. Molecular profiling of beer wort fermentation diversity across natural Saccharomyces eubayanus isolates. Microb Biotechnol. 13 (4), 1012-1025 (2020).
- Brickwedde, A., et al. physiological and regulatory analysis of maltose transporter genes in Saccharomyces eubayanus CBS 12357T. Front Microbiol. 9, 1786 (2018).
- Brouwers, N., et al. In vivo recombination of Saccharomyces eubayanus maltose-transporter genes yields a chimeric transporter that enables maltotriose fermentation. PLoS Genet. 15 (4), e1007853 (2019).
- Meurer, M., Chevyreva, V., Cerulus, B., Knop, M. The regulatable MAL32 promoter in Saccharomyces cerevisiae: characteristics and tools to facilitate its use. Yeast. 34 (1), 39-49 (2017).
- Mashruwala, A. A., Boyd, J. M. De novo assembly of plasmids using yeast recombinational cloning. Methods Mol Biol. 1373, 33-41 (2016).
- Sikorski, R. S., Hieter, P. A system of shuttle vectors and yeast host strains designed for efficient manipulation of DNA in Saccharomyces cerevisiae. Genetics. 122 (1), 19-27 (1989).
- Gietz, R. D., Schiestl, R. H. High-efficiency yeast transformation using the LiAc/SS carrier DNA/PEG method. Nat Protoc. 2 (1), 31-34 (2007).
- Baker, E. P., Hittinger, C. T. Evolution of a novel chimeric maltotriose transporter in Saccharomyces eubayanus from parent proteins unable to perform this function. PLoS Genet. 15 (4), e1007786 (2019).
- Nespolo, R. F., et al. An Out-of-Patagonia migration explains the worldwide diversity and distribution of Saccharomyces eubayanus lineages. PLoS Genet. 16 (5), e1008777 (2020).
- Hohnholz, R., Pohlmann, K. J., Achstetter, T. Impact of plasmid architecture on stability and yEGFP3 reporter gene expression in a set of isomeric multicopy vectors in yeast. Appl Microbiol Biotechnol. 101 (23-24), 8455-8463 (2017).
- Wu, Y., et al. Engineering an efficient expression using heterologous GAL promoters and transcriptional activators in Saccharomyces cerevisiae. ACS Synth Biol. 12 (6), 1859-1867 (2023).
- Calvey, C. H., Willis, L. B., Jeffries, T. W. An optimized transformation protocol for Lipomyces starkeyi. Curr Genet. 60 (3), 223-230 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved