Method Article
Ведение беременности и кормления кроликов, перенесших эмбрионы и генетически модифицированных
* Эти авторы внесли равный вклад
В этой статье
Резюме
В данном протоколе описана методика ведения беременности и кормления кроликов, перенесших эмбрионы и генетически модифицированные, направленная на снижение смертности новорожденных кроликов и повышение эффективности подготовки генетически отредактированных кроликов.
Аннотация
С развитием научных исследований растет спрос на генетически отредактированные модели кроликов. Тем не менее, существуют ограниченные системы управления беременностью и кормлением для генетически отредактированных кроликов, что приводит к низким показателям выживаемости среди генетически отредактированных кроликов, подготовленных многими неопытными исследователями. Поэтому правильное руководство имеет важное значение. В данной статье обобщены разработанные в лаборатории автора методы стельности и кормления генетически модифицированных кроликов и изложен ряд фундаментальных процессов. К ним относятся диагностика беременности, дородовой уход, акушерство, вспомогательное грудное вскармливание, отлучение от груди и другие процедуры, а также спасение и уход за слабыми новорожденными кроликами. По сравнению с традиционными методами естественных родов и вскармливания, используемыми в кролиководческих хозяйствах, этот подход предполагает более совершенное управление, требующее дополнительного времени и усилий, но значительно повышающее выживаемость подсосных кроликов. Методы, описанные в этой статье, подходят для большинства сценариев лабораторного разведения кроликов с отредактированными генами или эмбрионами и являются простым и эффективным ориентиром для других исследователей.
Введение
Кролики являются классической животной моделью для биомедицинских исследований и все чаще становятся предпочтительной трансляционной моделью для преодоления разрыва между моделями грызунов и моделями крупных животных 1,2. По сравнению с крупными животными, кролики имеют умеренные размеры тела, небольшое пространство для кормления, низкую стоимость кормления и удобный забор крови, что способствует повторному сбору данных исследований и хирургическим операциям. Кролики характеризуются хорошей репродуктивной способностью, коротким периодом беременности (28-32 дня для новозеландских белых кроликов), большим количеством родов, быстрым ростом 3,4. По сравнению с грызунами, кролики ближе к человеку по филогенезу5. Это экономически эффективный и практичный экспериментальный заменитель свиней и нечеловекообразных приматов6. По сравнению с другими крупными и средними животными для редактирования генов (свиньи, крупный рогатый скот, овцы, кошки, собаки, обезьяны) стоимость подготовки кроликов для редактирования генов низкая, а цикл короткий. С развитием генной терапии 7,8,9, терапии стволовыми клетками 10,11,12,13, исследований в области мозга 14 и других научных областей 1,15,16,17,18 спрос на виды без грызунов в редактировании генов увеличивается.
Кролики, занимающиеся редактированием генов, когда-то считались одними из животных среднего размера, которые могли бы реализовать промышленное применение6. Однако до сегодняшнего дня кроликам с редактированием генов не удалось добиться широкомасштабного производства. Одна из основных причин заключается в том, что производство и разведение кроликов с редактированием генов является сложной задачей, и сложность намного выше, чем у мышей или крыс с редактированием генов. Существует не так много лабораторий, которые могут эффективно выращивать кроликов с редактированием генов. Новичкам часто бывает сложно успешно подготовить кроликов по редактированию генов, и они часто сталкиваются с такими неприятными проблемами, как низкая стельность19, аборты20, дистоция21, отказ от лактации самками крольчихи22, падеж подсосных крольчат23. Тем не менее, существует мало систематических данных или литературных рекомендаций по беременности и кормлению кроликов с редактированием генов или кроликов, перенесших эмбрионы. Большинство из них основаны на опыте обычных кролиководческих ферм.
Поэтому в данной статье обобщен зрелый опыт ведения беременности и кормления генетически модифицированных кроликов из авторской лаборатории, а также представлен комплекс основных процессов эмбрионального переноса кроликов и генетически модифицированных кроликов, включая диагностику беременности, дородовое наблюдение, акушерство, искусственное вспомогательное вскармливание, аблактацию, а также спасение и выхаживание слабых крольчат. Этот процесс специально налажен для разведения кроликов с редактированием генов или кроликов, перенесших эмбрионы. По сравнению с традиционным методом естественных родов и вскармливания на кролиководческих фермах, модель ведения беременности и кормления требует больше времени и энергии, но она может значительно снизить смертность крольчат, и усилия того стоят.
протокол
Все протоколы экспериментов на животных были одобрены Комитетом по этике экспериментов на животных Центра медицинских лабораторных животных провинции Гуандун. Номер этического обзора для разведения кроликов с модифицированным геном MKRN3, участвующих в этом исследовании, составляет B202210-6. В исследовании соблюдены процедуры, соответствующие этическим нормам, изложенным в Хельсинкской декларации 1975 года (пересмотренной в 1983 году). Новозеландские кролики, использованные в этом исследовании, были получены из Центра медицинских лабораторных животных провинции Гуандун в Китае. Описанный в этой статье процесс беременности и кормления генетически модифицированных кроликов является кратким изложением ежедневной практики разведения животных в лаборатории автора. Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Диагностика беременности
- На12-14 день после переноса эмбрионов (выберите одну из временных точек) подтвердите беременность путем прямой пальпации.
ПРИМЕЧАНИЕ: Этот шаг можно пропустить. Если пальпация будет слишком грубой и принудительной, это может привести к выкидышу у беременных крольчих.- Одной рукой придерживайте кожу шеи за ушами кролика, дайте ягодицам кролика сжаться вперед, приблизившись к брюшной полости ягодиц кролика, а затем другой рукой раскройте ладонь и аккуратно пропальпируйте задний конец живота.
- Надавите на живот до определенной степени. Если прощупать непрерывную нить гладких и эластичных шариков из мякоти, похожих по размеру на бобы конфорки, то считается беременность24.
- Если позволяют условия, используйте УЗИ на15-й день после переноса эмбрионов, чтобы определить, беременна ли крольчиха. Диагностика схватки кроликов основывается на наличии небольших, крепких эхогенных точек (гестационных мешочков) в жидкой темной зоне.
- В период с 16-гопо 18-й день после переноса эмбрионов наблюдайте за кроликом два раза в день утром и вечером, примерно по 15 минут каждый раз. Если во время родов или течки наблюдается такое поведение, как беспокойство, учащенное дыхание, выщипывание шерсти для строительства гнезд и т. д., это указывает на то, что самка кролика псевдобеременна и по-настоящему не забеременела.
ПРИМЕЧАНИЕ: Если перенос эмбрионов не удается, у самок крольчихи будет ложная беременность, похожая на роженицу или течку, на 16-18-й день из-за снижения лютеинового гормона.
2. Дородовое наблюдение
- Позволяйте беременным крольчихам свободно питаться во время беременности и добавляйте свежий зеленый корм раз в неделю.
- Утром или вечером25-го дня после переноса эмбрионов переведите беременных крольчих в клетку для родов.
- Заранее продезинфицируйте клетку для родов, инкубатор для животных, обрезки бумаги или стружку.
ПРИМЕЧАНИЕ: Выбирайте клетку для доставки кроликов, которая соответствует международным критериям по размеру. Убедитесь, что в клетке для родов достаточно места для перемещения крольчихи. Выбирайте инкубатор, который сможет противостоять грызению крольчихи. Выбирайте плотные обрезки бумаги с хорошим водопоглощением. В соответствии с требованиями и предложениями местного руководства животноводческого хозяйства, выберите подходящие методы дезинфекции. - Закрепите инкубатор с одной стороны клетки для родов и положите полотенца, стружку или обрезки бумаги в инкубатор для животных, чтобы беременные крольчихи могли сделать гнездо.
- Обеспечьте достаточное количество корма и питьевой воды.
- Аккуратно переместите беременных крольчат в клетку для родов.
- Обратите внимание на то, сделали ли беременные крольчихи гнездо в инкубаторе каждый день. Если нет, добавьте немного обрезков бумаги и полотенец за пределы инкубатора утром28-го дня беременности.
ПРИМЕЧАНИЕ: Если беременные крольчихи не гнездятся в инкубаторе, они, скорее всего, не будут рожать в инкубаторе. Положите немного полотенец и обрезков бумаги за пределы инкубатора, чтобы новорожденные кролики не теряли температуру и не умирали вне коробки.
- Заранее продезинфицируйте клетку для родов, инкубатор для животных, обрезки бумаги или стружку.
3. Роды
ПРИМЕЧАНИЕ: День 0 относится к вскоре после оплодотворения и образования прокариот. Кролики – животные, стимулирующие овуляцию, у которых происходит овуляция через 10-12 ч после спаривания. Эмбрионы одноклеточной стадии, полученные на следующий день после спаривания, считаются эмбрионами на0,5-й день. Если эмбрионы одноклеточной стадии культивируют in vitro всего 2-3 ч, а затем переносят суррогатным кроликам, то это также считается0,5-й день беременности.
- Пренатальное наблюдение
ПРИМЕЧАНИЕ: Срок беременности кроликов составляет 28-32 дня. Если крольчиха рожает до30-го дня беременности, то размеры плода обычно относительно небольшие, и бывают редкие случаи тяжелых родов. До30-го дня не требуется чрезмерного вмешательства.- Утром30-го дня беременности у крольчих проводят абдоминальную пальпацию, чтобы примерно определить количество, размеры и активность плода.
- Одной рукой придерживайте кожу шеи за ушами кролика, дайте ягодицам кролика сжаться вперед, приблизившись к брюшной полости ягодиц кролика, а затем другой рукой раскройте ладонь и аккуратно пропальпируйте задний конец живота. Сила должна быть легкой.
ПРИМЕЧАНИЕ: Надавливание на живот в определенной степени приведет к пальпации нескольких эллипсоидов размером с яйцо, которые могут ощущать движение плода.
- Одной рукой придерживайте кожу шеи за ушами кролика, дайте ягодицам кролика сжаться вперед, приблизившись к брюшной полости ягодиц кролика, а затем другой рукой раскройте ладонь и аккуратно пропальпируйте задний конец живота. Сила должна быть легкой.
- Если установлено, что количество плодов, зачатых беременными крольчихами, составляет всего 1-2, то на30-й день беременности в 17 часов внутримышечно вводят 0,02 мг клопростенола, чтобы вызвать роды у крольчат на следующий день.
ПРИМЕЧАНИЕ: Беременные крольчихи имеют только 1-2 плода, которые склонны к дистоции или срыву родов в зрелом возрасте.
- Утром30-го дня беременности у крольчих проводят абдоминальную пальпацию, чтобы примерно определить количество, размеры и активность плода.
- Ускорьте роды
Примечание: Если беременная крольчиха не рожает утром31-го дня беременности, она может рассмотреть вопрос о том, нужно ли ей ускорить роды в соответствии со следующими условиями. Если плода больше 2, никаких дальнейших действий предпринято не будет.- Если беременная крольчиха беременна только 1-2 плодами и накануне ей ввели клопростенол, утром31-го дня беременности введите 10 единиц окситоцина в мышцы, чтобы вызвать роды.
- Если у беременной крольчихи наблюдаются признаки родов (такие как беспокойство, учащенное дыхание, расширение сосудов уха, выщипывание и изготовление гнезда, планирование грунта и т.д.), введите в мышцы 10 единиц окситоцина, чтобы вызвать родовую деятельность.
- Если у беременной крольчихи нет признаков родоразрешения и движения плода в норме, продолжайте наблюдение. Если родов нет утром32-го дня беременности, введите 10 единиц окситоцина в мышцы, чтобы вызвать роды.
ПРИМЕЧАНИЕ: Обычно, применение окситоцина может решить сложные роды. Как правило, через 5-10 минут после введения окситоцина у беременных крольчих начинаются роды. Окситоцин эффективен в течение примерно получаса и может быть введен повторно через полчаса. Не рекомендуется вызывать роды окситоцином более 3 раз. Если окситоцин неэффективен, попросите ветеринара провести кесарево сечение. В противном случае плод погибнет в матке, размягчится, и будет выделяться из влагалища.
4. Акушерство
- Обустройте и подготовьте инкубаторы (рисунок 1).
ПРИМЕЧАНИЕ: Подготовьтесь заранее, прежде чем крольчиха родит. Размер инкубатора, использованного в данном исследовании, составляет 45 см × 30 см × 15 см в длину × ширину × высоту.- Добавьте стерильную абсорбирующую набивку. Рекомендуется использовать гранулы кукурузного початка.
- Расстелите полотенце в виде коврика, покрытого искусственным пухом.
ПРИМЕЧАНИЕ: Материалом искусственного пухового хлопка является детское полиэфирное волокно, которое не токсично. Искусственный пух очень подходит для новорожденных кроликов, согревающихся в тепле. Тем не менее, его нельзя использовать для создания гнезда для матери-крольчихи, или он может быть съеден в желудок.
- Быстро вытрите слизь на новорожденных крольчатах полотенцем. Убедитесь, что они дышат ровно, а затем поместите их в инкубатор.
ПРИМЕЧАНИЕ: Если дыхание новорожденных крольчат остановилось, немедленно надавите на грудную клетку для вспомогательного дыхания (25-35 раз/мин) для уменьшения диаметра грудной клетки на 25%-30% до восстановления спонтанного дыхания. - После рождения беременных крольчих подсчитайте количество родившихся плодов. Наклейте на инкубатор информационные карточки: измененные гены, количество новорожденных крольчат, дата рождения и т.д.
ПРИМЕЧАНИЕ: Подходящая температура окружающей среды для новорожденных кроликов составляет 30-32 °C. Помещение в инкубатор соответствующего количества кроличьей шерсти или искусственного пухового хлопка может достичь хорошего изоляционного эффекта. В кроличьем домике следует поддерживать температуру 16-25 °C. У самок кроликов обычно 6-8 сосков. Если малышей слишком много, некоторых малышей могут кормить другие крольчата-мамы.
5. Послеродовой уход
- Уход за крольчатами (Рисунок 2)
ПРИМЕЧАНИЕ: После родов дайте крольчихе отдохнуть около 1 часа перед кормлением грудью. Кроликов обычно кормят грудью 1-3 раза в день.- Перед первым кормлением очистите все соски крольчихи спиртовой ватой. За исключением грудного вскармливания, в остальное время крольчат и крольчат содержат отдельно.
- Аккуратно помассируйте каждый сосок и аккуратно выдавите первую каплю молока.
- Кормление 1-2-дневных крольчат: Каждый раз кладите крольчатину на коврик в боковом положении или в положении лежа и прикладывайте сосущих кроликов по одному к их соскам, чтобы они сосали молоко (Рисунок 2А). 1-2-дневных кроликов нужно кормить 2-3 раза в день.
ПРИМЕЧАНИЕ: Недоношенные кролики или крольчата с низкой массой тела при рождении склонны к гипогликемии. Кормите 1 мл 5% глюкозы и употребите грудное молоко как можно скорее. Если крольчиха слишком слаб для питья, то сразу вводят 1 мл 5% глюкозы в брюшную полость. - На второй день после рождения с помощью маркера пронумеруйте спину каждого крольчатина. Обрежьте небольшое количество ткани хвоста для генотипирования.
- Кормление крольчат старше 2 дней: Во время кормления поместите крольчатину в инкубатор и дайте ей самостоятельно кормить грудью (Рисунок 2B). 2-9-дневных кроликов нужно кормить 1-2 раза в день, а свыше 9-дневных кроликов нужно кормить один раз в день до отъема. Убедитесь, что крольчата сыты (рисунок 2C).
ПРИМЕЧАНИЕ: Если крольчиха не желает кормить грудью, ее можно кормить свежими овощами, чтобы она была более склонна к сотрудничеству. При необходимости крольчат-матерей можно кормить грудью после помещения в устойчивое положение. Аккуратно выдавите первую каплю молока из каждого соска крольчихи, чтобы облегчить набухание и боль в груди, что полезно для крольчат сосать молоко. Если вышеперечисленные методы неэффективны, для кормления следует использовать других кормящих крольчат-матерей. - В течение первых 4 дней после рождения очищайте промежность крольчатина два раза в день влажными ватными шариками, чтобы стимулировать выведение мекония и мочи (рисунок 2D).
- По мере того, как шерсть крольчатина отрастает, каждый день убирайте из инкубатора немного пуховой ваты.
- Меняйте полотенце один раз в день, пока крольчиха не вырастет до такой степени, что все его тело будет покрыто шерстью.
ПРИМЕЧАНИЕ: Как правило, полотенце больше не нужно на8-й день после рождения. - Если у крольчат (в возрасте 1-2 недель) наблюдается диарея, немедленно скармливайте 3 капли гентамицина животного происхождения (концентрация 0,04 г/мл) два раза в день в течение 5 дней подряд.
Примечание: Диарея у крольчат обычно вызвана сосанием молока у крольчат с маститом или высокой температурой и влажностью окружающей среды. Смертность крольчат при диарее очень высока. - После того, как молодой кролик откроет глаза (возраст около 2 недель), переместите его в клетку для кормления с помощью полотенца. Добавьте немного зеленого корма и ежедневный рацион.
ПРИМЕЧАНИЕ: Подходящая температура для крольчат (в возрасте 2-3 недель) составляет 23-30 °C. - Отделите крольчатину от крольчат и открывайте перегородку только один раз в день для кормления грудью.
ПРИМЕЧАНИЕ: Это может помешать крольчатам кусать сосок матери-крольчихи.
- Послеродовой уход за матерью-крольчихой
- Во время лактации позволяйте крольчихам свободно пить и есть и кормите их подходящими зелеными кормами, чтобы обеспечить достаточное питание.
- Если крольчиха страдает маститом, немедленно прекратите грудное вскармливание и назначьте соответствующие ветеринарные антибиотики для лечения (рекомендуются цефалоспорины). Скармливайте молодых крольчат другим кормящим крольчихам с аналогичными сроками родов.
6. Аблактация
- Убедитесь, что большинство молодых кроликов отлучены от груди в возрасте 35 дней. Слабых кроликов отлучают от груди в возрасте 40 дней.
ПРИМЕЧАНИЕ: Подходящая температура для молодых кроликов (от 3 недель до 3 месяцев) составляет 20-25 °C. Подходящая температура для молодых кроликов (3-6 месяцев) и взрослых кроликов также составляет 15-25 °C. - Рассмотрите, следует ли прививать обычные вакцины в соответствии с экспериментальными требованиями после отъема.
Результаты
В данной статье описывается процедура ведения беременности и кормления кроликов, перенесших эмбрионы и генетически модифицированных. В конце 2022 года авторская лаборатория приступила к разработке платформы для подготовки генно-модифицированных кроликов. В течение этого периода было обнаружено несколько распространенных проблем, включая аборты, невыполнение родов в срок, дистоцию, неспособность выщипывать шерсть для подготовки гнезда перед родами, нежелание матерей-крольчат кормить грудью или случаи каннибализма, недостаточное количество грудного молока из-за большого размера помета и неспособность крольчат пить молоко. Эти проблемы значительно снизили эффективность разведения генетически модифицированных кроликов.
Обобщив опыт и изучив эти проблемы, был разработан протокол ведения беременности и кормления новорожденных кроликов, перенесших эмбрионы и генетически модифицированных (Рисунок 3). Этот протокол позволил значительно повысить выживаемость новорожденных кроликов и снизить смертность в период лактации (табл. 1). Для большинства случаев, за исключением специфических генетически модифицированных моделей заболеваний с тяжелыми постнатальными фенотипами генетических заболеваний, приводящими к более высоким показателям смертности, этот подход доказал свою эффективность и приемлемость.
В настоящее время авторская лаборатория перешла от традиционных естественных методов родов и вскармливания к вновь созданной модели ведения беременности и кормления. На сегодняшний день этот метод способствовал успешному выведению более десяти новых разновидностей генетически модифицированных кроликов, в результате чего было получено многочисленное потомство. Хотя такой подход увеличивает рабочую нагрузку, он очень эффективен. На рисунке 4 показан реальный пример разведения генетически модифицированного потомства кроликов MKRN3, демонстрирующий процесс от рождения до отлучения от груди.

Рисунок 1: Устройство инкубаторов для крольчат. Этапы подготовки инкубатора для крольчат: (1) Подготовка инкубатора; (2) Набивка; (3) Расстелить полотенце; (4) Добавление искусственного пуха из хлопка; (5) Помещение крольчата внутрь; (6) Прикрепление информационной карточки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
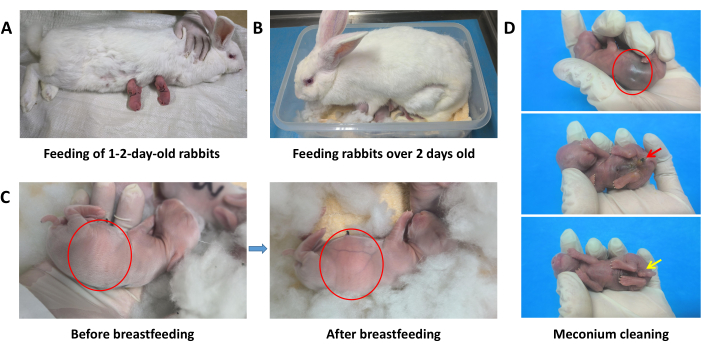
Рисунок 2: Вспомогательное грудное вскармливание для крольчат. (А) Кормление крольчат в возрасте 1-2 дней. (Б) Кормление крольчат старше 2-дневного возраста. (В) Сравнение брюшной полости щенков кроликов до и после кормления, показывающее заметное выпячивание и видимое белое грудное молоко в желудке (обозначено красным кружком). (D) Выведение мекония из желудочно-кишечного тракта в течение 3 дней после рождения (обозначено красной стрелкой). Промежность требует регулярной чистки влажным ватным тампоном (обозначен желтой стрелкой). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
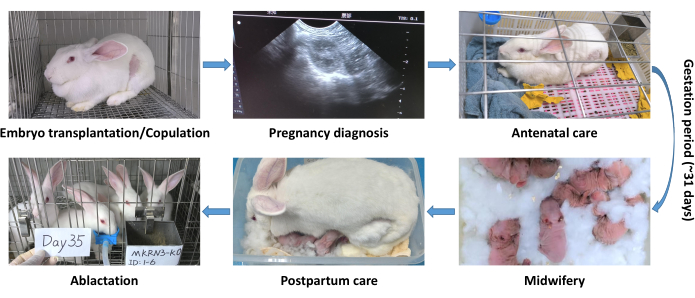
Рисунок 3: Процесс ведения беременности и кормления новорожденных кроликов, перенесших эмбрионы и генетически модифицированных. Этапы в процессе ведения: Диагностика беременности; Дородовой уход; Акушерство; Послеродовой уход; Аблактировка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Рост и развитие генетически модифицированных кроликов от рождения до амортации. (А) Изображения крольчат в возрасте от 1 до 8 дней. (В) Пятнадцатидневные крольчата, с матерью-крольчихой слева и крольчатами справа. (В) Тридцатипятидневные молодые кролики, отлученные от груди. (D) Кривая роста крольчат в течение первых трех недель после рождения. Крольчата были из одного помета: ID1, ID2 и ID3 представляют кроликов с модифицированным геном mkrn3 , в то время как ID4, ID5 и ID6 представляют кроликов дикого типа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Традиционные естественные роды и вскармливание | Ведение беременности и кормления грудью | |
| Количество новорожденных крольчат (8 пометов) | 68 | 71 |
| Количество выживших новорожденных крольчат | 42 | 66 |
| Количество выживших отъемышей крольчат | 29 | 63 |
| Выживаемость при рождении (= новорожденные кролики / выжившие новорожденные кролики × 100%) | 61.80% | 93.00% |
| Выживаемость при отъеме (= выживаемость отлученных от отъема кроликов / новорожденных кроликов × 100%) | 69.00% | 95.50% |
Таблица 1: Выживаемость детенышей кроликов при различных режимах управления разведением. Сравнение показателей выживаемости детенышей кроликов при различных стратегиях управления разведением.
Обсуждение
Основными этапами ведения беременности и кормления эмбрионов и генетически модифицированных кроликов являются акушерство и раннее вспомогательное грудное вскармливание. Трудные роды – распространенная проблема у кроликов19. Длительные сроки родов часто приводят к ишемии, гипоксии и смерти плода25. Надлежащее использование окситоцина может эффективно сократить время родов и уменьшить случаи дистоции плода26. Многие первородящие крольчихи не выщипывают шерсть для подготовки гнезд, что увеличивает риск потери температуры и смертности у новорожденных крольчат27,28. Как правило, после внутримышечного введения окситоцина у крольчат в течение 5-10 мин начинаются роды, что облегчает искусственное родоразрешение и повышает выживаемость новорожденных. Плохое материнское поведение или неопытность часто препятствуют правильному росту крольчат. Управление вспомогательным кормлением обеспечивает достаточное грудное вскармливание новорожденных кроликов и размещение в комфортабельных инкубаторах, что значительно улучшает их выживаемость29.
В этом исследовании использовался простой инкубатор с использованием искусственного пухового хлопка и полотенец для согревания. Оптимальная температура окружающей среды для новорожденных крольчат составляет 30-32 °С30. Если это возможно, оборудование для контроля температуры и влажности может еще больше улучшить результаты. На поздних стадиях беременности у самок крольчихи могут проявляться такие симптомы, как учащенное дыхание, респираторные хрипы, расширение ушных сосудов и нежелание естьили двигаться. Эти симптомы напоминают гипертензию, вызванную беременностью человека, и требуют немедленного внимания. В тяжелых случаях может наступить материнская смерть и смерть плода. В таких условиях беременных крольчих следует содержать в более просторных клетках с обрезками бумаги, чтобы стимулировать гнездование, приучать к физическим упражнениям и обеспечивать их свежим зеленым кормом. Эти меры в целом облегчают неблагоприятные симптомы у беременных крольчих. Однако в критических случаях необходима внутримышечная инъекция 0,02 мг клопростенола, чтобы вызвать прерывание беременности на ранних сроках32.
В этом исследовании установлен протокол ведения беременности и кормления для эмбриональных и генетически модифицированных кроликов, что значительно повышает эффективность разведения генетически модифицированных кроликов. По сравнению с традиционными методами разведения кролиководческих ферм, такой подход требует больше рабочей силы и материальных ресурсов и предполагает более кропотливый процесс. Тем не менее, для стандартных лабораторных условий этот метод отвечает экспериментальным потребностям и предлагает практические знания и навыки.
При разведении моделей кроликов на определенные генетические заболевания, таких как мышечная атрофия кроликов или голые кролики, слабая врожденная конституция этих моделей часто приводит к их неспособности конкурировать с кроликами дикого типа в том же помете за грудное молоко, что приводит к высоким показателям смертности вскорепосле рождения. Вспомогательное сестринское обслуживание эффективно смягчает эти проблемы, предотвращая преждевременную гибель детенышей кроликов. Кроме того, этот протокол позволяет исследователям наблюдать и определять генотип новорожденных кроликов сразу после рождения, снижая опасения по поводу того, что самки кроликов могут кусать или есть их потомство. В целом, этот протокол имеет многообещающее применение в создании эмбриональных и генетически модифицированных кроликов.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано Национальным фондом естественных наук Китая (грант No 82101937), Проектом Фонда медицинских исследований науки и техники провинции Гуандун, Китай (грант No B2024069) и проектом плана науки и техники в Гуанчжоу, Китай (грант No 100). SL2023A04J02229, присвоение No 2024A04J4923).
Материалы
| Name | Company | Catalog Number | Comments |
| Artificial down cotton | Yangzhou Anguang Textile Co., Ltd, China | 5490-Jinyu | |
| Cloprostenol Sodium Injection | Shanghai Quanyu Biotechnology (Zhumadian) Animal Pharmaceutical Co., Ltd, China | 163232207 | |
| Corncob granules | Guangdong Provincial Medical Laboratory Animal Center, China | YUMIXIN | |
| Electronic platform scale | Yongkang Runjin weighing instrument Co., Ltd, China | rj-09 | |
| Gentamicin | Shanxi Jinfukang Biological Pharmaceutical Co., Ltd, China | 041531504 | |
| Glucose injection | Henan Kelun Pharmaceutical Co., Ltd, China | H41022251 | |
| Incubator | Foshan Chancheng Hualong Plastic Factory, China | AAA-2 | For newborn rabbits |
| Incubator box | Hebei mabao wire mesh products Co., Ltd., China | https://qr.1688.com/s/AJ1K7O3p | As a nest for the mother rabbits |
| Inslin Syringe | Becton,Dickinson and Company, USA | Ultra-Fine,328421 | |
| Oxytocin injection | Guangzhou Baiyunshan Mingxing Pharmaceutical Co., Ltd | H44025245 | |
| Penicillin injection | Guangdong Kangtaiyuan Animal Husbandry Co., Ltd, China | 300012430 | |
| Rabbit delivery cage | Suzhou Suhang Technology Equipment Co., Ltd., Suzhou, China | RB42-8G | |
| Towel | Zhejiang Jieliya Co., Ltd, China | W3290 |
Ссылки
- Xu, J., et al. Gene editing in rabbits: Unique opportunities for translational biomedical research. Front Genet. 12, 642444 (2021).
- Esteves, P. J., et al. The wide utility of rabbits as models of human diseases. Exp Mol Med. 50 (5), 1-10 (2018).
- Song, J., et al. Genome engineering technologies in rabbits. J Biomed Res. 35 (2), 135-147 (2020).
- Brewer, N. R. Biology of the rabbit. J Am Assoc Lab Anim Sci. 45 (1), 8-24 (2006).
- Inazu, A., et al. Increased high-density lipoprotein levels caused by a common cholesteryl-ester transfer protein gene mutation. N Engl J Med. 323 (18), 1234-1238 (1990).
- Han, Y., et al. Genome-edited rabbits: Unleashing the potential of a promising experimental animal model across diverse diseases. Zool Res. 45 (2), 253-262 (2024).
- Ebrahimi, P., et al. In vivo and ex vivo gene therapy for neurodegenerative diseases: A promise for disease modification. Naunyn Schmiedebergs Arch Pharmacol. 397 (10), 7501-7530 (2024).
- Carter, J. E., Schuchman, E. H. Gene therapy for neurodegenerative diseases: Fact or fiction. Br J Psychiatry. 178, 392-394 (2001).
- Zha, Y., et al. CRISPR/Cas9-mediated knockout of APOC3 stabilizes plasma lipids and inhibits atherosclerosis in rabbits. Lipids Health Dis. 20 (1), 180 (2021).
- Khandpur, S., Gupta, S., Gunaabalaji, D. R. Stem cell therapy in dermatology. Indian J Dermatol Venereol Leprol. 87 (6), 753-767 (2021).
- Gao, L., et al. Stem cell therapy: A promising therapeutic method for intracerebral hemorrhage. Cell Transplant. 27 (12), 1809-1824 (2018).
- Alessandrini, M., Preynat-Seauve, O., De Bruin, K., Pepper, M. S. Stem cell therapy for neurological disorders. S Afr Med J. 109 (8b), 70-77 (2019).
- Song, J., et al. Development of the nude rabbit model. Stem Cell Reports. 16 (3), 656-665 (2021).
- Liu, X., et al. YIPF5 (p.W218R) mutation induced primary microcephaly in rabbits. Neurobiol Dis. 182, 106135 (2023).
- Bhaskar, S. M. M. Incidental findings in brain imaging research: spotlight on ethical considerations. Eur Radiol. 32 (10), 6977-6978 (2022).
- Sá, K. N., Venas, G. Brazilian research on noninvasive brain stimulation applied to health conditions. Arq Neuropsiquiatr. 79 (11), 974-981 (2021).
- Fan, J., Wang, Y., Chen, Y. E. Genetically modified rabbits for cardiovascular research. Front Genet. 12, 614379 (2021).
- Mu, Y., et al. GTKO Rabbit: A novel animal model for preclinical assessment of decellularized xenogeneic grafts via in situ implantation. Mater Today Bio. 18, 100505 (2023).
- Castellini, C., et al. The main factors affecting the reproductive performance of rabbit does: A review. Anim Reprod Sci. 122 (3-4), 174-182 (2010).
- Rosell, J. M., Fuente, L. F. Reproductive diseases in farmed rabbit does. Animals (Basel). 10 (10), (2020).
- Dickie, E. Dystocia in a rabbit (Oryctolagus cuniculus). Can Vet J. 52 (1), 80-83 (2011).
- Jiménez, A., González-Mariscal, G. Maternal responsiveness to suckling is modulated by time post-nursing: A behavioral and c-Fos/oxytocin immunocytochemistry study in rabbits. J Neuroendocrinol. 31 (9), e12788 (2019).
- Whitney, J. C., et al. Rabbit mortality survey. Lab Anim. 10 (3), 203-207 (1976).
- Varga, M. Rabbit Basic Science. Textbook of Rabbit Medicine. , 3-108 (2014).
- Hudson, R., Müller, A., Kennedy, G. A. Parturition in the rabbit is compromised by daytime nursing: the role of oxytocin. Biol Reprod. 53 (3), 519-524 (1995).
- Morgan, D. R. Routine birth induction in rabbits using oxytocin. Lab Anim. 8 (2), 127-130 (1974).
- Hamilton, H. H., Lukefahr, S. D., McNitt, J. I. Maternal nest quality and its influence on litter survival and weaning performance in commercial rabbits. J Anim Sci. 75 (4), 926-933 (1997).
- Benedek, I., Altbӓcker, V., Molnár, T. Stress reactivity near birth affects nest building timing and offspring number and survival in the European rabbit (Oryctolagus cuniculus). PLoS One. 16 (1), e0246258 (2021).
- González-Mariscal, G., Gallegos, J. A. The maintenance and termination of maternal behavior in rabbits: involvement of suckling and progesterone. Physiol Behav. 124, 72-76 (2014).
- Saxmose Nielsen, S., et al. Health and welfare of rabbits farmed in different production systems. Efsa j. 18 (1), e05944 (2020).
- Pinto-Pinho, P., Pinto, M. L., Monteiro, J., Fardilha, M. Pregnancy Complications and feto-maternal monitoring in rabbits. Vet Sci. 10 (10), 622 (2023).
- Abel, M., Smith, G. W., Nathanielsz, P. W. Prostaglandin-induced parturition in the rabbit; quantitative aspects of the route and duration of administration. J Endocrinol. 58 (1), xvi (1973).
- Sui, T., et al. A novel rabbit model of Duchenne muscular dystrophy generated by CRISPR/Cas9. Dis Model Mech. 11 (6), 032201 (2018).
- Deng, J., et al. The disrupted balance between hair follicles and sebaceous glands in Hoxc13-ablated rabbits. Faseb j. 33 (1), 1226-1234 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены