Method Article
إدارة الحمل والتمريض للأرانب المنقولة بالجنة والمعدل وراثيا
* These authors contributed equally
In This Article
Summary
يصف هذا البروتوكول تقنية إدارة الحمل والتغذية للأرانب المنقولة بالجنين والمعدل وراثيا ، والتي تهدف إلى تقليل وفيات الأرانب حديثي الولادة وتعزيز كفاءة تحضير الأرانب المعدلة جينيا.
Abstract
مع تقدم البحث العلمي ، يتزايد الطلب على نماذج الأرانب المعدلة جينيا. ومع ذلك ، هناك أنظمة محدودة لإدارة الحمل والتغذية للأرانب المعدلة جينيا ، مما يؤدي إلى انخفاض معدلات البقاء على قيد الحياة بين الأرانب المعدلة جينيا التي أعدها العديد من الباحثين عديمي الخبرة. لذلك ، فإن التوجيه المناسب ضروري. تلخص هذه المقالة ممارسات الحمل والتغذية للأرانب المعدلة وراثيا التي تم تطويرها في مختبر المؤلف وتوضح مجموعة من العمليات الأساسية. وتشمل هذه تشخيص الحمل ، ورعاية ما قبل الولادة ، والقبالة ، والرضاعة الطبيعية المساعدة ، والفطام ، وغيرها من الإجراءات ، إلى جانب إنقاذ ورعاية الأرانب حديثي الولادة الضعيفة. بالمقارنة مع طرق الولادة الطبيعية التقليدية والرعاية المستخدمة في مزارع الأرانب ، فإن هذا النهج ينطوي على إدارة أكثر دقة ، مما يتطلب وقتا وجهدا إضافيين ولكنه يزيد بشكل كبير من معدل بقاء الأرانب المرضعة. الطرق الموضحة في هذه المقالة مناسبة لمعظم سيناريوهات التكاثر المختبرية التي تتضمن الأرانب المعدلة جينيا أو المنقولة بالجنين وتوفر مرجعا مباشرا وفعالا للباحثين الآخرين.
Introduction
الأرانب هي نموذج حيواني كلاسيكي للأبحاث الطبية الحيوية وأصبحت بشكل متزايد النموذج الانتقالي المفضل لسد الفجوة بين نماذج القوارض ونماذج الكبيرة1،2. بالمقارنة مع الكبيرة ، تتمتع الأرانب بحجم جسم معتدل ، ومساحة تغذية صغيرة ، وتكلفة تغذية منخفضة ، وجمع دم مريح ، مما يؤدي إلى الجمع المتكرر لبيانات البحث والعمليات الجراحية. تتميز الأرانب بالقدرة الإنجابية الجيدة ، وفترة الحمل القصيرة (28-32 يوما للأرانب البيضاء النيوزيلندية) ، وعدد كبير من المواليد ، والنمو السريع3،4. بالمقارنة مع القوارض ، فإن الأرانب أقرب إلى البشر في تطورالنشوء 5. إنه بديل تجريبي عملي وفعال من حيث التكلفة للخنازير والرئيسيات غير البشرية6. بالمقارنة مع تحرير الجينات الكبيرة والمتوسطة الحجم الأخرى (الخنازير والماشية والأغنام والقطط) ، فإن تكلفة تحضير أرانب تحرير الجينات منخفضة ، والدورة قصيرة. مع تطور العلاج الجيني7،8،9 ، والعلاج بالخلايا الجذعية10،11،12،13 ، وأبحاث علومالدماغ 14 ، والمجالات العلميةالأخرى 1،15،16،17،18 ، يتزايد الطلب على الأنواع غير القوارض في تحرير الجينات.
كانت أرانب تحرير الجينات تعتبر ذات يوم واحدة من تحرير الجينات متوسطة الحجم التي يمكن أن تحقق التطبيقات الصناعية6. ومع ذلك ، حتى اليوم ، لم تتمكن الأرانب المجردة للجينات من تحقيق إنتاج واسع النطاق. أحد الأسباب الرئيسية هو أن إنتاج وتربية الأرانب المحررة للجينات يمثل تحديا ، والصعوبة أكبر بكثير من تلك التي تعاني من الفئران أو الفئران المجردة للجينات. لا توجد العديد من المختبرات التي يمكنها زراعة الأرانب المعدلة للجينات بكفاءة. غالبا ما يكون من الصعب على المبتدئين إعداد أرانب تحرير الجينات بنجاح ، وغالبا ما يواجهون مشاكل غير سارة مثل انخفاض معدل الحمل19 ، والإجهاض20 ، وعسر الحياة21 ، ورفض الرضاعة من قبل إناث الأرانب22 ، وموت الأرانبالرضيعة 23. ومع ذلك ، هناك عدد قليل من البيانات المنهجية أو إرشادات الأدبيات حول حمل وتغذية الأرانب المعدلة للجينات أو الأرانب المنقولة بالجنين. يعتمد معظمهم على تجربة مزارع الأرانب العادية.
لذلك ، تلخص هذه المقالة التجربة الناضجة للحمل وإدارة التمريض للأرانب المعدلة وراثيا من مختبر المؤلف ، وتقدم مجموعة من العمليات الأساسية للأرانب المنقولة بالجنين والأرانب المعدلة وراثيا ، بما في ذلك تشخيص الحمل ، ورعاية ما قبل الولادة ، والقبالة ، والتغذية الاصطناعية بمساعدة ، والاستبعاد ، وكذلك إنقاذ ورضاعة الأرانب الصغيرة الضعيفة. تم إنشاء هذه العملية خصيصا لتربية الأرانب المعدلة للجينات أو الأرانب المنقولة بالجنين. بالمقارنة مع طريقة الولادة الطبيعية التقليدية والرعاية لمزارع الأرانب ، فإن نموذج إدارة الحمل والتمريض يستغرق مزيدا من الوقت والطاقة ، ولكنه يمكن أن يقلل بشكل كبير من وفيات صغار الأرانب ، والجهد يستحق كل هذا العناء.
Protocol
تمت الموافقة على جميع البروتوكولات التجريبية من قبل لجنة أخلاقيات التجارب على التابعة لمركز المختبر الطبي في قوانغدونغ. رقم المراجعة الأخلاقية لتربية الأرانب المعدلة جينيا MKRN3 المشاركة في هذه الدراسة هو B202210-6. تلتزم الدراسة بالإجراءات التي تمتثل للمعايير الأخلاقية المبينة في إعلان هلسنكي لعام 1975 (المنقح عام 1983). تم الحصول على الأرانب النيوزيلندية المستخدمة في هذه الدراسة من مركز مختبر قوانغدونغ الطبي في الصين. عملية الحمل والتغذية للأرانب المعدلة وراثيا الموصوفة في هذه المقالة هي ملخص لممارسات تربية اليومية في مختبر المؤلف. وترد تفاصيل الكواشف والمعدات المستخدمة في جدول المواد.
1. تشخيص الحمل
- في اليوم من 12إلى 14 بعد نقل الأجنة (اختر إحدى النقاط الزمنية) ، تأكد من الحمل من خلال الجس المباشر.
ملاحظة: يمكن تخطي هذه الخطوة. إذا كان الجس قاسيا وقويا للغاية ، فقد يؤدي إلى الإجهاض في الأرانب الحامل.- أمسك جلد الرقبة خلف آذان الأرنب بيد واحدة ، واترك أرداف الأرنب تتقلص للأمام ، بالقرب من تجويف البطن في أرداف الأرنب ، ثم استخدم اليد الأخرى لفتح راحة اليد وتلس الطرف الخلفي من البطن برفق.
- اضغط على البطن إلى درجة معينة. إذا تم تحسس سلسلة مستمرة من كرات اللحم الملساء والمرنة ، والتي تشبه في الحجم الفول ، فإنها تعتبر الحمل24.
- إذا سمحت الظروف ، استخدم الموجات فوق الصوتية في اليوم الخامسعشر بعد نقل الجنين لتحديد ما إذا كان الأرنب حاملا. يعتمد تشخيص حمل الأرانب على وجود نقاط صدى صغيرة وقوية (أكياس الحمل) في المنطقة المظلمة السائلة.
- خلال فترةالأيام 16-18 بعد نقل الأجنة ، راقب الأرنب مرتين يوميا في الصباح والمساء ، لمدة 15 دقيقة تقريبا في كل مرة. إذا لوحظ أن الأرنب يظهر سلوكيات مثل الأرق ، والتنفس السريع ، ونتف الشعر لبناء أعشاش ، وما إلى ذلك ، أثناء المخاض أو الشبق ، فهذا يشير إلى أن أنثى الأرنب حامل زائفة ولم تحمل حقا.
ملاحظة: إذا فشل نقل الأجنة ، فستعاني إناث الأرانب من حمل كاذب مشابه للولادة أو الشبقفي الأيام 16-18 بسبب انخفاض الهرمون الأصفر.
2. رعاية ما قبل الولادة
- اسمحي للأرانب الحامل بتناول الطعام بحرية أثناء الحمل وأضيفي علفا أخضر طازجا مرة واحدة في الأسبوع.
- في صباح أو مساء اليوم الخامس والعشرين بعد نقل الأجنة ، انقل الأرانب الحامل إلى قفص الولادة.
- قم بتطهير قفص الولادة أو حاضنة أو قصاصات الورق أو نشارة البطاطس مسبقا.
ملاحظة: اختر قفص توصيل الأرانب الذي يلبي المعايير الدولية في الحجم. تأكد من أن قفص الولادة به مساحة كافية لتحرك الأرنب الأم. اختر حاضنة يمكنها مقاومة قضم الأرانب الأم. اختر قصاصات الورق السميكة ذات امتصاص الماء بشكل جيد. وفقا لمتطلبات واقتراحات إدارة مرافق المحلية ، حدد طرق التطهير المناسبة. - ثبت الحاضنة على جانب واحد من قفص الولادة ، وضع المناشف أو نشارة الخشب أو قصاصات الورق في حاضنة للأرانب الحامل لصنع عش.
- توفير العلف الكافي ومياه الشرب.
- انقل الأرانب الحامل برفق إلى قفص الولادة.
- انتبه إلى ما إذا كانت الأرانب الحامل قد صنعت عشا في الحاضنة كل يوم. إذا لم يكن الأمر كذلك ، أضف بعض قصاصات الورق والمناشف خارج الحاضنة فيصباح اليوم 28 من الحمل.
ملاحظة: إذا لم تعشش الأرانب الحامل في الحاضنة ، فمن المحتمل ألا تلد في الحاضنة. ضع بعض المناشف والقصاصات الورقية خارج الحاضنة لمنع الأرانب حديثي الولادة من فقدان درجة الحرارة والموت خارج الصندوق.
- قم بتطهير قفص الولادة أو حاضنة أو قصاصات الورق أو نشارة البطاطس مسبقا.
3. الولادة
ملاحظة: يشير اليوم 0 إلى فترة وجيزة بعد الإخصاب وتكوين بدائية النواة. الأرانب هي محفزة للإباضة وتحدث الإباضة بعد 10-12 ساعة من التزاوج. تعتبر الأجنة أحادية الخلية التي تم الحصول عليها في اليوم التالي للتزاوجفي اليوم 0.5. إذا تم استزراع أجنة المرحلة المفردة في المختبر لمدة 2-3 ساعات فقط ثم نقلها إلى الأرانب البديلة ، فإنها تعتبرأيضا اليوم 0.5 من الحمل.
- مراقبة ما قبل الولادة
ملاحظة: فترة حمل الأرانب هي 28-32 يوما. إذا أنجبت الأرنبقبل اليوم الثلاثين من الحمل ، فعادة ما يكون حجم الجنين صغيرا نسبيا ، وهناك حالات نادرة من المخاض الصعب. لا حاجة إلى تدخل مفرطقبل اليوم الثلاثين.- في صباح اليوم الثلاثين من الحمل في الأرانب ، قم بإجراء ملامسة البطن لتحديد عدد الجنين وحجمه ونشاطه تقريبا.
- أمسك جلد الرقبة خلف آذان الأرنب بيد واحدة ، واترك أرداف الأرنب تتقلص للأمام ، بالقرب من تجويف البطن في أرداف الأرنب ، ثم استخدم اليد الأخرى لفتح راحة اليد وتلس الطرف الخلفي من البطن برفق. يجب أن تكون القوة خفيفة.
ملاحظة: الضغط على البطن إلى حد ما سيؤدي إلى ملامسة العديد من الأشكال الإهليلجية بحجم البيضة ، والتي يمكن أن تشعر بحركة الجنين.
- أمسك جلد الرقبة خلف آذان الأرنب بيد واحدة ، واترك أرداف الأرنب تتقلص للأمام ، بالقرب من تجويف البطن في أرداف الأرنب ، ثم استخدم اليد الأخرى لفتح راحة اليد وتلس الطرف الخلفي من البطن برفق. يجب أن تكون القوة خفيفة.
- إذا وجد أن عدد الأجنة التي تحملها الأرانب الحامل هو 1-2 فقط ،في اليوم الثلاثين من الحمل ، قم بحقن 0.02 مجم من كلوبروستينول في العضل في الساعة 5 مساء للحث على ولادة الأرانب في اليوم التالي.
ملاحظة: الأرانب الحامل لديها 1-2 جنين فقط ، وهي عرضة لعسر الولادة أو فشل الولادة عندما تنضج.
- في صباح اليوم الثلاثين من الحمل في الأرانب ، قم بإجراء ملامسة البطن لتحديد عدد الجنين وحجمه ونشاطه تقريبا.
- تسريع الولادة
ملاحظة: إذا لم تلد الأرنب الحامل في صباح اليوم الحادي والثلاثين من الحمل ، فيمكنها التفكير فيما إذا كانت بحاجة إلى تسريع الولادة وفقا للشروط التالية. إذا كان هناك أكثر من 2 جنين ، فلن يتم اتخاذ أي إجراء آخر.- إذا كانت الأرنب الحامل حاملا فقط ب 1-2 جنين وتم حقنها بعقار كلوبروستنول في اليوم السابق ، في صباح اليوم الحادي والثلاثين من الحمل ، قم بحقن 10 وحدات من الأوكسيتوسين في العضلات للحث على المخاض.
- إذا كانت الأرنب الحامل يعاني من علامات الولادة (مثل الأرق ، والتنفس السريع ، وتمدد الأوعية الدموية في الأذن ، ونتف وصنع العش ، وتخطيط الأرض ، وما إلى ذلك) ، فقم بحقن 10 وحدات من الأوكسيتوسين في العضلات للحث على المخاض.
- إذا لم يكن لدى الأرنب الحامل علامات الولادة وكانت حركة الجنين طبيعية ، فاستمر في المراقبة. إذا لم تكن هناك ولادة فيصباح اليوم 32 من الحمل ، حقن 10 وحدات من الأوكسيتوسين في العضلات للحث على المخاض.
ملاحظة: عادة ، يمكن أن يؤدي استخدام الأوكسيتوسين إلى حل المخاض الصعب. بشكل عام ، بعد 5-10 دقائق من حقن الأوكسيتوسين ، ستبدأ الأرانب الحامل في الولادة. الأوكسيتوسين فعال لمدة نصف ساعة تقريبا ويمكن إعطاؤه مرة أخرى بعد نصف ساعة. لا ينصح بتحفيز المخاض بالأوكسيتوسين أكثر من 3 مرات. إذا كان الأوكسيتوسين غير فعال ، اطلب من الطبيب البيطري إجراء عملية قيصرية. خلاف ذلك ، سيموت الجنين في الرحم ، ويلين ، ويخرج من المهبل.
4. القبالة
- رتب وتحضير الحاضنات (الشكل 1).
ملاحظة: استعد مسبقا قبل أن يلد الأرنب. يبلغ حجم الحاضنة المستخدمة في هذه الدراسة 45 سم × 30 سم × 15 سم في الطول × العرض × الارتفاع.- أضف حشوة ماصة معقمة. يوصى باستخدام حبيبات كوز الذرة.
- انشر منشفة على شكل حصيرة مغطاة بالقطن الصناعي.
ملاحظة: مادة القطن الاصطناعي هي ألياف بوليستر من فئة الأطفال ، وهي غير سامة. القطن الاصطناعي مناسب جدا للأرانب حديثي الولادة الذين يحافظون على الدفء. ومع ذلك ، لا يمكن استخدامه لصنع عش للأرنب الأم ، أو يمكن تناوله في المعدة.
- امسح المخاط بسرعة على الأرانب حديثي الولادة بمنشفة. تأكد من أنهم يتنفسون بسلاسة ، ثم ضعهم في الحاضنة.
ملاحظة: إذا توقف تنفس الأرانب حديثي الولادة ، فاضغط على الفور على الصدر للتنفس المساعد (25-35 مرة / دقيقة) لتقليل قطر الصدر بنسبة 25٪ -30٪ حتى يتم استعادة التنفس التلقائي. - بعد ولادة الأرانب الحامل ، احسب عدد الأجنة المولودة. بطاقات معلومات العصا على الحاضنة: الجينات المعدلة ، وعدد الأرانب حديثي الولادة ، وتاريخ الميلاد ، وما إلى ذلك.
ملاحظة: درجة الحرارة البيئية المناسبة للأرانب حديثي الولادة هي 30-32 درجة مئوية. يمكن أن يؤدي وضع كمية مناسبة من شعر الأرانب أو القطن الاصطناعي داخل الحاضنة إلى تحقيق تأثير عزل جيد. يجب الحفاظ على منزل الأرانب عند 16-25 درجة مئوية. عادة ما يكون لدى الأرانب 6-8 حلمات. إذا كان هناك عدد كبير جدا من الأطفال ، فيمكن إطعام بعض الأطفال من قبل الأرانب الأم الأخرى.
5. رعاية ما بعد الولادة
- رعاية الأرانب الصغيرة (الشكل 2)
ملاحظة: بعد الولادة ، دع الأرنب الأم ترتاح لمدة ساعة تقريبا قبل الرضاعة الطبيعية. عادة ما ترضع الأرانب 1-3 مرات في اليوم.- نظف جميع حلمات الأرنب الأم بقطن الكحول قبل الرضاعة الأولى. باستثناء الرضاعة الطبيعية ، احتفظ بالأرانب الأم والأرانب الصغيرة بشكل منفصل في أوقات أخرى.
- دلكي كل حلمة برفق واعصري القطرة الأولى من الحليب برفق.
- إطعام الأرانب الصغيرة البالغة من العمر 1-2 يوم: في كل مرة ، ضع الأرنب الأم على السجادة في وضع جانبي أو في وضع الانبطاح وضع الأرانب الماصة واحدة تلو الأخرى على حلماتها لامتصاص الحليب (الشكل 2 أ). يجب إطعام 1-2 أرانب عمرها يوم 2-3 مرات في اليوم.
ملاحظة: الأرانب المبكرة أو الأرانب الصغيرة منخفضة الوزن عند الولادة عرضة لنقص السكر في الدم. إطعام 1 مل من الجلوكوز بنسبة 5٪ واستهلك حليب الثدي في أسرع وقت ممكن. إذا كان الأرنب الصغير أضعف من أن يشرب ، فقم بحقن 1 مل من الجلوكوز بنسبة 5٪ مباشرة في تجويف البطن. - في اليوم الثاني بعد الولادة ، استخدم قلم تحديد لترقيم ظهر كل أرنب صغير. تقليم كمية صغيرة من أنسجة الذيل للتنميط الجيني.
- إطعام الأرانب الصغيرة التي يزيد عمرها عن يومين: عند الرضاعة ، ضعي الأرنب الأم في حاضنة واتركيها ترضعها من تلقاء نفسها (الشكل 2 ب). تحتاج الأرانب البالغة من العمر 2-9 أيام إلى إطعامها 1-2 مرات في اليوم ، ويجب إطعام الأرانب التي يزيد عمرها عن 9 أيام مرة واحدة يوميا حتى الفطام. تأكد من امتلاء الأرانب الصغيرة (الشكل 2 ج).
ملاحظة: إذا كانت الأرنب الأم غير راغبة في الرضاعة الطبيعية ، فيمكن إطعامها بعض الخضروات الطازجة لجعلها أكثر استعدادا للتعاون. إذا لزم الأمر ، يمكن إرضاع الأرانب الأم بعد وضعها في وضع مستقر. اعصر برفق أول قطرة من الحليب من كل حلمة للأرنب الأم لتخفيف تورم الثدي والألم ، وهو أمر مفيد للأرانب الصغيرة للرضاعة من الحليب. إذا كانت الطرق المذكورة أعلاه غير فعالة ، فيجب استخدام الأرانب الأم المرضعة الأخرى للرضاعة الطبيعية. - خلال الأيام الأربعة الأولى بعد الولادة ، نظف العجان من الأرنب الصغير مرتين يوميا بكرات قطنية مبللة لتحفيز إفراز العقي والبول (الشكل 2 د).
- مع نمو شعر الأرنب الصغير ، قم بإزالة بعض القطن السفلي من الحاضنة كل يوم.
- قم بتغيير المنشفة مرة واحدة يوميا حتى ينمو الأرنب الصغير إلى النقطة التي يتم فيها تغطية جسمه بالكامل بالشعر.
ملاحظة: بشكل عام ، لم تعد هناك حاجة إلى المنشفة في اليومالثامن بعد الولادة. - إذا أصيب صغار الأرانب (1-2 أسبوع) بالإسهال ، فقم بإطعام 3 قطرات من الجنتاميسين الحيواني على الفور (التركيز 0.04 جم / مل) مرتين يوميا لمدة 5 أيام متتالية.
ملاحظة: عادة ما يحدث الإسهال في الأرانب الصغيرة بسبب امتصاص الحليب من الأرانب الأم المصابة بالتهاب الضرع ، أو بسبب ارتفاع درجة الحرارة والرطوبة في البيئة. معدل وفيات الأرانب الصغيرة المصابة بالإسهال مرتفع للغاية. - بعد أن يفتح الأرنب الصغير عينيه (حوالي أسبوعين) ، انقله إلى قفص تمريض بمنشفة. أضف بعض الأعلاف الخضراء والنظام الغذائي اليومي.
ملاحظة: درجة الحرارة المناسبة للأرانب الصغيرة (2-3 أسابيع) هي 23-30 درجة مئوية. - افصل الأرنب الأم عن الأرانب الصغيرة وافتح الحاجز مرة واحدة فقط يوميا للرضاعة الطبيعية.
ملاحظة: هذا يمكن أن يمنع الأرانب الصغيرة من عض حلمة الأرنب الأم.
- رعاية ما بعد الولادة للأرنب الأم
- أثناء الرضاعة ، اسمح للأرانب الأم بالشرب وتناول الطعام بحرية وإطعامها بالأعلاف الخضراء المناسبة لضمان التغذية الكافية.
- إذا كانت الأرنب الأم تعاني من التهاب الضرع ، فتوقف عن الرضاعة الطبيعية على الفور وقم بإعطاء المضادات الحيوية البيطرية المناسبة للعلاج (يوصى باستخدام السيفالوسبورينات). أطعم الأرانب الصغيرة للأرانب الأم المرضعة الأخرى بأوقات تسليم مماثلة.
6. الاستئصال
- تأكد من فطام معظم الأرانب الصغيرة في عمر 35 يوما. يتم فطام الأرانب الضعيفة في عمر 40 يوما.
ملاحظة: درجة الحرارة المناسبة للأرانب الصغيرة (من 3 أسابيع إلى 3 أشهر) هي 20-25 درجة مئوية. درجة الحرارة المناسبة للأرانب الصغيرة (3-6 أشهر) والأرانب البالغة هي أيضا 15-25 درجة مئوية. - النظر في ما إذا كان سيتم تطعيم اللقاحات التقليدية وفقا للمتطلبات التجريبية بعد الفطام.
النتائج
توضح هذه المقالة إجراء إدارة الحمل والتغذية للأرانب المنقولة بالجنين والمعدل وراثيا. في نهاية عام 2022 ، بدأ مختبر المؤلف في تطوير منصة تحضير للأرانب المعدلة جينيا. خلال هذه الفترة ، تمت مواجهة العديد من المشكلات الشائعة ، بما في ذلك الإجهاض ، والفشل في الولادة ، وعسر الولادة ، والفشل في نتف الشعر لإعداد العش قبل الولادة ، وعدم رغبة الأرانب الأم في الرضاعة الطبيعية أو حوادث أكل لحوم البشر ، وعدم كفاية حليب الثدي بسبب أحجام القمامة الكبيرة ، وفشل صغار الأرانب في شرب الحليب. أدت هذه التحديات إلى تقليل كفاءة تربية الأرانب المعدلة جينيا بشكل كبير.
من خلال تلخيص الخبرات والتعلم من هذه المشكلات ، تم تطوير بروتوكول إدارة الحمل والتمريض للأرانب المنقولة بالجنين والمعدل وراثيا (الشكل 3). أدى هذا البروتوكول إلى تحسين معدل بقاء الأرانب حديثي الولادة بشكل كبير وتقليل معدل الوفيات أثناء الرضاعة (الجدول 1). بالنسبة لمعظم الحالات ، باستثناء نماذج الأمراض المعدلة وراثيا المحددة ذات الأنماط الظاهرية الوخيمة للمرض الوراثي بعد الولادة التي تؤدي إلى ارتفاع معدلات الوفيات ، أثبت هذا النهج فعاليته وقبوله.
حاليا ، انتقل مختبر المؤلف من طرق الولادة والتنشئة الطبيعية التقليدية إلى نموذج إدارة الحمل والتمريض الذي تم إنشاؤه حديثا. حتى الآن ، سهلت هذه الطريقة التكاثر الناجح لأكثر من عشرة أنواع جديدة من الأرانب المعدلة وراثيا ، مما أدى إلى إنتاج العديد من النسل. على الرغم من أن هذا النهج يزيد من عبء العمل ، إلا أنه فعال للغاية. يوضح الشكل 4 مثالا واقعيا لتربية نسل الأرانب المعدلة جينيا MKRN3 ، ويعرض العملية من الولادة إلى الفطام.

الشكل 1: ترتيب حاضنات الأرانب الصغيرة. الخطوات المتبعة في إعداد حاضنة للأرانب الصغيرة: (1) تحضير الحاضنة. (2) الحشو. (3) نشر منشفة. (4) إضافة قطن صناعي ؛ (5) وضع الأرنب الصغير في الداخل ؛ (6) إرفاق بطاقة المعلومات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
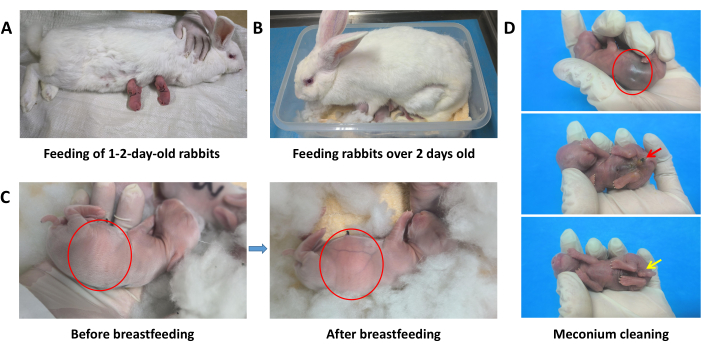
الشكل 2: الرضاعة الطبيعية المساعدة للأرانب الصغيرة. (أ) تغذية الأرانب الصغيرة البالغة من العمر 1-2 يوم. (ب) إطعام صغار الأرانب التي يزيد عمرها عن يومين. (ج) مقارنة بين بطون صغار الأرانب قبل وبعد الرضاعة ، مما يدل على انتفاخ ملحوظ وحليب الثدي الأبيض المرئي في المعدة (يشار إليه بالدائرة الحمراء). (د) إفراز العقي من الجهاز الهضمي خلال 3 أيام من الولادة (يشار إليه بالسهم الأحمر). يتطلب العجان تنظيفا منتظما بكرة قطنية مبللة (يشار إليها بالسهم الأصفر). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
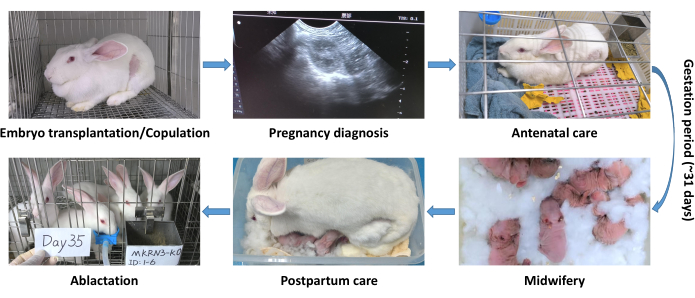
الشكل 3: عملية إدارة الحمل والتمريض للأرانب المنقولة بالجنين والمعدل وراثيا. خطوات عملية الإدارة: تشخيص الحمل. رعاية ما قبل الولادة؛ القباله; رعاية ما بعد الولادة; الاستئصال. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: نمو وتطور الأرانب المعدلة وراثيا من الولادة إلى الولادة. (أ) صور الأرانب الصغيرة من عمر 1-8 أيام. (ب) أرانب صغيرة عمرها خمسة عشر يوما ، مع الأرنب الأم على اليسار والأرانب الصغيرة على اليمين. (ج) أرانب صغيرة مفطومة تبلغ من العمر خمسة وثلاثين يوما. (د) منحنى نمو صغار الأرانب خلال الأسابيع الثلاثة الأولى بعد الولادة. كانت الأرانب الصغيرة من نفس القمامة: ID1 و ID2 و ID3 تمثل الأرانب المعدلة جينيا mkrn3 ، بينما تمثل ID4 و ID5 و ID6 أرانبا من النوع البري. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الولادة الطبيعية التقليدية والرعاية | إدارة الحمل والتمريض | |
| عدد الأرانب حديثي الولادة (8 لتات) | 68 | 71 |
| عدد الأرانب حديثي الولادة الباقية | 42 | 66 |
| عدد الأرانب المفطومة الباقية | 29 | 63 |
| معدل البقاء على قيد الحياة عند الولادة (= الأرانب حديثي الولادة / الأرانب حديثي الولادة الباقية × 100٪) | 61.80% | 93.00% |
| معدل البقاء على قيد الحياة في الفطام (= الأرانب المفطومة الباقية / الأرانب حديثي الولادة × 100٪) | 69.00% | 95.50% |
الجدول 1: بقاء صغار الأرانب في ظل أوضاع إدارة التربية المختلفة. مقارنة بين معدلات بقاء جرو الأرانب عبر استراتيجيات إدارة التربية المختلفة.
Discussion
تشمل الخطوات الرئيسية في إدارة الحمل والتمريض للأرانب المنقولة بالجنة والمعدل وراثيا القبالة والرضاعة الطبيعية المبكرة. الولادة الصعبة هي مشكلة شائعة في الأرانب19. غالبا ما تؤدي أوقات الولادة الطويلة إلى نقص تروية الجنين ونقص الأكسجة والموت25. يمكن أن يؤدي الاستخدام المناسب للأوكسيتوسين إلى تقصير أوقات الولادة بشكل فعال وتقليل حالات عسر ولادة الجنين26. تفشل العديد من الأرانب الأم البدائية في نتف الشعر لإعداد الأعشاش ، مما يزيد من خطر فقدان درجة الحرارة والوفيات في الأرانب حديثي الولادة27،28. عادة ، بعد الحقن العضلي للأوكسيتوسين ، تبدأ الأرانب في الولادة في غضون 5-10 دقائق ، مما يسهل الولادة الاصطناعية ويحسن معدل بقاء الأطفال حديثي الولادة. غالبا ما يعيق سلوك الأم السيئ أو قلة الخبرة النمو السليم لصغار الأرانب. تضمن إدارة التمريض المساعدة حصول الأرانب حديثي الولادة على الرضاعة الطبيعية الكافية وإيواؤها في حاضنات مريحة ، مما يحسن بشكل كبير من بقائهاعلى قيد الحياة 29.
في هذه الدراسة ، تم استخدام حاضنة بسيطة ، تستخدم القطن والمناشف الاصطناعية للتدفئة. درجة الحرارة البيئية المثلى للأرانب حديثي الولادة هي 30-32 درجة مئوية30. إذا كانت متوفرة ، يمكن لمعدات التحكم في درجة الحرارة والرطوبة أن تعزز النتائج بشكل أكبر. في المراحل المتأخرة من الحمل ، قد تظهر على إناث الأرانب أعراض مثل التنفس المتسارع ، وارتفاع الجهاز التنفسي ، وتوسع الأوعية في الأذن ، والإحجام عن تناول الطعام أو التحرك31. تشبه هذه الأعراض ارتفاع ضغط الدم الناجم عن الحمل البشري وتتطلب عناية فورية. في الحالات الشديدة ، قد تحدث وفاة الأمهات والجنين. في ظل هذه الظروف ، يجب إيواء الأرانب الحامل في أقفاص أكثر اتساعا مع قصاصات ورقية لتشجيع صنع العش ، والترويج لممارسة الرياضة ، وتزويدها بأعلاف خضراء طازجة. تخفف هذه الإجراءات بشكل عام من الأعراض السلبية في الأرانب الحامل. ومع ذلك ، في الحالات الحرجة ، من الضروري الحقن العضلي بمقدار 0.02 مجم من كلوبروستينول للحث على إنهاء الحملالمبكر 32.
تضع هذه الدراسة بروتوكولا لإدارة الحمل والتمريض للأرانب المنقولة بالجنين والمعدل وراثيا ، مما يحسن بشكل كبير من كفاءة تربية الأرانب المعدلة وراثيا. بالمقارنة مع طرق تربية مزارع الأرانب التقليدية ، يتطلب هذا النهج المزيد من القوى العاملة والموارد المادية وينطوي على عملية أكثر دقة. ومع ذلك ، بالنسبة لإعدادات المختبر القياسية ، تلبي هذه الطريقة الاحتياجات التجريبية وتوفر رؤى ومهارات عملية.
عند تربية نماذج الأرانب لأمراض وراثية معينة ، مثل الأرانب الضمور العضلي أو الأرانب الخالية من الشعر ، غالبا ما يؤدي التكوين الخلقي الضعيف لهذه النماذج إلى عدم قدرتها على التنافس مع الأرانب البرية في نفس القمامة للحصول على حليب الثدي ، مما يؤدي إلى ارتفاع معدلات الوفيات بعد الولادة بفترة وجيزة33،34. تخفف إدارة التمريض المساعدة بشكل فعال من هذه التحديات ، وتمنع الموت المبكر لصغار الأرانب. بالإضافة إلى ذلك ، يسمح هذا البروتوكول للباحثين بمراقبة وتحديد النمط الجيني للأرانب حديثي الولادة مباشرة بعد الولادة ، مما يقلل من المخاوف بشأن عض إناث الأرانب أو أكل ذريتها. بشكل عام ، يحتوي هذا البروتوكول على تطبيقات واعدة في توليد الأرانب المنقولة بالجنين والمعدل وراثيا.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذا البحث من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (المنحة رقم 82101937) ، ومشروع صندوق أبحاث العلوم والتكنولوجيا الطبية في قوانغدونغ ، الصين (المنحة رقم B2024069) ، ومشروع خطة قوانغتشو للعلوم والتكنولوجيا ، الصين (المنحة رقم 17). SL2023A04J02229 ، التعيين رقم 2024A04J4923).
Materials
| Name | Company | Catalog Number | Comments |
| Artificial down cotton | Yangzhou Anguang Textile Co., Ltd, China | 5490-Jinyu | |
| Cloprostenol Sodium Injection | Shanghai Quanyu Biotechnology (Zhumadian) Animal Pharmaceutical Co., Ltd, China | 163232207 | |
| Corncob granules | Guangdong Provincial Medical Laboratory Animal Center, China | YUMIXIN | |
| Electronic platform scale | Yongkang Runjin weighing instrument Co., Ltd, China | rj-09 | |
| Gentamicin | Shanxi Jinfukang Biological Pharmaceutical Co., Ltd, China | 041531504 | |
| Glucose injection | Henan Kelun Pharmaceutical Co., Ltd, China | H41022251 | |
| Incubator | Foshan Chancheng Hualong Plastic Factory, China | AAA-2 | For newborn rabbits |
| Incubator box | Hebei mabao wire mesh products Co., Ltd., China | https://qr.1688.com/s/AJ1K7O3p | As a nest for the mother rabbits |
| Inslin Syringe | Becton,Dickinson and Company, USA | Ultra-Fine,328421 | |
| Oxytocin injection | Guangzhou Baiyunshan Mingxing Pharmaceutical Co., Ltd | H44025245 | |
| Penicillin injection | Guangdong Kangtaiyuan Animal Husbandry Co., Ltd, China | 300012430 | |
| Rabbit delivery cage | Suzhou Suhang Technology Equipment Co., Ltd., Suzhou, China | RB42-8G | |
| Towel | Zhejiang Jieliya Co., Ltd, China | W3290 |
References
- Xu, J., et al. Gene editing in rabbits: Unique opportunities for translational biomedical research. Front Genet. 12, 642444 (2021).
- Esteves, P. J., et al. The wide utility of rabbits as models of human diseases. Exp Mol Med. 50 (5), 1-10 (2018).
- Song, J., et al. Genome engineering technologies in rabbits. J Biomed Res. 35 (2), 135-147 (2020).
- Brewer, N. R. Biology of the rabbit. J Am Assoc Lab Anim Sci. 45 (1), 8-24 (2006).
- Inazu, A., et al. Increased high-density lipoprotein levels caused by a common cholesteryl-ester transfer protein gene mutation. N Engl J Med. 323 (18), 1234-1238 (1990).
- Han, Y., et al. Genome-edited rabbits: Unleashing the potential of a promising experimental animal model across diverse diseases. Zool Res. 45 (2), 253-262 (2024).
- Ebrahimi, P., et al. In vivo and ex vivo gene therapy for neurodegenerative diseases: A promise for disease modification. Naunyn Schmiedebergs Arch Pharmacol. 397 (10), 7501-7530 (2024).
- Carter, J. E., Schuchman, E. H. Gene therapy for neurodegenerative diseases: Fact or fiction. Br J Psychiatry. 178, 392-394 (2001).
- Zha, Y., et al. CRISPR/Cas9-mediated knockout of APOC3 stabilizes plasma lipids and inhibits atherosclerosis in rabbits. Lipids Health Dis. 20 (1), 180 (2021).
- Khandpur, S., Gupta, S., Gunaabalaji, D. R. Stem cell therapy in dermatology. Indian J Dermatol Venereol Leprol. 87 (6), 753-767 (2021).
- Gao, L., et al. Stem cell therapy: A promising therapeutic method for intracerebral hemorrhage. Cell Transplant. 27 (12), 1809-1824 (2018).
- Alessandrini, M., Preynat-Seauve, O., De Bruin, K., Pepper, M. S. Stem cell therapy for neurological disorders. S Afr Med J. 109 (8b), 70-77 (2019).
- Song, J., et al. Development of the nude rabbit model. Stem Cell Reports. 16 (3), 656-665 (2021).
- Liu, X., et al. YIPF5 (p.W218R) mutation induced primary microcephaly in rabbits. Neurobiol Dis. 182, 106135 (2023).
- Bhaskar, S. M. M. Incidental findings in brain imaging research: spotlight on ethical considerations. Eur Radiol. 32 (10), 6977-6978 (2022).
- Sá, K. N., Venas, G. Brazilian research on noninvasive brain stimulation applied to health conditions. Arq Neuropsiquiatr. 79 (11), 974-981 (2021).
- Fan, J., Wang, Y., Chen, Y. E. Genetically modified rabbits for cardiovascular research. Front Genet. 12, 614379 (2021).
- Mu, Y., et al. GTKO Rabbit: A novel animal model for preclinical assessment of decellularized xenogeneic grafts via in situ implantation. Mater Today Bio. 18, 100505 (2023).
- Castellini, C., et al. The main factors affecting the reproductive performance of rabbit does: A review. Anim Reprod Sci. 122 (3-4), 174-182 (2010).
- Rosell, J. M., Fuente, L. F. Reproductive diseases in farmed rabbit does. Animals (Basel). 10 (10), (2020).
- Dickie, E. Dystocia in a rabbit (Oryctolagus cuniculus). Can Vet J. 52 (1), 80-83 (2011).
- Jiménez, A., González-Mariscal, G. Maternal responsiveness to suckling is modulated by time post-nursing: A behavioral and c-Fos/oxytocin immunocytochemistry study in rabbits. J Neuroendocrinol. 31 (9), e12788 (2019).
- Whitney, J. C., et al. Rabbit mortality survey. Lab Anim. 10 (3), 203-207 (1976).
- Varga, M. Rabbit Basic Science. Textbook of Rabbit Medicine. , 3-108 (2014).
- Hudson, R., Müller, A., Kennedy, G. A. Parturition in the rabbit is compromised by daytime nursing: the role of oxytocin. Biol Reprod. 53 (3), 519-524 (1995).
- Morgan, D. R. Routine birth induction in rabbits using oxytocin. Lab Anim. 8 (2), 127-130 (1974).
- Hamilton, H. H., Lukefahr, S. D., McNitt, J. I. Maternal nest quality and its influence on litter survival and weaning performance in commercial rabbits. J Anim Sci. 75 (4), 926-933 (1997).
- Benedek, I., Altbӓcker, V., Molnár, T. Stress reactivity near birth affects nest building timing and offspring number and survival in the European rabbit (Oryctolagus cuniculus). PLoS One. 16 (1), e0246258 (2021).
- González-Mariscal, G., Gallegos, J. A. The maintenance and termination of maternal behavior in rabbits: involvement of suckling and progesterone. Physiol Behav. 124, 72-76 (2014).
- Saxmose Nielsen, S., et al. Health and welfare of rabbits farmed in different production systems. Efsa j. 18 (1), e05944 (2020).
- Pinto-Pinho, P., Pinto, M. L., Monteiro, J., Fardilha, M. Pregnancy Complications and feto-maternal monitoring in rabbits. Vet Sci. 10 (10), 622 (2023).
- Abel, M., Smith, G. W., Nathanielsz, P. W. Prostaglandin-induced parturition in the rabbit; quantitative aspects of the route and duration of administration. J Endocrinol. 58 (1), xvi (1973).
- Sui, T., et al. A novel rabbit model of Duchenne muscular dystrophy generated by CRISPR/Cas9. Dis Model Mech. 11 (6), 032201 (2018).
- Deng, J., et al. The disrupted balance between hair follicles and sebaceous glands in Hoxc13-ablated rabbits. Faseb j. 33 (1), 1226-1234 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved