Method Article
ניהול הריון והנקה לארנבות שהועברו בעוברים והונדסו גנטית
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר טכניקת ניהול הריון והאכלה לארנבים שהועברו בעוברים והונדסו גנטית, שמטרתה להפחית את תמותת הארנבים שזה עתה נולדו ולשפר את יעילות ההכנה של ארנבים שעברו עריכה גנטית.
Abstract
עם התקדמות המחקר המדעי, הביקוש למודלים של ארנבים ערוכים גנטית הולך וגובר. עם זאת, ישנן מערכות ניהול הריון והזנה מוגבלות לארנבים שעברו עריכה גנטית, מה שמוביל לשיעורי הישרדות נמוכים בקרב ארנבים ערוכים גנטית שהוכנו על ידי חוקרים חסרי ניסיון רבים. לכן, הדרכה נכונה היא חיונית. מאמר זה מסכם את שיטות ההריון וההאכלה של ארנבים מהונדסים גנטית שפותחו במעבדתו של המחבר ומתאר מערך של תהליכים בסיסיים. אלה כוללים אבחון הריון, טיפול טרום לידה, מיילדות, סיוע בהנקה, גמילה והליכים אחרים, יחד עם הצלה וטיפול בארנבות חלשות שזה עתה נולדו. בהשוואה לשיטות הלידה והטיפוח הטבעיות המסורתיות המשמשות בחוות ארנבות, גישה זו כוללת ניהול מעודן יותר, הדורש זמן ומאמץ נוספים אך מגדיל משמעותית את שיעור ההישרדות של ארנבים יונקים. השיטות המתוארות במאמר זה מתאימות לרוב תרחישי הרבייה במעבדה הכוללים ארנבים שעברו עריכה גנטית או העברת עוברים ומספקות התייחסות ישירה ויעילה לחוקרים אחרים.
Introduction
ארנבים הם מודל חיות קלאסי למחקר ביו-רפואי והופכים יותר ויותר למודל התרגום המועדף כדי לגשר על הפער בין מודלים של מכרסמים למודלים של בעלי חיים גדולים 1,2. בהשוואה לבעלי חיים גדולים, לארנבים יש גודל גוף בינוני, מרחב האכלה קטן, עלות האכלה נמוכה ואיסוף דם נוח, התורמים לאיסוף חוזר של נתוני מחקר ופעולות כירורגיות. ארנבים מאופיינים ביכולת רבייה טובה, תקופת הריון קצרה (28-32 יום לארנבים לבנים ניו זילנדים), מספר רב של לידות וצמיחה מהירה 3,4. בהשוואה למכרסמים, ארנבים קרובים יותר לבני אדם בפילוגנזה5. זהו תחליף ניסיוני חסכוני ומעשי לחזירים ופרימטים שאינם אנושיים6. בהשוואה לבעלי חיים גדולים ובינוניים אחרים לעריכת גנים (חזירים, בקר, כבשים, חתולים, כלבים, קופים), עלות ההכנה של ארנבות עריכת גנים נמוכה, והמחזור קצר. עם התפתחות ריפוי גנטי 7,8,9, טיפול בתאי גזע 10,11,12,13, חקר מדעי המוח14 ותחומים מדעיים אחרים 1,15,16,17,18, הביקוש למינים שאינם מכרסמים בעריכת גנים הולך וגובר.
ארנבים לעריכת גנים נחשבו בעבר לאחד מבעלי החיים הבינוניים לעריכת גנים שיכולים לממשיישומים תעשייתיים. עם זאת, עד היום, ארנבים עורכי גנים לא הצליחו להשיג ייצור בקנה מידה גדול. אחת הסיבות העיקריות לכך היא שהייצור והרבייה של ארנבים עורכי גנים הם מאתגרים, והקושי גדול בהרבה מזה של עכברים או חולדות עורכי גנים. אין הרבה מעבדות שיכולות לגדל ביעילות ארנבים לעריכת גנים. לעתים קרובות קשה למתחילים להכין בהצלחה ארנבים לעריכת גנים, ולעתים קרובות הם נתקלים בבעיות לא נעימות כמו שיעור הריון נמוך19, הפלה20, דיסטוציה21, סירוב הנקה על ידי ארנבותנקבות 22 ומוות של ארנבות יונקות23. עם זאת, יש מעט נתונים שיטתיים או הנחיות ספרות על הריון והאכלה של ארנבים עורכי גנים או ארנבים שהועברו בעוברים. רובם מבוססים על הניסיון של חוות ארנבים רגילות.
לכן, מאמר זה מסכם את הניסיון הבוגר של ניהול הריון והנקה של ארנבים מהונדסים גנטית ממעבדתו של המחבר, ומציג מערך של תהליכים בסיסיים של ארנבים שהועברו בעוברים וארנבים מהונדסים גנטית, כולל אבחון הריון, טיפול טרום לידה, מיילדות, האכלה מלאכותית בסיוע, הנקה, כמו גם הצלה והנקה של ארנבים חלשים. תהליך זה הוקם במיוחד לגידול ארנבים עורכי גנים או ארנבים המועברים בעוברים. בהשוואה לשיטת הלידה והטיפוח הטבעית המסורתית של חוות ארנבות, מודל ניהול ההריון וההנקה לוקח יותר זמן ואנרגיה, אך הוא יכול להפחית מאוד את התמותה של ארנבים תינוקות, והמאמץ שווה את זה.
Protocol
כל פרוטוקולי הניסוי אושרו על ידי ועדת האתיקה לניסויים בבעלי חיים של מרכז חיות המעבדה הרפואית של גואנגדונג. מספר הסקירה האתית של גידול ארנבים מהונדסים גנטית MKRN3 המעורב במחקר זה הוא B202210-6. המחקר מקפיד על נהלים התואמים את הסטנדרטים האתיים המתוארים בהצהרת הלסינקי משנת 1975 (תוקנה בשנת 1983). הארנבים הניו זילנדים ששימשו במחקר זה התקבלו ממרכז חיות המעבדה הרפואית גואנגדונג בסין. תהליך ההיריון וההאכלה של ארנבים מהונדסים גנטית המתואר במאמר זה הוא סיכום של שיטות הגידול היומיומיות של בעלי חיים במעבדה של המחבר. פרטים על הריאגנטים והציוד המשמש מפורטים בטבלת החומרים.
1. אבחון הריון
- ביוםה-12 עדה-14 לאחר החזרת העוברים (בחרי אחת מנקודות הזמן), אשרי הריון באמצעות מישוש ישיר.
הערה: ניתן לדלג על שלב זה. אם המישוש מחוספס וכוחני מדי, זה יכול להוביל להפלה אצל ארנבות בהריון.- החזק את עור הצוואר מאחורי אוזני הארנב ביד אחת, תן לישבן הארנב להתכווץ קדימה, קרוב לחלל הבטן של ישבן הארנב, ולאחר מכן השתמש ביד השנייה כדי לפתוח את כף היד ולמשש בעדינות את הקצה האחורי של הבטן.
- לחץ על הבטן במידה מסוימת. אם ממששים מחרוזת רציפה של כדורי בשר חלקים ואלסטיים, הדומים בגודלם לפול, זה נחשב הריון24.
- אם התנאים מאפשרים זאת, השתמש באולטרסאונד ביוםה-15 לאחר העברת העוברים כדי לקבוע אם הארנב בהריון. אבחון ההריון של ארנבות מבוסס על נוכחות של נקודות אקוגניות קטנות וחזקות (שקי הריון) באזור הכהה הנוזלי.
- במהלך התקופה של הימים ה-16-18 לאחר העברת העוברים, התבונן בארנב פעמיים ביום בבוקר ובערב, למשך כ-15 דקות בכל פעם. אם הארנב נצפה מפגין התנהגויות כמו חוסר מנוחה, נשימה מהירה, מריטת שיער לבניית קנים וכו', במהלך לידה או ייחום, זה מצביע על כך שהארנב הנקבה היא פסאודו-הריונית ולא הרתה באמת.
הערה: אם העברת העוברים נכשלת, לארנבות נקבות יהיה הריון מדומה, הדומה ללידה או ייחוםבימים 16-18 עקב ירידה בהורמון הלוטאלי.
2. טיפול טרום לידתי
- אפשר לארנבות בהריון לאכול בחופשיות במהלך ההריון ולהוסיף מזון ירוק טרי פעם בשבוע.
- בבוקר או בערב היוםה-25 לאחר החזרת העוברים, העבירו את הארנבות ההרות לכלוב הלידה.
- יש לחטא מראש את כלוב המסירה, חממת בעלי חיים, שאריות נייר או שבבים.
הערה: בחר כלוב משלוח ארנב העומד בקריטריונים בינלאומיים בגודלו. ודא שלכלוב הלידה יש מספיק מקום לאם הארנב לנוע. בחר חממה שיכולה לעמוד בפני נשנוש אמא ארנב. בחר שאריות נייר עבות עם ספיגת מים טובה. על פי הדרישות וההצעות של הנהלת מתקן בעלי חיים מקומי, בחר שיטות חיטוי מתאימות. - קבעו את החממה בצד אחד של כלוב הלידה, והכניסו מגבות, שבבים או שאריות נייר לתוך חממת החיות כדי שהארנבות ההרות יבנו קן.
- לספק מזון ומי שתייה נאותים.
- העבירו בעדינות את הארנבות ההרות לכלוב הלידה.
- שימו לב האם הארנבות ההרות יצרו קן בחממה מדי יום. אם לא, הוסיפו כמה שאריות נייר ומגבות מחוץ לאינקובטור בבוקר היוםה-28 להריון.
הערה: אם הארנבות ההרות לא מקננות בחממה, סביר להניח שהיא לא תלד בחממה. הניחו כמה מגבות ושאריות נייר מחוץ לחממה כדי למנוע מארנבים שזה עתה נולדו לאבד טמפרטורה ולמות מחוץ לקופסה.
- יש לחטא מראש את כלוב המסירה, חממת בעלי חיים, שאריות נייר או שבבים.
3. לידה
הערה: יום 0 מתייחס זמן קצר לאחר ההפריה והיווצרות פרוקריוטית. ארנבים הם בעלי חיים מעוררי ביוץ המבייצים 10-12 שעות לאחר ההזדווגות. העוברים בשלב התא היחיד המתקבלים ביום שלאחר ההזדווגות נחשבים ליוםה-0.5 . אם עוברים בשלב חד-תאי מתורבתים במבחנה למשך 2-3 שעות בלבד ולאחר מכן מועברים לארנבות פונדקאיות, זה נחשב גם ליוםה-0.5 להריון.
- ניטור טרום לידתי
הערה: תקופת ההיריון של ארנבים היא 28-32 יום. אם ארנב יולדת לפני היוםה-30 להריון, גודל העובר בדרך כלל קטן יחסית, וישנם מקרים נדירים של לידה קשה. אין צורך בהתערבות מוגזמת לפני היוםה-30 .- בבוקר היום ה- 30 להריון בארנבות, בצע מישוש בטן כדי לקבוע בערך את מספר, גודל ופעילות העובר.
- החזק את עור הצוואר מאחורי אוזני הארנב ביד אחת, תן לישבן הארנב להתכווץ קדימה, קרוב לחלל הבטן של ישבן הארנב, ולאחר מכן השתמש ביד השנייה כדי לפתוח את כף היד ולמשש בעדינות את הקצה האחורי של הבטן. הכוח חייב להיות קל.
הערה: לחיצה לתוך הבטן במידה מסוימת תמשש מספר אליפסואידים בגודל ביצה, שיכולים להרגיש את תנועת העובר.
- החזק את עור הצוואר מאחורי אוזני הארנב ביד אחת, תן לישבן הארנב להתכווץ קדימה, קרוב לחלל הבטן של ישבן הארנב, ולאחר מכן השתמש ביד השנייה כדי לפתוח את כף היד ולמשש בעדינות את הקצה האחורי של הבטן. הכוח חייב להיות קל.
- אם נמצא שמספר העוברים שנולדו על ידי ארנבות בהריון הוא 1-2 בלבד, ביוםה-30 להריון, יש להזריק 0.02 מ"ג קלופרוסטנול תוך שרירית בשעה 17:00 כדי לגרום ללידת הארנבים למחרת.
הערה: לארנבות בהריון יש רק 1-2 עוברים, המועדים לדיסטוציה או לכישלון לידה בבגרותם.
- בבוקר היום ה- 30 להריון בארנבות, בצע מישוש בטן כדי לקבוע בערך את מספר, גודל ופעילות העובר.
- לידה חפוזה
הערה: אם הארנבת ההרה לא יולדת בבוקר היוםה-31 להריון, היא יכולה לשקול אם היא צריכה לזרז את הלידה בהתאם לתנאים הבאים. אם יש יותר מ-2 עוברים, לא יינקטו צעדים נוספים.- אם הארנבת ההרה בהריון רק עם 1-2 עוברים והוזרק לה קלופרוסטנול יום קודם, בבוקר היוםה-31 להריון, הזריק 10 יחידות אוקסיטוצין לשרירים כדי לזרז לידה.
- אם לארנבת ההרה יש סימני לידה (כגון חוסר מנוחה, נשימה מהירה, הרחבת כלי דם באוזניים, מריטה והקמת קן, תכנון הקרקע וכו'), יש להזריק 10 יחידות אוקסיטוצין לשרירים כדי לעורר לידה.
- אם לארנב ההרה אין סימני לידה ותנועת העובר תקינה, המשך להתבונן. אם אין לידה בבוקר היוםה-32 להריון, יש להזריק 10 יחידות אוקסיטוצין לשרירים כדי לזרז לידה.
הערה: בדרך כלל, השימוש באוקסיטוצין יכול לפתור לידה קשה. בדרך כלל, 5-10 דקות לאחר הזרקת האוקסיטוצין, הארנבות ההרות יתחילו ללדת. אוקסיטוצין יעיל למשך כחצי שעה וניתן לתת אותו שוב לאחר חצי שעה. לא מומלץ לזרז לידה עם אוקסיטוצין יותר מ-3 פעמים. אם אוקסיטוצין אינו יעיל, בקש מווטרינר לבצע ניתוח קיסרי. אחרת, העובר ימות ברחם, יתרכך וישתחרר מהנרתיק.
4. מיילדות
- מסדרים ומכינים את החממות (איור 1).
הערה: התכוננו מראש לפני שהארנב יולד. גודל האינקובטור ששימש במחקר זה הוא 45 ס"מ × 30 ס"מ × 15 ס"מ אורך × רוחב × גובה.- יש להוסיף ריפוד סופג סטרילי. מומלץ גרגירי קלחי תירס.
- מורחים מגבת כמחצלת מכוסה בכותנה מלאכותית.
הערה: החומר של כותנה פוך מלאכותית הוא סיבי פוליאסטר בדרגת תינוק, שאינם רעילים. כותנה פוך מלאכותית מתאימה מאוד לארנבים שזה עתה נולדו ששומרים על חום. עם זאת, לא ניתן להשתמש בו להכנת קן לארנב האם, או שהוא עלול להיאכל לתוך הבטן.
- נגב במהירות את הריר על הארנבים שזה עתה נולדו במגבת. ודא שהם נושמים בצורה חלקה, ולאחר מכן הכניס אותם לאינקובטור.
הערה: אם נשימתם של ארנבים שזה עתה נולדו נפסקת, לחץ מיד על החזה לנשימת עזר (25-35 פעמים לדקה) כדי להקטין את קוטר החזה ב-25%-30% עד לשחזור הנשימה הספונטנית. - לאחר לידת ארנבות בהריון, ספרו את מספר העוברים שנולדו. הדביקו כרטיסי מידע על האינקובטור: גנים מהונדסים, מספר ארנבים שזה עתה נולדו, תאריך לידה וכו'.
הערה: הטמפרטורה הסביבתית המתאימה לארנבים שזה עתה נולדו היא 30-32 מעלות צלזיוס. הנחת כמות מתאימה של שיער ארנב או כותנה מלאכותית בתוך החממה יכולה להשיג אפקט בידוד טוב. יש לשמור על בית הארנב בטמפרטורה של 16-25 מעלות צלזיוס. לארנבות נקבות יש בדרך כלל 6-8 פטמות. אם יש יותר מדי תינוקות, חלק מהתינוקות יכולים להיות מוזנים על ידי ארנבות אמהות אחרות.
5. טיפול לאחר לידה
- טיפול בארנב תינוק (איור 2)
הערה: לאחר הלידה, הניחו לארנבת האם לנוח כשעה לפני ההנקה. ארנבים בדרך כלל יונקים 1-3 פעמים ביום.- נקו את כל הפטמות של הארנב האם עם כותנה אלכוהולית לפני ההאכלה הראשונה. מלבד הנקה, החזיקו ארנבות אמהות וארנבות תינוקות בנפרד בזמנים אחרים.
- יש לעסות בעדינות כל פטמה ולסחוט בעדינות את טיפת החלב הראשונה.
- האכלה של ארנבים תינוקות בני 1-2 יום: בכל פעם, הניחו את הארנב האם על המזרן בתנוחה צדדית או במצב שכיבה והניחו את הארנבים המוצצים בזה אחר זה לפטמות שלהם כדי למצוץ חלב (איור 2A). יש להאכיל ארנבים בני 1-2 יום 2-3 פעמים ביום.
הערה: ארנבים פגים או ארנבים תינוקות במשקל לידה נמוך מועדים להיפוגליקמיה. האכילו 1 מ"ל של 5% גלוקוז וצרכו חלב אם בהקדם האפשרי. אם הארנב התינוק חלש מכדי לשתות, הזריק ישירות 1 מ"ל של 5% גלוקוז לחלל הבטן. - ביום השני לאחר הלידה, השתמש בעט טוש כדי למספר את החלק האחורי של כל ארנב תינוק. חתוך כמות קטנה של רקמת זנב לצורך גנוטיפ.
- האכלת ארנבים תינוקות מעל גיל יומיים: בעת האכלה, הניחו את הארנב האם באינקובטור ותנו לו לינוק בעצמו (איור 2B). יש להאכיל ארנבים בני 2-9 ימים 1-2 פעמים ביום, ויש להאכיל ארנבים מעל גיל 9 ימים פעם ביום עד הגמילה. ודאו שהארנבים הקטנים מלאים (איור 2C).
הערה: אם הארנב האם אינו מוכן להניק, ניתן להאכיל אותו בכמה ירקות טריים כדי לגרום לו להיות מוכן יותר לשתף פעולה. במידת הצורך ניתן להניק ארנבות אמהות לאחר שהוצבו במצב יציב. סחטו בעדינות את טיפת החלב הראשונה מכל פטמה של הארנב האם כדי להקל על נפיחות וכאבים בשד, מה שמועיל לארנבים התינוקות לינוק מהחלב. אם השיטות לעיל אינן יעילות, יש להשתמש בארנבות מניקות אחרות להנקה. - במהלך 4 הימים הראשונים אחרי הלידה, נקו את הפרינאום של הארנב פעמיים ביום עם כדורי צמר גפן רטובים כדי לעורר את הפרשת המקוניום והשתן (איור 2D).
- ככל ששיערו של הארנב התינוק גדל, הסר מעט כותנה מהחממה מדי יום.
- החלף את המגבת פעם ביום עד שהארנב התינוק גדל עד לנקודה שבה כל גופו מכוסה בשיער.
הערה: בדרך כלל, המגבת אינה נחוצה יותר ביוםהשמיני לאחר הלידה. - אם ארנבים תינוקות (בני 1-2 שבועות) חווים שלשול, האכילו מיד 3 טיפות של גנטמיצין בדרגה מן החי (הריכוז הוא 0.04 גרם/מ"ל) פעמיים ביום למשך 5 ימים רצופים.
הערה: שלשול אצל ארנבים תינוקות נגרם בדרך כלל על ידי מציצת חלב מארנבות אמהות עם דלקת בשד, או על ידי הטמפרטורה והלחות הגבוהות של הסביבה. שיעור התמותה של ארנבים תינוקות עם שלשול גבוה מאוד. - לאחר שהארנב הצעיר פוקח את עיניו (כבן שבועיים), העבירו אותו לכלוב הנקה עם מגבת. הוסף קצת מזון ירוק ותזונה יומית.
הערה: הטמפרטורה המתאימה לארנבים תינוקות (בני 2-3 שבועות) היא 23-30 מעלות צלזיוס. - הפרד את הארנב האם מהארנבות התינוקות ופתח את המבלבל רק פעם ביום להנקה.
הערה: זה יכול למנוע מהארנבים התינוקות לנשוך את הפטמה של הארנב האם.
- טיפול לאחר לידה בארנב האם
- במהלך ההנקה, אפשרו לאמהות ארנבות לשתות ולאכול בחופשיות והאכילו אותן בהזנה ירוקה מתאימה כדי להבטיח תזונה נאותה.
- אם האם ארנבת סובלת מדלקת בשד, יש להפסיק מיד להניק ולתת אנטיביוטיקה וטרינרית מתאימה לטיפול (מומלץ צפלוספורינים). האכילו את הארנבים הצעירים לארנבות מניקות אחרות עם זמני אספקה דומים.
6. הנקה
- ודא שרוב הארנבים הצעירים נגמלים בגיל 35 יום. ארנבים חלשים נגמלים בגיל 40 יום.
הערה: הטמפרטורה המתאימה לארנבים צעירים (בני 3 שבועות עד 3 חודשים) היא 20-25 מעלות צלזיוס. הטמפרטורה המתאימה לארנבים צעירים (בני 3-6 חודשים) ולארנבים בוגרים היא גם 15-25 מעלות צלזיוס. - שקול אם לחסן חיסונים קונבנציונליים בהתאם לדרישות הניסוי לאחר הגמילה.
תוצאות
מאמר זה מתאר הליך ניהול הריון והאכלה עבור ארנבים שהועברו בעוברים והונדסו גנטית. בסוף 2022 יזמה מעבדתו של המחבר פיתוח פלטפורמת הכנה לארנבים מהונדסים גנטית. במהלך תקופה זו, נתקלו במספר בעיות נפוצות, כולל הפלות, אי לידה במועד, דיסטוציה, אי מריטת שיער להכנת הקן לפני הלידה, חוסר נכונות של ארנבות אמהות להניק או תקריות של קניבליזם, חלב אם לא מספיק עקב גודל המלטה גדול, וארנבים תינוקות שאינם שותים חלב. אתגרים אלה הפחיתו משמעותית את יעילות הרבייה של ארנבים מהונדסים גנטית.
על ידי סיכום חוויות ולמידה מהנושאים האלה, פותח פרוטוקול ניהול הריון והנקה עבור ארנבות שהועברו בעוברים והונדסו גנטית (איור 3). פרוטוקול זה שיפר באופן משמעותי את שיעור ההישרדות של ארנבים שזה עתה נולדו והפחית את התמותה במהלך ההנקה (טבלה 1). ברוב המקרים, למעט מודלים ספציפיים של מחלות מהונדסות גנטית עם פנוטיפים של מחלות גנטיות חמורות לאחר הלידה המובילים לשיעורי תמותה גבוהים יותר, גישה זו הוכחה כיעילה ומקובלת.
נכון לעכשיו, המעבדה של המחבר עברה משיטות לידה טבעיות מסורתיות וטיפוח למודל ניהול הריון והנקה שהוקם לאחרונה. עד כה, שיטה זו אפשרה גידול מוצלח של יותר מעשרה זנים חדשים של ארנבים מהונדסים גנטית, וכתוצאה מכך נוצרו צאצאים רבים. למרות שגישה זו מגדילה את עומס העבודה, היא יעילה ביותר. איור 4 ממחיש דוגמה מהחיים האמיתיים של גידול צאצאי ארנב מהונדסים גנטית MKRN3, המציג את התהליך מהלידה ועד הגמילה.

איור 1: סידור אינקובטורים לתינוקות ארנבות. שלבים הכרוכים בהכנת חממה לארנבים תינוקות: (1) הכנת החממה; (2) ריפוד; (3) פריסת מגבת; (4) הוספת כותנה פוך מלאכותית; (5) הנחת הארנב התינוק בפנים; (6) צירוף כרטיס המידע. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
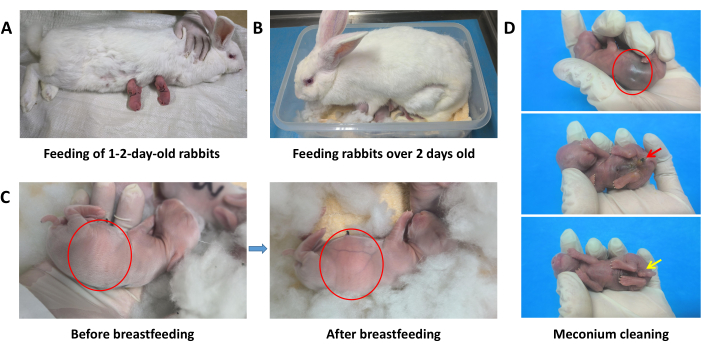
איור 2: סיוע בהנקה עבור ארנבים תינוקות. (A) האכלה של ארנבים תינוקות בני 1-2 יום. (B) האכלת ארנבים תינוקות מעל גיל יומיים. (C) השוואה בין הבטן של גורי ארנבים לפני ואחרי האכלה, שמראה חלב אם לבן בולט וגלוי לעין בקיבה (מסומן בעיגול האדום). (D) הפרשת מקוניום ממערכת העיכול תוך 3 ימים מהלידה (מסומן בחץ האדום). הפרינאום דורש ניקוי קבוע עם צמר גפן רטוב (מסומן בחץ הצהוב). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
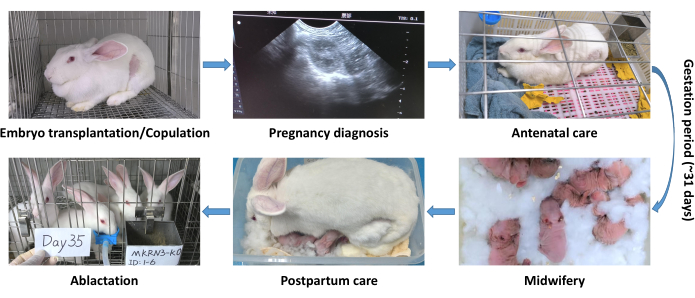
איור 3: תהליך ניהול הריון והנקה עבור ארנבות שהועברו בעוברים והונדסו גנטית. שלבים בתהליך הניהול: אבחון הריון; טיפול טרום לידתי; מיילדות; טיפול לאחר לידה; הנקה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: גדילה והתפתחות של ארנבים מהונדסים גנטית מלידה ועד להנקה. (A) תמונות של ארנבים תינוקות מגיל 1-8 ימים. (B) ארנבות תינוקות בנות חמישה עשר יום, עם הארנבת האם משמאל והארנבות התינוקות מימין. (C) ארנבות צעירות נגמלות בנות שלושים וחמישה יום. (D) עקומת גדילה של ארנבים תינוקות במהלך שלושת השבועות הראשונים לאחר הלידה. ארנבים תינוקות היו מאותה המלטה: ID1, ID2 ו-ID3 מייצגים ארנבים מהונדסים גנטית mkrn3 , בעוד ID4, ID5 ו-ID6 מייצגים ארנבים מסוג בר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| לידה טבעית מסורתית וטיפוח | ניהול הריון והנקה | |
| מספר הארנבים שזה עתה נולדו (8 המלטה) | 68 | 71 |
| מספר הארנבים שזה עתה נולדו ששרדו | 42 | 66 |
| מספר הארנבים הנגמלים ששרדו | 29 | 63 |
| שיעור הישרדות לידה (= ארנבים שזה עתה נולדו / ארנבים שזה עתה נולדו ששרדו × 100%) | 61.80% | 93.00% |
| שיעור הישרדות הגמילה (= ארנבים נגמלים / ארנבים שזה עתה נולדו × 100%) | 69.00% | 95.50% |
טבלה 1: הישרדות גורי ארנבים בשיטות ניהול שונות של רבייה. השוואה של שיעורי ההישרדות של גורי ארנבים על פני אסטרטגיות ניהול רבייה שונות.
Discussion
השלבים העיקריים בניהול ההיריון וההנקה של ארנבות שהועברו בעוברים והונדסו גנטית כוללים מיילדות והנקה מוקדמת. לידה קשה היא בעיה שכיחה אצל ארנבים19. זמני לידה ממושכים גורמים לעתים קרובות לאיסכמיה עוברית, היפוקסיה ומוות25. שימוש נכון באוקסיטוצין יכול לקצר ביעילות את זמני הלידה ולהפחית מקרים של דיסטוציה עוברית26. ארנבות אמהות קדמוניות רבות אינן מצליחות למרוט שיער כדי להכין קנים, מה שמגדיל את הסיכון לאובדן טמפרטורה ותמותה אצל ארנבים שזה עתה נולדו27,28. בדרך כלל, לאחר הזרקה תוך שרירית של אוקסיטוצין, ארנבים מתחילים ללדת תוך 5-10 דקות, מה שמקל על לידה מלאכותית ומשפר את שיעור ההישרדות של יילודים. התנהגות אימהית לקויה או חוסר ניסיון מעכבים לעתים קרובות את הצמיחה התקינה של גורי ארנבות. ניהול הנקה מסייע מבטיח שארנבים שזה עתה נולדו יקבלו הנקה נאותה והם שוכנים באינקובטורים נוחים, מה שמשפר משמעותית את הישרדותם29.
במחקר זה נעשה שימוש בחממה פשוטה, המשתמשת בכותנה מלאכותית ומגבות לחימום. הטמפרטורה הסביבתית האופטימלית לארנבים שזה עתה נולדו היא 30-32 מעלות צלזיוס30. אם זמין, ציוד בקרת טמפרטורה ולחות יכול לשפר עוד יותר את התוצאות. בשלבים המאוחרים של ההריון, ארנבות עלולות להפגין תסמינים כגון נשימה מואצת, נשימה, הרחבת כלי דם באוזניים וחוסר רצון לאכולאו לזוז. תסמינים אלה דומים ליתר לחץ דם הנגרם על ידי הריון אנושי ודורשים התייחסות מיידית. במקרים חמורים עלול להתרחש מוות של האם והעובר. בנסיבות כאלה, יש לשכן ארנבות בהריון בכלובים מרווחים יותר עם שאריות נייר כדי לעודד יצירת קן, לעודד פעילות גופנית ולספק מזון ירוק טרי. אמצעים אלה בדרך כלל מקלים על תסמינים שליליים אצל ארנבות בהריון. עם זאת, במקרים קריטיים, יש צורך בהזרקה תוך שרירית של 0.02 מ"ג קלופרוסטנול כדי לגרום להפסקת הריון מוקדמת32.
מחקר זה קובע פרוטוקול ניהול הריון והנקה עבור ארנבים שהועברו בעוברים והונדסו גנטית, ומשפר משמעותית את יעילות הרבייה של ארנבים מהונדסים גנטית. בהשוואה לשיטות גידול מסורתיות של חוות ארנבות, גישה זו דורשת יותר כוח אדם ומשאבים חומריים וכוללת תהליך קפדני יותר. עם זאת, עבור הגדרות מעבדה סטנדרטיות, שיטה זו עונה על צרכי הניסוי ומציעה תובנות ומיומנויות מעשיות.
כאשר מגדלים מודלים של ארנבים למחלות גנטיות ספציפיות, כגון ארנבות ניוון שרירים או ארנבים חסרי שיער, המבנה המולד החלש של מודלים אלה מביא לרוב לחוסר יכולתם להתחרות עם ארנבים מסוג בר באותה המלטה על חלב אם, מה שמוביל לשיעורי תמותה גבוהים זמן קצר לאחר הלידה33,34. ניהול סיעודי בסיוע מקל ביעילות על אתגרים אלה, ומונע מוות בטרם עת של גורי ארנבות. בנוסף, פרוטוקול זה מאפשר לחוקרים להתבונן ולקבוע את הגנוטיפ של ארנבים שזה עתה נולדו מיד לאחר הלידה, ולהפחית את החששות מפני ארנבות נקבות שנושכות או אוכלות את צאצאיהן. בסך הכל, לפרוטוקול זה יש יישומים מבטיחים ביצירת ארנבים שהועברו על ידי עוברים והונדסו גנטית.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה נתמך על ידי הקרן הלאומית למדעי הטבע של סין (מענק מס' 82101937), פרויקט קרן המחקר למדע וטכנולוגיה רפואית של גואנגדונג, סין (מענק מס' B2024069), ופרויקט תוכנית המדע והטכנולוגיה של גואנגג'ואו, סין (מענק מס. SL2023A04J02229, מטלה מס' 2024A04J4923).
Materials
| Name | Company | Catalog Number | Comments |
| Artificial down cotton | Yangzhou Anguang Textile Co., Ltd, China | 5490-Jinyu | |
| Cloprostenol Sodium Injection | Shanghai Quanyu Biotechnology (Zhumadian) Animal Pharmaceutical Co., Ltd, China | 163232207 | |
| Corncob granules | Guangdong Provincial Medical Laboratory Animal Center, China | YUMIXIN | |
| Electronic platform scale | Yongkang Runjin weighing instrument Co., Ltd, China | rj-09 | |
| Gentamicin | Shanxi Jinfukang Biological Pharmaceutical Co., Ltd, China | 041531504 | |
| Glucose injection | Henan Kelun Pharmaceutical Co., Ltd, China | H41022251 | |
| Incubator | Foshan Chancheng Hualong Plastic Factory, China | AAA-2 | For newborn rabbits |
| Incubator box | Hebei mabao wire mesh products Co., Ltd., China | https://qr.1688.com/s/AJ1K7O3p | As a nest for the mother rabbits |
| Inslin Syringe | Becton,Dickinson and Company, USA | Ultra-Fine,328421 | |
| Oxytocin injection | Guangzhou Baiyunshan Mingxing Pharmaceutical Co., Ltd | H44025245 | |
| Penicillin injection | Guangdong Kangtaiyuan Animal Husbandry Co., Ltd, China | 300012430 | |
| Rabbit delivery cage | Suzhou Suhang Technology Equipment Co., Ltd., Suzhou, China | RB42-8G | |
| Towel | Zhejiang Jieliya Co., Ltd, China | W3290 |
References
- Xu, J., et al. Gene editing in rabbits: Unique opportunities for translational biomedical research. Front Genet. 12, 642444 (2021).
- Esteves, P. J., et al. The wide utility of rabbits as models of human diseases. Exp Mol Med. 50 (5), 1-10 (2018).
- Song, J., et al. Genome engineering technologies in rabbits. J Biomed Res. 35 (2), 135-147 (2020).
- Brewer, N. R. Biology of the rabbit. J Am Assoc Lab Anim Sci. 45 (1), 8-24 (2006).
- Inazu, A., et al. Increased high-density lipoprotein levels caused by a common cholesteryl-ester transfer protein gene mutation. N Engl J Med. 323 (18), 1234-1238 (1990).
- Han, Y., et al. Genome-edited rabbits: Unleashing the potential of a promising experimental animal model across diverse diseases. Zool Res. 45 (2), 253-262 (2024).
- Ebrahimi, P., et al. In vivo and ex vivo gene therapy for neurodegenerative diseases: A promise for disease modification. Naunyn Schmiedebergs Arch Pharmacol. 397 (10), 7501-7530 (2024).
- Carter, J. E., Schuchman, E. H. Gene therapy for neurodegenerative diseases: Fact or fiction. Br J Psychiatry. 178, 392-394 (2001).
- Zha, Y., et al. CRISPR/Cas9-mediated knockout of APOC3 stabilizes plasma lipids and inhibits atherosclerosis in rabbits. Lipids Health Dis. 20 (1), 180 (2021).
- Khandpur, S., Gupta, S., Gunaabalaji, D. R. Stem cell therapy in dermatology. Indian J Dermatol Venereol Leprol. 87 (6), 753-767 (2021).
- Gao, L., et al. Stem cell therapy: A promising therapeutic method for intracerebral hemorrhage. Cell Transplant. 27 (12), 1809-1824 (2018).
- Alessandrini, M., Preynat-Seauve, O., De Bruin, K., Pepper, M. S. Stem cell therapy for neurological disorders. S Afr Med J. 109 (8b), 70-77 (2019).
- Song, J., et al. Development of the nude rabbit model. Stem Cell Reports. 16 (3), 656-665 (2021).
- Liu, X., et al. YIPF5 (p.W218R) mutation induced primary microcephaly in rabbits. Neurobiol Dis. 182, 106135 (2023).
- Bhaskar, S. M. M. Incidental findings in brain imaging research: spotlight on ethical considerations. Eur Radiol. 32 (10), 6977-6978 (2022).
- Sá, K. N., Venas, G. Brazilian research on noninvasive brain stimulation applied to health conditions. Arq Neuropsiquiatr. 79 (11), 974-981 (2021).
- Fan, J., Wang, Y., Chen, Y. E. Genetically modified rabbits for cardiovascular research. Front Genet. 12, 614379 (2021).
- Mu, Y., et al. GTKO Rabbit: A novel animal model for preclinical assessment of decellularized xenogeneic grafts via in situ implantation. Mater Today Bio. 18, 100505 (2023).
- Castellini, C., et al. The main factors affecting the reproductive performance of rabbit does: A review. Anim Reprod Sci. 122 (3-4), 174-182 (2010).
- Rosell, J. M., Fuente, L. F. Reproductive diseases in farmed rabbit does. Animals (Basel). 10 (10), (2020).
- Dickie, E. Dystocia in a rabbit (Oryctolagus cuniculus). Can Vet J. 52 (1), 80-83 (2011).
- Jiménez, A., González-Mariscal, G. Maternal responsiveness to suckling is modulated by time post-nursing: A behavioral and c-Fos/oxytocin immunocytochemistry study in rabbits. J Neuroendocrinol. 31 (9), e12788 (2019).
- Whitney, J. C., et al. Rabbit mortality survey. Lab Anim. 10 (3), 203-207 (1976).
- Varga, M. Rabbit Basic Science. Textbook of Rabbit Medicine. , 3-108 (2014).
- Hudson, R., Müller, A., Kennedy, G. A. Parturition in the rabbit is compromised by daytime nursing: the role of oxytocin. Biol Reprod. 53 (3), 519-524 (1995).
- Morgan, D. R. Routine birth induction in rabbits using oxytocin. Lab Anim. 8 (2), 127-130 (1974).
- Hamilton, H. H., Lukefahr, S. D., McNitt, J. I. Maternal nest quality and its influence on litter survival and weaning performance in commercial rabbits. J Anim Sci. 75 (4), 926-933 (1997).
- Benedek, I., Altbӓcker, V., Molnár, T. Stress reactivity near birth affects nest building timing and offspring number and survival in the European rabbit (Oryctolagus cuniculus). PLoS One. 16 (1), e0246258 (2021).
- González-Mariscal, G., Gallegos, J. A. The maintenance and termination of maternal behavior in rabbits: involvement of suckling and progesterone. Physiol Behav. 124, 72-76 (2014).
- Saxmose Nielsen, S., et al. Health and welfare of rabbits farmed in different production systems. Efsa j. 18 (1), e05944 (2020).
- Pinto-Pinho, P., Pinto, M. L., Monteiro, J., Fardilha, M. Pregnancy Complications and feto-maternal monitoring in rabbits. Vet Sci. 10 (10), 622 (2023).
- Abel, M., Smith, G. W., Nathanielsz, P. W. Prostaglandin-induced parturition in the rabbit; quantitative aspects of the route and duration of administration. J Endocrinol. 58 (1), xvi (1973).
- Sui, T., et al. A novel rabbit model of Duchenne muscular dystrophy generated by CRISPR/Cas9. Dis Model Mech. 11 (6), 032201 (2018).
- Deng, J., et al. The disrupted balance between hair follicles and sebaceous glands in Hoxc13-ablated rabbits. Faseb j. 33 (1), 1226-1234 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved