Method Article
Заражение корней картофеля паразитическими нематодами in vivo и in vitro для оценки индуцированных структурных изменений
В этой статье
Резюме
В протоколе описано заражение корней Solanum tuberosum паразитическими нематодами растений в тепличных условиях in vivo и трансгенных корней картофеля in vitro для гистохимического анализа структуры корней с помощью оптической микроскопии.
Аннотация
Почвенные паразитические нематоды растений (ППН) являются серьезными вредителями картофеля, которые вызывают поражения и/или изменяют корневую структуру растений, что приводит к снижению приспособленности и продуктивности урожая. Исследования клеточных и субклеточных механизмов заражения и развития PPN могут проводиться с использованием полевых растений или рассады в тепличных условиях. Полевые исследования более репрезентативны для природной среды, но подвержены непредсказуемости условий окружающей среды, которые могут сильно повлиять на результаты исследований. Исследования в теплицах позволяют лучше контролировать переменные окружающей среды и повысить безопасность против загрязняющих веществ или патогенов. Однако у некоторых хозяев генетическое разнообразие становится важным фактором изменчивости и влияет на комплексную реакцию хозяин-паразит. Мы разработали in vitro кокультуры трансгенных корней с PPN в качестве надежной альтернативы, которая занимает меньше места, требует меньше времени для получения и не подвержена загрязнению или генетической изменчивости хозяина. Кокультуры получают путем введения асептических ППН в трансгенные корни in vitro . Они могут поддерживаться бесконечно, что делает их отличным подспорьем для хранения коллекций эталонных PPN. В настоящей работе подробно описан протокол контролируемого заражения корней картофеля in vivo корневой нематодой и создания in vitro кокультур трансгенных корней картофеля с корневой узловой нематодой. Сокультуры in vitro обеспечивали лабораторный показатель естественной инфекции картофеля и образовывали стадии жизни нематод независимо от сезона или климатических условий. Кроме того, методология, используемая для структурного анализа, детализирована с помощью гистохимии и оптической микроскопии. Кислотный краситель фуксин используется для отслеживания мест атаки нематод на корнях, в то время как дифференциальное окрашивание периодической кислотой-Шиффом (PAS) и толуидиновым синим O выделяет структуры нематод во внутренней ткани корня картофеля.
Введение
Корнеплоды и клубнеплоды занимают4-е место среди самых важных продуктов питания в мире. Картофель (Solanum tuberosum L.) является одним из важнейших культивируемых клубней. Он берет свое начало в горах Анд в Южной Америке, но после того, как был завезен в Европу в 16веке, быстро стал самым распространенным источником пищи для населения с более низким доходом. Сегодня картофель составляет 1,7% отмирового потребления калорий1. Растениеводство сильно страдает от вредителей и патогенов растений, из которых паразитические нематоды растений (ППН) могут вызывать средние потери урожая, которые увеличиваются до 12%2. Паразитические нематоды на растениях являются причиной некоторых из наиболее разрушительных болезней сельскохозяйственных культур в современном сельском хозяйстве. Почвенные ППН наносят большие убытки фермерам, поскольку они воздействуют на корни растений и снижают урожайность, снижая производство и/или нанося вред продуктам, делая их непригодными для продажи3. Эти опасные фитопаразиты используют свой стилет (игольчатый ротовой аппарат) для прокола клеток корня и питаются их содержимым. Некоторые PPN питаются извне корней, другие проникают в корень и вызывают повреждение тканей (мигрируют), в то время как третьи проникают в корни и становятся малоподвижными, сильно изменяя структуру корней для облегчения питания4. Основными ППН, поражающими картофель, являются картофельные цистообразующие нематоды, Globodera spp., галловые нематоды (RKN), Meloidogyne spp., корневые нематоды поражения, Pratylenchus spp., ложноузловатая нематода Nacobbus aberrans и картофельная гнилостная нематода Ditylenchus destructor. Для этих PPN различные пищевые привычки вызывают различные структурные изменения в тканях корня хозяина 5,6. Исследования механизмов инфицирования PPN и реакции хозяина часто проводятся в полевых или тепличных испытаниях для поддержания коллекций эталонных культур PPN или для проведения крупномасштабных экспериментов 7,8. Тестирование в естественных условиях сильно зависит от изменений окружающей среды, а также биотических или абиотических стрессовых факторов. Тепличные биотесты являются более близкой альтернативой естественным условиям, позволяя при этом относительно контролировать изменения окружающей среды и ограничивая влияние абиотического и биотического стресса. Тем не менее, генетическое разнообразие хозяина все еще может быть проблемой для испытаний, требующих более тонкого контроля биологической изменчивости. Эти ограничения можно преодолеть, прибегнув к культурам тканей растений in vitro. Это универсальные лабораторные системы, обладающие многими преимуществами для исследования заболеваний ППН. Для почвенных ППН, культур трансгенных корней in vitro являются полезным инструментом для исследований в лабораторных условиях 9,10.
Трансгенные корни, или волосистые корни (HR), образуются после заражения растительного материала Rhizobium rhizogenes (Riker et al. 1930) Young et al. 200111. Эта грамотрицательная бактерия индуцирует трансфекцию своей Ri-плазмиды в геном хозяина и изменяет регуляцию биосинтеза растительных гормонов, способствуя образованию корневойткани12. Трансгенные корни могут сохраняться в течение неограниченного времени под асептикой в культуральной среде. Преимуществами использования HR для изучения PPN являются высокая скорость роста при отсутствии регуляторов роста растений, влияющих на заражение и развитие нематод, высокий коэффициент производства биомассы в единицу времени, а также клеточная целостность и долголетие, определяющие более высокую генетическую и биохимическую стабильность6. Прибегая к трансгенным корням in vitro, генотипы PPN могут поддерживаться в лабораторных условиях в течение неограниченного времени, можно легко отслеживать инфекцию и развитие PPN, можно снизить генетическую изменчивость хозяина, манипуляции с молекулярным составом хозяина могут быть напрямую связаны с реакцией нематоды, а структурные изменения хозяина и паразита могут быть более точно прослежены 6,13. Для исследований болезней ППН картофеля трансгенные сокультуры корней in vitro позволяют проводить эксперименты независимо от сезона или покоя клубней картофеля.
В данном протоколе подробно описана традиционная методика поддержания ППН и заражения растений картофеля in vivo . Для структурного анализа инфицированных корней также подробно описана усовершенствованная методология, основанная на создании in vitro сокультур трансгенных корней картофеля с PPN, в качестве альтернативы, которая позволяет лучше контролировать окружающую среду и генетическую изменчивость хозяина. Для отслеживания инфекции и развития ППН в тканях корня используется гистохимия, помогающая в наблюдении ППН с помощью оптической микроскопии. Общая цель данного протокола заключается в оптимизации изучения взаимодействий PPN и хозяина, обеспечении более контролируемых и воспроизводимых условий для экспериментов и одновременном облегчении детального структурного анализа и анализа развития нематод в ткани корня.
протокол
1. Заражение растений картофеля, выращенных в теплицах
ПРИМЕЧАНИЕ: Тепличные испытания проводятся с суспензиями PPN на смешанных стадиях жизни или на второй стадии молоди (J2), в зависимости от конкретного жизненного цикла вредителя PPN. Для этого протокола использовали суспензии смешанных стадий жизни корневой нематоды поражения (РЛН) Pratylenchus penetrans . PPN могут быть выращены в лаборатории или запрошены в сертифицированных референс-лабораториях.
- Размножение и поддержание корневых поражений нематод
ПРИМЕЧАНИЕ: Стерилизованные морковные диски используются для размножения и поддержания RLN14. Используйте коммерчески приобретенную морковь (var. Nice) без видимых повреждений, чтобы уменьшить микробное загрязнение. Предпочтительно, чтобы они не содержали пестицидов, чтобы не препятствовать развитию RLN.- Промойте морковь в проточной водопроводной воде, чтобы удалить более крупный мусор, а затем обычным раствором моющего средства (1 капля на 40 мл воды), чтобы удалить более мелкие загрязнения. Высушите лабораторными бумажными полотенцами.
- Под асептикой, в вытяжку с вертикальным потоком, вставьте стерилизованную металлическую шпажку на верхнюю часть моркови (от 1 до 2 см внутрь), чтобы ее было легче держать.
- С помощью промывочной бутылки с насадкой намочите морковь 96% (v/v) этанолом. Промокните нижний кончик моркови в стерилизованной фильтровальной бумаге и осторожно поднесите ее к пламени.
ВНИМАНИЕ: Имейте в виду, что этанол сильно воспламеняется, поэтому стойте на расстоянии. - Очистите морковь сверху вниз с помощью стерильной овощечистки, а затем повторите предыдущий шаг. Выбросьте верхнюю и нижнюю части (на 2 см внутрь) и установите среднюю часть моркови в стерильную чашку Петри (диаметром 150 мм). С помощью стерильного лезвия и пинцета аккуратно отрежьте отрезки толщиной 1 см от части моркови диаметром примерно 2 см (Рисунок 1).
- Переложите срезы в стерильные чашки Петри (диаметр 60 мм) и заклейте границу прозрачной пленкой. С помощью ультрафиолетового излучения простерилизовать поверхность морковных дисков в течение 60 минут с каждой стороны.
- Хранить при температуре 25 °C в течение 1-2 недель в темноте и выбросить все морковные диски, на которых начинают проявляться признаки микробного загрязнения15.
ПРИМЕЧАНИЕ: Видимыми признаками загрязнения являются чрезмерное потемнение (гниение), скопление жидкости в нижней границе морковного диска или рост грибкового мицелия на поверхности. - Оставшиеся морковные диски готовы к заражению суспензиями RLN. Начните с того, что сделайте Х-образный надрез в центре морковного диска с помощью стерильного лезвия. Обязательно режьте только наполовину вглубь.
- Инокулировать RLN путем пипетирования 50 мкл суспензии, содержащей не менее 50 смешанных жизненных стадий, в центре Х-образной раны. Закройте чашку Петри и заклейте границу прозрачной пленкой, чтобы избежать высыхания.
- Определить среднее количество нематод в суспензии путем подсчета пяти аликвот по 50 мкл под бинокулярным стереомикроскопом (40x) при комнатной температуре в вогнутом предметном стекле. Установите суспензию смешанных РЛН на стадии жизни на 1000 на мл, добавив воду в суспензию или дождавшись, пока нематоды осядут (примерно 60 мин), и уменьшите объем путем сцеживания поверхностных вод.
- Храните морковные диски при температуре 25 °C, в темноте, до 3 месяцев и еженедельно наблюдайте под бинокулярным стереомикроскопом на предмет признаков некротических поражений, являющихся результатом роста популяции RLN.
ПРИМЕЧАНИЕ: Успешно зараженные морковные диски можно хранить при температуре 11 °C для последующего использования до 2 месяцев, но регулярно проверяйте их на микробное загрязнение. Паразитированные морковные диски с признаками микробной инфекции должны быть обеззаражены путем автоклавирования перед утилизацией. - Извлеките RLN под проточный колпак путем переноса морковных дисков с видимым некрозом тканей в месте инокуляции (рис. 1) на сито диаметром 8 см и ячеистым размером 75 мкм, установленное в стерильной стеклянной миске. Оставьте небольшой зазор в 1 см между дном сита и вогнутостью чаши для сбора RLN.
ПРИМЕЧАНИЕ: При отсутствии коммерчески приобретенного сита, его можно изготовить из пластиковой трубки диаметром 8 см / прочного пластикового стаканчика и плотной сетчатой марли. С помощью резиновых лент закрепите марлю на пластиковой трубке или чашке. - Налейте в сито раствор антибиотика, пока морковные диски не покроются, и выдержите 12 часов (на ночь) в темноте. RLN выходят из морковных дисков и оседают на дне миски. Раствор антибиотиков следует готовить непосредственно с экстракцией путем добавления по 50 мкг/мл канамицина и карбенициллина в стерилизованную дистиллированную воду16.
Исходные растворы антибиотиков готовят из расчета 50 мг/мл путем растворения 0,5 г канамицина моносульфата или 0,5 г карбенициллина динатрия в 10 мл стерилизованной дистиллированной воды. Исходные растворы фильтруются (0,22 мкм меш) в проточном колпаке и могут храниться при температуре -20 °C до 1 года. - Снимите сито, с помощью стерилизованной стеклянной пипетки наберите RLN со дна миски в стерилизованный стеклянный краситель (4 см x 4 см x 1 см) и промойте пипетированием 1 мл раствора антибиотика. Подождите от 30 до 40 минут, пока нематоды осядут, прежде чем собирать использованный раствор антибиотика. Повторите эту стирку 4-5 раз.
- Используйте водную суспензию вместе с RLN немедленно или храните ее при температуре 11 °C в течение более длительного срока хранения (до 2 месяцев).
- Заражение растений картофеля ППН in vivo
ПРИМЕЧАНИЕ: Для выращивания восприимчивых растений картофеля (S. tuberosum var. Désirée) сертифицированный семенной картофель должен быть приобретен у агродилеров в период с января по март. Выбирайте сертифицированный семенной картофель, потому что он продается с фитосанитарным паспортом, гарантирующим, что он не заражен карантинными фитопаразитами. В качестве меры предосторожности можно провести начальный этап дезинфекции 10% раствором отбеливателя с последующей промывкой в проточной воде из-под крана, чтобы обеспечить дезинфекцию поверхности клубней картофеля. Обычный коммерческий картофель не рекомендуется, так как обработка, применяемая для снижения прорастания и силы, может помешать росту картофеля и реакции на инфекцию.- Выбирайте клубни картофеля одинакового размера и выбрасывайте те, у которых есть дыры, помятости или более мягкие срезы. Аккуратно удалите все подросшие ростки (1 мм) перед посевом, чтобы синхронизировать прорастание.
ПРИМЕЧАНИЕ: При необходимости храните семенной картофель в хорошо проветриваемом, сухом и темном месте перед посевом. - Заполните горшки объемом 5 л (22 см x 18 см) смесью автоклавной почвы и мелкого крупнозернистого песка в соотношении 1:1, смешанной с 22,5 г удобрения NPK с медленным высвобождением (12-12-12) и посейте картофель на глубине 9 см от поверхности почвы.
ПРИМЕЧАНИЕ: Почву и песок следует просеять для удаления мусора размером более 2 мм, автоклавировать 2x при 121 °C в течение 15 минут и высушить при 100 °C в течение 1-2 дней, с частым перемешиванием. Проветривайте в течение следующих 7-10 дней, часто перемешивая, перед использованием. - Держите горшки в теплице во влажных условиях (влажность 50%-70%) и часто поливайте (поддерживайте максимальную водоудерживающую способность почвы 70%), избегая перепадов температур, пока на поверхности почвы не начнут появляться ростки картофельных растений.
- После появления всходов растений используйте свежеизвлеченные суспензии RLN для заражения корней картофеля. Начните с создания равномерно распределенных от 4 до 6 отверстий (шириной 1 см) вокруг растения на глубину семени.
- Равномерно внесите в отверстия 8 мл суспензии 30 000 живых РЛН смешанной стадии жизни так, чтобы инокулюм был в соотношении 4 живых РЛН на г почвенной смеси, и накройте почвенной смесью. Для горшков с RLN воздержитесь от полива в день прививки.
ПРИМЕЧАНИЕ: РЛН подсчитываются под стереомикроскопом (40x). Мертвые нематоды неподвижны и имеют вытянутую форму, в то время как живые нематоды обычно подвижны (невытянутая форма). Физическое подталкивание используется для установления смертности. - Держите горшки в течение 2 месяцев в условиях, описанных выше (рисунок 2). После этого вырвите с корнем растения картофеля и взвесьте побеги и корни отдельно.
- Тщательно промойте корневую систему перед проверкой местоположения мест атаки RLN с помощью методов окрашивания5.
- Выбирайте клубни картофеля одинакового размера и выбрасывайте те, у которых есть дыры, помятости или более мягкие срезы. Аккуратно удалите все подросшие ростки (1 мм) перед посевом, чтобы синхронизировать прорастание.
2. Создание in vitro сокультур трансгенных корней картофеля с ППН
- Установление in vitro трансгенные корни картофеля
ПРИМЕЧАНИЕ: Для этого протокола мы использовали Rhizobium rhizogenes Переноска gus репортерный ген, коинтегрированный в плазмиду Ri и управляемый двойным промотором 35S (A4pRiA4::70GUS)17. Бактерии могут быть получены из коммерческих источников или запрошены в сертифицированных референс-лабораториях.- Чтобы получить бактерии в фазе экспоненциального роста, разложите планшет R. rhizogenes в твердой средней пластине Лурии-Бертани (LB)18 и выдержите в течение ночи при температуре 26 °C.
ПРИМЕЧАНИЕ: Среду LB можно приобрести в коммерческих целях или приготовить в лаборатории путем добавления 10 г/л пептона, 5 г/л дрожжевого экстракта, 10 г/л NaCl и 15 г/л агара, а затем стерилизации паром в течение 15 мин при 121 °C. - С помощью петли посева выберите колонию и введите 10 мл жидкого бульона LB (среда LB без агара) в стерильную колбу объемом 50 мл. Оставить на ночь в темноте при температуре 26 °C при перемешивании (180 об/мин).
- Измеряйте абсорбцию жидкой культуры до тех пор, пока A600 не достигнет 0,6. На этой стадии бактерии находятся в фазе экспоненциального роста и используются для инокуляции растительного материала.
- Инокуляцию проводят в асептические клубни свежего картофеля. Чтобы простерилизовать поверхность клубней картофеля, начните с промывки в проточной водопроводной воде для удаления более крупного мусора, а затем с помощью обычного раствора моющего средства (1 капля на 40 мл воды) при энергичном перемешивании, чтобы удалить более мелкие остатки.
ПРИМЕЧАНИЕ: Выберите сорт картофеля с известной восприимчивостью к используемым ППН. Для этого протокола мы использовали S. tuberosum var. Désirée. - Поместите клубни в контейнер, залейте раствором товарного известителя (1:4, коммерческий отбеливатель в водопроводной воде) и закройте. Перемешайте в течение 15 минут, утилизируйте раствор отбеливателя и 3 раза промойте стерилизованной водой из-под крана.
- В проточной колпаке погрузите клубни в раствор этанола (80%, v/v) на 15 минут с энергичным перемешиванием, утилизируйте этанол и промойте 3 раза стерилизованной водой из-под крана.
- С помощью стерильного скальпеля удалите периферийные участки клубней (примерно 50% клубня от поверхности внутрь), а внутренний центральный кусочек разделите на19 сегментов толщиной 0,5 см. Немедленно введите бактериальную суспензию, приготовленную на шаге 2.1.3.
- Для посева бактериальную суспензию разбавляют, добавляя 1 мл бактериальной суспензии к 9 мл среды Schenk and Hildebrandt20 (SH) с добавлением 30 г/л сахарозы при pH = 5,6. Окуните кончик стерильного скальпеля в разведенную суспензию и обмотайте поверхность картофельного сегмента. Повторите этот шаг 5 раз для каждого сегмента картофеля.
- Сегменты избыточной влажности высушить в стерильной фильтровальной бумаге в течение 1 мин, поместить в полутвердую среду SH (среда SH с сахарозой 30 г/л, агаром 8 г/л, pH = 5,6) и держать в темноте при температуре 25 °C для проведения трансфекции плазмид.
- Через 3 дня перенесите инфицированные сегменты в планшеты с полутвердой средой SH с добавлением по 150 мкг/мл цефотаксима и карбенициллина каждого антибиотика. Хранить более 3 месяцев с еженедельным обновлением среды для обеспечения элиминации бактерий.
ПРИМЕЧАНИЕ: Стоковый раствор цефотаксима можно приготовить при концентрации 100 мг/мл путем растворения 1 г цефотаксима натрия в 10 мл стерильной деминерализованной воды и фильтрации (0,22 мкм меш) под проточным колпаком. Антибиотики можно хранить при температуре -20 °C до 1 года. - Через 3 месяца рост трансгенных корней становится обширным. Переложите корни в свежую полутвердую среду SH без антибиотиков, собрав кончиками стерильного пинцета комок корня массой 1 г и поместив его в центр питательной среды в новой тарелке (рис. 3).
Примечание: Примерно через 1 месяц после заражения на поверхности картофельного сегмента появляются небольшие массы клеточного роста, откуданачинают развиваться трансгенные корни. Обязательно держите их в контакте с питательной средой, иначе они могут высохнуть. - Чтобы обеспечить генетическую и метаболическую стабильность, храните трансгенные корни в рамках ежемесячного режима субкультуры (как описано в шаге 2.1.11.) при температуре 25 °C в темноте в течение более 1 года перед инфекцией PPN.
ПРИМЕЧАНИЕ: Убедитесь, что на каждом этапе протокола сохраняется не менее шести повторов, поскольку часто происходит нежелательное микробное загрязнение. После создания одна сокультуральная пластина может быть использована в качестве инокулята для нескольких новых сокультур; Тем не менее, обязательно сохраните не менее шести репликационных пластин.
- Чтобы получить бактерии в фазе экспоненциального роста, разложите планшет R. rhizogenes в твердой средней пластине Лурии-Бертани (LB)18 и выдержите в течение ночи при температуре 26 °C.
- Создание in vitro кокультур трансгенных корней картофеля с PPN
Примечание: Для получения кокультур трансгенных корней с PPN процесс стерилизации нематод имеет решающее значение. Для настоящего протокола использовали молодь второй стадии карантинной галловой нематоды Meloidogyne chitwoodi. Инокулюмент нематоды можно получить в сертифицированных референс-лабораториях в виде корневых галлов.- Под бинокулярным стереомикроскопом (20х) изолировать яичные массы нематоды из галлов корней стерильным ультратонким пинцетом. Поместите яичные массы в закрытую чашку Петри с 5 мл стерильной водопроводной воды и дайте яйцам вылупиться в течение 48 часов. Установите суспензию J2 на 100 нематод на мл.
- В проточный колпак нанесите 5 мл суспензии, содержащей 500 Дж2, в стерильное стерильное сито размером 20 мкм и промойте стерильной водопроводной водой.
- Погрузите нижнюю половину сита, содержащего J2, в 20 % раствор перекиси водорода (H2O2) и перемешайте вручную круговыми движениями в течение 15 минут.
- Промойте стерильные J2, пропустив стерильную воду из-под крана через сито. Повторите этот шаг 3 раза. При окончательной промывке наклоните сито так, чтобы нематоды собрались на границе сита. Восстановите стерильную суспензию нематоды путем пипетирования 1 мл стерильной сверхчистой воды на границе сита и храните при температуре 11 °C или используйте немедленно.
Примечание: Успех стерилизации можно оценить, поместив 100 мкл аликвоты суспензии нематоды в среду SH и регулярно контролируя загрязнение в течение 1 недели. - В проточном колпаке субкультурируют 1 г пучка трансгенных корней картофеля (как описано в шаге 2.1.11.) на SH-планшетах со 100 стерильными нематодами (100 мкл суспензии с 1000 J2s на мл). Через 2 – 3 недели в новых корнях начинают появляться мелкие галлы.
- Регулярно следите за сокультурой под перевернутым микроскопом (100x), и когда массы яиц начнут становиться заметными, подкультивируйте в новую полутвердую среднюю пластину SH, убедившись, что галлы взяты вместе с комком корня (рис. 4). Сокультуры должны проходить ежемесячный режим субкультуры при температуре 25 °C в темноте.
3. Структурный анализ инфекции ППН
ПРИМЕЧАНИЕ: Для отслеживания вызванных ППН изменений в структуре тканей корня используются методы гистохимического окрашивания для контрастирования тканей с различным химическим составом. Дифференциальное окрашивание проводится в корневых массах или в тонких срезах неподвижного корневого материала, где специфические красители реагируют с целевой тканью в соответствии с их химическим сродством21. Для настоящего протокола мы использовали кислотный фуксин или периодический кислотный реагент Шиффа (PAS) в сочетании с толуидиновыми синими О-красителями для дифференциального окрашивания.
- Распространение паразитических нематод растений в корнях, окрашенных кислым фуксином
ПРИМЕЧАНИЕ: Чтобы проследить за распределением PPN по корневой системе, кислотный фуксин используется для окрашивания мышечной ткани нематоды в красный оттенок5.- Начните с промывания корневой системы под проточной водой из-под крана в течение 5 минут, чтобы удалить любые остатки почвы (корни растений in vivo ) или остатки питательной среды (трансгенные корни in vitro ). Используйте пальцы круговыми движениями, чтобы помочь отделить почву от корневой системы.
- Разрежьте корневую систему на участки длиной от 1 до 2 см и поместите ее внутрь стакана объемом 150 мл. Дозируйте 70 мл 1,5 % раствора гипохлорита натрия (NaOCl) и энергично перемешивайте в течение 4 минут, чтобы очистить ткани корня. После этого утилизируйте раствор NaOCl, промойте корни в проточной водопроводной воде и замочите на 15 минут в деминерализованной воде, чтобы удалить остатки NaOCl22.
ПРИМЕЧАНИЕ: Хлорный отбеливатель содержит минимум 5,25% NaOCl, поэтому добавьте 20 мл хлорного отбеливателя в 50 мл воды, чтобы получить 1,5% раствор NaOCl. Для более мягкого материала (например, более мягких тканей молодых корней или трансгенных корней, выращенных in vitro ) используют 0,9% раствор NaOCl, в то время как для более твердого материала (старые одревесневшие корни) используют 2,0% раствор NaOCl. - Слейте воду с очищенных корней и установите их на стакан из боросиликатного стекла с 30 мл деминерализованной воды. Пипеткой пипетку 1 мл раствора красителя фуксина, перемешать вручную и кипятить 30 с на горячей плите. Дайте стеклянному стакану остыть, слейте раствор и промойте испачканные корни в проточной воде из-под крана.
ПРИМЕЧАНИЕ: Раствор для окрашивания кислотой фуксина получают путем растворения 3,5 г порошка красителя фуксина в 250 мл уксусной кислоты и добавления 750 мл деминерализованной воды. За окрашиванием всегда следует этап удаления неиспользованных лишних пятен и повышения контрастности образца. - Удалите пятна, добавив 10-30 мл глицерина, подкисленного несколькими каплями HCl (5N)13.
- Наблюдайте под стереомикроскопом или инвертированным микроскопом, чтобы примерно оценить, где в структуре корня PPN атакуют преимущественно (рис. 5 и рис. 6).
- Оценка морфологии клеток корня с периодической кислотой-Шиффом (PAS)/толуидиновым синим O
Примечание: Влияние инфекции PPN или повреждение морфологии корневых клеток можно оценить под микроскопом путем предварительной фиксации, разрезания и дифференциального окрашивания инфицированных корней картофеля.- В закрытом флаконе с образцом зафиксировать свежий корневой материал с 2,5% глутаральдегидом, приготовленным в 0,1 М натрийфосфатном буфере, при рН 7,2, в течение 24-48 ч, при комнатной температуре6.
ВНИМАНИЕ: Глутаральдегид токсичен. Избегайте вдыхания и контакта. Используйте защитный лабораторный халат и перчатки и работайте в вытяжном шкафу. Флаконы с образцами должны быть закрыты, за исключением случаев промывки или вакуумных процедур. Утилизируйте глутаральдегид в соответствии с правилами процедуры обращения с опасными отходами. Шаги с 3.2.1 по 3.2.5 выполняют в вытяжном шкафу во избежание вдыхания реагентов.
ПРИМЕЧАНИЕ: Для приготовления 1 л буфера фосфата натрия pH 7,2 добавьте 68,4 мл 1M Na2HPO4 (141,96 г в 1 л раствора) в 31,6 мл 1M2PO4 (119,98 г в 1 л раствора) и заполните до 1 л, добавив 900 мл деминерализованной воды. Чтобы облегчить инфильтрацию фиксатора, поместите незакрытые пробирки с корневым материалом в низкий вакуум (26 мм рт.ст.) на 2 минуты в эксикатор, подключенный к вакуумному насосу. - С помощью стеклянной пастеровской пипетки сбросить фиксирующий раствор и промыть зафиксированные корни фосфатно-натриевым буфером (3x).
- Начните постепенное обезвоживание зафиксированной корневой ткани, заменяя буфер 10 % раствором этанола (v/v) в течение 15 минут. После этого замените 20% раствором этанола с помощью стеклянной пипетки и оставьте корни на 15 минут. Продолжайте поэтапную последовательность повышения концентрации этанола (30%, 40%, 50%, 60%, 70%, 80% и 90% в течение 15 мин каждая) до стадии чистого этанола, где корни должны храниться в течение 1 ч.
- Постепенно заделывайте обезвоженные корни в смолу (2-гидроксиэтилметакрилат). С помощью стеклянной пипетки замените чистый этанол раствором этанола/смолы в соотношении 3:1 (v/v) и выдержите в течение 24 часов при температуре 4 °C. Затем нанесите растворы этанола/смолы в соотношении 1:1 и 1:3 (v/v), каждый из которых имеет 24-часовой инкубационный период при 4 °C. После этого замените раствор 1:3 (v/v) чистой смолой с добавлением пероксида дибензоила (1%) в качестве инициатора полимеризации.
- Поместите образцы в формовочный лоток для смолы, добавьте смесь смолы:диметилсульфоксида 15:1 (v/v) и выдержите при температуре 60 °C на горячей плите в течение 48 часов, чтобы смола затвердела.
- Поместите пропитанные образцы во вращающийся микротом, оснащенный вольфрамовым ножом, и нарежьте срезы размером 2-5 мкм на предметные стекла в соответствии с инструкциями производителя.
- Дифференциальное окрашивание начинают с погружения предметных стекол на 10 мин в стеклянную банку для окрашивания с 15% раствором 2,4-динитрофенилгидразина в уксусной кислоте, при комнатной температуре. После этого тщательно промойте под проточной водой из-под крана в течение 15 минут и высушите в духовке при температуре 60 °C (15 минут).
- Затем погрузите предметные стекла в периодическую кислоту (1%) на 10 минут, а затем промойте под проточной водой из-под крана на 5 минут и оставьте сушиться в духовке при температуре 60 °C (15 минут).
- Погрузите предметные стекла в реагент Шиффа (состоящий из 1% парарозанилина и 4% метабисульфита натрия в 0,25 М соляной кислоте) на 30 минут. После этого промыть раствором метабисульфита натрия (0,5%) в соляной кислоте (0,05 М), в течение 2 мин. Повторить 3 раза. Наконец, промойте в проточной воде из-под крана в течение 5 минут и высушите при комнатной температуре.
- Для контраста окрашивание производится путем погружения предметных стекол в 0,05% толуидина синего O на 15 минут, мытья в проточной воде из-под крана в течение 15 минут и сушки в духовке при температуре 60 °C (15 минут).
- Наблюдайте под микроскопом (100x), оснащенным оборудованием для захвата изображений (рис. 7).
- В закрытом флаконе с образцом зафиксировать свежий корневой материал с 2,5% глутаральдегидом, приготовленным в 0,1 М натрийфосфатном буфере, при рН 7,2, в течение 24-48 ч, при комнатной температуре6.
Результаты
Морковные диски могут использоваться для размножения и поддержания нескольких видов мигрирующих ППН23. Для RLN этот метод обычно используется для поддержания эталонных коллекций видов нематод или изолятов. Используя морковные диски, можно получить в среднем 100-кратное увеличение популяции нематод в течение 3 месяцев (рис. 1). Тем не менее, численность нематод колеблется в широких пределах (от 30 до 200 раз), в основном из-за генетического разнообразия нематод и/или вариаций питательной ценности моркови. Кроме того, несмотря на ряд профилактических мер, используемых для снижения микробного загрязнения, от 20% до 30% морковных дисков могут загрязниться, поэтому обязательно подготовьте больше тарелок, чем требуется.
У растений картофеля присутствие RLN не всегда вызывает видимые симптомы, поскольку они в значительной степени зависят от численности популяции паразитов, атакующих корневую систему (Рисунок 2). Для P. penetran первоначальный инокулюм в 4 RLNs/г почвы может образовать до 2000 RLNs/г корня и 750 яиц/г корня через 2 месяца, что приводит к снижению массы корняпочти на 30%.
Волосатые корневые культуры картофеля представляют собой высокопроизводительную систему для изучения корнезависимых заболеваний в лабораторных условиях. Установленные трансгенные корни картофеля имеют удельную скорость роста 300 мг свежей массы корня на л среды SH в день и время удвоения 2,6дня 6 (Рисунок 3). При совместном культивировании с M. chitwoodi эти параметры немного изменяются, так как нематоды питаются тканью корня и вызывают поглотитель энергии. Для сокультур может быть достигнута удельная скорость роста 200 мг свежего веса корня на л среды SH в день и время удвоения 3дня6. Количество развившихся нематод может возрастать до 1200 Дж2 на г свежего веса трансгенного корня картофеля, а количество яиц может быть в 4 раза выше 6,13 (рис. 4). По сравнению с тестами на почве растений, зараженных RKN, выращенных в теплицах, самая высокая урожайность популяций нематод составила лишь половину от урожайности трансгенных корней на г корневого материала (неопубликованные данные). Тем не менее, известно, что рост популяции RKN в значительной степени зависит от вида и даже сорта растения-хозяина. Тем не менее, морфологически нематоды, выращенные в трансгенных корнях, не показывают существенных отличий от нематод, полученных от полевых или тепличных инфекций 6,13.
Применение кислотного фуксина полезно для отслеживания атак нематод на ткани корня. Известно, что подвижные стадии РЛН обнаруживаются внутри корней уже через 1 день после инокуляции5. Считается, что эта начальная стадия не зависит от восприимчивости хозяина. Однако после проникновения RLN либо остаются питаться клетками эпидермиса и коры корня, размножаются и вызывают образование некроза у восприимчивых растений, либо выходят из корней обратнов почву. За этими механизмами легко следовать окрашивание кислотным фуксином (рис. 5). Сокультуры волосатых корней картофеля с РКН представляют собой мощный лабораторный инструмент для анализа механизмов проникновения J2 и принятия решений при создании места кормления для оседлой взрослой самки. Можно проследить каждую стадию после заражения, включая формирование студенистого матрикса и высвобождение яйцеклеток (Рисунок 6).
Структура тканей может быть детализирована с помощью гистохимии и оптической микроскопии. Используя методы дифференциального окрашивания, можно проследить стадии жизненного цикла фитопаразита вместе с изменениями, индуцированными в окружающих тканях корня. Meloidogyne chitwoodi, как и другие галловые нематоды, способствуют образованию места питания, состоящего из определенного типа клеток, называемых гигантскими клетками. Эти многоядерные клетки индуцируются секрецией нематоды J2s и становятся метаболически сверхактивными, производя пищу для неподвижной взрослой самки (Рисунок 7). Последующее формирование этой специализированной структуры дает важную информацию о механизмах питания нематоды и позволяет определить конкретные шаги, которые могут быть направлены на нарушение ее жизненного цикла. Кроме того, структура кормового участка может быть специфичной для вида RKN, что способствует его идентификации.

(A) Диски корней моркови стерилизуются и заражаются Pratylenchus penetrans, вызывая (B) характерные некротические поражения (темные участки) из-за (C) роста популяции. Стержень = 1 см (А и В), 100 мкм (С). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Заражение корней Solanum tuberosum , выращенных в тепличных условиях. Контрольные растения картофеля (горшки сзади) и растения, зараженные корневой нематодой (горшки спереди), не проявляют видимых симптомов инфекции на побегах через 30 дней после заражения. Брусок = 10 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.

Рисунок 3: Развитие трансгенных корней Solanum tuberosum . (А) Малые клеточные массы роста начинают появляться вдоль области раны скальпеля на участке клубня картофеля (стрелка), (В) с последующим появлением первых трансгенных корней (правая вставка), (В) которые быстро растут и приживаются в питательной среде. (D) Комок корня может быть перенесен на тарелку со свежей питательной средой для непрерывного роста. Брусок = 1 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.

Рисунок 4: Сокультуры Solanum tuberosum с паразитической на растениях нематодой Meloidogyne chitwoodi. (A) Трансгенные корневые культуры картофеля in vitro могут быть инфицированы (B) асептической молодью второй стадии нематоды Columbia root knot (J2) для создания совместной культуры растения/нематоды. (C) Корневые галлы могут быть получены у взрослых самок, несущих яичные массы. Стержень = 1 см (А, В) и 200 мкм (С). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
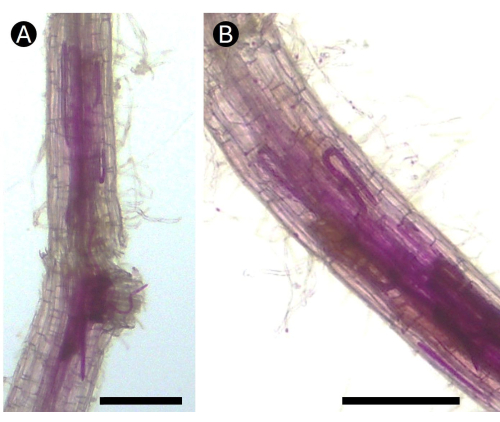
Рисунок 5: Окрашенные фуксином корни картофеля, зараженные корневой нематодой Pratylenchus penetrans в тепличных условиях. (А) Несколько жизненных стадий нематоды можно увидеть в области коры головного мозга (В) корня, вызывающих некротические поражения. Бар = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Кислотный фуксин окрашивает галлы корней трансгенных корней, инфицированных Meloidogyne chitwoodi. (A) Можно увидеть ткань желчного пузыря (B), охватывающую часть взрослой самки M. chitwoodi (C), которая уже произвела яйцевую массу (D) вместе с яйцами. Стержень = 500 мкм (А), 100 мкм (В, С) и 20 мкм (D). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 7: Клеточная структура трансгенного корневого галла, образованного Meloidogyne chitwoodi. (А) Ультратонкие срезы трансгенного корневого галла, окрашенные периодической кислотой-Шиффом (PAS) и толуидиновым синим О, показывающие место кормления взрослой самки, и (В) гигантские клетки, индуцированные нематодой, заключенные в ткань корневого галла. Бар = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Изучение механизмов инфекции и развития болезней у растений, пораженных почвенными ППН, затруднено, поскольку эти фитопаразиты обычно поражают внутренние ткани корневой системы и вызывают неспецифические симптомы у побегов. Несмотря на контролируемые условия окружающей среды в теплице, проращивание клубней картофеля и рост растений картофеля по-прежнему благоприятствуют весенним и летним месяцам, сокращая доступный экспериментальный период до одного сезона в году. Кроме того, в значительном количестве горшков не появляются растения картофеля. Жизненный цикл RLN относительно длинный, и требуется от 2 до 3 месяцев, чтобы достичь популяционных пиков, способных вызывать симптоматику заболевания. Основные недостатки использования тепличных биотестов для исследования ППН заключаются в том, что: а) тесты на теплицах часто демонстрируют высокую вариабельность, когда речь идет о восприимчивости к заболеваниям ППН; б) несмотря на то, что инфекции проводятся с чистыми популяциями ППН, существует риск неудачного приживания ППН и/или перекрестного заражения различными видами ППН; в) несмотря на то, что принимаются профилактические меры, всегда существует риск заражения микробными патогенами; и г) в зависимости от имеющихся средств и размера теплицы, количество повторов часто слишком мало для адекватной схемы выборки, для статистической достоверности.
Трансгенные корни картофеля являются универсальным лабораторным инструментом, не требующим больших площадей для содержания; может быть получен за меньшее количество времени; не подвержены загрязнению или генетической изменчивости хозяина; и, что более важно, позволяют контролировать отдельные переменные окружающей среды или питания, что гарантирует, что реакция корней является прямымрезультатом назначенного лечения. В исследованиях инфекции и развития PPN использование HRs является улучшением по сравнению с тепличными биопробами. Во-первых, нет необходимости в предварительном выращивании больших количеств PPN перед каждым экспериментом, так как сокультуры HR/PPN картофеля представляют собой непрерывную систему, обеспечивающую все стадии развития нематод независимо от времени года и климатических условий. Кроме того, генетическая изменчивость очень ограничена, поскольку HR являются клональной соматической тканью, поэтому изменения в ответе на PPN напрямую зависят от наложенных условий. Сокультуры HR/PPN картофеля занимают небольшое пространство; В камере для выращивания с регулируемой температурой может разместиться множество чашек Петри, поэтому эксперименты редко ограничиваются количеством повторяющихся чашек. Наконец, метод может быть расширен на другие картофельные PPN, например, Globodera spp., поскольку он в основном ограничен стадией стерилизации нематод, которая может стать сложной в зависимости от вида PPN и жизненной стадии, выбранной для обеззараживания 19,24. Несмотря на многочисленные преимущества, исследования с использованием кокультур ограничены исследованиями на тканевом уровне, например, ультраструктурной морфологии или механизмов биохимической регуляции, в условиях биотического или абиотического стресса 6,25, и недостаточны для исследований, требующих, например, определения урожайности клубней или фенотипа повреждений. Кроме того, взаимодействие растений и нематод в естественных условиях зависит от многих переменных, поэтому рекомендуется проявлять осторожность при прямых сравнениях с результатами, полученными в исследованиях с сокультурами.
Гистохимия сочетает гистологию с химическими аспектами, что позволяет определить природу веществ, присутствующих в тканях, и их местоположение21. Методы дифференциального окрашивания широко используются для различения специфических химических и морфологических изменений. Кислотный краситель фуксин окрашивает ткани нематоды, проникая в непроницаемую кутикулу во время стадии кипячения. В дальнейшем задержание корневой системы подкисленным глицерином позволяет выявить участки, где атакуют нематоды, так как они будут контрастировать с тканью корня. Однако, если хранить в подкисленном глицерине дольше 1-2 месяцев, интенсивность пятна уменьшится, а контраст между нематодами и корнями растений уменьшится.
Периодическая кислота-Шиффа (PAS) и толуидиновый синий O используются для метода двойного окрашивания, обычно используемого для окрашивания свежих тканей или тканей, залитых смолой. Это простая в применении методика, но с низкой специфичностью и чувствительностью. Последовательное нанесение двух красителей позволяет одновременно окрашивать несколько клеточных мишеней с различными химическими свойствами. Периодическая кислота с реагентом Шиффа окрашивает полисахариды розового оттенка, в основном крахмал, полисахариды клеточной стенки и некоторые фенолы, но не целлюлозу или каллозу. Толуидиновый синий краситель O подчеркивает окрашивание PAS и окрашивает клеточные стенки ксилемы и склеренхимы в зеленый или сине-зеленый цвет, клеточные стенки колленхимы и паренхимы в фиолетово-красный цвет, а стенки флоэмы и средние пластинки клеточных стенок в красный. Каллоза и крахмал не будут окрашиваться21.
Описанный протокол предлагает несколько перспективных будущих применений в растениеводстве, сельском хозяйстве и биотехнологии. Это позволяет детально изучить молекулярные и клеточные механизмы паразитизма, давая представление о том, как PPN заражают хозяев и манипулируют ими. Он поддерживает селекцию устойчивых культур, помогая скринингу сортов картофеля или трансгенных линий на устойчивость к PPN, а также идентификации ключевых генов, участвующих в резистентности или восприимчивости. Кроме того, кокультуры in vitro могут служить мощным инструментом для высокопроизводительного скрининга нематоцидов или агентов биологического контроля (например, микробов или натуральных продуктов), позволяя исследователям оценить их эффективность в борьбе с заболеваниями PPN.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Это исследование было частично профинансировано Fundação para a Ciência e a Tecnologia (FCT) через гранты NemACT, DOI: 10.54499/2022.00359.CEECIND/CP1737/CT0002 (JMSF), CEECIND/00040/2018, DOI: 10.54499/CEECIND/00040/2018/CP1560/CT0001 (CSLV) и SFRH/BD/134201/2017 (PB); проект PratyOmics, DOI: 10.54499/PTDC/ASP-PLA/0197/2020; и структурное финансирование UIDB/00329/2020 | cE3c (DOI: 10.54499/UIDB/00329/2020) + LA/P/0121/2020 |CHANGE (DOI: 10.54499/LA/P/0121/2020) и GreenIT (DOI: 10.54499/UIDB/04551/2020 и DOI: 10.54499/UIDP/04551/2020)..
Материалы
| Name | Company | Catalog Number | Comments |
| 2,4-Dinitrophenylhydrazine | Sigma-Aldrich | D199303 | |
| 2-Hydroxyethyl methacrylate | Sigma-Aldrich | 17348 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Acid Fuchsin | Sigma-Aldrich | F8129 | |
| Benzoyl peroxide | Sigma-Aldrich | B5907 | |
| borosilicate glass beaker | Sigma-Aldrich | Z231827 | |
| Carbenicillin disodium salt | Sigma-Aldrich | C3416 | |
| Cefotaxime sodium salt | Sigma-Aldrich | C7039 | |
| Dimethyl sulfoxide | Sigma-Aldrich | 472301 | |
| Ethanol | Supelco | 1.00983 | |
| Fertilizer | Compo Expert | ||
| Flower pot 5 L | VWR | 470049-676 | |
| Glutaraldehyde | Sigma-Aldrich | 354400 | |
| Glycerol | Sigma-Aldrich | G7893 | |
| Hydrochloric acid | Sigma-Aldrich | 258148 | |
| Kanamycin monosulfate | Sigma-Aldrich | BP861 | |
| LB Broth with agar | Sigma-Aldrich | L3147 | |
| MCE syringe filter | Millipore | SLGSR33SS | |
| PARAFILM M sealing film | BRAND | HS234526B-1EA | |
| Pararosaniline hydrochloride | Sigma-Aldrich | P3750 | |
| Periodic acid | Sigma-Aldrich | P0430 | |
| Phyto agar | Duchefa Biochemie | P1003 | |
| Scalpel blade no. 24 | Romed Holland | BLADE24 | |
| Schenk & Hildebrandt Basal salt medium | Duchefa Biochemie | S0225 | |
| Schenk & Hildebrandt vitamin mixture | Duchefa Biochemie | S0411 | |
| Schiff′s reagent | Sigma-Aldrich | 1.09033 | |
| Sodium metabisulfite | Sigma-Aldrich | 161519 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | Sigma-Aldrich | S5011 | |
| Soil / Substrate | Compo Sana | ||
| Stainless Steel Tweezers | Sigma-Aldrich | 22435-U | |
| Sucrose | Duchefa Biochemie | S0809 | |
| Toluidine Blue O | Sigma-Aldrich | 198161 |
Ссылки
- Çalışkan, M. E., Yousaf, M. F., Yavuz, C., Zia, M. A. B., Çalışkan, S. History, production, current trends, and future prospects. Potato Production Worldwide. , 1-18 (2022).
- Barker, K. R., Koenning, S. R. Developing sustainable systems for nematode management. Ann Rev Phytopathol. 36 (1), 165-205 (1998).
- Jones, J. T., et al. Top 10 plant-parasitic nematodes in molecular plant pathology. Mol Plant Pathol. 14 (9), 946-961 (2013).
- Davis, E. L., Hussey, R. S., Baum, T. J. Getting to the roots of parasitism by nematodes. Trend Parasitol. 20 (3), 134-141 (2004).
- Figueiredo, J., Vieira, P., Abrantes, I., Esteves, I. Commercial potato cultivars exhibit distinct susceptibility to the root lesion nematode Pratylenchus penetrans. Horticulturae. 8 (3), 244 (2022).
- Faria, J. M. S., et al. In vitro co-culture of Solanum tuberosum hairy roots with Meloidogyne chitwoodi: Structure, growth and production of volatiles. Plant Cell Tissue Organ Culture. 118 (3), 519-530 (2014).
- Wesemael, W. M. L., Moens, M., Viaene, N., Taning, L. M. Life cycle and damage of the root-knot nematode Meloidogyne minor on potato, Solanum tuberosum. Nematology. 16 (2), 185-192 (2014).
- Subramanian, P., et al. Differential metabolic profiles during the developmental stages of plant-parasitic nematode Meloidogyne incognita. Int J Mol Sci. 18 (7), 1351 (2017).
- Gutierrez-Valdes, N., et al. Hairy root cultures-A versatile tool with multiple applications. Front Plant Sci. 11, 33 (2020).
- Cho, H. J., Farrand, S. K., Noel, G. R., Widholm, J. M. High-efficiency induction of soybean hairy roots and propagation of the soybean cyst nematode. Planta. 210 (2), 195-204 (2000).
- Young, J. M., Kuykendall, L. D., Martínez-Romero, E., Kerr, A., Sawada, H., et al. A revision of Rhizobium Frank 1889, with an emended description of the genus, and the inclusion of all species of Agrobacterium Conn 1942 and Allorhizobium undicola de Lajudie et al. 1998 as new combinations: Rhizobium radiobacter, R. rhizogenes, R. rubi, R. undicola and R. vitis. Int J Syst Evol Microbiol. 51 (1), 89-103 (2001).
- Giri, A., Narasu, M. L. Transgenic hairy roots. Biotechnol Adv. 18 (1), 1-22 (2000).
- Faria, J. M. S., Rusinque, L., Cavaco, T., Nunes, J. C., Inácio, M. L. Essential oil volatiles as sustainable antagonists for the root-knot nematode Meloidogyne ethiopica. Sustainability. 15 (14), 11421 (2023).
- European Mediterranean Plant Protection Organization (EPPO). PM 7/148 (1) Guidelines for the management of nematode collections used for the production and maintenance of reference material. EPPO Bulletin. 51 (3), 507-548 (2021).
- Boisseau, M., Sarah, J. L. In vitro rearing of Pratylenchidae nematodes on carrot discs. Fruits. 63 (5), 307-310 (2008).
- Barbosa, P., et al. Nematicidal activity of phytochemicals against the root-lesion nematode Pratylenchus penetrans. Plants. 13 (5), 726 (2024).
- Santos, P. M., et al. Essential oils from hairy root cultures and from fruits and roots of Pimpinella anisum. Phytochemistry. 48 (3), 455-460 (1998).
- Bertani, G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. J Bacteriol. 62 (3), 293-300 (1951).
- Kumar, A., Forrest, J. M. Reproduction of Globodera rostochiensis on transformed roots of Solanum tuberosum cv. Desiree. J Nematol. 22 (3), 395-398 (1990).
- Schenk, R. U., Hildebrandt, A. C. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Canadian J Botany. 50 (1), 199-204 (1972).
- Figueiredo, A. C. S., Barroso, J. M. G., Pedro, L. M. G., Ascensão, L. . Histoquímica e citoquímica em plantas: princípios e protocolos. Universidade de Lisboa. , (2007).
- Bybd, D. W., Kirkpatrick, T., Barker, K. R. An improved technique for clearing and staining plant tissues for detection of nematodes. J Nematol. 15 (1), 142-143 (1983).
- Coyne, D., Adewuyi, O., Mbiru, E. . Protocol for in vitro culturing of lesion nematodes: Radopholus similis and Pratylenchus spp. on carrot disc. , (2014).
- Faria, J. M. S., Vicente, C. S. L., Rusinque, L., Camacho, M. J., Inácio, M. L. Plant-Nematode co-cultures in the screening of sustainable nematicides against soil-dweling parasitic nematodes of plants. Revista de Ciências Agrárias. 45 (4), 436-439 (2022).
- Faria, J. M. S., et al. In vitro co-cultures of Pinus pinaster with Bursaphelenchus xylophilus: a biotechnological approach to study pine wilt disease. Planta. 241 (6), 1325-1336 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены