Method Article
Infezione in vivo e in vitro delle radici della patata con nematodi parassiti delle piante per la valutazione dei cambiamenti strutturali indotti
In questo articolo
Riepilogo
Il protocollo descrive l'infezione delle radici di Solanum tuberosum con nematodi parassiti delle piante in condizioni di serra in vivo e radici transgeniche in vitro di patate per l'analisi istochimica della struttura radicale attraverso la microscopia ottica.
Abstract
I nematodi parassiti delle piante che vivono nel suolo (PPN) sono importanti parassiti della patata che causano lesioni e/o modificano la struttura delle radici delle piante, portando a una riduzione della fitness e della produttività delle colture. La ricerca sui meccanismi cellulari e subcellulari dell'infezione e dello sviluppo delle PPN può ricorrere a piante da campo o piantine in condizioni di serra. Gli studi sul campo sono più rappresentativi degli ambienti naturali, ma sono soggetti all'imprevedibilità delle condizioni ambientali che possono influenzare pesantemente i risultati della ricerca. Gli studi in serra consentono un maggiore controllo sulle variabili ambientali e una maggiore sicurezza contro contaminanti o agenti patogeni. Tuttavia, in alcuni ospiti, la diversità genetica diventa un importante fattore di variabilità e influenza la risposta complessa ospite-parassita. Abbiamo sviluppato co-colture in vitro di radici transgeniche con PPN come alternativa affidabile che occupa meno spazio, richiede meno tempo per essere ottenuta ed è esente da contaminazione o variabilità genetica dell'ospite. Le co-colture sono ottenute introducendo PPN asettiche per ospitare radici transgeniche in vitro . Possono essere mantenuti a tempo indeterminato, il che li rende un ottimo supporto per la conservazione di raccolte di PPN di riferimento. Nel presente lavoro, viene descritto un protocollo per l'infezione controllata delle radici della patata in vivo con il nematode della lesione radicale e per stabilire co-colture in vitro di radici transgeniche della patata con il nematode del nodo radicale. Le co-colture in vitro hanno fornito un proxy di laboratorio per la condizione naturale di infezione da patata e hanno prodotto fasi di vita dei nematodi indipendentemente dalla stagione o dalle condizioni climatiche. Inoltre, la metodologia utilizzata per l'analisi strutturale è dettagliata utilizzando l'istochimica e la microscopia ottica. Il colorante acido fucsina viene utilizzato per seguire i siti di attacco dei nematodi sulle radici, mentre la colorazione differenziale con acido periodico di Schiff (PAS) e blu di toluidina O evidenzia le strutture dei nematodi nel tessuto radicale interno della patata.
Introduzione
Le colture di radici e tuberi sono al 4° posto tra gli alimenti di base più importanti al mondo. La patata (Solanum tuberosum L.) è uno dei tuberi più importanti coltivati. Ha avuto la sua origine nelle Ande del Sud America, ma dopo essere stato introdotto in Europa nelXVI secolo è diventato rapidamente la fonte di cibo più comune per la popolazione con un reddito più basso. Oggi, le patate rappresentano l'1,7% dell'apporto calorico mondiale1. La produzione agricola è fortemente influenzata da parassiti e agenti patogeni delle piante, di cui i nematodi parassiti delle piante (PPN) possono causare perdite di resa medie che aumentano fino al 12%2. I nematodi parassiti delle piante sono responsabili di alcune delle malattie più dannose per le colture nell'agricoltura moderna. I PPN che vivono nel suolo impongono pesanti perdite agli agricoltori perché influenzano le radici delle piante e interferiscono con la produttività delle colture riducendo la produzione e/o danneggiando i prodotti, rendendoli non commerciabili3. Questi pericolosi fitoparassiti usano il loro stiletto (un apparato boccale aghiforme) per perforare le cellule radicali e nutrirsi del contenuto cellulare. Alcuni PPN si nutrono dall'esterno delle radici, altri entrano nella radice e causano danni ai tessuti (migratori), mentre altri entrano nelle radici e diventano sedentari, modificando pesantemente la struttura delle radici per facilitare l'alimentazione4. I principali PPN che colpiscono la patata sono i nematodi a cisti della patata, Globodera spp., i nematodi del nodo radicale (RKN), Meloidogyne spp., i nematodi delle lesioni radicali, Pratylenchus spp., il falso nematode del nodo radicale Nacobbus aberrans e il nematode del marciume della patata Ditylenchus destructor. Per questi PPN, diverse abitudini alimentari inducono diversi cambiamenti strutturali nei tessuti radicali dell'ospite 5,6. La ricerca sui meccanismi dell'infezione da PPN e della risposta dell'ospite viene spesso eseguita attraverso prove sul campo o in serra per mantenere collezioni di colture PPN di riferimento o per eseguire esperimenti su larga scala 7,8. I test in condizioni naturali sono fortemente influenzati dalle variazioni ambientali e dai fattori di stress biotici o abiotici. I biosaggi in serra sono un'alternativa più vicina a una condizione naturale, consentendo un controllo relativo della variazione ambientale e limitando l'influenza dello stress abiotico e biotico. Tuttavia, la diversità genetica dell'ospite può ancora rappresentare una sfida per gli studi che richiedono un controllo più preciso della variabilità biologica. Questi limiti possono essere superati ricorrendo a colture di tessuti vegetali in vitro. Si tratta di sistemi di laboratorio versatili con molti vantaggi per la ricerca sulla malattia PPN. Per le PPN che vivono nel suolo, le colture in vitro di radici transgeniche sono uno strumento utile per la ricerca in condizioni di laboratorio 9,10.
Le radici transgeniche, o radici pelose (HR), si ottengono dopo l'infezione di materiale vegetale con Rhizobium rhizogenes (Riker et al. 1930) Young et al. 200111. Questo batterio gram-negativo induce la trasfezione del suo plasmide Ri nel genoma ospite e modifica la regolazione della biosintesi degli ormoni vegetali, promuovendo la formazione del tessuto radicale12. Le radici transgeniche possono essere mantenute indefinitamente in asepsi in un terreno di coltura. I vantaggi dell'utilizzo dell'HR per lo studio delle PPN sono un alto tasso di crescita in assenza di regolatori della crescita delle piante che influenzano l'infezione e lo sviluppo dei nematodi, un alto rapporto di produzione di biomassa per unità di tempo e l'integrità e la longevità cellulare, che determinano una maggiore stabilità genetica e biochimica6. Ricorrendo a radici transgeniche in vitro, i genotipi di PPN possono essere mantenuti indefinitamente in condizioni di laboratorio, l'infezione e lo sviluppo di PPN possono essere facilmente seguiti, la variabilità genetica dell'ospite può essere ridotta, la manipolazione della composizione molecolare dell'ospite può essere direttamente collegata alla risposta dei nematodi e i cambiamenti strutturali dell'ospite e del parassita possono essere seguiti in modo più accurato 6,13. Per gli studi sulle malattie PPN della patata, le cocolture di radici transgeniche in vitro consentono di condurre esperimenti indipendentemente dalla stagione o dalla dormienza del tubero di patata.
In questo protocollo, viene dettagliata la metodologia tradizionale del mantenimento delle PPN e dell'infezione in vivo delle piante di patata. Per l'analisi strutturale delle radici infette, viene anche descritta una metodologia migliorata basata sulla creazione di co-colture in vitro di radici transgeniche di patata con PPN come alternativa che consente un maggiore controllo della variabilità genetica ambientale e dell'ospite. Per seguire l'infezione e lo sviluppo delle PPN nel tessuto radicolare, viene impiegata l'istochimica per aiutare nell'osservazione delle PPN al microscopio ottico. L'obiettivo generale di questo protocollo è quello di ottimizzare lo studio delle interazioni PPN-ospite, garantendo condizioni più controllate e riproducibili per la sperimentazione e facilitando analisi strutturali e di sviluppo dettagliate dei nematodi nel tessuto radicale.
Protocollo
1. Infezione delle piante di patate coltivate in serra
NOTA: Le prove in serra vengono eseguite con sospensioni di PPN in fasi di vita miste o giovani al secondo stadio (J2), a seconda del ciclo di vita specifico del parassita PPN. Per questo protocollo, sono state utilizzate sospensioni di stadi di vita misti del nematode della lesione radicolare (RLN) Pratylenchus penetrans . I PPN possono essere allevati in laboratorio o richiesti a laboratori di riferimento certificati.
- Moltiplicazione e mantenimento dei nematodi radicolari
NOTA: I dischi di carote sterilizzati vengono utilizzati per la moltiplicazione e il mantenimento degli RLN14. Utilizzare carote acquistate in commercio (var. Nice) senza danni visibili per ridurre la contaminazione microbica. Preferibilmente, dovrebbero essere privi di pesticidi per evitare di ostacolare lo sviluppo di RLN.- Lavare la carota in acqua corrente del rubinetto per rimuovere i detriti più grandi e, successivamente, con una soluzione detergente comune (1 goccia per 40 ml di acqua) per rimuovere i detriti più fini. Asciugare con carta assorbente da laboratorio.
- In caso di asepsi, in una cappa a flusso verticale, inserire uno spiedino di metallo sterilizzato sulla parte superiore della carota (da 1 a 2 cm verso l'interno) in modo che possa essere tenuta più facilmente.
- Con l'aiuto di un flacone di lavaggio con ugello, bagnare la carota con etanolo al 96% (v/v). Tamponare la punta inferiore della carota in una carta da filtro sterilizzata e portarla con cura sul fuoco.
ATTENZIONE: Tieni presente che l'etanolo si accende fortemente, quindi stai a distanza. - Sbucciare la carota dall'alto verso il basso utilizzando un pelapatate sterile e poi ripetere il passaggio precedente. Scartare la parte superiore e quella inferiore (2 cm verso l'interno) e mettere la parte centrale della carota in una capsula di Petri sterile (150 mm di diametro). Utilizzando una lama sterile e una pinzetta, tagliare con cura sezioni spesse 1 cm dalla parte della carota di circa 2 cm di diametro (Figura 1).
- Trasferire le sezioni in piastre di Petri sterili (diametro 60 mm) e sigillare il bordo con pellicola trasparente. Usando una luce UV, sterilizzare la superficie dei dischi di carota per 60 minuti su ciascun lato.
- Conservare a 25 °C per 1-2 settimane al buio e scartare i dischi di carota che iniziano a mostrare segni di contaminazione microbica15.
NOTA: I segni visibili di contaminazione sono l'eccessivo imbrunimento (marciume), l'accumulo di liquidi nel bordo inferiore del disco di carota o la crescita di micelio fungino sulla superficie. - I dischi di carota rimanenti sono pronti per essere infettati con sospensioni RLN. Inizia praticando un'incisione a forma di X al centro del disco di carota usando una lama sterile. Assicurati di tagliare solo a metà profondità.
- Inoculare l'RLN pipettando 50 μl di una sospensione contenente almeno 50 fasi di vita miste al centro della ferita a forma di X. Chiudere la capsula di Petri e sigillare il bordo con pellicola trasparente per evitare l'essiccazione.
- Determinare il numero medio di nematodi nella sospensione contando cinque aliquote da 50 μl sotto uno stereomicroscopio binoculare (40x) a temperatura ambiente in un vetrino concavo. Impostare la sospensione di RLN misti in fase di vita a 1000 per mL aggiungendo acqua alla sospensione o attendendo che i nematodi si stabilizzino (circa 60 minuti) e abbassando il volume travasando l'acqua superficiale.
- Conservare i dischi di carota a 25 °C, al buio, per un massimo di 3 mesi e seguirli settimanalmente sotto uno stereomicroscopio binoculare per segni di lesioni necrotiche, risultanti dalla crescita della popolazione di RLN.
NOTA: I dischi di carote parassitati con successo possono essere conservati a 11 °C per un uso successivo fino a 2 mesi, ma controllano regolarmente la presenza di contaminazioni microbiche. I dischi di carota parassitati che mostrano segni di infezione microbica devono essere decontaminati in autoclave prima di essere smaltiti. - Sotto la cappa di flusso, estrarre gli RLN trasferendo i dischi di carota con necrosi tissutale visibile nel sito di inoculazione (Figura 1) in un setaccio a maglie di 8 cm di diametro e 75 μm in una ciotola di vetro sterile. Lasciare un piccolo spazio di 1 cm tra il fondo del setaccio e la concavità della ciotola per raccogliere gli RLN.
NOTA: In mancanza di un setaccio acquistato in commercio, uno può essere realizzato con un tubo di plastica di 8 cm di diametro/un robusto bicchiere di plastica e una garza a maglie strette. Usa degli elastici per fissare la garza al tubo di plastica o alla tazza. - Versare una soluzione antibiotica nel setaccio fino a coprire i dischi di carota e tenere per 12 ore (tutta la notte) al buio. Gli RLN fuoriescono dai dischi di carota e si depositano sul fondo della ciotola. La soluzione antibiotica deve essere preparata estemporaneamente con l'estrazione aggiungendo 50 μg/mL ciascuno di kanamicina e carbenicillina in acqua distillata sterilizzata16.
NOTA: Le soluzioni madre antibiotiche vengono preparate a 50 mg/mL sciogliendo 0,5 g di kanamicina monosolfato o 0,5 g di carbenicillina disodica ciascuno in 10 mL di acqua distillata sterilizzata. Le soluzioni madre vengono filtrate (maglia da 0,22 μm) nella cappa di flusso e possono essere conservate a -20 °C per un massimo di 1 anno. - Rimuovere il setaccio, utilizzare una pipetta di vetro sterilizzata per aspirare gli RLN dal fondo della ciotola in un blocco di colorazione di vetro sterilizzato (4 cm x 4 cm x 1 cm) e lavare pipettando 1 ml di soluzione antibiotica. Attendere da 30 a 40 minuti affinché i nematodi si stabilizzino prima di raccogliere la soluzione antibiotica usata. Ripetere questo lavaggio 4x-5x.
- Utilizzare immediatamente la sospensione acquosa con gli RLN o mantenerla a 11 °C per un periodo di conservazione più lungo (fino a 2 mesi).
- Infezione in vivo di piante di patata con PPN
NOTA: Per coltivare piante di patate sensibili (S. tuberosum var. Désirée), le patate da semina certificate devono essere acquistate dai rivenditori agricoli tra gennaio e marzo. Scegli patate da semina certificate perché vengono vendute con un passaporto fitosanitario, assicurandoti che non siano contaminate da fitoparassiti da quarantena. Per precauzione, è possibile eseguire una fase iniziale di disinfezione con una soluzione di candeggina al 10% seguita dal lavaggio in acqua corrente del rubinetto per garantire la disinfezione della superficie del tubero di patata. Le patate comunemente commercializzate non sono raccomandate poiché i trattamenti imposti per ridurre la germinazione e il vigore possono interferire con la crescita delle patate e la risposta alle infezioni.- Seleziona tuberi di patata della stessa dimensione e scarta quelli con buchi, lividi o sezioni più morbide. Rimuovere delicatamente tutti i germogli cresciuti (1 mm) prima della semina per sincronizzare la germinazione.
NOTA: Se necessario, conservare i tuberi-seme di patate in un luogo ben ventilato, asciutto e buio prima della semina. - Riempi vasi da 5 L (22 cm x 18 cm) con una miscela 1:1 di terriccio autoclavato e sabbia grossolana fine mescolata con 22,5 g di fertilizzante NPK a lenta cessione (12-12-12) e semina le patate a 9 cm sotto la superficie del terreno.
NOTA: Il terreno e la sabbia devono essere setacciati per rimuovere i detriti di dimensioni superiori a 2 mm, sterilizzati in autoclave 2 volte a 121 °C per 15 minuti ed essiccati a 100 °C per 1 o 2 giorni, mescolando frequentemente. Aerare i successivi 7-10 giorni mescolando frequentemente, prima dell'uso. - Tenete i vasi in una serra in condizioni di umidità (50%-70% di umidità) e annaffiate frequentemente (mantenete il terreno al 70% della capacità massima di ritenzione idrica), evitando temperature estreme, fino a quando i germogli delle piante di patata iniziano a emergere sulla superficie del suolo.
- Dopo l'emergenza delle piante, utilizzare sospensioni RLN appena estratte per infettare le radici della patata. Inizia creando da 4 a 6 fori distribuiti uniformemente (1 cm di larghezza) attorno alla pianta fino alla profondità del seme.
- Pipettare uniformemente una sospensione di 8 ml di 30.000 RLN vivi in fase di vita mista nei fori, in modo che l'inoculo abbia un rapporto di 4 RLN vivi per g di miscela di terreno e coprire con una miscela di terreno. Per i vasi con RLN, sospendere l'irrigazione il giorno dell'inoculazione.
NOTA: Gli RLN vengono contati al microscopio stereomicroscopio (40x). I nematodi morti non sono mobili e hanno una forma estesa, mentre i nematodi vivi sono generalmente in movimento (forma non estesa). Il pungolo fisico viene utilizzato per accertare la mortalità. - Conservare i vasi per 2 mesi nelle condizioni sopra descritte (Figura 2). Successivamente, sradica le piante di patate e pesa separatamente i germogli e le radici.
- Lavare accuratamente l'apparato radicale prima di controllare la posizione dei siti di attacco RLN attraverso tecniche di colorazione5.
- Seleziona tuberi di patata della stessa dimensione e scarta quelli con buchi, lividi o sezioni più morbide. Rimuovere delicatamente tutti i germogli cresciuti (1 mm) prima della semina per sincronizzare la germinazione.
2. Costituzione di co-colture in vitro di radici transgeniche di patata con PPN
- Stabilire in vitro radici transgeniche di patate
NOTA: Per questo protocollo, abbiamo utilizzato Rhizobium rhizogenes portando il gus gene reporter co-integrato nel plasmide Ri e guidato da un doppio promotore 35S (A4pRiA4::70GUS)17. I batteri possono essere acquisiti da fonti commerciali o richiesti a laboratori di riferimento certificati.- Per ottenere batteri nella fase di crescita esponenziale, stendere la piastra R. rhizogenes in una piastra media solida Luria-Bertani (LB)18 e conservare per una notte a 26 °C.
NOTA: Il terreno LB può essere acquistato commercialmente o preparato in laboratorio aggiungendo 10 g/L di peptone, 5 g/L di estratto di lievito, 10 g/L di NaCl e 15 g/L di agar e quindi sterilizzando a vapore per 15 minuti a 121 °C. - Con un ciclo di inoculazione, prelevare una colonia e inoculare 10 ml di brodo LB liquido (terreno LB senza agar) in un pallone sterile da 50 ml. Conservare per una notte al buio a 26 °C sotto agitazione (180 giri/min).
- Misurare l'assorbanza della coltura liquida fino a quando A600 raggiunge 0,6. In questa fase, i batteri sono nella fase di crescita esponenziale e vengono utilizzati per inoculare il materiale vegetale.
- L'inoculazione viene eseguita in tuberi di patata fresca asettica. Per sterilizzare la superficie dei tuberi di patata, iniziare lavandoli in acqua corrente del rubinetto per rimuovere i detriti più grandi, e poi con una soluzione detergente comune (1 goccia per 40 ml di acqua), con una vigorosa agitazione, per rimuovere i detriti più fini.
NOTA: Selezionare una varietà di patate con nota suscettibilità ai PPN in uso. Per questo protocollo, abbiamo utilizzato S. tuberosum var. - Mettere i tuberi in un contenitore, coprire con una soluzione di candeggina commerciale (1:4, candeggina commerciale in acqua di rubinetto) e chiudere. Mescolare per 15 minuti, smaltire la soluzione di candeggina e risciacquare 3 volte con acqua di rubinetto sterilizzata.
- In una cappa a flusso, immergere i tuberi in una soluzione di etanolo (80%, v/v) per 15 minuti agitando energicamente, smaltire l'etanolo e sciacquare 3 volte con acqua di rubinetto sterilizzata.
- Utilizzando un bisturi sterile, rimuovere le porzioni periferiche dei tuberi (circa il 50% del tubero dalla superficie verso l'interno) e sezionare il pezzo centrale interno in segmenti spessi 0,5 cm19. Inoculare immediatamente con la sospensione batterica preparata al punto 2.1.3.
- Per l'inoculazione, diluire la sospensione batterica aggiungendo 1 mL di sospensione batterica a 9 mL di terreno Schenk e Hildebrandt20 (SH) integrato con 30 g/L di saccarosio a pH = 5,6. Immergere la punta di un bisturi sterile nella sospensione diluita e avvolgere la superficie del segmento di patata. Ripeti questo passaggio 5 volte per ogni segmento di patate.
- Asciugare i segmenti di umidità in eccesso in carta da filtro sterile per 1 minuto, metterli in un terreno SH semisolido (terreno SH con 30 g/L di saccarosio, 8 g/L di agar, pH = 5,6) e tenerli al buio a 25 °C per consentire la trasfezione plasmidica.
- Dopo 3 giorni, trasferire i segmenti infetti in piastre di terreno SH semisolido integrate con 150 μg/mL di cefotaxima e carbenicillina dell'antibiotico. Conservare per oltre 3 mesi con rinnovo medio settimanale per garantire l'eliminazione dei batteri.
NOTA: La soluzione madre di cefotaxima può essere preparata a 100 mg/mL sciogliendo 1 g di cefotaxima sodico in 10 mL di acqua demineralizzata sterile e filtrando (maglia da 0,22 μm) sotto la cappa di flusso. Gli antibiotici possono essere mantenuti a -20 °C per un massimo di 1 anno. - Dopo 3 mesi, la crescita delle radici transgeniche è estesa. Trasferire le radici in un terreno SH fresco e semisolido senza antibiotici raccogliendo un ciuffo di radice da 1 g con la punta di una pinzetta sterile e posizionandolo al centro del terreno di coltura in una nuova piastra (Figura 3).
NOTA: Circa 1 mese dopo l'infezione, piccole masse di crescita cellulare compaiono sulla superficie del segmento della patata, da dove iniziano a svilupparsi le radici transgeniche6. Assicurati di tenerli a contatto con il terreno di coltura, altrimenti potrebbero seccarsi. - Per garantire la stabilità genetica e metabolica, mantenere le radici transgeniche sotto una routine di sottocoltura mensile (come descritto al passaggio 2.1.11.) a 25 °C al buio per oltre 1 anno prima di infettare con PPN.
NOTA: Assicurarsi che siano conservate almeno sei repliche in ogni fase del protocollo, poiché spesso si verifica una contaminazione microbica indesiderata. Una volta stabilita, una singola piastra di co-coltura può essere utilizzata come inoculo per diverse nuove co-colture; Tuttavia, assicurati di conservare almeno sei piastre replicate.
- Per ottenere batteri nella fase di crescita esponenziale, stendere la piastra R. rhizogenes in una piastra media solida Luria-Bertani (LB)18 e conservare per una notte a 26 °C.
- Stabilire co-colture in vitro di radici transgeniche di patata con PPN
NOTA: Per ottenere co-colture di radici transgeniche con PPN, il processo di sterilizzazione dei nematodi è fondamentale. Per il presente protocollo sono stati utilizzati giovani di secondo stadio del nematode da quarantena Meloidogyne chitwoodi. L'inoculo di nematodi può essere ottenuto da laboratori di riferimento certificati sotto forma di galle radicali.- Con uno stereomicroscopio binoculare (20x), isolare le masse di uova di nematodi dalle galle delle radici con una pinzetta sterile a punta ultrafine. Mettere le masse di uova in una capsula di Petri coperta con 5 ml di acqua di rubinetto sterile e lasciare schiudere le uova per 48 ore. Impostare la sospensione J2 su 100 nematodi per mL.
- In una cappa di flusso, pipettare 5 mL di una sospensione contenente 500 J2 in un setaccio sterile a rete sterile da 20 μm e lavare con acqua di rubinetto sterile.
- Immergere la metà inferiore del setaccio contenente i J2s in una soluzione di perossido di idrogeno al 20 % (H2O2) e mescolare manualmente con movimenti circolari per 15 minuti.
- Lavare i J2 sterili erogando acqua di rubinetto sterile attraverso il setaccio. Ripeti questo passaggio 3 volte. Nel lavaggio finale, inclinare il setaccio in modo che i nematodi si raccolgano sul bordo del setaccio. Recuperare la sospensione sterile di nematodi pipettando 1 mL di acqua ultrapura sterile nel bordo del setaccio e conservarla a 11 °C o utilizzarla immediatamente.
NOTA: Il successo della sterilizzazione può essere valutato piastrando un'aliquota di 100 μl della sospensione di nematode in terreno SH e monitorando regolarmente, per 1 settimana, la presenza di contaminazione. - Nella cappa di flusso, sottocoltivare un ciuffo di 1 g di radici transgeniche di patata (come descritto al punto 2.1.11.) su piastre SH con 100 nematodi sterili (100 μL di una sospensione con 1000 J2s per mL). Dopo 2 o 3 settimane, piccole galle iniziano a comparire nelle nuove radici.
- Seguire regolarmente la co-coltura al microscopio invertito (100x) e, quando le masse di uova iniziano a essere evidenti, passare a una nuova piastra media SH semisolida, assicurandosi che le galle vengano prelevate con il grumo di radice (Figura 4). Mantieni le co-colture sotto una routine mensile di sotto-coltura a 25 °C al buio.
3. Analisi strutturale dell'infezione da PPNs
NOTA: Per seguire i cambiamenti indotti dalle PPN nella struttura del tessuto radicolare, vengono utilizzate tecniche di colorazione istochimica per contrastare tessuti con diverse composizioni chimiche. La colorazione differenziale viene eseguita in masse radicali o in sezioni sottili di materiale radicolare fisso, dove coloranti specifici reagiscono con il tessuto bersaglio in base alla loro affinità chimica21. Per il presente protocollo, abbiamo utilizzato la fucsina acida, o reagente periodico acido-Schiff (PAS) combinato con coloranti blu di toluidina O per la colorazione differenziale.
- Distribuzione dei nematodi parassiti delle piante nelle radici colorate con fucsina acida
NOTA: Per seguire la distribuzione dei PPN in tutto il sistema radicale, la fucsina acida viene utilizzata per colorare il tessuto muscolare del nematode in una tonalità rossa5.- Iniziare lavando l'apparato radicale sotto l'acqua corrente del rubinetto per 5 minuti per rimuovere eventuali detriti di terreno (radici di piante in vivo ) o residui del terreno di coltura (radici transgeniche in vitro ). Usa le dita con un movimento circolare per aiutare a staccare il terreno dal sistema radicale.
- Tagliare l'apparato radicale in sezioni lunghe da 1 a 2 cm e posizionarlo all'interno di un becher da 150 ml. Erogare 70 ml di una soluzione di ipoclorito di sodio (NaOCl) all'1,5% e mescolare energicamente per 4 minuti per liberare i tessuti radicolari. Successivamente, smaltire la soluzione di NaOCl, sciacquare le radici in acqua corrente del rubinetto e immergerle per 15 minuti in acqua demineralizzata per rimuovere il residuo di NaOCl22.
NOTA: La candeggina al cloro contiene almeno il 5,25% di NaOCl, quindi aggiungere 20 ml di candeggina al cloro a 50 ml di acqua per ottenere una soluzione di NaOCl all'1,5%. Per i materiali più morbidi (ad esempio, tessuti più morbidi di radici giovani o di radici transgeniche cresciute in vitro ) utilizzare una soluzione di NaOCl allo 0,9%, mentre per i materiali più duri (radici lignificate più vecchie) viene utilizzata una soluzione di NaOCl al 2,0%. - Scolare le radici pulite e adagiarle su un becher di vetro borosilicato con 30 ml di acqua demineralizzata. Pipettare 1 mL di soluzione di colorante acido fucsina, mescolare manualmente e far bollire per 30 s su una piastra calda. Lasciare raffreddare il bicchiere di vetro, scolare la soluzione e lavare le radici macchiate in acqua corrente del rubinetto.
NOTA: La soluzione di colorante acido fucsina si ottiene sciogliendo 3,5 g di polvere di colorante acido fucsina in 250 ml di acido acetico e aggiungendo 750 ml di acqua demineralizzata. La colorazione è sempre seguita da una fase di decolorazione per rimuovere le macchie in eccesso inutilizzate e migliorare il contrasto del campione. - Decolorare aggiungendo 10-30 mL di glicerina acidificata con qualche goccia di HCl (5N)13.
- Osservare sotto lo stereomicroscopio o il microscopio invertito per valutare approssimativamente dove nella struttura della radice le PPN stanno attaccando preferenzialmente (Figura 5 e Figura 6).
- Valutazione della morfologia delle cellule radicali con acido periodico di Schiff (PAS)/blu di toluidina O
NOTA: L'influenza dell'infezione da PPN o del danno alla morfologia delle cellule radicali può essere valutata al microscopio fissando, sezionando e colorando in modo differenziale le radici di patata infette.- In una fiala di campione chiusa, fissare il materiale radicale fresco con glutaraldeide al 2,5%, preparato in tampone fosfato di sodio 0,1 M, a pH 7,2, per 24-48 ore, a temperatura ambiente6.
ATTENZIONE: La glutaraldeide è tossica. Evitare l'inalazione e il contatto. Utilizzare camice e guanti protettivi da laboratorio e lavorare in una cappa aspirante. Le fiale dei campioni devono essere chiuse a meno che non siano in risciacquo o sotto vuoto. Smaltire la glutaraldeide seguendo le regole delle procedure per i rifiuti pericolosi. Le fasi da 3.2.1 a 3.2.5 vengono eseguite in una cappa aspirante per evitare l'inalazione dei reagenti.
NOTA: Per preparare 1 L di tampone fosfato di sodio, pH 7,2, aggiungere 68,4 mL di 1M Na2HPO4 (141,96 g in 1 L di soluzione) a 31,6 mL di 1M NaH2PO4 (119,98 g in 1 L di soluzione) e riempire fino a 1 L aggiungendo 900 mL di acqua demineralizzata. Per facilitare l'infiltrazione del fissativo, posizionare le fiale di campionamento non tappate con materiale radicolare sotto un basso vuoto (26 mm Hg) per 2 minuti in un essiccatore collegato a una pompa a vuoto. - Con una pipetta di vetro Pasteur, scartare la soluzione fissativa e lavare le radici fissate con tampone fosfato di sodio (3x).
- Iniziare a disidratare gradualmente il tessuto radicolare fissato sostituendo il tampone con una soluzione di etanolo al 10% (v/v) per 15 minuti. Successivamente, scambiare con una soluzione di etanolo al 20% utilizzando una pipetta di vetro e mantenere le radici incorporate per 15 minuti. Continuare con la successione graduale di concentrazioni crescenti di etanolo (30%, 40%, 50%, 60%, 70%, 80% e 90% per 15 minuti ciascuna) fino alla fase di etanolo puro, dove le radici devono essere conservate per 1 ora.
- Incorporare gradualmente le radici disidratate nella resina (2-idrossietilmetacrilato). Con una pipetta di vetro, sostituire l'etanolo puro con una soluzione di etanolo/resina 3:1 (v/v) e conservare per 24 ore a 4 °C. Seguire con soluzioni di etanolo/resina 1:1 e 1:3 (v/v), ciascuna con un periodo di incubazione di 24 ore a 4 °C. Successivamente, sostituire la soluzione 1:3 (v/v) con resina pura integrata con perossido di dibenzoile (1%) come iniziatore della polimerizzazione.
- Posizionare i campioni in uno stampo in resina, aggiungere una miscela di resina:dimetilsolfossido 15:1 (v/v) e mantenere a 60 °C su una piastra calda per 48 ore affinché la resina si indurisca.
- Posizionare i campioni impregnati in un microtomo rotante dotato di un coltello in tungsteno e tagliare sezioni di 2-5 μm su vetrini, secondo le istruzioni del produttore.
- Iniziare la colorazione differenziale immergendo i vetrini per 10 minuti in un barattolo di vetro con una soluzione di 2,4-dinitrofenilidrazina al 15% in acido acetico, a temperatura ambiente. Successivamente lavare accuratamente sotto l'acqua corrente del rubinetto per 15 minuti e asciugare in forno a 60 °C (15 min).
- Successivamente, immergere i vetrini in acido periodico (1%) per 10 min, quindi lavarli sotto l'acqua corrente del rubinetto per 5 min e lasciare asciugare in forno a 60 °C (15 min).
- Immergere i vetrini nel Reagente di Schiff (composto da pararosanilina all'1% e metabisolfito di sodio al 4%, in acido cloridrico 0,25 M), per 30 min. Successivamente, lavare con una soluzione di metabisolfito di sodio (0,5%) in acido cloridrico (0,05 M), per 2 minuti. Ripetere 3 volte. Infine lavare in acqua corrente per 5 minuti e asciugare a temperatura ambiente.
- Per contrasto, colorare immergendo i vetrini in blu di toluidina O allo 0,05% per 15 minuti, lavandoli in acqua corrente del rubinetto per 15 minuti e asciugandoli in forno a 60 °C (15 minuti).
- Osservare al microscopio (100x) dotato di hardware per l'acquisizione delle immagini (Figura 7).
- In una fiala di campione chiusa, fissare il materiale radicale fresco con glutaraldeide al 2,5%, preparato in tampone fosfato di sodio 0,1 M, a pH 7,2, per 24-48 ore, a temperatura ambiente6.
Risultati
I dischi di carota possono essere utilizzati per moltiplicare e mantenere diversi tipi di PPN migratori23. Per l'RLN, questa tecnica viene generalmente utilizzata per mantenere collezioni di riferimento di specie di nematodi o isolati. Utilizzando i dischi di carota, è possibile ottenere un aumento medio di 100 volte delle popolazioni di nematodi in un periodo di 3 mesi (Figura 1). Tuttavia, il numero di nematodi varia notevolmente (tra 30 e 200 volte), principalmente a causa della diversità genetica dei nematodi e/o della variazione del contenuto nutrizionale delle carote. Inoltre, nonostante le diverse misure di prevenzione utilizzate per ridurre la contaminazione microbica, dal 20% al 30% dei dischi di carota può contaminare, quindi assicurati di preparare più piatti del necessario.
Nelle piante di patata, la presenza di RLN non sempre induce sintomi visibili poiché dipendono fortemente dal numero di popolazioni di parassiti che attaccano l'apparato radicale (Figura 2). Per P. penetrans, un inoculo iniziale di 4 RLN/g di terreno può accumulare fino a 2000 RLN/g di radice e 750 uova/g di radice dopo 2 mesi, inducendo una diminuzione di quasi il 30% del peso radicale5.
Le colture di radici pelose di patata sono un sistema ad alto rendimento per lo studio delle malattie legate alle radici in un contesto di laboratorio. Le radici transgeniche della patata stabilite hanno un tasso di crescita specifico di 300 mg di peso fresco radicale per litro di terreno SH al giorno e un tempo di raddoppio di 2,6 giorni6 (Figura 3). Quando vengono co-coltivati con M. chitwoodi, questi parametri sono leggermente influenzati poiché i nematodi si nutrono del tessuto radicale e causano un calo di energia. Per le co-colture, è possibile raggiungere un tasso di crescita specifico di 200 mg di peso fresco di radice per litro di terreno SH al giorno e un tempo di raddoppio di 3 giorni6. Il numero di nematodi sviluppati può aumentare fino a 1200 J2 per g di peso fresco di radice transgenica di patata e la quantità di uova può essere 4 volte superiore a 6,13 (Figura 4). Rispetto ai test nel suolo di piante di pomodoro infette da RKN coltivate in serra, la resa più alta per le popolazioni di nematodi era solo la metà di quella delle radici transgeniche per g di materiale radicale (dati non pubblicati). Tuttavia, è noto che la crescita della popolazione di RKN dipende fortemente dalle specie di piante ospiti e persino dalla varietà. Tuttavia, morfologicamente, i nematodi allevati in radici transgeniche non mostrano differenze sostanziali da quelli recuperati da infezioni di campo o in serra 6,13.
L'uso della fucsina acida è utile per tracciare gli attacchi dei nematodi sul tessuto radicale. È noto che gli stadi mobili dell'RLN si trovano all'interno delle radici già 1 giorno dopo l'inoculazione5. Si ritiene che questa fase iniziale non dipenda dalla suscettibilità dell'ospite. Tuttavia, dopo la penetrazione, gli RLN rimangono nutrendosi delle cellule epidermiche e della corteccia della radice, si riproducono e inducono la formazione di necrosi nelle piante sensibili, oppure escono dalle radici nel terreno5. Questi meccanismi sono facilmente seguiti dalla colorazione con fucsina acida (Figura 5). Le co-colture di radici pelose di patata con RKN forniscono un potente strumento di laboratorio per analizzare i meccanismi di penetrazione di J2 e il processo decisionale nella creazione del sito di alimentazione per la femmina adulta sedentaria. È possibile seguire tutte le fasi successive all'infezione, compresa la formazione della matrice gelatinosa e il rilascio dell'uovo (Figura 6).
La struttura del tessuto può essere dettagliata utilizzando l'istochimica e la microscopia ottica. Utilizzando tecniche di colorazione differenziale, le fasi del ciclo di vita del fitoparassita possono essere seguite insieme ai cambiamenti indotti nel tessuto radicale circostante. Il Meloidogyne chitwoodi, così come altri nematodi radicali, promuovono la formazione di un sito di alimentazione composto da un tipo specifico di cellule chiamate cellule giganti. Queste cellule multinucleate sono indotte dalle secrezioni del nematode J2s e diventano metabolicamente iperattive, producendo cibo per la femmina adulta stazionaria (Figura 7). Seguire la formazione di questa struttura specializzata fornisce importanti informazioni sui meccanismi di alimentazione dei nematodi e consente l'identificazione di passaggi specifici che possono essere mirati per l'interruzione del suo ciclo di vita. Inoltre, la struttura del sito di alimentazione può essere specifica per la specie RKN, contribuendo alla sua identificazione.

Figura 1: Mantenimento dei nematodi delle lesioni radicali nei dischi di carota. (A) I dischi di radici di carota vengono sterilizzati e infettati con Pratylenchus penetrans che causano (B) lesioni necrotiche caratteristiche (sezioni scure) dovute a (C) crescita della popolazione. Barra=1 cm (A e B), 100 μm (C). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Infezione delle radici di Solanum tuberosum coltivate in serra. Le piante di patate di controllo (vasi nella parte posteriore) e le piante infettate dal nematode della lesione radicale (vasi nella parte anteriore) non mostrano sintomi visibili di infezione nei germogli dopo 30 giorni dall'infezione. Barra = 10 cm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Sviluppo delle radici transgeniche di Solanum tuberosum . (A) Piccole masse di crescita cellulare iniziano ad apparire lungo l'area di ferita del bisturi nella sezione del tubero di patata (freccia), (B) seguite dall'emergere delle prime radici transgeniche (inserto sul lato destro), (C) che crescono rapidamente e si mantengono nel terreno di coltura. (D) Un ciuffo di radice può essere trasferito su una piastra di coltura fresca per una crescita continua. Barra = 1 cm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Co-colture di Solanum tuberosum con il nematode parassita delle piante Meloidogyne chitwoodi. (A) In vitro, le colture di radici transgeniche di patata possono essere infettate con (B) giovani asettici di secondo stadio (J2) di nematode del nodo radicale Columbia per stabilire una co-coltura pianta/nematode. (C) Le galle radicali possono essere ottenute con femmine adulte che portano masse di uova. Barra = 1 cm (A, B) e 200 μm (C). Clicca qui per visualizzare una versione più grande di questa figura.
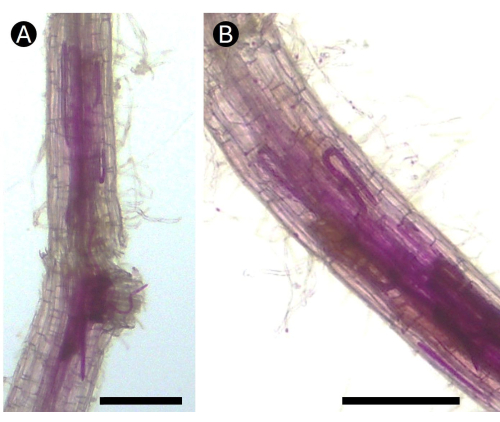
Figura 5: Radici acide di patate macchiate di fucsina infettate dal nematode Pratylenchus penetrans in condizioni di serra. (A) Diversi stadi di vita del nematode possono essere osservati nell'area della corteccia di (B) la radice che causa lesioni necrotiche. Barra = 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Galle radicolari colorate con fucsina acida da radici transgeniche infettate da Meloidogyne chitwoodi. (A) Si può vedere il tessuto biliare (B) che racchiude parte della femmina adulta di M. chitwoodi (C) che ha già prodotto la massa di uova (D) con le uova. Bar = 500 μm (A), 100 μm (B, C) e 20 μm (D). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: Struttura cellulare di una galla radicale transgenica formata da Meloidogyne chitwoodi. (A) Sezioni ultrasottili di una galla radicolare transgenica colorate con acido-Schiff periodico (PAS) e blu di toluidina O, che mostrano il sito di alimentazione della femmina adulta e (B) le cellule giganti indotte dal nematode racchiuse dal tessuto biliare radicale. Barra = 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Lo studio dei meccanismi di infezione e sviluppo della malattia nelle piante attaccate da PPN che vivono nel suolo è difficile perché questi fitoparassiti generalmente infettano i tessuti interni dell'apparato radicale e inducono sintomi aspecifici nei germogli. Nonostante le condizioni ambientali controllate della serra, la germinazione dei tuberi di patata e la crescita delle piante di patata sono comunque favorite nei mesi primaverili ed estivi, riducendo il periodo sperimentale a disposizione a una stagione all'anno. Inoltre, un numero considerevole di vasi non ha l'emergenza di piante di patate. Il ciclo di vita della RLN è relativamente lungo e sono necessari circa 2 o 3 mesi per raggiungere picchi di popolazione in grado di indurre la sintomatologia della malattia. I principali difetti del ricorso ai biotest in serra per la ricerca sulle PPN sono che a) i test in vaso presentano spesso un'elevata variabilità quando si tratta di suscettibilità alle malattie da PPN; b) sebbene le infezioni siano effettuate con popolazioni pure di PPN, esiste il rischio di insuccesso dell'instaurazione di PPN e/o di contaminazione incrociata con diverse specie di PPN; c) anche se vengono applicate misure preventive, esiste sempre il rischio di contaminazioni da parte di agenti patogeni microbici; e d) a seconda dei fondi disponibili e delle dimensioni della serra, il numero di repliche è spesso troppo ridotto per uno schema di campionamento adeguato, per la validità statistica.
Le radici transgeniche di patata sono uno strumento da laboratorio versatile che non necessita di grandi spazi per la manutenzione; può essere ottenuto in meno tempo; siano esenti da contaminazione o variabilità genetica dell'ospite; e, cosa più importante, consentire il controllo di singole variabili ambientali o nutrizionali, il che garantisce che la risposta radicale sia direttamente risultante dal trattamento imposto12. Per gli studi sull'infezione e lo sviluppo di PPN, l'utilizzo delle HR è un miglioramento rispetto ai biotest in serra. In primo luogo, la necessità di coltivare in precedenza grandi quantità di PPN prima di ogni esperimento non è necessaria poiché le co-colture HR/PPN di patate sono un sistema continuo che fornisce tutte le fasi di sviluppo dei nematodi, indipendentemente dalla stagione o dalle condizioni climatiche. Inoltre, la variabilità genetica è molto limitata perché gli HR sono tessuto somatico clonale, quindi i cambiamenti nella risposta dei PPN dipendono direttamente dalle condizioni imposte. Le co-colture HR/PPN di patate occupano uno spazio ridotto; una camera di crescita a temperatura controllata può ospitare molte piastre di Petri, quindi la sperimentazione è raramente limitata dal numero di repliche. Infine, la tecnica è espandibile ad altri PPN di patate, ad esempio Globodera spp., essendo principalmente limitata dalla fase di sterilizzazione dei nematodi, che può diventare impegnativa a seconda delle specie di PPN e della fase di vita selezionata per la decontaminazione 19,24. Nonostante i suoi numerosi vantaggi, la ricerca che utilizza le co-colture è limitata a studi a livello tissutale, ad esempio morfologia ultrastrutturale o sui meccanismi di regolazione biochimica, in condizioni di stress biotico o abiotico 6,25, ed è inadeguata per studi che richiedono, ad esempio, la determinazione della resa o del fenotipo del danno dei tuberi. Inoltre, le interazioni pianta-nematode in condizioni naturali sono influenzate da molte variabili, quindi si consiglia cautela per confronti diretti con i risultati ottenuti da studi con co-colture.
L'istochimica combina l'istologia con gli aspetti chimici, consentendo di determinare la natura delle sostanze presenti nei tessuti e la loro ubicazione21. Le tecniche di colorazione differenziale sono ampiamente utilizzate per la distinzione di specifici cambiamenti chimici e morfologici. Il colorante acido fucsina colora i tessuti dei nematodi penetrando nella cuticola impermeabile durante la fase di ebollizione. Successivamente, la decolorazione dell'apparato radicale con glicerina acidificata consente di identificare i siti in cui i nematodi stanno attaccando, poiché contrasteranno con il tessuto radicale. Tuttavia, se conservato in glicerolo acidificato per più di 1 o 2 mesi, la macchia diminuirà di intensità e il contrasto tra i nematodi e le radici delle piante si ridurrà.
L'acido-Schiff periodico (PAS) e il blu di toluidina O sono impiegati per una tecnica di doppia colorazione comunemente utilizzata per colorare tessuti freschi o incorporati in resina. Questa è una tecnica facile da applicare ma con bassa specificità e sensibilità. L'applicazione sequenziale di due coloranti consente la colorazione simultanea di più bersagli cellulari con diverse proprietà chimiche. L'acido periodico con il reagente di Schiff colora i polisaccaridi con una tonalità rosa, principalmente amido, polisaccaridi della parete cellulare e alcuni fenoli, ma non cellulosa o callosio. Il colorante blu O di toluidina evidenzia la colorazione PAS e colora le pareti cellulari dello xilema e dello sclerenchima in verde o blu-verde, le pareti cellulari del collenchima e del parenchima in rosso porpora e le pareti del floema e la lamella centrale delle pareti cellulari in rosso. La callosio e l'amido non si macchiano21.
Il protocollo descritto offre diverse promettenti applicazioni future nella scienza delle piante, nell'agricoltura e nella biotecnologia. Consente studi dettagliati sui meccanismi molecolari e cellulari del parassitismo, fornendo informazioni su come le PPN infettano e manipolano gli ospiti. Supporta l'allevamento di colture resistenti aiutando lo screening di cultivar di patate o linee transgeniche per la resistenza alle PPN, nonché l'identificazione di geni chiave coinvolti nella resistenza o nella suscettibilità. Inoltre, le co-colture in vitro possono fungere da potente strumento per lo screening ad alto rendimento di nematocidi o agenti di controllo biologico (ad esempio, microbi o prodotti naturali), consentendo ai ricercatori di valutare la loro efficacia nel controllo delle malattie PPN.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Questa ricerca è stata in parte finanziata dalla Fundação para a Ciência e a Tecnologia (FCT), attraverso le sovvenzioni NemACT, DOI: 10.54499/2022.00359.CEECIND/CP1737/CT0002 (JMSF), CEECIND/00040/2018, DOI: 10.54499/CEECIND/00040/2018/CP1560/CT0001 (CSLV) e SFRH/BD/134201/2017 (PB); progetto PratyOmics, DOI: 10.54499/PTDC/ASP-PLA/0197/2020; e i fondi strutturali UIDB/00329/2020 | cE3c (DOI: 10.54499/UIDB/00329/2020) + LA/P/0121/2020 |CHANGE (DOI: 10.54499/LA/P/0121/2020) e GreenIT (DOI: 10.54499/UIDB/04551/2020 e DOI: 10.54499/UIDP/04551/2020)..
Materiali
| Name | Company | Catalog Number | Comments |
| 2,4-Dinitrophenylhydrazine | Sigma-Aldrich | D199303 | |
| 2-Hydroxyethyl methacrylate | Sigma-Aldrich | 17348 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Acid Fuchsin | Sigma-Aldrich | F8129 | |
| Benzoyl peroxide | Sigma-Aldrich | B5907 | |
| borosilicate glass beaker | Sigma-Aldrich | Z231827 | |
| Carbenicillin disodium salt | Sigma-Aldrich | C3416 | |
| Cefotaxime sodium salt | Sigma-Aldrich | C7039 | |
| Dimethyl sulfoxide | Sigma-Aldrich | 472301 | |
| Ethanol | Supelco | 1.00983 | |
| Fertilizer | Compo Expert | ||
| Flower pot 5 L | VWR | 470049-676 | |
| Glutaraldehyde | Sigma-Aldrich | 354400 | |
| Glycerol | Sigma-Aldrich | G7893 | |
| Hydrochloric acid | Sigma-Aldrich | 258148 | |
| Kanamycin monosulfate | Sigma-Aldrich | BP861 | |
| LB Broth with agar | Sigma-Aldrich | L3147 | |
| MCE syringe filter | Millipore | SLGSR33SS | |
| PARAFILM M sealing film | BRAND | HS234526B-1EA | |
| Pararosaniline hydrochloride | Sigma-Aldrich | P3750 | |
| Periodic acid | Sigma-Aldrich | P0430 | |
| Phyto agar | Duchefa Biochemie | P1003 | |
| Scalpel blade no. 24 | Romed Holland | BLADE24 | |
| Schenk & Hildebrandt Basal salt medium | Duchefa Biochemie | S0225 | |
| Schenk & Hildebrandt vitamin mixture | Duchefa Biochemie | S0411 | |
| Schiff′s reagent | Sigma-Aldrich | 1.09033 | |
| Sodium metabisulfite | Sigma-Aldrich | 161519 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | Sigma-Aldrich | S5011 | |
| Soil / Substrate | Compo Sana | ||
| Stainless Steel Tweezers | Sigma-Aldrich | 22435-U | |
| Sucrose | Duchefa Biochemie | S0809 | |
| Toluidine Blue O | Sigma-Aldrich | 198161 |
Riferimenti
- Çalışkan, M. E., Yousaf, M. F., Yavuz, C., Zia, M. A. B., Çalışkan, S. History, production, current trends, and future prospects. Potato Production Worldwide. , 1-18 (2022).
- Barker, K. R., Koenning, S. R. Developing sustainable systems for nematode management. Ann Rev Phytopathol. 36 (1), 165-205 (1998).
- Jones, J. T., et al. Top 10 plant-parasitic nematodes in molecular plant pathology. Mol Plant Pathol. 14 (9), 946-961 (2013).
- Davis, E. L., Hussey, R. S., Baum, T. J. Getting to the roots of parasitism by nematodes. Trend Parasitol. 20 (3), 134-141 (2004).
- Figueiredo, J., Vieira, P., Abrantes, I., Esteves, I. Commercial potato cultivars exhibit distinct susceptibility to the root lesion nematode Pratylenchus penetrans. Horticulturae. 8 (3), 244 (2022).
- Faria, J. M. S., et al. In vitro co-culture of Solanum tuberosum hairy roots with Meloidogyne chitwoodi: Structure, growth and production of volatiles. Plant Cell Tissue Organ Culture. 118 (3), 519-530 (2014).
- Wesemael, W. M. L., Moens, M., Viaene, N., Taning, L. M. Life cycle and damage of the root-knot nematode Meloidogyne minor on potato, Solanum tuberosum. Nematology. 16 (2), 185-192 (2014).
- Subramanian, P., et al. Differential metabolic profiles during the developmental stages of plant-parasitic nematode Meloidogyne incognita. Int J Mol Sci. 18 (7), 1351 (2017).
- Gutierrez-Valdes, N., et al. Hairy root cultures-A versatile tool with multiple applications. Front Plant Sci. 11, 33 (2020).
- Cho, H. J., Farrand, S. K., Noel, G. R., Widholm, J. M. High-efficiency induction of soybean hairy roots and propagation of the soybean cyst nematode. Planta. 210 (2), 195-204 (2000).
- Young, J. M., Kuykendall, L. D., Martínez-Romero, E., Kerr, A., Sawada, H., et al. A revision of Rhizobium Frank 1889, with an emended description of the genus, and the inclusion of all species of Agrobacterium Conn 1942 and Allorhizobium undicola de Lajudie et al. 1998 as new combinations: Rhizobium radiobacter, R. rhizogenes, R. rubi, R. undicola and R. vitis. Int J Syst Evol Microbiol. 51 (1), 89-103 (2001).
- Giri, A., Narasu, M. L. Transgenic hairy roots. Biotechnol Adv. 18 (1), 1-22 (2000).
- Faria, J. M. S., Rusinque, L., Cavaco, T., Nunes, J. C., Inácio, M. L. Essential oil volatiles as sustainable antagonists for the root-knot nematode Meloidogyne ethiopica. Sustainability. 15 (14), 11421 (2023).
- European Mediterranean Plant Protection Organization (EPPO). PM 7/148 (1) Guidelines for the management of nematode collections used for the production and maintenance of reference material. EPPO Bulletin. 51 (3), 507-548 (2021).
- Boisseau, M., Sarah, J. L. In vitro rearing of Pratylenchidae nematodes on carrot discs. Fruits. 63 (5), 307-310 (2008).
- Barbosa, P., et al. Nematicidal activity of phytochemicals against the root-lesion nematode Pratylenchus penetrans. Plants. 13 (5), 726 (2024).
- Santos, P. M., et al. Essential oils from hairy root cultures and from fruits and roots of Pimpinella anisum. Phytochemistry. 48 (3), 455-460 (1998).
- Bertani, G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. J Bacteriol. 62 (3), 293-300 (1951).
- Kumar, A., Forrest, J. M. Reproduction of Globodera rostochiensis on transformed roots of Solanum tuberosum cv. Desiree. J Nematol. 22 (3), 395-398 (1990).
- Schenk, R. U., Hildebrandt, A. C. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Canadian J Botany. 50 (1), 199-204 (1972).
- Figueiredo, A. C. S., Barroso, J. M. G., Pedro, L. M. G., Ascensão, L. . Histoquímica e citoquímica em plantas: princípios e protocolos. Universidade de Lisboa. , (2007).
- Bybd, D. W., Kirkpatrick, T., Barker, K. R. An improved technique for clearing and staining plant tissues for detection of nematodes. J Nematol. 15 (1), 142-143 (1983).
- Coyne, D., Adewuyi, O., Mbiru, E. . Protocol for in vitro culturing of lesion nematodes: Radopholus similis and Pratylenchus spp. on carrot disc. , (2014).
- Faria, J. M. S., Vicente, C. S. L., Rusinque, L., Camacho, M. J., Inácio, M. L. Plant-Nematode co-cultures in the screening of sustainable nematicides against soil-dweling parasitic nematodes of plants. Revista de Ciências Agrárias. 45 (4), 436-439 (2022).
- Faria, J. M. S., et al. In vitro co-cultures of Pinus pinaster with Bursaphelenchus xylophilus: a biotechnological approach to study pine wilt disease. Planta. 241 (6), 1325-1336 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon