Method Article
Infección in vivo e in vitro de raíces de papa con nematodos parásitos de plantas para la evaluación de cambios estructurales inducidos
En este artículo
Resumen
El protocolo describe la infección de las raíces de Solanum tuberosum con nematodos parásitos de plantas en condiciones de invernadero in vivo y las raíces transgénicas de papa in vitro para el análisis histoquímico de la estructura de la raíz mediante microscopía óptica.
Resumen
Los nematodos parásitos de las plantas que habitan en el suelo (PPN) son plagas importantes de la papa que causan lesiones y/o cambian la estructura de las raíces de las plantas, lo que reduce la aptitud y la productividad de los cultivos. La investigación sobre los mecanismos celulares y subcelulares de la infección y el desarrollo de PPN puede recurrir a plantas de campo o plántulas en condiciones de invernadero. Los estudios de campo son más representativos de los entornos naturales, pero están sujetos a la imprevisibilidad de las condiciones ambientales que pueden influir en gran medida en los resultados de la investigación. Los estudios de invernadero permiten un mayor control sobre las variables ambientales y una mayor seguridad frente a contaminantes o patógenos. Sin embargo, en algunos hospedadores, la diversidad genética se convierte en un factor importante de variabilidad e influye en la respuesta del complejo hospedador-parásito. Hemos desarrollado co-cultivos in vitro de raíces transgénicas con PPNs como una alternativa confiable que ocupa menos espacio, requiere menos tiempo de obtención y está libre de contaminación o de variabilidad genética del huésped. Los cocultivos se obtienen mediante la introducción de PPN asépticos para alojar raíces transgénicas in vitro . Se pueden mantener indefinidamente, lo que los convierte en un excelente soporte para mantener colecciones de PPN de referencia. En el presente trabajo se detalla un protocolo para la infección controlada de raíces de papa in vivo con el nematodo de la lesión radicular y para el establecimiento de co-cultivos in vitro de raíces transgénicas de papa con el nematodo agallador. Los cocultivos in vitro proporcionaron un proxy de laboratorio para la condición de infección natural de la papa y produjeron etapas de vida de nematodos independientemente de la temporada o las condiciones climáticas. Además, se detalla la metodología utilizada para el análisis estructural mediante histoquímica y microscopía óptica. El tinte ácido fucsina se utiliza para seguir los sitios de ataque de nematodos en las raíces, mientras que la tinción diferencial con ácido peryódico-Schiff (PAS) y azul de toluidina O resalta las estructuras de los nematodos en el tejido interno de la raíz de la papa.
Introducción
Los cultivos de raíces y tubérculos ocupan el4º lugar entre los alimentos básicos más importantes del mundo. La papa (Solanum tuberosum L.) es uno de los tubérculos cultivados más importantes. Tuvo su origen en la cordillera de los Andes de América del Sur, pero después de ser introducida en Europa enel siglo XVI se convirtió rápidamente en la fuente de alimento más común para la población con ingresos más bajos. Hoy en día, las patatas representan el 1,7% de la ingesta calórica mundial. La producción de cultivos se ve muy afectada por plagas y patógenos de las plantas, de los cuales los nematodos parásitos de las plantas (PPN) pueden causar pérdidas medias de rendimiento de hasta el 12%2. Los nematodos parásitos de las plantas son responsables de algunas de las enfermedades más dañinas para los cultivos en la agricultura moderna. Los PPN que habitan en el suelo imponen grandes pérdidas a los agricultores porque afectan las raíces de las plantas e interfieren con la productividad de los cultivos al reducir la producción y/o dañar los productos, convirtiéndolos en incomercializables3. Estos peligrosos fitoparásitos utilizan su estilete (una pieza bucal en forma de aguja) para perforar las células de la raíz y alimentarse del contenido de las células. Algunas PPN se alimentan desde fuera de las raíces, otras entran en la raíz y causan daño tisular (migratorias), mientras que otras entran en las raíces y se vuelven sedentarias, cambiando fuertemente la estructura de la raíz para facilitar la alimentación4. Los principales PPN que afectan a la papa son los nematodos del quiste de la papa, Globodera spp., nematodos agalladores (RKN), Meloidogyne spp., nematodos de lesiones de raíz, Pratylenchus spp., el falso nematodo agallador Nacobbus aberrans y el nematodo de la podredumbre de la papa Ditylenchus destructor. Para estos PPN, diferentes hábitos alimenticios inducen diferentes cambios estructurales en los tejidos de la raíz del huésped 5,6. La investigación sobre los mecanismos de la infección por PPN y la respuesta del huésped a menudo se realiza a través de ensayos de campo o de invernadero para mantener colecciones de cultivo de PPN de referencia o para realizar experimentos a gran escala 7,8. Las pruebas en condiciones naturales están fuertemente influenciadas por la variación ambiental y los factores de estrés biótico o abiótico. Los bioensayos de invernadero son una alternativa más cercana a una condición natural, al tiempo que permiten un control relativo de la variación ambiental y limitan la influencia del estrés abiótico y biótico. Sin embargo, la diversidad genética del huésped aún puede ser un desafío para los ensayos que requieren un control más preciso de la variabilidad biológica. Estas limitaciones pueden superarse recurriendo a cultivos de tejidos vegetales in vitro. Se trata de sistemas de laboratorio versátiles con muchas ventajas para la investigación de enfermedades PPN. En el caso de las NPP que habitan en el suelo, los cultivos in vitro de raíces transgénicas son una herramienta útil para la investigación en condiciones de laboratorio 9,10.
Las raíces transgénicas, o raíces pilosas (HR), se obtienen después de la infección del material vegetal con Rhizobium rhizogenes (Riker et al. 1930) Young et al. 200111. Esta bacteria gramnegativa induce la transfección de su plásmido Ri en el genoma del huésped y cambia la regulación de la biosíntesis de hormonas vegetales, promoviendo la formación de tejido radicular12. Las raíces transgénicas pueden mantenerse indefinidamente bajo asepsia en un medio de cultivo. Las ventajas del uso de HR para el estudio de los PPN son una alta tasa de crecimiento en ausencia de reguladores del crecimiento de las plantas que influyan en la infección y el desarrollo de nematodos, una alta proporción de producción de biomasa por unidad de tiempo, y la integridad celular y longevidad, que determinan una mayor estabilidad genética y bioquímica6. Al recurrir a raíces transgénicas in vitro, los genotipos de PPNs pueden mantenerse indefinidamente en condiciones de laboratorio, la infección y el desarrollo de PPNs pueden seguirse fácilmente, la variabilidad genética del huésped puede reducirse, la manipulación de la composición molecular del huésped puede vincularse directamente con la respuesta de los nematodos, y los cambios estructurales del huésped y del parásito pueden seguirse con mayor precisión 6,13. Para los estudios sobre las enfermedades de PPN de la papa, los cocultivos de raíces transgénicas in vitro permiten realizar experimentos independientemente de la temporada o la latencia del tubérculo de la papa.
En este protocolo se detalla la metodología tradicional de mantenimiento de PPNs e infección in vivo de plantas de papa. Para el análisis estructural de raíces infectadas, también se detalla una metodología mejorada basada en el establecimiento de cocultivos in vitro de raíces de papa transgénica con PPNs como una alternativa que permite un mayor control de la variabilidad genética ambiental y del hospedero. Para seguir la infección y el desarrollo de PPNs en el tejido radicular, se emplea la histoquímica para ayudar en la observación de PPNs bajo microscopía óptica. El objetivo general de este protocolo es optimizar el estudio de las interacciones PPN-huésped, asegurando condiciones más controladas y reproducibles para la experimentación, al tiempo que facilita análisis estructurales y de desarrollo detallados de los nematodos en el tejido de la raíz.
Protocolo
1. Infección de plantas de papa cultivadas en invernadero
NOTA: Los ensayos en invernadero se realizan con suspensiones de PPN en etapas de vida mixtas o juveniles en segunda etapa (J2), dependiendo del ciclo de vida específico de la plaga de PPN. Para este protocolo se utilizaron suspensiones de etapas de vida mixtas del nematodo de la lesión radicular (RLN) Pratylenchus penetrans . Los PPN pueden criarse en el laboratorio o solicitarse a laboratorios de referencia certificados.
- Multiplicación y mantenimiento de nematodos de lesiones radiculares
NOTA: Los discos de zanahoria esterilizados se utilizan para la multiplicación y el mantenimiento de RLN14. Use zanahorias adquiridas comercialmente (var. Nice) sin daños visibles para reducir la contaminación microbiana. Preferiblemente, deben estar libres de pesticidas para evitar obstaculizar el desarrollo de RLN.- Lave la zanahoria con agua corriente del grifo para eliminar los residuos más grandes y, después, con una solución de detergente común (1 gota por cada 40 ml de agua) para eliminar los residuos más finos. Secar con toallas de papel de laboratorio.
- Bajo asepsia, en una campana de flujo vertical, inserte una brocheta de metal esterilizada en la parte superior de la zanahoria (de 1 a 2 cm hacia adentro) para que pueda sostenerse más fácilmente.
- Con la ayuda de una botella de lavado con boquilla, humedezca la zanahoria con etanol al 96% (v/v). Seca la punta inferior de la zanahoria en un papel de filtro esterilizado y llévala con cuidado a la llama.
PRECAUCIÓN: Tenga en cuenta que el etanol se enciende fuertemente, así que manténgase a distancia. - Pela la zanahoria de arriba hacia abajo con un pelador estéril y luego repite el paso anterior. Deseche las secciones superior e inferior (2 cm hacia adentro) y coloque la sección central de la zanahoria en una placa de Petri estéril (150 mm de diámetro). Con una cuchilla estéril y unas pinzas, corte con cuidado secciones de 1 cm de grosor de la porción de aproximadamente 2 cm de diámetro de la zanahoria (Figura 1).
- Transfiera las secciones a placas de Petri estériles (60 mm de diámetro) y selle el borde con una película transparente. Con una luz ultravioleta, esterilice la superficie de los discos de zanahoria durante 60 minutos por cada lado.
- Mantener a 25 °C durante 1-2 semanas en oscuridad y desechar los discos de zanahoria que comiencen a mostrar signos de contaminación microbiana15.
NOTA: Los signos visibles de contaminación son el pardeamiento excesivo (putrefacción), la acumulación de líquido en el borde inferior del disco de zanahoria o el crecimiento de micelio fúngico en la superficie. - Los discos de zanahoria restantes están listos para ser infectados con suspensiones de RRL. Comience haciendo una incisión en forma de X en el centro del disco de zanahoria con una cuchilla estéril. Asegúrese de cortar solo la mitad de la profundidad.
- Inocular la RLN pipeteando 50 μL de una suspensión que contenga al menos 50 etapas de vida mixtas en el centro de la herida en forma de X. Cierre la placa de Petri y selle el borde con una película transparente para evitar la desecación.
- Determine el número promedio de nematodos en la suspensión contando cinco alícuotas de 50 μL bajo un microscopio estereoscópico binocular (40x) a temperatura ambiente en un portaobjetos cóncavo. Ajuste la suspensión de los RLN mixtos en etapa de vida a 1000 por ml agregando agua a la suspensión o esperando a que los nematodos se asienten (aproximadamente 60 min) y bajando el volumen decantando el agua superficial.
- Mantenga los discos de zanahoria a 25 °C, en la oscuridad, durante un máximo de 3 meses y realice un seguimiento semanal bajo un microscopio estereoscópico binocular para detectar signos de lesiones necróticas, resultantes del crecimiento de la población de RLN.
NOTA: Los discos de zanahoria parasitados con éxito se pueden almacenar a 11 °C para su uso posterior hasta por 2 meses, pero se debe verificar regularmente si hay contaminación microbiana. Los discos de zanahoria parasitados que muestran signos de infección microbiana deben descontaminarse en autoclave antes de ser desechados. - Debajo de la campana de flujo, extraiga los RLN transfiriendo discos de zanahoria con necrosis tisular visible en el sitio de inoculación (Figura 1) a un tamiz de malla de 8 cm de diámetro y 75 μm colocado en un recipiente de vidrio estéril. Deje un pequeño espacio de 1 cm entre el fondo del tamiz y la concavidad del recipiente para recoger los RLN.
NOTA: A falta de un tamiz adquirido comercialmente, se puede fabricar uno con un tubo de plástico de 8 cm de diámetro / un vaso de plástico resistente y una gasa de malla apretada. Use bandas elásticas para asegurar la gasa al tubo o vaso de plástico. - Vierta una solución antibiótica en el colador hasta que los discos de zanahoria estén cubiertos y manténgalo durante 12 h (toda la noche) en la oscuridad. Los RLN salen de los discos de zanahoria y se depositan en el fondo del tazón. La solución antisticaria debe prepararse de forma improvisada con la extracción añadiendo 50 μg/ml de kanamicina y 50 μl de kanamicina y carbenicillina en agua destilada esterilizada16.
NOTA: Las soluciones madre de antibióticos se preparan a 50 mg/mL disolviendo 0,5 g de monosulfato de kanamicina o 0,5 g de carbenicilina disódica cada uno en 10 mL de agua destilada esterilizada. Las soluciones madre se filtran (malla de 0,22 μm) en la campana de flujo y pueden mantenerse a -20 °C hasta 1 año. - Retire el colador, utilice una pipeta de vidrio esterilizada para extraer los RLN del fondo del recipiente y colóquelos en un bloque de tinción de vidrio esterilizado (4 cm x 4 cm x 1 cm) y lave pipeteando 1 ml de solución antibiótica. Espere de 30 a 40 minutos para que los nematodos se asienten antes de recoger la solución antibiótica usada. Repita este lavado 4 veces-5 veces.
- Utilice la suspensión acuosa con los RLN inmediatamente o manténgala a 11 °C durante un período de almacenamiento más largo (hasta 2 meses).
- Infección in vivo de plantas de papa con PPN
NOTA: Para cultivar plantas de papa susceptibles (S. tuberosum var. Désirée), las papas de siembra certificadas deben adquirirse de los comerciantes agrícolas entre enero y marzo. Elija papas de siembra certificadas porque se venden con un pasaporte fitosanitario, lo que garantiza que no estén contaminadas con fitoparásitos en cuarentena. Como precaución, se puede realizar un paso inicial de desinfección con una solución de lejía al 10% seguido de un lavado con agua corriente del grifo para garantizar la desinfección de la superficie del tubérculo de papa. No se recomiendan las papas comercializadas comunes, ya que los tratamientos impuestos para reducir la brotación y el vigor pueden interferir con el crecimiento de la papa y la respuesta a la infección.- Seleccione tubérculos de papa del mismo tamaño y deseche los que tengan agujeros, moretones o secciones más blandas. Retire suavemente todos los brotes cultivados (1 mm) antes de sembrar para sincronizar la brotación.
NOTA: Si es necesario, almacene las papas de siembra en un lugar bien ventilado, seco y oscuro antes de sembrar. - Llene macetas de 5 L (22 cm x 18 cm) con una mezcla 1:1 de tierra esterilizada en autoclave y arena gruesa fina mezclada con 22,5 g de fertilizante NPK de liberación lenta (12-12-12) y siembre las patatas a 9 cm por debajo de la superficie del suelo.
NOTA: La tierra y la arena deben tamizarse para eliminar los residuos de más de 2 mm, esterilizarse en autoclave 2 veces a 121 °C durante 15 minutos y secarse a 100 °C durante 1 a 2 días, con mezclas frecuentes. Airear los siguientes 7 a 10 días mezclando con frecuencia, antes de usar. - Mantenga las macetas en un invernadero en condiciones húmedas (50%-70% de humedad) y riegue con frecuencia (mantenga el suelo al 70% de su capacidad máxima de retención de agua), evitando temperaturas extremas, hasta que los brotes de la planta de papa comiencen a emerger en la superficie del suelo.
- Después de la emergencia de la planta, use suspensiones de RLN recién extraídas para infectar las raíces de la papa. Comience creando de 4 a 6 agujeros (1 cm de ancho) distribuidos uniformemente alrededor de la planta hasta la profundidad de la semilla.
- Pipetear uniformemente una suspensión de 8 mL de 30.000 RLN vivos en etapa de vida mixta en los agujeros, de modo que el inóculo tenga una proporción de 4 RLN vivos por g de mezcla de suelo, y cubrir con mezcla de suelo. Para las macetas con RLN, suspenda el riego el día de la inoculación.
NOTA: Las RLN se cuentan bajo un microscopio estereoscópico (40x). Los nematodos muertos son inmóviles y tienen una forma extendida, mientras que los nematodos vivos generalmente se mueven (forma no extendida). La punzada física se utiliza para determinar la mortalidad. - Mantenga las macetas durante 2 meses en las condiciones descritas anteriormente (Figura 2). Luego, arranque las plantas de papa y pese los brotes y las raíces por separado.
- Lave cuidadosamente el sistema radicular antes de verificar la ubicación de los sitios de ataque de RLN mediante técnicas de tinción5.
- Seleccione tubérculos de papa del mismo tamaño y deseche los que tengan agujeros, moretones o secciones más blandas. Retire suavemente todos los brotes cultivados (1 mm) antes de sembrar para sincronizar la brotación.
2. Establecimiento de cocultivos in vitro de raíces transgénicas de papa con PPNs
- Establecer in vitro Raíces transgénicas de papa
NOTA: Para este protocolo, utilizamos Rhizobium rhizogenes Llevando el gus gen reportero cointegrado en el plásmido Ri y conducido por un doble promotor 35S (A4pRiA4::70GUS)17. Las bacterias pueden adquirirse de fuentes comerciales o solicitarse a laboratorios de referencia certificados.- Para obtener bacterias en la fase de crecimiento exponencial, extienda la placa R. rhizogenes en una placa de medio sólido Luria-Bertani (LB)18 y manténgala toda la noche a 26 °C.
NOTA: El medio LB puede adquirirse comercialmente o prepararse en el laboratorio añadiendo 10 g/L de peptona, 5 g/L de extracto de levadura, 10 g/L de NaCl y 15 g/L de agar y luego esterilizar con vapor durante 15 min a 121 °C. - Con un asa de inoculación, elija una colonia e inocule 10 mL de caldo LB líquido (medio LB sin agar) en un matraz estéril de 50 mL. Mantener toda la noche en la oscuridad a 26 °C bajo agitación (180 rpm).
- Mida la absorbancia del cultivo líquido hasta que A600 llegue a 0,6. En esta etapa, las bacterias se encuentran en la fase de crecimiento exponencial y se utilizan para inocular el material vegetal.
- La inoculación se realiza en tubérculos de patata fresca asépticos. Para esterilizar la superficie de los tubérculos de papa, comience lavando con agua corriente del grifo para eliminar los desechos más grandes, y luego con una solución de detergente común (1 gota por 40 ml de agua), con agitación vigorosa, para eliminar los desechos más finos.
NOTA: Seleccione una variedad de papa con susceptibilidad conocida a los PPN en uso. Para este protocolo, se utilizó S. tuberosum var. - Coloque los tubérculos en un recipiente, cúbralos con una solución de lejía comercial (1:4, lejía comercial en agua del grifo) y cierre. Mezcle durante 15 minutos, deseche la solución de lejía y enjuague 3 veces con agua del grifo esterilizada.
- En una campana de flujo, sumerja los tubérculos en una solución de etanol (80%, v/v) durante 15 minutos con agitación vigorosa, deseche el etanol y enjuague 3 veces con agua del grifo esterilizada.
- Con un bisturí estéril, retire las partes periféricas de los tubérculos (aproximadamente el 50% del tubérculo desde la superficie hacia adentro) y corte la pieza central interna en segmentos de 0,5 cm de grosor19. Inocular inmediatamente con la suspensión bacteriana preparada en el paso 2.1.3.
- Para la inoculación, diluir la suspensión bacteriana añadiendo 1 mL de suspensión bacteriana a 9 mL de medio Schenk and Hildebrandt20 (SH) suplementado con 30 g/L de sacarosa a pH = 5,6. Sumerja la punta de un bisturí estéril en la suspensión diluida y enrolle la superficie del gajo. Repita este paso 5 veces para cada segmento de papa.
- Secar los segmentos de exceso de humedad en papel de filtro estéril durante 1 min, colocarlos en medio SH semisólido (medio SH con 30 g/L de sacarosa, 8 g/L de agar, pH = 5,6) y mantener en oscuridad a 25 °C para que se produzca la transfección de plásmidos.
- Después de 3 días, transfiera los segmentos infectados a placas de medio SH semisólido suplementado con 150 μg/mL de cefotaxima y carbenicilina del antibiótico. Conservar durante más de 3 meses con renovación media semanal para asegurar la eliminación de las bacterias.
NOTA: La solución madre de cefotaxima puede prepararse a 100 mg/mL disolviendo 1 g de cefotaxima sódica en 10 mL de agua desmineralizada estéril y filtrando (malla de 0,22 μm) bajo la campana de flujo. Los antibióticos pueden mantenerse a -20 °C hasta 1 año. - Después de 3 meses, el crecimiento de las raíces transgénicas es extenso. Transfiera las raíces a un medio SH fresco, semisólido y sin antibióticos reuniendo un grupo de raíces de 1 g con las puntas de unas pinzas estériles y colocándolo en el centro del medio de cultivo en una placa nueva (Figura 3).
NOTA: Aproximadamente 1 mes después de la infección, aparecen pequeñas masas de crecimiento celular en la superficie del segmento de papa, a partir de donde comienzan a desarrollarse las raíces transgénicas6. Asegúrese de mantenerlos en contacto con el medio de cultivo, de lo contrario podrían desecarse. - Para garantizar la estabilidad genética y metabólica, mantener las raíces transgénicas bajo una rutina mensual de subcultivo (como se describe en el paso 2.1.11.) a 25 °C en la oscuridad durante más de 1 año antes de infectar con PPN.
NOTA: Asegúrese de que se mantengan al menos seis réplicas en cada paso del protocolo, ya que a menudo se produce una contaminación microbiana no deseada. Una vez establecida, una sola placa de cocultivo puede utilizarse como inóculo para varios cocultivos nuevos; Sin embargo, asegúrese de conservar al menos seis placas replicadas.
- Para obtener bacterias en la fase de crecimiento exponencial, extienda la placa R. rhizogenes en una placa de medio sólido Luria-Bertani (LB)18 y manténgala toda la noche a 26 °C.
- Establecimiento de cocultivos in vitro de raíces de papa transgénicas con PPNs
NOTA: Para obtener cocultivos de raíces transgénicas con PPN, el proceso de esterilización de nematodos es crítico. Para el presente protocolo se utilizaron juveniles de segunda etapa del nematodo agallador de cuarentena Meloidogyne chitwoodi. El inóculo de nematodos se puede obtener de laboratorios de referencia certificados en forma de agallas de raíz.- Bajo un microscopio estereoscópico binocular (20x), aísle las masas de huevos de nematodos de las agallas de la raíz con pinzas estériles de punta ultrafina. Coloque las masas de huevos en una placa de Petri tapada con 5 mL de agua del grifo estéril y deje que los huevos eclosionen durante 48 h. Ajuste la suspensión J2 a 100 nematodos por mL.
- En una campana de flujo, pipetee 5 mL de una suspensión que contenga 500 J2 en un tamiz estéril de malla de 20 μm y lávese con agua estéril del grifo.
- Sumerja la mitad inferior del tamiz que contiene los J2 en una solución de peróxido de hidrógeno (H2O2) al 20 % y mezcle manualmente con movimientos circulares durante 15 minutos.
- Lave los J2 estériles dispensando agua del grifo estéril a través del tamiz. Repita este paso 3 veces. En el lavado final, incline el tamiz para que los nematodos se acumulen en el borde del tamiz. Recupere la suspensión estéril de nematodos pipeteando 1 mL de agua ultrapura estéril en el borde del tamiz y guárdela a 11 °C o utilícela inmediatamente.
NOTA: El éxito de la esterilización puede evaluarse mediante la siembra de una alícuota de 100 μL de la suspensión de nematodos en medio SH y el control regular, durante 1 semana, de la contaminación. - En la campana de flujo, subcultive un grupo de 1 g de raíces transgénicas de patata (como se describe en el paso 2.1.11.) en placas SH con 100 nematodos estériles (100 μL de una suspensión con 1000 J2s por mL). Después de 2 a 3 semanas, comienzan a aparecer pequeñas agallas en las nuevas raíces.
- Siga el cocultivo regularmente bajo un microscopio invertido (100x), y cuando las masas de huevos comiencen a ser notables, subcultivo a una nueva placa de medio SH semisólida, asegurándose de que las agallas se tomen con el grupo de raíces (Figura 4). Mantener los cocultivos bajo una rutina mensual de subcultivos a 25 °C en la oscuridad.
3. Análisis estructural de la infección por PPNs
NOTA: Para seguir los cambios inducidos por las PPN en la estructura del tejido radicular, se utilizan técnicas de tinción histoquímica para contrastar tejidos con diferentes composiciones químicas. La tinción diferencial se realiza en masas radiculares o en secciones delgadas de material radicular fijo, donde los colorantes específicos reaccionan con el tejido objetivo de acuerdo con su afinidad química21. Para el presente protocolo, utilizamos fucsina ácida o reactivo de Schiff de ácido peryódico (PAS) combinado con colorantes azul de toluidina O para la tinción diferencial.
- Distribución de nematodos parásitos de plantas en raíces teñidas con fucsina ácida
NOTA: Para seguir la distribución de PPN en todo el sistema radicular, se usa fucsina ácida para teñir el tejido muscular del nematodo en un tono rojo5.- Comience lavando el sistema radicular con agua corriente del grifo durante 5 minutos para eliminar cualquier residuo de tierra (raíces de plantas in vivo ) o residuos del medio de cultivo (raíces transgénicas in vitro ). Use sus dedos en un movimiento circular para ayudar a separar la tierra del sistema de raíces.
- Corta el sistema radicular en secciones de 1 a 2 cm de largo y colócalo dentro de un vaso de precipitados de 150 ml. Dispensar 70 ml de una solución de hipoclorito de sodio (NaOCl) al 1,5 % y mezclar enérgicamente durante 4 minutos para limpiar los tejidos de la raíz. Después, deseche la solución de NaOCl, enjuague las raíces con agua corriente del grifo y remoje durante 15 minutos en agua desmineralizada para eliminar los residuos de NaOCl22.
NOTA: El blanqueador de cloro contiene un mínimo de 5.25% de NaOCl, así que agregue 20 mL de blanqueador de cloro a 50 mL de agua para obtener una solución de NaOCl al 1.5%. Para el material más blando (por ejemplo, tejido más blando de raíces jóvenes o de raíces transgénicas cultivadas in vitro ) se utiliza una solución de NaOCl al 0,9%, mientras que para el material más duro (raíces lignificadas más viejas) se utiliza una solución de NaOCl al 2,0%. - Escurre las raíces aclaradas y colócalas en un vaso de vidrio de borosilicato con 30 ml de agua desmineralizada. Pipetear 1 mL de solución ácida para manchas de fucsina, mezclar manualmente y hervir durante 30 s en una placa caliente. Deje que el vaso de vidrio se enfríe, escurra la solución y lave las raíces manchadas con agua corriente del grifo.
NOTA: La solución de tinción de fucsina ácida se elabora disolviendo 3,5 g de polvo de colorante de fucsina ácida en 250 ml de ácido acético y añadiendo 750 mL de agua desmineralizada. La tinción siempre va seguida de un paso de decoloración para eliminar el exceso de manchas no utilizadas y mejorar el contraste de la muestra. - Decolorar añadiendo 10-30 mL de glicerina acidificada con unas gotas de HCl (5N)13.
- Observar bajo el microscopio estereoscópico o el microscopio invertido para evaluar aproximadamente en qué parte de la estructura de la raíz están atacando preferentemente los PPN (Figura 5 y Figura 6).
- Evaluación de la morfología de las células radiculares con ácido peryódico-Schiff (PAS)/azul de toluidina O
NOTA: La influencia de la infección por PPNs o el daño a la morfología de las células de la raíz se puede evaluar bajo el microscopio fijando, seccionando y teñiendo diferencialmente las raíces de papa infectadas.- En un vial de muestra cerrado, fije el material radicular fresco con glutaraldehído al 2,5%, preparado en tampón de fosfato sódico 0,1 M, a pH 7,2, durante 24-48 h, a temperatura ambiente6.
PRECAUCIÓN: El glutaraldehído es tóxico. Evite la inhalación y el contacto. Use una bata protectora de laboratorio y guantes y trabaje con una campana extractora. Los viales de muestra deben cerrarse a menos que se trate de enjuague o de vacío. Deseche el glutaraldehído siguiendo las reglas de los Procedimientos de Desechos Peligrosos. Los pasos 3.2.1 a 3.2.5 se realizan en una campana extractora para evitar la inhalación de reactivos.
NOTA: Para preparar 1 L de tampón de fosfato de sodio, pH 7.2, agregue 68.4 mL de 1M Na2HPO4 (141.96 g en solución de 1 L) a 31.6 mL de 1M NaH2PO4 (119.98 g en 1 L de solución) y llene hasta 1 L agregando 900 mL de agua desmineralizada. Para ayudar a la infiltración del fijador, coloque los viales de muestra sin tapar con material radicular bajo un vacío bajo (26 mm Hg) durante 2 min en un desecador conectado a una bomba de vacío. - Con una pipeta Pasteur de vidrio, deseche la solución fijadora y lave las raíces fijadas con tampón de fosfato de sodio (3x).
- Comience a deshidratar gradualmente el tejido radicular fijado reemplazando el tampón con una solución de etanol al 10 % (v/v) durante 15 min. A continuación, cámbielo por una solución de etanol al 20% con una pipeta de vidrio y mantenga las raíces incrustadas durante 15 minutos. Continúe con la sucesión gradual de concentraciones crecientes de etanol (30%, 40%, 50%, 60%, 70%, 80% y 90% durante 15 minutos cada una) hasta el paso de etanol puro, donde las raíces deben mantenerse durante 1 h.
- Incrustar las raíces deshidratadas gradualmente en resina (2-hidroxietil metacrilato). Con una pipeta de vidrio, sustituya el etanol puro por una solución de etanol/resina 3:1 (v/v) y manténgala durante 24 h a 4 °C. A continuación, aplique soluciones de etanol/resina 1:1 y 1:3 (v/v), cada una con un período de incubación de 24 horas a 4 °C. A continuación, sustituya la solución 1:3 (v/v) por resina pura suplementada con peróxido de dibenzoilo (1%) como iniciador de la polimerización.
- Coloque las muestras en una bandeja de molde de resina, agregue una mezcla de resina:dimetilsulfóxido 15:1 (v/v) y manténgala a 60 °C sobre una placa caliente durante 48 h para que la resina se endurezca.
- Coloque las muestras impregnadas en un micrótomo giratorio equipado con una cuchilla de tungsteno y corte secciones de 2-5 μm en portaobjetos de vidrio, de acuerdo con las instrucciones del fabricante.
- Comience la tinción diferencial sumergiendo los portaobjetos durante 10 min en un frasco de tinción de vidrio con una solución de 2,4-dinitrofenilhidracina al 15% en ácido acético, a temperatura ambiente. A continuación, lavar cuidadosamente con agua corriente del grifo durante 15 min y secar en horno a 60 °C (15 min).
- A continuación, sumerja los portaobjetos en ácido peryódico (1%) durante 10 minutos, y luego lávelos con agua corriente del grifo durante 5 minutos y déjelos secar en un horno a 60 °C (15 min).
- Sumerja los portaobjetos en el reactivo de Schiff (compuesto por un 1% de pararosanilina y un 4% de metabisulfito de sodio, en ácido clorhídrico 0,25 M), durante 30 min. A continuación, lavar con una solución de metabisulfito de sodio (0,5%) en ácido clorhídrico (0,05 M), durante 2 min. Repetir 3 veces. Por último, lavar con agua corriente del grifo durante 5 minutos y secar a temperatura ambiente.
- Para contraste, teñir sumergiendo los portaobjetos en azul de toluidina O al 0,05% durante 15 min, lavándolos con agua corriente del grifo durante 15 min y secándolos en horno a 60 °C (15 min).
- Observar bajo un microscopio (100x) equipado con hardware de captura de imágenes (Figura 7).
- En un vial de muestra cerrado, fije el material radicular fresco con glutaraldehído al 2,5%, preparado en tampón de fosfato sódico 0,1 M, a pH 7,2, durante 24-48 h, a temperatura ambiente6.
Resultados
Los discos de zanahoria se pueden utilizar para multiplicar y mantener varios tipos de PPN migratorios23. Para el RLN, esta técnica se utiliza generalmente para mantener colecciones de referencia de especies de nematodos o aislados. Usando discos de zanahoria, se puede obtener un aumento promedio de 100 veces en las poblaciones de nematodos en un período de 3 meses (Figura 1). Sin embargo, el número de nematodos varía ampliamente (entre 30x y 200x), principalmente debido a la diversidad genética de los nematodos y/o a la variación en el contenido nutricional de las zanahorias. Además, a pesar de varias medidas de prevención utilizadas para reducir la contaminación microbiana, entre el 20% y el 30% de los discos de zanahoria pueden contaminar, así que asegúrese de preparar más platos de los requeridos.
En las plantas de papa, la presencia de RLN no siempre induce síntomas visibles, ya que dependen en gran medida del número de poblaciones de parásitos que atacan el sistema radicular (Figura 2). Para P. penetrans, un inóculo inicial de 4 RLNs/g de suelo puede acumular hasta 2000 RLNs/g de raíz y 750 huevos/g de raíz después de 2 meses, induciendo una disminución de casi el 30% en el peso de la raíz5.
Los cultivos de raíces pilosas de papa son un sistema de alto rendimiento para estudiar enfermedades relacionadas con la raíz en un contexto de laboratorio. Las raíces transgénicas de papa establecidas tienen una tasa de crecimiento específica de 300 mg de peso fresco de raíz por L de medio SH por día y un tiempo de duplicación de 2,6 días6 (Figura 3). Cuando se co-cultiva con M. chitwoodi, estos parámetros se ven ligeramente afectados ya que los nematodos se alimentan del tejido de la raíz y causan un sumidero de energía. Para los cocultivos, se puede alcanzar una tasa de crecimiento específica de 200 mg de peso fresco de raíz por L de medio SH por día y un tiempo de duplicación de 3 días6. El número de nematodos desarrollados puede aumentar hasta 1200 J2s por g de peso fresco de raíz transgénica de papa, y la cantidad de huevos puede ser 4 veces mayor 6,13 (Figura 4). En comparación con las pruebas en el suelo de plantas de tomate infectadas con RKN cultivadas en invernadero, el rendimiento más alto de las poblaciones de nematodos fue solo la mitad del de las raíces transgénicas por g de material radicular (datos no publicados). Sin embargo, se sabe que el crecimiento de la población de RKN depende en gran medida de las especies de plantas hospederas e incluso de la variedad. Sin embargo, morfológicamente, los nematodos criados en raíces transgénicas no muestran diferencias sustanciales con los recuperados de infecciones de campo o invernadero 6,13.
El uso de fucsina ácida es útil para rastrear los ataques de nematodos en el tejido de la raíz. Se sabe que los estadios móviles de la RLN se encuentran dentro de las raíces tan pronto como 1 día después de la inoculación5. Se cree que esta etapa inicial no depende de la susceptibilidad del huésped. Sin embargo, después de la penetración, las RLN permanecen alimentándose de las células epidérmicas y de la corteza de la raíz, se reproducen e inducen la formación de necrosis en plantas susceptibles, o salen de las raíces de regreso al suelo5. Estos mecanismos son fácilmente seguidos por la tinción con fucsina ácida (Figura 5). Los cocultivos de raíces pilosas de papa con RKNs proporcionan una poderosa herramienta de laboratorio para analizar los mecanismos de penetración de J2 y la toma de decisiones en el establecimiento del sitio de alimentación para la hembra adulta sedentaria. Se pueden seguir todas las etapas posteriores a la infección, incluida la formación de la matriz gelatinosa y la liberación de óvulos (Figura 6).
La estructura del tejido se puede detallar mediante histoquímica y microscopía óptica. Mediante el uso de técnicas de tinción diferencial, se pueden seguir las etapas del ciclo de vida del fitoparásito junto con los cambios inducidos en el tejido radicular circundante. Meloidogyne chitwoodi, al igual que otros nematodos agalladores, promueven la formación de un sitio de alimentación compuesto por un tipo específico de células llamadas células gigantes. Estas células multinucleadas son inducidas por las secreciones del nematodo J2s y se vuelven metabólicamente hiperactivas, produciendo alimento para la hembra adulta estacionaria (Figura 7). La formación de esta estructura especializada proporciona información importante sobre los mecanismos de alimentación de los nematodos y permite la identificación de pasos específicos que pueden ser objeto de interrupciones en su ciclo de vida. Además, la estructura del sitio de alimentación puede ser específica de la especie RKN, lo que contribuye a su identificación.

Figura 1: Mantenimiento del nematodo de la lesión radicular en discos de zanahoria. (A) Los discos de las raíces de zanahoria están esterilizados e infectados con Pratylenchus penetrans , causando (B) lesiones necróticas características (secciones oscuras) debido a (C) el crecimiento de la población. Bar=1 cm (A y B), 100 μm (C). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Infección de raíces de Solanum tuberosum cultivadas en condiciones de invernadero. Las plantas de papa de control (macetas en la parte posterior) y las plantas infectadas con el nematodo de la lesión de la raíz (macetas en el frente) no muestran síntomas visibles de infección en los brotes después de 30 días de infección. Barra = 10 cm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Desarrollo de raíces transgénicas de Solanum tuberosum . (A) Comienzan a aparecer pequeñas masas de crecimiento celular a lo largo del área de herida del bisturí en la sección del tubérculo de papa (flecha), (B) seguidas de la aparición de las primeras raíces transgénicas (inserto del lado derecho), (C) que crecen y se sostienen rápidamente en el medio de cultivo. (D) Un grupo de raíces se puede transferir a una placa de medio de cultivo fresco para un crecimiento continuo. Barra = 1 cm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Cocultivos de Solanum tuberosum con el nematodo parásito Meloidogyne chitwoodi. (A) In vitro, los cultivos de raíces transgénicas de papa pueden infectarse con (B) juveniles asépticos de segundo estadio del nematodo avezado del agallador Columbia (J2) para establecer un cocultivo planta/nematodo. (C) Las agallas de la raíz se pueden obtener con hembras adultas que tienen masas de huevos. Barra = 1 cm (A, B) y 200 μm (C). Haga clic aquí para ver una versión más grande de esta figura.
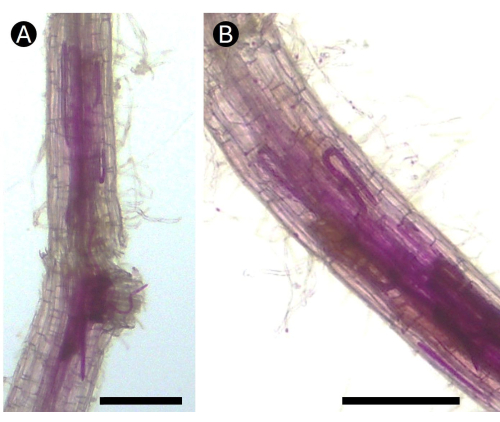
Figura 5: Raíces de papas teñidas con ácido fucsina infectadas por el nematodo Pratylenchus penetrans en condiciones de invernadero. (A) Se pueden observar varias etapas de vida del nematodo en el área de la corteza de (B) la raíz causando lesiones necróticas. Barra = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Agallas de raíz teñidas con fucsina ácida de raíces transgénicas infectadas con Meloidogyne chitwoodi. (A) El tejido biliar se puede ver (B) encerrando parte de la hembra adulta de M. chitwoodi (C) que ya ha producido la masa de huevos (D) con los huevos. Barra = 500 μm (A), 100 μm (B, C) y 20 μm (D). Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Estructura celular de una agalla transgénica formada por Meloidogyne chitwoodi. (A) Secciones ultrafinas de una agalla de raíz transgénica teñida con ácido peryódico-Schiff (PAS) y azul de toluidina O, que muestra el sitio de alimentación de la hembra adulta y (B) las células gigantes inducidas por el nematodo encerradas por el tejido de la agalla de la raíz. Barra = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El estudio de los mecanismos de infección y desarrollo de enfermedades en plantas atacadas por PPN que habitan en el suelo es difícil porque estos fitoparásitos generalmente infectan los tejidos internos del sistema radicular e inducen síntomas inespecíficos en los brotes. A pesar de las condiciones ambientales controladas del invernadero, los tubérculos de papa en germinación y el crecimiento de plantas de papa aún se ven favorecidos en los meses de primavera y verano, reduciendo el período experimental disponible a una temporada por año. Además, un número sustancial de macetas no tienen emergencia de plantas de papa. El ciclo de vida de la RLN es relativamente largo y se necesitan alrededor de 2 a 3 meses para alcanzar picos poblacionales capaces de inducir la sintomatología de la enfermedad. Las principales deficiencias de recurrir a bioensayos de invernadero para la investigación de PPN son que: a) las pruebas en macetas suelen presentar una gran variabilidad en lo que respecta a la susceptibilidad a las enfermedades de PPN; b) aunque las infecciones se realizan con poblaciones puras de los PPN, existe el riesgo de un establecimiento fallido de PPN y/o de contaminación cruzada con diferentes especies de PPN; c) aunque se apliquen medidas preventivas, siempre existe el riesgo de contaminación por patógenos microbianos; y d) dependiendo de los fondos disponibles y del tamaño del invernadero, el número de réplicas es a menudo demasiado reducido para un esquema de muestreo adecuado, para la validez estadística.
Las raíces transgénicas de papa son una herramienta de laboratorio versátil que no requiere grandes espacios para su mantenimiento; se puede obtener en menos tiempo; estén libres de contaminación o variabilidad genética del huésped; y, lo que es más importante, permiten controlar variables ambientales o nutricionales individuales, lo que garantiza que la respuesta radicular sea directamente consecuencia del tratamiento impuesto12. Para los estudios sobre la infección y el desarrollo de PPN, el uso de HR es una mejora en comparación con los bioensayos de invernadero. En primer lugar, la necesidad de cultivar previamente grandes cantidades de PPN antes de cada experimento es innecesaria, ya que los cocultivos de papa HR/PPN son un sistema continuo que proporciona todas las etapas de desarrollo de nematodos, independientemente de la temporada o las condiciones climáticas. Además, la variabilidad genética es muy limitada debido a que los HRs son tejido somático clonal, por lo que los cambios en la respuesta a los PPNs dependen directamente de las condiciones impuestas. Los cocultivos de papa HR/PPNs ocupan un espacio pequeño; una cámara de crecimiento con temperatura controlada puede albergar muchas placas de Petri, por lo que la experimentación rara vez se ve limitada por el número de réplicas. Por último, la técnica es ampliable a otros PPN de papa, por ejemplo, Globodera spp., estando limitada principalmente por la etapa de esterilización del nematodo, que puede llegar a ser un desafío dependiendo de la especie de PPN y la etapa de vida seleccionada para la descontaminación 19,24. A pesar de sus muchas ventajas, la investigación con cocultivos se limita a estudios a nivel tisular, por ejemplo, morfología ultraestructural o sobre mecanismos de regulación bioquímica, bajo estrés biótico o abiótico 6,25, y es inadecuada para estudios que requieren, por ejemplo, determinar el rendimiento del tubérculo o el fenotipo del daño. Además, las interacciones planta-nematodo en condiciones naturales están influenciadas por muchas variables, por lo que se recomienda precaución para las comparaciones directas con los resultados obtenidos de estudios con cocultivos.
La histoquímica combina la histología con los aspectos químicos, lo que permite determinar la naturaleza de las sustancias presentes en los tejidos y su localización21. Las técnicas de tinción diferencial son ampliamente utilizadas para la distinción de cambios químicos y morfológicos específicos. El tinte ácido fucsina tiñe los tejidos de los nematodos al penetrar en la cutícula impermeable durante el paso de ebullición. Posteriormente, la decoloración del sistema radicular con glicerina acidificada permite identificar los sitios donde los nematodos están atacando, ya que contrastarán con el tejido radicular. Sin embargo, si se mantiene en glicerol acidificado durante más de 1 a 2 meses, la tinción disminuirá en intensidad y el contraste entre los nematodos y las raíces de las plantas se reducirá.
El ácido peryódico-Schiff (PAS) y el azul de toluidina O se emplean para una técnica de tinción doble comúnmente utilizada para teñir tejido fresco o incrustado en resina. Se trata de una técnica fácil de aplicar pero con baja especificidad y sensibilidad. La aplicación secuencial de dos colorantes permite la tinción simultánea de múltiples dianas celulares con diferentes propiedades químicas. El ácido peryódico con reactivo de Schiff teñirá los polisacáridos con un tono rosado, principalmente almidón, polisacáridos de la pared celular y algunos fenoles, pero no celulosa ni callosa. El colorante azul O de toluidina resalta la tinción PAS y tiñirá las paredes celulares del xilema y el esclerénquima de verde o azul verdoso, las paredes celulares del colénquima y el parénquima en rojo púrpura, y las paredes del floema y la lámina media de las paredes celulares en rojo. La calosa y el almidón no se mancharán21.
El protocolo descrito ofrece varias aplicaciones futuras prometedoras en la ciencia de las plantas, la agricultura y la biotecnología. Permite estudios detallados sobre los mecanismos moleculares y celulares del parasitismo, proporcionando información sobre cómo los PPN infectan y manipulan a los huéspedes. Apoya el mejoramiento de cultivos resistentes al ayudar a la selección de cultivares de papa o líneas transgénicas para detectar resistencia a los PPN, así como la identificación de genes clave involucrados en la resistencia o susceptibilidad. Además, los cocultivos in vitro pueden servir como una poderosa herramienta para el cribado de alto rendimiento de nematicidas o agentes de control biológico (por ejemplo, microbios o productos naturales), lo que permite a los investigadores evaluar su eficacia en el control de las enfermedades PPN.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Esta investigación fue financiada en parte por la Fundação para a Ciência e a Tecnologia (FCT), a través de las subvenciones NemACT, DOI: 10.54499/2022.00359.CEECIND/CP1737/CT0002 (JMSF), CEECIND/00040/2018, DOI: 10.54499/CEECIND/00040/2018/CP1560/CT0001 (CSLV) y SFRH/BD/134201/2017 (PB); proyecto PratyOmics, DOI: 10.54499/PTDC/ASP-PLA/0197/2020; y Fondos Estructurales UIDB/00329/2020 | cE3c (DOI: 10.54499/UIDB/00329/2020) + LA/P/0121/2020 |CHANGE (DOI: 10.54499/LA/P/0121/2020), y GreenIT (DOI: 10.54499/UIDB/04551/2020 y DOI: 10.54499/UIDP/04551/2020).
Materiales
| Name | Company | Catalog Number | Comments |
| 2,4-Dinitrophenylhydrazine | Sigma-Aldrich | D199303 | |
| 2-Hydroxyethyl methacrylate | Sigma-Aldrich | 17348 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Acid Fuchsin | Sigma-Aldrich | F8129 | |
| Benzoyl peroxide | Sigma-Aldrich | B5907 | |
| borosilicate glass beaker | Sigma-Aldrich | Z231827 | |
| Carbenicillin disodium salt | Sigma-Aldrich | C3416 | |
| Cefotaxime sodium salt | Sigma-Aldrich | C7039 | |
| Dimethyl sulfoxide | Sigma-Aldrich | 472301 | |
| Ethanol | Supelco | 1.00983 | |
| Fertilizer | Compo Expert | ||
| Flower pot 5 L | VWR | 470049-676 | |
| Glutaraldehyde | Sigma-Aldrich | 354400 | |
| Glycerol | Sigma-Aldrich | G7893 | |
| Hydrochloric acid | Sigma-Aldrich | 258148 | |
| Kanamycin monosulfate | Sigma-Aldrich | BP861 | |
| LB Broth with agar | Sigma-Aldrich | L3147 | |
| MCE syringe filter | Millipore | SLGSR33SS | |
| PARAFILM M sealing film | BRAND | HS234526B-1EA | |
| Pararosaniline hydrochloride | Sigma-Aldrich | P3750 | |
| Periodic acid | Sigma-Aldrich | P0430 | |
| Phyto agar | Duchefa Biochemie | P1003 | |
| Scalpel blade no. 24 | Romed Holland | BLADE24 | |
| Schenk & Hildebrandt Basal salt medium | Duchefa Biochemie | S0225 | |
| Schenk & Hildebrandt vitamin mixture | Duchefa Biochemie | S0411 | |
| Schiff′s reagent | Sigma-Aldrich | 1.09033 | |
| Sodium metabisulfite | Sigma-Aldrich | 161519 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | Sigma-Aldrich | S5011 | |
| Soil / Substrate | Compo Sana | ||
| Stainless Steel Tweezers | Sigma-Aldrich | 22435-U | |
| Sucrose | Duchefa Biochemie | S0809 | |
| Toluidine Blue O | Sigma-Aldrich | 198161 |
Referencias
- Çalışkan, M. E., Yousaf, M. F., Yavuz, C., Zia, M. A. B., Çalışkan, S. History, production, current trends, and future prospects. Potato Production Worldwide. , 1-18 (2022).
- Barker, K. R., Koenning, S. R. Developing sustainable systems for nematode management. Ann Rev Phytopathol. 36 (1), 165-205 (1998).
- Jones, J. T., et al. Top 10 plant-parasitic nematodes in molecular plant pathology. Mol Plant Pathol. 14 (9), 946-961 (2013).
- Davis, E. L., Hussey, R. S., Baum, T. J. Getting to the roots of parasitism by nematodes. Trend Parasitol. 20 (3), 134-141 (2004).
- Figueiredo, J., Vieira, P., Abrantes, I., Esteves, I. Commercial potato cultivars exhibit distinct susceptibility to the root lesion nematode Pratylenchus penetrans. Horticulturae. 8 (3), 244 (2022).
- Faria, J. M. S., et al. In vitro co-culture of Solanum tuberosum hairy roots with Meloidogyne chitwoodi: Structure, growth and production of volatiles. Plant Cell Tissue Organ Culture. 118 (3), 519-530 (2014).
- Wesemael, W. M. L., Moens, M., Viaene, N., Taning, L. M. Life cycle and damage of the root-knot nematode Meloidogyne minor on potato, Solanum tuberosum. Nematology. 16 (2), 185-192 (2014).
- Subramanian, P., et al. Differential metabolic profiles during the developmental stages of plant-parasitic nematode Meloidogyne incognita. Int J Mol Sci. 18 (7), 1351 (2017).
- Gutierrez-Valdes, N., et al. Hairy root cultures-A versatile tool with multiple applications. Front Plant Sci. 11, 33 (2020).
- Cho, H. J., Farrand, S. K., Noel, G. R., Widholm, J. M. High-efficiency induction of soybean hairy roots and propagation of the soybean cyst nematode. Planta. 210 (2), 195-204 (2000).
- Young, J. M., Kuykendall, L. D., Martínez-Romero, E., Kerr, A., Sawada, H., et al. A revision of Rhizobium Frank 1889, with an emended description of the genus, and the inclusion of all species of Agrobacterium Conn 1942 and Allorhizobium undicola de Lajudie et al. 1998 as new combinations: Rhizobium radiobacter, R. rhizogenes, R. rubi, R. undicola and R. vitis. Int J Syst Evol Microbiol. 51 (1), 89-103 (2001).
- Giri, A., Narasu, M. L. Transgenic hairy roots. Biotechnol Adv. 18 (1), 1-22 (2000).
- Faria, J. M. S., Rusinque, L., Cavaco, T., Nunes, J. C., Inácio, M. L. Essential oil volatiles as sustainable antagonists for the root-knot nematode Meloidogyne ethiopica. Sustainability. 15 (14), 11421 (2023).
- European Mediterranean Plant Protection Organization (EPPO). PM 7/148 (1) Guidelines for the management of nematode collections used for the production and maintenance of reference material. EPPO Bulletin. 51 (3), 507-548 (2021).
- Boisseau, M., Sarah, J. L. In vitro rearing of Pratylenchidae nematodes on carrot discs. Fruits. 63 (5), 307-310 (2008).
- Barbosa, P., et al. Nematicidal activity of phytochemicals against the root-lesion nematode Pratylenchus penetrans. Plants. 13 (5), 726 (2024).
- Santos, P. M., et al. Essential oils from hairy root cultures and from fruits and roots of Pimpinella anisum. Phytochemistry. 48 (3), 455-460 (1998).
- Bertani, G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. J Bacteriol. 62 (3), 293-300 (1951).
- Kumar, A., Forrest, J. M. Reproduction of Globodera rostochiensis on transformed roots of Solanum tuberosum cv. Desiree. J Nematol. 22 (3), 395-398 (1990).
- Schenk, R. U., Hildebrandt, A. C. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Canadian J Botany. 50 (1), 199-204 (1972).
- Figueiredo, A. C. S., Barroso, J. M. G., Pedro, L. M. G., Ascensão, L. . Histoquímica e citoquímica em plantas: princípios e protocolos. Universidade de Lisboa. , (2007).
- Bybd, D. W., Kirkpatrick, T., Barker, K. R. An improved technique for clearing and staining plant tissues for detection of nematodes. J Nematol. 15 (1), 142-143 (1983).
- Coyne, D., Adewuyi, O., Mbiru, E. . Protocol for in vitro culturing of lesion nematodes: Radopholus similis and Pratylenchus spp. on carrot disc. , (2014).
- Faria, J. M. S., Vicente, C. S. L., Rusinque, L., Camacho, M. J., Inácio, M. L. Plant-Nematode co-cultures in the screening of sustainable nematicides against soil-dweling parasitic nematodes of plants. Revista de Ciências Agrárias. 45 (4), 436-439 (2022).
- Faria, J. M. S., et al. In vitro co-cultures of Pinus pinaster with Bursaphelenchus xylophilus: a biotechnological approach to study pine wilt disease. Planta. 241 (6), 1325-1336 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados