Method Article
זיהום in vivo ו-In vitro של שורשי תפוחי אדמה בנמטודות טפיליות צמחיות להערכת שינויים מבניים מושרים
In This Article
Summary
הפרוטוקול מתאר זיהום של שורשי Solanum tuberosum בנמטודות טפיליות של צמחים בתנאי חממה in vivo ושורשים טרנסגניים של תפוחי אדמה במבחנה לניתוח היסטוכימי של מבנה השורשים באמצעות מיקרוסקופיה אופטית.
Abstract
נמטודות טפיליות של צמחים השוכנים בקרקע (PPNs) הן מזיקים חשובים לתפוחי אדמה הגורמים לנגעים ו/או משנים את מבנה שורשי הצמח, מה שמוביל לירידה בכושר היבול ובפרודוקטיביות. מחקר על המנגנונים התאיים והתת-תאיים של זיהום והתפתחות PPN יכול לפנות לצמחי שדה או שתילים בתנאי חממה. מחקרי שדה מייצגים יותר סביבות טבעיות אך נתונים לתנאים סביבתיים בלתי צפויים שיכולים להשפיע מאוד על תוצאות המחקר. מחקרי חממה מאפשרים שליטה גבוהה יותר על משתנים סביבתיים ובטיחות גבוהה יותר מפני מזהמים או פתוגנים. עם זאת, בחלק מהפונדקאים, המגוון הגנטי הופך לגורם חשוב של שונות ומשפיע על התגובה המורכבת של הפונדקאי-טפיל. פיתחנו תרביות מבחנה של שורשים טרנסגניים עם PPNs כחלופה אמינה שתופסת פחות מקום, דורשת פחות זמן להשגה, ונקייה מזיהום או משונות גנטית של המארח. תרבויות משותפות מתקבלות על ידי החדרת PPNs אספטיים לשורשים טרנסגניים במבחנה . ניתן לתחזק אותם ללא הגבלת זמן, מה שהופך אותם לתמיכה מצוינת בשמירת אוספים של PPNs ייחוס. בעבודה הנוכחית, מפורט פרוטוקול לזיהום מבוקר של שורשי תפוחי אדמה in vivo עם נמטודת נגע השורש ולהקמת תרביות משותפות במבחנה של שורשים טרנסגניים של תפוחי אדמה עם נמטודת קשר השורש. התרבויות המשותפות במבחנה סיפקו פרוקסי מעבדתי למצב הזיהום הטבעי של תפוחי האדמה ויצרו שלבי חיים של נמטודות ללא קשר לעונה או לתנאי האקלים. בנוסף, המתודולוגיה המשמשת לניתוח מבני מפורטת באמצעות היסטוכימיה ומיקרוסקופיה אופטית. צבע פוקסין החומצה משמש למעקב אחר אתרי התקפת נמטודות על שורשים, בעוד צביעה דיפרנציאלית עם חומצה תקופתית-שיף (PAS) וכחול טולואידין O מדגישה מבני נמטודות ברקמת השורש הפנימית של תפוחי האדמה.
Introduction
גידולי שורש ופקעות מדורגיםבמקום הרביעי בין מזונות היסוד החשובים ביותר בעולם. תפוח אדמה (Solanum tuberosum L.) הוא אחת הפקעות המעובדות החשובות ביותר. מקורו בהרי האנדים בדרום אמריקה, אך לאחר שהובא לאירופה במאהה-16 הפך במהירות למקור המזון הנפוץ ביותר עבור אוכלוסייה בעלת הכנסה נמוכה יותר. כיום, תפוחי אדמה מהווים 1.7% מצריכת הקלוריות בעולם1. ייצור היבולים מושפע מאוד ממזיקים ופתוגנים צמחיים, מתוכם נמטודות טפיליות צמחיות (PPNs) עלולות לגרום לאובדן יבול ממוצע שעולה עד 12%2. נמטודות טפיליות של צמחים אחראיות לכמה מהמחלות המזיקות ביותר ליבולים בחקלאות המודרנית. PPNs שוכני קרקע מטילים הפסדים כבדים לחקלאים מכיוון שהם משפיעים על שורשי הצמחים ומפריעים לפריון היבול על ידי הפחתת הייצור ו/או פגיעה במוצרים, מה שהופך אותם לבלתי סחירים3. הפיטופרזיטים המסוכנים האלה משתמשים בסטילט שלהם (חלק פה דמוי מחט) כדי לנקב תאי שורש ולהזין את תכולת התאים. חלק מה-PPN ניזונים מחוץ לשורשים, אחרים נכנסים לשורש וגורמים לנזק לרקמות (נודד), בעוד שאחרים נכנסים לשורשים והופכים לישיבה, ומשנים מאוד את מבנה השורש כדי להקלעל הזנה. ה-PPNs העיקריים המשפיעים על תפוחי האדמה הם נמטודות ציסטה של תפוחי אדמה, Globodera spp., נמטודות קשרי שורש (RKN), Meloidogyne spp., נמטודות נגע שורש, Pratylenchus spp., נמטודת קשר שורש כוזבת Nacobbus aberrans, ונמטודת ריקבון תפוחי האדמה Ditylenchus destructor. עבור PPNs אלה, הרגלי אכילה שונים גורמים לשינויים מבניים שונים ברקמות השורש המארח 5,6. מחקר על מנגנוני זיהום PPN ותגובת המארח מבוצע לעתים קרובות באמצעות ניסויי שדה או חממה כדי לשמור על אוספי תרביות PPN ייחוס או לבצע ניסויים בקנה מידה גדול 7,8. בדיקה בתנאים טבעיים מושפעת מאוד משונות סביבתית ומגורמי לחץ ביוטיים או אביוטיים. בדיקות ביולוגיות של חממה הן אלטרנטיבה קרובה יותר למצב טבעי תוך מתן שליטה יחסית בשונות הסביבתית והגבלת ההשפעה של לחץ אביוטי וביוטי. עם זאת, המגוון הגנטי של המארח עדיין יכול להוות אתגר לניסויים הדורשים שליטה עדינה יותר בשונות הביולוגית. ניתן להתגבר על מגבלות אלו על ידי שימוש בתרביות רקמת צמחים במבחנה. אלו הן מערכות מעבדה רב-תכליתיות עם יתרונות רבים לחקר מחלת PPNs. עבור PPNs שוכני אדמה, תרביות מבחנה של שורשים טרנסגניים הן כלי שימושי למחקר בתנאי מעבדה 9,10.
שורשים טרנסגניים, או שורשים שעירים (HR), מתקבלים לאחר הדבקה של חומר צמחי בריזוביום ריזוגנס (Riker et al. 1930) Young et al. 200111. חיידק גרם שלילי זה גורם להעברה של פלסמיד ה-Ri שלו לגנום המארח ומשנה את הוויסות של ביוסינתזה של הורמונים צמחיים, ומקדם את היווצרות רקמת השורש12. ניתן לשמור על שורשים טרנסגניים ללא הגבלת זמן תחת אספסיס במדיום תרבותי. היתרונות של שימוש ב-HR לחקר PPNs הם קצב גידול גבוה בהיעדר מווסתי גדילה של צמחים המשפיעים על זיהום והתפתחות נמטודות, יחס גבוה של ייצור ביומסה ליחידת זמן, ושלמות תאית ואריכות ימים, הקובעים יציבות גנטית וביוכימית גבוהה יותר6. על ידי שימוש בשורשים טרנסגניים במבחנה, ניתן לשמור על גנוטיפים של PPNs ללא הגבלת זמן בתנאי מעבדה, לעקוב בקלות אחר זיהום והתפתחות PPNs, להפחית את השונות הגנטית של המארח, ניתן לקשר ישירות מניפולציה של ההרכב המולקולרי של המארח לתגובת הנמטודה, וניתן לעקוב בצורה מדויקת יותר אחר שינויים מבניים של מארח וטפיל 6,13. למחקרים על מחלות PPN של תפוחי אדמה, תרביות שורש טרנסגניות במבחנה מאפשרות ביצוע ניסויים ללא תלות בעונה או בתרדמת פקעת תפוחי אדמה.
בפרוטוקול זה מפורטת המתודולוגיה המסורתית של תחזוקת PPNs וזיהום in vivo של צמחי תפוחי אדמה. לניתוח מבני של שורשים נגועים, מפורטת גם מתודולוגיה משופרת המבוססת על הקמת תרביות משותפות במבחנה של שורשי תפוחי אדמה טרנסגניים עם PPNs כחלופה המאפשרת שליטה גבוהה יותר בשונות הגנטית הסביבתית והמארח. כדי לעקוב אחר זיהום והתפתחות PPNs ברקמת השורש, נעשה שימוש בהיסטוכימיה כדי לסייע בתצפית PPNs במיקרוסקופיה אופטית. המטרה הכוללת של פרוטוקול זה היא לייעל את המחקר של אינטראקציות PPN-מארח, להבטיח תנאים מבוקרים וניתנים לשחזור יותר לניסויים תוך הקלה על ניתוחים מבניים והתפתחותיים מפורטים של נמטודות ברקמת השורש.
Protocol
1. זיהום של צמחי תפוחי אדמה שגדלו בחממה
הערה: ניסויי חממה מבוצעים עם השעיות של PPNs בשלבי חיים מעורבים או צעירים בשלב שני (J2), בהתאם למחזור החיים הספציפי של מזיק ה-PPN. עבור פרוטוקול זה, נעשה שימוש בתרחיפים של שלבי חיים מעורבים של נמטודת נגע השורש (RLN) Pratylenchus penetrans . ניתן לגדל PPN במעבדה או לבקש ממעבדות ייחוס מוסמכות.
- כפל ותחזוקה של נמטודות נגע שורש
הערה: דיסקי גזר מעוקרים משמשים להכפלה ותחזוקה של RLNs14. השתמש בגזר שנרכש באופן מסחרי (var. Nice) ללא נזק נראה לעין כדי להפחית את הזיהום המיקרוביאלי. רצוי שהם יהיו נקיים מחומרי הדברה כדי למנוע עיכוב בהתפתחות RLN.- שטפו את הגזר במי ברז זורמים כדי להסיר פסולת גדולה יותר, ולאחר מכן, עם תמיסת ניקוי נפוצה (טיפה אחת לכל 40 מ"ל מים) כדי להסיר פסולת עדינה יותר. יבש עם מגבות נייר מעבדה.
- מתחת לאפסיס, במכסה המנוע האנכי, הכנס שיפוד מתכת מעוקר בחלק העליון של הגזר (1 עד 2 ס"מ פנימה) כך שניתן יהיה להחזיק אותו ביתר קלות.
- בעזרת בקבוק כביסה עם זרבובית, הרטיבו את הגזר באתנול 96% (v/v). כתם את הקצה התחתון של הגזר בנייר פילטר מעוקר וקח אותו בזהירות ללהבה.
זהירות: שימו לב שאתנול נדלק חזק, אז עמדו במרחק. - מקלפים את הגזר מלמעלה למטה בעזרת קולפן סטרילי ואז חוזרים על השלב הקודם. השליכו את החלקים העליונים והתחתונים (2 ס"מ פנימה) והניחו את החלק האמצעי של הגזר בצלחת פטרי סטרילית (קוטר 150 מ"מ). בעזרת להב סטרילי ופינצטה, חותכים בזהירות חלקים בעובי 1 ס"מ מהחלק בקוטר של כ-2 ס"מ של הגזר (איור 1).
- העבירו את החלקים לצלחות פטרי סטריליות (קוטר 60 מ"מ) ואטמו את הגבול בסרט שקוף. בעזרת אור UV, עקרו את פני דיסקי הגזר למשך 60 דקות מכל צד.
- שמור בטמפרטורה של 25 מעלות צלזיוס למשך 1-2 שבועות בחושך והשליך את כל דיסקי הגזר שמתחילים להראות סימנים של זיהום מיקרוביאלי15.
הערה: סימנים גלויים לזיהום הם השחמה מוגזמת (ריקבון), הצטברות נוזלים בגבול התחתון של דיסק הגזר או צמיחת תפטיר פטרייתי על פני השטח. - דיסקי הגזר הנותרים מוכנים להידבק במתלי RLN. התחל בביצוע חתך בצורת X במרכז דיסק הגזר באמצעות להב סטרילי. הקפידו לחתוך רק באמצע הדרך.
- חיסון ה-RLN על ידי פיפטינג של 50 מיקרוליטר של תרחיף המכיל לפחות 50 שלבי חיים מעורבים במרכז הפצע בצורת X. סוגרים את צלחת הפטרי ואטומים את הגבול בניילון שקוף כדי למנוע התייבשות.
- קבע את המספר הממוצע של נמטודות בתרחיף על ידי ספירת חמש אליקוטות של 50 מיקרוליטר תחת סטריאומיקרוסקופ דו-עיני (40x) בטמפרטורת החדר בשקופית קעורה. הגדר את ההשעיה של RLNs מעורבים בשלב החיים ל-1000 למ"ל על ידי הוספת מים לתרחיף או המתנה לנמטודות להתיישבות (כ-60 דקות) והורדת הנפח על ידי סילוק המים העיליים.
- שמור את דיסקי הגזר בטמפרטורה של 25 מעלות צלזיוס, בחושך, עד 3 חודשים ועקוב מדי שבוע תחת סטריאומיקרוסקופ דו-עיני לאיתור סימנים לנגעים נמקיים, כתוצאה מגידול אוכלוסיית RLN.
הערה: ניתן לאחסן דיסקי גזר טפיליים בהצלחה ב-11 מעלות צלזיוס לשימוש מאוחר יותר עד חודשיים, אך בדוק באופן קבוע אם יש זיהום מיקרוביאלי. דיסקיות גזר טפיליות המראים סימנים של זיהום מיקרוביאלי חייבות להיות מטוהרות על ידי חיטוי לפני השלכתן. - מתחת למכסה המנוע, חלץ RLNs על ידי העברת דיסקי גזר עם נמק רקמה גלוי באתר החיסון (איור 1) לקוטר 8 ס"מ ומסננת רשת של 75 מיקרומטר המונחת בקערת זכוכית סטרילית. השאירו מרווח קטן של 1 ס"מ בין תחתית המסננת לקעור הקערה כדי לאסוף את ה- RLNs.
הערה: בהיעדר מסננת שנרכשה מסחרית, ניתן ליצור מצינור פלסטיק בקוטר 8 ס"מ / פלסטיק יציבה וגזה רשת הדוקה. השתמש בגומיות כדי להדק את הגזה לצינור הפלסטיק או לכוס. - יוצקים תמיסת אנטיביוטיקה למסננת עד שדיסקי הגזר מכוסים ושומרים למשך 12 שעות (לילה) בחושך. ה-RLNs יוצאים מדיסקיות הגזר ומתיישבים בתחתית הקערה. יש להכין את תמיסת האנטיביוטיקה באופן זמני עם המיצוי על ידי הוספת 50 מיקרוגרם/מ"ל כל אחד של קנמיצין וקרבניצילין במים מזוקקים מעוקרים16.
הערה: תמיסות מלאי אנטיביוטיקה מוכנות ב-50 מ"ג/מ"ל על ידי המסת 0.5 גרם קנמיצין מונוסולפט או 0.5 גרם קרבניצילין דיסודיום כל אחד ב-10 מ"ל מים מזוקקים מעוקרים. תמיסות מלאי מסוננות (רשת μm 0.22) במכסה הזרימה וניתן לשמור אותן בטמפרטורה של -20 מעלות צלזיוס עד שנה. - הסר את המסננת, השתמש בפיפטה מזכוכית מעוקרת כדי לשאוב את ה-RLNs מתחתית הקערה לתוך גוש כתמים מזכוכית מעוקרת (4 ס"מ על 4 ס"מ על 1 ס"מ), ושטוף על ידי פיפטינג של 1 מ"ל של תמיסת אנטיביוטיקה. המתן 30 עד 40 דקות עד שהנמטודות ישקעו לפני איסוף תמיסת האנטיביוטיקה המשומשת. חזור על הכביסה הזו 4x-5x.
- השתמש מיד בתרחיף המימי עם ה-RLNs או שמור אותו ב-11 מעלות צלזיוס לתקופת אחסון ארוכה יותר (עד חודשיים).
- זיהום in vivo של צמחי תפוחי אדמה עם PPNs
הערה: כדי לגדל צמחי תפוחי אדמה רגישים (S. tuberosum var. Désirée), יש לרכוש תפוחי אדמה זרעים מוסמכים מסוחרי חקלאות בין ינואר למרץ. בחר תפוחי אדמה זרעים מוסמכים מכיוון שהם נמכרים עם דרכון פיטוסניטרי, מה שמבטיח שהם אינם מזוהמים בפיטופרזיטים בהסגר. כאמצעי זהירות, ניתן לבצע שלב ראשוני של חיטוי בתמיסת אקונומיקה של 10% ואחריו שטיפה במי ברז זורמים כדי להבטיח חיטוי של משטח פקעת תפוחי האדמה. תפוחי אדמה ממוסחרים נפוצים אינם מומלצים מכיוון שהטיפולים המוטלים להפחתת הנביטה והמרץ עלולים להפריע לצמיחת תפוחי האדמה ולתגובה לזיהום.- בחר פקעות תפוחי אדמה בגודל זהה והשליך את אלה עם חורים, חבורות או חלקים רכים יותר. הסר בעדינות את כל הנבטים הגדלים (1 מ"מ) לפני הזריעה כדי לסנכרן את הנביטה.
הערה: במידת הצורך, יש לאחסן את תפוחי האדמה במקום מאוורר היטב, יבש וחשוך לפני הזריעה. - ממלאים סירים של 5 ליטר (22 ס"מ על 18 ס"מ) בתערובת 1:1 של אדמה חיטוי וחול גס דק מעורבב עם 22.5 גרם דשן NPK בשחרור איטי (12-12-12) וזורעים את תפוחי האדמה בגובה 9 ס"מ מתחת לפני האדמה.
הערה: יש לנפות אדמה וחול כדי להסיר פסולת גדולה מ-2 מ"מ, לבצע חיטוי פעמיים ב-121 מעלות צלזיוס למשך 15 דקות, ולייבש ב-100 מעלות צלזיוס למשך יום עד יומיים, עם ערבוב תכוף. יש לאוורר במשך 7-10 הימים הבאים על ידי ערבוב תכוף, לפני השימוש. - שמור את העציצים בחממה בתנאים לחים (50%-70% לחות) ומים לעתים קרובות (שמור על האדמה ב-70% יכולת החזקת מים מקסימלית), הימנע מקיצוניות בטמפרטורה, עד שיורה של צמח תפוחי אדמה מתחיל לצוץ על פני האדמה.
- לאחר הופעת הצמח, השתמש בתרחיפים RLN טריים כדי להדביק את שורשי תפוחי האדמה. התחל ביצירת 4 עד 6 חורים (ברוחב 1 ס"מ) המפוזרים באופן שווה סביב הצמח לעומק הזרע.
- פיפטה באופן שווה תרחיף של 8 מ"ל של 30,000 RLNs חיים בשלב החיים המעורבים לתוך החורים, כך שהחיסון יהיה ביחס של 4 RLNs חיים לכל גרם של תערובת אדמה, ולכסות בתערובת אדמה. עבור העציצים עם RLNs, מנע השקיה ביום החיסון.
הערה: RLNs נספרים תחת סטריאומיקרוסקופ (פי 40). נמטודות מתות אינן זזות ובעלות צורה מורחבת, בעוד שנמטודות חיות בדרך כלל נעות (צורה לא מורחבת). הדחיפה הפיזית משמשת כדי לברר את התמותה. - שמור את הסירים למשך חודשיים בתנאים שתוארו לעיל (איור 2). לאחר מכן, עקרו את צמחי תפוחי האדמה ושקלו את הקלעים והשורשים בנפרד.
- שטפו בזהירות את מערכת השורשים לפני בדיקת המיקום של אתרי התקפת RLN באמצעות טכניקות צביעה5.
- בחר פקעות תפוחי אדמה בגודל זהה והשליך את אלה עם חורים, חבורות או חלקים רכים יותר. הסר בעדינות את כל הנבטים הגדלים (1 מ"מ) לפני הזריעה כדי לסנכרן את הנביטה.
2. הקמת תרבויות משותפות במבחנה של שורשים טרנסגניים של תפוחי אדמה עם PPNs
- הקמת in vitro שורשים טרנסגניים של תפוחי אדמה
הערה: עבור פרוטוקול זה, השתמשנו ב- Rhizobium rhizogenes נושא את gus גן מדווח משולב בפלסמיד Ri ומונע על ידי מקדם כפול 35S (A4pRiA4::70GUS)17. ניתן לרכוש חיידקים ממקורות מסחריים או לבקש ממעבדות ייחוס מוסמכות.- כדי להשיג חיידקים בשלב הגידול האקספוננציאלי, מורחים צלחת R. rhizogenes בצלחת בינונית מוצקה של Luria-Bertani (LB)18 ושומרים למשך הלילה ב-26 מעלות צלזיוס.
הערה: ניתן לרכוש מדיום LB באופן מסחרי או להכין אותו במעבדה על ידי הוספת 10 גרם/ליטר פפטון, 5 גרם/ליטר תמצית שמרים, 10 גרם/ליטר NaCl ו-15 גרם/ליטר אגר ולאחר מכן עיקור בקיטור למשך 15 דקות ב-121 מעלות צלזיוס. - בעזרת לולאת חיסון, בחר מושבה וחסן 10 מ"ל מרק LB נוזלי (מדיום LB ללא אגר) בבקבוק סטרילי של 50 מ"ל. יש לשמור למשך הלילה בחושך בטמפרטורה של 26 מעלות צלזיוס תחת ערבוב (180 סל"ד).
- מדוד את ספיגת התרבות הנוזלית עד ש- A600 מגיע ל -0.6. בשלב זה, החיידקים נמצאים בשלב הגידול האקספוננציאלי ומשמשים לחיסון החומר הצמחי.
- החיסון מתבצע בפקעות תפוחי אדמה טריות אספטיות. כדי לעקר את פני פקעות תפוחי האדמה, התחל בשטיפה במי ברז זורמים כדי להסיר פסולת גדולה יותר, ולאחר מכן עם תמיסת ניקוי נפוצה (טיפה אחת לכל 40 מ"ל מים), עם תסיסה נמרצת, כדי להסיר את הפסולת העדינה יותר.
הערה: בחר זן תפוחי אדמה עם רגישות ידועה ל-PPN בשימוש. עבור פרוטוקול זה, השתמשנו ב-S. tuberosum var. Désirée. - מניחים את הפקעות במיכל, מכסים בתמיסת אקונומיקה מסחרית (1:4, אקונומיקה מסחרית במי ברז) וסוגרים. יש לערבב במשך 15 דקות, להשליך את תמיסת האקונומיקה ולשטוף 3 פעמים במי ברז מעוקרים.
- במכסה המנוע, טבלו את הפקעות בתמיסת אתנול (80%, v/v) למשך 15 דקות בתסיסה נמרצת, השליכו את האתנול ושטפו 3x במי ברז מעוקרים.
- בעזרת אזמל סטרילי, הסר את החלקים ההיקפיים של הפקעות (כ-50% מהפקעת מהמשטח פנימה), וחתך את החלק המרכזי הפנימי למקטעים בעובי 0.5 ס"מ19. יש לחסן מיד עם תרחיף החיידקים שהוכן בשלב 2.1.3.
- לחיסון, יש לדלל את תרחיף החיידקים על ידי הוספת 1 מ"ל של תרחיף חיידקי ל-9 מ"ל של מדיום שנק והילדברנדט20 (SH) בתוספת 30 גרם/ליטר סוכרוז ב-pH = 5.6. טובלים את קצה האזמל הסטרילי בתרחיף המדולל ופוצעים את פני פלח תפוחי האדמה. חזור על שלב זה פי 5 עבור כל פלח תפוחי אדמה.
- יבש את מקטעי הלחות העודפת בנייר סינון סטרילי למשך דקה אחת, הנח אותם במדיום SH מוצק למחצה (מדיום SH עם 30 גרם/ליטר סוכרוז, 8 גרם/ליטר אגר, pH = 5.6) ושמור בחושך ב-25 מעלות צלזיוס כדי שתתרחש טרנספקציה של פלסמיד.
- לאחר 3 ימים, העבירו את המקטעים הנגועים לצלחות של מדיום SH מוצק למחצה בתוספת 150 מיקרוגרם/מ"ל של כל אחד מהספוטקסים והקרבניצילין של האנטיביוטיקה. יש לשמור מעל 3 חודשים עם חידוש בינוני שבועי כדי להבטיח את חיסול החיידקים.
הערה: ניתן להכין תמיסת מלאי Cefotaxime ב-100 מ"ג/מ"ל על ידי המסת 1 גרם נתרן cefotaxime ב-10 מ"ל של מים דה-מינרליים סטריליים וסינון (רשת 0.22 מיקרומטר) מתחת למכסה המנוע. ניתן לשמור אנטיביוטיקה בטמפרטורה של -20 מעלות צלזיוס עד שנה. - לאחר 3 חודשים, צמיחת שורשים טרנסגנית היא נרחבת. העבירו את השורשים למדיום SH טרי ומוצק למחצה ללא אנטיביוטיקה על ידי איסוף גוש שורש של 1 גרם עם קצות פינצטה סטרילית והנחתו במרכז מדיום התרבית בצלחת חדשה (איור 3).
הערה: כחודש לאחר ההדבקה, מופיעות מסות קטנות של צמיחת תאים על פני השטח של פלח תפוחי האדמה, משם מתחילים להתפתח השורשים הטרנסגניים6. הקפד לשמור אותם בקשר עם מדיום התרבות אחרת הם עלולים להתייבש. - כדי להבטיח יציבות גנטית ומטבולית, שמור על שורשים טרנסגניים תחת שגרת תת-תרבית חודשית (כמתואר בשלב 2.1.11.) ב-25 מעלות צלזיוס בחושך במשך למעלה משנה לפני הדבקה ב-PPNs.
הערה: ודא שלפחות שישה שכפולים נשמרים בכל שלב של הפרוטוקול מכיוון שלעתים קרובות מתרחש זיהום מיקרוביאלי לא רצוי. לאחר הקמתה, צלחת תרבית משותפת אחת יכולה לשמש כחיסון למספר תרבויות משותפות חדשות; עם זאת, הקפד לשמור לפחות שש צלחות משוכפלות.
- כדי להשיג חיידקים בשלב הגידול האקספוננציאלי, מורחים צלחת R. rhizogenes בצלחת בינונית מוצקה של Luria-Bertani (LB)18 ושומרים למשך הלילה ב-26 מעלות צלזיוס.
- הקמת תרביות מבחנה של שורשי תפוחי אדמה מהונדסים עם PPNs
הערה: כדי להשיג תרביות משותפות של שורשים טרנסגניים עם PPNs, תהליך עיקור הנמטודות הוא קריטי. עבור הפרוטוקול הנוכחי השתמשנו בצעירים בשלב השני של נמטודת קשר השורש בהסגר Meloidogyne chitwoodi. ניתן להשיג חיסון נמטודה ממעבדות עיון מוסמכות בצורה של עפצי שורש.- תחת סטריאומיקרוסקופ דו-עיני (20x), בודדו מסות ביצי נמטודה מעפצי השורש בעזרת פינצטה סטרילית עדינה במיוחד. מניחים המוני ביצים בצלחת פטרי מכוסה עם 5 מ"ל מי ברז סטריליים ונותנים לביצים לבקוע במשך 48 שעות. הגדר את מתלה J2 ל-100 נמטודות למ"ל.
- במכסה המנוע, פיפטה 5 מ"ל של מתלה המכיל 500 J2 למסננת סטרילית של רשת 20 מיקרומטר ושטוף במי ברז סטריליים.
- טבלו את המחצית התחתונה של המסננת המכילה את ה-J2s בתמיסה של 20% מי חמצן (H2O2), וערבבו ידנית בתנועה סיבובית למשך 15 דקות.
- שטפו את ה-J2s הסטריליים על ידי הוצאת מי ברז סטריליים דרך המסננת. חזור על שלב זה 3 פעמים. בכביסה הסופית, הטה את המסננת כך שהנמטודות יתאספו בגבול המסננת. שחזר את תרחיף הנמטודה הסטרילית על ידי פיפטינג של 1 מ"ל מים סטריליים אולטרה-טהורים בגבול המסננת, ואחסן בטמפרטורה של 11 מעלות צלזיוס או השתמש מיד.
הערה: ניתן להעריך את הצלחת העיקור על ידי ציפוי של 100 מיקרוליטר של תרחיף הנמטודה במדיום SH וניטור קבוע, במשך שבוע, לזיהום. - במכסה הזרם, תת-תרבית גוש של 1 גרם של שורשים טרנסגניים של תפוחי אדמה (כמתואר בשלב 2.1.11.) על לוחות SH עם 100 נמטודות סטריליות (100 מיקרוליטר של תרחיף עם 1000 J2s למ"ל). לאחר שבועיים עד שלושה מתחילים להופיע עפצים קטנים בשורשים החדשים.
- עקבו אחר התרבות המשותפת באופן קבוע תחת מיקרוסקופ הפוך (פי 100), וכאשר מסת הביצים מתחילות להיות מורגשות, תת-תרבית לצלחת בינונית SH מוצקה למחצה חדשה, וודאו שהעפצים נלקחים עם גוש השורש (איור 4). שמרו על תרבויות משותפות תחת שגרת תת-תרבויות חודשית בטמפרטורה של 25 מעלות צלזיוס בחושך.
3. ניתוח מבני של זיהום PPNs
הערה: כדי לעקוב אחר שינויים שנגרמו על ידי PPNs במבנה רקמת השורש, נעשה שימוש בטכניקות צביעה היסטוכימיות כדי להנגיד רקמות עם הרכבים כימיים שונים. צביעה דיפרנציאלית מתבצעת במסות שורשים או בקטעים דקים של חומר שורש קבוע, כאשר צבעים ספציפיים מגיבים עם רקמת המטרה בהתאם לזיקתם הכימית21. עבור הפרוטוקול הנוכחי, השתמשנו בפוקסין חומצי, או מגיב חומצה תקופתי (PAS) בשילוב עם צבעי O כחולים טולואידין לצביעה דיפרנציאלית.
- התפלגות נמטודות טפיליות צמחיות בשורשים מוכתמים בפוקסין חומצי
הערה: כדי לעקוב אחר התפלגות ה-PPN בכל מערכת השורשים, משתמשים בפוקסין חומצי כדי לצבוע את רקמת שריר הנמטודה בגוון אדום5.- התחל בשטיפת מערכת השורשים מתחת למי ברז זורמים למשך 5 דקות כדי להסיר כל פסולת אדמה (שורשי צמחים in vivo ) או שאריות של מדיום התרבות (שורשים טרנסגניים במבחנה ). השתמש באצבעותיך בתנועה סיבובית כדי לסייע בניתוק האדמה ממערכת השורשים.
- חותכים את מערכת השורשים לחלקים באורך 1 עד 2 ס"מ ומניחים אותה בתוך של 150 מ"ל. יש להוציא 70 מ"ל של תמיסת נתרן היפוכלוריט (NaOCl) של 1.5% ולערבב במרץ במשך 4 דקות לניקוי רקמות השורש. לאחר מכן, השליכו את תמיסת ה-NaOCl, שטפו את השורשים במי ברז זורמים והשרו למשך 15 דקות במים דה-מינרליים כדי להסיר שאריותNaOCl 22.
הערה: אקונומיקה כלור מכילה מינימום של 5.25% NaOCl, לכן הוסף 20 מ"ל אקונומיקה כלור ל-50 מ"ל מים כדי לקבל תמיסת NaOCl של 1.5%. עבור חומר רך יותר (למשל, רקמה רכה יותר של שורשים צעירים או של שורשים טרנסגניים שגדלו במבחנה ) השתמש בתמיסת NaOCl של 0.9%, בעוד שעבור חומר קשה יותר (שורשים ישנים יותר) נעשה שימוש בתמיסת NaOCl של 2.0%. - מסננים את השורשים המנוקים ומניחים אותם על זכוכית בורוסיליקט עם 30 מ"ל מים דה-מינרליים. פיפטה 1 מ"ל תמיסת כתם פוקסין חומצה, מערבבים ידנית ומרתיחים 30 שניות על פלטה חמה. תנו לכוס הזכוכית להתקרר, נקזו את התמיסה ושטפו את השורשים המוכתמים במי ברז זורמים.
הערה: תמיסת כתם פוקסין חומצה מיוצרת על ידי המסת 3.5 גרם אבקת צבע פוקסין חומצה ב-250 מ"ל חומצה אצטית והוספת 750 מ"ל מים דה-מינרליים. לאחר הצביעה תמיד מגיע שלב מניעה כדי להסיר כתמים עודפים שאינם בשימוש ולשפר את ניגודיות הדגימה. - הימנעו על ידי הוספת 10-30 מ"ל גליצרין מחומצן עם כמה טיפות של HCl (5N)13.
- התבונן תחת הסטריאומיקרוסקופ או המיקרוסקופ ההפוך כדי להעריך בערך היכן במבנה השורש ה-PPNs תוקפים באופן מועדף (איור 5 ואיור 6).
- הערכת מורפולוגיה של תאי שורש עם חומצה תקופתית-שיף (PAS)/כחול טולואידין O
הערה: ניתן להעריך את ההשפעה של זיהום PPNs או נזק למורפולוגיה של תאי שורש תחת המיקרוסקופ על ידי קיבוע, חתך וצביעה דיפרנציאלית של שורשי תפוחי אדמה נגועים.- בבקבוקון דגימה סגור, תקן חומר שורש טרי עם 2.5% גלוטרלדהיד, שהוכן במאגר נתרן פוספט 0.1 M, ב-pH 7.2, למשך 24-48 שעות, בטמפרטורת החדר6.
אזהרה: גלוטרלדהיד רעיל. הימנע משאיפה ומגע. השתמש במעיל מעבדה מגן וכפפות ועבוד במכסה אדים. יש לסגור בקבוקונים לדוגמה אלא אם כן בשטיפה או בהליכי ואקום. השלך גלוטרלדהיד בהתאם לכללי נהלי פסולת מסוכנת. שלבים 3.2.1 עד 3.2.5 מבוצעים במכסה אדים כדי למנוע שאיפת ריאגנטים.
הערה: להכנת 1 ליטר של מאגר נתרן פוספט, pH 7.2, הוסף 68.4 מ"ל של 1M Na2HPO4 (141.96 גרם בתמיסה של 1 ליטר) ל-31.6 מ"ל של 1M NaH2PO4 (119.98 גרם בתמיסה של 1 ליטר) ומלא עד 1 ליטר על ידי הוספת 900 מ"ל מים דה-מינרליים. כדי לסייע בחדירה של הקיבוע, הנח את בקבוקוני הדגימה הלא מכוסים עם חומר שורש מתחת לוואקום נמוך (26 מ"מ כספית) למשך 2 דקות בחומר ייבוש המחובר למשאבת ואקום. - בעזרת פיפטת פסטר מזכוכית, השליכו את התמיסה המקובעת ושטפו שורשים קבועים עם מאגר נתרן פוספט (פי 3).
- התחל לייבש בהדרגה את רקמת השורש המקובעת על ידי החלפת המאגר בתמיסת אתנול של 10% (v/v) למשך 15 דקות. לאחר מכן, החליפו בתמיסת אתנול של 20% באמצעות פיפטת זכוכית, ושמרו על השורשים מוטבעים למשך 15 דקות. המשך ברצף המדורג של הגדלת ריכוזי האתנול (30%, 40%, 50%, 60%, 70%, 80% ו-90% למשך 15 דקות כל אחד) עד לשלב האתנול הטהור, שם יש לשמור את השורשים למשך שעה.
- הטמיעו את השורשים המיובשים בהדרגה בשרף (2-הידרוקסיאתיל מתאקרילט). בעזרת פיפטת זכוכית, החלף את האתנול הטהור בתמיסת אתנול/שרף 3:1 (v/v) ושמור למשך 24 שעות ב-4 מעלות צלזיוס. עקוב אחר זה עם תמיסות אתנול/שרף 1:1 ו-1:3 (v/v), כל אחת עם תקופת דגירה של 24 שעות ב-4 מעלות צלזיוס. לאחר מכן החלף את תמיסת ה-1:3 (v/v) בשרף טהור בתוספת דיבנזואיל פרוקסיד (1%) כיוזם פילמור.
- הניחו את הדגימות במגש תבנית שרף, הוסיפו תערובת שרף: דימתיל סולפוקסיד 15:1 (v/v), ושמרו בטמפרטורה של 60 מעלות צלזיוס על פלטה חמה למשך 48 שעות כדי שהשרף יתקשה.
- הניחו את הדגימות הספוגות במיקרוטום סיבובי המצויד בסכין טונגסטן ופרסו חלקים של 2-5 מיקרומטר על שקופיות זכוכית, לפי הוראות היצרן.
- התחל את הצביעה הדיפרנציאלית על ידי טבילת השקופיות למשך 10 דקות בצנצנת צביעה מזכוכית עם תמיסת 15% 2,4-dinitrophenylhydrazine בחומצה אצטית, בטמפרטורת החדר. לאחר מכן יש לשטוף בזהירות מתחת למי ברז זורמים למשך 15 דקות ולייבש בתנור בחום של 60 מעלות צלזיוס (15 דקות).
- לאחר מכן, טבלו את המגלשות בחומצה תקופתית (1%) למשך 10 דקות, ולאחר מכן שטפו תחת מי ברז זורמים למשך 5 דקות והשאירו לייבוש בתנור בחום של 60 מעלות צלזיוס (15 דקות).
- טבלו את השקופיות במגיב של שיף (המורכב מ-1% פרוסאנילין ו-4% נתרן מטאביסולפיט, בחומצה הידרוכלורית של 0.25 M), למשך 30 דקות. לאחר מכן, שטפו עם תמיסת נתרן מטאביסולפיט (0.5%) בחומצה הידרוכלורית (0.05 מ'), למשך 2 דקות. לבסוף שוטפים במי ברז זורמים למשך 5 דקות, ומייבשים בטמפרטורת החדר.
- לעומת זאת, יש לצבוע על ידי טבילת השקופיות ב-0.05% טולואידין כחול O למשך 15 דקות, שטיפה במי ברז זורמים למשך 15 דקות וייבוש בתנור בחום של 60 מעלות צלזיוס (15 דקות).
- התבוננו תחת מיקרוסקופ (100x) המצויד בחומרת לכידת תמונה (איור 7).
- בבקבוקון דגימה סגור, תקן חומר שורש טרי עם 2.5% גלוטרלדהיד, שהוכן במאגר נתרן פוספט 0.1 M, ב-pH 7.2, למשך 24-48 שעות, בטמפרטורת החדר6.
תוצאות
ניתן להשתמש בדיסקי גזר כדי להכפיל ולתחזק מספר סוגים של PPNs נודדים23. עבור RLN, טכניקה זו משמשת בדרך כלל לשמירה על אוספי ייחוס של מיני נמטודות או מבודדים. באמצעות דיסקיות גזר ניתן להשיג גידול ממוצע של פי 100 באוכלוסיות הנמטודות בתקופה של 3 חודשים (איור 1). עם זאת, מספרי הנמטודות משתנים מאוד (בין פי 30 ל-200x), בעיקר בשל המגוון הגנטי של הנמטודות ו/או השונות בתכולת התזונה של הגזר. כמו כן, למרות מספר אמצעי מניעה המשמשים להפחתת זיהום מיקרוביאלי, 20% עד 30% מדיסקי הגזר עלולים להזדהם, לכן הקפידו להכין יותר צלחות מהנדרש.
בצמחי תפוחי אדמה, נוכחות של RLNs לא תמיד גורמת לתסמינים נראים לעין, מאחר שהם תלויים מאוד במספר אוכלוסיית הטפילים שתוקפים את מערכת השורשים (איור 2). עבור P. penetrans, חיסון ראשוני של 4 RLNs/g של אדמה יכול לבנות עד 2000 RLNs/g של שורש ו-750 ביצים/גרם של שורש לאחר חודשיים, מה שגורם לירידה של כמעט 30% במשקל השורש5.
תרביות שורש שעירות תפוחי אדמה הן מערכת תפוקה גבוהה לחקר מחלות הקשורות לשורש בהקשר מעבדתי. לשורשים הטרנסגניים של תפוחי האדמה שהוקמו יש קצב גידול ספציפי של 300 מ"ג משקל טרי של שורש לליטר מדיום SH ליום וזמן הכפלה של 2.6 ימים6 (איור 3). בתרבית משותפת עם M. chitwoodi, הפרמטרים האלה מושפעים מעט מכיוון שהנמטודות ניזונות מרקמת השורש וגורמות לשקע אנרגיה. עבור התרביות המשותפות, ניתן להשיג קצב גידול ספציפי של 200 מ"ג משקל טרי של שורש לליטר מדיום SH ליום וזמן הכפלה של 3 ימים6. מספר הנמטודות שפותחו יכול לעלות עד 1200 J2s לגרם של שורש טרנסגני של תפוחי אדמה במשקל טרי, וכמות הביצים יכולהלהיות גבוהה פי 4 6,13 (איור 4). בהשוואה לבדיקות באדמה מצמחי עגבניות נגועים ב-RKN שגודלו בחממה, היבול הגבוה ביותר לאוכלוסיות נמטודות היה רק מחצית מזה של שורשים טרנסגניים לגרם חומר שורש (נתונים שלא פורסמו). עם זאת, ידוע כי גידול אוכלוסיית RKN תלוי במידה רבה במיני צמחים מארחים ואפילו במגוון. אף על פי כן, מבחינה מורפולוגית, הנמטודות שגודלו בשורשים טרנסגניים אינן מראות הבדל מהותי מאלו שנמצאו מזיהומי שדה או חממה 6,13.
השימוש בפוקסין חומצי עוזר לעקוב אחר התקפות נמטודות על רקמת השורש. ידוע כי השלבים הנעים של ה-RLN נמצאים בתוך השורשים כבר יום אחד לאחר החיסון5. מאמינים כי שלב ראשוני זה אינו תלוי ברגישות המארח. עם זאת, לאחר החדירה, RLNs נשארים ניזונים מתאי האפידרמיס וקליפת המוח של השורש, מתרבים וגורמים להיווצרות נמק בצמחים רגישים, או יוצאים מהשורשים בחזרה לאדמה5. מנגנונים אלה עוקבים בקלות על ידי צביעה עם פוקסין חומצי (איור 5). התרבויות המשותפות של שורשי תפוחי אדמה שעירים עם RKNs מספקות כלי מעבדה רב עוצמה לניתוח מנגנוני חדירת J2 וקבלת החלטות בהקמת אתר ההזנה לנקבה הבוגרת בישיבה. ניתן לעקוב אחר כל שלב לאחר ההדבקה, כולל היווצרות המטריצה הג'לטינית ושחרור הביציות (איור 6).
ניתן לפרט את מבנה הרקמה באמצעות היסטוכימיה ומיקרוסקופיה אופטית. באמצעות טכניקות צביעה דיפרנציאליות, ניתן לעקוב אחר שלבי מחזור החיים של הפיטופרזיט יחד עם השינויים המושרים ברקמת השורש שמסביב. Meloidogyne chitwoodi, כמו גם נמטודות אחרות של קשרי שורש, מקדמים את היווצרות אתר האכלה המורכב מסוג תאים ספציפי הנקרא תאים ענקיים. תאים מרובי גרעינים אלה מושרים על ידי הפרשות מהנמטודה J2s והופכים לפעילים יתר על המידה מבחינה מטבולית, ומייצרים מזון עבור הנקבה הבוגרת הנייחת (איור 7). בעקבות היווצרות מבנה מיוחד זה מספק מידע חשוב על מנגנוני הזנת נמטודות ומאפשר זיהוי של שלבים ספציפיים שניתן למקד לשיבוש מחזור החיים שלו. כמו כן, מבנה אתר ההאכלה יכול להיות ספציפי למין RKN, ולתרום לזיהויו.

איור 1: תחזוקת נמטודות נגע שורש בדיסקי גזר. (A) דיסקים של שורשי גזר מעוקרים ונגועים ב-Pratylenchus penetrans הגורמים (B) לנגעים נמקיים אופייניים (חתכים כהים) עקב (C) גידול אוכלוסייה. בר=1 ס"מ (A ו-B), 100 מיקרומטר (C). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: זיהום של שורשי Solanum tuberosum שגדלו בתנאי חממה. בקרה על צמחי תפוחי אדמה (עציצים מאחור) וצמחים הנגועים בנמטודת נגע השורש (עציצים מלפנים) אינם מראים תסמינים נראים לעין של זיהום ביורה לאחר 30 יום מהזיהום. בר = 10 ס"מ. לחץ כאן לצפייה בגרסה מוגדלת של איור זה.

איור 3: התפתחות שורשים טרנסגניים של Solanum tuberosum . (A) מסות גדילה קטנות של תאים מתחילות להופיע לאורך אזור פציעת האזמל בקטע פקעת תפוחי האדמה (חץ), (B) ואחריהם הופעת השורשים הטרנסגניים הראשונים (הכנסת צד ימין), (C) שגדלים במהירות ומתקיימים במדיום התרבית. (D) גוש שורש יכול להיות מועבר לצלחת בינונית של תרבית טרייה לצמיחה מתמשכת. בר = 1 ס"מ. לחץ כאן לצפייה בגרסה מוגדלת של איור זה.

איור 4: תרביות משותפות של Solanum tuberosum עם הנמטודה הטפילית של הצמח Meloidogyne chitwoodi. (A) במבחנה, תרביות שורש טרנסגניות של תפוחי אדמה יכולות להיות נגועות ב-(B) נמטודות שורש קולומביה צעירות בשלב שני אספטי (J2) כדי ליצור תרבית משותפת של צמח/נמטודה. (C) ניתן להשיג עפצי שורש עם נקבות בוגרות שנושאות מסות ביצים. בר = 1 ס"מ (A, B) ו -200 מיקרומטר (C). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
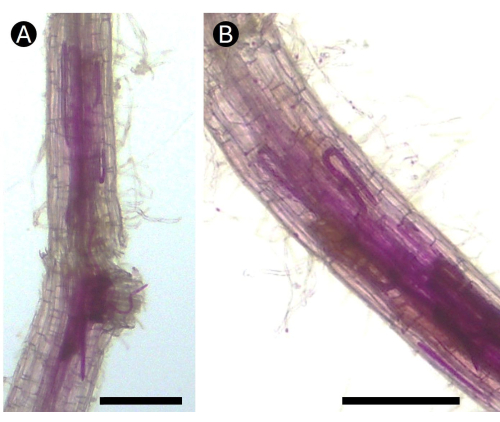
איור 5: שורשים מוכתמים בפוקסין חומצה של תפוחי אדמה שנדבקו על ידי נגע השורש נמטודת Pratylenchus חודרת בתנאי חממה. (A) ניתן לראות כמה שלבי חיים של הנמטודה באזור קליפת המוח של (B) השורש שגורם לנגעים נמקיים. בר = 100 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: עפצי שורש מוכתמים בפוקסין חומצי משורשים טרנסגניים שנדבקו ב-Meloidogyne chitwoodi. (A) ניתן לראות את רקמת העפצים (B) שעוטפת חלק מהנקבה הבוגרת M. chitwoodi (C) שכבר ייצרה את מסת הביצים (D) עם הביצים. בר = 500 מיקרומטר (A), 100 מיקרומטר (B, C) ו-20 מיקרומטר (D). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 7: מבנה תאי של עפצי שורש טרנסגניים שנוצרו על ידי Meloidogyne chitwoodi. (A) קטעים דקים במיוחד של עפצי שורש טרנסגניים המוכתמים בחומצה-שיף תקופתית (PAS) וכחול טולואידין O, המראים את אתר ההזנה של הנקבה הבוגרת ו-(B) תאי הענק המושרים על ידי הנמטודה העטופה ברקמת עפצי שורש. בר = 100 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
חקר מנגנוני הזיהום והתפתחות המחלות בצמחים המותקפים על ידי PPNs שוכני קרקע הוא קשה מכיוון שפיטוטפילים אלה בדרך כלל מדביקים את הרקמות הפנימיות של מערכת השורשים וגורמים לתסמינים לא ספציפיים ביורה. למרות התנאים הסביבתיים המבוקרים של החממה, הנבטת פקעות תפוחי אדמה וגידול צמחי תפוחי אדמה עדיין מועדפים בחודשי האביב והקיץ, מה שמפחית את תקופת הניסוי הזמינה לעונה אחת בשנה. כמו כן, למספר לא מבוטל של עציצים אין הופעה של צמחי תפוחי אדמה. מחזור החיים של ה-RLN ארוך יחסית ונדרשים כחודשיים עד שלושה כדי להגיע לשיאי אוכלוסייה המסוגלים לגרום לתסמיני מחלה. החסרונות העיקריים של פנייה לבדיקות ביולוגיות של חממה למחקר PPNs הם א) בדיקות מריחואנה מציגות לעתים קרובות שונות גבוהה בכל הנוגע לרגישות למחלות PPNs; ב) למרות שהזיהומים מבוצעים באוכלוסיות טהורות של PPNs, קיים סיכון להתבססות לא מוצלחת של PPNs ו/או זיהום צולב עם מינים שונים של PPNs; ג) למרות שאמצעי מניעה נאכפים, תמיד קיים סיכון לזיהומים על ידי פתוגנים מיקרוביאליים; ו-ד) בהתאם לכספים הזמינים ולגודל החממה, מספר השכפולים לרוב מצטמצם מדי עבור תוכנית דגימה נאותה, לצורך תוקף סטטיסטי.
שורשים טרנסגניים של תפוחי אדמה הם כלי מעבדה רב-תכליתי שאינו דורש חללים גדולים לתחזוקה; ניתן להשיג בפחות זמן; נקיים מזיהום או שונות גנטית של המארח; וחשוב מכך, לאפשר שליטה במשתנים סביבתיים או תזונתיים בודדים, מה שמבטיח שתגובת השורש נובעת ישירות מהטיפול שנכפה12. עבור מחקרים על זיהום והתפתחות PPNs, שימוש ב-HRs הוא שיפור בהשוואה לבדיקות ביולוגיות של חממה. ראשית, הצורך בגידול כמויות גדולות של PPNs לפני כל ניסוי הוא מיותר מכיוון שתרביות HR/PPNs של תפוחי אדמה הן מערכת רציפה המספקת את כל שלבי התפתחות הנמטודות ללא קשר לעונה או לתנאי האקלים. כמו כן, השונות הגנטית מוגבלת מאוד מכיוון ש-HRs הם רקמה סומטית משובטת, כך ששינויים בתגובת PPNs תלויים ישירות בתנאים הנכפים. תרבויות משותפות של תפוחי אדמה HR/PPN תופסות מקום קטן; תא גידול מבוקר טמפרטורה יכול להכיל צלחות פטרי רבות, כך שהניסויים מוגבלים רק לעתים רחוקות על ידי מספר השכפולים. לבסוף, הטכניקה ניתנת להרחבה ל-PPNs אחרים של תפוחי אדמה, למשל, Globodera spp., בהיותה מוגבלת בעיקר על ידי שלב עיקור הנמטודה, שיכול להיות מאתגר בהתאם למין ה-PPNs ושלב החיים שנבחר לטיהור 19,24. למרות יתרונותיו הרבים, המחקר העושה שימוש בתרביות משותפות מוגבל למחקרים ברמת הרקמה, למשל, מורפולוגיה אולטרה-מבנית או על מנגנוני בקרה ביוכימיים, תחת לחץ ביוטי או אביוטי 6,25, ואינו מתאים למחקרים הדורשים, למשל, קביעת תפוקת פקעת או פנוטיפ נזק. כמו כן, אינטראקציות בין צמח לנמטודה בתנאים טבעיים מושפעות ממשתנים רבים ולכן מומלץ לנקוט משנה זהירות בהשוואות ישירות לתוצאות שהתקבלו ממחקרים עם תרבויות משותפות.
היסטוכימיה משלבת היסטולוגיה עם היבטים כימיים, ומאפשרת לקבוע את אופי החומרים הקיימים ברקמות ומיקומם21. טכניקות צביעה דיפרנציאליות נמצאות בשימוש נרחב להבחנה בין שינויים כימיים ומורפולוגיים ספציפיים. צבע הפוקסין החומצי מכתים רקמות נמטודות על ידי חדירה לציפורן האטומה בשלב הרתיחה. מאוחר יותר, הימנעות ממערכת השורשים בגליצרין מחומצן מאפשרת לזהות את האתרים בהם תוקפות נמטודות, מכיוון שהן יהיו מנוגדות לרקמת השורש. עם זאת, אם נשמר בגליצרול מחומצן יותר מחודש עד חודשיים, הכתם יקטן בעוצמתו, והניגוד בין הנמטודות לשורשי הצמח יפחת.
חומצה-שיף תקופתית (PAS) וכחול טולואידין O משמשים לטכניקת צביעה כפולה המשמשת בדרך כלל לצביעה של רקמות טריות או משובצות שרף. זוהי טכניקה קלה ליישום אך עם ספציפיות ורגישות נמוכות. היישום הרציף של שני צבעים מאפשר צביעה בו זמנית של מטרות תאיות מרובות בעלות תכונות כימיות שונות. חומצה תקופתית עם מגיב שיף תכתים פוליסכרידים בגוון ורוד, בעיקר עמילן, פוליסכרידים של דופן התא וכמה פנולים, אך לא תאית או יבלת. צבע O כחול טולואידין מדגיש צביעת PAS ויכתים את דפנות התאים של קסילם וסקלרנכימה בירוק או כחול-ירוק, דפנות תאי קולנכימה ופרנכימה בסגול-אדום, ודפנות הפלום והלמלה האמצעית של דפנות התא באדום. קלוז ועמילן לא יוכתמו21.
הפרוטוקול המתואר מציע מספר יישומים עתידיים מבטיחים במדעי הצמח, חקלאות וביוטכנולוגיה. הוא מאפשר מחקרים מפורטים על המנגנונים המולקולריים והתאיים של טפילות, ומספק תובנות לגבי האופן שבו PPNs מדביקים ומתמרנים מארחים. הוא תומך בגידול יבולים עמידים על ידי סיוע בסינון זני תפוחי אדמה או קווים טרנסגניים לעמידות ל-PPNs, כמו גם זיהוי גנים מרכזיים המעורבים בעמידות או רגישות. יתר על כן, תרביות משותפות במבחנה יכולות לשמש ככלי רב עוצמה להקרנה בתפוקה גבוהה של קוטלי נמטיקה או חומרי הדברה ביולוגיים (למשל, חיידקים או מוצרים טבעיים), מה שמאפשר לחוקרים להעריך את יעילותם בשליטה במחלות PPN.
Disclosures
אין לנו מה לחשוף.
Acknowledgements
מחקר זה מומן בחלקו על ידי Fundação para a Ciência e a Tecnologia (FCT), באמצעות מענקים NemACT, DOI: 10.54499/2022.00359.CEECIND/CP1737/CT0002 (JMSF), CEECIND/00040/2018, DOI: 10.54499/CEECIND/00040/2018/CP1560/CT0001 (CSLV) ו-SFRH/BD/134201/2017 (PB); פרויקט PratyOmics, DOI: 10.54499/PTDC/ASP-PLA/0197/2020; ומימון מבני UIDB/00329/2020 | cE3c (DOI: 10.54499/UIDB/00329/2020) + LA/P/0121/2020 |שינוי (DOI: 10.54499/LA/P/0121/2020), ו-GreenIT (DOI: 10.54499/UIDB/04551/2020 ו-DOI: 10.54499/UIDP/04551/2020)..
Materials
| Name | Company | Catalog Number | Comments |
| 2,4-Dinitrophenylhydrazine | Sigma-Aldrich | D199303 | |
| 2-Hydroxyethyl methacrylate | Sigma-Aldrich | 17348 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Acid Fuchsin | Sigma-Aldrich | F8129 | |
| Benzoyl peroxide | Sigma-Aldrich | B5907 | |
| borosilicate glass beaker | Sigma-Aldrich | Z231827 | |
| Carbenicillin disodium salt | Sigma-Aldrich | C3416 | |
| Cefotaxime sodium salt | Sigma-Aldrich | C7039 | |
| Dimethyl sulfoxide | Sigma-Aldrich | 472301 | |
| Ethanol | Supelco | 1.00983 | |
| Fertilizer | Compo Expert | ||
| Flower pot 5 L | VWR | 470049-676 | |
| Glutaraldehyde | Sigma-Aldrich | 354400 | |
| Glycerol | Sigma-Aldrich | G7893 | |
| Hydrochloric acid | Sigma-Aldrich | 258148 | |
| Kanamycin monosulfate | Sigma-Aldrich | BP861 | |
| LB Broth with agar | Sigma-Aldrich | L3147 | |
| MCE syringe filter | Millipore | SLGSR33SS | |
| PARAFILM M sealing film | BRAND | HS234526B-1EA | |
| Pararosaniline hydrochloride | Sigma-Aldrich | P3750 | |
| Periodic acid | Sigma-Aldrich | P0430 | |
| Phyto agar | Duchefa Biochemie | P1003 | |
| Scalpel blade no. 24 | Romed Holland | BLADE24 | |
| Schenk & Hildebrandt Basal salt medium | Duchefa Biochemie | S0225 | |
| Schenk & Hildebrandt vitamin mixture | Duchefa Biochemie | S0411 | |
| Schiff′s reagent | Sigma-Aldrich | 1.09033 | |
| Sodium metabisulfite | Sigma-Aldrich | 161519 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | Sigma-Aldrich | S5011 | |
| Soil / Substrate | Compo Sana | ||
| Stainless Steel Tweezers | Sigma-Aldrich | 22435-U | |
| Sucrose | Duchefa Biochemie | S0809 | |
| Toluidine Blue O | Sigma-Aldrich | 198161 |
References
- Çalışkan, M. E., Yousaf, M. F., Yavuz, C., Zia, M. A. B., Çalışkan, S. History, production, current trends, and future prospects. Potato Production Worldwide. , 1-18 (2022).
- Barker, K. R., Koenning, S. R. Developing sustainable systems for nematode management. Ann Rev Phytopathol. 36 (1), 165-205 (1998).
- Jones, J. T., et al. Top 10 plant-parasitic nematodes in molecular plant pathology. Mol Plant Pathol. 14 (9), 946-961 (2013).
- Davis, E. L., Hussey, R. S., Baum, T. J. Getting to the roots of parasitism by nematodes. Trend Parasitol. 20 (3), 134-141 (2004).
- Figueiredo, J., Vieira, P., Abrantes, I., Esteves, I. Commercial potato cultivars exhibit distinct susceptibility to the root lesion nematode Pratylenchus penetrans. Horticulturae. 8 (3), 244 (2022).
- Faria, J. M. S., et al. In vitro co-culture of Solanum tuberosum hairy roots with Meloidogyne chitwoodi: Structure, growth and production of volatiles. Plant Cell Tissue Organ Culture. 118 (3), 519-530 (2014).
- Wesemael, W. M. L., Moens, M., Viaene, N., Taning, L. M. Life cycle and damage of the root-knot nematode Meloidogyne minor on potato, Solanum tuberosum. Nematology. 16 (2), 185-192 (2014).
- Subramanian, P., et al. Differential metabolic profiles during the developmental stages of plant-parasitic nematode Meloidogyne incognita. Int J Mol Sci. 18 (7), 1351 (2017).
- Gutierrez-Valdes, N., et al. Hairy root cultures-A versatile tool with multiple applications. Front Plant Sci. 11, 33 (2020).
- Cho, H. J., Farrand, S. K., Noel, G. R., Widholm, J. M. High-efficiency induction of soybean hairy roots and propagation of the soybean cyst nematode. Planta. 210 (2), 195-204 (2000).
- Young, J. M., Kuykendall, L. D., Martínez-Romero, E., Kerr, A., Sawada, H., et al. A revision of Rhizobium Frank 1889, with an emended description of the genus, and the inclusion of all species of Agrobacterium Conn 1942 and Allorhizobium undicola de Lajudie et al. 1998 as new combinations: Rhizobium radiobacter, R. rhizogenes, R. rubi, R. undicola and R. vitis. Int J Syst Evol Microbiol. 51 (1), 89-103 (2001).
- Giri, A., Narasu, M. L. Transgenic hairy roots. Biotechnol Adv. 18 (1), 1-22 (2000).
- Faria, J. M. S., Rusinque, L., Cavaco, T., Nunes, J. C., Inácio, M. L. Essential oil volatiles as sustainable antagonists for the root-knot nematode Meloidogyne ethiopica. Sustainability. 15 (14), 11421 (2023).
- European Mediterranean Plant Protection Organization (EPPO). PM 7/148 (1) Guidelines for the management of nematode collections used for the production and maintenance of reference material. EPPO Bulletin. 51 (3), 507-548 (2021).
- Boisseau, M., Sarah, J. L. In vitro rearing of Pratylenchidae nematodes on carrot discs. Fruits. 63 (5), 307-310 (2008).
- Barbosa, P., et al. Nematicidal activity of phytochemicals against the root-lesion nematode Pratylenchus penetrans. Plants. 13 (5), 726 (2024).
- Santos, P. M., et al. Essential oils from hairy root cultures and from fruits and roots of Pimpinella anisum. Phytochemistry. 48 (3), 455-460 (1998).
- Bertani, G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. J Bacteriol. 62 (3), 293-300 (1951).
- Kumar, A., Forrest, J. M. Reproduction of Globodera rostochiensis on transformed roots of Solanum tuberosum cv. Desiree. J Nematol. 22 (3), 395-398 (1990).
- Schenk, R. U., Hildebrandt, A. C. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Canadian J Botany. 50 (1), 199-204 (1972).
- Figueiredo, A. C. S., Barroso, J. M. G., Pedro, L. M. G., Ascensão, L. . Histoquímica e citoquímica em plantas: princípios e protocolos. Universidade de Lisboa. , (2007).
- Bybd, D. W., Kirkpatrick, T., Barker, K. R. An improved technique for clearing and staining plant tissues for detection of nematodes. J Nematol. 15 (1), 142-143 (1983).
- Coyne, D., Adewuyi, O., Mbiru, E. . Protocol for in vitro culturing of lesion nematodes: Radopholus similis and Pratylenchus spp. on carrot disc. , (2014).
- Faria, J. M. S., Vicente, C. S. L., Rusinque, L., Camacho, M. J., Inácio, M. L. Plant-Nematode co-cultures in the screening of sustainable nematicides against soil-dweling parasitic nematodes of plants. Revista de Ciências Agrárias. 45 (4), 436-439 (2022).
- Faria, J. M. S., et al. In vitro co-cultures of Pinus pinaster with Bursaphelenchus xylophilus: a biotechnological approach to study pine wilt disease. Planta. 241 (6), 1325-1336 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved