Method Article
Трансплантация биоинженерного легкого с использованием децеллюляризованных легких мыши и первичных эндотелиальных клеток человека
В этой статье
Резюме
В данной статье описывается, как создать биоинженерные легкие мышей с использованием методов децеллюляризации и рецеллюляризации. В нем также подробно описывается последующая ортотопическая трансплантация легких.
Аннотация
Трансплантация легких является критически важным методом лечения для пациентов с терминальной стадией заболеваний легких, таких как идиопатический легочный фиброз, но такие проблемы, как нехватка доноров и осложнения после трансплантации, сохраняются. Биоинженерные легкие, интегрирующие специфические для пациента клетки в децеллюляризованные каркасы животных, представляют собой многообещающую альтернативу. Несмотря на прогресс в использовании биоинженерных легких на животных моделях, функциональность и структура остаются незрелыми. Этот протокол устраняет критический барьер в биоинженерии органов: потребность в экономически эффективной экспериментальной платформе. Используя мышиные модели вместо более крупных животных, таких как крысы или свиньи, исследователи могут значительно сократить ресурсы, необходимые для каждого эксперимента, ускоряя прогресс исследований.
В протоколе подробно изложена процедура биоинженерии легких у мышей с использованием блоков сердца-легких и первичных клеток человека, уделяя особое внимание стратегии изоляции блок-сердца и легких мыши, децеллюляризации, установке биореактора, культуре органов на основе перфузии и ортотопической трансплантации биоинженерных легких. Эта мышиная платформа не только снижает затраты на эксперименты, но и обеспечивает жизнеспособную основу для оптимизации типов и количества клеток для рецеллюляризации, тестирования различных типов клеток с использованием гистологических и молекулярных методов, а также обеспечения кровотока после трансплантации. Метод имеет потенциал для широкого применения, включая изучение клеточных взаимодействий в трехмерных культурных условиях, клеточно-матричных взаимодействий и моделирование рака ex vivo , тем самым продвигая область органной биоинженерии.
Введение
Трансплантация легких является решающим лекарством для пациентов с терминальной стадией заболевания легких1, таким как идиопатический легочный фиброз, при котором медикаментозное лечение неэффективно для остановки ухудшения дыхательной функции. С каждым годом в список ожидания встает все больше пациентов, имеющих на это право; Тем не менее, количество донорских органов от умерших доноров отстает от растущего числа ожидающих пациентов 2,3. Даже после трансплантации легких функция трансплантированных легких может ухудшиться из-за многих проблем, включая дисфункцию первичного органа, реактивный аллогенный синдром и инфекции, которые значительно снижают 5-летнюю выживаемость реципиентов трансплантации легких.
Существует несколько вариантов противодействия текущим проблемам в области трансплантации органов, включая использование маргинальных доноров5, восстановление донорских легкихв системе перфузии легких ex vivo 6 и ксенотрансплантацию с использованием генетически отредактированных свиней7. Эти альтернативы могут расширить пул донорских органов; Тем не менее, ни один из них не может полностью решить проблему дефицита, иммуногенности и функциональной гетерогенности донорских органов.
Это далеко от реальности, но биоинженерные искусственные органы, в которых специфические для пациента клетки интегрированы в каркас децеллюляризованного органа животного, являются увлекательным потенциальным источникомтрансплантации солидных органов. С 2010 года сообщалось о нескольких новаторских исследованиях, которые продемонстрировали потенциальную полезность биоинженерных легких. В этих исследованиях легкие крыс или свиней децеллюляризировались с помощью детергентов, клетки животных или человека вводились из трахеи или легочной сосудистой сети для регенерации легочной ткани в биореакторе на основе перфузии, а некоторые из них были ортотопически трансплантированы в грудные полости животных 11,12,13,14,15. Тем не менее, функция и структура биоинженерных легких были преждевременными, предположительно из-за недостаточного количества клеток, культивируемых в биореакторе, или менее интегрированных межклеточных соединений.
Одним из препятствий для продвижения исследований в области биоинженерии органов является отсутствие мелкомасштабной экспериментальной платформы. В то время как крысы или свиньи являются широко используемыми животными в этой области, им требуется >108 клеток легких налегкое, что очень дорого для академических лабораторий. Если бы мыши были доступны для исследований в области биоинженерии органов, мы могли бы значительно снизить стоимость каждого эксперимента и ускорить исследовательскую программу. Несмотря на то, что существуют анатомические различия между мышиными и человеческими легкими17, основная архитектура легких у млекопитающих схожа18. Таким образом, результаты экспериментов на мышах можно применить к более крупным животным, просто умножив число в соответствии с размером тела.
Данный протокол направлен на описание детальной экспериментальной процедуры биоинженерии легких легких мышей с использованием блоков сердца-легких мыши и первичных клеток человека19. Для этого исследования мы приняли ранее описанный и широко используемый протокол децеллюляризации легких мышей 20,21,22. Сложной частью биоинженерии легких является рецеллюляризация децеллюляризованной капиллярной сосудистой сети20; Поэтому в этом протоколе будут использоваться эндотелиальные клетки вен пуповины человека.
протокол
Все эксперименты проводились в соответствии с Правилами проведения экспериментов на животных и связанной с ними деятельности в Университете Тохоку (15-е издание), опубликованными Университетом Тохоку23. Это исследование было одобрено Комитетом по уходу за животными и их использованию в Университете Тохоку (#2020AcA-041-01).
1. Подготовка материалов к децеллюляризации
- Приготовление растворов для децеллюляризации (формат 1 000 мл в автоклавируемом стеклянном флаконе объемом 1 л)
- Стерильная деионизированная (DI) вода: Добавьте 1 000 мл дистиллированной или деионизированной воды в автоклавируемые стеклянные бутылки объемом 1 л. Автоклав в течение 20 мин при 121 °C.
- Triton X-100: Добавьте 1 мл Triton X-100 в 1 000 мл стерильной деионизированной воды в автоклавируемую стеклянную бутылку объемом 1 л. (Дополнительный) Добавьте по 10 мл раствора пенициллина и стрептомицина (конечная концентрация, 500 ЕД/мл пенициллина и 500 мкг/мл стрептомицина).
ПРИМЕЧАНИЕ: Не делайте автоклавирование. - Дезоксихолат натрия: Добавьте 20 г порошка дезоксихолата натрия в 1 000 мл стерильной деионизированной воды в автоклавируемую стеклянную бутылку объемом 1 л. Закройте крышку и переверните флакон, чтобы порошок растворился. (Дополнительный) Добавьте по 10 мл пенициллина и раствор стрептомицина.
ПРИМЕЧАНИЕ: Не делайте автоклавирование. - 1 M NaCl: добавьте 58,44 г NaCl в 1 000 мл дистиллированной или деионизированной воды в автоклавируемую стеклянную бутылку объемом 1 л. Автоклав в течение 20 мин при 121 °C.
- Исходный раствор ДНКазы I: Разведите в концентрации 10 мг/мл в среде А.
- Среда А: Приготовьте 5 мМ CaCl2 (5 мг CaCl2 в 9 мл стерильной воды DI) и разбавьте 1:10 стерильной водой DI.
- Рабочий раствор DNase I: Добавьте 33 мкл стокового раствора DNase I к 10 мл среды B.
- Среда В: Приготовьте 10x Medium B (155 мг MgSO4 + 220 мг CaCl2 в 100 мл стерильной DI-воды) и 1:10 в разведении со стерильной DI-водой.
- Подготовка катетеров для легочной артерии (ПА) и трахеи (стерильная процедура)
- Разрежьте катетер PA (катетер для яремной вены крысы) длиной примерно 15 мм.
- Переместите ошейник к концу катетера.
- Вставьте соединитель катетера в катетер PA и прикрепите его к инжектору. Подготовленные катетеры ПА представлены на рисунке 1А.
- Храните катетер PA в 70% этаноле до использования.
- Разрежьте катетер 20 G для внутривенного введения длиной примерно 15 мм. Он используется для установки катетера в трахею.
- Хирургия мышей для забора блокады сердца и легких
- Усыпьте самца мыши (C57BL/6, вес > 28 г) с помощью передозировки углекислого газа или изофлурана.
- Поместите мышь в лежачем положении на хирургический стол и зафиксируйте конечности. Стерилизовать, распылив 70% этанол на поверхность груди и живота.
- Откройте брюшную полость по срединной линии до шеи нержавеющими ножницами и рассеките ножницами грудину. Резецируйте диафрагму от грудной стенки, разрежьте вентральную стенку грудной клетки, чтобы полностью обнажить грудные полости, и удалите тимус. Перевязать нижнюю полую вену и правую верхнюю полую вену шелком 4-0 для предотвращения регургитации PBS на шаге 1.3.5, тем самым усиливая вымывание крови в легочной сосудистой сети.
- Разрежьте брюшную аорту нержавеющими ножницами для дренирования. Если брюшная аорта неразличима, полностью перережьте нижнюю полую вену и брюшную аорту.
- Ввести 3 мл стерильного PBS из правого желудочка стерильным шприцем объемом 5 мл с иглой 27 G путем прокола стенки правого желудочка.
- Обмотайте основной ПА шелковкой 4-0 с помощью щипцов Дюмона.
ПРИМЕЧАНИЕ: Основная ПА и восходящая аорта могут быть закольцованы вместе. - Откройте окно диаметром 2 мм под клапанами PA, разрезав стенку правого желудочка пружинными ножницами.
- Вставьте катетер PA через окно и закрепите ранее запетленный шелк 4-0 (рисунок 1B).
ПРИМЕЧАНИЕ: Избегайте прикосновения к PA во время этой процедуры, так как это может повредить стенку PA. Основной ПА и восходящая аорта могут быть перевязаны и закреплены вместе. - Медленно введите 2 мл PBS через PA-катетер стерильным шприцем объемом 5 мл. Убедитесь, что оба легких немного расширяются во время введения PBS.
- Канюлеируйте трахею с помощью трахейного катетера и завяжите на месте шелковым швом 4-0 (Рисунок 1C).
- Медленно введите 2 мл воздуха через трахеальный катетер с помощью пустого стерильного шприца объемом 5 мл и подержите его в течение 10 с. Убедитесь, что нет утечки воздуха из легких.
- Удалите сердце и легкое целиком. Захватите трахею щипцами Дюмона и катетером трахеи внутри, разрежьте шейный пищевод и отделите его от позвонков. Перерезать двусторонние подключичные вены и артерии. Наконец, перережьте пищевод и полую вену на уровне диафрагмы.
ПРИМЕЧАНИЕ: Не прикасайтесь к поверхности легких никакими инструментами. Любое легкое прикосновение может привести к утечке воздуха.
- Децеллюляризация легких мыши (3-дневная процедура)
ПРИМЕЧАНИЕ: Все процедуры, описанные в разделе 1.4, должны выполняться в чистом шкафу биобезопасности.- День 1
- Перенесите резецированную блокаду сердца и легких в пластиковую чашку Петри диаметром 10 см и инкубируйте блокады сердца и легких в стерильной воде DI в течение 1 часа при температуре 4 °C.
- Введите 2 мл стерильной DI-воды через катетер трахеи 3x и 2 мл стерильной воды через PA-катетер с помощью стерильного шприца объемом 5 мл. Делайте паузу после каждой инъекции, чтобы жидкость вышла по мере откатки легкого (Рисунок 1C).
ПРИМЕЧАНИЕ: Впрыскивайте воду со скоростью примерно 0,5 мл/с. - Введите 2 мл 0,1% раствора Triton X-100 в катетер трахеи и 2 мл в катетер PA.
- Поместите блок искусственного кровообращения в чашку Петри и статически инкубируйте в растворе Triton X-100 в течение ночи при температуре 4 °C.
- День 2
- Удалите раствор Triton X-100 из легких с помощью стерильной деионизионной воды, как описано в шаге 1.4.1.2.
- Введите 2 мл 2% раствора дезоксихолата натрия в катетер трахеи и 2 мл в катетер PA. Инкубировать в растворе дезоксихолата в течение 24 ч при 4 °С.
- День 3
- Удалите раствор дезоксихолата натрия из легких стерильной деионизионной водой, как описано в шаге 1.4.1.2.
- Введите 2 мл 1 М раствора NaCl в катетер трахеи и 2 мл в катетер PA. Инкубировать в растворе NaCl в течение 1 ч при РТ.
- Удалите из раствора NaCl стерильную деионизионную воду, как описано в шаге 1.4.1.2.
- Введите 2 мл рабочего раствора ДНКазы I в катетер трахеи и 2 мл в катетер PA. Инкубировать в рабочем растворе ДНКазы в течение 1 ч при РТ.
- Удалите раствор ДНКазы из легких, как описано в шаге 1.4.1.2, но с помощью стерильного PBS. Подтвердите, что легкие белые и прозрачные по краю после процедуры децеллюляризации.
ПРИМЕЧАНИЕ: По мере прогрессирования процедуры децеллюляризации легкое становится более хрупким. Всегда обращайтесь с блоком искусственного кровообращения с осторожностью и избегайте прикосновения к поверхности легких. После децеллюляризации блокады сердца и легких могут храниться в PBS/антибиотиках при температуре 4 °C до 3 недель.
- День 1
2. Культивирование первичных клеток человека
- Смешайте среду для роста эндотелиальных клеток-2 (EGM2) и набор Bullet Kit, содержащие фетальную бычью сыворотку (конечная концентрация, 2%), гидрокортизон (конечная концентрация, 0,2 мкг/мл), основной фактор роста фибробластов человека (конечная концентрация, 4 нг/мл), фактор роста эндотелия сосудов (2 нг/мл), R3-инсулиноподобный фактор роста-1 (конечная концентрация, 5 нг/мл), аскорбиновую кислоту (конечная концентрация, 75 мкг/мл), эпидермальный фактор роста человека (конечная концентрация, 10 нг/мл), гентамицин/амфотерицин-1000 (конечная концентрация, гентамицин: 30 г/мл, амфотерицин: 15 нг/мл) и гепарин (конечная концентрация, 1 нг/мл).
- Разморозьте 2 × 106 эндотелиальных клеток пуповины пуповины человека (HUVECs) в замороженных флаконах на водяной бане при 37 °C.
- Смешайте клетки с EGM2 в конической пробирке объемом 15 мл и центрифугируйте при 500 × г в течение 5 минут.
- Подсчитайте клетки и подкультивируйте их при соответствующей плотности клеток (рекомендуется 2,0 x 10,4 клетки/см2 ). Начните с 6-луночных форматных планшетов, а затем переложите в колбы T75.
- Проходите по клеткам до тех пор, пока не будет получено необходимое количество ячеек.
ПРИМЕЧАНИЕ: Для полного покрытия легочных сосудов с использованием HUVEC потребуется 3 × 10 7 HUVEC19.
3. Установка биореактора и культура перфузионных органов
- Подготовка камеры органа и клеточного резервуара
- Вырежьте отверстия в силиконовой пробке с помощью пробкового сверла, как показано на рисунке 2А. Размеры отверстий составляют 5 мм (i, ii и iii) и 7 мм (iv и v). Каждый номер отверстия (i-v) на рисунке 2A соответствует номеру отверстий на рисунке 2B.
- Вставьте трубку насоса через силиконовую пробку, как показано на рисунке 2B.
- Вырежьте отверстие диаметром 5 мм в силиконовой перегородке завинчивающейся крышки с открытым верхом с помощью пробкового сверла. Вставьте в отверстие трубку, отвержденную платиной L/S 14 (Рисунок 2B, C).
- Провести автоклавирование вышеуказанных материалов, включая силиконовую пробку с трубкой, стеклянную канистру, завинчивающуюся крышку GL-45 с трубкой, автоклавируемую стеклянную бутылку объемом 250 мл и трубку L/S 14 с фитингами для приманки (трубка B и трубка C на рисунке 3A) в течение 20 минут при температуре 121 °C. Выберите подходящие фитинги для приманки, чтобы трубки B и C образовали петлю.
ПРИМЕЧАНИЕ: Стеклянная канистра используется для камеры для органов, а стеклянная бутылка объемом 250 мл используется для резервуара для клеток.
- Сборка контура биореактора на основе перфузии
ПРИМЕЧАНИЕ: Следующие процедуры должны выполняться на чистом стенде.- Добавьте 70 мл питательной среды в стеклянную канистру, а затем положите силиконовую пробку на стеклянную канистру.
- Соберите силиконовую пробку, стеклянную канистру, винтовую крышку GL-45 с трубкой, автоклавируемую стеклянную бутылку объемом 250 мл и трубку L/S 14 с фитингами для приманки с помощью трехходовых запорных кранов, как описано на рисунке 3A. Вставьте иглу 20 G в силиконовую перегородку завинчивающейся крышки GL-45.
- Заполните фильтрующий материал в трубках A, B и C с помощью шприца объемом 10 мл, подключенного к запорным кранам i) и iii) (для заполнения 1 м трубки потребуется ~3-5 мл фильтрующего материала). Повторите ввод и забор среды с помощью шприца объемом 10 мл через трехходовой запорный кран, чтобы убедиться, что внутри трубки нет пузырьков воздуха.
- Прикрепите PA-катетер децеллюляризованной блокады сердца и легких с помощью приманочного фитинга, подключенного к трубке C. Избегайте попадания пузырьков воздуха в катетер или трубку.
- Собирайте и ресуспендируйте HUVEC с плотностью 0,5-1 × 106 клеток/мл в EGM2. Добавьте клеточную суспензию с шага 2.5 в резервуар для клеток.
ПРИМЕЧАНИЕ: Клеточную суспензию предпочтительно готовят между этапами 3.2.4 и 3.2.5. Поставьте в резервуар ячейки штангу для перемешивания.
- Гравитационное введение эндотелиальных клеток
- Поместите резервуар с клеткой, содержащий HUVECs, на магнитную мешалку. Убедитесь, что дно клеточного резервуара находится на высоте 30 см над камерой органа (рисунок 2D и рисунок 3A).
- Включите магнитную мешалку со скоростью примерно 120 об/мин.
- Откройте запорный кран i) и ii) таким образом, чтобы клеточную суспензию можно было ввести в децеллюляризованный каркас через трубку А, трубку С и катетер PA.
ПРИМЕЧАНИЕ: При введении 3 × 107 клеток при плотности клеток 1 × 106 клеток/мл объем клеточной суспензии должен составлять 30 мл. Типичная скорость инъекции составляет 1-2 мл/мин. - После полного введения клеточной суспензии отсоедините трубку А от запорного крана ii).
ПРИМЕЧАНИЕ: На этом этапе можно провести подсчет клеток для измерения скорости удержания клеток в децеллюляризованном каркасе. Типичный коэффициент удержания клеток составляет 80-90%, независимо от количества введенных клеток19.
Качество децеллюляризованного каркаса легкого строго определяет скорость удержания клеток. Любая утечка из децеллюляризованного легкого (например, из основного ПА, поверхности легкого) приводит к снижению скорости удержания клеток. Убедитесь в отсутствии видимой утечки из децеллюляризованного легкого, введя 2-3 мл питательных сред стерильным шприцем, подключенным к одному из запорных кранов в биореакторе на основе перфузии, и убедитесь, что децеллюляризованные легкие немного расширяются при введении среды.
- Культура перфузионных органов
- Поместите камеру органа в инкубатор сСО2 .
- Закрепите трубку B на головке насоса, подключенной к пульсирующему насосу.
- Закройте стеклянную дверцу инкубатора CO2 . Убедитесь, что трубка правильно размещена между стеклянной дверцей и резиновым уплотнителем (Рисунок 3B).
- Инкубируйте децеллюляризованный каркас при температуре 37 °C в течение 3 часов, чтобы введенные эндотелиальные клетки осядли в каркасе.
ПРИМЕЧАНИЕ: Убедитесь, что пульсирующий насос всегда выключен между шагами 3.4.1 и 3.4.4. - Запустите насос со скоростью 6 об/мин, что приводит к перфузии среды со скоростью 2 мл/мин с помощью трубки L/S 14. Посмотрите, как децеллюляризированное легкое слегка расширяется с помощью перфузии среды.
- Закройте дверцу инкубатора (рисунок 3C).
- Выполните смену носителя с помощью Stopcock iii). Меняйте половину носителя каждые 2 или 3 дня.
- Остановите привод насоса, прикрепите стерильный шприц объемом 50 мл к запорному крану iii) и извлеките 50 мл среды из камеры.
- Наполните еще 50 мл стерильного шприца 50 мл предварительно подогретой среды и перенесите среду в камеру с помощью запорного крана. Переключите запорный кран соответствующим образом, а затем запустите пульсирующий насос.
- Соберите рецеллюляризованную блокаду сердца и легких по крайней мере через 2 дня культивирования перфузионных органов.
Примечание: В нашем исследовании 2 дней перфузионного культивирования было достаточно для гомогенной реваскуляризации децеллюляризованного каркаса легкого с использованием 3 ×10-7 HUVECs. При использовании менее 3 ×10-7 HUVEC может потребоваться более длительная инкубация для повышения эффективности рецеллюляризации.
4. Ортотопическая трансплантация биоинженерного легкого
- Приготовление лекарств
- Приготовьте комбинированный анестетик MMB, смешав мидазолам (конечная концентрация, 4 мг/кг), медетомидин (конечная концентрация, 0,75 мг/кг) и тартрат буторфанола (конечная концентрация, 5 мг/кг) с физиологическим раствором клинической степени.
- Приготовьте раствор гепарина, смешав его с физиологическим раствором клинической степени (конечная концентрация, 1000 Ед/мл).
- Приготовьте цефазолин натрия, смешав его с физиологическим раствором клинической степени (одна доза, 30 мг/кг).
- Хирургическое вмешательство
- Подготовка манжет
- Слегка потрите три типа ангиокатетеров мелкой наждачной бумагой, чтобы облегчить удержание сосудов в манжетах.
- Подготовьте бронхиальную манжету из тефлонового ангиокатетера 20 G длиной 1 мм с помощью скальпеля #11. Перед тем, как разрезать ангиокатетер, используйте тыльную сторону скальпеля #11, чтобы сделать углубление в ангиокатетере, чтобы перевязать нейлон 10-0.
- Подготовьте манжету легочной вены (ФВ) из тефлонового ангиокатетера 22 G длиной 0,8 мм и манжету PA из тефлонового ангиокатетера 24 G длиной 0,6 мм.
ПРИМЕЧАНИЕ: Эту подготовку можно провести до дня проведения эксперимента.
- Прикрепление манжеты к биоинженерному легкому
- Поместите блок искусственного кровообращения на кусок стерильной марли, смоченный холодным физиологическим раствором, положите под него еще один кусок сухой чистой марли и положите чашку Петри в пенопластовую коробку, наполненную чистым льдом.
ПРИМЕЧАНИЕ: Наложение сухой марли предотвращает случайное замерзание блокады сердца и легких. - Установите зажим для аневризмы, чтобы закрепить трахею и марлю (рисунок 4A). Положите небольшой кусочек марли на сердце, закрывая также правое легкое. Наложите еще одну марлю на левое легкое. Отрегулируйте это втягивание с помощью увлажненной марли, чтобы как можно лучше обнажить левый воротник.
- Осторожно отделите прикорневые структуры друг от друга с помощью прямых или угловых микрощипцов, в зависимости от предпочтений (рисунок 4B). Начинайте расслоение от легочной связки по ходу блуждающего нерва. Разрежьте висцеральную плевру под ЛВ и переместите нисходящую аорту и блуждающий нерв вместе через заднюю часть левого легочного ворота в сторону черепа.
- Рассеките левый основной ПА от легочного ствола до самого края левого легкого (рис. 4В). Затем разделите PA на уровне легочного ствола, чтобы получить достаточную длину.
- Рассеките левый ЛВ от левой стороны левого предсердия до самого края левого легкого (рисунок 4D). Разделите левую ПВ на уровне левого предсердия, чтобы получить достаточную длину.
- Подвесьте манжету PA чуть выше PA с помощью стабилизирующего зажима и вставьте PA внутрь манжеты (Рисунок 4E). Сложите ПА над манжетой), обнажив эндотелиальную поверхность. Закрепите манжету с помощью нейлоновой завязки 10-0 (Рисунок 4F). Поместите манжету на фотоэлектрический стекло таким же образом (Рисунок 4G, H).
- Разделите левый бронх на уровне киля. Поместите манжету на бронх таким же образом (рисунок 4I).
- Поместите блок искусственного кровообращения на кусок стерильной марли, смоченный холодным физиологическим раствором, положите под него еще один кусок сухой чистой марли и положите чашку Петри в пенопластовую коробку, наполненную чистым льдом.
- Порядок действий для мыши-реципиента
- Обезболите мышь-реципиента смесью MMB i.p. с помощью иглы 27 G и интубируйте путем введения полиуретанового ангиокатетера 20 G под микроскоп. Поместите мышь-реципиент на регулируемый по температуре электрический грелка в правом боковом положении пролежня и подключите ангиохатетер к респиратору. Установите настройку аппарата ИВЛ следующим образом : кислород 2 л/мин, частота дыхания 120 уд/мин, дыхательный объем 0,5 мл. Стерилизуйте стенку грудной клетки 70% этанолом и введите смесь цефазолина.
- Надрежьте кожу ножницами. Разрежьте подкожную клетчатку и мышцы с помощью прижигания. Вскройте грудную клетку через3-е межреберье и разместите грудные ретракторы.
ПРИМЕЧАНИЕ: Хотя торакотомия должна быть достаточно большой для имплантации, не травмируйте внутреннюю молочную артерию, что может привести к массивному кровотечению. - Рассеките легочную связку ватным тампоном и большими пружинными ножницами. Поместите изогнутое средство для очищения артерий на левое легкое реципиента, чтобы легко втянуть легкое. С помощью расположенных под углом микрощипцов рассеките плевру средостения вокруг левого легочного воротка.
ПРИМЕЧАНИЕ: Основа рассечения плевры аналогична анатомической резекции легкого человека. - Рассеките ПА от бронха с помощью изогнутых микрощипцов от средостения до самого края левого легкого (рисунок 5А). Аналогичным образом отделите бронх от ФВ.
ПРИМЕЧАНИЕ: Диссекция может быть легко выполнена, если плевра рассекается при предыдущем маневре (шаг 4.2.3.3). - Поместите накладной узел из шелка 10-0 у основания PA, чтобы окклюзировать (Рисунок 5B). Поместите тонкий угловой аневризматический зажим у основания ПВ и бронха (рисунок 5C).
- Обмотайте нейлон 10-0 вокруг бронхов, PA и PV, оставляя свободным, чтобы зафиксировать манжеты на следующих шагах.
- Надрежьте ПА, бронх и ЛВ реципиента по краю левого легкого реципиента с помощью ножниц с микропружинами (рисунок 5D). Аккуратно расширьте ПА и ПВ с помощью прямых микрощипцов. Удалите кровь из ПА и ПВ с помощью физиологического раствора с помощью шприца объемом 1 мл и ангиокатера 24 г.
ПРИМЕЧАНИЕ: Разрезы PA, бронхов и PV составляют примерно одну треть круга. Прямые микрощипцы щадящие и подходят для расширения. - Поместите биоинженерное легкое, покрытое увлажненной марлей, поверх левого легкого реципиента (рисунок 5E), как можно ближе к средостению реципиента.
- Введение манжеты донорского ПА в ПА реципиента (Рисунок 5F).
ПРИМЕЧАНИЕ: Будет некоторое растяжение донорской ПА. Если размер разреза PA подходящий, вероятность смещения манжеты донора снижается. Перемещение биоинженерного легкого ближе к средостению также предотвратит смещение манжеты донора. - Закрепите вокруг манжеты нейлоновой завязкой 10-0 (Рисунок 5G). Аналогичным образом вставьте и закрепите донорский бронх (рисунок 5H) и манжеты PV (рисунок 5I, J).
- Снимите тонкий аневризматический зажим (рисунок 5L). Обратите внимание на то, что кровь течет обратно за пределы ФВ-манжеты, и снимите шелковый галстук на ПА, чтобы возобновить антеградный приток крови к биоинженерному легкому.
- Подготовка манжет
Результаты
В соответствии с протоколом децеллюляризации легкие мышей становятся заметно белыми и полупрозрачными (рисунок 6A). Клеточные компоненты должны быть полностью удалены, но альвеолярная структура остается нетронутой при гистологическом наблюдении (рис. 6B, C). Рецеллюляризованные легкие мышей с использованием 3 × 107 HUVEC с 2-дневной культурой биореактора на основе перфузии демонстрируют однородное распределение HUVEC (рис. 7A). HUVEC мигрируют в периферическую альвеолярную область, образуя капиллярную сеть (рис. 7B). После ортотопической трансплантации и реперфузии биоинженерных легких в биоинженерных легких однородно наблюдается кровоток, содержащий эритроциты (рис. 8A, B).

Рисунок 1: Канюляция блокады сердца и легких у мыши. (А) Подготовленные катетеры легочной артерии. (B) Схема канюляции. (В) Репрезентативное изображение после завершения канюляции. Масштабные линейки = 1 см (A,C). Эта цифра была взята из Tomiyama et al.19. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Подготовка камеры органа. (А) Отверстия вырезаются, как описано. (B) Трубка вставляется, как указано. (C) Подготовка крышки для автоклавируемого стеклянного флакона объемом 250 мл для резервуара для клеток. (D) Стеклянная бутылка объемом 250 мл помещается на магнитную мешалку. Эта цифра была взята из Tomiyama et al.19. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Установка биореактора на основе перфузии. (A) Детали и сборка. (B) Фактическая установка. Обратите внимание, что трубка вставляется между стеклянной дверцей и резиновым уплотнителем. (C) Снимок во время культивирования перфузионного органа с помощью насоса. Эта цифра была взята из Tomiyama et al.19. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Подготовка биоинженерного легкого к трансплантации. (А) Установка инженерного легкого. (В) Рассечение воротника. (В) Вскрытие основной ПА. (D) Вскрытие ПВ. (E) Введение PA в манжету. (F) Фиксация ПВ к манжете. (G) Введение PV в манжету. (H) Фиксация ПВ к манжете. (I) Введение и фиксация левого бронха к манжете. Сокращения: PA = легочная артерия; PV = легочная вена. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
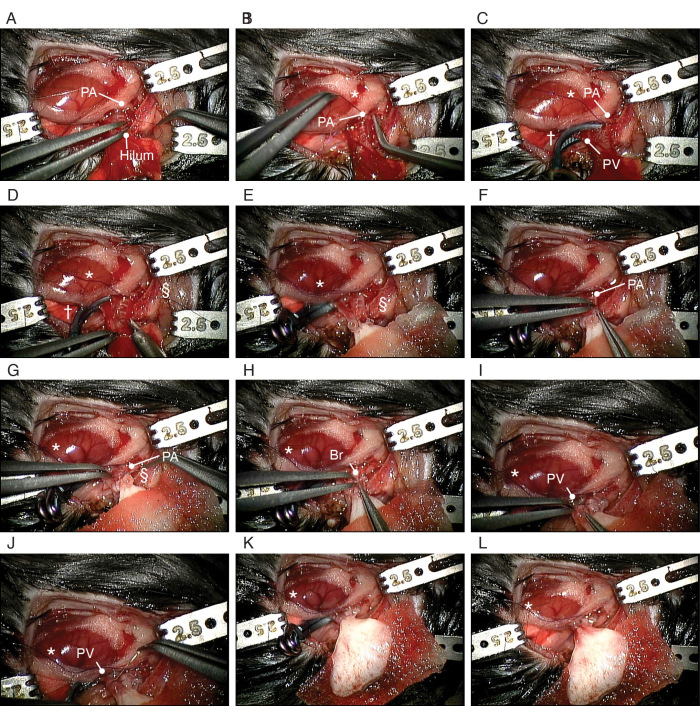
Рисунок 5: Процедура ортотопической трансплантации биоинженерного легкого. (А) Вскрытие ПА реципиента. (Б) Завязывание узла вокруг PA получателя. (C) Обрезка PV и бронхов. (D) Надрез PA. (E) Установка биоинженерного левого легкого. (F) Введение манжеты ПА биоинженерного легкого в ПА реципиента. (G) Закрепление PA вокруг манжеты. (H) Введение бронхиальной манжеты биоинженерного легкого в бронх реципиента. (I) Введение ПВ биоинженерного легкого в ПВ реципиента. (J) Закрепление PA вокруг манжеты. Сокращения: PA = легочная артерия; PV = легочная вена; Br = бронх; * = скользкий узел; † = аневризматический клипс; § = нейлоновый галстук 10-0. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Децеллюляризация легкого мыши. (A) Макроскопическое изображение децеллюляризованного легкого. (B) Маломощное изображение децеллюляризованного легкого (увеличение, 100x). (C) Изображение децеллюляризованного легкого, окрашенное гематоксилином и эозином высокой мощности. Обратите внимание, что отсутствует видимая клеточная составляющая (увеличение, 400x). Масштабные линейки = 100 μм (B), 50 μm (C). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
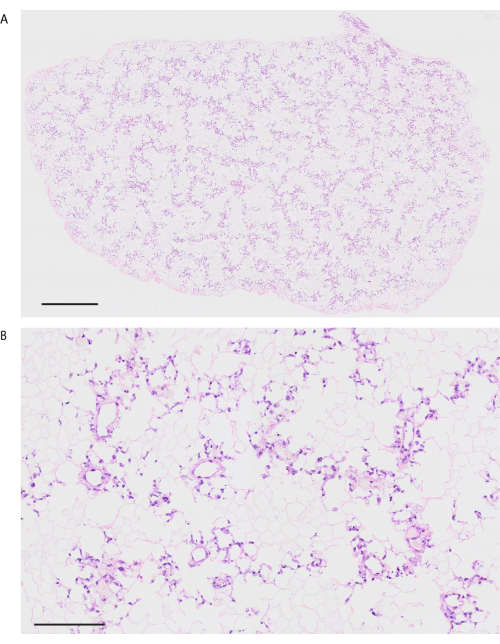
Рисунок 7: Реваскуляризированное легкое мыши с использованием HUVECs. (A) Маломощное изображение реваскуляризированного легкого, окрашенное гематоксилином и эозином (увеличение, 200x, мозаика). (B) Мощное H&E-окрашенное изображение реваскуляризированного легкого (увеличение, 200x). Масштабные линейки = 1000 μм (А), 100 μм (В). Сокращения: HUVECs = эндотелиальные клетки вен пуповины человека; H&E = гематоксилин и эозин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
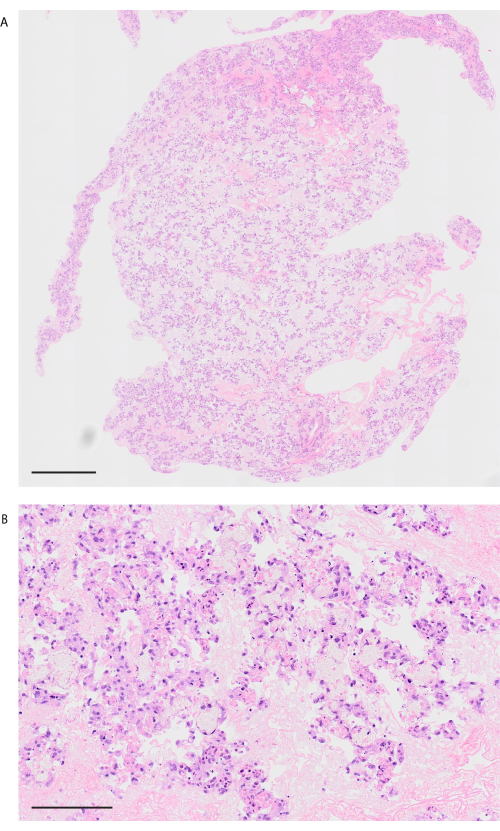
Рисунок 8: Изображение легких после трансплантации и реперфузии крови. (A) Маломощное H&E-изображение реваскуляризированного легкого после 10 минут реперфузии (увеличение, 200x, мозаика). (B) Высокомощное H&E изображение реваскуляризированного легкого после 10 минут реперфузии (увеличение, 200x). Масштабные линейки = 1000 μм (А), 100 μм (В). Сокращение: H&E = гематоксилин и эозин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Органная биоинженерия – это сложная задача. Дорогостоящий процесс отбора затрудняет цикл исследований и разработок в этой области. При использовании мышей в качестве экспериментальной платформы пространство, клетки и среда значительно сокращаются по сравнению с ранее используемой крысиной платформой. Несмотря на то, что детальное измерение физических параметров, таких как газообмен, сосудистое сопротивление или податливость легких, еще не достигнуто, модель легких мыши позволяет ускорить сроки исследований, поскольку она позволяет быстро повторять экспериментальные протоколы и тестировать жизнеспособность клеток, интеграцию и взаимодействие каркаса. Мыши быстро размножаются и доступны в многочисленных генетически модифицированных линиях, что обеспечивает гибкость в изучении различных генетических и клеточных модификаций in vivo. Эта способность быстро проверять гипотезы и оптимизировать протоколы помогает нам лучше понять оптимальную клеточную среду и методы культивирования, необходимые для успешной биоинженерии легких. Совершенствуя методы на мышиных моделях, исследователи могут создать масштабируемые методы и протоколы, которые впоследствии могут быть переведены на более крупные животные модели и, в конечном итоге, на человеческие приложения.
Критическим этапом процедуры является установка и фиксация PA катетера. Фиксация катетера PA возможна только с помощью катетера малого диаметра (<3 Fr) с воротником на конце. Из-за хрупкого характера легких хирургическое вмешательство следует проводить с осторожностью. Никакие металлические инструменты не должны касаться поверхности легких; В противном случае из легкого произойдет значительная утечка. При необходимости используйте ватный тампон, чтобы маневрировать легкими. Авторы предполагают, что исследователи могут эффективно выполнить процедуру канюляции после обучения на 10-15 мышах.
Описанный здесь протокол децеллюляризации основан на предыдущих отчетах22,24. Могут быть применимы и другие протоколы с использованием различных наборов моющих средств. К блокаде сердца и легких всегда следует относиться с осторожностью. Типичные инциденты во время процедуры децеллюляризации включают проникновение в катетер PA, отхождение катетера трахеи и утечку воздуха. Авторами экспериментально не подтверждена целостность децеллюляризованного каркаса после холодильного хранения в PBS. Тем не менее, авторы не испытывали проблем при использовании децеллюляризованных блоков сердца-легких, хранящихся в PBS до 4 недель.
Крайне важно избегать бактериального загрязнения. Все стеклянное оборудование, ПВДФ и силиконовые детали должны быть автоклавированы перед экспериментом. Остальные части следует использовать только один раз. Чтобы свести к минимуму риск бактериального заражения, все процедуры следует проводить в чистом шкафу биобезопасности. Желательно включать в состав среды антимикотики, а также антибиотики. Частая смена среды во время перфузии увеличивает риск загрязнения. Кроме того, в трубке всегда следует избегать образования пузырьков воздуха. Пузырьки воздуха в трубке впоследствии задерживаются в децеллюляризованном каркасе, что может блокировать перфузию среды в периферической области и привести к неоднородному распределению клеток. Кроме того, эндотелиальные клетки должны быть тщательно отделены с помощью трипсинизации или других подходящих сред для диссоциации клеток. Клеточные гранулы должны быть хорошо разрушены, чтобы получилась однородная одноклеточная суспензия. Слишком высокая плотность клеток (например, >2 миллиона клеток/мл) может способствовать образованию клеточных скоплений, что может привести к эмболии в проксимальном отделе сосудистой системы.
Мы испытали только короткий период (2 или 3 дня) перфузионной культуры биореактора. В нашем предыдущем исследовании мы использовали различное количество эндотелиальных клеток для реваскуляризации децеллюляризованного каркаса легких мыши и обнаружили, что существует порог, при котором добавление большего количества клеток не улучшает покрытие клеток, который составил ~3 × 107 эндотелиальных клеток на блок легких и сердцамыши 19. Мы ожидаем, что более длительная продолжительность культивирования (например, 14 дней) улучшит охват и созревание рецеллюляризованной сосудистой сети, как описано в предыдущих исследованиях биоинженерии легких 9,10,15,25.
Основа биоинженерного препарата легочного трансплантата аналогична основе обычной трансплантации легких мыши26,27. Сконструированная легочная ткань не такая хрупкая, как обычный легочный трансплантат. Проблема заключается в том, что легочная ткань, включая структуру ворот, полностью белая или почти прозрачная. Точное понимание местной анатомии необходимо для успешной трансплантации. Стабильная техника должна быть заработана с использованием родных легких. Авторы предполагают, что исследователи могут комфортно провести процедуру трансплантации после обучения на 100 мышах.
Трансплантация биоинженерного легкого с использованием клеток, полученных от человека, у мышей технически доступна; Тем не менее, острое отторжение трансплантата неизбежно из-за ксенотрансплантационного характера этой модели. Эта модель может быть использована для проверки краткосрочной эффективности рецеллюляризации биоинженерных легких, а долгосрочная функциональность должна быть исследована на мышах с иммунодефицитом.
Несмотря на то, что биоинженерия всего легкого не была проверена в текущем методе, биоинженерия всего легкого с использованием эндотелиальных и эпителиальных клеток технически не должна быть такой сложной, учитывая описанные здесь трудности в инженерии легочных сосудов. Кроме того, эта мышиная платформа может быть расширена для других областей исследований, таких как изучение клеточного взаимодействия в условиях 3D-культуры, взаимодействие клеточного матрикса, моделирование рака ex-vivo и так далее. Подводя итог, можно сказать, что этот метод обеспечивает разумную и надежную платформу для биоинженерии легких.
Раскрытие информации
У авторов нет конфликта интересов в отношении данной рукописи.
Благодарности
Это исследование было финансово поддержано Grant-in-Aid for Scientific Research / KAKENHI (C) #20K09174, #23K08308, Фондом содействия совместным международным исследованиям (Fostering Joint International Research (B)) #22KK0132 для TS, JSPS KAKENHI Grant Number 21K08877 для TW, Leave a Nest Grant Ikeda-Rika award для FT и Grant-in-Aid для JSPS Fellows #21J21515 для FT. Мы выражаем глубокую признательность г-же Майко Уэда, техническому персоналу Центра биомедицинских исследований Высшей школы медицины Университета Тохоку, за ее интенсивную работу в области гистологического наблюдения. Мы также признательны г-же Юми Йошида и г-ну Кодзи Кадзи за их технические консультации из Центра исследовательских инструментов IDAC Университета Тохоку за их поддержку в обработке изображений.
Материалы
| Name | Company | Catalog Number | Comments |
| DECELLULARIZATION | |||
| 27 G x 1/2 in. BD PrecisionGlide Needle | BD | 305109 | Or equivalent 27 G injection needle |
| BD Insyte IV Catheter 20 GA X 1.8 8IN | BD | 381237 | Or equivalent 20 G IV catheter |
| Blade silk suture (4-0) | Nesco | GA04SB | Or equivalent |
| CaCl2 | Sigma-Aldrich | C5670 | |
| Catheter for rat jugular vein, PU 2Fr 10 cm | Instech | C20PU-MJV1301 | Recommended for mice weighs 30 g and under. |
| Catheter for rat jugular vein, PU 3Fr 10 cm | Instech | C30PU-RJV1307 | Recommended for mice weighs over 30 g. |
| DNase I | Sigma-Aldrich | DN25 | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| NaCl | Sigma-Aldrich | S3014 | |
| PinPort injectors | Instech | PNP3M | |
| PinPorts, 22 G | Instech | PNP3F22-50 | Fits C30PU-RJV1307 |
| PinPorts, 25 G | Instech | PNP3F25-50 | Fits C20PU-MJV1301 |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | |
| Sterile syringe, 5 mL | Generic | ||
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| CELL CULTURE | |||
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| HUVEC – Human Umbilical Vein Endothelial Cells | Lonza | C2519A | |
| PERFUSION-BASED BIOREACTOR | |||
| 20 G needle | Generic | ||
| 3-way stopcock | Generic | ||
| Cork borer | Generic | Boring size, 6-10 mm | |
| EasyLoad III pump head | Cole-Parmer | 243934 | |
| Glass canister | Hario | SCN-200T | Inner diameter: 80 mm |
| Heating magnetic stirrer | Generic | ||
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9965-01 | Female, fits tubing with I.D. 1.5 mm (L/S 14) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9964-01 | Male, fits tubing with I.D. 1.5 mm (L/S 14) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9965-03 | Female, fits tubing with I.D. 3 mm (L/S 16) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9964-03 | Male, fits tubing with I.D. 3 mm (L/S 16) |
| Magnetic stirring bar | Generic | ||
| Masterflex L/S Digital Precision Modular Drive with Remote I/O and Benchtop Controller | Cole-Parmer | 07557-00 | |
| Masterflex L/S Precision Pump Tubing, PharMed BPT, L/S 16 | Cole-Parmer | 06508-16 | |
| Masterflex L/S Pricision Pump Tubing, Platinum-Cured Silicone, L/S 14 | Cole-Parmer | 96410-14 | |
| Millex-GP Syringe Filter Unit, 0.22 µm, polyethersulfone, 33 mm, gamma sterilized | Millipore | SLGPR33RS | |
| Pyrex 250 mL grass bottle, GL-45 screw cap | Corning | 1395-250 | |
| Silicon Septa for GL45 Open Top PBT Screw Cap | Corning | 1395-455S | |
| Silicone Light Stopper | IMG | 07763-18 | Upper diameter: 87 mm, Lower diameter: 75 mm |
| Sterile syringe, 10 mL, 50 mL | Generic | ||
| MOUSE SURGERY (Isolation of the heart-lung block | Lung transplantation) | |||
| 10-0 Nylon ties | Kono Seisakusho | N/A | |
| 10-0 Silk ties | Kono Seisakusho | N/A | |
| 4-0 Silk ties | Kono Seisakusho | N/A | |
| Arterial clamp, 45 mm curved, grooved | Natsume seisakusyo | C-17-45 | |
| BD Insyte IV Catheter 24GA | BD | 381512 | Or equivalent 24G i.v. catheter |
| Bulldog Vascular Forceps 45mm curved | Natsume seisakusyo | M2 | |
| Butorphanol tartrate | Meiji Seika Pharma | N/A | |
| Cefazolin Sodium | Otsuka Pharmaceutical | N/A | |
| Dumont forceps #5/45 | Fine Science Tools | 1251-35 | |
| Fine vannas style spring scissors | Fine Science Tools | 15403-08 | 45° tip, 0.01 x 0.06 mm |
| Gemini Cautery Kit | Harvard Apparatus | RS-300 | |
| Halsted-Mosquito clamp curved tip, 125 mm | Bioresearch center | 16181670 | |
| Hegar needle holder, 150 mm | B Braun/Aesculap | BM065R | |
| Heparine solution | Mochida Seiyaku | N/A | |
| Medetomidine | Nippon Zenyaku Kogyo | N/A | |
| Micro forceps straight | B Braun/Aesculap | BD33R | |
| Midazolam | Sandoz | N/A | |
| Mouse Ventilator | Harvard Apparatus | Model 687™ | |
| Normal Saline, Clinical grade | Otsuka Pharmaceutical | N/A | |
| Petri dish, 60 x 15 mm | BD | 351007 | |
| Safelet Cath PU 20 gauge polyurethan catheter | Nipro | 09-031 | |
| Sakaki stainless scissors curved 14 cm | Bioresearch center | 64152034 | |
| Scalpel holder | Bioresearch center | 16101040 | |
| Small animal retraction system | Fine Science Tools | 18200-20 | |
| Spare blade scalpel #11 | Muranaka Medical Instruments | 567-001-03 | |
| Spring scissors, 15 cm | Bioresearch center | PRI13-3736 | |
| Stereomicroscope | Leica Microsystems | M525 | Clinical-grade surgical microscope with a flexible arm system is preferable. |
| Sugita titanium aneurysm clip curved slim, No.98 | Mizuho medical | 17-001-98 | |
| Sugita titanium clip applier, 110 mm | Mizuho medical | 17-013-53 | |
| Temperature-adjustable electric warmer | Generic | ||
| Ultrafine cotton swab | Generic | ||
| VASCULAR AND BRONCHIAL CUFF | |||
| Fine sandpaper | Generic | ||
| Venula 20 gauge Teflon angiocatheter | Top | 1160 | |
| Venula 22 gauge Teflon angiocatheter | Top | 1161 | |
| Venula 24 gauge Teflon angiocatheter | Top | 1124 |
Ссылки
- van der Mark, S. C., Hoek, R. A. S., Hellemons, M. E. Developments in lung transplantation over the past decade. Eur Respir Rev. 29 (157), 190132 (2020).
- Valapour, M., et al. OPTN/SRTR 2022 Annual Data Report: Lung. Am J Transplant. 24 (2S1), S394-S456 (2024).
- Hoffman, T. W. Waiting list dynamics and lung transplantation outcomes after introduction of the lung allocation score in the Netherlands. Transplant Direct. 7 (10), e760 (2021).
- Wilk, A. R., Edwards, L. B., Edwards, E. B. The effect of augmenting OPTN data with external death data on calculating patient survival rates after organ transplantation. Transplantation. 101 (4), 836-843 (2017).
- Neizer, H., Singh, G. B., Gupta, S., Singh, S. K. Addressing donor-organ shortages using extended criteria in lung transplantation. Ann Cardiothorac Surg. 9 (1), 49-50 (2020).
- Oliveira, P., Yamanashi, K., Wang, A., Cypel, M. Establishment of an ex vivo lung perfusion rat model for translational insights in lung transplantation. J Vis Exp. (199), e65981 (2023).
- Anand, R. P. Design and testing of a humanized porcine donor for xenotransplantation. Nature. 622 (7982), 393-401 (2023).
- Shakir, S., Hackett, T. L., Mostaco-Guidolin, L. B. Bioengineering lungs: An overview of current methods, requirements, and challenges for constructing scaffolds. Front Bioeng Biotechnol. 10, 1011800 (2022).
- Ott, H. C. Regeneration and orthotopic transplantation of a bioartificial lung. Nat Med. 16 (8), 927-933 (2010).
- Petersen, T. H. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Leiby, K. L. Rational engineering of lung alveolar epithelium. NPJ Regen Med. 8 (1), 22 (2023).
- Kitano, K., et al. Orthotopic transplantation of human bioartificial lung grafts in a porcine model: A feasibility study. Semin Thorac Cardiovasc Surg. 34 (2), 752-759 (2022).
- Ohata, K., Ott, H. C. Human-scale lung regeneration based on decellularized matrix scaffolds as a biologic platform. Surg Today. 50 (7), 633-643 (2020).
- Ren, X. Engineering pulmonary vasculature in decellularized rat and human lungs. Nat Biotech. 33 (10), 1097-1102 (2015).
- Doi, R. Transplantation of bioengineered rat lungs recellularized with endothelial and adipose-derived stromal cells. Sci Rep. 7 (1), 8447 (2017).
- Stone, K. C., Mercer, R. R., Gehr, P., Stockstill, B., Crapo, J. D. Allometric relationships of cell numbers and size in the mammalian lung. Am J Respir Cell Mol Biol. 6 (2), 235-243 (1992).
- Basil, M. C., Morrisey, E. E. Lung regeneration: a tale of mice and men. Semin Cell Dev Biol. 100, 88-100 (2020).
- Hsia, C. C., Hyde, D. M., Weibel, E. R. Lung structure and the intrinsic challenges of gas exchange. Compr Physiol. 6 (2), 827-895 (2016).
- Tomiyama, F., et al. Orthotopic transplantation of the bioengineered lung using a mouse-scale perfusion-based bioreactor and human primary endothelial cells. Sci Rep. 14 (1), 7040 (2024).
- Stoian, A., Adil, A., Biniazan, F., Haykal, S. Two decades of advances and limitations in organ recellularization. Curr Issues Mol Biol. 46 (8), 9179-9214 (2024).
- Crabbe, A. Recellularization of decellularized lung scaffolds is enhanced by dynamic suspension culture. PLoS One. 10 (5), e0126846 (2015).
- Daly, A. B. Initial binding and recellularization of decellularized mouse lung scaffolds with bone marrow-derived mesenchymal stromal cells. Tissue Eng Part A. 18 (1-2), 1-16 (2012).
- . Regulations for Animal Experiments and Related Activities Available from: https://www.clag.med.tohoku.ac.jp/clar/en/ (2024)
- Sokocevic, D., et al. The effect of age and emphysematous and fibrotic injury on the re-cellularization of de-cellularized lungs. Biomaterials. 34 (13), 3256-3269 (2013).
- Ren, X., et al. Ex vivo non-invasive assessment of cell viability and proliferation in bio-engineered whole organ constructs. Biomaterials. 52, 103-112 (2015).
- Watanabe, T. Mesenchymal stem cells attenuate ischemia-reperfusion injury after prolonged cold ischemia in a mouse model of lung transplantation: a preliminary study. Surg Today. 47 (4), 425-431 (2017).
- Watanabe, T., et al. Donor IL-17 receptor A regulates LPS-potentiated acute and chronic murine lung allograft rejection. JCI Insight. 8 (21), e158002 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены