Method Article
زرع الرئة المعدلة بيولوجيا باستخدام رئتي الفئران منزوعة الخلايا والخلايا البطانية البشرية الأولية
In This Article
Summary
توضح هذه الورقة كيفية إنشاء رئتي الفئران المعدلة بيولوجيا باستخدام طرق إزالة الخلايا وإعادة الخلية. كما أنه يفصل زراعة الرئة التقويمية اللاحقة.
Abstract
تعتبر زراعة الرئة علاجا مهما للمرضى الذين يعانون من أمراض الرئة في المرحلة النهائية مثل التليف الرئوي مجهول السبب ، لكن التحديات مثل نقص المتبرعين ومضاعفات ما بعد الزرع لا تزال قائمة. تقدم الرئتان المعدلة بيولوجيا ، التي تدمج الخلايا الخاصة بالمريض في سقالات حيوانية منزوعة الخلايا ، بديلا واعدا. على الرغم من التقدم المحرز في استخدام الرئتين المعدلة بيولوجيا في النماذج الحيوانية ، لا تزال الوظائف والبنية غير ناضجة. يعالج هذا البروتوكول عائقا حاسما في الهندسة الحيوية للأجهزة: الحاجة إلى منصة تجريبية فعالة من حيث التكلفة. باستخدام نماذج الفئران بدلا من الكبيرة مثل الجرذان أو الخنازير ، يمكن للباحثين تقليل الموارد المطلوبة لكل تجربة بشكل كبير ، مما يؤدي إلى تسريع تقدم البحث.
يحدد البروتوكول إجراء مفصلا للهندسة الحيوية للرئة باستخدام كتل القلب والرئة للفأر والخلايا الأولية البشرية ، مع التركيز على استراتيجية العزل لإحصار القلب والرئة للفأر ، وإزالة الخلايا ، وإعداد المفاعل الحيوي ، وزراعة الأعضاء القائمة على التروية ، وزرع تقويم العظام للرئتين المعدلة بيولوجيا. لا تقلل هذه المنصة على نطاق الماوس من التكاليف التجريبية فحسب ، بل توفر أيضا إطارا قابلا للتطبيق لتحسين أنواع الخلايا وأعدادها لإعادة الخلايا ، واختبار أنواع الخلايا المختلفة باستخدام الطرق النسيجية والجزيئية ، وضمان تدفق الدم بعد الزرع. تحمل هذه الطريقة إمكانية لتطبيقات واسعة النطاق ، بما في ذلك دراسة تفاعلات الخلايا في ظروف الثقافة ثلاثية الأبعاد ، وتفاعلات مصفوفة الخلية ، ونمذجة السرطان خارج الجسم الحي ، وبالتالي تطوير مجال الهندسة الحيوية للأجهزة.
Introduction
كانت زراعة الرئة هي العلاج الحاسم للمرضى الذين يعانون من مرض الرئة في المرحلةالنهائية 1 مثل التليف الرئوي مجهول السبب ، حيث يكون العلاج الدوائي غير فعال لوقف تدهور وظيفة الجهاز التنفسي. يضيف المزيد من المرضى المؤهلين إلى قائمة الانتظار كل عام ؛ ومع ذلك ، فإن عدد التبرعات بالأعضاء من المتبرعين المتوفين كان يتخلف عن العدد المتزايد من المرضى المنتظرين 2,3. حتى بعد الخضوع لعملية زرع الرئة ، فإن عددا غير قليل من المشاكل من شأنه أن يؤدي إلى تدهور وظيفة الرئتين المزروعة ، بما في ذلك الخلل الوظيفي للأعضاء الأولية ، والمتلازمة الخيفية التفاعلية ، والالتهابات ، مما يقلل بشكل كبير من بقاء متلقي زراعة الرئة لمدة 5 سنوات4.
توجد العديد من الخيارات لمواجهة المشاكل الحالية في زراعة الأعضاء ، بما في ذلك استخدام المتبرعين الهامشيين5 ، واستعادة رئتي المتبرع في نظام نضح الرئة خارج الجسم الحي 6 ، وزرع الأجانب باستخدام الخنازير المعدلةجينيا 7. ويمكن لهذه البدائل أن توسع مجموعة الأعضاء المانحة؛ ومع ذلك ، لا يمكن لأي منها أن يعالج تماما ندرة أعضاء المتبرع ومناعتها وعدم تجانسها الوظيفي.
إنه بعيد كل البعد عن الواقع ، لكن الأعضاء الاصطناعية المهندسة بيولوجيا حيث يتم دمج الخلايا الخاصة بالمريض في سقالة الأعضاء الحيوانية منزوعة الخلايا هي مصدر محتمل رائع لزرع الأعضاء الصلبة8. تم الإبلاغ عن العديد من الدراسات الرائدة التي أظهرت الفائدة المحتملة للرئتين المهندسة بيولوجيا منذ عام 2010 9,10. في هذه الدراسات ، تم نزع الخلايا من رئتي الفئران أو الخنازير بواسطة المنظفات ، وتم حقن الخلايا الحيوانية أو البشرية من القصبة الهوائية أو الأوعية الدموية الرئوية لتجديد أنسجة الرئة في المفاعل الحيوي القائم على التروية ، وتم زرع بعضها تقويما في تجاويف الصدر الحيوانية11 ، 12 ، 13 ، 14 ، 15. ومع ذلك ، كانت وظيفة وهيكل الرئتين المهندسة بيولوجيا سابقة لأوانها ، ويفترض ذلك بسبب عدم كفاية عدد الخلايا المزروعة في المفاعل الحيوي أو الوصلات بين الخلايا الأقل تكاملا.
تتمثل إحدى العقبات التي تحول دون النهوض بالبحث في الهندسة الحيوية للأعضاء في عدم وجود منصة تجريبية صغيرة النطاق. في حين أن الفئران أو الخنازير هي الشائعة الاستخدام في هذا المجال ، إلا أنها تتطلب >108 خلايا رئوية لكل رئة16 ، وهو أمر مكلف للغاية للمختبرات الأكاديمية. إذا كانت الفئران متاحة لأبحاث الهندسة الحيوية للأعضاء ، فيمكننا تقليل تكلفة كل تجربة بشكل كبير وتسريع برنامج البحث. على الرغم من وجود اختلافات تشريحية بين الفأر ورئتي الإنسان17 ، إلا أن البنية الأساسية للرئة متشابهة عبر الثدييات18. لذلك ، يمكن أن تنطبق نتائج التجارب على نطاق الفأر على الكبيرة ببساطة عن طريق ضرب الرقم وفقا لحجم الجسم.
يهدف هذا البروتوكول إلى وصف الإجراء التجريبي التفصيلي للهندسة الحيوية للرئة باستخدام كتل الفئران والقلب والرئة والخلايا الأولية البشرية19. اعتمدنا بروتوكول إزالة الخلايا من رئة الفأر الذي تم الإبلاغ عنه سابقا والمستخدم على نطاق واسع لهذه الدراسة20،21،22. الجزء الصعب من الهندسة الحيوية للرئة هو إعادة خلية الأوعية الدموية الشعرية منزوعة الخلايا20. لذلك ، سيتم استخدام الخلايا البطانية الوريدية للحبل السري البشري في هذا البروتوكول.
Protocol
اتبعت جميع التجارب لوائح التجارب على والأنشطة ذات الصلة في جامعة توهوكو(الطبعة 15) ، التي نشرتها جامعة توهوكو23. تمت الموافقة على هذه الدراسة من قبل اللجنة المؤسسية لرعاية واستخدامه في جامعة توهوكو (#2020AcA-041-01).
1. تحضير المواد لإزالة الخلايا
- تحضير محاليل إزالة الخلايا (بتنسيق 1,000 مل في زجاجة زجاجية قابلة للتعقيم بسعة 1 لتر)
- الماء المعقم منزوع الأيونات (DI): أضف 1,000 مل من الماء المقطر أو الماء DI إلى زجاجات زجاجية قابلة للتعقيم سعة 1 لتر. الأوتوكلاف لمدة 20 دقيقة عند 121 درجة مئوية.
- Triton X-100: أضف 1 مل من Triton X-100 إلى 1,000 مل من ماء DI المعقم في زجاجة زجاجية قابلة للتعقيم بحجم 1 لتر. (اختياري) أضف 10 مل من محلول البنسلين والستربتومايسين (التركيز النهائي ، 500 وحدة / مل من البنسلين و 500 ميكروغرام / مل من الستربتومايسين).
ملاحظة: لا تقم بالأوتوكلاف. - ديوكسي كولات الصوديوم: أضف 20 جم من مسحوق ديوكسي كولات الصوديوم إلى 1,000 مل من ماء DI المعقم في زجاجة زجاجية قابلة للتعقيم بحجم 1 لتر. أغلق الغطاء واقلب الزجاجة لإذابة المسحوق. (اختياري) أضف 10 مل من البنسلين ومحلول الستربتومايسين.
ملاحظة: لا تقم بالأوتوكلاف. - 1 M كلوريد الصوديوم: أضف 58.44 جم من كلوريد الصوديوم إلى 1,000 مل من الماء المقطر أو الماء المقطر في زجاجة زجاجية قابلة للتعقيم بحجم 1 لتر. الأوتوكلاف لمدة 20 دقيقة عند 121 درجة مئوية.
- محلول مخزون DNase I: يخفف بتركيز 10 مجم / مل في المتوسط أ.
- متوسط أ: تحضير 5 ملي CaCl2 (5 مجم من CaCl2 في 9 مل من ماء DI المعقم) و 1:10 مخفف بماء DI معقم.
- حل عمل DNase I: أضف 33 ميكرولتر من محلول مخزون DNase I إلى 10 مل من Medium B.
- متوسط ب: تحضير 10x متوسط B (155 مجم من MgSO4 + 220 مجم من CaCl2 في 100 مل من ماء DI المعقم) و 1:10 مخفف بماء DI معقم.
- تحضير القسطرة للشريان الرئوي (PA) والقصبة الهوائية (إجراء معقم)
- قطع قسطرة PA (قسطرة للوريد الوداجي للفئران) بطول حوالي 15 مم.
- حرك الطوق إلى نهاية القسطرة.
- أدخل موصل قسطرة في قسطرة PA وقم بتوصيله بحاقنة. يتم عرض قسطرة PA المعدة في الشكل 1 أ.
- قم بتخزين قسطرة PA في 70٪ من الإيثانول حتى الاستخدام.
- قطع القسطرة 20 G ivv بطول 15 مم تقريبا. يستخدم هذا لقسطرة القصبة الهوائية.
- جراحة الفئران لحصاد إحصار القلب والرئة
- قتل فأر ذكر (C57BL / 6 ، وزنه > 28 جم) بجرعة زائدة من ثاني أكسيد الكربون أو الأيزوفلوران.
- ضع الفأر في وضع ضعيف على طاولة جراحية وقم بإصلاح الأطراف. تعقيم عن طريق رش 70٪ إيثانول على سطح الصدر والبطن.
- افتح تجويف البطن في الخط المتوسط إلى الرقبة بمقص غير قابل للصدأ وقم بتقسيم القص بالمقص. قم بإزالة الحجاب الحاجز من جدار الصدر ، وقطع جدار الصدر البطني لكشف تجاويف الصدر بالكامل ، وإزالة الغدة الصعترية. اربط الوريد الأجوف السفلي والوريد الأجوف العلوي الأيمن بحرير 4-0 لمنع قلس PBS في الخطوة 1.3.5 ، وبالتالي تعزيز غسل الدم في الأوعية الدموية الرئوية.
- قطع الشريان الأورطي البطني بمقص غير قابل للصدأ للتصريف. إذا كان الشريان الأورطي البطني غير ملحوظ ، فقم بقطع الوريد الأجوف السفلي والشريان الأورطي البطني تماما.
- حقن 3 مل من PBS المعقم من البطين الأيمن بحقنة معقمة سعة 5 مل بإبرة 27 جم عن طريق ثقب جدار البطين الأيمن.
- قم بلف السلطة الفلسطينية الرئيسية بحرير 4-0 باستخدام ملقط دومون.
ملاحظة: يمكن تكرار PA الرئيسي والشريان الأورطي الصاعد معا. - افتح نافذة مقاس 2 مم أسفل صمامات PA عن طريق قطع جدار البطين الأيمن بمقص زنبركي.
- أدخل قسطرة PA من خلال النافذة وقم بتأمين الحرير الحلقي مسبقا 4-0 (الشكل 1 ب).
ملاحظة: تجنب لمس PA أثناء هذا الإجراء ، مما قد يؤدي إلى تلف جدار PA. يمكن ربط PA الرئيسي والشريان الأورطي الصاعد وتثبيتهما معا. - حقن 2 مل من PBS ببطء من خلال قسطرة PA بحقنة معقمة سعة 5 مل. تأكد من أن كلتا الرئتين تتمدد قليلا أثناء حقن PBS.
- قم بتقطيع القصبة الهوائية بقسطرة القصبة الهوائية وربطة عنق في مكانها بخياطة حريرية 4-0 (الشكل 1 ج).
- حقن 2 مل من الهواء ببطء من خلال قسطرة القصبة الهوائية بحقنة معقمة فارغة سعة 5 مل واحتفظ بها لمدة 10 ثوان. تأكد من عدم وجود تسرب للهواء من الرئتين.
- قم بإزالة القلب والرئة في كتلة. أمسك القصبة الهوائية بملقط دومون ومع قسطرة القصبة الهوائية بالداخل ، وقم بقطع مريء عنق الرحم ، وقم بتشريحها من الفقرات. قطع الأوردة والشرايين تحت الترقوة الثنائية. أخيرا ، قم بقطع المريء وتحت الحمراء الوريد الأجوف على مستوى الحجاب الحاجز.
ملاحظة: لا تلمس سطح الرئة بأي أدوات. أي لمسة طفيفة يمكن أن تؤدي إلى تسرب الهواء.
- نزع الخلايا من رئتي الفأر (إجراء 3 أيام)
ملاحظة: يجب تنفيذ جميع الإجراءات الواردة في القسم 1.4 في خزانة نظيفة للسلامة البيولوجية.- اليوم 1
- انقل كتلة القلب والرئة المقطوعة إلى طبق بتري بلاستيكي بقطر 10 سم واحتضان كتل القلب والرئة في ماء DI معقم لمدة ساعة واحدة عند 4 درجات مئوية.
- حقن 2 مل من ماء DI المعقم من خلال قسطرة القصبة الهوائية 3x و 2 مل من الماء المعقم من خلال قسطرة PA مع حقنة معقمة سعة 5 مل. توقف مؤقتا بعد كل حقنة للسماح للسائل بالخروج مع ارتداد الرئة (الشكل 1 ج).
ملاحظة: حقن الماء بحوالي 0.5 مل / ثانية. - حقن 2 مل من محلول Triton X-100 0.1٪ في القسطرة القصبية و 2 مل في قسطرة PA.
- ضع كتلة القلب والرئة في طبق بتري واحتضانها بشكل ثابت في محلول Triton X-100 طوال الليل عند 4 درجات مئوية.
- اليوم 2
- قم بإزالة محلول Triton X-100 من الرئتين بماء DI معقم كما هو موضح في الخطوة 1.4.1.2.
- حقن 2 مل من محلول ديوكسي كولات الصوديوم 2٪ في القسطرة الهوائية و 2 مل في قسطرة PA. احتضان في محلول ديوكسي كولات لمدة 24 ساعة عند 4 درجات مئوية.
- اليوم 3
- قم بإزالة محلول ديوكسي كولات الصوديوم من الرئتين بماء DI معقم كما هو موضح في الخطوة 1.4.1.2.
- حقن 2 مل من محلول كلوريد الصوديوم 1 M في القسطرة القصبية و 2 مل في قسطرة PA. احتضان في محلول كلوريد الصوديوم لمدة 1 ساعة في RT.
- أخرجه من محلول كلوريد الصوديوم بماء DI معقم كما هو موضح في الخطوة 1.4.1.2.
- حقن 2 مل من محلول عمل DNAse I في قسطرة القصبة الهوائية و 2 مل في قسطرة PA. احتضان في حل عمل DNase لمدة 1 ساعة في RT.
- قم بإزالة محلول DNase من الرئتين كما هو موضح في الخطوة 1.4.1.2 ولكن باستخدام PBS معقم. تأكد من أن الرئتين بيضاء وشفافة على الحافة بعد إجراء إزالة الخلايا.
ملاحظة: مع تقدم إجراء إزالة الخلايا ، تصبح الرئة أكثر هشاشة. تعامل دائما مع كتلة القلب والرئة بحذر وتجنب لمس سطح الرئة. بعد إزالة الخلايا ، يمكن تخزين كتل القلب والرئة في PBS / المضادات الحيوية عند 4 درجات مئوية لمدة تصل إلى 3 أسابيع.
- اليوم 1
2. ثقافة الخلايا الأولية البشرية
- امزج وسط نمو الخلايا البطانية -2 (EGM2) ومجموعة الرصاص التي تحتوي على مصل بقري جنيني (التركيز النهائي ، 2٪) ، الهيدروكورتيزون (التركيز النهائي ، 0.2 ميكروغرام / مل) ، عامل نمو الخلايا الليفية الأساسية للإنسان (التركيز النهائي ، 4 نانوغرام / مل) ، عامل نمو بطانة الأوعية الدموية (2 نانوغرام / مل) ، عامل النمو الشبيه بالأنسولين R3 -1 (التركيز النهائي ، 5 نانوغرام / مل) ، حمض الأسكوربيك (التركيز النهائي ، 75 ميكروغرام / مل) ، عامل نمو البشرة البشري (التركيز النهائي ، 10 نانوغرام/مل)، جنتاميسين/أمفوتريسين-1000 (التركيز النهائي، الجنتاميسين: 30 ميكروغرام/مل، الأمفوتريسين: 15 نانوغرام/مل)، والهيبارين (التركيز النهائي، 1 نانوغرام/مل).
- قم بإذابة الجليد 2 × 106 خلايا بطانة الوريد السري البشري (HUVECs) في قوارير مجمدة في حمام مائي عند 37 درجة مئوية.
- امزج الخلايا مع EGM2 في أنبوب مخروطي سعة 15 مل وجهاز طرد مركزي بسعة 500 × جم لمدة 5 دقائق.
- عد الخلايا وزراعتها الفرعية بكثافة خلوية مناسبة (يوصى ب 2.0 × 104 خلايا / سم2 ). ابدأ من لوحات بتنسيق 6 آبار ثم انقلها إلى قوارير T75.
- قم بتمرير الخلايا حتى يتم الحصول على العدد المطلوب من الخلايا.
ملاحظة: لتغطية الأوعية الدموية الرئوية الكاملة باستخدام HUVECs ، ستكون هناك حاجة إلى 3 × 107 HUVECs19.
3. إعداد المفاعل الحيوي وثقافة أعضاء التروية
- تحضير حجرة الأعضاء وخزان الخلية
- قم بقطع الثقوب في سدادة السيليكون باستخدام حفار الفلين ، كما هو موضح في الشكل 2 أ. أحجام الثقب هي 5 مم (i و ii و iii) و 7 مم (iv و v). يتوافق كل رقم ثقب (i-v) في الشكل 2 أ مع أرقام الثقوب في الشكل 2 ب.
- أدخل أنبوب المضخة من خلال سدادة السيليكون كما هو موضح في الشكل 2 ب.
- قم بقطع ثقب 5 مم في حاجز من السيليكون لغطاء لولبي مفتوح باستخدام حفار الفلين. أدخل أنبوبا معالجا بالبلاتين L / S 14 في الحفرة (الشكل 2 ب ، ج).
- قم بتعقيم المواد المذكورة أعلاه ، بما في ذلك سدادة السيليكون مع الأنابيب ، والعلبة الزجاجية ، وغطاء المسمار GL-45 مع الأنابيب ، وزجاجة زجاجية قابلة للتعقيم سعة 250 مل ، وأنبوب L / S 14 مع تركيبات إغراء (الأنابيب B والأنابيب C في الشكل 3A) لمدة 20 دقيقة عند 121 درجة مئوية. حدد تركيبات الإغراء المناسبة للتأكد من أن الأنابيب B و C تصنع حلقة.
ملاحظة: يتم استخدام العلبة الزجاجية لغرفة الأعضاء ، ويتم استخدام الزجاجة سعة 250 مل لخزان الخلية.
- تجميع دائرة المفاعل الحيوي القائم على التروية
ملاحظة: يجب تنفيذ الإجراءات التالية على مقعد نظيف.- أضف 70 مل من وسائط الثقافة إلى العلبة الزجاجية ثم ضع سدادة السيليكون فوق العلبة الزجاجية.
- قم بتجميع سدادة السيليكون ، وعلبة زجاجية ، وغطاء لولبي GL-45 مع أنابيب ، وزجاجة زجاجية قابلة للتعقيم بسعة 250 مل ، وأنبوب L / S 14 مع تركيبات إغراء باستخدام محبس ثلاثي الاتجاهات كما هو موضح في الشكل 3 أ. أدخل إبرة 20 G في حاجز من السيليكون من غطاء لولبي GL-45.
- املأ الوسائط في الأنابيب A و B و C بحقنة سعة 10 مل متصلة بمحبس i) و iii) (ستكون هناك حاجة ~ 3-5 مل من الوسائط لملء 1 متر من الأنابيب). كرر حقن الوسائط وسحبها باستخدام حقنة سعة 10 مل من خلال محبس ثلاثي الاتجاهات للتأكد من عدم وجود فقاعة هواء داخل الأنبوب.
- قم بتوصيل قسطرة PA لإحصار القلب والرئة منزوعة الخلايا عبر تركيب إغراء متصل بالأنبوب C. تجنب فقاعات الهواء في القسطرة أو الأنبوب.
- حصاد وتعليق HUVECs بكثافة 0.5-1 × 106 خلايا / مل في EGM2. أضف تعليق الخلية من الخطوة 2.5 إلى خزان الخلية.
ملاحظة: يفضل تحضير تعليق الخلية بين الخطوتين 3.2.4 و 3.2.5. ضع شريط التحريك في خزان الخلية.
- الحقن المدفوع بالجاذبية للخلايا البطانية
- ضع خزان الخلية الذي يحتوي على HUVECs على محرك مغناطيسي. تأكد من أن الجزء السفلي من خزان الخلية يقع على ارتفاع 30 سم فوق حجرة العضو (الشكل 2D والشكل 3 أ).
- قم بتشغيل النمام المغناطيسي بسرعة 120 دورة في الدقيقة تقريبا.
- افتح محبس المحطة i) و ii) بحيث يمكن حقن تعليق الخلية في السقالة منزوعة الخلايا عبر الأنبوب A و Tubing C و PA القسطرة.
ملاحظة: عند حقن 3 × 107 خلايا بكثافة خلية تبلغ 1 × 106 خلايا / مل ، يجب أن يكون حجم تعليق الخلية 30 مل. معدل الحقن النموذجي هو 1-2 مل / دقيقة. - بعد حقن تعليق الخلية بالكامل ، افصل الأنبوب A عن Stopcock ii).
ملاحظة: يمكن إجراء عدد الخلايا في هذه الخطوة لقياس معدل الاحتفاظ بالخلايا في السقالة منزوعة الخلايا. معدل الاحتفاظ بالخلايا النموذجي هو 80-90٪ ، بغض النظر عن عدد الخلايا المحقونة19.
تحدد جودة سقالة الرئة منزوعة الخلايا بدقة معدل الاحتفاظ بالخلايا. أي تسرب من الرئة منزوعة الخلايا (على سبيل المثال ، من PA الرئيسي ، سطح الرئة) يؤدي إلى انخفاض معدل احتباس الخلايا. تأكد من عدم وجود تسرب واضح من الرئة منزوعة الخلايا عن طريق حقن 2-3 مل من وسائط المزرعة بحقنة معقمة متصلة بأحد محبس التثبيت في المفاعل الحيوي القائم على التروية وتأكد من أن الرئتين منزوعة الخلايا تتمدد قليلا أثناء حقن الوسائط.
- ثقافة أعضاء التروية
- ضع حجرة الأعضاء في حاضنة ثاني أكسيد الكربون2 .
- قم بتثبيت الأنبوب B برأس مضخة متصل بمضخة نابضة.
- أغلق الباب الزجاجي لحاضنة ثاني أكسيد الكربون2 . تأكد من وضع الأنبوب بشكل صحيح بين الباب الزجاجي والختم المطاطي (الشكل 3 ب).
- احتضان السقالة منزوعة الخلايا عند 37 درجة مئوية لمدة 3 ساعات للسماح للخلايا البطانية المحقونة بالاستقرار في السقالة.
ملاحظة: تأكد من إيقاف تشغيل المضخة النابضة دائما بين الخطوتين 3.4.1 و 3.4.4. - ابدأ تشغيل المضخة بمعدل 6 دورة في الدقيقة ، مما ينتج عنه نضح وسائط 2 مل / دقيقة باستخدام أنبوب L / S 14. شاهد الرئة منزوعة الخلايا وهي تتمدد قليلا مع نضح الوسائط.
- أغلق باب الحاضنة (الشكل 3C).
- قم بإجراء تغيير الوسائط من خلال Stopcock iii). قم بتغيير نصف الوسائط كل 2 أو 3 أيام.
- أوقف محرك المضخة ، وقم بتوصيل حقنة معقمة سعة 50 مل بمحبس ثالث) ، واسحب 50 مل من الوسائط من الغرفة.
- املأ حقنة معقمة أخرى سعة 50 مل ب 50 مل من الوسائط الدافئة مسبقا وانقل الوسائط إلى الغرفة عبر محبس التثبيت الثالث). قم بتبديل محبس المحطة بشكل مناسب ثم ابدأ تشغيل المضخة النابضة.
- حصاد كتلة القلب والرئة المعاد خلوها بعد يومين على الأقل من زراعة أعضاء التروية.
ملاحظة: في دراستنا ، كان يومان من ثقافة التروية كافيين لإعادة وعي سقالة الرئة منزوعة الخلايا بشكل متجانس باستخدام 3 × 107 HUVECs. عند استخدام أقل من 3 × 107 HUVECs ، قد تكون هناك حاجة إلى حضانة أطول لتحسين كفاءة إعادة الخلية.
4. زرع تقويم العظام للرئة المهندسة بيولوجيا
- تحضير الدواء
- تحضير عامل مخدر مركب MMB عن طريق خلط الميدازولام (التركيز النهائي ، 4 مجم / كغ) ، ميديتوميدين (التركيز النهائي ، 0.75 مجم / كغ) ، وطرطرات البوتورفانول (التركيز النهائي ، 5 مجم / كغ) مع محلول ملحي عادي من الدرجة السريرية.
- تحضير محلول الهيبارين عن طريق خلطه مع محلول ملحي عادي من الدرجة السريرية (التركيز النهائي ، 1000 وحدة / مل).
- تحضير سيفازولين الصوديوم عن طريق خلطه مع محلول ملحي عادي من الدرجة السريرية (جرعة واحدة، 30 ملغم/كجم).
- الإجراء الجراحي
- تحضير الأصفاد
- افركي الأنواع الثلاثة من القسطرة الوعائية برفق بورق صنفرة ناعم لتسهيل بقاء الأوعية مكبلة.
- قم بإعداد صفعة قصبية من قسطرة وعائية تفلون 20 جم بطول 1 مم باستخدام مشرط # 11. قبل قطع القسطرة الوعائية ، استخدم الجزء الخلفي من المشرط # 11 لعمل فجوة في القسطرة الوعائية لربط النايلون 10-0.
- تحضير الكفة الوريدية الرئوية (PV) من قسطرة وعائية تفلون 22 جم بطول 0.8 مم وصفعة PA من قسطرة وعائية تفلون 24 جم بطول 0.6 مم.
ملاحظة: يمكن إجراء هذا التحضير قبل يوم التجربة.
- ربط الكفة بالرئة المعدلة بيولوجيا
- ضع كتلة القلب والرئة على قطعة من الشاش المعقم مبللة بمحلول ملحي بارد ، ضع قطعة أخرى من الشاش الجاف والنظيف تحتها ، وضع طبق بتري في صندوق من الستايروفوم مملوء بالثلج النظيف.
ملاحظة: وضع الشاش الجاف يمنع كتلة القلب والرئة من التجمد عن طريق الخطأ. - ضع مشبك تمدد الأوعية الدموية لتأمين القصبة الهوائية والشاش (الشكل 4 أ). ضع قطعة صغيرة من الشاش على القلب ، وتغطي الرئة اليمنى أيضا. ضع شاشا آخر على الرئة اليسرى. اضبط هذا التراجع باستخدام الشاش المبلل لكشف النقير الأيسر بأكبر قدر ممكن من الوضوح.
- قم بتشريح هياكل الهيلار بعناية من بعضها البعض باستخدام ملقط دقيق مستقيم أو بزاوية ، حسب التفضيل (الشكل 4 ب). ابدأ في تشريح الرباط الرئوي على طول العصب المبهم. شق غشاء الجنب الحشوي تحت PV ، وحرك الشريان الأورطي الهابط والعصب المبهم معا عبر الجزء الخلفي من النقير الرئوي الأيسر إلى الجانب الجمجمي.
- قم بتشريح PA الرئيسي الأيسر من الجذع الرئوي إلى حافة الرئة اليسرى (الشكل 4C). ثم قسم السلطة الفلسطينية على مستوى الجذع الرئوي للحصول على الطول الكافي.
- قم بتشريح PV الأيسر من الجانب الأيسر من الأذين الأيسر إلى حافة الرئة اليسرى (الشكل 4D). قسم الكهروضوئية اليسرى على مستوى الأذين الأيسر للحصول على الطول الكافي.
- قم بتعليق صفعة PA فوق PA مباشرة باستخدام مشبك التثبيت وأدخل PA داخل الكفة (الشكل 4E). قم بطي PA فوق الكفة) ، مع تعريض السطح البطاني. قم بتثبيته حول الكفة بربطة عنق من النايلون 10-0 (الشكل 4F). ضع الكفة على PV بطريقة متطابقة (الشكل 4G ، H).
- قسم القصبات الهوائية اليسرى على مستوى الكارينا. ضع الكفة على الشعب الهوائية بطريقة متطابقة (الشكل 4I).
- ضع كتلة القلب والرئة على قطعة من الشاش المعقم مبللة بمحلول ملحي بارد ، ضع قطعة أخرى من الشاش الجاف والنظيف تحتها ، وضع طبق بتري في صندوق من الستايروفوم مملوء بالثلج النظيف.
- إجراء الماوس المستلم
- قم بتخدير الفأر المتلقي بمزيج من MMB ip. بإبرة 27 جم وتنبيب عن طريق إدخال قسطرة وعائية من البولي يوريثين 20 جم تحت المجهر. ضع الماوس المتلقي على جهاز تسخين كهربائي قابل لضبط درجة الحرارة في وضع الاستلقاء الجانبي الأيمن وقم بتوصيل الوعائي بجهاز التنفس الصناعي. اضبط إعداد جهاز التنفس الصناعي على النحو التالي: الأكسجين 2 لتر / دقيقة ، معدل التنفس 120 نبضة في الدقيقة ، حجم المد والجزر 0.5 مل. تعقيم جدار الصدر بنسبة 70٪ من الإيثانول وحقن خليط السيفازولين SC.
- شق الجلد بالمقص. قطع الأنسجة تحت الجلد والعضلات مع الكي. افتح الصدر من خلال المساحة الوربية 3rd وضع ضاعات الصدر.
ملاحظة: على الرغم من أن بضع الصدر يجب أن يكون كبيرا بما يكفي للزرع ، إلا أنه لا تؤذي الشريان الثديي الداخلي ، مما قد يؤدي إلى نزيف حاد. - تشريح الرباط الرئوي بقطعة قطن ومقص زنبركي كبير. ضع منظفا شريانيا منحنيا على الرئة اليسرى للمتلقي لسحب الرئة بسهولة. باستخدام ملقط دقيق بزاوية ، قم بتشريح غشاء الجنب المنصف حول النقير الرئوي الأيسر.
ملاحظة: أساس تشريح غشاء الجنب مشابه لاستئصال الرئة التشريحي للإنسان. - قم بتشريح PA من الشعب الهوائية باستخدام ملقط دقيق منحني من المنصف إلى حافة الرئة اليسرى (الشكل 5 أ). تشريح الشعب الهوائية من PV بطريقة مماثلة.
ملاحظة: يمكن إجراء التشريح بسهولة عند تشريح غشاء الجنب في المناورة السابقة (الخطوة 4.2.3.3). - ضع عقدة منزلقة من الحرير 10-0 عند قاعدة PA للانسداد (الشكل 5 ب). ضع مشبك تمدد الأوعية الدموية النحيف بزاوية عند قاعدة PV والشعب الهوائية (الشكل 5C).
- قم بلف النايلون 10-0 حول الشعب الهوائية ، و PA ، و PV ، واتركها فضفاضة لتأمين الأصفاد في الخطوات التالية.
- قم بشق PA والشعب الهوائية والكهروضوئية الخاصة بالمتلقي على حافة الرئة اليسرى للمتلقي باستخدام مقص microspring (الشكل 5 د). قم بتوسيع PA و PV برفق باستخدام ملقط دقيق مستقيم. قم بإزالة الدم في PA و PV باستخدام محلول ملحي باستخدام حقنة 1 مل و 24 جم من الأوعية الدموية.
ملاحظة: تبلغ شقوق PA والشعب الهوائية والكهروضوئية حوالي ثلث الطريق. الملقط الدقيق المستقيم لطيف ومناسب للتمدد. - ضع الرئة المهندسة بيولوجيا ، المغطاة بشاش مبلل ، فوق الرئة اليسرى للمتلقي (الشكل 5E) ، بالقرب من المنصف المتلقي قدر الإمكان.
- إدخال صفعة PA للمتبرع في PA المتلقي (الشكل 5F).
ملاحظة: سيكون هناك بعض التمدد على السلطة الفلسطينية المانحة. إذا كان حجم شق PA مناسبا ، فمن غير المرجح أن يتم إزاحة سوار المتبرع. سيؤدي تحريك الرئة المهندسة بيولوجيا بالقرب من المنصف أيضا إلى منع إزاحة صفعة المتبرع. - قم بتثبيته حول الكفة بربطة عنق من النايلون 10-0 (الشكل 5 جم). بطريقة مماثلة ، أدخل وقم بتأمين الشعب الهوائية المانحة (الشكل 5H) والأصفاد الكهروضوئية (الشكل 5I ، J).
- قم بإزالة مشبك تمدد الأوعية الدموية ذو الزاوية الرفيعة (الشكل 5L). لاحظ أن الدم يتدفق إلى ما وراء الكفة الكهروضوئية وقم بإزالة ربطة العنق الحريرية على PA لاستئناف تدفق الدم المسبق إلى الرئة المعدلة بيولوجيا.
- تحضير الأصفاد
النتائج
باتباع بروتوكول إزالة الخلايا ، تكون رئتا الفأر بيضاء وشفافة بشكل واضح (الشكل 6 أ). يجب إزالة المكونات الخلوية بالكامل ، لكن البنية السنخية تظل سليمة في الملاحظة النسيجية (الشكل 6 ب ، ج). تظهر رئتا الفئران المعاد خليهما باستخدام 3 × 107 HUVECs مع ثقافة المفاعل الحيوي القائمة على التروية لمدة يومين توزيعا متجانسا ل HUVECs (الشكل 7 أ). تهاجر HUVECs إلى المنطقة السنخية الطرفية ، وتشكل شبكة شعرية (الشكل 7 ب). بعد زرع تقويم العظام وإعادة ضخ رئتي الهندسة الحيوية ، يتم ملاحظة تدفق الدم الذي يحتوي على خلايا الدم الحمراء بشكل متجانس في الرئتين المعدلة بيولوجيا (الشكل 8 أ ، ب).

الشكل 1: قنية كتلة القلب والرئة للفأر. (أ) قسطرة الشريان الرئوي المحضرة. (ب) مخطط القنية. (ج) صورة تمثيلية بعد الانتهاء من التقسيم. قضبان المقياس = 1 سم (A ، C). تم اعتماد هذا الرقم من Tomiyama et al.19. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تحضير حجرة العضو. (أ) يتم قطع الثقوب كما هو موضح. (ب) يتم إدخال الأنبوب على النحو المشار إليه. (ج) تحضير غطاء زجاجة زجاجية قابلة للتعقيم بالتعقيم سعة 250 مل لخزان الخلية. (د) الزجاجة سعة 250 مل الموضوعة على النمام المغناطيسي. تم اعتماد هذا الرقم من Tomiyama et al.19. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: إعداد المفاعل الحيوي القائم على التروية. (أ) قطع الغيار والتجميع. (ب) الإعداد الفعلي. لاحظ أنه يتم إدخال الأنبوب بين باب زجاجي وختم مطاطي. (ج) لقطة أثناء ثقافة أعضاء التروية التي تحركها المضخة. تم اعتماد هذا الرقم من Tomiyama et al.19. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تحضير الرئة المعدلة بيولوجيا للزرع. (أ) وضع الرئة الهندسية. (ب) تشريح النقير. (ج) تشريح السلطة الفلسطينية الرئيسية. (د) تشريح الكهروضوئية. (ه) إدخال السلطة الفلسطينية في الكفة. (و) تثبيت الكهروضوئية على الكفة. (ز) إدخال الكهروضوئية في الكفة. (ح) تثبيت الكهروضوئية على الكفة. (ط) إدخال وتثبيت الشعب الهوائية اليسرى على الكفة. الاختصارات: PA = الشريان الرئوي. PV = الوريد الرئوي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
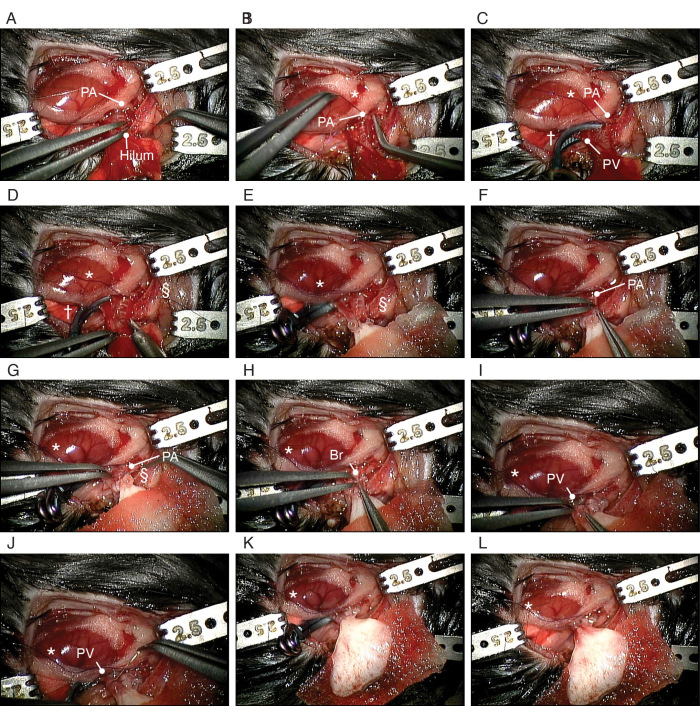
الشكل 5: إجراء زرع تقويم العظام للرئة المهندسة بيولوجيا. (أ) تشريح PA للمتلقي. (ب) عمل عقدة زلة حول PA الخاص بالمستلم. (ج) قص الكهروضوئية والشعب الهوائية. (د) الاعتراض على السلطة الفلسطينية. (ه) وضع الرئة اليسرى المعدلة بيولوجيا. (و) إدخال PA المكبل للرئة المعدلة بيولوجيا في PA للمتلقي. (ز) تثبيت السلطة الفلسطينية حول الكفة. (ح) إدخال الكفة القصبية للرئة المعدلة هندسة حيويا في الشعب الهوائية للمتلقي. (I) إدخال PV للرئة المعدلة بيولوجيا في PV للمتلقي. (ي) تأمين السلطة الفلسطينية حول الكفة. الاختصارات: PA = الشريان الرئوي. PV = الوريد الرئوي. Br = قصبات هوائية. * = عقدة انزلاقية. † = مقطع تمدد الأوعية الدموية. § = 10-0 ربطة عنق من النايلون. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: نزع الخلايا من رئة الفأر. (أ) صورة عيانية للرئة منزوعة الخلايا. (ب) صورة منخفضة الطاقة للرئة منزوعة الخلايا (تكبير ، 100x). (ج) صورة عالية الطاقة ملطخة بالهيماتوكسيلين واليوزين للرئة منزوعة الخلايا. لاحظ أنه لا يوجد مكون خلوي مرئي (تكبير، 400 ضعف). أشرطة المقياس = 100 ميكرومتر (B) ، 50 ميكرومتر (C). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
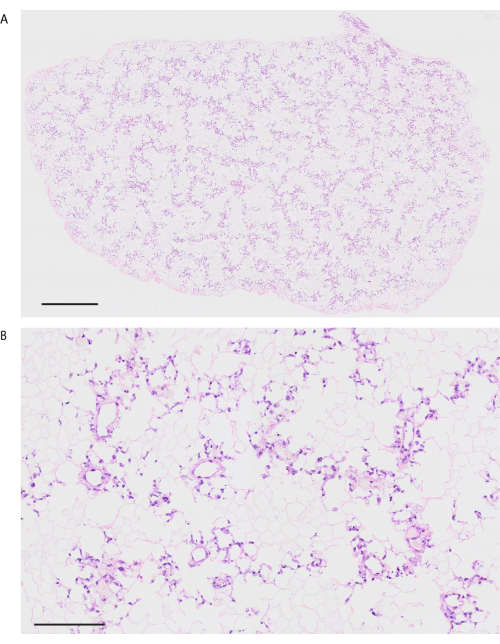
الشكل 7: رئة الفأر المجوية باستخدام HUVECs. (أ) صورة ملطخة بالهيماتوكسيلين واليوزين منخفضة الطاقة للرئة المجهدة (التكبير ، 200x ، التبليط). (ب) صورة عالية الطاقة ملطخة ب H & E للرئة المجهدة (التكبير ، 200x). أشرطة المقياس = 1000 ميكرومتر (أ) ، 100 ميكرومتر (ب). الاختصارات: HUVECs = الخلايا البطانية في الوريد السري البشري. H & E = الهيماتوكسيلين واليوزين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
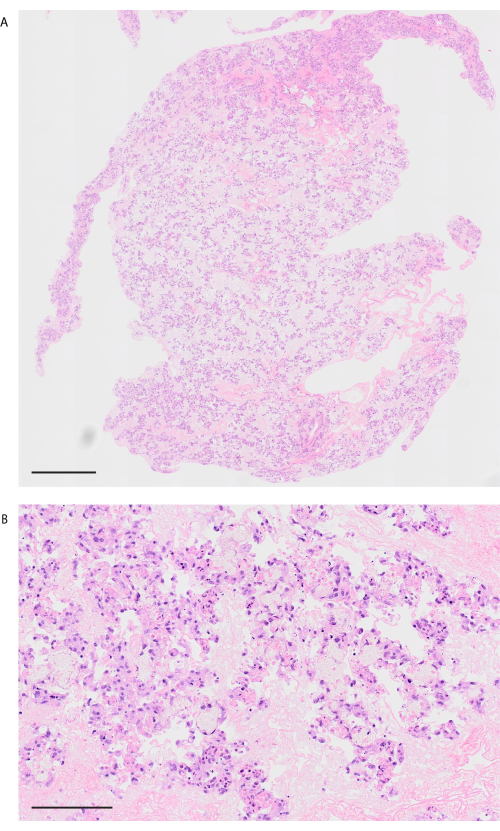
الشكل 8: صورة الرئة بعد الزرع وإعادة نضح الدم. (أ) صورة H & E منخفضة الطاقة للرئة المجوية بعد 10 دقائق من إعادة التروية (التكبير ، 200x ، التبليط). (ب) صورة H & E عالية الطاقة للرئة المجهدة بعد 10 دقائق من إعادة التروية (التكبير ، 200x). أشرطة المقياس = 1000 ميكرومتر (أ) ، 100 ميكرومتر (ب). الاختصار: H & E = الهيماتوكسيلين واليوزين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
الهندسة الحيوية للأعضاء هي مؤسسة متطلبة. وقد أعاقت عملية الفحص المكلفة دورة البحث والتطوير في هذا المجال. باستخدام الفئران كمنصة تجريبية ، يتم تقليل المساحة والخلايا والوسائط بشكل كبير مقارنة بمنصة الفئران المستخدمة سابقا. على الرغم من أن قياس المعلمات الفيزيائية التفصيلية مثل تبادل الغازات أو مقاومة الأوعية الدموية أو امتثال الرئة لم يتحقق بعد ، إلا أن نموذج رئة الفأر يسمح بالجداول الزمنية للبحث المتسارع لأنه يتيح التكرار السريع للبروتوكولات التجريبية واختبار صلاحية الخلية والتكامل وتفاعل السقالة. تتكاثر الفئران بسرعة وتتوفر في العديد من السلالات المعدلة وراثيا ، مما يوفر المرونة في دراسة التعديلات الجينية والخلوية المختلفة في الجسم الحي. تساعد هذه القدرة على اختبار الفرضيات بسرعة وتحسين البروتوكولات على تعزيز فهمنا للبيئات الخلوية المثلى وتقنيات الاستزراع المطلوبة للهندسة الحيوية الناجحة للرئة. من خلال تحسين التقنيات في نماذج الفئران ، يمكن للباحثين إنشاء طرق وبروتوكولات قابلة للتطوير يمكن ترجمتها لاحقا إلى نماذج حيوانية أكبر ، وفي النهاية ، إلى تطبيقات بشرية.
الخطوة الحاسمة في الإجراء هي إدخال قسطرة PA وتثبيتها. لا يمكن تثبيت قسطرة PA إلا باستخدام قسطرة صغيرة القطر (<3 فرن) مع طوق في الحافة. بسبب الطبيعة الهشة للرئتين ، يجب إجراء الجراحة بحذر تام. يجب ألا تلمس أي أدوات معدنية سطح الرئة. خلاف ذلك ، ستعاني الرئة من تسرب كبير. استخدم قطعة قطن لمناورة الرئتين عند الضرورة. يفترض المؤلفون أن الباحثين قد يؤدون إجراء القنحة بكفاءة بعد التدريب باستخدام 10-15 فأرا.
يعتمد بروتوكول إزالة الخلايا الموصوف هنا على التقارير السابقة22،24. يمكن تطبيق بروتوكولات أخرى تستخدم مجموعات منظفات مختلفة. يجب دائما التعامل مع إحصار القلب والرئة بحذر. تشمل الحوادث النموذجية أثناء إجراء إزالة الخلايا تغلغل قسطرة PA ، وخروج قسطرة القصبة الهوائية ، وتسرب الهواء. لم يؤكد المؤلفون تجريبيا سلامة السقالة منزوعة الخلايا بعد التخزين المبرد في PBS. ومع ذلك ، لم يواجه المؤلفون مشاكل في استخدام كتل القلب والرئة منزوعة الخلايا المخزنة في PBS لمدة تصل إلى 4 أسابيع.
تجنب التلوث البكتيري أمر بالغ الأهمية. يجب تعقيم جميع المعدات الزجاجية و PVDF وأجزاء السيليكون قبل التجربة. يجب استخدام الأجزاء الأخرى مرة واحدة فقط. لتقليل مخاطر التلوث البكتيري ، يجب تنفيذ جميع الإجراءات في خزانة سلامة حيوية نظيفة. من المستحسن تضمين مضادات الفطريات وكذلك المضادات الحيوية في وسائل الإعلام. تزيد التغييرات المتكررة في الوسائط أثناء التروية من خطر التلوث. بالإضافة إلى ذلك ، يجب دائما تجنب فقاعات الهواء في الأنبوب. يتم احتجاز فقاعات الهواء في الأنبوب لاحقا في السقالة منزوعة الخلايا ، والتي يمكن أن تحجب نضح الوسائط في المنطقة المحيطية وتؤدي إلى توزيع الخلايا غير المتجانس. علاوة على ذلك ، يجب فصل الخلايا البطانية تماما عن طريق التربسين أو غيرها من وسائط تفكك الخلايا المناسبة. يجب تعطيل كريات الخلية جيدا لعمل تعليق متجانس أحادي الخلية. يمكن أن تؤدي كثافة الخلايا الزائدة (على سبيل المثال ، >2 مليون خلية / مل) إلى تكوين كتل الخلايا ، مما قد يؤدي إلى انسداد في الأوعية الدموية القريبة.
لقد اختبرنا فترة قصيرة فقط (2 أو 3 أيام) من ثقافة المفاعل الحيوي للتروية. في دراستنا السابقة ، استخدمنا أعدادا متفاوتة من الخلايا البطانية لإعادة تشغيل سقالة رئة الفأر منزوعة الخلايا ووجدنا أن هناك عتبة لا تؤدي فيها إضافة المزيد من الخلايا إلى تحسين تغطية الخلية ، والتي كانت ~ 3 × 107 خلايا بطانية لكل كتلة رئة وقلبفأر 19. نتوقع أن تؤدي مدة الاستزراع الأطول (على سبيل المثال ، 14 يوما) إلى تحسين تغطية ونضج الأوعية الدموية المعاد خلويتها ، كما هو موضح في دراسات الهندسة الحيوية للرئةالسابقة 9،10،15،25.
يشبه أساس تحضير طعم الرئة المصمم بيولوجيا أساس زرع رئة الفأر المنتظم26،27. أنسجة الرئة المهندسة ليست هشة مثل طعم الرئة العادي. التحدي هو أن أنسجة الرئة ، بما في ذلك بنية النقير ، بيضاء بالكامل أو شبه شفافة. لا غنى عن الفهم الدقيق للتشريح الموضعي لنجاح عملية الزرع. يجب الحصول على التقنية المستقرة باستخدام الرئتين الأصليتين. يفترض المؤلفون أن الباحثين قد يؤدون إجراء الزرع بشكل مريح بعد التدريب باستخدام 100 فأر.
زرع الرئة المعدلة بيولوجيا باستخدام الخلايا المشتقة من الإنسان في الفأر متاح تقنيا. ومع ذلك ، فإن الرفض الحاد للكسب غير المشروع أمر لا مفر منه بسبب طبيعة زرع الأجانب لهذا النموذج. يمكن استخدام هذا النموذج لاختبار كفاءة إعادة الخلايا على المدى القصير للرئتين المعدلة بيولوجيا ، ويجب فحص الوظيفة طويلة المدى باستخدام الفئران التي تعاني من نقص المناعة.
على الرغم من أنه لم يتم اختباره بالطريقة الحالية ، إلا أن الهندسة الحيوية للرئة بأكملها باستخدام كل من الخلايا البطانية والظهارية لا ينبغي أن تكون صعبة من الناحية الفنية ، مع الأخذ في الاعتبار الصعوبات في هندسة الأوعية الدموية الرئوية الموضحة هنا. علاوة على ذلك ، يمكن توسيع هذه المنصة على نطاق الماوس لتشمل مجالات بحث أخرى ، مثل التحقيق في التفاعل الخلوي في ظروف الثقافة ثلاثية الأبعاد ، وتفاعل مصفوفة الخلية ، ونمذجة السرطان خارج الجسم الحي ، وما إلى ذلك. باختصار ، توفر هذه الطريقة منصة هندسة حيوية للرئة معقولة وقوية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح فيما يتعلق بهذه المخطوطة.
Acknowledgements
تم دعم هذه الدراسة ماليا من قبل منحة المساعدة للبحث العلمي / KAKENHI (C) #20K09174 ، #23K08308 ، وصندوق تعزيز البحوث الدولية المشتركة (تعزيز البحوث الدولية المشتركة (B)) #22KK0132 ل TS ، و JSPS KAKENHI Grant Number 21K08877 ل TW ، وجائزة Leave a Nest Grant Ikeda-Rika ل FT ، و Grant-in-Aid for JSPS Fellows #21J21515 ل FT. نحن نقدر كثيرا السيدة مايكو أويدا ، الطاقم الفني في مركز البحوث الطبية الحيوية في كلية الدراسات العليا للطب بجامعة توهوكو ، لعملها المكثف في المراقبة النسيجية. كما نقدر المشورة الفنية للسيدة يومي يوشيدا والسيد كوجي كاجي في مركز أدوات البحث في IDAC ، جامعة توهوكو ، لدعمهم لمعالجة الصور.
Materials
| Name | Company | Catalog Number | Comments |
| DECELLULARIZATION | |||
| 27 G x 1/2 in. BD PrecisionGlide Needle | BD | 305109 | Or equivalent 27 G injection needle |
| BD Insyte IV Catheter 20 GA X 1.8 8IN | BD | 381237 | Or equivalent 20 G IV catheter |
| Blade silk suture (4-0) | Nesco | GA04SB | Or equivalent |
| CaCl2 | Sigma-Aldrich | C5670 | |
| Catheter for rat jugular vein, PU 2Fr 10 cm | Instech | C20PU-MJV1301 | Recommended for mice weighs 30 g and under. |
| Catheter for rat jugular vein, PU 3Fr 10 cm | Instech | C30PU-RJV1307 | Recommended for mice weighs over 30 g. |
| DNase I | Sigma-Aldrich | DN25 | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| NaCl | Sigma-Aldrich | S3014 | |
| PinPort injectors | Instech | PNP3M | |
| PinPorts, 22 G | Instech | PNP3F22-50 | Fits C30PU-RJV1307 |
| PinPorts, 25 G | Instech | PNP3F25-50 | Fits C20PU-MJV1301 |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | |
| Sterile syringe, 5 mL | Generic | ||
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| CELL CULTURE | |||
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| HUVEC – Human Umbilical Vein Endothelial Cells | Lonza | C2519A | |
| PERFUSION-BASED BIOREACTOR | |||
| 20 G needle | Generic | ||
| 3-way stopcock | Generic | ||
| Cork borer | Generic | Boring size, 6-10 mm | |
| EasyLoad III pump head | Cole-Parmer | 243934 | |
| Glass canister | Hario | SCN-200T | Inner diameter: 80 mm |
| Heating magnetic stirrer | Generic | ||
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9965-01 | Female, fits tubing with I.D. 1.5 mm (L/S 14) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9964-01 | Male, fits tubing with I.D. 1.5 mm (L/S 14) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9965-03 | Female, fits tubing with I.D. 3 mm (L/S 16) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9964-03 | Male, fits tubing with I.D. 3 mm (L/S 16) |
| Magnetic stirring bar | Generic | ||
| Masterflex L/S Digital Precision Modular Drive with Remote I/O and Benchtop Controller | Cole-Parmer | 07557-00 | |
| Masterflex L/S Precision Pump Tubing, PharMed BPT, L/S 16 | Cole-Parmer | 06508-16 | |
| Masterflex L/S Pricision Pump Tubing, Platinum-Cured Silicone, L/S 14 | Cole-Parmer | 96410-14 | |
| Millex-GP Syringe Filter Unit, 0.22 µm, polyethersulfone, 33 mm, gamma sterilized | Millipore | SLGPR33RS | |
| Pyrex 250 mL grass bottle, GL-45 screw cap | Corning | 1395-250 | |
| Silicon Septa for GL45 Open Top PBT Screw Cap | Corning | 1395-455S | |
| Silicone Light Stopper | IMG | 07763-18 | Upper diameter: 87 mm, Lower diameter: 75 mm |
| Sterile syringe, 10 mL, 50 mL | Generic | ||
| MOUSE SURGERY (Isolation of the heart-lung block | Lung transplantation) | |||
| 10-0 Nylon ties | Kono Seisakusho | N/A | |
| 10-0 Silk ties | Kono Seisakusho | N/A | |
| 4-0 Silk ties | Kono Seisakusho | N/A | |
| Arterial clamp, 45 mm curved, grooved | Natsume seisakusyo | C-17-45 | |
| BD Insyte IV Catheter 24GA | BD | 381512 | Or equivalent 24G i.v. catheter |
| Bulldog Vascular Forceps 45mm curved | Natsume seisakusyo | M2 | |
| Butorphanol tartrate | Meiji Seika Pharma | N/A | |
| Cefazolin Sodium | Otsuka Pharmaceutical | N/A | |
| Dumont forceps #5/45 | Fine Science Tools | 1251-35 | |
| Fine vannas style spring scissors | Fine Science Tools | 15403-08 | 45° tip, 0.01 x 0.06 mm |
| Gemini Cautery Kit | Harvard Apparatus | RS-300 | |
| Halsted-Mosquito clamp curved tip, 125 mm | Bioresearch center | 16181670 | |
| Hegar needle holder, 150 mm | B Braun/Aesculap | BM065R | |
| Heparine solution | Mochida Seiyaku | N/A | |
| Medetomidine | Nippon Zenyaku Kogyo | N/A | |
| Micro forceps straight | B Braun/Aesculap | BD33R | |
| Midazolam | Sandoz | N/A | |
| Mouse Ventilator | Harvard Apparatus | Model 687™ | |
| Normal Saline, Clinical grade | Otsuka Pharmaceutical | N/A | |
| Petri dish, 60 x 15 mm | BD | 351007 | |
| Safelet Cath PU 20 gauge polyurethan catheter | Nipro | 09-031 | |
| Sakaki stainless scissors curved 14 cm | Bioresearch center | 64152034 | |
| Scalpel holder | Bioresearch center | 16101040 | |
| Small animal retraction system | Fine Science Tools | 18200-20 | |
| Spare blade scalpel #11 | Muranaka Medical Instruments | 567-001-03 | |
| Spring scissors, 15 cm | Bioresearch center | PRI13-3736 | |
| Stereomicroscope | Leica Microsystems | M525 | Clinical-grade surgical microscope with a flexible arm system is preferable. |
| Sugita titanium aneurysm clip curved slim, No.98 | Mizuho medical | 17-001-98 | |
| Sugita titanium clip applier, 110 mm | Mizuho medical | 17-013-53 | |
| Temperature-adjustable electric warmer | Generic | ||
| Ultrafine cotton swab | Generic | ||
| VASCULAR AND BRONCHIAL CUFF | |||
| Fine sandpaper | Generic | ||
| Venula 20 gauge Teflon angiocatheter | Top | 1160 | |
| Venula 22 gauge Teflon angiocatheter | Top | 1161 | |
| Venula 24 gauge Teflon angiocatheter | Top | 1124 |
References
- van der Mark, S. C., Hoek, R. A. S., Hellemons, M. E. Developments in lung transplantation over the past decade. Eur Respir Rev. 29 (157), 190132 (2020).
- Valapour, M., et al. OPTN/SRTR 2022 Annual Data Report: Lung. Am J Transplant. 24 (2S1), S394-S456 (2024).
- Hoffman, T. W. Waiting list dynamics and lung transplantation outcomes after introduction of the lung allocation score in the Netherlands. Transplant Direct. 7 (10), e760 (2021).
- Wilk, A. R., Edwards, L. B., Edwards, E. B. The effect of augmenting OPTN data with external death data on calculating patient survival rates after organ transplantation. Transplantation. 101 (4), 836-843 (2017).
- Neizer, H., Singh, G. B., Gupta, S., Singh, S. K. Addressing donor-organ shortages using extended criteria in lung transplantation. Ann Cardiothorac Surg. 9 (1), 49-50 (2020).
- Oliveira, P., Yamanashi, K., Wang, A., Cypel, M. Establishment of an ex vivo lung perfusion rat model for translational insights in lung transplantation. J Vis Exp. (199), e65981 (2023).
- Anand, R. P. Design and testing of a humanized porcine donor for xenotransplantation. Nature. 622 (7982), 393-401 (2023).
- Shakir, S., Hackett, T. L., Mostaco-Guidolin, L. B. Bioengineering lungs: An overview of current methods, requirements, and challenges for constructing scaffolds. Front Bioeng Biotechnol. 10, 1011800 (2022).
- Ott, H. C. Regeneration and orthotopic transplantation of a bioartificial lung. Nat Med. 16 (8), 927-933 (2010).
- Petersen, T. H. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Leiby, K. L. Rational engineering of lung alveolar epithelium. NPJ Regen Med. 8 (1), 22 (2023).
- Kitano, K., et al. Orthotopic transplantation of human bioartificial lung grafts in a porcine model: A feasibility study. Semin Thorac Cardiovasc Surg. 34 (2), 752-759 (2022).
- Ohata, K., Ott, H. C. Human-scale lung regeneration based on decellularized matrix scaffolds as a biologic platform. Surg Today. 50 (7), 633-643 (2020).
- Ren, X. Engineering pulmonary vasculature in decellularized rat and human lungs. Nat Biotech. 33 (10), 1097-1102 (2015).
- Doi, R. Transplantation of bioengineered rat lungs recellularized with endothelial and adipose-derived stromal cells. Sci Rep. 7 (1), 8447 (2017).
- Stone, K. C., Mercer, R. R., Gehr, P., Stockstill, B., Crapo, J. D. Allometric relationships of cell numbers and size in the mammalian lung. Am J Respir Cell Mol Biol. 6 (2), 235-243 (1992).
- Basil, M. C., Morrisey, E. E. Lung regeneration: a tale of mice and men. Semin Cell Dev Biol. 100, 88-100 (2020).
- Hsia, C. C., Hyde, D. M., Weibel, E. R. Lung structure and the intrinsic challenges of gas exchange. Compr Physiol. 6 (2), 827-895 (2016).
- Tomiyama, F., et al. Orthotopic transplantation of the bioengineered lung using a mouse-scale perfusion-based bioreactor and human primary endothelial cells. Sci Rep. 14 (1), 7040 (2024).
- Stoian, A., Adil, A., Biniazan, F., Haykal, S. Two decades of advances and limitations in organ recellularization. Curr Issues Mol Biol. 46 (8), 9179-9214 (2024).
- Crabbe, A. Recellularization of decellularized lung scaffolds is enhanced by dynamic suspension culture. PLoS One. 10 (5), e0126846 (2015).
- Daly, A. B. Initial binding and recellularization of decellularized mouse lung scaffolds with bone marrow-derived mesenchymal stromal cells. Tissue Eng Part A. 18 (1-2), 1-16 (2012).
- . Regulations for Animal Experiments and Related Activities Available from: https://www.clag.med.tohoku.ac.jp/clar/en/ (2024)
- Sokocevic, D., et al. The effect of age and emphysematous and fibrotic injury on the re-cellularization of de-cellularized lungs. Biomaterials. 34 (13), 3256-3269 (2013).
- Ren, X., et al. Ex vivo non-invasive assessment of cell viability and proliferation in bio-engineered whole organ constructs. Biomaterials. 52, 103-112 (2015).
- Watanabe, T. Mesenchymal stem cells attenuate ischemia-reperfusion injury after prolonged cold ischemia in a mouse model of lung transplantation: a preliminary study. Surg Today. 47 (4), 425-431 (2017).
- Watanabe, T., et al. Donor IL-17 receptor A regulates LPS-potentiated acute and chronic murine lung allograft rejection. JCI Insight. 8 (21), e158002 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved