Method Article
Trapianto di polmone bioingegnerizzato utilizzando polmoni di topo decellularizzati e cellule endoteliali umane primarie
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo articolo descrive come creare polmoni di topo bioingegnerizzati utilizzando metodi di decellularizzazione e ricellularizzazione. Descrive anche in dettaglio il successivo trapianto di polmone ortotopico.
Abstract
Il trapianto di polmone è un trattamento fondamentale per i pazienti con malattie polmonari allo stadio terminale come la fibrosi polmonare idiopatica, ma persistono sfide come la carenza di donatori e le complicanze post-trapianto. I polmoni bioingegnerizzati, che integrano cellule specifiche del paziente in scaffold animali decellularizzati, rappresentano un'alternativa promettente. Nonostante i progressi nell'uso dei polmoni bioingegnerizzati nei modelli animali, la funzionalità e la struttura rimangono immature. Questo protocollo affronta un ostacolo critico nella bioingegneria degli organi: la necessità di una piattaforma sperimentale economicamente vantaggiosa. Utilizzando modelli murini invece di animali più grandi come ratti o suini, i ricercatori possono ridurre significativamente le risorse necessarie per ogni esperimento, accelerando il progresso della ricerca.
Il protocollo delinea una procedura dettagliata per la bioingegneria polmonare utilizzando blocchi cuore-polmone di topo e cellule primarie umane, concentrandosi sulla strategia di isolamento per il blocco cuore-polmone di topo, la decellularizzazione, l'impostazione del bioreattore, la coltura di organi basata sulla perfusione e il trapianto ortotopico di polmoni bioingegnerizzati. Questa piattaforma su scala murina non solo riduce i costi sperimentali, ma fornisce anche un quadro praticabile per ottimizzare i tipi e il numero di cellule per la ricellularizzazione, testare diversi tipi di cellule utilizzando metodi istologici e molecolari e garantire il flusso sanguigno dopo il trapianto. Il metodo ha il potenziale per ampie applicazioni, tra cui lo studio delle interazioni cellulari in condizioni di coltura tridimensionale, le interazioni cellula-matrice e la modellazione ex vivo del cancro, facendo così progredire il campo della bioingegneria degli organi.
Introduzione
Il trapianto di polmone è stata la cura decisiva per i pazienti affetti da malattia polmonare allo stadio terminale1 come la fibrosi polmonare idiopatica, dove il trattamento farmacologico è inefficace per fermare il deterioramento della funzione respiratoria. Ogni anno si aggiungono alla lista d'attesa più pazienti idonei; Tuttavia, il numero di donazioni di organi da donatori deceduti è stato inferiore al numero crescentedi pazienti in attesa 2,3. Anche dopo aver subito il trapianto di polmone, alcuni problemi degraderebbero la funzione dei polmoni trapiantati, tra cui la disfunzione d'organo primaria, la sindrome allogenica reattiva e le infezioni, che riducono significativamente la sopravvivenza a 5 annidei destinatari del trapianto di polmone.
Esistono diverse opzioni per contrastare gli attuali problemi nel trapianto di organi, tra cui l'utilizzo di donatori marginali5, il recupero dei polmoni di donatore in un sistema di perfusione polmonare ex vivo 6 e lo xenotrapianto utilizzando suini geneticamente modificati7. Queste alternative possono espandere il pool di organi dei donatori; Tuttavia, nessuno può affrontare completamente la scarsità, l'immunogenicità e l'eterogeneità funzionale degli organi del donatore.
È lontano dalla realtà, ma gli organi artificiali bioingegnerizzati in cui le cellule specifiche del paziente sono integrate nell'impalcatura di organi animali decellularizzati sono un'affascinante fonte potenziale di trapianto di organi solidi8. Dal 2010 sono stati riportati diversi studi pionieristici che hanno dimostrato la potenziale utilità dei polmoni bioingegnerizzati 9,10. In questi studi, i polmoni di ratti o suini sono stati decellularizzati da detergenti, cellule animali o umane sono state iniettate dalla trachea o dalla vascolarizzazione polmonare per rigenerare il tessuto polmonare nel bioreattore basato sulla perfusione e alcune di esse sono state trapiantate ortotopicamente nelle cavità toraciche degli animali 11,12,13,14,15. Tuttavia, la funzione e la struttura dei polmoni bioingegnerizzati erano prematuri, presumibilmente a causa del numero inadeguato di cellule coltivate nel bioreattore o di giunzioni intercellulari meno integrate.
Un ostacolo all'avanzamento della ricerca nel campo della bioingegneria degli organi è la mancanza di una piattaforma sperimentale su piccola scala. Sebbene i ratti o i suini siano gli animali comunemente usati in questo campo, richiedono >108 cellule polmonari per polmone16, il che è molto costoso per i laboratori accademici. Se i topi sono disponibili per la ricerca di bioingegneria degli organi, potremmo ridurre drasticamente il costo di ogni esperimento e accelerare il programma di ricerca. Sebbene esistano differenze anatomiche tra i polmoni del topo e quelli umani17, l'architettura di base del polmone è simile tra i mammiferi18. Pertanto, i risultati degli esperimenti su scala di topo possono essere applicati ad animali più grandi semplicemente moltiplicando il numero in base alle dimensioni del corpo.
Questo protocollo mira a descrivere la dettagliata procedura sperimentale di bioingegneria polmonare utilizzando blocchi cuore-polmone di topo e cellule primarie umane19. Per questo studio abbiamo adottato il protocollo di decellularizzazione polmonare del topo precedentemente riportato e ampiamente utilizzato 20,21,22. La parte impegnativa della bioingegneria polmonare è la ricellularizzazione del sistema vascolare capillare decellularizzato20; Pertanto, in questo protocollo verranno utilizzate cellule endoteliali della vena del cordone ombelicale umano.
Protocollo
Tutti gli esperimenti hanno seguito il Regolamento per gli esperimenti sugli animali e le attività correlate presso l'Università di Tohoku (15a edizione), pubblicato dall'Università di Tohoku23. Questo studio è stato approvato dal Comitato Istituzionale per la Cura e l'Uso degli Animali dell'Università di Tohoku (#2020AcA-041-01).
1. Preparazione dei materiali per la decellularizzazione
- Preparazione di soluzioni di decellularizzazione (formato da 1.000 mL in flacone di vetro autoclavabile da 1 L)
- Acqua deionizzata sterile (DI): aggiungere 1.000 ml di acqua distillata o deionizzata a bottiglie di vetro autoclavabili da 1 litro. Autoclavare per 20 minuti a 121 °C.
- Triton X-100: aggiungere 1 mL di Triton X-100 a 1.000 mL di acqua deionizzata sterile in un flacone di vetro autoclavabile da 1 L. (Facoltativo) Aggiungere 10 mL di soluzione di penicillina e streptomicina (concentrazione finale, 500 unità/mL di penicillina e 500 μg/mL di streptomicina).
NOTA: Non sterilizzare in autoclave. - Desossicolato di sodio: aggiungere 20 g di polvere di desossicolato di sodio a 1.000 ml di acqua deionizzata sterile in un flacone di vetro autoclavabile da 1 L. Chiudere il tappo e capovolgere il flacone per solubilizzare la polvere. (Facoltativo) Aggiungere 10 ml di penicillina e soluzione di streptomicina.
NOTA: Non sterilizzare in autoclave. - 1 M di NaCl: aggiungere 58,44 g di NaCl a 1.000 ml di acqua distillata o deionizzata in un flacone di vetro autoclavabile in formato 1 L. Autoclavare per 20 minuti a 121 °C.
- Soluzione madre di DNasi I: Diluire a una concentrazione di 10 mg/mL nel terreno A.
- Terreno A: Preparare 5 mM di CaCl2 (5 mg di CaCl2 in 9 mL di acqua deionizzata sterile) e diluire 1:10 con acqua deionizzata sterile.
- Soluzione di lavoro della DNasi I: aggiungere 33 μL di soluzione madre di DNasi I a 10 mL di terreno B.
- Terreno B: Preparare 10 volte il Terreno B (155 mg di MgSO4 + 220 mg di CaCl2 in 100 ml di acqua deionizzata sterile) e diluire 1:10 con acqua deionizzata sterile.
- Preparazione dei cateteri per l'arteria polmonare (PA) e la trachea (procedura sterile)
- Tagliare il catetere PA (catetere per la vena giugulare di ratto) a una lunghezza di circa 15 mm.
- Spostare il collare all'estremità del catetere.
- Inserire un connettore del catetere nel catetere PA e collegarlo a un iniettore. I cateteri PA preparati sono presentati nella Figura 1A.
- Conservare il catetere PA in etanolo al 70% fino al momento dell'uso.
- Tagliare il catetere endovenoso da 20 G a una lunghezza di circa 15 mm. Questo viene utilizzato per un catetere tracheale.
- Chirurgia del topo per il prelievo del blocco cuore-polmone
- Eutanasia di un topo maschio (C57BL/6, peso > 28 g) con un sovradosaggio di anidride carbonica o isoflurano.
- Posiziona il mouse in posizione supina su un tavolo chirurgico e fissa gli arti. Sterilizzare spruzzando etanolo al 70% sulla superficie del torace e dell'addome.
- Aprire la cavità addominale nella linea mediana fino al collo con le forbici inossidabili e dividere lo sterno con le forbici. Resecare il diaframma dalla parete toracica, tagliare la parete toracica ventrale per esporre completamente le cavità toraciche e rimuovere il timo. Legare la vena cava inferiore e la vena cava superiore destra con una seta 4-0 per prevenire il rigurgito di PBS nel passaggio 1.3.5, migliorando così il dilavamento del sangue nel sistema vascolare polmonare.
- Tagliare l'aorta addominale con forbici inossidabili per il drenaggio. Se l'aorta addominale è indistinguibile, tagliare del tutto la vena cava inferiore e l'aorta addominale.
- Iniettare 3 mL di PBS sterile dal ventricolo destro con una siringa sterile da 5 mL con un ago da 27 G perforando la parete del ventricolo destro.
- Avvolgi il PA principale con una seta 4-0 usando il forcipe Dumont.
NOTA: Il PA principale e l'aorta ascendente possono essere avvolti insieme. - Aprire una finestra di 2 mm sotto le valvole PA tagliando la parete del ventricolo destro con le forbici a molla.
- Inserire il catetere PA attraverso la finestra e fissare la seta 4-0 precedentemente avvolta (Figura 1B).
NOTA: Evitare di toccare il PA durante questa procedura, poiché potrebbe danneggiare la parete PA. Il PA principale e l'aorta ascendente possono essere legati e fissati insieme. - Iniettare lentamente 2 mL di PBS attraverso il catetere PA con una siringa sterile da 5 mL. Assicurati che entrambi i polmoni si espandano leggermente durante l'iniezione del PBS.
- Incannulare la trachea con un catetere tracheale e legarla in posizione con una sutura di seta 4-0 (Figura 1C).
- Iniettare lentamente 2 mL di aria attraverso il catetere tracheale con una siringa sterile vuota da 5 mL e tenerla premuta per 10 s. Assicurarsi che non vi siano perdite d'aria dai polmoni.
- Rimuovere il cuore e il polmone in blocco. Afferrare la trachea con la pinza Dumont e con il catetere tracheale all'interno, tagliare l'esofago cervicale e sezionarlo dalle vertebre. Tagliare le vene succlave bilaterali e le arterie. Infine, tagliare l'esofago e l'infravena cava a livello del diaframma.
NOTA: Non toccare la superficie polmonare con nessuno strumento. Qualsiasi leggero tocco potrebbe causare perdite d'aria.
- Decellularizzazione dei polmoni del topo (procedura di 3 giorni)
NOTA: Tutte le procedure descritte nella sezione 1.4 devono essere eseguite in una cappa di biosicurezza pulita.- Giorno 1
- Trasferire il blocco cuore-polmone resecato in una piastra di Petri di plastica di 10 cm di diametro e incubare i blocchi cuore-polmone in acqua sterile deionizzata per 1 ora a 4 °C.
- Iniettare 2 ml di acqua deionizzata sterile attraverso il catetere tracheale 3 volte e 2 ml di acqua sterile attraverso il catetere PA con una siringa sterile da 5 ml. Fare una pausa dopo ogni iniezione per consentire al liquido di fuoriuscire mentre il polmone si ritrae (Figura 1C).
NOTA: Iniettare acqua a circa 0,5 mL/s. - Iniettare 2 mL di soluzione di Triton X-100 allo 0,1% nel catetere tracheale e 2 mL nel catetere PA.
- Posizionare il blocco cuore-polmone nella capsula di Petri e incubare staticamente nella soluzione di Triton X-100 per una notte a 4 °C.
- Giorno 2
- Rimuovere la soluzione di Triton X-100 dai polmoni con acqua deionizzata sterile come descritto al punto 1.4.1.2.
- Iniettare 2 mL di soluzione di desossicolato di sodio al 2% nel catetere tracheale e 2 mL nel catetere PA. Incubare in soluzione desossicolata per 24 ore a 4 °C.
- Giorno 3
- Rimuovere la soluzione di sodio desossicolato dai polmoni con acqua sterile per via endovenosa come descritto al punto 1.4.1.2.
- Iniettare 2 mL di soluzione di NaCl 1 M nel catetere tracheale e 2 mL nel catetere PA. Incubare in soluzione di NaCl per 1 ora a RT.
- Rimuovere dalla soluzione di NaCl con acqua deionizzata sterile come descritto al punto 1.4.1.2.
- Iniettare 2 mL di soluzione di lavoro di DNAsi I nel catetere tracheale e 2 mL nel catetere PA. Incubare in soluzione di lavoro DNasi per 1 ora a RT.
- Rimuovere la soluzione di DNasi dai polmoni come descritto al punto 1.4.1.2 ma con PBS sterile. Verificare che i polmoni siano bianchi e trasparenti sul bordo dopo la procedura di decellularizzazione.
NOTA: Man mano che la procedura di decellularizzazione progredisce, il polmone diventa più fragile. Maneggiare sempre il blocco cuore-polmone con cautela ed evitare di toccare la superficie polmonare. Dopo la decellularizzazione, i blocchi cuore-polmone possono essere conservati in PBS/antibiotici a 4 °C per un massimo di 3 settimane.
- Giorno 1
2. Coltura di cellule primarie umane
- Mescolare il terreno di crescita delle cellule endoteliali-2 (EGM2) e il kit Bullet contenenti siero fetale bovino (concentrazione finale, 2%), idrocortisone (concentrazione finale, 0,2 μg/mL), fattore di crescita dei fibroblasti basici umani (concentrazione finale, 4 ng/mL), fattore di crescita dell'endotelio vascolare (2 ng/mL), fattore di crescita R3-insulin-simile-1 (concentrazione finale, 5 ng/mL), acido ascorbico (concentrazione finale, 75 μg/mL), fattore di crescita epidermico umano (concentrazione finale, 10 ng/mL), gentamicina/amfotericina-1000 (concentrazione finale, gentamicina: 30 μg/mL, amfotericina: 15 ng/mL) ed eparina (concentrazione finale, 1 ng/mL).
- Scongelare 2 × 106 cellule endoteliali della vena del cordone ombelicale umano (HUVEC) in fiale congelate a bagnomaria a 37 °C.
- Miscelare le cellule con EGM2 in una provetta conica da 15 mL e centrifugare a 500 × g per 5 minuti.
- Contare le cellule e sottocoltivarle a una densità cellulare appropriata (si consiglia 2,0 x 104 cellule/cm2 ). Iniziare da piastre di formato a 6 pozzetti e poi trasferire in matracci T75.
- Far passare le celle fino ad ottenere il numero di celle richiesto.
NOTA: Per la copertura vascolare polmonare completa con HUVEC, saranno necessari 3 × 107 HUVEC19.
3. Allestimento del bioreattore e coltura di organi di perfusione
- Preparazione di una camera d'organo e di un serbatoio cellulare
- Praticare dei fori in un tappo di silicone utilizzando una trivella per sughero, come mostrato nella Figura 2A. Le dimensioni dei fori sono di 5 mm (i, ii e iii) e 7 mm (iv e v). Ogni numero di foro (i-v) nella Figura 2A corrisponde ai numeri di foro nella Figura 2B.
- Inserire il tubo della pompa attraverso il tappo in silicone come indicato nella Figura 2B.
- Praticare un foro di 5 mm in un setto di silicone di un tappo a vite aperto utilizzando una trivella per sughero. Inserire un tubo L/S 14 polimerizzato al platino nel foro (Figura 2B, C).
- Autoclavare i materiali di cui sopra, tra cui il tappo in silicone con tubo, il contenitore di vetro, il tappo a vite GL-45 con tubo, un flacone di vetro autoclavabile da 250 ml e un tubo L/S 14 con raccordi per esche (tubo B e tubo C nella Figura 3A) per 20 minuti a 121 °C. Selezionare i raccordi per esche adeguati per garantire che i tubi B e C formino un anello.
NOTA: Il contenitore di vetro viene utilizzato per una camera d'organo e il flacone di vetro da 250 ml viene utilizzato per un serbatoio di cellule.
- Assemblaggio del circuito del bioreattore basato sulla perfusione
NOTA: Le seguenti procedure devono essere eseguite su un banco pulito.- Aggiungere 70 ml di terreno di coltura al contenitore di vetro, quindi posizionare il tappo di silicone sopra il contenitore di vetro.
- Assemblare un tappo in silicone, un contenitore di vetro, un tappo a vite GL-45 con tubo, un flacone di vetro autoclavabile da 250 ml e un tubo L/S 14 con raccordi per esche utilizzando rubinetti a tre vie come descritto nella Figura 3A. Inserire un ago da 20 G in un setto di silicone di un tappo a vite GL-45.
- Riempire il terreno nei tubi A, B e C con una siringa da 10 ml collegata ai rubinetti i) e iii) (saranno necessari ~3-5 ml di terreno per riempire 1 m di tubo). Ripetere l'iniezione e l'estrazione del terreno utilizzando una siringa da 10 ml attraverso un rubinetto a tre vie per assicurarsi che non vi siano bolle d'aria all'interno del tubo.
- Collegare il catetere PA del blocco cuore-polmone decellularizzato tramite un raccordo per esche collegato al tubo C. Evitare la formazione di bolle d'aria nel catetere o nel tubo.
- Raccogliere e risospendere gli HUVEC a una densità di 0,5-1 × 106 cellule/mL in EGM2. Aggiungere la sospensione cellulare del passaggio 2.5 al serbatoio della cella.
NOTA: La sospensione cellulare viene preparata preferibilmente tra i passaggi 3.2.4 e 3.2.5. Mettere una barra di agitazione nel serbatoio della cella.
- Iniezione per gravità di cellule endoteliali
- Posizionare il serbatoio cellulare contenente HUVEC su un agitatore magnetico. Assicurarsi che il fondo del serbatoio cellulare si trovi a 30 cm sopra la camera dell'organo (Figura 2D e Figura 3A).
- Accendere l'agitatore magnetico a una velocità di circa 120 giri/min.
- Aprire il rubinetto i) e ii) in modo che la sospensione cellulare possa essere iniettata nell'impalcatura decellularizzata tramite il tubo A, il tubo C e il catetere PA.
NOTA: Quando si iniettano 3 × 107 cellule a una densità cellulare di 1 × 106 cellule/mL, il volume della sospensione cellulare deve essere di 30 mL. Una velocità di iniezione tipica è di 1-2 ml/min. - Dopo aver iniettato completamente la sospensione cellulare, staccare il tubo A dal rubinetto ii).
NOTA: In questa fase è possibile eseguire la conta cellulare per misurare il tasso di ritenzione cellulare nello scaffold decellularizzato. Il tasso tipico di ritenzione cellulare è dell'80-90%, indipendentemente dal numero di cellule iniettate19.
La qualità dell'impalcatura polmonare decellularizzata determina rigorosamente il tasso di ritenzione cellulare. Qualsiasi perdita dal polmone decellularizzato (ad esempio, dal PA principale, dalla superficie polmonare) si traduce in un tasso di ritenzione cellulare inferiore. Assicurarsi che non vi siano perdite apparenti dal polmone decellularizzato iniettando 2-3 ml di terreno di coltura con una siringa sterile collegata a uno dei rubinetti del bioreattore a base di perfusione e verificare che i polmoni decellularizzati si espandano leggermente durante l'iniezione del terreno.
- Coltura d'organo di perfusione
- Collocare la camera dell'organo in un incubatore a CO2 .
- Fissare il tubo B a una testa della pompa collegata a una pompa pulsatile.
- Chiudere lo sportello in vetro dell'incubatore a CO2 . Assicurarsi che il tubo sia posizionato correttamente tra la porta in vetro e la guarnizione in gomma (Figura 3B).
- Incubare lo scaffold decellularizzato a 37 °C per 3 ore per consentire alle cellule endoteliali iniettate di depositarsi nello scaffold.
NOTA: Assicurarsi che la pompa pulsatile sia sempre spenta tra i passaggi 3.4.1 e 3.4.4. - Avviare la pompa a una velocità di 6 giri/min, il che si traduce in una perfusione del fluido di 2 mL/min utilizzando un tubo L/S 14. Osservate il polmone decellularizzato che si espande leggermente con la perfusione mediatica.
- Chiudere lo sportello dell'incubatore (Figura 3C).
- Eseguire il cambio del supporto tramite il rubinetto iii). Cambia metà del supporto ogni 2 o 3 giorni.
- Arrestare l'azionamento della pompa, collegare una siringa sterile da 50 ml al rubinetto iii) ed estrarre 50 ml di terreno dalla camera.
- Riempire un'altra siringa sterile da 50 mL con 50 mL di terreno preriscaldato e trasferire il terreno nella camera tramite il rubinetto iii). Azionare il rubinetto in modo appropriato e quindi avviare la pompa pulsatile.
- Prelevare il blocco cuore-polmone ricellularizzato dopo almeno 2 giorni di coltura d'organo di perfusione.
NOTA: Nel nostro studio, 2 giorni di coltura di perfusione sono stati sufficienti per rivascolarizzare in modo omogeneo l'impalcatura polmonare decellularizzata utilizzando 3 × 107 HUVEC. Quando si utilizzano meno di 3 × 107 HUVEC, potrebbe essere necessaria un'incubazione più lunga per migliorare l'efficienza della ricellularizzazione.
4. Trapianto ortotopico del polmone bioingegnerizzato
- Preparazione del farmaco
- Preparare l'agente anestetico combinato MMB mescolando midazolam (concentrazione finale, 4 mg/kg), medetomidina (concentrazione finale, 0,75 mg/kg) e butorfanolo tartrato (concentrazione finale, 5 mg/kg) con soluzione fisiologica di grado clinico.
- Preparare la soluzione di eparina mescolandola con soluzione fisiologica di grado clinico (concentrazione finale, 1000 U/mL).
- Preparare la cefazolina sodica mescolandola con soluzione fisiologica di grado clinico (una dose, 30 mg/kg).
- Procedura chirurgica
- Preparazione dei polsini
- Strofinare leggermente i tre tipi di angiocatheter con carta vetrata fine per facilitare la permanenza dei vasi in cuffia.
- Preparare una cuffia bronchiale da un atleta in teflon da 20 G di lunghezza 1 mm utilizzando un bisturi #11. Prima di tagliare l'anatrice, utilizzare la parte posteriore del bisturi #11 per fare una rientranza nell'anatrice, per legare il nylon 10-0.
- Preparare la cuffia della vena polmonare (PV) da un atleta in teflon da 22 G di 0,8 mm di lunghezza e la cuffia PA da un atleta in teflon da 24 G di 0,6 mm di lunghezza.
NOTA: Questa preparazione può essere eseguita prima del giorno dell'esperimento.
- Attacco della cuffia al polmone bioingegnerizzato
- Metti il blocco cuore-polmone su un pezzo di garza sterile inumidita con soluzione salina fredda, metti un altro pezzo di garza asciutta e pulita sotto di esso e metti una capsula di Petri in una scatola di polistirolo piena di ghiaccio pulito.
NOTA: Posizionare la garza asciutta impedisce il congelamento accidentale del blocco cuore-polmone. - Posizionare una clip per aneurisma per fissare la trachea e la garza (Figura 4A). Metti un pezzetto di garza sul cuore, coprendo anche il polmone destro. Metti un'altra garza sul polmone sinistro. Regola questa retrazione con la garza inumidita per esporre l'ilo sinistro nel modo più chiaro possibile.
- Sezionare con cura le strutture ilari l'una dall'altra utilizzando micro pinze diritte o angolate, a seconda delle preferenze (Figura 4B). Inizia a sezionare dal legamento polmonare lungo il nervo vago. Incidere la pleura viscerale sotto il PV e muovere l'aorta discendente e il nervo vago insieme attraverso la parte posteriore dell'ilo polmonare sinistro verso il lato cranico.
- Sezionare il PA principale sinistro dal tronco polmonare fino al bordo del polmone sinistro (Figura 4C). Quindi, dividere il PA a livello del tronco polmonare per ottenere una lunghezza adeguata.
- Sezionare il PV sinistro dal lato sinistro dell'atrio sinistro fino al bordo del polmone sinistro (Figura 4D). Dividi il PV sinistro al livello dell'atrio sinistro per ottenere una lunghezza adeguata.
- Sospendere il bracciale PA appena sopra il PA usando la stabilizzazione clamp e inserire il PA all'interno del bracciale (Figura 4E). Piegare il PA sopra il bracciale), esponendo la superficie endoteliale. Fissare intorno al bracciale con una fascetta di nylon 10-0 (Figura 4F). Posizionare il bracciale sul PV in modo identico (Figura 4G,H).
- Dividere il bronco sinistro a livello della carena. Posizionare il bracciale sul bronco in modo identico (Figura 4I).
- Metti il blocco cuore-polmone su un pezzo di garza sterile inumidita con soluzione salina fredda, metti un altro pezzo di garza asciutta e pulita sotto di esso e metti una capsula di Petri in una scatola di polistirolo piena di ghiaccio pulito.
- Procedura per il mouse ricevente
- Anestetizzare il topo ricevente con una miscela di MMB i.p. con un ago da 27 G e intubare inserendo un angiocatetere in poliuretano da 20 G al microscopio. Posizionare il mouse ricevente su uno scaldino elettrico a temperatura regolabile nella posizione laterale destra del decubito e collegare l'angiocatetere al respiratore. Impostare l'impostazione del ventilatore come segue: ossigeno 2 L/min, frequenza respiratoria 120 bpm, volume corrente 0,5 mL. Sterilizzare la parete toracica con etanolo al 70% e iniettare la miscela di cefazolina s.c.
- Incidere la pelle con le forbici. Tagliare il tessuto sottocutaneo e i muscoli con un cauterio. Aprire il torace attraverso il 3° spazio intercostale e posizionare i divaricatori toracici.
NOTA: Sebbene la toracotomia debba essere sufficientemente grande per l'impianto, non danneggiare l'arteria mammaria interna, che può portare a sanguinamento massiccio. - Seziona il legamento polmonare con un batuffolo di cotone e grandi forbici a molla. Posizionare un detergente arterioso curvo sul polmone sinistro del ricevente per ritrarre facilmente il polmone. Con una micro-pinza angolata, sezionare la pleura mediastinica attorno all'ilo polmonare sinistro.
NOTA: La base della dissezione della pleura è simile alla resezione polmonare anatomica di un essere umano. - Sezionare il PA dal bronco utilizzando una micro pinza curva dal mediastino fino al bordo del polmone sinistro (Figura 5A). Seziona il bronco da PV in modo simile.
NOTA: La dissezione può essere eseguita facilmente quando la pleura viene sezionata durante la manovra precedente (passaggio 4.2.3.3). - Posizionare un nodo scorsoio di seta 10-0 alla base del PA per occludere (Figura 5B). Posizionare una clip aneurismatica sottile e angolata alla base del PV e del bronco (Figura 5C).
- Avvolgere il nylon 10-0 attorno al bronco, al PA e al PV, lasciando i polsini allentati per fissare i polsini nei passaggi successivi.
- Incidere il PA, il bronco e il PV del ricevente sul bordo del polmone sinistro del ricevente utilizzando le forbici a micromolla (Figura 5D). Dilatare delicatamente il PA e il PV utilizzando micro pinze diritte. Rimuovere il sangue nella PA e nel PV con soluzione fisiologica utilizzando una siringa da 1 ml e un angiocathater da 24 G.
NOTA: Le incisioni di PA, bronco e PV sono circa un terzo del giro. Le micro pinze dritte sono delicate e adatte alla dilatazione. - Posizionare il polmone bioingegnerizzato, che è coperto da una garza inumidita, sopra il polmone sinistro del ricevente (Figura 5E), il più vicino possibile al mediastino del ricevente.
- Inserimento del bracciale PA del donatore nel PA ricevente (Figura 5F).
NOTA: Ci sarà un po' di allungamento sul PA donatore. Se la dimensione dell'incisione PA è appropriata, è meno probabile che la cuffia del donatore venga rimossa. Spostare il polmone bioingegnerizzato vicino al mediastino impedirà anche che la cuffia del donatore venga spostata. - Fissare intorno al bracciale con una fascetta di nylon 10-0 (Figura 5G). In modo analogo, inserire e fissare il bronco del donatore (Figura 5H) e i bracciali PV (Figura 5I, J).
- Rimuovere la clip aneurismatica ad angolo sottile (Figura 5L). Osservare che il sangue rifluisce oltre il bracciale PV e rimuovere la cravatta di seta sul PA per riprendere il flusso sanguigno anterogrado al polmone bioingegnerizzato.
- Preparazione dei polsini
Risultati
Seguendo il protocollo di decellularizzazione, i polmoni di topo sono visibilmente bianchi e traslucidi (Figura 6A). I componenti cellulari devono essere completamente rimossi, ma la struttura alveolare rimane intatta nell'osservazione istologica (Figura 6B, C). I polmoni di topo ricellularizzati utilizzando 3 × 10 7 HUVEC con coltura di bioreattore basata sulla perfusione di 2 giorni mostrano una distribuzione omogenea di HUVEC (Figura 7A). Gli HUVEC migrano nell'area alveolare periferica, formando una rete capillare (Figura 7B). Dopo il trapianto ortotopico e la riperfusione dei polmoni di bioingegneria, il flusso sanguigno contenente globuli rossi è osservato in modo omogeneo nei polmoni bioingegnerizzati (Figura 8A, B).

Figura 1: Incannulamento del blocco cuore-polmone di topo. (A) Cateteri arteriosi polmonari preparati. (B) Schema di incannulamento. (C) Immagine rappresentativa dopo il completamento dell'incannulamento. Barre della scala = 1 cm (A,C). Questa cifra è stata adottata da Tomiyama et al.19. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Preparazione della camera dell'organo. (A) I fori vengono tagliati come descritto. (B) Il tubo è inserito come indicato. (C) Preparazione del tappo per un flacone di vetro autoclavabile da 250 ml per il serbatoio cellulare. (D) Il flacone di vetro da 250 ml posto sull'agitatore magnetico. Questa cifra è stata adottata da Tomiyama et al.19. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Configurazione del bioreattore basato sulla perfusione. (A) Parti e assemblaggio. (B) Configurazione effettiva. Si noti che il tubo è inserito tra una porta in vetro e una guarnizione in gomma. (C) Un'istantanea durante la coltura di organi a perfusione azionata da pompa. Questa cifra è stata adottata da Tomiyama et al.19. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Preparazione del polmone bioingegnerizzato per il trapianto. (A) Posizionamento del polmone ingegnerizzato. (B) Dissezione dell'ilo. (C) Dissezione del PA principale. (D) Dissezione del PV. (E) Inserimento del PA nel bracciale. (F) Fissaggio del PV al bracciale. (G) Inserimento del PV nel bracciale. (H) Fissaggio del PV al bracciale. (I) Inserimento e fissazione del bronco sinistro al bracciale. Abbreviazioni: PA = arteria polmonare; PV = vena polmonare. Clicca qui per visualizzare una versione più grande di questa figura.
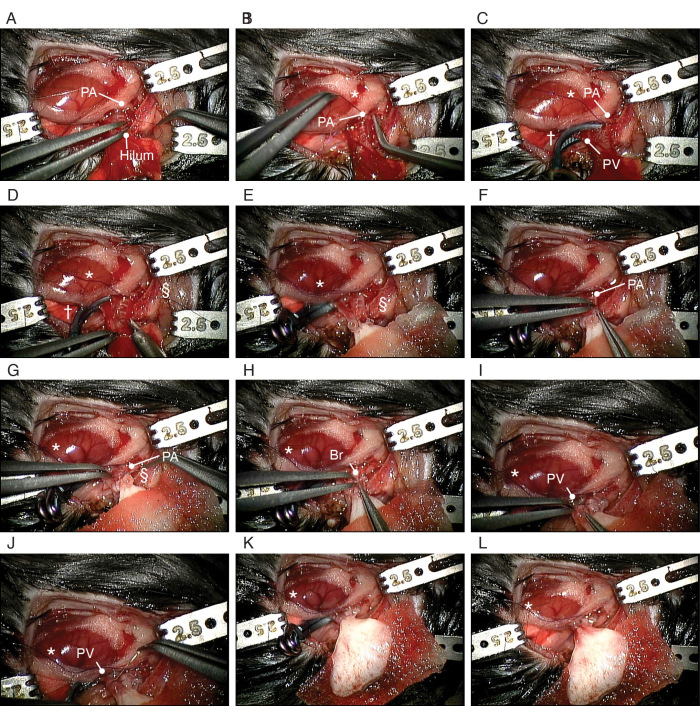
Figura 5: Procedura di trapianto ortotopico del polmone bioingegnerizzato. (A) Dissezione del PA del ricevente. (B) Fare un nodo scorsoio attorno all'AP del ricevente. (C) Clippatura del PV e del bronco. (D) Incisione della PA. (E) Posizionamento del polmone sinistro bioingegnerizzato. (F) Inserimento del PA cuffiato del polmone bioingegnerizzato nel PA del ricevente. (G) Fissaggio del PA attorno al bracciale. (H) Inserimento della cuffia bronchiale del polmone bioingegnerizzato nel bronco del ricevente. (I) Inserimento del PV del polmone bioingegnerizzato nel PV del ricevente. (J) Fissare il PA attorno al bracciale. Abbreviazioni: PA = arteria polmonare; PV = vena polmonare; Br = bronco; * = nodo scorsoio; † = clip aneurismatica; § = Cravatta di nylon 10-0. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Decellularizzazione del polmone di topo. (A) Immagine macroscopica del polmone decellularizzato. (B) Immagine a bassa potenza del polmone decellularizzato (ingrandimento, 100x). (C) Immagine colorata con ematossilina ed eosina ad alta potenza del polmone decellularizzato. Si noti che non c'è alcun componente cellulare visibile (ingrandimento, 400x). Barre di scala = 100 μm (B), 50 μm (C). Clicca qui per visualizzare una versione più grande di questa figura.
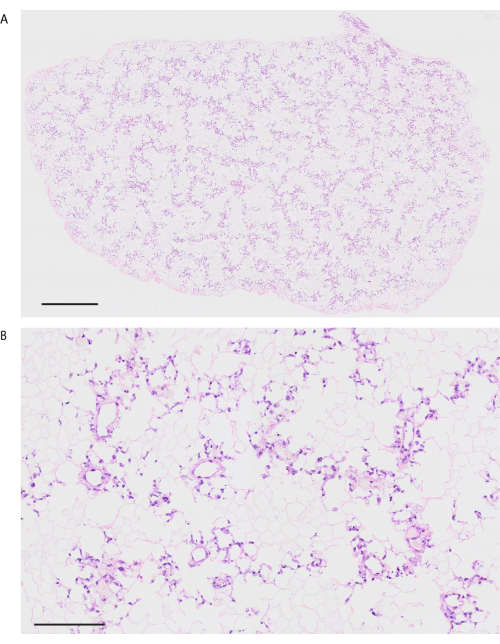
Figura 7: Polmone di topo rivascolarizzato utilizzando HUVECs. (A) Immagine a bassa potenza colorata con ematossilina ed eosina del polmone rivascolarizzato (ingrandimento, 200x, piastrellatura). (B) Immagine colorata con H&E ad alta potenza del polmone rivascolarizzato (ingrandimento, 200x). Barre di scala = 1000 μm (A), 100 μm (B). Abbreviazioni: HUVECs = cellule endoteliali della vena del cordone ombelicale umano; H&E = ematossilina ed eosina. Clicca qui per visualizzare una versione più grande di questa figura.
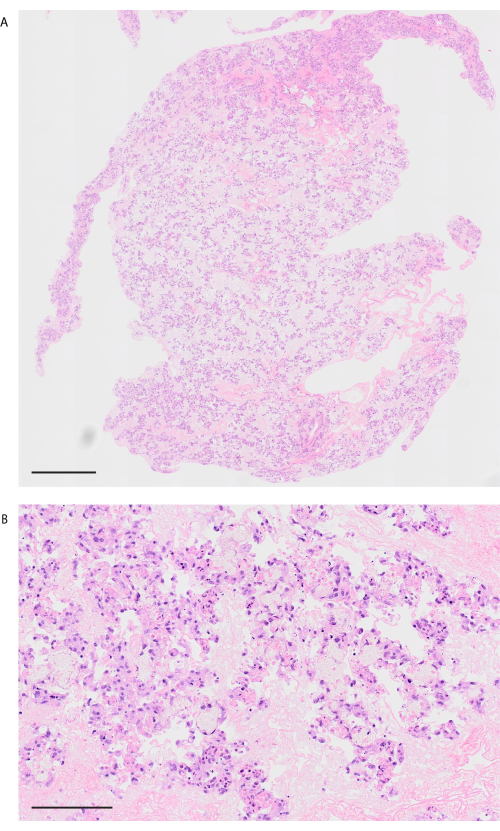
Figura 8: Immagine polmonare dopo trapianto e riperfusione sanguigna. (A) Immagine H&E a bassa potenza del polmone rivascolarizzato dopo 10 minuti di riperfusione (ingrandimento, 200x, piastrellatura). (B) Immagine H&E ad alta potenza del polmone rivascolarizzato dopo 10 minuti di riperfusione (ingrandimento, 200x). Barre di scala = 1000 μm (A), 100 μm (B). Abbreviazione: H&E = ematossilina ed eosina. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
La bioingegneria degli organi è un'impresa impegnativa. Il costoso processo di screening ha ostacolato il ciclo di ricerca e sviluppo di questo settore. Utilizzando i topi come piattaforma sperimentale, lo spazio, le cellule e i terreni sono significativamente ridotti rispetto alla piattaforma per ratti precedentemente utilizzata. Sebbene la misurazione di parametri fisici dettagliati come lo scambio gassoso, la resistenza vascolare o la compliance polmonare non sia ancora stata raggiunta, il modello polmonare del topo consente di accelerare le tempistiche di ricerca in quanto consente una rapida iterazione dei protocolli sperimentali e la verifica della vitalità cellulare, dell'integrazione e dell'interazione con lo scaffold. I topi si riproducono rapidamente e sono disponibili in numerosi ceppi geneticamente modificati, offrendo flessibilità nello studio di varie modificazioni genetiche e cellulari in vivo. Questa capacità di testare rapidamente le ipotesi e ottimizzare i protocolli aiuta a far progredire la nostra comprensione degli ambienti cellulari ottimali e delle tecniche di coltura necessarie per il successo della bioingegneria polmonare. Perfezionando le tecniche nei modelli murini, i ricercatori possono stabilire metodi e protocolli scalabili che possono essere successivamente tradotti in modelli animali più grandi e, infine, in applicazioni umane.
La fase critica della procedura è l'inserimento e il fissaggio di un catetere PA. Il fissaggio del catetere PA è possibile solo utilizzando un catetere di piccolo diametro (<3 Fr) con un collare sulla punta. A causa della natura fragile dei polmoni, la chirurgia deve essere eseguita con cautela. Nessuno strumento metallico deve toccare la superficie polmonare; in caso contrario, il polmone subirebbe perdite significative. Usa un batuffolo di cotone per manovrare i polmoni quando necessario. Gli autori ipotizzano che i ricercatori potrebbero eseguire in modo efficiente la procedura di canulazione dopo l'allenamento utilizzando 10-15 topi.
Il protocollo di decellularizzazione qui descritto si basa su rapporti precedenti22,24. Possono essere applicabili altri protocolli che utilizzano diversi set di detergenti. Il blocco cuore-polmone deve essere sempre trattato con cautela. Gli incidenti tipici durante la procedura di decellularizzazione includono la penetrazione del catetere PA, il distacco del catetere tracheale e la perdita d'aria. Gli autori non hanno confermato sperimentalmente l'integrità dell'impalcatura decellularizzata dopo la conservazione refrigerata in PBS. Tuttavia, gli autori non hanno riscontrato problemi nell'utilizzo di blocchi cuore-polmone decellularizzati conservati in PBS per un massimo di 4 settimane.
Evitare la contaminazione batterica è fondamentale. Tutte le apparecchiature in vetro, PVDF e parti in silicone devono essere sterilizzate in autoclave prima dell'esperimento. Le altre parti devono essere utilizzate una sola volta. Per ridurre al minimo il rischio di contaminazione batterica, tutte le procedure devono essere eseguite in una cappa di biosicurezza pulita. È auspicabile includere antimicotici e antibiotici nei media. I frequenti cambi di terreno durante la perfusione aumentano il rischio di contaminazione. Inoltre, è necessario evitare sempre bolle d'aria nei tubi. Le bolle d'aria nel tubo vengono successivamente intrappolate nello scaffold decellularizzato, il che potrebbe bloccare la perfusione dei media nell'area periferica e provocare una distribuzione cellulare eterogenea. Inoltre, le cellule endoteliali devono essere completamente staccate mediante tripsinizzazione o altri mezzi di dissociazione cellulare appropriati. I pellet cellulari devono essere ben disgregati per ottenere una sospensione omogenea di una singola cellula. Un'eccessiva densità cellulare (ad esempio, >2 milioni di cellule/mL) potrebbe favorire la formazione di grumi cellulari, che potrebbero provocare embolia nel sistema vascolare prossimale.
Abbiamo testato solo un breve periodo (2 o 3 giorni) di coltura di bioreattore di perfusione. Nel nostro studio precedente, abbiamo utilizzato un numero variabile di cellule endoteliali per rivascolarizzare l'impalcatura polmonare di topo decellularizzata e abbiamo scoperto che esiste una soglia in cui l'aggiunta di più cellule non migliora la copertura cellulare, che era ~ 3 × 107 cellule endoteliali per blocco polmone-cuore di topo19. Ci aspettiamo che una maggiore durata della coltura (ad esempio, 14 giorni) migliorerà la copertura e la maturazione della vascolarizzazione ricellularizzata, come descritto nei precedenti studi di bioingegneria polmonare 9,10,15,25.
La base della preparazione dell'innesto polmonare bioingegnerizzato è simile a quella di un normale trapianto di polmone di topo26,27. Il tessuto polmonare ingegnerizzato non è fragile come un normale innesto polmonare. La sfida è che il tessuto polmonare, compresa la struttura dell'ilo, è completamente bianco o quasi trasparente. Una comprensione precisa dell'anatomia locale è indispensabile per il successo del trapianto. La tecnica stabile dovrebbe essere ottenuta utilizzando polmoni nativi. Gli autori presumono che i ricercatori potrebbero eseguire comodamente la procedura di trapianto dopo l'allenamento utilizzando 100 topi.
Il trapianto del polmone bioingegnerizzato utilizzando cellule di derivazione umana nel topo è tecnicamente disponibile; Tuttavia, il rigetto acuto del trapianto è inevitabile a causa della natura xenotrapiantologica di questo modello. Questo modello può essere utilizzato per testare l'efficienza di ricellularizzazione a breve termine dei polmoni bioingegnerizzati e la funzionalità a lungo termine dovrebbe essere studiata utilizzando topi immunodeficienti.
Sebbene non sia stata testata con il metodo attuale, la bioingegneria polmonare intera che utilizza sia cellule endoteliali che epiteliali non dovrebbe essere tecnicamente così impegnativa, considerando le difficoltà nell'ingegneria vascolare polmonare qui descritte. Inoltre, questa piattaforma su scala murina può essere estesa ad altri campi di ricerca, come lo studio dell'interazione cellulare in condizioni di coltura 3D, l'interazione cellula-matrice, la modellazione del cancro ex-vivo e così via. In sintesi, questo metodo fornisce una piattaforma di bioingegneria polmonare ragionevole e robusta.
Divulgazioni
Gli autori non hanno alcun conflitto di interessi riguardo a questo manoscritto.
Riconoscimenti
Questo studio è stato sostenuto finanziariamente dal Grant-in-Aid for Scientific Research / KAKENHI (C) #20K09174, #23K08308, dal Fondo per la promozione della ricerca internazionale congiunta (Fostering Joint International Research (B)) #22KK0132 per TS, JSPS KAKENHI Grant Number 21K08877 per TW, Leave a Nest Grant Ikeda-Rika award per FT e Grant-in-Aid for JSPS Fellows #21J21515 per FT. Apprezziamo molto la signora Maiko Ueda, staff tecnico del Nucleo di Ricerca Biomedica della Graduate School of Medicine dell'Università di Tohoku, per il suo intenso lavoro nell'osservazione istologica. Apprezziamo anche la consulenza tecnica di Yumi Yoshida e Koji Kaji del Center of Research Instruments presso l'IDAC, Università di Tohoku, per il loro supporto all'elaborazione delle immagini.
Materiali
| Name | Company | Catalog Number | Comments |
| DECELLULARIZATION | |||
| 27 G x 1/2 in. BD PrecisionGlide Needle | BD | 305109 | Or equivalent 27 G injection needle |
| BD Insyte IV Catheter 20 GA X 1.8 8IN | BD | 381237 | Or equivalent 20 G IV catheter |
| Blade silk suture (4-0) | Nesco | GA04SB | Or equivalent |
| CaCl2 | Sigma-Aldrich | C5670 | |
| Catheter for rat jugular vein, PU 2Fr 10 cm | Instech | C20PU-MJV1301 | Recommended for mice weighs 30 g and under. |
| Catheter for rat jugular vein, PU 3Fr 10 cm | Instech | C30PU-RJV1307 | Recommended for mice weighs over 30 g. |
| DNase I | Sigma-Aldrich | DN25 | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| NaCl | Sigma-Aldrich | S3014 | |
| PinPort injectors | Instech | PNP3M | |
| PinPorts, 22 G | Instech | PNP3F22-50 | Fits C30PU-RJV1307 |
| PinPorts, 25 G | Instech | PNP3F25-50 | Fits C20PU-MJV1301 |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | |
| Sterile syringe, 5 mL | Generic | ||
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| CELL CULTURE | |||
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| HUVEC – Human Umbilical Vein Endothelial Cells | Lonza | C2519A | |
| PERFUSION-BASED BIOREACTOR | |||
| 20 G needle | Generic | ||
| 3-way stopcock | Generic | ||
| Cork borer | Generic | Boring size, 6-10 mm | |
| EasyLoad III pump head | Cole-Parmer | 243934 | |
| Glass canister | Hario | SCN-200T | Inner diameter: 80 mm |
| Heating magnetic stirrer | Generic | ||
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9965-01 | Female, fits tubing with I.D. 1.5 mm (L/S 14) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9964-01 | Male, fits tubing with I.D. 1.5 mm (L/S 14) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9965-03 | Female, fits tubing with I.D. 3 mm (L/S 16) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9964-03 | Male, fits tubing with I.D. 3 mm (L/S 16) |
| Magnetic stirring bar | Generic | ||
| Masterflex L/S Digital Precision Modular Drive with Remote I/O and Benchtop Controller | Cole-Parmer | 07557-00 | |
| Masterflex L/S Precision Pump Tubing, PharMed BPT, L/S 16 | Cole-Parmer | 06508-16 | |
| Masterflex L/S Pricision Pump Tubing, Platinum-Cured Silicone, L/S 14 | Cole-Parmer | 96410-14 | |
| Millex-GP Syringe Filter Unit, 0.22 µm, polyethersulfone, 33 mm, gamma sterilized | Millipore | SLGPR33RS | |
| Pyrex 250 mL grass bottle, GL-45 screw cap | Corning | 1395-250 | |
| Silicon Septa for GL45 Open Top PBT Screw Cap | Corning | 1395-455S | |
| Silicone Light Stopper | IMG | 07763-18 | Upper diameter: 87 mm, Lower diameter: 75 mm |
| Sterile syringe, 10 mL, 50 mL | Generic | ||
| MOUSE SURGERY (Isolation of the heart-lung block | Lung transplantation) | |||
| 10-0 Nylon ties | Kono Seisakusho | N/A | |
| 10-0 Silk ties | Kono Seisakusho | N/A | |
| 4-0 Silk ties | Kono Seisakusho | N/A | |
| Arterial clamp, 45 mm curved, grooved | Natsume seisakusyo | C-17-45 | |
| BD Insyte IV Catheter 24GA | BD | 381512 | Or equivalent 24G i.v. catheter |
| Bulldog Vascular Forceps 45mm curved | Natsume seisakusyo | M2 | |
| Butorphanol tartrate | Meiji Seika Pharma | N/A | |
| Cefazolin Sodium | Otsuka Pharmaceutical | N/A | |
| Dumont forceps #5/45 | Fine Science Tools | 1251-35 | |
| Fine vannas style spring scissors | Fine Science Tools | 15403-08 | 45° tip, 0.01 x 0.06 mm |
| Gemini Cautery Kit | Harvard Apparatus | RS-300 | |
| Halsted-Mosquito clamp curved tip, 125 mm | Bioresearch center | 16181670 | |
| Hegar needle holder, 150 mm | B Braun/Aesculap | BM065R | |
| Heparine solution | Mochida Seiyaku | N/A | |
| Medetomidine | Nippon Zenyaku Kogyo | N/A | |
| Micro forceps straight | B Braun/Aesculap | BD33R | |
| Midazolam | Sandoz | N/A | |
| Mouse Ventilator | Harvard Apparatus | Model 687™ | |
| Normal Saline, Clinical grade | Otsuka Pharmaceutical | N/A | |
| Petri dish, 60 x 15 mm | BD | 351007 | |
| Safelet Cath PU 20 gauge polyurethan catheter | Nipro | 09-031 | |
| Sakaki stainless scissors curved 14 cm | Bioresearch center | 64152034 | |
| Scalpel holder | Bioresearch center | 16101040 | |
| Small animal retraction system | Fine Science Tools | 18200-20 | |
| Spare blade scalpel #11 | Muranaka Medical Instruments | 567-001-03 | |
| Spring scissors, 15 cm | Bioresearch center | PRI13-3736 | |
| Stereomicroscope | Leica Microsystems | M525 | Clinical-grade surgical microscope with a flexible arm system is preferable. |
| Sugita titanium aneurysm clip curved slim, No.98 | Mizuho medical | 17-001-98 | |
| Sugita titanium clip applier, 110 mm | Mizuho medical | 17-013-53 | |
| Temperature-adjustable electric warmer | Generic | ||
| Ultrafine cotton swab | Generic | ||
| VASCULAR AND BRONCHIAL CUFF | |||
| Fine sandpaper | Generic | ||
| Venula 20 gauge Teflon angiocatheter | Top | 1160 | |
| Venula 22 gauge Teflon angiocatheter | Top | 1161 | |
| Venula 24 gauge Teflon angiocatheter | Top | 1124 |
Riferimenti
- van der Mark, S. C., Hoek, R. A. S., Hellemons, M. E. Developments in lung transplantation over the past decade. Eur Respir Rev. 29 (157), 190132 (2020).
- Valapour, M., et al. OPTN/SRTR 2022 Annual Data Report: Lung. Am J Transplant. 24 (2S1), S394-S456 (2024).
- Hoffman, T. W. Waiting list dynamics and lung transplantation outcomes after introduction of the lung allocation score in the Netherlands. Transplant Direct. 7 (10), e760 (2021).
- Wilk, A. R., Edwards, L. B., Edwards, E. B. The effect of augmenting OPTN data with external death data on calculating patient survival rates after organ transplantation. Transplantation. 101 (4), 836-843 (2017).
- Neizer, H., Singh, G. B., Gupta, S., Singh, S. K. Addressing donor-organ shortages using extended criteria in lung transplantation. Ann Cardiothorac Surg. 9 (1), 49-50 (2020).
- Oliveira, P., Yamanashi, K., Wang, A., Cypel, M. Establishment of an ex vivo lung perfusion rat model for translational insights in lung transplantation. J Vis Exp. (199), e65981 (2023).
- Anand, R. P. Design and testing of a humanized porcine donor for xenotransplantation. Nature. 622 (7982), 393-401 (2023).
- Shakir, S., Hackett, T. L., Mostaco-Guidolin, L. B. Bioengineering lungs: An overview of current methods, requirements, and challenges for constructing scaffolds. Front Bioeng Biotechnol. 10, 1011800 (2022).
- Ott, H. C. Regeneration and orthotopic transplantation of a bioartificial lung. Nat Med. 16 (8), 927-933 (2010).
- Petersen, T. H. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Leiby, K. L. Rational engineering of lung alveolar epithelium. NPJ Regen Med. 8 (1), 22 (2023).
- Kitano, K., et al. Orthotopic transplantation of human bioartificial lung grafts in a porcine model: A feasibility study. Semin Thorac Cardiovasc Surg. 34 (2), 752-759 (2022).
- Ohata, K., Ott, H. C. Human-scale lung regeneration based on decellularized matrix scaffolds as a biologic platform. Surg Today. 50 (7), 633-643 (2020).
- Ren, X. Engineering pulmonary vasculature in decellularized rat and human lungs. Nat Biotech. 33 (10), 1097-1102 (2015).
- Doi, R. Transplantation of bioengineered rat lungs recellularized with endothelial and adipose-derived stromal cells. Sci Rep. 7 (1), 8447 (2017).
- Stone, K. C., Mercer, R. R., Gehr, P., Stockstill, B., Crapo, J. D. Allometric relationships of cell numbers and size in the mammalian lung. Am J Respir Cell Mol Biol. 6 (2), 235-243 (1992).
- Basil, M. C., Morrisey, E. E. Lung regeneration: a tale of mice and men. Semin Cell Dev Biol. 100, 88-100 (2020).
- Hsia, C. C., Hyde, D. M., Weibel, E. R. Lung structure and the intrinsic challenges of gas exchange. Compr Physiol. 6 (2), 827-895 (2016).
- Tomiyama, F., et al. Orthotopic transplantation of the bioengineered lung using a mouse-scale perfusion-based bioreactor and human primary endothelial cells. Sci Rep. 14 (1), 7040 (2024).
- Stoian, A., Adil, A., Biniazan, F., Haykal, S. Two decades of advances and limitations in organ recellularization. Curr Issues Mol Biol. 46 (8), 9179-9214 (2024).
- Crabbe, A. Recellularization of decellularized lung scaffolds is enhanced by dynamic suspension culture. PLoS One. 10 (5), e0126846 (2015).
- Daly, A. B. Initial binding and recellularization of decellularized mouse lung scaffolds with bone marrow-derived mesenchymal stromal cells. Tissue Eng Part A. 18 (1-2), 1-16 (2012).
- . Regulations for Animal Experiments and Related Activities Available from: https://www.clag.med.tohoku.ac.jp/clar/en/ (2024)
- Sokocevic, D., et al. The effect of age and emphysematous and fibrotic injury on the re-cellularization of de-cellularized lungs. Biomaterials. 34 (13), 3256-3269 (2013).
- Ren, X., et al. Ex vivo non-invasive assessment of cell viability and proliferation in bio-engineered whole organ constructs. Biomaterials. 52, 103-112 (2015).
- Watanabe, T. Mesenchymal stem cells attenuate ischemia-reperfusion injury after prolonged cold ischemia in a mouse model of lung transplantation: a preliminary study. Surg Today. 47 (4), 425-431 (2017).
- Watanabe, T., et al. Donor IL-17 receptor A regulates LPS-potentiated acute and chronic murine lung allograft rejection. JCI Insight. 8 (21), e158002 (2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon