Method Article
Transplantation de poumon issu de la bio-ingénierie à l’aide de poumons de souris décellularisés et de cellules endothéliales humaines primaires
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cet article décrit comment créer des poumons de souris issus de la bio-ingénierie à l’aide de méthodes de décellularisation et de recellularisation. Il détaille également la transplantation pulmonaire orthotopique ultérieure.
Résumé
La transplantation pulmonaire est un traitement essentiel pour les patients atteints de maladies pulmonaires en phase terminale comme la fibrose pulmonaire idiopathique, mais des défis tels que la pénurie de donneurs et les complications post-transplantation persistent. Les poumons issus de la bio-ingénierie, intégrant des cellules spécifiques au patient dans des échafaudages animaux décellularisés, présentent une alternative prometteuse. Malgré les progrès réalisés dans l’utilisation de poumons issus de la bio-ingénierie dans des modèles animaux, la fonctionnalité et la structure restent immatures. Ce protocole s’attaque à un obstacle critique en bio-ingénierie organique : le besoin d’une plateforme expérimentale rentable. En utilisant des modèles de souris au lieu d’animaux plus gros comme des rats ou des porcs, les chercheurs peuvent réduire considérablement les ressources nécessaires à chaque expérience, accélérant ainsi les progrès de la recherche.
Le protocole décrit une procédure détaillée pour la bio-ingénierie pulmonaire à l’aide de blocs cœur-poumon de souris et de cellules primaires humaines, en se concentrant sur la stratégie d’isolement du bloc cœur-poumon de souris, la décellularisation, la configuration du bioréacteur, la culture d’organes basée sur la perfusion et la transplantation orthotopique de poumons bio-modifiés. Cette plate-forme à l’échelle de la souris réduit non seulement les coûts expérimentaux, mais fournit également un cadre viable pour optimiser les types et le nombre de cellules pour la recellularisation, tester différents types de cellules à l’aide de méthodes histologiques et moléculaires et assurer le flux sanguin après la transplantation. La méthode a le potentiel d’être utilisée à de larges reprises, notamment l’étude des interactions cellulaires dans des conditions de culture tridimensionnelle, les interactions cellule-matrice et la modélisation ex vivo du cancer, faisant ainsi progresser le domaine de la bio-ingénierie des organes.
Introduction
La transplantation pulmonaire a été le remède décisif pour les patients atteints d’une maladie pulmonaire en phase terminale1 telle que la fibrose pulmonaire idiopathique, où le traitement médicamenteux est inefficace pour arrêter la détérioration de la fonction respiratoire. Chaque année, de plus en plus de patients éligibles s’ajoutent à la liste d’attente. Cependant, le nombre de dons d’organes de donneurs décédés a été inférieur au nombre croissant de patients en attente 2,3. Même après avoir subi une transplantation pulmonaire, un certain nombre de problèmes dégraderaient la fonction des poumons transplantés, notamment le dysfonctionnement des organes primaires, le syndrome allogénique réactif et les infections, qui réduisent considérablement la survie à 5 ans des receveurs de transplantation pulmonaire4.
Plusieurs options existent pour contrer les problèmes actuels de transplantation d’organes, notamment l’utilisation de donneurs marginaux5, la récupération de poumons de donneurs dans un système de perfusion pulmonaire ex vivo 6 et la xénotransplantation à l’aide de porcs génétiquement modifiés7. Ces alternatives peuvent élargir le bassin d’organes de donneurs ; Cependant, aucun ne peut entièrement résoudre la rareté, l’immunogénicité et l’hétérogénéité fonctionnelle des organes du donneur.
C’est loin d’être la réalité, mais les organes artificiels bio-conçus, où des cellules spécifiques au patient sont intégrées dans l’échafaudage d’organes animaux décellularisés, sont une source potentielle fascinante de transplantation d’organes solides. Plusieurs études pionnières qui ont démontré l’utilité potentielle des poumons issus de la bio-ingénierie ont été rapportées depuis 2010 9,10. Dans ces études, des poumons de rats ou de porcs ont été décellularisés par des détergents, des cellules animales ou humaines ont été injectées à partir de la trachée ou du système vasculaire pulmonaire pour régénérer le tissu pulmonaire dans le bioréacteur à perfusion, et certains d’entre eux ont été transplantés orthotopiquement dans les cavités thoraciques animales 11,12,13,14,15. Cependant, la fonction et la structure des poumons issus de la bio-ingénierie étaient prématurées, probablement en raison du nombre insuffisant de cellules cultivées dans le bioréacteur ou de jonctions intercellulaires moins intégrées.
L’un des obstacles à l’avancement de la recherche en bio-ingénierie des organes est l’absence d’une plate-forme expérimentale à petite échelle. Bien que les rats ou les porcs soient les animaux couramment utilisés dans ce domaine, ils nécessitent >10 8cellules pulmonaires par poumon16, ce qui est très coûteux pour les laboratoires universitaires. Si des souris sont disponibles pour la recherche en bio-ingénierie organique, nous pourrions réduire considérablement le coût de chaque expérience et accélérer le programme de recherche. Bien qu’il existe des différences anatomiques entre les poumons de souris et les poumons humains17, l’architecture de base du poumon est similaire chez les mammifères18. Par conséquent, les résultats des expériences à l’échelle de la souris peuvent s’appliquer à des animaux plus grands en multipliant simplement le nombre en fonction de la taille du corps.
Ce protocole vise à décrire la procédure expérimentale détaillée de bio-ingénierie pulmonaire à l’aide de blocs cœur-poumon de souris et de cellules primaires humaines19. Nous avons adopté un protocole de décellularisation pulmonaire de souris précédemment rapporté et largement utilisé pour cette étude 20,21,22. La partie difficile de la bio-ingénierie pulmonaire est la recellularisation du système vasculaire capillaire décellularisé20 ; Par conséquent, les cellules endothéliales de la veine du cordon ombilical humain seront utilisées dans ce protocole.
Protocole
Toutes les expériences ont suivi le Règlement sur l’expérimentation animale et les activités connexes à l’Université du Tohoku (15eédition), publié par l’Université du Tohoku23. Cette étude a été approuvée par le Comité institutionnel de protection et d’utilisation des animaux de l’Université de Tohoku (#2020AcA-041-01).
1. Préparation des matériaux pour la décellularisation
- Préparation de solutions de décellularisation (format 1 000 mL dans un flacon en verre autoclavable de 1 L)
- Eau déminéralisée stérile (DI) : Ajouter 1 000 ml d’eau distillée ou DI dans des bouteilles en verre autoclavables de 1 L. Autoclave pendant 20 min à 121 °C.
- Triton X-100 : Ajouter 1 mL de Triton X-100 à 1 000 mL d’eau DI stérile dans une bouteille en verre autoclavable au format 1 L. (Facultatif) Ajouter 10 mL de pénicilline et une solution de streptomycine (concentration finale, 500 unités/mL de pénicilline et 500 μg/mL de streptomycine).
REMARQUE : Ne pas autoclave. - Désoxycholate de sodium : Ajouter 20 g de poudre de désoxycholate de sodium à 1 000 ml d’eau DI stérile dans une bouteille en verre autoclavable de 1 L. Fermez le bouchon et retournez le flacon pour solubiliser la poudre. (Facultatif) Ajouter 10 ml de solution de pénicilline et de streptomycine.
REMARQUE : Ne pas autoclave. - 1 M de NaCl : Ajouter 58,44 g de NaCl à 1 000 ml d’eau distillée ou DI dans une bouteille en verre autoclavable de 1 L. Autoclave pendant 20 min à 121 °C.
- Solution mère de DNase I : Diluer à une concentration de 10 mg/mL dans le milieu A.
- Milieu A : Préparer 5 mM de CaCl2 (5 mg de CaCl2 dans 9 mL d’eau DI stérile) et une dilution 1:10 avec de l’eau DI stérile.
- Solution de travail DNase I : Ajouter 33 μL de solution mère de DNase I à 10 mL de milieu B.
- Milieu B : Préparer 10 fois le milieu B (155 mg de MgSO4 + 220 mg de CaCl2 dans 100 mL d’eau stérile DI) et une dilution 1:10 avec de l’eau DI stérile.
- Préparation des cathéters pour l’artère pulmonaire (AP) et la trachée (procédure stérile)
- Coupez le cathéter PA (cathéter pour la veine jugulaire du rat) à une longueur d’environ 15 mm.
- Déplacez le collier jusqu’à l’extrémité du cathéter.
- Insérez un connecteur de cathéter dans le cathéter PA et fixez-le à un injecteur. Les cathéters PA préparés sont présentés à la figure 1A.
- Conservez le cathéter PA dans de l’éthanol à 70 % jusqu’à utilisation.
- Coupez le cathéter i.v. de 20 G à une longueur d’environ 15 mm. Ceci est utilisé pour un cathéter trachéal.
- Chirurgie de la souris pour le prélèvement d’un bloc cœur-poumon
- Euthanasier une souris mâle (C57BL/6, poids > 28 g) présentant une surdose de dioxyde de carbone ou d’isoflurane.
- Placez la souris en position couchée sur une table d’opération et fixez les membres. Stériliser en vaporisant de l’éthanol à 70 % sur la surface de la poitrine et de l’abdomen.
- Ouvrez la cavité abdominale dans la ligne médiane du cou avec des ciseaux en acier inoxydable et fendez le sternum avec les ciseaux. Réséquez le diaphragme de la paroi thoracique, coupez la paroi thoracique ventrale pour exposer complètement les cavités thoraciques et retirez le thymus. Lister la veine cave inférieure et la veine cave supérieure droite avec une soie 4-0 pour empêcher la régurgitation de PBS à l’étape 1.3.5, améliorant ainsi l’évacuation du sang dans le système vasculaire pulmonaire.
- Coupez l’aorte abdominale avec des ciseaux en acier inoxydable pour le drainage. Si l’aorte abdominale est indiscernable, coupez la veine cave inférieure et l’aorte abdominale.
- Injecter 3 mL de PBS stérile à partir du ventricule droit à l’aide d’une seringue stérile de 5 mL avec une aiguille de 27 G en perforant la paroi du ventricule droit.
- Enroulez le PA principal avec une soie 4-0 à l’aide d’une pince Dumont.
REMARQUE : L’AP principal et l’aorte ascendante peuvent être enroulés ensemble. - Ouvrez une fenêtre de 2 mm sous les valves PA en coupant la paroi du ventricule droit avec des ciseaux à ressort.
- Insérez le cathéter PA à travers la fenêtre et fixez la soie 4-0 précédemment bouclée (Figure 1B).
REMARQUE : Évitez de toucher le PA pendant cette procédure, cela pourrait endommager la paroi du PA. L’AP principale et l’aorte ascendante peuvent être ligaturées et fixées ensemble. - Injectez lentement 2 ml de PBS à travers le cathéter PA à l’aide d’une seringue stérile de 5 ml. Assurez-vous que les deux poumons se dilatent légèrement lorsque le PBS est injecté.
- Canulez la trachée à l’aide d’un cathéter trachéal et attachez-la en place avec une suture en soie 4-0 (Figure 1C).
- Injectez lentement 2 ml d’air à travers le cathéter trachéal à l’aide d’une seringue stérile vide de 5 ml et maintenez-la pendant 10 secondes. Assurez-vous qu’il n’y a pas de fuite d’air des poumons.
- Retirez le cœur et le poumon en bloc. Saisissez la trachée avec la pince de Dumont et avec le cathéter trachéal à l’intérieur, coupez l’œsophage cervical et disséquez-le des vertèbres. Coupez les veines sous-clavières bilatérales et les artères. Enfin, coupez l’œsophage et l’infra veine cave au niveau du diaphragme.
REMARQUE : Ne touchez pas la surface des poumons avec des instruments. Tout léger contact peut entraîner une fuite d’air.
- Décellularisation des poumons de souris (procédure de 3 jours)
REMARQUE : Toutes les procédures de la section 1.4 doivent être effectuées dans une enceinte de sécurité biologique propre.- Jour 1
- Transférez le bloc cœur-poumon réséqué dans une boîte de Pétri en plastique de 10 cm de diamètre et incubez les blocs cœur-poumon dans de l’eau stérile DI pendant 1 h à 4 °C.
- Injecter 3 fois 2 ml d’eau DI stérile dans le cathéter de la trachée et 3 fois plus d’eau stérile dans le cathéter PA à l’aide d’une seringue stérile de 5 mL. Faites une pause après chaque injection pour permettre au liquide de sortir lorsque le poumon recule (Figure 1C).
REMARQUE : Injectez de l’eau à environ 0,5 mL/s. - Injecter 2 mL de solution Triton X-100 à 0,1 % dans le cathéter trachéal et 2 mL dans le cathéter PA.
- Placez le bloc cœur-poumon dans la boîte de Pétri et incubez statiquement dans la solution Triton X-100 pendant une nuit à 4 °C.
- Jour 2
- Retirer la solution de Triton X-100 des poumons avec de l’eau DI stérile comme décrit à l’étape 1.4.1.2.
- Injecter 2 mL de solution de désoxycholate de sodium à 2 % dans le cathéter trachéal et 2 mL dans le cathéter PA. Incuber dans une solution de désoxycholate pendant 24 h à 4 °C.
- Jour 3
- Retirer la solution de désoxycholate de sodium des poumons avec de l’eau DI stérile comme décrit à l’étape 1.4.1.2.
- Injecter 2 mL de solution de NaCl 1 M dans le cathéter trachéal et 2 mL dans le cathéter PA. Incuber dans la solution NaCl pendant 1 h à RT.
- Retirer de la solution de NaCl avec de l’eau DI stérile comme décrit à l’étape 1.4.1.2.
- Injecter 2 mL de solution de travail de DNAse I dans le cathéter trachéal et 2 mL dans le cathéter PA. Incuber dans la solution de travail DNase pendant 1 h à RT.
- Retirer la solution de DNase des poumons comme décrit à l’étape 1.4.1.2, mais avec du PBS stérile. Confirmez que les poumons sont blancs et transparents sur le bord après la procédure de décellularisation.
REMARQUE : Au fur et à mesure que la procédure de décellularisation progresse, le poumon devient plus fragile. Manipulez toujours le bloc cœur-poumon avec prudence et évitez de toucher la surface des poumons. Après décellularisation, les blocs cœur-poumon peuvent être stockés dans du PBS/antibiotiques à 4 °C jusqu’à 3 semaines.
- Jour 1
2. Culture de cellules primaires humaines
- Mélangez le milieu de croissance des cellules endothéliales-2 (EGM2) et le kit Bullet contenant du sérum fœtal bovin (concentration finale, 2 %), de l’hydrocortisone (concentration finale, 0,2 μg/mL), du facteur de croissance des fibroblastes de base humain (concentration finale, 4 ng/mL), du facteur de croissance de l’endothélium vasculaire (2 ng/mL), du facteur de croissance analogue à l’insuline R3-1 (concentration finale, 5 ng/mL), de l’acide ascorbique (concentration finale, 75 μg/mL), du facteur de croissance épidermique humaine (concentration finale, 10 ng/mL), la gentamicine/amphotéricine-1000 (concentration finale, gentamicine : 30 μg/mL, amphotéricine : 15 ng/mL) et l’héparine (concentration finale, 1 ng/mL).
- Décongeler 2 × 106 cellules endothéliales des veines du cordon ombilical humain (HUVEC) dans des flacons congelés dans un bain-marie à 37 °C.
- Mélanger les cellules avec EGM2 dans un tube conique de 15 mL et centrifuger à 500 × g pendant 5 min.
- Comptez les cellules et sous-cultivez-les à une densité cellulaire appropriée (2,0 x 104 cellules/cm2 est recommandé). Commencez à partir de plaques de format 6 puits, puis transférez-les dans des flacons T75.
- Passez les cellules jusqu’à ce que le nombre requis de cellules soit obtenu.
REMARQUE : Pour une couverture vasculaire pulmonaire complète à l’aide d’HUVEC, 3 × 107 HUVECs seront nécessaires19.
3. Configuration du bioréacteur et culture d’organes de perfusion
- Préparation d’une chambre d’organe et d’un réservoir cellulaire
- Découpez des trous dans un bouchon en silicone à l’aide d’une perceuse de liège, comme le montre la figure 2A. La taille des trous est de 5 mm (i, ii et iii) et de 7 mm (iv et v). Chaque numéro de trou (i-v) de la figure 2A correspond aux numéros de trou de la figure 2B.
- Insérez le tube de la pompe dans le bouchon en silicone comme indiqué sur la Figure 2B.
- Découpez un trou de 5 mm dans un septum en silicone d’un bouchon à vis ouvert à l’aide d’une perceuse de liège. Insérez un tube L/S 14 durci au platine dans le trou (Figure 2B,C).
- Autoclavez les matériaux ci-dessus, y compris le bouchon en silicone avec tube, la cartouche en verre, le bouchon à vis GL-45 avec tube, une bouteille en verre autoclavable de 250 ml et un tube L/S 14 avec raccords de leurre (tube B et tube C sur la figure 3A) pendant 20 min à 121 °C. Choisissez les raccords de leurre appropriés pour vous assurer que les tubes B et C forment une boucle.
REMARQUE : La cartouche en verre est utilisée pour une chambre d’organe, et la bouteille en verre de 250 ml est utilisée pour un réservoir de cellule.
- Assemblage d’un circuit de bioréacteur à perfusion
REMARQUE : Les procédures suivantes doivent être effectuées sur un banc propre.- Ajoutez 70 ml de milieu de culture dans la boîte en verre, puis placez le bouchon en silicone sur la boîte en verre.
- Assembler un bouchon en silicone, une cartouche en verre, un bouchon à vis GL-45 avec tube, une bouteille en verre autoclavable de 250 ml et un tube L/S 14 avec des raccords de leurre à l’aide de robinets à trois voies, comme décrit à la figure 3A. Insérez une aiguille de 20 G dans un septum en silicone d’un bouchon à vis GL-45.
- Remplissez le média dans les tubes A, B et C avec une seringue de 10 ml reliée aux robinets d’arrêt i) et iii) (~3 à 5 ml de média seront nécessaires pour remplir 1 m de tube). Répéter l’injection et le retrait du média à l’aide d’une seringue de 10 mL à l’aide d’un robinet d’arrêt à trois voies pour s’assurer qu’il n’y a pas de bulle d’air à l’intérieur de la tubulure.
- Fixez le cathéter PA du bloc cœur-poumon décellularisé à l’aide d’un raccord de leurre relié à la tubulure C. Évitez les bulles d’air dans le cathéter ou la tubulure.
- Récoltez et remettez en suspension les HUVECs à une densité de 0,5-1 × 106 cellules/mL dans EGM2. Ajoutez la suspension cellulaire de l’étape 2.5 dans le réservoir de cellule.
REMARQUE : La suspension cellulaire est préparée de préférence entre les étapes 3.2.4 et 3.2.5. Mettez une barre d’agitation dans le réservoir de la cellule.
- Injection gravitaire de cellules endothéliales
- Placez le réservoir de la cellule contenant les HUVECs sur un agitateur magnétique. Assurez-vous que le fond du réservoir de la cellule se trouve à 30 cm au-dessus de la chambre de l’organe (Figure 2D et Figure 3A).
- Allumez l’agitateur magnétique à une vitesse d’environ 120 tr/min.
- Ouvrez le robinet d’arrêt i) et ii) afin que la suspension cellulaire puisse être injectée dans l’échafaudage décellularisé via la tubulure A, la tubulure C et le cathéter PA.
REMARQUE : Lors de l’injection de 3 × 107 cellules à une densité cellulaire de 1 × 106 cellules/mL, le volume de la suspension cellulaire doit être de 30 mL. Un débit d’injection typique est de 1 à 2 mL/min. - Après avoir injecté complètement la suspension cellulaire, détachez le tube A du robinet ii).
REMARQUE : Le comptage des cellules peut être effectué à cette étape pour mesurer le taux de rétention des cellules dans l’échafaudage décellularisé. Le taux de rétention cellulaire typique est de 80 à 90 %, quel que soit le nombre de cellules injectées19.
La qualité de l’échafaudage pulmonaire décellularisé détermine strictement le taux de rétention cellulaire. Toute fuite du poumon décellularisé (par exemple, de l’AP principal, la surface pulmonaire) entraîne un taux de rétention cellulaire plus faible. Assurez-vous qu’il n’y a pas de fuite apparente du poumon décellularisé en injectant 2 à 3 mL de milieu de culture avec une seringue stérile reliée à l’un des robinets d’arrêt du bioréacteur à perfusion et confirmez que les poumons décellularisés se dilatent légèrement au fur et à mesure que le milieu est injecté.
- Culture d’organe de perfusion
- Placez la chambre de l’orgue dans un incubateur de CO2 .
- Fixez le tube B à une tête de pompe reliée à une pompe pulsatile.
- Fermez la porte vitrée de l’incubateur de CO2 . Assurez-vous que le tube est correctement placé entre la porte vitrée et le joint en caoutchouc (Figure 3B).
- Incuber l’échafaudage décellularisé à 37 °C pendant 3 h pour laisser les cellules endothéliales injectées s’installer dans l’échafaudage.
REMARQUE : Assurez-vous que la pompe pulsatile est toujours éteinte entre les étapes 3.4.1 et 3.4.4. - Démarrez la pompe à un débit de 6 tr/min, ce qui permet une perfusion de 2 ml/min à l’aide d’un tube L/S 14. Regardez le poumon décellularisé être légèrement dilaté avec la perfusion médiale.
- Fermez la porte de l’incubateur (figure 3C).
- Effectuez le changement de support via Stopcock iii). Changez la moitié du support tous les 2 ou 3 jours.
- Arrêtez l’entraînement de la pompe, fixez une seringue stérile de 50 ml au robinet d’arrêt iii) et retirez 50 ml de fluide de la chambre.
- Remplissez une autre seringue stérile de 50 ml avec 50 ml de milieu préchauffé et transférez le milieu dans la chambre à l’aide du robinet d’arrêt iii). Changez le robinet d’arrêt de manière appropriée, puis démarrez la pompe pulsatile.
- Récoltez le bloc cœur-poumon recellularisé après au moins 2 jours de culture d’organe de perfusion.
REMARQUE : Dans notre étude, 2 jours de culture de perfusion ont suffi pour revasculariser de manière homogène l’échafaudage pulmonaire décellularisé à l’aide de 3 × 107 HUVEC . Lorsque l’on utilise moins de 3 × 107 HUVEC, une incubation plus longue pourrait être nécessaire pour améliorer l’efficacité de la recellularisation.
4. Transplantation orthotopique du poumon bio-modifié
- Préparation du médicament
- Préparez l’agent anesthésique combiné MMB en mélangeant du midazolam (concentration finale, 4 mg/kg), de la médétomidine (concentration finale, 0,75 mg/kg) et du tartrate de butorphanol (concentration finale, 5 mg/kg) avec une solution saline normale de qualité clinique.
- Préparez la solution d’héparine en la mélangeant avec une solution saline normale de qualité clinique (concentration finale, 1000 U/mL).
- Préparez la céfazoline sodique en la mélangeant avec une solution saline normale de qualité clinique (une dose, 30 mg/kg).
- Intervention chirurgicale
- Préparation des poignets
- Frottez légèrement les trois types d’angiocathéter avec du papier de verre fin pour faciliter le maintien des vaisseaux dans le ballonnet.
- Préparez un brassard bronchique à partir d’un angiocathéter en téflon de 20 g de 1 mm de longueur à l’aide d’un scalpel #11. Avant de couper l’angiocathéter, utilisez l’arrière du scalpel #11 pour faire une indentation dans l’angiocathéter afin d’attacher le nylon 10-0.
- Préparez le brassard de veine pulmonaire (PV) à partir d’un angiocathéter en téflon de 22 g de 0,8 mm de longueur et le brassard en PA à partir d’un angiocathéter en téflon de 24 g de 0,6 mm de longueur.
REMARQUE : Cette préparation peut être effectuée avant le jour de l’expérience.
- Fixation du brassard au poumon issu de la bio-ingénierie
- Placez le bloc cœur-poumon sur un morceau de gaze stérile humidifié avec une solution saline froide, placez un autre morceau de gaze sèche et propre en dessous et placez une boîte de Pétri dans une boîte en polystyrène remplie de glace propre.
REMARQUE : La mise en place de la gaze sèche empêche le bloc cœur-poumon de geler accidentellement. - Placez une pince à anévrisme pour fixer la trachée et la gaze (Figure 4A). Placez un petit morceau de gaze sur le cœur, en couvrant également le poumon droit. Placez une autre gaze sur le poumon gauche. Ajustez cette rétraction avec la gaze humidifiée pour exposer le hile gauche aussi clairement que possible.
- Disséquez soigneusement les structures hilaires les unes des autres à l’aide d’une micro-pince droite ou inclinée, selon la préférence (Figure 4B). Commencez à disséquer à partir du ligament pulmonaire le long du nerf vague. Incisez la plèvre viscérale sous le PV et déplacez l’aorte descendante et le nerf vague ensemble à travers l’arrière du hile pulmonaire gauche vers le côté crânien.
- Disséquez l’AP principal gauche du tronc pulmonaire jusqu’au bord même du poumon gauche (Figure 4C). Ensuite, divisez l’AP au niveau du tronc pulmonaire pour obtenir une longueur adéquate.
- Disséquez le PV gauche du côté gauche de l’oreillette gauche jusqu’au bord même du poumon gauche (Figure 4D). Divisez le PV gauche au niveau de l’oreillette gauche pour obtenir une longueur adéquate.
- Suspendez le brassard de sonorisation juste au-dessus du PA à l’aide de la pince de stabilisation et insérez le PA à l’intérieur du brassard (Figure 4E). Repliez l’AP sur le brassard), exposant la surface endothéliale. Fixez-le autour du poignet à l’aide d’une attache en nylon 10-0 (Figure 4F). Placez le brassard sur le PV de la même manière (Figure 4G,H).
- Divisez la bronche gauche au niveau de la carène. Placez le brassard sur la bronche de manière identique (Figure 4I).
- Placez le bloc cœur-poumon sur un morceau de gaze stérile humidifié avec une solution saline froide, placez un autre morceau de gaze sèche et propre en dessous et placez une boîte de Pétri dans une boîte en polystyrène remplie de glace propre.
- Procédure pour la souris réceptrice
- Anesthésier la souris receveuse avec un mélange de MMB i.p. avec une aiguille de 27 G et intuber en insérant un angiocathéter en polyuréthane de 20 G sous un microscope. Placez la souris receveuse sur un réchauffeur électrique à température réglable dans la position de décubitus latéral droit et connectez l’angio-chathéter au respirateur. Réglez le réglage du ventilateur comme suit : oxygène 2 L/min, fréquence respiratoire 120 bpm, volume courant 0,5 mL. Stérilisez la paroi thoracique avec de l’éthanol à 70 % et injectez le mélange de céphazoline s.c.
- Incisez la peau avec des ciseaux. Coupez le tissu sous-cutané et les muscles avec un cautérisation. Ouvrez le coffre à travers le 3èmeespace intercostal et placez les écarteurs de poitrine.
REMARQUE : Bien que la thoracotomie doive être suffisamment grande pour l’implantation, ne blessez pas l’artère mammaire interne, ce qui peut entraîner des saignements massifs. - Disséquez le ligament pulmonaire à l’aide d’un coton-tige et de gros ciseaux à ressort. Placez un nettoyant artériel incurvé sur le poumon gauche du receveur pour rétracter facilement le poumon. À l’aide d’une micro-pince coudée, disséquez la plèvre médiastinale autour du hile pulmonaire gauche.
REMARQUE : La base de la dissection de la plèvre est similaire à la résection pulmonaire anatomique d’un être humain. - Disséquez l’AP de la bronche à l’aide d’une micro-pince incurvée du médiastin jusqu’au bord même du poumon gauche (Figure 5A). Disséquez la bronche de la PV de la même manière.
REMARQUE : La dissection peut être effectuée facilement lorsque la plèvre est disséquée lors de la manœuvre précédente (étape 4.2.3.3). - Placez un noeud coulant de soie 10-0 à la base du PA pour occlure (Figure 5B). Placez une pince anévrismale mince et inclinée à la base de la PV et de la bronche (Figure 5C).
- Enroulez du nylon 10-0 autour de la bronche, du PA et du PV, en le laissant lâche pour fixer les poignets aux étapes suivantes.
- Incisez l’AP, la bronche et la PV du receveur au bord du poumon gauche du receveur à l’aide de ciseaux à microressort (Figure 5D). Dilater doucement le PA et le PV à l’aide d’une micro-pince droite. Prélever le sang dans l’AP et le PV avec une solution saline à l’aide d’une seringue de 1 mL et d’un angiocathater de 24 G.
REMARQUE : Les incisions de l’AP, des bronches et de la PV sont environ un tiers du tour. Les micro-pinces droites sont douces et adaptées à la dilatation. - Placez le poumon issu du génie biologique, qui est recouvert de gaze humidifiée, sur le poumon gauche du receveur (figure 5E), aussi près que possible du médiastin du receveur.
- Insertion du brassard PA du donneur dans le PA du receveur (Figure 5F).
REMARQUE : Il y aura un certain étirement sur l’AP du donneur. Si la taille de l’incision de l’AP est appropriée, le brassard du donneur est moins susceptible d’être délogé. Déplacer le poumon bio-modifié près du médiastin empêchera également le brassard du donneur d’être délogé. - Fixez-le autour du poignet à l’aide d’une attache en nylon 10-0 (Figure 5G). De la même manière, insérez et fixez la bronche du donneur (Figure 5H) et les brassards PV (Figure 5I,J).
- Retirez le clip anévrysmal à angle mince (Figure 5L). Observez que le sang reflue au-delà du brassard PV et retirez l’attache en soie sur PA pour reprendre le flux sanguin antérograde vers le poumon bio-modifié.
- Préparation des poignets
Résultats
Selon le protocole de décellularisation, les poumons de souris sont visiblement blancs et translucides (Figure 6A). Les composants cellulaires doivent être entièrement éliminés, mais la structure alvéolaire reste intacte lors de l’observation histologique (Figure 6B,C). Des poumons de souris recellularisés à l’aide de 3 × 107 HUVEC avec une culture de bioréacteur à perfusion de 2 jours montrent une distribution homogène des HUVECs (Figure 7A). Les HUVECs migrent dans la zone alvéolaire périphérique, formant un réseau capillaire (Figure 7B). Après la transplantation orthotopique et la reperfusion de poumons de bio-ingénierie, un flux sanguin contenant des globules rouges est observé de manière homogène dans les poumons de bio-ingénierie (Figure 8A,B).

Figure 1 : Canulation du bloc cœur-poumon de souris. (A) Cathéters artériels pulmonaires préparés. (B) Schéma de canulation. (C) Image représentative après la fin de la canulation. Barres d’échelle = 1 cm (A,C). Cette figure a été adoptée de Tomiyama et al.19. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Préparation de la chambre de l’organe. (A) Les trous sont découpés comme décrit. (B) Le tube est inséré comme indiqué. (C) Préparation du bouchon d’une bouteille en verre autoclavable de 250 mL pour le réservoir de la cellule. (D) La bouteille en verre de 250 ml placée sur l’agitateur magnétique. Cette figure a été adoptée de Tomiyama et al.19. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Configuration d’un bioréacteur à base de perfusion. (A) Pièces et assemblage. (B) Configuration réelle. Notez que le tube est inséré entre une porte vitrée et un joint en caoutchouc. (C) Un instantané pendant la culture d’organe de perfusion entraînée par pompe. Cette figure a été adoptée de Tomiyama et al.19. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Préparation du poumon issu du génie biologique pour la transplantation. (A) Placement du poumon modifié. (B) Dissection du hile. (C) Dissection de l’AP principal. (D) Dissection du PV. (E) Insertion du PA dans le brassard. (F) Fixation du PV au brassard. (G) Insertion du PV dans le brassard. (H) Fixation du PV au brassard. (I) Insertion et fixation de la bronche gauche au brassard. Abréviations : PA = artère pulmonaire ; PV = veine pulmonaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
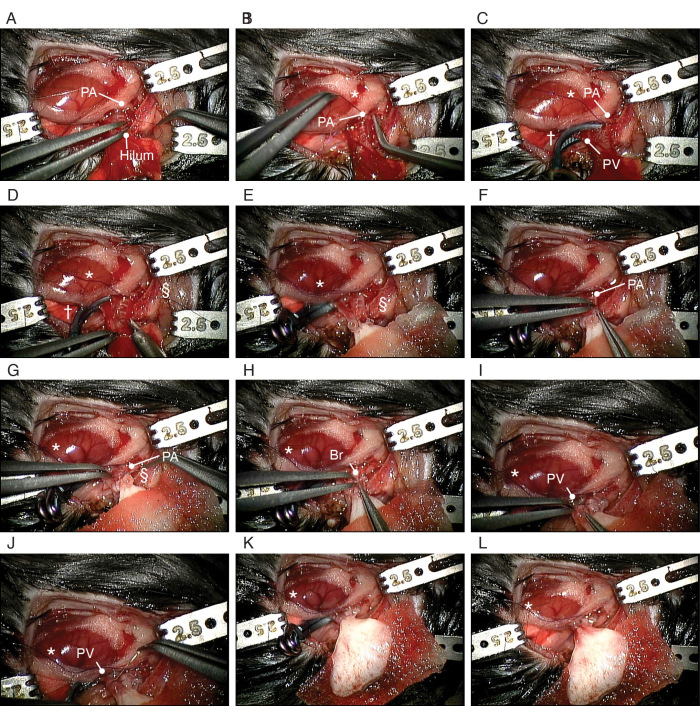
Figure 5 : Procédure de transplantation orthotopique du poumon bio-modifié. (A) Dissection de l’AP du receveur. (B) Faire un nœud coulant autour de l’AP du destinataire. (C) Écrêtage du PV et de la bronche. (D) Inciser l’AP. (E) Mise en place du poumon gauche issu de la bio-ingénierie. (F) Insertion de l’AP du ballonnet du poumon bio-modifié dans l’AP du receveur. (G) Fixation du PA autour du brassard. (H) Insertion du brassard bronchique du poumon issu de la bio-ingénierie dans la bronche du receveur. (I) Insertion du PV du poumon issu de la bio-ingénierie dans le PV du receveur. (J) Fixation du PA autour du brassard. Abréviations : PA = artère pulmonaire ; PV = veine pulmonaire ; Br = bronche ; * = noeud coulant ; † = clip anévrismal ; § = Cravate en nylon 10-0. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Décellularisation du poumon de souris. (A) Image macroscopique du poumon décellularisé. (B) Image de faible puissance du poumon décellularisé (grossissement, 100x). (C) Image de haute puissance du poumon décellularisé colorée à l’hématoxyline et à l’éosine. Notez qu’il n’y a pas de composante cellulaire visible (grossissement, 400x). Barres d’échelle = 100 μm (B), 50 μm (C). Veuillez cliquer ici pour voir une version agrandie de cette figure.
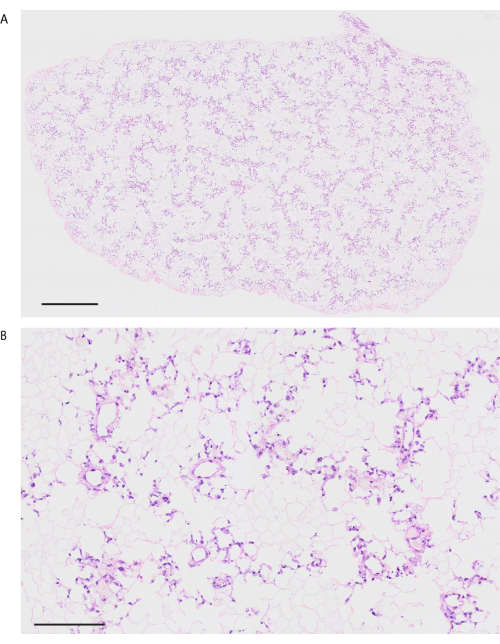
Figure 7 : Poumon de souris revascularisé à l’aide de HUVEC. (A) Image de faible puissance du poumon revascularisé colorée à l’hématoxyline et à l’éosine (grossissement, 200x, pavage). (B) Image de haute puissance du poumon revascularisé (grossissement, 200x). Barres d’échelle = 1000 μm (A), 100 μm (B). Abréviations : HUVECs = cellules endothéliales de la veine du cordon ombilical humain ; H&E = hématoxyline et éosine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
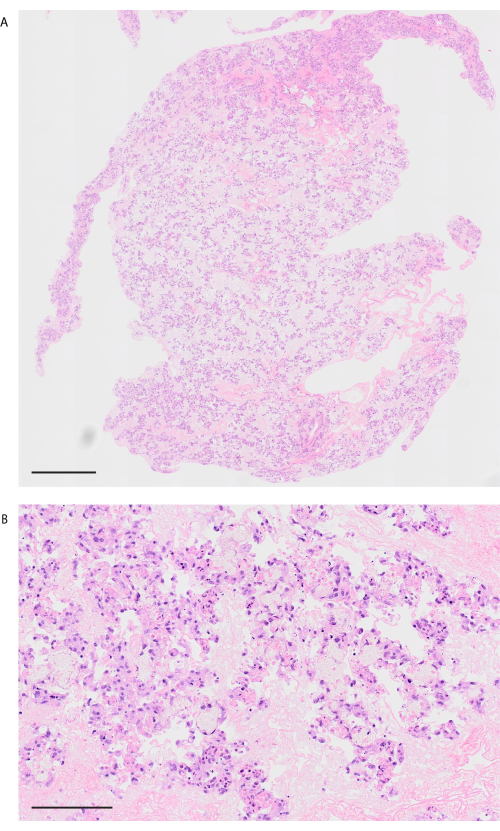
Figure 8 : Image pulmonaire après transplantation et reperfusion sanguine. (A) Image H&E de faible puissance du poumon revascularisé après 10 min de reperfusion (grossissement, 200x, pavage). (B) Image H&E haute puissance du poumon revascularisé après 10 min de reperfusion (grossissement, 200x). Barres d’échelle = 1000 μm (A), 100 μm (B). Abréviation : H&E = hématoxyline et éosine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La bio-ingénierie organique est une entreprise exigeante. Le processus de sélection coûteux a entravé le cycle de recherche et de développement de ce domaine. En utilisant des souris comme plate-forme expérimentale, l’espace, les cellules et les milieux sont considérablement réduits par rapport à la plate-forme de rat précédemment utilisée. Bien qu’il n’ait pas encore été possible de mesurer des paramètres physiques détaillés tels que l’échange gazeux, la résistance vasculaire ou la compliance pulmonaire, le modèle pulmonaire de souris permet d’accélérer les délais de recherche car il permet une itération rapide des protocoles expérimentaux et des tests de viabilité cellulaire, d’intégration et d’interaction entre les cellules. Les souris se reproduisent rapidement et sont disponibles dans de nombreuses souches génétiquement modifiées, offrant une flexibilité dans l’étude de diverses modifications génétiques et cellulaires in vivo. Cette capacité à tester rapidement des hypothèses et à optimiser les protocoles contribue à faire progresser notre compréhension des environnements cellulaires optimaux et des techniques de culture nécessaires à la réussite de la bio-ingénierie pulmonaire. En affinant les techniques dans des modèles murins, les chercheurs peuvent établir des méthodes et des protocoles évolutifs qui peuvent ensuite être traduits en modèles animaux plus grands et, éventuellement, en applications humaines.
L’étape critique de la procédure est l’insertion et la fixation d’un cathéter PA. La fixation du cathéter PA n’est possible qu’en utilisant un cathéter de petit diamètre (<3 Fr) avec un collier à l’extrémité. En raison de la nature fragile des poumons, la chirurgie doit être pratiquée avec prudence. Aucun instrument métallique ne doit toucher la surface des poumons ; Sinon, le poumon subirait des fuites importantes. Utilisez un coton-tige pour manœuvrer les poumons si nécessaire. Les auteurs supposent que les chercheurs pourraient effectuer efficacement la procédure de canulation après l’entraînement à l’aide de 10 à 15 souris.
Le protocole de décellularisation décrit ici est basé sur les rapports précédents22,24. D’autres protocoles utilisant différents ensembles de détergents peuvent être applicables. Le bloc cœur-poumon doit toujours être traité avec prudence. Les incidents typiques au cours de la procédure de décellularisation comprennent la pénétration du cathéter PA, le détachement du cathéter trachéal et les fuites d’air. Les auteurs n’ont pas confirmé expérimentalement l’intégrité de l’échafaudage décellularisé après stockage réfrigéré dans le PBS. Pourtant, les auteurs n’ont pas rencontré de problèmes lors de l’utilisation de blocs cœur-poumon décellularisés stockés dans le PBS pendant une période allant jusqu’à 4 semaines.
Il est crucial d’éviter la contamination bactérienne. Tous les équipements en verre, en PVDF et en silicium doivent être autoclavés avant l’expérience. Les autres pièces ne doivent être utilisées qu’une seule fois. Pour minimiser le risque de contamination bactérienne, toutes les procédures doivent être effectuées dans une enceinte de biosécurité propre. Il est souhaitable d’inclure des antimycosiques ainsi que des antibiotiques dans les milieux. Les changements fréquents de milieu pendant la perfusion augmentent le risque de contamination. De plus, les bulles d’air doivent toujours être évitées dans le tube. Les bulles d’air dans le tube sont ensuite piégées dans l’échafaudage décellularisé, ce qui pourrait bloquer la perfusion du média dans la zone périphérique et entraîner une distribution cellulaire hétérogène. De plus, les cellules endothéliales doivent être complètement détachées par trypsinisation ou par d’autres milieux de dissociation cellulaire appropriés. Les granules cellulaires doivent être bien perturbées pour former une suspension unicellulaire homogène. Une densité cellulaire trop élevée (par exemple, >2 millions de cellules/ml) pourrait favoriser la formation d’amas cellulaires, ce qui pourrait entraîner une embolie dans le système vasculaire proximal.
Nous n’avons testé qu’une courte période (2 ou 3 jours) de culture en bioréacteur de perfusion. Dans notre étude précédente, nous avons utilisé un nombre variable de cellules endothéliales pour revasculariser l’échafaudage pulmonaire décellularisé de la souris et avons constaté qu’il existe un seuil où l’ajout de cellules supplémentaires n’améliore pas la couverture cellulaire, qui était de ~3 × 107 cellules endothéliales par bloc poumon-cœur de souris19. Nous nous attendons à ce qu’une durée de culture plus longue (par exemple, 14 jours) améliore la couverture et la maturation du système vasculaire recellularisé, comme décrit dans les études précédentes de bio-ingénierie pulmonaire 9,10,15,25.
La base de la préparation de la greffe pulmonaire bio-modifiée est similaire à celle d’une transplantation pulmonaire de souris ordinaire26,27. Le tissu pulmonaire modifié n’est pas aussi fragile qu’une greffe pulmonaire ordinaire. Le défi est que le tissu pulmonaire, y compris la structure du hile, est entièrement blanc ou presque transparent. Une compréhension précise de l’anatomie locale est indispensable à la réussite de la transplantation. La technique stable doit être obtenue en utilisant des poumons natifs. Les auteurs supposent que les chercheurs pourraient effectuer confortablement la procédure de transplantation après s’être entraînés à l’aide de 100 souris.
La transplantation du poumon bio-modifié à l’aide de cellules dérivées de l’homme chez la souris est techniquement disponible ; Cependant, le rejet aigu du greffon est inévitable en raison de la nature xénotransplantatoire de ce modèle. Ce modèle peut être utilisé pour tester l’efficacité de recellularisation à court terme des poumons issus de la bio-ingénierie, et la fonctionnalité à long terme devrait être étudiée à l’aide de souris immunodéficientes.
Bien qu’elle n’ait pas été testée dans la méthode actuelle, la bio-ingénierie du poumon entier utilisant à la fois des cellules endothéliales et épithéliales ne devrait pas être techniquement si difficile, compte tenu des difficultés de l’ingénierie vasculaire pulmonaire décrites ici. De plus, cette plateforme à l’échelle de la souris peut être étendue à d’autres domaines de recherche, tels que l’étude de l’interaction cellulaire dans des conditions de culture 3D, l’interaction cellule-matrice, la modélisation ex-vivo du cancer, etc. En résumé, cette méthode fournit une plate-forme de bio-ingénierie pulmonaire raisonnable et robuste.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts concernant ce manuscrit.
Remerciements
Cette étude a été soutenue financièrement par la subvention d’aide à la recherche scientifique / KAKENHI (C) #20K09174, #23K08308, le Fonds pour la promotion de la recherche internationale conjointe (Fostering Joint International Research (B)) #22KK0132 pour TS, la subvention JSPS KKENHI numéro 21K08877 pour TW, la bourse Leave a Nest Ikeda-Rika pour FT et la subvention Grant-in-Aid pour les boursiers JSPS #21J21515 pour FT. Nous apprécions grandement Mme Maiko Ueda, membre du personnel technique du noyau de recherche biomédicale de la faculté de médecine de l’Université de Tohoku, pour son travail intensif en observation histologique. Nous apprécions également les conseils techniques de Mme Yumi Yoshida et de M. Koji Kaji du Centre des instruments de recherche de l’IDAC, Université de Tohoku, pour leur soutien au traitement d’images.
matériels
| Name | Company | Catalog Number | Comments |
| DECELLULARIZATION | |||
| 27 G x 1/2 in. BD PrecisionGlide Needle | BD | 305109 | Or equivalent 27 G injection needle |
| BD Insyte IV Catheter 20 GA X 1.8 8IN | BD | 381237 | Or equivalent 20 G IV catheter |
| Blade silk suture (4-0) | Nesco | GA04SB | Or equivalent |
| CaCl2 | Sigma-Aldrich | C5670 | |
| Catheter for rat jugular vein, PU 2Fr 10 cm | Instech | C20PU-MJV1301 | Recommended for mice weighs 30 g and under. |
| Catheter for rat jugular vein, PU 3Fr 10 cm | Instech | C30PU-RJV1307 | Recommended for mice weighs over 30 g. |
| DNase I | Sigma-Aldrich | DN25 | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| NaCl | Sigma-Aldrich | S3014 | |
| PinPort injectors | Instech | PNP3M | |
| PinPorts, 22 G | Instech | PNP3F22-50 | Fits C30PU-RJV1307 |
| PinPorts, 25 G | Instech | PNP3F25-50 | Fits C20PU-MJV1301 |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | |
| Sterile syringe, 5 mL | Generic | ||
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| CELL CULTURE | |||
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| HUVEC – Human Umbilical Vein Endothelial Cells | Lonza | C2519A | |
| PERFUSION-BASED BIOREACTOR | |||
| 20 G needle | Generic | ||
| 3-way stopcock | Generic | ||
| Cork borer | Generic | Boring size, 6-10 mm | |
| EasyLoad III pump head | Cole-Parmer | 243934 | |
| Glass canister | Hario | SCN-200T | Inner diameter: 80 mm |
| Heating magnetic stirrer | Generic | ||
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9965-01 | Female, fits tubing with I.D. 1.5 mm (L/S 14) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9964-01 | Male, fits tubing with I.D. 1.5 mm (L/S 14) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9965-03 | Female, fits tubing with I.D. 3 mm (L/S 16) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9964-03 | Male, fits tubing with I.D. 3 mm (L/S 16) |
| Magnetic stirring bar | Generic | ||
| Masterflex L/S Digital Precision Modular Drive with Remote I/O and Benchtop Controller | Cole-Parmer | 07557-00 | |
| Masterflex L/S Precision Pump Tubing, PharMed BPT, L/S 16 | Cole-Parmer | 06508-16 | |
| Masterflex L/S Pricision Pump Tubing, Platinum-Cured Silicone, L/S 14 | Cole-Parmer | 96410-14 | |
| Millex-GP Syringe Filter Unit, 0.22 µm, polyethersulfone, 33 mm, gamma sterilized | Millipore | SLGPR33RS | |
| Pyrex 250 mL grass bottle, GL-45 screw cap | Corning | 1395-250 | |
| Silicon Septa for GL45 Open Top PBT Screw Cap | Corning | 1395-455S | |
| Silicone Light Stopper | IMG | 07763-18 | Upper diameter: 87 mm, Lower diameter: 75 mm |
| Sterile syringe, 10 mL, 50 mL | Generic | ||
| MOUSE SURGERY (Isolation of the heart-lung block | Lung transplantation) | |||
| 10-0 Nylon ties | Kono Seisakusho | N/A | |
| 10-0 Silk ties | Kono Seisakusho | N/A | |
| 4-0 Silk ties | Kono Seisakusho | N/A | |
| Arterial clamp, 45 mm curved, grooved | Natsume seisakusyo | C-17-45 | |
| BD Insyte IV Catheter 24GA | BD | 381512 | Or equivalent 24G i.v. catheter |
| Bulldog Vascular Forceps 45mm curved | Natsume seisakusyo | M2 | |
| Butorphanol tartrate | Meiji Seika Pharma | N/A | |
| Cefazolin Sodium | Otsuka Pharmaceutical | N/A | |
| Dumont forceps #5/45 | Fine Science Tools | 1251-35 | |
| Fine vannas style spring scissors | Fine Science Tools | 15403-08 | 45° tip, 0.01 x 0.06 mm |
| Gemini Cautery Kit | Harvard Apparatus | RS-300 | |
| Halsted-Mosquito clamp curved tip, 125 mm | Bioresearch center | 16181670 | |
| Hegar needle holder, 150 mm | B Braun/Aesculap | BM065R | |
| Heparine solution | Mochida Seiyaku | N/A | |
| Medetomidine | Nippon Zenyaku Kogyo | N/A | |
| Micro forceps straight | B Braun/Aesculap | BD33R | |
| Midazolam | Sandoz | N/A | |
| Mouse Ventilator | Harvard Apparatus | Model 687™ | |
| Normal Saline, Clinical grade | Otsuka Pharmaceutical | N/A | |
| Petri dish, 60 x 15 mm | BD | 351007 | |
| Safelet Cath PU 20 gauge polyurethan catheter | Nipro | 09-031 | |
| Sakaki stainless scissors curved 14 cm | Bioresearch center | 64152034 | |
| Scalpel holder | Bioresearch center | 16101040 | |
| Small animal retraction system | Fine Science Tools | 18200-20 | |
| Spare blade scalpel #11 | Muranaka Medical Instruments | 567-001-03 | |
| Spring scissors, 15 cm | Bioresearch center | PRI13-3736 | |
| Stereomicroscope | Leica Microsystems | M525 | Clinical-grade surgical microscope with a flexible arm system is preferable. |
| Sugita titanium aneurysm clip curved slim, No.98 | Mizuho medical | 17-001-98 | |
| Sugita titanium clip applier, 110 mm | Mizuho medical | 17-013-53 | |
| Temperature-adjustable electric warmer | Generic | ||
| Ultrafine cotton swab | Generic | ||
| VASCULAR AND BRONCHIAL CUFF | |||
| Fine sandpaper | Generic | ||
| Venula 20 gauge Teflon angiocatheter | Top | 1160 | |
| Venula 22 gauge Teflon angiocatheter | Top | 1161 | |
| Venula 24 gauge Teflon angiocatheter | Top | 1124 |
Références
- van der Mark, S. C., Hoek, R. A. S., Hellemons, M. E. Developments in lung transplantation over the past decade. Eur Respir Rev. 29 (157), 190132 (2020).
- Valapour, M., et al. OPTN/SRTR 2022 Annual Data Report: Lung. Am J Transplant. 24 (2S1), S394-S456 (2024).
- Hoffman, T. W. Waiting list dynamics and lung transplantation outcomes after introduction of the lung allocation score in the Netherlands. Transplant Direct. 7 (10), e760 (2021).
- Wilk, A. R., Edwards, L. B., Edwards, E. B. The effect of augmenting OPTN data with external death data on calculating patient survival rates after organ transplantation. Transplantation. 101 (4), 836-843 (2017).
- Neizer, H., Singh, G. B., Gupta, S., Singh, S. K. Addressing donor-organ shortages using extended criteria in lung transplantation. Ann Cardiothorac Surg. 9 (1), 49-50 (2020).
- Oliveira, P., Yamanashi, K., Wang, A., Cypel, M. Establishment of an ex vivo lung perfusion rat model for translational insights in lung transplantation. J Vis Exp. (199), e65981 (2023).
- Anand, R. P. Design and testing of a humanized porcine donor for xenotransplantation. Nature. 622 (7982), 393-401 (2023).
- Shakir, S., Hackett, T. L., Mostaco-Guidolin, L. B. Bioengineering lungs: An overview of current methods, requirements, and challenges for constructing scaffolds. Front Bioeng Biotechnol. 10, 1011800 (2022).
- Ott, H. C. Regeneration and orthotopic transplantation of a bioartificial lung. Nat Med. 16 (8), 927-933 (2010).
- Petersen, T. H. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Leiby, K. L. Rational engineering of lung alveolar epithelium. NPJ Regen Med. 8 (1), 22 (2023).
- Kitano, K., et al. Orthotopic transplantation of human bioartificial lung grafts in a porcine model: A feasibility study. Semin Thorac Cardiovasc Surg. 34 (2), 752-759 (2022).
- Ohata, K., Ott, H. C. Human-scale lung regeneration based on decellularized matrix scaffolds as a biologic platform. Surg Today. 50 (7), 633-643 (2020).
- Ren, X. Engineering pulmonary vasculature in decellularized rat and human lungs. Nat Biotech. 33 (10), 1097-1102 (2015).
- Doi, R. Transplantation of bioengineered rat lungs recellularized with endothelial and adipose-derived stromal cells. Sci Rep. 7 (1), 8447 (2017).
- Stone, K. C., Mercer, R. R., Gehr, P., Stockstill, B., Crapo, J. D. Allometric relationships of cell numbers and size in the mammalian lung. Am J Respir Cell Mol Biol. 6 (2), 235-243 (1992).
- Basil, M. C., Morrisey, E. E. Lung regeneration: a tale of mice and men. Semin Cell Dev Biol. 100, 88-100 (2020).
- Hsia, C. C., Hyde, D. M., Weibel, E. R. Lung structure and the intrinsic challenges of gas exchange. Compr Physiol. 6 (2), 827-895 (2016).
- Tomiyama, F., et al. Orthotopic transplantation of the bioengineered lung using a mouse-scale perfusion-based bioreactor and human primary endothelial cells. Sci Rep. 14 (1), 7040 (2024).
- Stoian, A., Adil, A., Biniazan, F., Haykal, S. Two decades of advances and limitations in organ recellularization. Curr Issues Mol Biol. 46 (8), 9179-9214 (2024).
- Crabbe, A. Recellularization of decellularized lung scaffolds is enhanced by dynamic suspension culture. PLoS One. 10 (5), e0126846 (2015).
- Daly, A. B. Initial binding and recellularization of decellularized mouse lung scaffolds with bone marrow-derived mesenchymal stromal cells. Tissue Eng Part A. 18 (1-2), 1-16 (2012).
- . Regulations for Animal Experiments and Related Activities Available from: https://www.clag.med.tohoku.ac.jp/clar/en/ (2024)
- Sokocevic, D., et al. The effect of age and emphysematous and fibrotic injury on the re-cellularization of de-cellularized lungs. Biomaterials. 34 (13), 3256-3269 (2013).
- Ren, X., et al. Ex vivo non-invasive assessment of cell viability and proliferation in bio-engineered whole organ constructs. Biomaterials. 52, 103-112 (2015).
- Watanabe, T. Mesenchymal stem cells attenuate ischemia-reperfusion injury after prolonged cold ischemia in a mouse model of lung transplantation: a preliminary study. Surg Today. 47 (4), 425-431 (2017).
- Watanabe, T., et al. Donor IL-17 receptor A regulates LPS-potentiated acute and chronic murine lung allograft rejection. JCI Insight. 8 (21), e158002 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon