Method Article
Хирургическая поясничная симпатэктомия у мышей
В этой статье
Резюме
В данной рукописи представлен протокол хирургического удаления постганглионарных поясничных симпатических нейронов у мыши. Эта процедура будет способствовать проведению множества исследований, направленных на изучение роли симпатической иннервации в дистальных тканевых мишенях.
Аннотация
Повреждения периферических нервов встречаются часто, а полное функциональное восстановление после травмы достигается только у 10% пациентов. Симпатическая нервная система играет много важных ролей в поддержании гомеостаза организма, но она редко изучается в контексте повреждения периферических нервов. Степень постганглионарных симпатических нейронных функций в дистальных мишенях на периферии в настоящее время неясна. Чтобы лучше изучить роль симпатической иннервации периферических мишеней, хирургическая модель «нокаута» предлагает альтернативный подход. Хотя это может быть достигнуто химическим путем, химическая деструкция постганглионарных симпатических нейронов может быть неспецифической и дозозависимой. Использование хирургической поясничной симпатэктомии у мышей, которое когда-то считалось «практически непрактичным» у мелких животных, позволяет целенаправленно воздействовать на постганглионарные симпатические нейроны, которые иннервируют задние конечности. В данной рукописи описывается, как хирургическое удаление поясничных симпатических ганглиев L2-L5 у мыши в качестве операции по выживанию, которая надежно снижает потовую реакцию задней лапы и количество симпатических аксонов в седалищном нерве.
Введение
Повреждения периферических нервов (ПНИ) могут приводить к двигательному, сенсорному и симпатическому дефициту в дистальных тканевых мишенях, которые редко полностью функционально восстанавливаются1. Исследования PNI часто сосредоточены на моторной и сенсорной регенерации; Тем не менее, почти четверть седалищного нерва крысы состоит из немиелинизированных симпатическихаксонов2. Роль симпатической иннервации в периферических тканях, тем не менее, до конца не изучена3. Симпатическая нервная система играет важную роль в поддержании гомеостаза организма, участвуя в иммунной регуляции, терморегуляции, тонусе сосудов, митохондриальном биогенезе и т.д. 4,5,6,7,8,9,10,11. При утрате симпатической иннервации в нервно-мышечном соединении наблюдается стойкая мышечная слабость и синаптическая нестабильность, несмотря на поддержание иннервации мотонейрона12. Было показано, что эта симпатическая регуляция синаптической передачи в нервно-мышечном соединении снижается с возрастом13,14, что способствует саркопении, определяемой как возрастное снижение мышечной массы, силы и мощности15. Лучшее понимание роли симпатической иннервации периферических тканей необходимо для разработки методов лечения, которые оптимизируют функциональные результаты у пациентов с ПНИ и другими формами симпатической дисфункции.
Симпатэктомия является мощным экспериментальным инструментом, который позволит исследовать роль симпатической иннервации в дистальных тканях-мишенях. В частности, удаление симпатических ганглиев уровня L2-L5 удаляет большую часть симпатической иннервации нижних конечностей, что особенно полезно для исследователей, интересующихся седалищным нервом.
В этом протоколе подробно описывается удаление постганглионарных симпатических нейронов уровня L2-L5 у мыши в качестве операции по выживанию. Эта процедура требует от грызунов микрохирургических навыков и знакомства с анатомией мыши, и при эффективном выполнении не вызывает каких-либо видимых фенотипических различий. Хирургическая поясничная симпатэктомия использовалась в исследованиях на грызунах, в большей степени на крысах, чем на мышах 16,17,18,19,20,21; Однако подробного протокола, описывающего этот протокол, в настоящее время не существует. Предыдущие исследования с использованием поясничной симпатэктомии в первую очередь были сосредоточены на роли симпатической иннервации в болевой реакции, которая, как правило, ослабляется симпатэктомией в различных моделях повреждения нервов. В меньшем количестве исследований этот метод использовался на мышах22, вероятно, из-за меньшего размера анатомических ориентиров, поскольку использование хирургической симпатэктомии считалось «практически непрактичным» у мелких животных23,24. Локализованная симпатэктомия в форме микросимпатэктомии также использовалась в моделях грызунов, также в основном в контексте болевого поведения 25,26,27. Микросимпатэктомия, в отличие от тотальной поясничной симпатэктомии, использует дорсальный доступ, посредством которого сегмент серой ветви к определенному спинномозговому нерву отсоединяется и удаляется, что позволяет проводить очень целенаправленную симпатэктомию, которая позволит избежать более широких побочных эффектов.
Поскольку мышиные модели имеют решающее значение для многих исследований, требующих генетических манипуляций, эта процедура будет иметь универсальное применение и за пределами широты повреждений периферических нервов. Используя трансабдоминальный доступ, поясничные симпатические ганглии могут быть надежно визуализированы и удалены от мыши без видимых побочных эффектов. Несмотря на то, что существуют протоколы химического разрушения постганглионарных симпатических нейронов, такие как использование 6-гидроксидопамина (6-OHDA)23,24, эта хирургическая процедура позволяет анатомически специфично нацеливаться на постганглионарные поясничные симпатические ганглии. Использование хирургической симпатэктомии также позволяет избежать неспецифических и дозозависимых проблем, связанных с фармакологическими методами28,29.
Использование химических симпатэктомий путем введения 6-OHDA было описано в 1967 году как простой способ достижения избирательного разрушения адренергических нервных окончаний, поскольку хирургическая симпатэктомия у мелких животных не была предпочтительной. 6-OHDA представляет собой катехоламинергический нейротоксин, который эндогенно образуется у пациентов с болезнью Паркинсона, а его токсичность обусловлена его способностью образовывать свободные радикалы и ингибировать цепь переноса электронов в митохондриях30,31. Благодаря механизмам транспортировки норадреналина Uptake-1, 6-OHDA способен накапливаться в норадренергических нейронах, таких как постганглионарные симпатические нейроны28. В конце концов, нейрон разрушается 6-OHDA; Тем не менее, терминали в периферической нервной системе регенерируют с восстановлением функциональной активности даже тогда, когда уровень аминов все еще снижен. Различные пороговые дозы также присутствуют для разных органов в ответ на 6-OHDA, и было показано, что более высокие дозы 6-OHDA проявляют более неспецифические эффекты, распространяя его нейротоксические последствия на нейроны, не содержащие катехоламин, и даже на ненейрональные клетки. Помимо норадренергических нейронов, дофаминергические нейроны также поражаются 6-OHDA29, что делает химическую симпатэктомию в конечном итоге менее специфичной для постганглионарных симпатических нейронов, чем хирургическая симпатэктомия.
Таким образом, хирургическая поясничная симпатэктомия позволяет целенаправленно абляционировать симпатическую иннервацию нижних конечностей, что может быть сочетано с различными экспериментальными методами и генетическими манипуляциями на мышах для изучения того, как симпатическая нервная система способствует различным травмам и болезненным состояниям.
протокол
Все эксперименты были одобрены Комитетом по институциональному уходу за животными и их использованию (IACUC) Университета Эмори (в соответствии с протоколом IACUC No PROTO201700371). В этом исследовании были использованы четыре взрослые самки мышей дикого типа C57BL/6J в возрасте 14 недель и весом от 16 до 21 г. Подробная информация об используемых здесь реагентах и оборудовании приведена в Таблице материалов.
1. Предоперационная подготовка
- В автоклаве хирургические инструменты: 1 пара острых ножниц, 2 пинцета с тонким наконечником, 1 игольчатый инструмент.
- Нагрейте грелку до 37 °C и положите ее под операционную столешницу.
- Опрыскайте операционную зону, в том числе индукционную камеру анестезии, дезинфицирующим средством и тщательно протрите ее бумажными полотенцами.
- Убедитесь в надлежащем халате и мытье рук перед тем, как брать мышь в руки.
- Кормите мышь мелоксикамом в концентрации 5 мг/кг массы тела и дайте мышке достаточно времени, чтобы полностью проглотить лекарство, чтобы избежать аспирации во время индукции.
- Индуцируйте мышь под анестезией 3% изофлураном в 1 л/мин кислорода (в соответствии с утвержденными в учреждении протоколами).
- После того, как мышь будет обезболена (не будет реакции на защемление пальца ноги), поместите мышь на хирургическую столешницу, лежа на спине, так, чтобы нос находился в подогнанном носовом конусе.
- После того, как мышь будет правильно установлена в носовом конусе, отрегулируйте дозу изофлурана до 2% для поддержания анестезии.
- Нанесите гель для глаз мыши на глаза, чтобы предотвратить сухой кератоконъюнктивит (сухой глаз).
- Убедитесь, что мышь надежно закреплена хирургической лентой на хирургической столешнице.
- Непрерывный мониторинг для облегчения дыхания и адекватной частоты дыхания.
- Сбрейте шерсть с брюшка мыши от уровня гениталий до ниже ребер.
- После того, как мех будет удален, сначала протрите операционную область круговыми движениями, от центральной к периферической, 70% этанолом. Затем протрите операционную область бетадином теми же круговыми движениями. Повторите шаги с этанолом и бетадином в общей сложности 3 раза.
- Накиньте на мышь стерильную хирургическую простыню с отверстием соответствующего размера, вырезанным посередине, чтобы визуализировать операционное поле. Ромбовидную форму можно приобрести, сложив драпировку пополам и вырезав равнобедренный треугольник высотой ~10 мм и основанием ~15 мм.
2. Разрезы
- С помощью острых ножниц и пинцета с тонким концом сделайте разрез по средней линии от ~1 мм над уровнем лобкового симфиза до ~2 мм ниже ребер.
- Определите срединную фасцию (linea alba) между двусторонними прямыми мышцами живота. С помощью пинцета поднимите мышцы живота в сторону от подлежащих органов и разрежьте по белой линии для входа в брюшную полость.
ПРИМЕЧАНИЕ: Белая линия может быть идентифицирована путем осторожного вытягивания двусторонних прямых мышц живота в сторону, чтобы обнажить более тонкую линию фасции, которая проходит в продольном направлении вдоль средней линии32. Выполнение разреза через белую линию позволяет легче закрыть мышцу. - Втяните мышцы живота и кожу с помощью швов 5-0 сбоку, чтобы правильно визуализировать следующие шаги.
3. Идентификация поясничных симпатических ганглиев L2-L5
- Поясничные симпатические ганглии лежат позади брюшной аорты и нижней полой вены. Чтобы визуализировать аорту, частично удаляют кишечник из брюшной полости.
ПРИМЕЧАНИЕ: Симпатические ганглии уровня L2-L5 проходят от уровня бифуркации аорты в подвздошные сосуды до уровня левой почечной артерии21,33.- Положите стерильный ватный квадрат, пропитанный стерильным физиологическим раствором, на простыню, лежа сверху и слева от разреза. Осторожно, с помощью 2 стерильных аппликаторов с ватным наконечником, частично вытолкните толстую кишку и тонкую кишку на пропитанный солевым раствором ватный квадрат.
ПРИМЕЧАНИЕ: Убедитесь, что слепая кишка и аппендикс находятся вне брюшной полости и что можно визуализировать нисходящую ободочную кишку. - Накройте оголенные кишки другим ватным квадратом, пропитанным солевым раствором.
- Периодически контролируйте перистальтику на протяжении всей операции, которую можно определить по ритмичному движению кишечника.
- Положите стерильный ватный квадрат, пропитанный стерильным физиологическим раствором, на простыню, лежа сверху и слева от разреза. Осторожно, с помощью 2 стерильных аппликаторов с ватным наконечником, частично вытолкните толстую кишку и тонкую кишку на пропитанный солевым раствором ватный квадрат.
- Определите нисходящую ободочную кишку, которая представляет собой часть кишечника, которая движется к прямой кишке и анусу и может содержать видимые фекальные массы, и отклоните эту структуру влево с помощью закрытого пинцета, чтобы открыть брюшную аорту и нижнюю полую вену. Эти два сосуда связаны соединительной тканью и должны двигаться как единое целое.
- С помощью пинцета поднимите сосуды брюшной полости за окружающую их соединительную ткань. Пока он приподнимается, осторожно наложите нейлоновый шов 5-0 через соединительную ткань.
ВНИМАНИЕ: НЕ прокалывайте иглой сосуды брюшной полости: это приведет к быстрой декомпенсации мыши и вероятной смерти. - После того, как шов был введен через соединительную ткань, отклоните сосуды брюшной полости влево. Это даст треугольное окно, позволяющее напрямую визуализировать двусторонние поясничные мышцы.
Примечание: Из-за тесной связи ганглиев с сосудами брюшной полости, симпатические ганглии, хотя обычно расположены по средней линии, будут немного отклоняться влево (справа от мыши) вместе с сосудами. После того, как сосуды брюшной полости отклоняются, следует визуализировать треугольник, две стороны которого слева состоят из отклоненных сосудов брюшной полости, а правая сторона определяется средней линией мыши (между двусторонними поясничными мышцами). Симпатические ганглии лежат в центре этого треугольника (рис. 1А). Они движутся вертикально бок о бок и кажутся полупрозрачными. Они могут перекрывать небольшой сосуд, который погружается в среднюю линию мыши и ложится на правую поясничную мышцу. Используйте пинцет, чтобы тупо рассечь любую вышележащую фасцию, чтобы выявить ганглии (Рисунок 1B).
- С помощью пинцета поднимите сосуды брюшной полости за окружающую их соединительную ткань. Пока он приподнимается, осторожно наложите нейлоновый шов 5-0 через соединительную ткань.
- Определите левую почечную артерию и левую тестикулярную или яичниковую артерию.
Примечание: Это крупные сосуды, которые образуют четырехугольник, стороны которого состоят из левой почечной артерии сверху, средней линии животного и брюшной аорты/нижней полой вены латерально, и левой тестикулярной или яичниковой артерии внизу. Ганглии уровня L2 большие и лежат в пределах этого четырехугольника (рис. 1А). Тщательно затупите рассечение, чтобы войти в этот четырехугольник пинцетом и определить двусторонние ганглии L2 (рисунок 1B). - После того, как нижняя и верхняя части ганглиев будут определены, возьмите пинцетом нижнюю часть видимых двусторонних ганглиев и потяните вверх. Визуализацию более низко расположенных ганглиев типа L4 и L5 можно увеличить, мягко надавливая второй парой пинцета на любые органы, закрывающие обзор снизу.
ПРИМЕЧАНИЕ: Визуализация перфорирующего сосуда по срединной линии, упомянутого в шаге 3.2.2, обеспечит более полную поясничную симпатэктомию. Держа вторую пару пинцетов в другой руке, оттяните фасцию и нейронные связи, удерживающие ганглии в брюшной полости, в сторону, одновременно подтягивая сами ганглии первой парой пинцетов. Только одна пара пинцетов должна удерживать ганглии, в то время как другая очищает фасцию и нейронные связи. Оказавшись на уровне левого яичка или яичниковой артерии, может быть полезно для идентификации L2, если ганглии нижней цепи все еще не повреждены, так как ганглии L2 будут двигаться при втягивании нижней цепью. Ганглии L3-5 могут быть разорваны в тестикулярной или яичниковой артерии перед извлечением ганглиев L2 из четырехугольника с помощью пинцета. Единственными ганглиями, присутствующими в четырехугольнике, являются ганглии L2. - Эта процедура должна иметь минимальную кровопотерю. При возникновении кровотечения обеспечьте адекватный гемостаз перед закрытием.
4. Застежка на коже
- После того как будет достигнут адекватный гемостаз, снимают шов, удерживающий сосуды брюшной полости на месте.
- С помощью 2 стерильных аппликаторов с ватным наконечником аккуратно замените отведенный кишечник в брюшную полость.
- С помощью рассасывающегося шва 5-0 выполните бегущий шов, чтобы приблизить мышцы живота.
- С помощью нейлонового шва 5-0 используйте простые прерывистые стежки, чтобы закрыть кожу.
- Нанесите обильный слой мази с антибиотиком, например, Неоспорином, на место разреза.
- Поместите мышь в чистую клетку на грелку.
- Наблюдайте за мышью каждые 15 минут, пока она не придет в себя и не начнет передвигаться. Обычно это занимает менее 30 минут.
5. Пилокарпиновый анализ на пот
ПРИМЕЧАНИЕ: Для оценки истощения симпатической функциональной активности после поясничной симпатэктомии через 7 дней после поясничной симпатэктомии был проведен анализ пилокарпинового пота.
- Приготовьте 1% раствор пилокарпина гидрохлорида в 0,9% NaCl вместе со смесью 10% картофельного крахмала в касторовом масле.
- С помощью кисти покройте подошвенную поверхность стопы бетадином. Дайте этому слою полностью высохнуть.
- Как только слой бетадина высохнет, с помощью отдельной кисти нанесите слой 10% крахмала в касторовом масле.
- Введите 0,25 мкл/г массы тела 1% пилокарпина подкожно с помощью шприца в дряблую кожу над шеей. Запустите таймер сразу после введения пилокарпина.
- Через 8 минут после инъекции сделайте фотографии подошвенной поверхности стопы.
- Используя Фиджи, подсчитайте количество темных пятен, расположенных на всех шести (6) подушечках ног (Рисунок 2A).
6. Иммуногистохимия
Примечание: Для оценки дегенерации симпатических аксонов в периферических нервах после поясничной симпатэктомии двусторонние седалищные нервы были собраны на 21-е сутки после операции.
- Обезболите мышей (следуя шагу 1 протокола), извлеките двусторонние седалищные нервы, а затем немедленно усыпьте животное (в соответствии с институционально утвержденными протоколами).
- Поместите седалищные нервы непосредственно в 4% параформальдегид в 0,01 М фосфатно-солевом буфере (PBS) на 20 минут, затем перенесите их в 20% сахарозу в 0,1 М PBS для ночной криозащиты при 4 °C.
- Рассекайте седалищные нервы в продольном направлении с помощью криостата с температурой 20 мкм и размещайте срезы на заряженных предметных стеклах.
- Блокируйте нервные отделы 10% нормальной козьей сывороткой (NGS) в трис-буферном физрастворе с 1% Tween 20 (TBST) в течение 1 ч при комнатной температуре.
- Удалите блокирующий буфер и замените его первичными антителами кроличьей антитирозингидроксилазой и куриными антинейрофиламентами, разведенными в блокирующем буфере (10% NGS в TBST) в соотношении 1:750 и 1:1000 соответственно. Дайте первичным антителам инкубироваться в течение ночи в камере влажности при комнатной температуре.
- Промойте предметное стекло TBST 3 раза, по 10 мин каждое мытье, прежде чем применять вторичные антитела козий анти-кролик 647 и козий анти-куриный 488, разведенные в соотношении 1:200 в блокирующем буфере. Дайте вторичным антителам инкубироваться в камере влажности в течение 2 ч при комнатной температуре.
- Вымойте предметное стекло TBST 4 раза, по 10 минут каждое мытье, и дайте предметному стеклу высохнуть в защищенном от света месте перед установкой.
- Получите изображение срезов нервов на расстоянии не менее 40 мкм друг от друга на флуоресцентном микроскопе с 10-кратным объективом.
- На Фиджи выпрямите нервные участки и нарисуйте три случайно расположенные вертикальные линии, охватывающие ширину участка. Посчитайте количество аксонов, пересекающих каждую вертикальную линию, и разделите его на ширину участка по вертикальной линии. Повторите для каждой из трех вертикальных линий на секции. Усредните три значения, полученные для каждого отдела, и далее усредните значения трех участков для каждого нерва.
Результаты
Этот протокол описывает хирургическое удаление постганглионарных поясничных симпатических нейронов у мыши. Две мыши получили поясничную симпатэктомию, а две мыши служили контрольной группой. Для достижения успешной хирургической поясничной симпатэктомии должна быть достигнута адекватная визуализация, по крайней мере, L2 и L3 двусторонних поясничных симпатических ганглий, как показано на рисунке 1. Удаление ганглиев L4 и L5 приведет к полной симпатической денервации нижней части тела; Однако визуализация нижних ганглиев может быть затруднена мочеполовыми органами. Предыдущие исследования ретроградной трассировки показали, что большинство нейронов в ганглиях L2-L5 расположены в ганглиях L2 и L3. Несмотря на то, что для получения репрезентативных результатов использовались только самки мышей соответствующего возраста, эта хирургическая процедура была воспроизведена много раз как у самцов, так и у самок мышей, при этом не наблюдалось существенных анатомических различий с точки зрения расположения яичковой или яичниковой артерии и симпатических ганглий.
После удаления ганглиев реакция потливости в ответ на пилокарпин быстро снижается, со значительными различиями, наблюдаемыми к 7-му дню после операции (Рисунок 2). 7-й день после операции был выбран в связи с экспоненциальным снижением симпатически опосредованной потоотделения в течение 7 дней после различных повреждений седалищного нерва у34 крыс. Поскольку дегенерация аксонов может занять до 14 дней, а также из-за потенциальных трудностей с визуализацией ганглиев L4 и L5 во время операции (мочевой пузырь и половые органы могут препятствовать обзору), реакция на потливость может быть не полностью абляирована35,36.
Плотность тирозингидроксилаза-положительных (TH+) аксонов была значительно снижена к 21-му дню после операции без изменения плотности тяжелой цепи нейрофиламентов (NF-H) (рис. 3). Маловероятно, что TH+ аксоны будут полностью истощены из-за наличия сенсорных аксонов TH+, иннервирующих низкопороговые механорецепторы, и потенциальных трудностей с визуализацией полной поясничной симпатической цепи37.
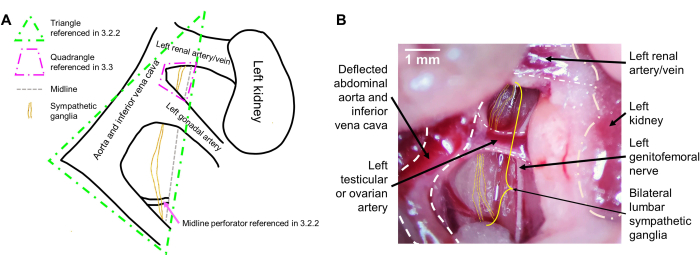
Рисунок 1: Интраоперационный вид поясничных симпатических ганглий. (A) Схема с ожидаемыми ориентирами. (Б) Репрезентативное интраоперационное изображение с маркированными ориентирами. Поясничные симпатические ганглии расположены позади нисходящей брюшной аорты и нижней полой вены (отклоняются). Ганглии оттягиваются вправо мыши за счет отклонения брюшных сосудов и располагаются на правой поясничной мышце, проходя снизу и вверху. Двусторонние L2-ганглии могут быть визуализированы между левой почечной артерией и левой тестикулярной или яичниковой артерией, а L3-ганглии видны ниже левого яичка или яичниковой артерии. Масштабная линейка: 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.

Рисунок 2: Хирургическая поясничная симпатэктомия уменьшает количество пятен потливости на задней лапе. (A) Схема расположения подушечек лап на подошвенной поверхности задней лапы мыши. (B) Репрезентативное изображение реакции на потливость через 8 минут после инъекции пилокарпина у интактного животного. (В') Увеличенное изображение с белыми стрелками, обозначающими выбранное количество пятен потоотделения. (C) Репрезентативное изображение реакции на потливость через 8 минут после инъекции пилокарпина у симпатэктомированного животного на 7-й день после операции. (С') Увеличенное изображение с белыми стрелками, обозначающими выбранное количество пятен потоотделения. (D) Общее количество пятен потливости на всех шести подушечках задней лапы у неповрежденных и симпатэктомированных мышей. Данные отображаются линией, представляющей медиану. Тест Манна-Уитни. *p < 0.05. Масштабные линейки: 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.

Рисунок 3: Хирургическая поясничная симпатэктомия (Sympx) уменьшает количество симпатических аксонов в седалищном нерве. (A) Тирозингидроксилаза (TH)-положительные аксоны на мкм седалищного нерва (ширина нерва) на 21-й день после операции. Репрезентативные участки нерва окрашивания ТГ у интактной (В) и симпатэктомированной (В') мыши. (C) Нейрофиламент-тяжелая цепь (NF-H)-положительные аксоны на мкм седалищного нерва. Репрезентативный нервный срез окрашивания NF-H у интактной (D) и симпатэктомированной (D') мыши. Пурпурные пунктирные линии представляют собой возможные случайно расположенные вертикальные линии, которые охватывают ширину участка нерва, используемого для вычисления плотности аксонов в нерве. Пурпурные стрелки указывают на выбранное количество аксонов, которые пересекают случайно расположенные вертикальные линии. Данные отображаются в виде среднего ± SEM. Непарный t-критерий. **p < 0,01. Масштабные линейки: 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Поясничные симпатические ганглии – это очень мелкие структуры, расположенные позади многих критически важных органов брюшной полости и крупных сосудов. Поэтому данная процедура требует значительной точности и аккуратности. Большая часть трудностей заключается в интраоперационной идентификации симпатических ганглий. Предлагается, чтобы обучаемый сначала смог идентифицировать ганглии в трупе мыши, прежде чем пытаться выполнить эту процедуру на живой мыши. Устранение неполадок часто необходимо при выявлении симпатических ганглиев после отведения кишечника. Чтобы обеспечить адекватную визуализацию, нисходящая ободочная кишка должна быть видна. Кишечный отвод за пределы брюшной полости должен включать слепую кишку. Кроме того, мочевой пузырь может быть полным и увеличенным, что может препятствовать обзору нисходящей ободочной кишки и, впоследствии, нисходящей брюшной аорты и нижней полой вены. В идеале мочевой пузырь сцеживается вручную, как только мышь находится под наркозом, прежде чем делать первоначальный разрез кожи. Однако, если мочевой пузырь не сцеживается и интраоперационный обзор заблокирован, возможно мягкое сцеживание с помощью 2 стерильных аппликаторов с ватным наконечником. Следите за тем, чтобы не повредить мочеточники, которые прикрепляются к задней части мочевого пузыря. После того, как брюшная аорта и нижняя полая вена идентифицированы позади нисходящей ободочной кишки, адекватное отклонение и стабилизация сосудов имеют решающее значение для визуализации симпатических ганглий. Фасция относительно жесткая, и если шов накладывается исключительно через слой фасций и нейронных соединений, а не через стенки сосудов, сосуды должны быть оттянуты не менее чем на 1 мм от средней линии. Фасцию, расположенную над симпатическими ганглиями, можно аккуратно рассечь с помощью пинцета. Если во время процедуры лопнет небольшой сосуд, надавите стерильным аппликатором с ватным наконечником не менее чем на 10 с, чтобы обеспечить достаточный гемостаз перед закрытием. Если во время операции были проколоты крупные сосуды брюшной полости, мышь следует быстро усыпить.
Несмотря на то, что этот метод позволяет осуществлять прямую визуализацию и удаление симпатических ганглий, тем самым обеспечивая более специфическое нацеливание на эти постганглионарные симпатические нейроны по сравнению с химическими симпатэктомиями23, существуют некоторые ограничения. Результатом этой операции является удаление поясничных симпатических ганглиев L2-L5; однако из-за обструкции зрения, вызванной жизненно важными мочеполовыми органами, нижние ганглии, такие как ганглии уровня L4-L5, труднее визуализировать и удалить во время этой процедуры. Большинство нейронов, иннервирующих нижние конечности, расположены в больших L2-ганглиях. Ганглии L5 чрезвычайно малы и содержат меньше нейронов, как видно в предыдущих экспериментах по флуоресцентной ретроградной трассировке38; Тем не менее, неспособность удалить эти нейроны может исказить анализ результатов из наиболее дистальных структур, таких как стопы. Чтобы обеспечить лучшие результаты при изучении дистальных мишеней в стопах, было бы целесообразно проверить извлеченную ткань для подсчета количества удаленных ганглий. Это можно сделать с помощью флуоресцентной мыши-репортера, у которой можно легко визуализировать постганглионарные симпатические нейроны, или с помощью флуоресцентного ретроградного индикатора, введенного в дистальную мишень перед операцией. Некоторые флуоресцентные репортерные мыши для этой цели включают ThCre:mTmG (см. Таблицу материалов), которая имеет крайне разреженную маркировку тирозингидроксилаза-положительных нейронов39, Phox2bCre:tdTomato (см. Таблицу материалов), которая имеет умеренную маркировку постганглионарных симпатических нейронов40,41, и ThCre:tdTomato (см. Таблицу материалов), который имеет обширную маркировку постганглионарных симпатических нейронов42. Это далеко не полный список доступных линий.
Кроме того, из-за большого разреза, необходимого для этой хирургической процедуры, мышам может потребоваться более длительный период восстановления, прежде чем можно будет проводить дальнейшие эксперименты. Мыши должны находиться под наблюдением не менее 3 дней для правильной дефекации, мочеиспускания и кормления. Кроме того, неправильный гемостаз может привести к неустраненному внутрибрюшному кровотечению, что может привести к летальному исходу у мышей в неожиданные моменты времени. Таким образом, обеспечение гемостаза до хирургического закрытия имеет решающее значение для успеха будущих экспериментов. Симпатические нейроны также могут быть подвергнуты химическому воздействию, как указанов пункте 24.
Использование хирургических симпатэктомий позволит провести множество исследований, направленных на изучение роли постганглионарной симпатической иннервации в дистальных мишенях, таких как роль симпатической иннервации в нервно-мышечном соединении12. Кроме того, методы флуоресцентной ретроградной трассировки могут быть использованы для количественной оценки симпатической реиннервации дистальных тканей, поскольку этот протокол может быть адаптирован для извлечения ганглиев en bloc у мышей с фиксированным параформальдегидом38. В контексте повреждений периферических нервов эта хирургическая модель «нокаута» позволит лучше охарактеризовать ожидаемое симпатическое функциональное восстановление в ранее иннервированных тканях.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Эта работа была поддержана Национальным институтом неврологических расстройств и инсульта NIH под номером K01NS124912 и частично грантом на развитие от финансируемого NIH Специализированного центра передового опыта исследований в области половых различий U54AG062334 и Программой подготовки ученых-медиков Медицинской школы Университета Эмори. Благодарим Дэвида Кима, постбакалавра, за рассечение седалищных нервов и ХаоМин СиМа, специалиста по исследованиям, за 3D-печать крепления для телефона для нашего стереомикроскопа, которое позволило снять видео.
Материалы
| Name | Company | Catalog Number | Comments |
| 5-0 absorable suture | CP Medical | 421A | |
| 5-0 nylon suture | Med-Vet International | MV-661 | |
| 70% ethanol | Sigma-Aldrich | E7023-4L | |
| Anesthesia Induction Chamber | Kent Scientific VetFlo | VetFlo-0530XS | |
| Anesthesia Vaporizer | Kent Scientific VetFlo | 13-005-202 | |
| Betadine | HealthyPets | BET16OZ | |
| C57BL/6J mice | Jackson Laboratory | #000664 | |
| Chicken anti-neurofilament-heavy | Abcam | ab72996 | |
| Cryostat | Leica | CM1850 | |
| Data Analysis Software | Prism | ||
| Fine-tipped tweezers | World Precision Instruments | 500233 | |
| Fluorescent microscope | Nikon | Ti-E | |
| Goat anti-chicken 488 | Invitrogen | A32931 | |
| Goat anti-rabbit 647 | Invitrogen | A21245 | |
| Heating pad | Braintree Scientific | 39DP | |
| Image Analysis Software | Fiji | ||
| Imaging Software | Nikon | NIS-Elements | |
| Isoflurane | Med-Vet International | RXISO-250 | |
| Meloxicam | Med-Vet International | RXMELOXIDYL32 | |
| Needle driver | Roboz Surgical Store | RS-7894 | |
| Normal Goat Serum | Abcam | ab7481 | |
| Ophthalmic ointment | Refresh | Refresh P.M. | |
| Phox2bCre:tdTomato mutant mice | Jackson Laboratory | #016223, #007914 | |
| Pilocarpine hydrochloride | Sigma-Aldrich | P6503 | |
| Rabbit anti-tyrosine hydroxylase | Abcam | ab112 | |
| Small straight scissors | Fine Science Tools | 14084-09 | |
| Sterile cotton swabs 2x2 | Dynarex | 3252 | |
| Sterile cotton tipped applicators | Dynarex | 4301 | |
| Sterile drape | Med-Vet International | DR4042 | |
| Sterile saline solution | Med-Vet International | 1070988-BX | |
| ThCre:mTmG mutant mice | Mutant Mouse Resource and Research Centers | strain #017262-UCD | Jackson Laboratory, strain #007576 |
| ThCre:tdTomato mutant mice | European Mouse Mutant Archive | strain #00254 | Jackson Laboratory, strain #007914 |
Ссылки
- Scholz, T., et al. Peripheral nerve injuries: An international survey of current treatments and future perspectives. J Reconstr Microsurg. 25 (06), 339-344 (2009).
- Schmalbruch, H. Fiber composition of the rat sciatic nerve. Anat Rec. 215 (1), 71-81 (1986).
- Tian, T., Moore, A. M., Ghareeb, P. A., Boulis, N. M., Ward, P. J. A perspective on electrical stimulation and sympathetic regeneration in peripheral nerve injuries. Neurotrauma Rep. 5 (1), 172-180 (2024).
- Gagnon, D., Crandall, C. G. Sweating as a heat loss thermoeffector. Hand Clin Neurol. 156, 211-232 (2018).
- Grassi, G. Role of the sympathetic nervous system in human hypertension. J Hypertens. 16 (12), 1979-1987 (1998).
- Dibona, G. F. Sympathetic nervous system and the kidney in hypertension. Curr Opin Nephrol Hypertens. 11 (2), 197-200 (2002).
- Elenkov, I. J., Wilder, R. L., Chrousos, G. P., Vizi, E. S. The sympathetic nerve-An integrative interface between two supersystems: The brain and the immune system. Pharmacol Rev. 52 (4), 595-638 (2000).
- Besedovsky, H. O., Del Rey, A., Sorkin, E., Da Prada, M., Keller, H. Immunoregulation mediated by the sympathetic nervous system. Cell Immunol. 48 (2), 346-355 (1979).
- Straka, T., et al. Postnatal development and distribution of sympathetic innervation in mouse skeletal muscle. Int J Mol Sci. 19 (7), 1935 (2018).
- Geng, T., et al. Pgc-1α plays a functional role in exercise-induced mitochondrial biogenesis and angiogenesis but not fiber-type transformation in mouse skeletal muscle. Am J Physiol Cell Physiol. 298 (3), C572-C579 (2010).
- Lin, J., Handschin, C., Spiegelman, B. M. Metabolic control through the pgc-1 family of transcription coactivators. Cell Metab. 1 (6), 361-370 (2005).
- Khan, M. M., et al. Sympathetic innervation controls homeostasis of neuromuscular junctions in health and disease. Proc Natl Acad Sci. 113 (3), 746-750 (2016).
- Delbono, O., Rodrigues, A. C. Z., Bonilla, H. J., Messi, M. L. The emerging role of the sympathetic nervous system in skeletal muscle motor innervation and sarcopenia. Ageing Res Rev. 67, 101305 (2021).
- Rodrigues, A. C. Z., et al. Heart and neural crest derivative 2-induced preservation of sympathetic neurons attenuates sarcopenia with aging. J Cachexia Sarcopenia Muscle. 12 (1), 91-108 (2021).
- Rosenberg, I. H. Summary comments. Am J Clin Nutr. 50 (5), 1231-1233 (1989).
- Murata, Y., Olmarker, K., Takahashi, I., Takahashi, K., Rydevik, B. Effects of lumbar sympathectomy on pain behavioral changes caused by nucleus pulposus-induced spinal nerve damage in rats. Eur Spine J. 15, 634-640 (2006).
- Xie, J., Park, S. K., Chung, K., Chung, J. M. The effect of lumbar sympathectomy in the spinal nerve ligation model of neuropathic pain. J Pain. 2 (5), 270-278 (2001).
- Lee, D. H., Katner, J., Iyengar, S., Lodge, D. The effect of lumbar sympathectomy on increased tactile sensitivity in spinal nerve ligated rats. Neurosci Lett. 298 (2), 99-102 (2001).
- Ringkamp, M., et al. Lumbar sympathectomy failed to reverse mechanical allodynia-and hyperalgesia-like behavior in rats with l5 spinal nerve injury. Pain. 79 (2-3), 143-153 (1999).
- Zhao, C., et al. Lumbar sympathectomy attenuates cold allodynia but not mechanical allodynia and hyperalgesia in rats with spared nerve injury. J Pain. 8 (12), 931-937 (2007).
- Zheng, Z. -. F., et al. Recovery of sympathetic nerve function after lumbar sympathectomy is slower in the hind limbs than in the torso. Neural Regen Res. 12 (7), 1177 (2017).
- Holmberg, K., Shi, T. -. J. S., Albers, K. M., Davis, B. M., Hökfelt, T. Effect of peripheral nerve lesion and lumbar sympathectomy on peptide regulation in dorsal root ganglia in the ngf-overexpressing mouse. Exp Neurol. 167 (2), 290-303 (2001).
- Thoenen, H., Tranzer, J. Chemical sympathectomy by selective destruction of adrenergic nerve endings with 6-hydroxydopamine. Naunyn Schmiedebergs Arch. Exp. Pathol. Pharmakol. 261, 271-288 (1968).
- Thoenen, H., Tranzer, J. P., Häusler, G. . Chemical sympathectomy with 6-hydroxydopamine. New Aspects of Storage and Release Mechanisms of Catecholamines. , 130-143 (1970).
- Xie, W., et al. Localized sympathectomy reduces mechanical hypersensitivity by restoring normal immune homeostasis in rat models of inflammatory pain. J Neuroscience. 36 (33), 8712-8725 (2016).
- Zhu, X., Xie, W., Zhang, J., Strong, J. A., Zhang, J. -. M. Sympathectomy decreases pain behaviors and nerve regeneration by downregulating monocyte chemokine ccl2 in dorsal root ganglia in the rat tibial nerve crush model. Pain. 163 (1), e106-e120 (2022).
- Tonello, R., et al. Local sympathectomy promotes anti-inflammatory responses and relief of paclitaxel-induced mechanical and cold allodynia in mice. Anesthesiology. 132 (6), 1540-1553 (2020).
- Kostrzewa, R. M., Jacobowitz, D. M. Pharmacological actions of 6-hydroxydopamine. Pharmacol Rev. 26 (3), 199-288 (1974).
- Michel, P., Hefti, F. Toxicity of 6-hydroxydopamine and dopamine for dopaminergic neurons in culture. J Neuroscience Res. 26 (4), 428-435 (1990).
- Andrew, R., et al. The determination of hydroxydopamines and other trace amines in the urine of parkinsonian patients and normal controls. Neurochemical Res. 18, 1175-1177 (1993).
- Glinka, Y., Gassen, M., Youdim, M. Mechanism of 6-hydroxydopamine neurotoxicity. J Neural Transm Suppl. 5, 55-66 (1997).
- Treuting, P. M., Dintzis, S. M., Montine, K. S. . Comparative anatomy and histology: A mouse, rat, and human atlas. , 119 (2017).
- Hweidi, S. A., Lee, S., Wolf, P. Effect of sympathectomy on microvascular anastomosis in the rat. Microsurgery. 6 (2), 9-96 (1985).
- Navarro, X., Kennedy, W. R. Sweat gland reinnervation by sudomotor regeneration after different types of lesions and graft repairs. Exp Neurol. 104 (3), 229-234 (1989).
- Gaudet, A. D., Popovich, P. G., Ramer, M. S. Wallerian degeneration: Gaining perspective on inflammatory events after peripheral nerve injury. J Neuroinflammation. 8 (1), 1-13 (2011).
- Babetto, E., et al. Targeting nmnat1 to axons and synapses transforms its neuroprotective potency in vivo. J Neuroscience. 30 (40), 13291-13304 (2010).
- Brumovsky, P. R. Dorsal root ganglion neurons and tyrosine hydroxylase-an intriguing association with implications for sensation and pain. Pain. 157 (2), 314 (2016).
- Tian, T., Harris, A., Owyoung, J., Sima, H., Ward, P. J. Conditioning electrical stimulation fails to enhance sympathetic axon regeneration. bioRxiv. , (2023).
- Tian, T., Ward, P. J. The ThCre: Mtmg mouse has sparse expression in the sympathetic nervous system. bioRxiv. , 2023 (2023).
- Ohman-Gault, L., Huang, T., Krimm, R. The transcription factor Phox2b distinguishes between oral and non-oral sensory neurons in the geniculate ganglion. J Comparative Neurol. 525 (18), 3935-3950 (2017).
- Pattyn, A., Morin, X., Cremer, H., Goridis, C., Brunet, J. -. F. The homeobox gene phox2b is essential for the development of autonomic neural crest derivatives. Nature. 399 (6734), 366-370 (1999).
- François, M., et al. Sympathetic innervation of the interscapular brown adipose tissue in mouse. Ann N Y Acad Sci. 1454 (1), 3-13 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены