Method Article
Sympathectomie lombaire chirurgicale chez la souris
Dans cet article
Résumé
Ce manuscrit présente un protocole pour l’ablation chirurgicale des neurones sympathiques lombaires postganglionnaires d’une souris. Cette procédure facilitera une multitude d’études visant à étudier le rôle de l’innervation sympathique dans les cibles du tissu distal.
Résumé
Les lésions des nerfs périphériques sont fréquentes, et la récupération fonctionnelle complète après une blessure n’est obtenue que chez 10% des patients. Le système nerveux sympathique joue de nombreux rôles essentiels dans le maintien de l’homéostasie corporelle, mais il a rarement été étudié dans le contexte des lésions nerveuses périphériques. L’étendue des fonctions neuronales sympathiques postganglionnaires chez les cibles distales de la périphérie n’est actuellement pas claire. Pour mieux explorer le rôle de l’innervation sympathique des cibles périphériques, un modèle chirurgical « knock-out » propose une approche alternative. Bien que cela puisse être réalisé chimiquement, la destruction chimique des neurones sympathiques postganglionnaires peut être non spécifique et dépendante de la dose. L’utilisation d’une sympathectomie lombaire chirurgicale chez la souris, que l’on pensait autrefois « pratiquement impraticable » chez les petits animaux, permet de cibler spécifiquement les neurones sympathiques postganglionnaires qui innervent les membres postérieurs. Ce manuscrit décrit comment enlever chirurgicalement les ganglions sympathiques lombaires L2-L5 d’une souris dans le cadre d’une chirurgie de survie, ce qui diminue de manière fiable la réponse sudoripare-transpiration de la patte arrière et le nombre d’axones sympathiques dans le nerf sciatique.
Introduction
Les lésions des nerfs périphériques (PNI) peuvent entraîner des déficits moteurs, sensoriels et sympathiques dans les cibles du tissu distalqui se rétablissent rarement complètement 1. La recherche PNI s’est souvent concentrée sur la régénération motrice et sensorielle ; Cependant, près d’un quart du nerf sciatique du rat est constitué d’axones sympathiques2 non myélinisés. Le rôle de l’innervation sympathique dans les tissus périphériques n’est cependant pas entièrement compris3. Le système nerveux sympathique joue un rôle majeur dans le maintien de l’homéostasie corporelle, participant à la régulation immunitaire, à la thermorégulation, au tonus vasculaire, à la biogenèse mitochondriale, etc. 4,5,6,7,8,9,10,11 . Lorsque l’innervation sympathique à la jonction neuromusculaire est perdue, une faiblesse musculaire persistante et une instabilité synaptique sont observées malgré le maintien de l’innervation des motoneurones12. Il a été démontré que cette régulation sympathique de la transmission synaptique à la jonction neuromusculaire diminue avec l’âge13,14, ce qui contribue à la sarcopénie, définie comme la réduction de la masse musculaire, de la force et de la puissance en fonction de l’âge15. Une meilleure compréhension du rôle de l’innervation sympathique des tissus périphériques est nécessaire pour le développement de thérapies qui optimiseront les résultats fonctionnels pour les patients atteints de PNI et d’autres formes de dysfonction sympathique.
La sympathectomie est un outil expérimental puissant qui permettra d’étudier le rôle de l’innervation sympathique dans les tissus cibles distaux. Plus précisément, l’ablation des ganglions sympathiques de niveau L2-L5 supprime la majorité de l’innervation sympathique des membres inférieurs, ce qui est particulièrement utile pour les chercheurs intéressés par le nerf sciatique.
Ce protocole détaille l’ablation des neurones sympathiques postganglionnaires de niveau L2-L5 d’une souris dans le cadre d’une chirurgie de survie. Cette procédure nécessite des compétences microchirurgicales chez les rongeurs et une familiarité avec l’anatomie de la souris, et lorsqu’elle est effectuée efficacement, elle ne provoque aucune différence phénotypique visible. Une sympathectomie lombaire chirurgicale a été utilisée dans la recherche sur les rongeurs, plus chez les rats que chez les souris 16,17,18,19,20,21 ; Cependant, il n’existe pas actuellement de protocole détaillé décrivant le protocole. Des études antérieures utilisant la sympathectomie lombaire se sont principalement concentrées sur le rôle de l’innervation sympathique dans la réponse à la douleur, qui est généralement atténuée par la sympathectomie dans divers modèles de lésions nerveuses. Moins d’études ont utilisé cette technique chez la souris22, probablement en raison de la taille plus petite des repères anatomiques, car l’utilisation de la sympathectomie chirurgicale était considérée comme « pratiquement impraticable » chez les petits animaux23,24. Des sympathectomies localisées sous forme de microsympathectomies ont également été utilisées dans des modèles de rongeurs, également principalement dans le contexte des comportements douloureux 25,26,27. La microsympathectomie, contrairement à la sympathectomie lombaire totale, utilise une approche dorsale par laquelle un segment de la branche grise d’un nerf spinal spécifique est déconnecté et retiré, ce qui permet une sympathectomie très ciblée qui évitera des effets secondaires plus larges.
Étant donné que les modèles murins sont essentiels pour de nombreuses études nécessitant une manipulation génétique, cette procédure aura des applications polyvalentes au-delà de l’étendue des lésions nerveuses périphériques. En utilisant une approche transabdominale, les ganglions sympathiques lombaires peuvent être visualisés de manière fiable et réséqués de la souris sans effets indésirables apparents. Bien qu’il existe des protocoles pour la destruction chimique des neurones sympathiques postganglionnaires, tels que l’utilisation de la 6-hydroxydopamine (6-OHDA)23,24, cette intervention chirurgicale permet de cibler anatomiquement spécifiquement les ganglions sympathiques lombaires postganglionnaires. L’utilisation d’une sympathectomie chirurgicale permet également d’éviter les problèmes non spécifiques et dose-dépendants liés aux méthodes pharmacologiques28,29.
L’utilisation de sympathectomies chimiques par l’administration de 6-OHDA a été décrite en 1967 comme un moyen simple d’obtenir une destruction sélective des terminaisons nerveuses adrénergiques, car les sympathectomies chirurgicales chez les petits animaux n’étaient pas favorisées23,24. La 6-OHDA est une neurotoxine catécholaminergique qui se forme de manière endogène chez les patients atteints de la maladie de Parkinson, et sa toxicité provient de sa capacité à former des radicaux libres et à inhiber la chaîne de transport d’électrons dans les mitochondries30,31. Grâce aux mécanismes de transport de l’absorption de la noradrénaline 1, la 6-OHDA est capable de s’accumuler dans les neurones noradrénergiques, tels que les neurones sympathiques postganglionnaires28. Finalement, le neurone est détruit par le 6-OHDA ; Cependant, les terminaisons du système nerveux périphérique se régénèrent, avec la restauration de l’activité fonctionnelle même lorsque les niveaux d’amines sont encore réduits. Des seuils de dosage différents sont également présents pour différents organes en réponse au 6-OHDA, et il a été démontré que des doses plus élevées de 6-OHDA présentent des effets plus non spécifiques, étendant ses conséquences neurotoxiques aux neurones non contenant des catécholamines et même aux cellules non neuronales. Outre les neurones noradrénergiques, les neurones dopaminergiques sont également affectés par la 6-OHDA29, ce qui rend la sympathectomie chimique finalement moins spécifique aux neurones sympathiques postganglionnaires que la sympathectomie chirurgicale.
Par conséquent, une sympathectomie lombaire chirurgicale permet l’ablation ciblée de l’innervation sympathique des membres inférieurs, qui peut être combinée avec une variété de techniques expérimentales et de manipulations génétiques chez la souris pour étudier comment le système nerveux sympathique contribue à diverses lésions et états pathologiques.
Protocole
Toutes les expériences ont été approuvées par l’Institutional Animal Care and Use Committee (IACUC) de l’Université Emory (sous le numéro de protocole IACUC PROTO201700371). Quatre souris femelles adultes de type sauvage C57BL/6J, âgées de 14 semaines et pesant entre 16 et 21 g, ont été utilisées dans cette étude. Les détails des réactifs et de l’équipement utilisés ici sont répertoriés dans la table des matériaux.
1. Préparation préopératoire
- Autoclavez les outils chirurgicaux : 1 paire de ciseaux tranchants, 2 pinces à épiler à pointe fine, 1 tourne-aiguille.
- Réchauffez un coussin chauffant à 37 °C et placez-le sous la table chirurgicale.
- Vaporisez la zone chirurgicale, y compris la chambre d’induction de l’anesthésie, avec un désinfectant et essuyez-la soigneusement avec des serviettes en papier.
- Assurez-vous de bien porter votre blouse et de vous laver les mains avant de manipuler la souris.
- Nourrissez la souris avec du méloxicam à 5 mg/kg de poids corporel et laissez-lui suffisamment de temps pour avaler complètement le médicament afin d’éviter l’aspiration pendant l’induction.
- Induire la souris sous anesthésie avec 3 % d’isoflurane dans 1 L/min d’oxygène (selon les protocoles approuvés par l’établissement).
- Une fois que la souris est anesthésiée (pas de réaction au pincement des orteils), placez-la sur la table chirurgicale, en décubitus dorsal, le nez dans un cône nasal ajusté.
- Une fois que la souris est correctement ajustée dans le cône nasal, ajustez l’isoflurane à 2% pour le maintien de l’anesthésie.
- Placez du gel pour les yeux sur les yeux de la souris pour prévenir la kératoconjonctivite sèche (sécheresse oculaire).
- Assurez-vous que la souris est correctement fixée avec du ruban chirurgical sur la table d’opération.
- Surveillez en permanence la facilité respiratoire et une fréquence respiratoire adéquate.
- Rasez la fourrure de l’abdomen de la souris du niveau des organes génitaux jusqu’en dessous des côtes.
- Une fois la fourrure retirée, essuyez d’abord la zone chirurgicale dans un mouvement circulaire, du centre vers la périphérie, avec de l’éthanol à 70%. Ensuite, essuyez la zone chirurgicale avec de la bétadine dans le même mouvement circulaire. Répétez les étapes de l’éthanol et de la bétadine 3 fois au total.
- Drapez la souris avec un champ chirurgical stérile avec un trou de taille appropriée découpé au milieu pour visualiser le champ opératoire. La forme rhomboïdale peut être réalisée en pliant le drapé en deux et en découpant un triangle isocèle d’une hauteur de ~10 mm et d’une base de ~15 mm.
2. Les incisions
- À l’aide d’une paire de ciseaux bien aiguisés et d’une pince à épiler à pointe fine, créez une incision médiane de ~1 mm au-dessus du niveau de la symphyse pubienne à ~2 mm sous les côtes.
- Identifiez le fascia médian (linea alba) entre les muscles droits de l’abdomen bilatéraux. À l’aide de la pince à épiler, soulevez les muscles abdominaux loin des organes sous-jacents et coupez le long de la linea alba pour entrer dans la cavité abdominale.
REMARQUE : La linea alba peut être identifiée en tirant doucement les muscles bilatéraux de l’abdomen droit vers le côté pour révéler une ligne de fascia plus mince qui se trouve longitudinalement le long de la ligne médiane32. Faire l’incision à travers la linea alba permet de fermer le muscle plus facilement. - Rétractez les muscles abdominaux et la peau avec des sutures 5-0 latéralement pour visualiser correctement les prochaines étapes.
3. Identification des ganglions sympathiques lombaires L2-L5
- Les ganglions sympathiques lombaires se trouvent en arrière de l’aorte abdominale et de la veine cave inférieure. Pour visualiser l’aorte, retirez partiellement les intestins de la cavité abdominale.
REMARQUE : Les ganglions sympathiques de niveau L2-L5 traversent le niveau de la bifurcation aortique dans les vaisseaux iliaques jusqu’au niveau de l’artère rénale gauche21,33.- Posez un carré de coton stérile saturé de solution saline stérile sur le drapé, situé au-dessus et à gauche de l’incision. Soigneusement, à l’aide de 2 applicateurs stériles à embout de coton, poussez partiellement le côlon et l’intestin grêle sur le carré de coton imbibé de solution saline.
REMARQUE : Assurez-vous que le caecum et l’appendice sont hors de la cavité abdominale et que le côlon descendant peut être visualisé. - Couvrez les intestins exposés avec un autre carré de coton saturé de solution saline.
- Surveillez périodiquement le péristaltisme tout au long de la chirurgie, qui peut être identifié par le mouvement rythmique des intestins.
- Posez un carré de coton stérile saturé de solution saline stérile sur le drapé, situé au-dessus et à gauche de l’incision. Soigneusement, à l’aide de 2 applicateurs stériles à embout de coton, poussez partiellement le côlon et l’intestin grêle sur le carré de coton imbibé de solution saline.
- Identifiez le côlon descendant, qui est la partie de l’intestin qui se déplace vers le rectum et l’anus et qui peut contenir des matières fécales visibles, et déviez cette structure vers la gauche avec une pince à épiler fermée pour révéler l’aorte abdominale et la veine cave inférieure. Ces deux vaisseaux sont liés par du tissu conjonctif et doivent se déplacer comme une seule unité.
- À l’aide d’une pince à épiler, soulevez les vaisseaux abdominaux par le tissu conjonctif environnant. Pendant que celui-ci est levé, placez soigneusement une suture en nylon 5-0 à travers le tissu conjonctif.
ATTENTION : Ne percez PAS les vaisseaux abdominaux avec l’aiguille : Cela entraînerait une décompensation rapide de la souris et probablement la mort. - Une fois que la suture a été insérée dans le tissu conjonctif, déviez les vaisseaux abdominaux vers la gauche. Cela donnera une fenêtre triangulaire, permettant une visualisation directe des muscles psoas bilatéraux.
REMARQUE : En raison des connexions intimes que les ganglions ont avec les vaisseaux abdominaux, les ganglions sympathiques, bien que généralement situés sur la ligne médiane, seront légèrement déviés vers la gauche (droite de la souris) avec les vaisseaux. Une fois que les vaisseaux abdominaux sont déviés, il faut visualiser un triangle, avec les deux côtés à gauche constitués des vaisseaux abdominaux déviés et le côté droit défini par la ligne médiane de la souris (entre les muscles psoas bilatéraux). Les ganglions sympathiques se trouvent au milieu de ce triangle (Figure 1A). Ils se déplacent verticalement côte à côte et semblent translucides. Ils peuvent chevaucher un petit vaisseau qui plonge dans la ligne médiane de la souris et repose à plat sur son muscle psoas droit. À l’aide d’une pince à épiler, disséquez brutalement les fascias sus-jacents afin de révéler les ganglions (figure 1B).
- À l’aide d’une pince à épiler, soulevez les vaisseaux abdominaux par le tissu conjonctif environnant. Pendant que celui-ci est levé, placez soigneusement une suture en nylon 5-0 à travers le tissu conjonctif.
- Identifiez l’artère rénale gauche et l’artère testiculaire ou ovarienne gauche.
REMARQUE : Il s’agit de gros vaisseaux qui formeront un quadrilatère, dont les côtés sont constitués de l’artère rénale gauche en haut, de la ligne médiane de l’animal et de l’aorte abdominale/veine cave inférieure latéralement, et de l’artère testiculaire ou ovarienne gauche en bas. Les ganglions de niveau L2 sont grands et se trouvent à l’intérieur de ce quadrilatère (Figure 1A). Disséquez soigneusement pour pénétrer dans ce quadrilatère à l’aide d’une pince à épiler et identifiez les ganglions bilatéraux L2 (figure 1B). - Une fois que les parties inférieure et supérieure des ganglions sont identifiées, saisissez l’aspect inférieur des ganglions bilatéraux visibles à l’aide d’une pince à épiler et tirez vers le haut. La visualisation des ganglions plus bas, tels que L4 et L5, peut être augmentée en poussant doucement tous les organes obstruant la vue vers le bas avec la deuxième paire de pinces à épiler.
REMARQUE : La visualisation du vaisseau perforant médian mentionné à l’étape 3.2.2 assurera une sympathectomie lombaire plus complète. En tenant une deuxième pince à épiler dans l’autre main, tirez sur le fascia et les connexions neuronales qui retiennent les ganglions de l’abdomen tout en tirant simultanément sur les ganglions eux-mêmes avec la première paire de pinces à épiler. Une seule pince à épiler doit retenir les ganglions, tandis que l’autre dégage le fascia et les connexions neuronales. Une fois au niveau du testicule gauche ou de l’artère ovarienne, il peut être utile pour l’identification de la L2 si les ganglions de la chaîne inférieure sont encore intacts, car les ganglions L2 se déplacent lorsqu’ils sont tirés par la chaîne inférieure. Les ganglions L3-5 peuvent être cassés au niveau de l’artère testiculaire ou ovarienne avant d’extraire les ganglions L2 du quadrilatère à l’aide d’une pince à épiler. Les seuls ganglions présents dans le quadrilatère sont les ganglions L2. - Cette procédure doit avoir une perte de sang minimale. En cas de saignement, assurez-vous d’une hémostase adéquate avant de fermer.
4. Fermeture de la peau
- Une fois l’hémostase adéquate obtenue, retirez la suture qui maintient les vaisseaux abdominaux en place.
- À l’aide de 2 applicateurs stériles à embout de coton, replacez soigneusement les intestins détournés dans la cavité abdominale.
- Avec une suture résorbable 5-0, effectuez un point de suture pour approximer les muscles abdominaux.
- Avec une suture en nylon 5-0, utilisez de simples points interrompus pour fermer la peau.
- Appliquez une couche généreuse de pommade antibiotique, telle que Neosporin, sur le site d’incision.
- Placez la souris dans une cage propre sur un coussin chauffant.
- Observez la souris toutes les 15 minutes jusqu’à ce qu’elle soit réveillée et ambulatoire. Cela prend généralement moins de 30 minutes.
5. Dosage de la sueur de la pilocarpine
REMARQUE : Pour évaluer l’épuisement de l’activité fonctionnelle sympathique à la suite d’une sympathectomie lombaire, un test de transpiration à la pilocarpine a été utilisé 7 jours après la sympathectomie lombaire.
- Préparez une solution de chlorhydrate de pilocarpine à 1 % dans du NaCl à 0,9 % avec un mélange de fécule de pomme de terre à 10 % dans de l’huile de ricin.
- À l’aide d’un pinceau, recouvrez la surface plantaire du pied de bétadine. Laissez cette couche sécher complètement.
- Une fois que la couche de bétadine est sèche, utilisez un pinceau séparé pour appliquer une couche de 10% d’amidon dans de l’huile de ricin.
- Administrer par voie sous-cutanée à l’aide d’une seringue 0,25 μL/g de poids corporel de pilocarpine à 1 %. Démarrez une minuterie immédiatement après l’administration de pilocarpine.
- À 8 min après l’injection, prenez des photos de la surface plantaire du pied.
- À l’aide des Fidji, comptez le nombre de taches sombres situées sur les six (6) coussinets (Figure 2A).
6. Immunohistochimie
REMARQUE : Pour évaluer la dégénérescence des axones sympathiques dans les nerfs périphériques après la sympathectomie lombaire, les nerfs sciatiques bilatéraux ont été prélevés le 21e jour postopératoire.
- Anesthésie les souris (en suivant l’étape 1 du protocole), prélevez les nerfs sciatiques bilatéraux, puis euthanasiez rapidement l’animal (en suivant les protocoles approuvés par l’établissement).
- Placez les nerfs sciatiques directement dans du paraformaldéhyde à 4 % dans une solution saline tamponnée au phosphate (PBS) à 0,01 M pendant 20 min, puis transférez-les dans du saccharose à 20 % dans du PBS à 0,1 M pour une cryoprotection pendant la nuit à 4 °C.
- Sectionnez les nerfs sciatiques longitudinalement à l’aide d’un cryostat à 20 μm, et placez les sections sur des lames chargées.
- Bloquez les sections nerveuses avec 10 % de sérum de chèvre normal (NGS) dans une solution saline tamponnée à 1 % de Tween 20 (TBST) pendant 1 h à température ambiante.
- Retirez le tampon bloquant et remplacez-le par les anticorps primaires anti-tyrosine hydroxylase de lapin et anti-neurofilaments de poulet dilués dans le tampon de blocage (10% NGS dans TBST) à 1:750 et 1:1000, respectivement. Laissez les anticorps primaires incuber pendant la nuit dans une chambre humide à température ambiante.
- Laver la lame avec du TBST 3 fois, 10 min à chaque lavage, avant d’appliquer les anticorps secondaires chèvre anti-lapin 647 et chèvre anti-poulet 488, tous deux dilués à 1:200 dans le tampon de blocage. Laissez les anticorps secondaires incuber dans une chambre d’humidité pendant 2 h à température ambiante.
- Lavez la diapositive avec du TBST 4 fois, 10 minutes à chaque lavage, et laissez la diapositive sécher dans un endroit protégé de la lumière avant de la monter.
- Imagez des coupes nerveuses distantes d’au moins 40 m au microscope fluorescent sur l’objectif 10x.
- Sur Fidji, redressez les sections nerveuses et tracez trois lignes verticales placées au hasard sur toute la largeur de la section. Comptez le nombre d’axones traversant chaque ligne verticale et divisez-le par la largeur de la section au niveau de la ligne verticale. Répétez l’opération pour chacune des trois lignes verticales par section. Faites la moyenne des trois valeurs obtenues par section, puis faites la moyenne des valeurs des trois sections par nerf.
Résultats
Ce protocole décrit l’ablation chirurgicale des neurones sympathiques lombaires postganglionnaires d’une souris. Deux souris ont reçu des sympathectomies lombaires et deux souris ont servi de témoins. Pour réussir une sympathectomie lombaire chirurgicale, une visualisation adéquate d’au moins les ganglions sympathiques lombaires bilatéraux L2 et L3 doit être obtenue, comme le montre la figure 1. L’ablation des ganglions L4 et L5 permettrait d’obtenir une dénervation sympathique complète du bas du corps ; Cependant, la visualisation des ganglions inférieurs peut être obstruée par les organes urogénitaux. Des études antérieures de traçage rétrograde ont montré que la majorité des neurones des ganglions L2-L5 sont situés dans les ganglions L2 et L3. Bien que seules des souris femelles du même âge aient été utilisées pour obtenir les résultats représentatifs, cette procédure chirurgicale a été reproduite à de nombreuses reprises chez des souris mâles et femelles, sans qu’aucune différence anatomique significative n’ait été observée en termes d’emplacement de l’artère testiculaire ou ovarienne et des ganglions sympathiques.
Lors de l’ablation des ganglions, la réponse de transpiration en réponse à la pilocarpine diminue rapidement, avec des différences significatives observées au 7e jour postopératoire (Figure 2). Le jour 7 postopératoire a été choisi en raison de la diminution exponentielle de l’activité de transpiration à médiation sympathique dans les 7 jours suivant diverses lésions du nerf sciatique chez le rat34. Étant donné que la dégénérescence axonale peut prendre jusqu’à 14 jours et en raison de la difficulté potentielle à visualiser les ganglions L4 et L5 en peropératoire (la vessie et les organes génitaux peuvent obstruer la vue), la réponse de transpiration peut ne pas être complètement éliminée35,36.
La densité axonale positive à la tyrosine hydroxylase (TH+) a été significativement diminuée au 21e jour postopératoire, sans changement de la densité de la chaîne lourde des neurofilaments (NF-H) (Figure 3). Il est peu probable que les axones TH+ soient complètement épuisés en raison de la présence d’axones sensoriels TH+ innervant les mécanorécepteurs à bas seuil et des difficultés potentielles à visualiser la chaîne sympathique lombaire complète37.
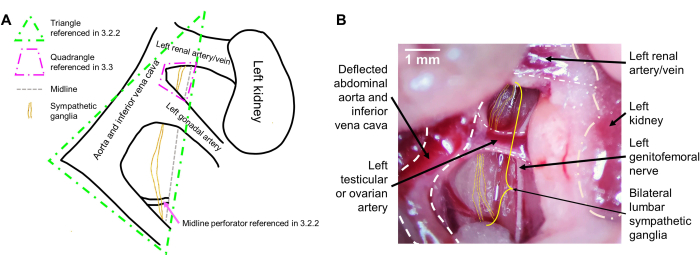
Figure 1 : Vue peropératoire des ganglions sympathiques lombaires. (A) Schéma avec les points de repère attendus. (B) Image peropératoire représentative avec points de repère étiquetés. Les ganglions sympathiques lombaires sont situés derrière l’aorte abdominale descendante et la veine cave inférieure (déviée). Les ganglions sont tirés vers la droite de la souris avec la déviation des vaisseaux abdominaux et sont situés sur le psoas droit, traversant vers le bas et vers le haut. Les ganglions bilatéraux L2 peuvent être visualisés entre l’artère rénale gauche et l’artère testiculaire ou ovarienne gauche, et les ganglions L3 sont vus en dessous de l’artère testiculaire ou ovarienne gauche. Barre d’échelle : 1 mm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 2 : La sympathectomie lombaire chirurgicale réduit le nombre de points de transpiration sur la patte arrière. (A) Schéma de l’emplacement des coussinets plantaires sur la surface plantaire de la patte arrière de la souris. (B) Une image représentative de la réponse de transpiration 8 min après l’injection de pilocarpine chez un animal intact. (B') Image agrandie avec des flèches blanches indiquant un certain nombre de points de transpiration. (C) Une image représentative de la réponse sudorale 8 min après l’injection de pilocarpine chez un animal sympathectomisé au 7e jour postopératoire. (C') Image agrandie avec des flèches blanches indiquant un certain nombre de points de transpiration. (D) Le nombre total de points de transpiration sur les six coussinets de la patte arrière chez les souris intactes par rapport aux souris sympathéctomisées. Les données sont indiquées par la ligne représentant la médiane. Test de Mann-Whitney. *p < 0,05. Barres d’échelle : 1 mm. Veuillez cliquer ici pour voir une version plus grande de cette figurine.

Figure 3 : La sympathectomie lombaire chirurgicale (Sympx) réduit le nombre d’axones sympathiques dans le nerf sciatique. (A) Axones positifs à la tyrosine hydroxylase (TH) par μm du nerf sciatique (largeur du nerf) au 21e jour postopératoire. Sections nerveuses représentatives de la coloration TH chez une souris intacte (B) et sympathéctomisée (B'). (C) Axones positifs à la chaîne lourde des neurofilaments (NF-H) par μm du nerf sciatique. Coupe nerveuse représentative de la coloration NF-H chez une souris intacte (D) et sympathectomisée (D'). Les lignes pointillées magenta représentent des lignes verticales possibles placées au hasard qui s’étendent sur la largeur de la section nerveuse utilisée pour calculer les densités axonales dans le nerf. Les flèches magenta indiquent un certain nombre d’axones qui traversent les lignes verticales placées au hasard. Les données sont présentées sous forme de moyenne ± MEB. Test t non apparié. **p < 0,01. Barres d’échelle : 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les ganglions sympathiques lombaires sont de très petites structures situées derrière de nombreux organes abdominaux critiques et de gros vaisseaux. Par conséquent, cette procédure nécessite une précision et une exactitude considérables. Une grande partie de la difficulté réside dans l’identification des ganglions sympathiques en peropératoire. Il est suggéré que l’apprenant soit d’abord capable d’identifier les ganglions dans un cadavre de souris avant de tenter cette procédure chez une souris vivante. Un dépannage devra souvent avoir lieu lors de l’identification des ganglions sympathiques après la dérivation des intestins. Pour assurer une visualisation adéquate, le côlon descendant doit être visible. La dérivation intestinale à l’extérieur de la cavité abdominale doit inclure le caïcum. De plus, la vessie peut être pleine et élargie, ce qui peut obstruer la vue du côlon descendant et, par la suite, de l’aorte abdominale descendante et de la veine cave inférieure. Idéalement, la vessie est exprimée manuellement une fois que la souris est sous anesthésie avant de faire l’incision cutanée initiale. Cependant, si la vessie n’est pas exprimée et que la vue peropératoire est bloquée, une expression douce avec 2 applicateurs stériles à embout de coton est possible. Veillez à ne pas endommager les uretères, qui sont attachés à la face postérieure de la vessie. Une fois que l’aorte abdominale et la veine cave inférieure sont identifiées en arrière du côlon descendant, une déviation et une stabilisation adéquates des vaisseaux sont essentielles pour la visualisation des ganglions sympathiques. Le fascia est relativement résistant, et si la suture est placée uniquement à travers la couche de fascia et de connexions neuronales et non à travers les parois des vaisseaux, les vaisseaux doivent être tirés à au moins 1 mm de la ligne médiane. Le fascia recouvrant les ganglions sympathiques peut être délicatement disséqué à l’aide d’une pince à épiler. En cas de rupture d’un petit vaisseau pendant la procédure, appliquez une pression avec un applicateur stérile à bout de coton pendant au moins 10 s pour assurer une hémostase adéquate avant la fermeture. Si les gros vaisseaux abdominaux sont perforés pendant l’opération, la souris doit être rapidement euthanasiée.
Bien que cette méthode permette de visualiser et d’enlever directement les ganglions sympathiques, permettant ainsi un ciblage plus spécifique de ces neurones sympathiques postganglionnaires par rapport aux sympathectomies chimiques23, il existe certaines limites. Cette chirurgie entraîne l’ablation des ganglions sympathiques lombaires L2-L5 ; cependant, en raison de l’obstruction visuelle causée par les organes urogénitaux vitaux, les ganglions les plus bas, tels que les ganglions de niveau L4-L5, sont plus difficiles à visualiser et à enlever au cours de cette procédure. La majorité des neurones innervant les membres inférieurs sont situés dans les grands ganglions L2. Les ganglions L5 sont extrêmement petits et contiennent moins de neurones, comme on l’a vu dans les expériences précédentes de traçage rétrograde fluorescent38 ; Cependant, l’incapacité à retirer ces neurones peut fausser l’analyse des résultats des structures les plus distales, telles que les pieds. Pour garantir de meilleurs résultats lors de l’étude des cibles distales dans les pieds, il serait conseillé de vérifier le tissu extrait pour compter le nombre de ganglions qui ont été retirés. Cela peut se faire via une souris rapporteure fluorescente chez laquelle les neurones sympathiques postganglionnaires peuvent facilement être visualisés ou via un traceur rétrograde fluorescent injecté dans la cible distale avant la chirurgie. Parmi les souris rapporteures fluorescentes à cet effet, citons la ThCre :mTmG (voir le tableau des matériaux), qui a un marquage extrêmement clairsemé des neurones positifs à la tyrosine hydroxylase39, le Phox2bCre :tdTomato (voir le tableau des matériaux), qui a un marquage modéré des neurones sympathiques postganglionnaires40,41, et le ThCre :tdTomato (voir le tableau des matériaux), qui présente un marquage étendu des neurones sympathiques postganglionnaires42. Il ne s’agit pas d’une liste exhaustive des lignes disponibles.
De plus, en raison de la grande incision requise pour cette procédure chirurgicale, les souris peuvent avoir besoin d’une période de récupération plus longue avant que d’autres expériences puissent être effectuées. Les souris doivent être surveillées pendant au moins 3 jours pour s’assurer qu’elles défèquent, urinent et se nourrissent correctement. De plus, une hémostase incorrecte peut entraîner des saignements intra-abdominaux non traités, ce qui peut entraîner la mort de la souris à des moments inattendus. Par conséquent, il est essentiel de s’assurer que l’hémostase est obtenue avant la fermeture chirurgicale pour le succès des expériences futures. Les neurones sympathiques peuvent également être ciblés chimiquement, comme mentionnéci-dessus 24.
L’utilisation des sympathectomies chirurgicales permettra de réaliser une multitude d’études visant à étudier le rôle de l’innervation sympathique postganglionnaire chez les cibles distales, comme le rôle de l’innervation sympathique à la jonction neuromusculaire12. De plus, des techniques de traçage rétrograde fluorescent peuvent être utilisées pour quantifier la réinnervation sympathique des tissus distaux, car ce protocole peut être adapté pour extraire les ganglions en bloc de souris fixées au paraformaldéhyde38. Dans le contexte des lésions nerveuses périphériques, ce modèle chirurgical « knock-out » permettra de mieux caractériser la récupération fonctionnelle sympathique attendue dans les tissus précédemment innervés.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été soutenu par le National Institute of Neurological Disorders and Stroke des NIH sous le numéro de bourse K01NS124912 et en partie par une subvention de développement du Centre spécialisé de recherche d’excellence en différences sexuelles d’U54AG062334 Emory financé par les NIH et du programme de formation des scientifiques médicaux de la faculté de médecine de l’Université Emory. Merci à David Kim, post-bac, pour la section des nerfs sciatiques et à HaoMin SiMa, spécialiste de la recherche, pour l’impression 3D d’un support de téléphone pour notre stéréomicroscope qui a permis de filmer la vidéo.
matériels
| Name | Company | Catalog Number | Comments |
| 5-0 absorable suture | CP Medical | 421A | |
| 5-0 nylon suture | Med-Vet International | MV-661 | |
| 70% ethanol | Sigma-Aldrich | E7023-4L | |
| Anesthesia Induction Chamber | Kent Scientific VetFlo | VetFlo-0530XS | |
| Anesthesia Vaporizer | Kent Scientific VetFlo | 13-005-202 | |
| Betadine | HealthyPets | BET16OZ | |
| C57BL/6J mice | Jackson Laboratory | #000664 | |
| Chicken anti-neurofilament-heavy | Abcam | ab72996 | |
| Cryostat | Leica | CM1850 | |
| Data Analysis Software | Prism | ||
| Fine-tipped tweezers | World Precision Instruments | 500233 | |
| Fluorescent microscope | Nikon | Ti-E | |
| Goat anti-chicken 488 | Invitrogen | A32931 | |
| Goat anti-rabbit 647 | Invitrogen | A21245 | |
| Heating pad | Braintree Scientific | 39DP | |
| Image Analysis Software | Fiji | ||
| Imaging Software | Nikon | NIS-Elements | |
| Isoflurane | Med-Vet International | RXISO-250 | |
| Meloxicam | Med-Vet International | RXMELOXIDYL32 | |
| Needle driver | Roboz Surgical Store | RS-7894 | |
| Normal Goat Serum | Abcam | ab7481 | |
| Ophthalmic ointment | Refresh | Refresh P.M. | |
| Phox2bCre:tdTomato mutant mice | Jackson Laboratory | #016223, #007914 | |
| Pilocarpine hydrochloride | Sigma-Aldrich | P6503 | |
| Rabbit anti-tyrosine hydroxylase | Abcam | ab112 | |
| Small straight scissors | Fine Science Tools | 14084-09 | |
| Sterile cotton swabs 2x2 | Dynarex | 3252 | |
| Sterile cotton tipped applicators | Dynarex | 4301 | |
| Sterile drape | Med-Vet International | DR4042 | |
| Sterile saline solution | Med-Vet International | 1070988-BX | |
| ThCre:mTmG mutant mice | Mutant Mouse Resource and Research Centers | strain #017262-UCD | Jackson Laboratory, strain #007576 |
| ThCre:tdTomato mutant mice | European Mouse Mutant Archive | strain #00254 | Jackson Laboratory, strain #007914 |
Références
- Scholz, T., et al. Peripheral nerve injuries: An international survey of current treatments and future perspectives. J Reconstr Microsurg. 25 (06), 339-344 (2009).
- Schmalbruch, H. Fiber composition of the rat sciatic nerve. Anat Rec. 215 (1), 71-81 (1986).
- Tian, T., Moore, A. M., Ghareeb, P. A., Boulis, N. M., Ward, P. J. A perspective on electrical stimulation and sympathetic regeneration in peripheral nerve injuries. Neurotrauma Rep. 5 (1), 172-180 (2024).
- Gagnon, D., Crandall, C. G. Sweating as a heat loss thermoeffector. Hand Clin Neurol. 156, 211-232 (2018).
- Grassi, G. Role of the sympathetic nervous system in human hypertension. J Hypertens. 16 (12), 1979-1987 (1998).
- Dibona, G. F. Sympathetic nervous system and the kidney in hypertension. Curr Opin Nephrol Hypertens. 11 (2), 197-200 (2002).
- Elenkov, I. J., Wilder, R. L., Chrousos, G. P., Vizi, E. S. The sympathetic nerve-An integrative interface between two supersystems: The brain and the immune system. Pharmacol Rev. 52 (4), 595-638 (2000).
- Besedovsky, H. O., Del Rey, A., Sorkin, E., Da Prada, M., Keller, H. Immunoregulation mediated by the sympathetic nervous system. Cell Immunol. 48 (2), 346-355 (1979).
- Straka, T., et al. Postnatal development and distribution of sympathetic innervation in mouse skeletal muscle. Int J Mol Sci. 19 (7), 1935 (2018).
- Geng, T., et al. Pgc-1α plays a functional role in exercise-induced mitochondrial biogenesis and angiogenesis but not fiber-type transformation in mouse skeletal muscle. Am J Physiol Cell Physiol. 298 (3), C572-C579 (2010).
- Lin, J., Handschin, C., Spiegelman, B. M. Metabolic control through the pgc-1 family of transcription coactivators. Cell Metab. 1 (6), 361-370 (2005).
- Khan, M. M., et al. Sympathetic innervation controls homeostasis of neuromuscular junctions in health and disease. Proc Natl Acad Sci. 113 (3), 746-750 (2016).
- Delbono, O., Rodrigues, A. C. Z., Bonilla, H. J., Messi, M. L. The emerging role of the sympathetic nervous system in skeletal muscle motor innervation and sarcopenia. Ageing Res Rev. 67, 101305 (2021).
- Rodrigues, A. C. Z., et al. Heart and neural crest derivative 2-induced preservation of sympathetic neurons attenuates sarcopenia with aging. J Cachexia Sarcopenia Muscle. 12 (1), 91-108 (2021).
- Rosenberg, I. H. Summary comments. Am J Clin Nutr. 50 (5), 1231-1233 (1989).
- Murata, Y., Olmarker, K., Takahashi, I., Takahashi, K., Rydevik, B. Effects of lumbar sympathectomy on pain behavioral changes caused by nucleus pulposus-induced spinal nerve damage in rats. Eur Spine J. 15, 634-640 (2006).
- Xie, J., Park, S. K., Chung, K., Chung, J. M. The effect of lumbar sympathectomy in the spinal nerve ligation model of neuropathic pain. J Pain. 2 (5), 270-278 (2001).
- Lee, D. H., Katner, J., Iyengar, S., Lodge, D. The effect of lumbar sympathectomy on increased tactile sensitivity in spinal nerve ligated rats. Neurosci Lett. 298 (2), 99-102 (2001).
- Ringkamp, M., et al. Lumbar sympathectomy failed to reverse mechanical allodynia-and hyperalgesia-like behavior in rats with l5 spinal nerve injury. Pain. 79 (2-3), 143-153 (1999).
- Zhao, C., et al. Lumbar sympathectomy attenuates cold allodynia but not mechanical allodynia and hyperalgesia in rats with spared nerve injury. J Pain. 8 (12), 931-937 (2007).
- Zheng, Z. -. F., et al. Recovery of sympathetic nerve function after lumbar sympathectomy is slower in the hind limbs than in the torso. Neural Regen Res. 12 (7), 1177 (2017).
- Holmberg, K., Shi, T. -. J. S., Albers, K. M., Davis, B. M., Hökfelt, T. Effect of peripheral nerve lesion and lumbar sympathectomy on peptide regulation in dorsal root ganglia in the ngf-overexpressing mouse. Exp Neurol. 167 (2), 290-303 (2001).
- Thoenen, H., Tranzer, J. Chemical sympathectomy by selective destruction of adrenergic nerve endings with 6-hydroxydopamine. Naunyn Schmiedebergs Arch. Exp. Pathol. Pharmakol. 261, 271-288 (1968).
- Thoenen, H., Tranzer, J. P., Häusler, G. . Chemical sympathectomy with 6-hydroxydopamine. New Aspects of Storage and Release Mechanisms of Catecholamines. , 130-143 (1970).
- Xie, W., et al. Localized sympathectomy reduces mechanical hypersensitivity by restoring normal immune homeostasis in rat models of inflammatory pain. J Neuroscience. 36 (33), 8712-8725 (2016).
- Zhu, X., Xie, W., Zhang, J., Strong, J. A., Zhang, J. -. M. Sympathectomy decreases pain behaviors and nerve regeneration by downregulating monocyte chemokine ccl2 in dorsal root ganglia in the rat tibial nerve crush model. Pain. 163 (1), e106-e120 (2022).
- Tonello, R., et al. Local sympathectomy promotes anti-inflammatory responses and relief of paclitaxel-induced mechanical and cold allodynia in mice. Anesthesiology. 132 (6), 1540-1553 (2020).
- Kostrzewa, R. M., Jacobowitz, D. M. Pharmacological actions of 6-hydroxydopamine. Pharmacol Rev. 26 (3), 199-288 (1974).
- Michel, P., Hefti, F. Toxicity of 6-hydroxydopamine and dopamine for dopaminergic neurons in culture. J Neuroscience Res. 26 (4), 428-435 (1990).
- Andrew, R., et al. The determination of hydroxydopamines and other trace amines in the urine of parkinsonian patients and normal controls. Neurochemical Res. 18, 1175-1177 (1993).
- Glinka, Y., Gassen, M., Youdim, M. Mechanism of 6-hydroxydopamine neurotoxicity. J Neural Transm Suppl. 5, 55-66 (1997).
- Treuting, P. M., Dintzis, S. M., Montine, K. S. . Comparative anatomy and histology: A mouse, rat, and human atlas. , 119 (2017).
- Hweidi, S. A., Lee, S., Wolf, P. Effect of sympathectomy on microvascular anastomosis in the rat. Microsurgery. 6 (2), 9-96 (1985).
- Navarro, X., Kennedy, W. R. Sweat gland reinnervation by sudomotor regeneration after different types of lesions and graft repairs. Exp Neurol. 104 (3), 229-234 (1989).
- Gaudet, A. D., Popovich, P. G., Ramer, M. S. Wallerian degeneration: Gaining perspective on inflammatory events after peripheral nerve injury. J Neuroinflammation. 8 (1), 1-13 (2011).
- Babetto, E., et al. Targeting nmnat1 to axons and synapses transforms its neuroprotective potency in vivo. J Neuroscience. 30 (40), 13291-13304 (2010).
- Brumovsky, P. R. Dorsal root ganglion neurons and tyrosine hydroxylase-an intriguing association with implications for sensation and pain. Pain. 157 (2), 314 (2016).
- Tian, T., Harris, A., Owyoung, J., Sima, H., Ward, P. J. Conditioning electrical stimulation fails to enhance sympathetic axon regeneration. bioRxiv. , (2023).
- Tian, T., Ward, P. J. The ThCre: Mtmg mouse has sparse expression in the sympathetic nervous system. bioRxiv. , 2023 (2023).
- Ohman-Gault, L., Huang, T., Krimm, R. The transcription factor Phox2b distinguishes between oral and non-oral sensory neurons in the geniculate ganglion. J Comparative Neurol. 525 (18), 3935-3950 (2017).
- Pattyn, A., Morin, X., Cremer, H., Goridis, C., Brunet, J. -. F. The homeobox gene phox2b is essential for the development of autonomic neural crest derivatives. Nature. 399 (6734), 366-370 (1999).
- François, M., et al. Sympathetic innervation of the interscapular brown adipose tissue in mouse. Ann N Y Acad Sci. 1454 (1), 3-13 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon