Method Article
小鼠手术腰交感神经切除术
摘要
本手稿提出了一种通过手术从小鼠身上切除节后腰交感神经元的方案。该程序将促进旨在调查交感神经支配在远端组织靶标中的作用的大量研究。
摘要
周围神经损伤很常见,只有 10% 的患者在受伤后实现了完全功能恢复。交感神经系统在维持身体稳态方面起着许多关键作用,但很少在周围神经损伤的背景下对其进行研究。目前尚不清楚外围远端靶标中节后交感神经元的功能范围。为了更好地探索外周靶点交感神经支配的作用,手术 “敲除” 模型提供了一种替代方法。虽然这可以通过化学方式实现,但节后交感神经元的化学破坏可以是非特异性的并且是剂量依赖性的。在小鼠中使用手术腰交感神经切除术,曾经被认为在小动物中“几乎不可行”,允许特异性靶向支配后肢的节后交感神经神经元。本手稿描述了如何通过手术切除小鼠的 L2-L5 腰交感神经节作为生存手术,从而可靠地减少后爪汗液反应和坐骨神经中交感神经轴突的数量。
引言
周围神经损伤 (PNI) 可导致远端组织靶区的运动、感觉和交感神经功能障碍,这些目标很少能完全恢复功能1。PNI 研究通常集中在运动和感觉再生上;然而,大鼠坐骨神经的近四分之一由无髓交感神经轴突组成2。然而,交感神经支配在外周组织中的作用尚不完全清楚3。交感神经系统在维持身体稳态、参与免疫调节、体温调节、血管张力、线粒体生物发生等方面起着重要作用 4,5,6,7,8,9,10,11 .当神经肌肉接头处的交感神经支配丧失时,尽管运动神经元神经支配维持,但仍观察到持续的肌肉无力和突触不稳定12。神经肌肉接头突触传递的这种交感神经调节已被证明会随着年龄的增长而下降13,14,这会导致肌肉减少症,定义为肌肉质量、力量和力量的年龄依赖性降低15。更好地了解外周组织交感神经支配的作用对于开发优化 PNI 和其他形式交感神经功能障碍患者功能结果的疗法是必要的。
交感神经切除术是一种强大的实验工具,可用于研究交感神经支配在远端靶组织中的作用。具体来说,去除 L2-L5 水平交感神经节会去除下肢的大部分交感神经支配,这对于对坐骨神经感兴趣的研究人员特别有用。
该协议详细介绍了作为生存手术从小鼠中去除 L2-L5 水平的节后交感神经神经元。该程序需要啮齿动物显微外科技能和熟悉小鼠解剖结构,并且如果有效执行,不会引起任何可见的表型差异。外科腰交感神经切除术已用于啮齿动物研究,在大鼠中比在小鼠中更多 16,17,18,19,20,21;但是,目前不存在描述该协议的详细协议。以前利用腰交感神经切除术的研究主要集中在交感神经支配在疼痛反应中的作用,在各种神经损伤模型中,交感神经支配通常会减轻疼痛反应。在小鼠中使用这种技术的研究较少22,可能是由于解剖标志的尺寸较小,因为人们认为使用手术交感神经切除术在小动物中“几乎不可行”23,24。微交感神经切除术形式的局部交感神经切除术也已用于啮齿动物模型,也主要在疼痛行为的背景下 25,26,27。与全腰交感神经切除术相比,微交感神经切除术采用背侧入路,通过该入路断开并切除通往特定脊神经的灰色支段,从而允许进行非常有针对性的交感神经切除术,从而避免更广泛的扩散副作用。
由于小鼠模型对于许多需要遗传操作的研究至关重要,因此该程序也将具有超越周围神经损伤的广泛应用。使用经腹入路,可以可靠地观察并从小鼠中切除腰交感神经节,没有明显的不良反应。尽管有化学破坏节后交感神经元的方案,例如使用 6-羟基多巴胺 (6-OHDA)23,24,但这种外科手术允许在解剖学上特异性靶向节后腰交感神经节。使用手术交感神经切除术还避免了与药理学方法相关的非特异性和剂量依赖性问题28,29。
1967 年,通过施用 6-OHDA 使用化学交感神经切除术被描述为一种实现选择性破坏肾上腺素能神经末梢的简单方法,因为小动物的手术交感神经切除术不受欢迎23,24。6-OHDA 是一种儿茶酚胺能神经毒素,在帕金森病患者中内源性形成,其毒性来源于其形成自由基和抑制线粒体电子传递链的能力30,31。通过去甲肾上腺素摄取-1 转运机制,6-OHDA 能够在去甲肾上腺素能神经元内积累,例如节后交感神经神经元28。最终,神经元被 6-OHDA 破坏;然而,周围神经系统的末梢确实会再生,即使胺水平仍然降低,功能活性也会恢复。响应 6-OHDA 的不同器官也存在不同的剂量阈值,并且更高剂量的 6-OHDA 已被证明表现出更多的非特异性作用,将其神经毒性后果扩展到不含儿茶酚胺的神经元甚至非神经元细胞。除了去甲肾上腺素能神经元外,多巴胺能神经元也受 6-OHDA29 的影响,这使得化学交感神经切除术最终对节后交感神经神经元的特异性低于手术交感神经切除术。
因此,手术腰交感神经切除术能够针对性地消融下肢的交感神经支配,这可以与小鼠的各种实验技术和遗传操作相结合,以研究交感神经系统如何导致各种损伤和疾病状态。
研究方案
所有实验均已获得埃默里大学机构动物护理和使用委员会 (IACUC) 的批准(根据 IACUC 协议编号 PROTO201700371)。本研究使用了 4 只成年雌性野生型 C57BL/6J 小鼠,年龄为 14 周龄,体重在 16-21 g 之间。此处使用的试剂和设备的详细信息列在 材料表中。
1. 术前准备
- 高压灭菌手术工具:1 把锋利的剪刀、2 个细尖镊子、1 个针刀。
- 将加热垫加热至 37 °C,然后将其放在手术台下。
- 用消毒剂喷洒手术区域,包括麻醉诱导室,并用纸巾彻底擦拭。
- 在处理鼠标之前,请确保穿着正确的防护服并洗手。
- 用 5 mg/kg 体重的美洛昔康喂给小鼠,并留出足够的时间让小鼠完全吞下药物以避免诱导过程中误吸。
- 在 1 L/min 氧气中用 3% 异氟醚麻醉诱导小鼠(遵循机构批准的方案)。
- 麻醉小鼠后(对脚趾捏没有反应),将小鼠放在手术台上,仰卧,鼻子放在合适的鼻锥中。
- 将鼠标正确安装在鼻锥中后,将异氟醚调整至 2% 以维持麻醉。
- 将眼胶涂在小鼠的眼睛上,以防止干燥性角膜结膜炎(干眼症)。
- 确保用手术胶带将鼠标正确固定在手术台上。
- 持续监测呼吸是否轻松和呼吸频率充足。
- 从小鼠腹部从生殖器水平到肋骨下方剃掉皮毛。
- 去除皮毛后,首先用 70% 乙醇以圆周运动从中心到周边擦拭手术区域。然后,用 betadine 以相同的圆周运动擦拭手术区域。重复乙醇和优碘步骤共 3 次。
- 用无菌手术布覆盖鼠标,从中间切出一个适当大小的孔,以可视化手术区域。菱形可以通过将悬垂对折并切割一个高度为 ~10 毫米、底部为 ~15 毫米的等腰三角形来制作。
2. 切口
- 使用一把锋利的剪刀和细尖镊子,从耻骨联合水平上方 ~1 毫米到肋骨下方 ~2 毫米创建一个中线切口。
- 识别双侧腹直肌之间的中线筋膜(白线)。使用镊子将腹部肌肉从下面的器官中抬起,然后沿着白线切开,进入腹腔。
注意:可以通过轻轻横向拉动双侧腹直肌来识别白线,以露出沿中线32 纵向分布的较细筋膜线。通过白线切开可以更容易地闭合肌肉。 - 用 5-0 缝合线横向收缩腹部肌肉和皮肤,以正确观察后续步骤。
3. L2-L5 腰交感神经节的识别
- 腰交感神经节位于腹主动脉和下腔静脉的后方。要观察主动脉,请从腹腔中部分取出肠道。
注意:L2-L5 水平交感神经节从主动脉分叉水平穿过髂血管,一直延伸到左肾动脉水平21,33。- 将浸有无菌盐水的无菌棉方放在悬垂物上,位于切口上方和左侧。小心地,用 2 个无菌棉签涂抹器,将结肠和小肠部分推出到浸有盐水的棉方格上。
注意:确保盲肠和阑尾离开腹腔,并且可以看到降结肠。 - 用另一个浸有盐水的棉方块覆盖暴露的肠道。
- 在整个手术过程中定期监测蠕动,这可以通过肠道的节律性运动来识别。
- 将浸有无菌盐水的无菌棉方放在悬垂物上,位于切口上方和左侧。小心地,用 2 个无菌棉签涂抹器,将结肠和小肠部分推出到浸有盐水的棉方格上。
- 识别降结肠,这是肠道中流向直肠和肛门的部分,可能包含可见的粪便,并用闭合的镊子将该结构向左偏转,露出腹主动脉和下腔静脉。这两个血管由结缔组织结合,应该作为一个整体移动。
- 用一把镊子,通过周围的结缔组织提起腹腔血管。当它被提起时,小心地将 5-0 尼龙缝合线穿过结缔组织。
注意:不要用针刺穿腹腔血管:这会导致小鼠快速失代偿并可能死亡。 - 一旦缝合线通过结缔组织插入,将腹腔血管向左偏转。这将提供一个三角形窗口,允许直接观察双侧腰大肌。
注意:由于神经节与腹腔血管的紧密连接,交感神经节虽然通常位于中线,但会与血管一起略微向左偏转(小鼠的右侧)。一旦腹腔血管偏转,就应该想象一个三角形,左侧的两侧由偏转的腹腔血管组成,右侧由小鼠的中线(在双侧腰肌之间)定义。交感神经节位于这个三角形的中间(图 1A)。它们垂直并排移动,看起来是半透明的。它们可能会与一根潜入小鼠中线并平躺在右腰大肌上的小血管重叠。用镊子钝头解剖任何覆盖的筋膜,露出神经节(图 1B)。
- 用一把镊子,通过周围的结缔组织提起腹腔血管。当它被提起时,小心地将 5-0 尼龙缝合线穿过结缔组织。
- 识别左肾动脉和左睾丸或卵巢动脉。
注意:这些是将形成一个四边形的大血管,其侧面由左肾动脉上部、动物中线和腹主动脉/下腔静脉外侧以及左睾丸或卵巢动脉下部组成。L2 水平神经节很大,位于该四边形内(图 1A)。小心钝剖,用镊子进入这个四边形并识别双侧 L2 神经节(图 1B)。 - 一旦确定了神经节的下部和上部,用一把镊子抓住可见的双侧神经节的下部并向上拉。用第二对镊子轻轻推动任何阻碍下部视野的器官,可以增加位于更下方的神经节(如 L4 和 L5)的可视化。
注意:可视化步骤 3.2.2 中提到的中线穿孔血管将确保更完整的腰交感神经切除术。另一只手拿着第二对镊子,将固定腹部神经节的筋膜和神经元连接拉开,同时用第一对镊子拉起神经节本身。只有一对镊子应该抓住神经节,而另一对镊子可以清除筋膜和神经元连接。一旦到达左睾丸或卵巢动脉的水平,如果下链神经节仍然完好无损,则可能有助于 L2 识别,因为 L2 神经节在被下链拉动时会移动。在用镊子从四边形中提取 L2 神经节之前,可以在睾丸或卵巢动脉处打破 L3-5 神经节。四边形内唯一存在的神经节是 L2 神经节。 - 该手术应尽量减少失血。如果发生出血,请确保在闭合前进行足够的止血。
4. 皮肤闭合
- 达到足够的止血效果后,取下固定腹腔血管的缝合线。
- 使用 2 个无菌棉签涂抹器,小心地将分流的肠道置换到腹腔中。
- 使用 5-0 可吸收缝合线,进行连续缝合以接近腹部肌肉。
- 使用 5-0 尼龙缝合线,使用简单的间断缝合来闭合皮肤。
- 在切口部位涂抹一层厚厚的抗生素软膏,例如 Neosporin。
- 将鼠标放在加热垫上的干净笼子里。
- 每 15 分钟观察一次鼠标,直到它醒来并可以走动。这通常需要不到 30 分钟。
5. 毛果芸香碱汗液测定
注意:为了评估腰交感神经切除术后交感神经功能活动的耗竭,在腰交感神经切除术后 7 天进行了毛果芸香碱汗液测定。
- 制备 1% 盐酸毛果芸香碱溶液和 0.9% NaCl 以及 10% 马铃薯淀粉在蓖麻油中的混合物。
- 使用画笔,用 betadine 覆盖足底表面。让这一层完全干燥。
- 甜菜碱层干燥后,使用单独的画笔在蓖麻油中涂抹一层 10% 的淀粉。
- 使用注射器皮下注射 0.25 μL/g 体重的 1% 毛果芸香碱,注射到颈部松弛的皮肤中。毛果芸香碱给药后立即启动计时器。
- 注射后 8 分钟,拍摄足底表面的照片。
- 使用斐济,计算位于所有六 (6) 个脚垫上的黑点数量(图 2A)。
6. 免疫组化
注意:为了评估腰交感神经切除术后周围神经交感轴突的退化,在术后第 21 天采集了双侧坐骨神经。
- 麻醉小鼠(按照方案的第 1 步),收获双侧坐骨神经,然后立即对动物实施安乐死(遵循机构批准的方案)。
- 将坐骨神经直接置于 4% 多聚甲醛的 0.01 M 磷酸盐缓冲盐水 (PBS) 中 20 分钟,然后将它们转移到 0.1 M PBS 中的 20% 蔗糖中,在 4 °C 下进行过夜冷冻保护。
- 使用 20 μm 的低温恒温器纵向切片坐骨神经,并将切片放在带电载玻片上。
- 在室温下,用 10% 正常山羊血清 (NGS) 和含 1% 吐温 20 (TBST) 的 tris 缓冲盐水阻断神经切片 1 小时。
- 去除封闭缓冲液,并分别以 1:750 和 1:1000 的比例在封闭缓冲液(TBST 中的 10% NGS)中稀释的一抗兔抗酪氨酸羟化酶和鸡抗神经丝重量替换。让一抗在室温下在湿度箱中孵育过夜。
- 用 TBST 洗涤玻片 3 次,每次洗涤 10 分钟,然后应用二抗山羊抗兔 647 和山羊抗鸡 488,两者均在封闭缓冲液中以 1:200 稀释。让二抗在室温下在湿度室中孵育 2 小时。
- 用 TBST 洗涤载玻片 4 次,每次洗涤 10 分钟,并在安装前让载玻片在避光区域干燥。
- 在 10 倍物镜上的荧光显微镜上对相距至少 40 μm 的神经切片进行成像。
- 在斐济,拉直神经节并画三条随机放置的垂直线,横跨该节段的宽度。计算穿过每条垂直线的轴突数量,并将其除以垂直线处截面的宽度。对每个部分的三条垂直线中的每一条重复上述步骤。平均每个部分获得的三个值,并进一步平均每个神经的三个部分的值。
结果
该协议描述了从小鼠身上手术切除节后腰交感神经元。2 只小鼠接受腰交感神经切除术,2 只小鼠作为对照。为了实现成功的腰交感神经外科切除术,必须至少实现 L2 和 L3 双侧腰交感神经节的充分可视化,如图 1 所示。切除 L4 和 L5 神经节将实现下半身的完全交感神经去神经支配;然而,下神经节的可视化可能会受到泌尿生殖器官的阻碍。既往逆行追踪研究表明,L2-L5 神经节中的大多数神经元位于 L2 和 L3 神经节。虽然仅使用年龄匹配的雌性小鼠来获得代表性结果,但这种外科手术已在雄性和雌性小鼠中多次重现,在睾丸或卵巢动脉和交感神经节的位置方面没有观察到显着的解剖差异。
切除神经节后,对毛果芸香碱的反应迅速降低,到术后第 7 天出现显着差异(图2)。选择术后第 7 天是因为大鼠在各种坐骨神经损伤后 7 天内交感神经介导的出汗活动呈指数级减少34。由于轴突变性可能需要长达 14 天才能完成,并且由于术中可能难以看到 L4 和 L5 神经节(膀胱和生殖器官可能阻碍视线),因此出汗反应可能无法完全消融35,36。
到术后第 21 天,酪氨酸羟化酶阳性 (TH+) 轴突密度显着降低,而神经丝重链 (NF-H) 密度没有变化(图 3)。TH+ 轴突不太可能完全耗尽,因为 TH+ 感觉轴突的存在支配低阈值机械感受器,并且可能难以可视化完整的腰交感神经链37。
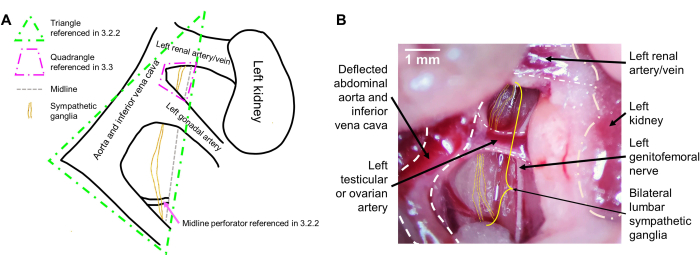
图 1:腰交感神经节的术中视图。 (A) 具有预期标志的示意图。(B) 带有标记标志的代表性术中图像。腰交感神经节位于降腹主动脉和下腔静脉(偏转)的后面。神经节随着腹腔血管的偏转而被拉到小鼠的右侧,位于右腰大肌上,向下和向上遍历。双侧 L2 神经节可以在左肾动脉和左睾丸或卵巢动脉之间看到,而 L3 神经节位于左睾丸或卵巢动脉的下方。比例尺:1 毫米。 请单击此处查看此图的较大版本。

图 2:手术腰交感神经切除术减少了后爪出汗点的数量。 (A) 小鼠后爪足底表面的脚垫位置示意图。(B) 在完整动物体内注射毛果芸香碱 8 分钟后出汗反应的代表性图像。(B')带有白色箭头的放大图像,指示选定数量的出汗点。(C) 术后第 7 天交感神经切除动物注射毛果芸香碱后 8 分钟出汗反应的代表性图像。(C')带有白色箭头的放大图像,指示选定数量的出汗点。(D) 完整小鼠与交感神经切除小鼠后爪所有六个脚垫上的出汗点总数。数据以表示中位数的线显示。Mann-Whitney 检验。*p < 0.05。比例尺:1 毫米。 请单击此处查看此图的较大版本。

图3:手术腰交感神经切除术 (Sympx) 减少了坐骨神经中交感神经轴突的数量。 (A) 术后第 21 天每 μm 坐骨神经(神经宽度)的酪氨酸羟化酶 (TH) 阳性轴突。完整 (B) 和交感神经切除 (B') 小鼠中 TH 染色的代表性神经切片。(C) 每 μm 坐骨神经的神经丝重链 (NF-H) 阳性轴突。完整 (D) 和交感神经切除 (D') 小鼠中 NF-H 染色的代表性神经切片。洋红色虚线表示可能随机放置的垂直线,这些垂直线跨越用于计算神经轴突密度的神经截面的宽度。洋红色箭头表示穿过随机放置的垂直线的选定数量的轴突。数据显示为 SEM ±平均值。未配对 的 t 检验。**p < 0.01。比例尺:100 μm。 请点击此处查看此图的较大版本。
讨论
腰交感神经节是非常小的结构,位于许多关键的腹部器官和大血管后面。因此,此过程需要很高的精度和准确度。大部分困难在于术中识别交感神经节。建议学习者在尝试在活小鼠中尝试此过程之前,首先能够识别小鼠尸体中的神经节。在肠道改道后识别交感神经节时,通常需要进行故障排除。为了确保足够的可视化,降序号必须可见。腹腔外的肠道改道必须包括盲肠。此外,膀胱可能充盈和扩大,这可能会阻碍降结肠的视野,进而阻碍降腹主动脉和下腔静脉的视野。理想情况下,一旦小鼠处于麻醉状态,在进行初始皮肤切口之前,膀胱就会手动挤出。然而,如果膀胱没有挤出并且术中视野被阻塞,可以用 2 个无菌棉签涂抹器轻轻挤出。注意不要损坏附着在膀胱后部的输尿管。一旦在降结肠后方确定腹主动脉和下腔静脉,血管的充分偏转和稳定对于交感神经节的可视化至关重要。筋膜相对坚韧,如果缝合线仅穿过筋膜和神经元连接层,而不是穿过血管壁,则应将血管从中线拉出至少 1 毫米。可以用镊子轻轻解剖覆盖交感神经节的筋膜。如果在手术过程中有任何小血管破裂,请用无菌棉签涂抹器施加压力至少 10 秒,以确保在闭合前有足够的止血。如果在手术过程中穿刺了大腹血管,则应迅速对小鼠实施安乐死。
尽管这种方法允许直接观察和切除交感神经节,因此与化学交感神经切除术相比,可以更特异性地靶向这些节后交感神经神经元23,但存在一些局限性。该手术切除了 L2-L5 腰交感神经节;然而,由于重要的泌尿生殖器官引起的视觉阻塞,最低的神经节,例如 L4-L5 水平的神经节,在此过程中更难看到和切除。支配下肢的大多数神经元位于大的 L2 神经节中。L5 神经节非常小,包含较少的神经元,如之前的荧光逆行示踪实验所示38;然而,未能去除这些神经元可能会扭曲对最远端结构(如足部)结果的分析。为了确保在研究足部远端目标时获得更好的结果,建议检查提取的组织以计算已切除的神经节数量。这可以通过荧光报告小鼠完成,其中节后交感神经元可以很容易地可视化,或者通过在手术前将荧光逆行示踪剂注射到远端靶标中来完成。一些用于此目的的荧光报告小鼠包括 ThCre:mTmG(参见材料表),它具有酪氨酸羟化酶阳性神经元39 的极稀标记,Phox2bCre:tdTomato(参见材料表),它具有节后交感神经元的中度标记40,41,以及 ThCre:tdTomato(参见材料表),它对节后交感神经元进行了广泛的标记42。这并不是可用线路的详尽列表。
此外,由于该外科手术需要大切口,小鼠可能需要更长的恢复期才能进行进一步的实验。应监测小鼠至少 3 天的正确排便、排尿和喂养。此外,不适当的止血会导致未解决的腹腔内出血,这可能导致小鼠在意想不到的时间点死亡。因此,确保在手术闭合前实现止血对于未来实验的成功至关重要。交感神经元也可以被化学靶向,如前所述24.
手术交感神经切除术的使用将允许进行大量研究,旨在调查节后交感神经支配在远端目标中的作用,例如交感神经支配在神经肌肉接头的作用12。此外,荧光逆行示踪技术可用于量化远端组织的交感神经再支配,因为该方案可以适应从多聚甲醛固定的小鼠中整块提取神经节38。在周围神经损伤的情况下,这种手术“敲除”模型将允许更好地表征先前神经支配组织中的预期交感神经功能恢复。
披露声明
作者没有需要披露的利益冲突。
致谢
这项工作得到了 NIH 国家神经疾病和中风研究所的支持,奖励编号为 K01NS124912,部分得到了 NIH 资助的埃默里性别差异专业中心U54AG062334和埃默里大学医学院医学科学家培训计划的发展赠款。感谢学士后 David Kim 对坐骨神经进行切片,感谢研究专家 HaoMin SiMa 为我们的立体显微镜 3D 打印手机支架,从而拍摄了视频。
材料
| Name | Company | Catalog Number | Comments |
| 5-0 absorable suture | CP Medical | 421A | |
| 5-0 nylon suture | Med-Vet International | MV-661 | |
| 70% ethanol | Sigma-Aldrich | E7023-4L | |
| Anesthesia Induction Chamber | Kent Scientific VetFlo | VetFlo-0530XS | |
| Anesthesia Vaporizer | Kent Scientific VetFlo | 13-005-202 | |
| Betadine | HealthyPets | BET16OZ | |
| C57BL/6J mice | Jackson Laboratory | #000664 | |
| Chicken anti-neurofilament-heavy | Abcam | ab72996 | |
| Cryostat | Leica | CM1850 | |
| Data Analysis Software | Prism | ||
| Fine-tipped tweezers | World Precision Instruments | 500233 | |
| Fluorescent microscope | Nikon | Ti-E | |
| Goat anti-chicken 488 | Invitrogen | A32931 | |
| Goat anti-rabbit 647 | Invitrogen | A21245 | |
| Heating pad | Braintree Scientific | 39DP | |
| Image Analysis Software | Fiji | ||
| Imaging Software | Nikon | NIS-Elements | |
| Isoflurane | Med-Vet International | RXISO-250 | |
| Meloxicam | Med-Vet International | RXMELOXIDYL32 | |
| Needle driver | Roboz Surgical Store | RS-7894 | |
| Normal Goat Serum | Abcam | ab7481 | |
| Ophthalmic ointment | Refresh | Refresh P.M. | |
| Phox2bCre:tdTomato mutant mice | Jackson Laboratory | #016223, #007914 | |
| Pilocarpine hydrochloride | Sigma-Aldrich | P6503 | |
| Rabbit anti-tyrosine hydroxylase | Abcam | ab112 | |
| Small straight scissors | Fine Science Tools | 14084-09 | |
| Sterile cotton swabs 2x2 | Dynarex | 3252 | |
| Sterile cotton tipped applicators | Dynarex | 4301 | |
| Sterile drape | Med-Vet International | DR4042 | |
| Sterile saline solution | Med-Vet International | 1070988-BX | |
| ThCre:mTmG mutant mice | Mutant Mouse Resource and Research Centers | strain #017262-UCD | Jackson Laboratory, strain #007576 |
| ThCre:tdTomato mutant mice | European Mouse Mutant Archive | strain #00254 | Jackson Laboratory, strain #007914 |
参考文献
- Scholz, T., et al. Peripheral nerve injuries: An international survey of current treatments and future perspectives. J Reconstr Microsurg. 25 (06), 339-344 (2009).
- Schmalbruch, H. Fiber composition of the rat sciatic nerve. Anat Rec. 215 (1), 71-81 (1986).
- Tian, T., Moore, A. M., Ghareeb, P. A., Boulis, N. M., Ward, P. J. A perspective on electrical stimulation and sympathetic regeneration in peripheral nerve injuries. Neurotrauma Rep. 5 (1), 172-180 (2024).
- Gagnon, D., Crandall, C. G. Sweating as a heat loss thermoeffector. Hand Clin Neurol. 156, 211-232 (2018).
- Grassi, G. Role of the sympathetic nervous system in human hypertension. J Hypertens. 16 (12), 1979-1987 (1998).
- Dibona, G. F. Sympathetic nervous system and the kidney in hypertension. Curr Opin Nephrol Hypertens. 11 (2), 197-200 (2002).
- Elenkov, I. J., Wilder, R. L., Chrousos, G. P., Vizi, E. S. The sympathetic nerve-An integrative interface between two supersystems: The brain and the immune system. Pharmacol Rev. 52 (4), 595-638 (2000).
- Besedovsky, H. O., Del Rey, A., Sorkin, E., Da Prada, M., Keller, H. Immunoregulation mediated by the sympathetic nervous system. Cell Immunol. 48 (2), 346-355 (1979).
- Straka, T., et al. Postnatal development and distribution of sympathetic innervation in mouse skeletal muscle. Int J Mol Sci. 19 (7), 1935 (2018).
- Geng, T., et al. Pgc-1α plays a functional role in exercise-induced mitochondrial biogenesis and angiogenesis but not fiber-type transformation in mouse skeletal muscle. Am J Physiol Cell Physiol. 298 (3), C572-C579 (2010).
- Lin, J., Handschin, C., Spiegelman, B. M. Metabolic control through the pgc-1 family of transcription coactivators. Cell Metab. 1 (6), 361-370 (2005).
- Khan, M. M., et al. Sympathetic innervation controls homeostasis of neuromuscular junctions in health and disease. Proc Natl Acad Sci. 113 (3), 746-750 (2016).
- Delbono, O., Rodrigues, A. C. Z., Bonilla, H. J., Messi, M. L. The emerging role of the sympathetic nervous system in skeletal muscle motor innervation and sarcopenia. Ageing Res Rev. 67, 101305 (2021).
- Rodrigues, A. C. Z., et al. Heart and neural crest derivative 2-induced preservation of sympathetic neurons attenuates sarcopenia with aging. J Cachexia Sarcopenia Muscle. 12 (1), 91-108 (2021).
- Rosenberg, I. H. Summary comments. Am J Clin Nutr. 50 (5), 1231-1233 (1989).
- Murata, Y., Olmarker, K., Takahashi, I., Takahashi, K., Rydevik, B. Effects of lumbar sympathectomy on pain behavioral changes caused by nucleus pulposus-induced spinal nerve damage in rats. Eur Spine J. 15, 634-640 (2006).
- Xie, J., Park, S. K., Chung, K., Chung, J. M. The effect of lumbar sympathectomy in the spinal nerve ligation model of neuropathic pain. J Pain. 2 (5), 270-278 (2001).
- Lee, D. H., Katner, J., Iyengar, S., Lodge, D. The effect of lumbar sympathectomy on increased tactile sensitivity in spinal nerve ligated rats. Neurosci Lett. 298 (2), 99-102 (2001).
- Ringkamp, M., et al. Lumbar sympathectomy failed to reverse mechanical allodynia-and hyperalgesia-like behavior in rats with l5 spinal nerve injury. Pain. 79 (2-3), 143-153 (1999).
- Zhao, C., et al. Lumbar sympathectomy attenuates cold allodynia but not mechanical allodynia and hyperalgesia in rats with spared nerve injury. J Pain. 8 (12), 931-937 (2007).
- Zheng, Z. -. F., et al. Recovery of sympathetic nerve function after lumbar sympathectomy is slower in the hind limbs than in the torso. Neural Regen Res. 12 (7), 1177 (2017).
- Holmberg, K., Shi, T. -. J. S., Albers, K. M., Davis, B. M., Hökfelt, T. Effect of peripheral nerve lesion and lumbar sympathectomy on peptide regulation in dorsal root ganglia in the ngf-overexpressing mouse. Exp Neurol. 167 (2), 290-303 (2001).
- Thoenen, H., Tranzer, J. Chemical sympathectomy by selective destruction of adrenergic nerve endings with 6-hydroxydopamine. Naunyn Schmiedebergs Arch. Exp. Pathol. Pharmakol. 261, 271-288 (1968).
- Thoenen, H., Tranzer, J. P., Häusler, G. . Chemical sympathectomy with 6-hydroxydopamine. New Aspects of Storage and Release Mechanisms of Catecholamines. , 130-143 (1970).
- Xie, W., et al. Localized sympathectomy reduces mechanical hypersensitivity by restoring normal immune homeostasis in rat models of inflammatory pain. J Neuroscience. 36 (33), 8712-8725 (2016).
- Zhu, X., Xie, W., Zhang, J., Strong, J. A., Zhang, J. -. M. Sympathectomy decreases pain behaviors and nerve regeneration by downregulating monocyte chemokine ccl2 in dorsal root ganglia in the rat tibial nerve crush model. Pain. 163 (1), e106-e120 (2022).
- Tonello, R., et al. Local sympathectomy promotes anti-inflammatory responses and relief of paclitaxel-induced mechanical and cold allodynia in mice. Anesthesiology. 132 (6), 1540-1553 (2020).
- Kostrzewa, R. M., Jacobowitz, D. M. Pharmacological actions of 6-hydroxydopamine. Pharmacol Rev. 26 (3), 199-288 (1974).
- Michel, P., Hefti, F. Toxicity of 6-hydroxydopamine and dopamine for dopaminergic neurons in culture. J Neuroscience Res. 26 (4), 428-435 (1990).
- Andrew, R., et al. The determination of hydroxydopamines and other trace amines in the urine of parkinsonian patients and normal controls. Neurochemical Res. 18, 1175-1177 (1993).
- Glinka, Y., Gassen, M., Youdim, M. Mechanism of 6-hydroxydopamine neurotoxicity. J Neural Transm Suppl. 5, 55-66 (1997).
- Treuting, P. M., Dintzis, S. M., Montine, K. S. . Comparative anatomy and histology: A mouse, rat, and human atlas. , 119 (2017).
- Hweidi, S. A., Lee, S., Wolf, P. Effect of sympathectomy on microvascular anastomosis in the rat. Microsurgery. 6 (2), 9-96 (1985).
- Navarro, X., Kennedy, W. R. Sweat gland reinnervation by sudomotor regeneration after different types of lesions and graft repairs. Exp Neurol. 104 (3), 229-234 (1989).
- Gaudet, A. D., Popovich, P. G., Ramer, M. S. Wallerian degeneration: Gaining perspective on inflammatory events after peripheral nerve injury. J Neuroinflammation. 8 (1), 1-13 (2011).
- Babetto, E., et al. Targeting nmnat1 to axons and synapses transforms its neuroprotective potency in vivo. J Neuroscience. 30 (40), 13291-13304 (2010).
- Brumovsky, P. R. Dorsal root ganglion neurons and tyrosine hydroxylase-an intriguing association with implications for sensation and pain. Pain. 157 (2), 314 (2016).
- Tian, T., Harris, A., Owyoung, J., Sima, H., Ward, P. J. Conditioning electrical stimulation fails to enhance sympathetic axon regeneration. bioRxiv. , (2023).
- Tian, T., Ward, P. J. The ThCre: Mtmg mouse has sparse expression in the sympathetic nervous system. bioRxiv. , 2023 (2023).
- Ohman-Gault, L., Huang, T., Krimm, R. The transcription factor Phox2b distinguishes between oral and non-oral sensory neurons in the geniculate ganglion. J Comparative Neurol. 525 (18), 3935-3950 (2017).
- Pattyn, A., Morin, X., Cremer, H., Goridis, C., Brunet, J. -. F. The homeobox gene phox2b is essential for the development of autonomic neural crest derivatives. Nature. 399 (6734), 366-370 (1999).
- François, M., et al. Sympathetic innervation of the interscapular brown adipose tissue in mouse. Ann N Y Acad Sci. 1454 (1), 3-13 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。