Method Article
Конвейер для многомасштабного трехмерного анатомического исследования сердца человека
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол представляет собой комплексный конвейер для анализа образцов, полученных из человеческого сердца, которые охватывают микроскопический и макроскопический масштабы.
Аннотация
Детальное изучение здоровых человеческих сердец, отторгнутых для трансплантации, дает уникальную возможность провести структурный анализ в микроскопическом и макроскопическом масштабах. Эти методы включают очистку тканей (трехмерная (3D) визуализация органов, очищенных растворителем, с помощью модифицированного иммуномечения) и иммуногистохимическое окрашивание. Процедуры мезоскопического исследования включают стереоскопическую диссекцию и микрокомпьютерное томографическое сканирование (КТ). Процедуры макроскопического исследования включают в себя грубое вскрытие, фотографирование (включая анаглифы и фотограмметрию), компьютерную томографию и 3D-печать физически или виртуально расчлененного или всего сердца. Перед макроскопическим исследованием может быть выполнена давяще-перфузионная фиксация для поддержания 3D-архитектуры и физиологически значимой морфологии сердца. Применение этих методов в сочетании для изучения человеческого сердца является уникальным и имеет решающее значение для понимания взаимосвязи между различными анатомическими особенностями, такими как коронарная сосудистая сеть и иннервация миокарда, в контексте трехмерной архитектуры сердца. В этом протоколе подробно описываются методологии и приводятся репрезентативные результаты, иллюстрирующие прогресс в исследованиях анатомии сердца человека.
Введение
Поскольку функция следует за формой, понимание архитектуры сердца имеет основополагающее значение для понимания его физиологии. Несмотря на то, что многочисленные исследования выявили анатомию сердца от микро- до макромасштабов 1,2,3, многие вопросы остаются нерешенными, особенно те, которые связаны с анатомией сердца человека. Отчасти это связано с тем, что в основных исследованиях, посвященных функциональной анатомии, обычно использовались сердца животных 4,5,6, которые часто отличаются от человеческих сердец 1,7,8. Кроме того, каждое отдельное исследование, даже с использованием образцов человеческого сердца, как правило, сосредоточено на очень специфических структурах, что затрудняет применение полученных результатов в контексте всего сердца. Это еще более верно, если сфокусированные структуры находятся в микро- или мезомасштабах, таких как перинексус9 и ганглионарные сплетения10.
В этом контексте системное структурное исследование человеческого сердца, отторгнутого для трансплантации, дает уникальную и редкую возможность получить исчерпывающий атлас сердечных структур в фокусе в микроскопическом и макроскопическоммасштабах. Протоколы микроскопического исследования включают очистку тканей (трехмерная (3D) визуализация органов, очищенных растворителем, с модифицированным иммуномечением, iDISCO+)12,13 и иммуногистохимическое окрашивание. Протоколы мезоскопического обследования включают стереоскопическую диссекцию, макрофотографию и микрокомпьютерную томографию (КТ). Протоколы макроскопического исследования включают в себя полное вскрытие14, фотографирование (включая анаглифы и фотограмметрию)15,16,17, компьютерную томографию, виртуальное вскрытие 18 и 3D-печать физически или виртуально рассеченного или всегосердца17. При подготовке к макроскопическому исследованию проводится давло-перфузионная фиксация для поддержания 3D-архитектуры и физиологически значимой морфологии сердца 14,19,20,21. Совместное применение этих методов уникально и имеет решающее значение для корреляции различных анатомических особенностей в контексте 3D-архитектуры человеческого сердца.
Поскольку возможность получения образца сердца человека без патологии крайне ограничена, описанный здесь многомасштабный подход позволяет максимально использовать образец. Применяя различные процедуры, описанные ниже, репрезентативные результаты продемонстрируют читателю, как полученные результаты могут быть использованы для различных целей, включая открытия в научных исследованиях11 (всесторонний анализ иннервации сердца, распределения ганглионированных сплетений), совершенствование клинических процедур (моделирование хирургических и интервенционных подходов) и анатомическое образование (реальная 3D-демонстрация анатомии сердца).
протокол
В этом исследовании использовались обезличенные образцы тканей, собранные из донорских человеческих сердец, и оно было одобрено Институциональным наблюдательным советом Калифорнийского университета в Лос-Анджелесе (UCLA). Образцы были получены из не отказывающих сердец, которые были отторгнуты для трансплантации. Сердца были перфузированы под давлением, зафиксированы в 4% параформальдегиде (PFA) и визуализированы перед обработкой тканей в соответствии со следующими методами. На рисунке 1 обобщена блок-схема порядка проведения исследования. Подробная информация о реагентах и оборудовании, использованном в исследовании, приведена в Таблице материалов.
1. Микромасштабное обследование
- Очищение тканей с использованием протокола 3D-визуализации очищенных растворителем органов (iDISCO+) с помощью модифицированного иммуномечения.
- Рассеките 4% фиксированную PFA ткань с помощью скальпеля так, чтобы она помещалась в камеру размером от 3 мм × 16 мм × 25 мм для конфокальной микроскопии. Для визуализации более толстых тканей на предметном стекле могут быть установлены дополнительные камеры и/или спейсеры.
- Образцы обезвоживают с использованием градуированного метанола (MeOH) (20%, 40%, 60%, 80% и 100% MeOH в деионизированном H2O [об./об.]) в течение 1 ч при комнатной температуре (RT) с перемешиванием.
- Простирать со 100% MeOH в течение 1 часа при RT и погрузить в 66% дихлорметан/33% MeOH при RT с перемешиванием на ночь.
- На следующий день дважды постирайте в MeOH (100%) в течение 1 часа при RT, охладите при 4 °C и обработайте 5% H2O2 в MeOH (vol/vol) в течение ночи при 4 °C.
- Регидратируйте с помощью градуированной серии MeOH (80%, 60%, 40% и 20% MeOH) и простирайте в 0,01 моль/л PBS в течение 1 ч каждый при RT с перемешиванием.
- Промойте салфетки дважды в 0,01 моль/л PBS с 0,2% Triton X-100 в течение 1 ч на RT.
- Подготовьте к иммуномечению путем пермеабилизации в 0,01 моль/л PBS, 20% диметилсульфоксида (ДМСО), 0,2% Triton X-100 и 0,3 моль/л глицина в течение 2 дней при 37 °C с перемешиванием.
- Заблокируйте 0,01 моль/л PBS 10% ДМСО, 0,2% Triton X-100 и 5% нормальной ослиной сыворотки еще на 2 дня при 37 °C с перемешиванием.
- Мечите первичным антителом, совместимым с MeOH, конъюгированным с флуорофорами, разведенными в 0,01 моль/л PBS с 10 мг/мл гепарина (PTwH), 0,2% Tween-20, 5% ДМСО и 3% нормальной ослиной сыворотки в течение 3-4 дней при 37 °C с перемешиванием.
- Пополните раствор антител и инкубируйте еще 3-4 дня при 37 °С с перемешиванием.
- После 1-недельной инкубации в первичном растворе антител промыть 4–5 раз в PTwH на ночь в режиме ЛТ.
- Инкубировать с вторичными антителами, конъюгированными с флуорофорами, разведенными в ПТвГ, 3% нормальной сывороткой крови осляка в течение 3 суток при 37 °С с перемешиванием.
- Восполните раствор вторичного антитела, инкубируйте еще 3 дня при 37 °С с перемешиванием.
- После 6-дневной инкубации в растворе вторичных антител промыть в PTwH 4-5 раз на ночь в режиме РТ.
- Обезвоживайте с помощью градуированной серии MeOH (20%, 40%, 60%, 80%, 100% и 100% MeOH). Образец может храниться в течение ночи в режиме RT.
- Инкубировать в 66% дихлорметане/33% MeOH в течение 3 ч при РТ с перемешиванием.
- Дважды промыть в 100% дихлорметане в течение 15 мин при RT с перемешиванием.
- Инкубируйте и храните образцы в бензиловом эфире. Заполните пробирку, чтобы свести к минимуму окисление образца воздухом.
- Визуализация образца, очищенного от тканей
- Прикрепите камеру, содержащую клей, к предметному стеклу и нанесите лак для ногтей по периметру камеры. Для более толстых тканей на предметном стекле могут быть установлены дополнительные камеры и/или спейсеры.
- Поместите очищенную салфетку в камеру, заполните бензиловым эфиром и наложите покровную накладку.
- Нанесите лак для ногтей вокруг покровного стекла, чтобы создать уплотнение.
- Получение изображений Tilescan и Z-стека с помощью вертикального лазерного сканирующего конфокального микроскопа с 5-кратным или 10-кратным объективом для получения изображений на глубине до рабочего расстояния от объектива.
- Изображение с разрешением 1024 x 1024 с использованием лазерных линий, соответствующих спектрам излучения используемых флуорофоров. Мышечная аутофлуоресценция видна с помощью лазерной линии с длиной волны 488 нм.
- Убедитесь, что размер шага по оси Z соизмерим с выборкой Найквиста на основе числовой апертуры указанного объектива11.
- Сшивайте изображения и используйте программное обеспечение для 3D-визуализации.
- Создание фигур с использованием изображений проекции максимальной интенсивности (MIP) стеков Z для отдельных и объединенных каналов (рис. 2).
- Иммуногистохимия
ПРИМЕЧАНИЕ: После того, как ткань погружена в парафин22, для создания предметных стекол для иммуногистохимического исследования используется следующая процедура.- Приготовление согласующего раствора для показателя преломления (RIMS).
- Приготовьте 0,1 моль/л фосфатного буфера, добавив 10,9 г Na2HPO4 (безводный) и 3,1 г2PO4 (моногидрат) к деионизированному H2O до общего объема 1 л (pH 7,4). Отфильтруйте и простерилизуйте раствор и храните его при RT.
- Разбавьте фосфатный буфер до 0,02 моль/л.
- Растворите Histodenz в 30 мл фосфатного буфера 0,02 моль/л, перемешивая раствор в течение 10 минут с помощью магнитной мешалки в конечной бутылке для хранения, которая может быть закрыта для минимизации испарения и загрязнения.
- Добавьте азид натрия до общей концентрации 0,01% (по массе) и отрегулируйте pH до 7,5 с помощью NaOH.
- Отрегулируйте RI, изменяя конечную концентрацию Histodenz.
- Храните RIMS в RT в течение нескольких месяцев. Выбросьте средства, если отмечается микробное загрязнение.
ПРИМЕЧАНИЕ: НЕ автоклавируйте растворы, содержащие азид натрия.
- Подготовка предметных стекол для иммуногистохимического исследования
- Создание участков толщиной 5 мкм с помощью микротома. Нанесите срез ткани на заряженные предметные стекла.
- Удалите парафин, инкубируя предметные стекла в >75% ксилола в течение 10 минут. Переместите предметные стекла во вторую емкость с ксилолом еще на 10 минут.
- Удалите ксилол, погрузив предметные стекла в 100% EtOH на 10 минут, затем в 95% EtOH на 5 минут и 70% EtOH на 5 минут.
- Промойте предметные стекла деионизированным H2O в течение 5 минут.
- Предметные стекла погрузить в буфер для извлечения антигена на 25 мин при температуре 90-95°С.
- Дайте контейнеру остыть до состояния RT в течение 1 ч с перемешиванием.
- Погрузите предметные стекла в буфер для замачивания (0,01 моль/л PBS + 0,4% Triton X-100) на 30 минут при температуре 4°C.
- Обвяжите ткань пап-ручкой. Добавьте PBS к каждому предметному стеклу и поместите его во увлажненную камеру, чтобы предотвратить высыхание.
- Вымыть предметные стекла PBS в режиме RT с перемешиванием в течение 5 минут.
- Блок с блокирующим буфером (0,01 моль/л PBS + 10% сыворотка осляка + 0,1% TX-100) в течение 1 ч с перемешиванием.
- Инкубировать с первичным антителом, разведенным в блокирующем буфере, в течение ночи при 4°C.
- На следующий день дайте предметным стеклам нагреться до температуры RT в течение 15 минут.
- Промойте предметные стекла 3 раза 0,01 моль/л PBS + 0,2% TritonX-100 в течение 5 минут.
- Инкубировать со вторичным антителом, разведенным в блокирующем буфере, в течение 1 ч при ЛТ с перемешиванием.
- Промойте предметные стекла 3 раза 0,01 моль/л PBS + 0,2% TritonX-100 в течение 5 минут.
- Промойте предметные стекла 3 раза с концентрацией 0,01 моль/л PBS в течение 5 минут.
- Нанесите 1 каплю RIMS с помощью пипетки и наклейте покровную пленку.
- Нанесите лак для ногтей вокруг покровного стекла, чтобы создать уплотнение.
- В качестве отрицательного контроля запустите образец без первичного антитела, чтобы продемонстрировать отсутствие специфического окрашивания.
- Визуализация иммуноокрашенных стекол
- Визуализируйте предметные стекла с помощью лазерного сканирующего конфокального микроскопа с объективом 10x, 20x и 40x.
- Изображение с разрешением 1024 x 1024 с использованием лазерных линий, соответствующих спектрам излучения используемых вторичных антител.
- Создание фигур с использованием изображений проекции максимальной интенсивности (MIP) стеков Z для отдельных и объединенных каналов (рис. 3).
- Приготовление согласующего раствора для показателя преломления (RIMS).
2. Мезомасштабная экспертиза
- Стереоскопическая диссекция
- Выполняйте деликатные диссекции, фокусируясь на крошечных или тонких структурах, таких как атриовентрикулярный узел, артерия атриовентрикулярного узла и сердечное нервное сплетение (в масштабе от субмиллиметра до миллиметра) с помощью увеличительной настольной лампы с зажимом, хирургических телескопов или стереомикроскопа.
- Микрокомпьютерная томография
ПРИМЕЧАНИЕ: КТ проводится после пресс-перфузии и фиксации и на любых этапах диссекции с помощью микропозитронно-эмиссионной томографии (ПЭТ)/компьютерного томографа (Рисунок 4).- Прогрейте источник рентгеновского излучения КТ в течение 25 минут перед визуализацией образца.
- Поместите образец сердца на кровать сканера.
- Переместите ложе сканера в горизонтальное положение 544 мм и вертикальное положение 14 мм, чтобы центрировать сердце в поле зрения КТ (FOV).
- Получение КТ-изображения с частотой 80 кВпик, 150 мкА с 720 проекциями в течение 1 минуты сканирования с пространственным разрешением 200 мкм.
- Восстановите данные компьютерной томографии с полем зрения 12 см x 12 см x 10 см и матрицей из 600 x 600 x 500 вокселей и сохраните их в виде файла DICOM.
3. Макромасштабная экспертиза
- Перфузия и фиксация давлением
Примечание: Авторы модифицируют ранее описанные методы перфузии и фиксации давлением и применяют их к здоровым человеческим сердцам, отторгнутым для трансплантации 14,19,20,21.- Используйте высокопоточные насосы для фиксации перфузии. Используйте в качестве фиксатора 100% этанол14, 4% PFA или 10% формалин.
ПРИМЕЧАНИЕ: Сердце восстанавливают с помощью восходящей аорты, легочного ствола и обеих полых вен, а также легочных вен, резецированных как можно дистальнее и доставляемых в раствореУниверситета Висконсина 23. - Используйте две хирургические канюли 20-24 Fr для перфузии правых и левых отделов сердца. Для перфузии правых отделов сердца канюлируйте верхнюю полую вену и установите вентиляционное отверстие в легочном стволе или легочной артерии с помощью наполовину разрезанных пластиковых шприцев объемом 12-30 мл с наконечниками Luer-Lock, прикрепленными к трехсторонним запорным кранам.
- Окклюзируйте нижнюю полую вену и другую легочную артерию шпагатом, поставив пластиковый шприц соответствующего размера или центрифужную пробирку объемом 1,5-5,0 мл.
- Для антеградной перфузии левого отдела сердца канюлируйте одну из легочных вен и установите вентиляционное отверстие на дистальном разрезанном конце аорты с помощью наполовину разрезанных пластиковых шприцев объемом 12-30 мл с наконечниками Luer-Lock, прикрепленных к трехсторонним запорным кранам.
- Для ретроградной перфузии левого отдела сердца канюлейте одну из ветвей дуги аорты и установите отверстие на другой ветви дуги аорты. Поместите кончики канюль в оба желудочка.
- Другие отверстия сосудов закупорьте шпагатом после введения соответствующего размера закрытого наполовину разреза пластикового шприца или микроцентрифужной пробирки объемом 1,5-5,0 мл. Используйте тонкую марлю, чтобы закрыть вводимую часть шприцев/трубок/канюль, чтобы предотвратить утечку и соскальзывание. Устраните большие утечки с помощью швов, бандажей или комков. Допускаются небольшие утечки.
- Подвесьте сердце в пластиковом контейнере.
- Подсоедините 22-24 Fr мягкую пластиковую трубку к каждой канюле и вставьте другой конец трубки в емкость, наполненную фиксатором.
- Циркулируйте фиксатор через правый и левый контуры отделов сердца с помощью высокопоточного насоса, установленного со скоростью примерно 100-300 мл/мин для правых отделов сердца и 200-400 мл/мин для левых отделов сердца, чтобы достичь приблизительно 20 мм рт.ст. в правом желудочке и 80 мм рт.ст. в левом желудочке соответственно.
- Поддерживайте перфузию при температуре 4 °C в течение 24 ч.
- Промыть сердце 0,01 моль/л PBS в течение 30 мин с четырехкратным перемешиванием.
- Хранить сердце в 0,01 моль/л PBS/0,02% азида натрия при температуре 4 °C.
ПРИМЕЧАНИЕ: Перфузионная фиксация давлением эффективна только для свежего сердца, а не для сердца, восстановленного из забальзамированного трупа.
- Используйте высокопоточные насосы для фиксации перфузии. Используйте в качестве фиксатора 100% этанол14, 4% PFA или 10% формалин.
- Грубое рассечение
- Выполняйте прогрессивную диссекцию с фотографическими записями на каждом этапе диссекции.
- Чтобы сохранить клиническую значимость, обратите особое внимание на то, чтобы не допустить деформации каких-либо структур для поддержания физиологической морфологии сердца.
- Визуализируйте целевые структуры с использованием клинически значимой ориентации, такой как правая передняя косая ориентация.
- Фотография
- Поместите неподвижное сердце с давлением на штатив с платформой, установленной с несколькими зубцами и возможностью вращения на 360°.
- Сфотографируйте сердце с помощью цифровой однообъективной зеркальной камеры (Рисунок 5)24, используя несколько светодиодных панелей, установленных на С-образных стойках, и широкую черную ткань с пуховым фоном.
- Фотографируйте с помощью объектива с большим фокусным расстоянием (200 мм) на рабочем расстоянии 4-6 футов для минимизации искажений объекта съемки14.
- Анаглифы
- Чтобы отобразить анаглифические изображения, восстановите пару фотографий или объемных изображений из наборов данных компьютерной томографии с разницей угла поворота в горизонтальной плоскости в 10°.
- Преобразуйте набор этих двумерных (2D) изображений, называемых стереограммами, в анаглифы с помощью бесплатной программы16.
- Для просмотра анаглифа используйте красные/голубые очки.
- Фотограмметрия
ПРИМЕЧАНИЕ: Фотограмметрия – это прикладная наука о создании трехмерной реконструкции поверхности на основе нескольких двумерных фотографий, сделанных под разнымиуглами.- Подвесьте образец на C-Stand или поместите его на вращающийся стол, чтобы получить сотни разнонаправленных фотографий с помощью смартфона.
- Сгенерируйте 3D-модель в формате FBX с помощью имеющегося в продаже программного обеспечения.
- Компьютерная томография
ПРИМЕЧАНИЕ: КТ может быть выполнена после перфузии и фиксации давлением и на любой стадии диссекции.- Подвесьте образец сердца к стержню, расположенному в верхней части контейнера. Чтобы сердце не раскачивалось во время сканирования, поддерживайте основание сердца пластиковыми зубцами, закрепленными на дне контейнера. Таким образом, воздух будет служить отрицательным контрастом.
- Выполнить компьютерную томографию можно с помощью серийно выпускаемого мультидетекторного рядного компьютерного томографа со следующими параметрами: напряжение трубки 120 кВ, ток трубки 800-900 мА, вращение гентри 280 мс. Произведение длины дозы обычно составляет 500-1200 mGy.cm.
- Реконструировать данные осевого изображения по следующим параметрам: толщина сечения, 0,6 мм; инкрементальный интервал, 0,3 мм; поле зрения, максимально маленькое (как правило, 100-200 мм); и матрица, 512 × 512.
- Виртуальное вскрытие
- Анализируйте изображения компьютерной томографии с помощью коммерчески доступного программного обеспечения для создания изображений виртуального вскрытия.
Примечание: Виртуальное препарирование представляет собой модификацию процесса объемной визуализации, при которой фокус смещается на стенки сердечных камер и сосудов18. В этом процессе ручное определение пороговых значений практически удаляет улучшенную камеру из исходных наборов данных. - Визуализируйте необработанные стенки, перегородки и клапаны с помощью виртуального препарирования, чтобы получить изображения, аналогичные грубому рассечению. В отличие от грубой диссекции образцов сердца, плоскости разреза при виртуальном рассечении практически не ограничены. Практически любой вид может быть воссоздан для визуализации интересующих структур по мере необходимости.
- Анализируйте изображения компьютерной томографии с помощью коммерчески доступного программного обеспечения для создания изображений виртуального вскрытия.
- 3D-печать
- Откройте совместимый файл образца сердца в программном обеспечении 3D-принтера.
- Используйте профиль 0,10 мм Fast DETAIL для печати настроек в 3D-принтере и уменьшите скорость печати до 20 мм/с. Включите параметр Создать вспомогательный материал.
- Используйте профиль нити ТПУ для «Настроек нити» на 3D-принтере.
- Используйте профиль сопла Original Prusa MK4 Input Shaper 0.4 для "Настроек принтера" в принтере.
- После завершения нарезки сохраните файл BGCODE на USB-накопителе для 3D-печати.
- Используйте нить ТПУ толщиной 1,75 мм для 3D-печати образца человеческого сердца. Перед 3D-печатью высушите нить из ТПУ в течение 6 часов с помощью сушилки для филамента.
- Чтобы уменьшить натяжение нити во время 3D-печати, поместите катушку с нитью на держатель катушки со встроенным подшипником, чтобы облегчить вращение катушки с нитью. Выполняйте 3D-печать с помощью коммерчески доступного 3D-принтера с текстурированным стальным листом с порошковым покрытием.
- Осторожно снимите вспомогательные материалы после завершения 3D-печати.
Результаты
Микромасштабные исследования
Применение очистки тканей позволяет визуализировать большие объемы ткани в 3D с помощью конфокальной микроскопии. В сердце можно визуализировать ганглии, содержащие сердечные нейроны, и нейронный паттерн иннервации миокарда (рис. 2). На рисунке 3 показано конфокальное изображение миокарда левого желудочка человека, иммуноокрашенного для нервов и гладкомышечных клеток. Отмечается, что кровеносные сосуды пересекают миокард, и идентифицируются многочисленные нервные волокна, как в ассоциации с кровеносными сосудами, так и независимо от них.
Мезо- и макромасштабные исследования
При использовании абсолютного этанола для перфузии и фиксации давлением в течение 24 ч естественный цвет образца отбеливается, ткань обезвоживаетсяв 25 часов, а эластичность значительно снижается. С другой стороны, при фиксации с помощью PFA и формалина естественный цвет и эластичность замечательно сохраняются. По этим причинам в качестве предпочтительного фиксатора в основном используется PFA или формалин.
На рисунке 6 показаны репрезентативные изображения валового препарирования, виртуального рассечения, полигональной модели STL и трехмерной печати. На рисунке 7 показаны репрезентативные изображения анаглифов, созданных как из грубых, так и из виртуальных изображений вскрытия. Восприятие глубины можно получить с помощью анаглифических очков. Полученная фотограмметрическая модель может наблюдаться практически со всех сторон с помощью коммерчески доступного программного обеспечения и демонстрирует сложные анатомические особенности, относящиеся к рутинным транскатетерным кардиохирургическим процедурам. Применяя эти методы к сердцу, подготовленному с помощью перфузии и фиксации давления, трехмерная информация о сердце может почти вечно сохраняться в цифровом или физическом виде и распространяться без границ. На рисунке 8 показаны 3D-печати в масштабе 50%, воспроизведенные из препарированных сердец, отторгнутых для трансплантации.

Рисунок 1: Блок-схема протокола. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
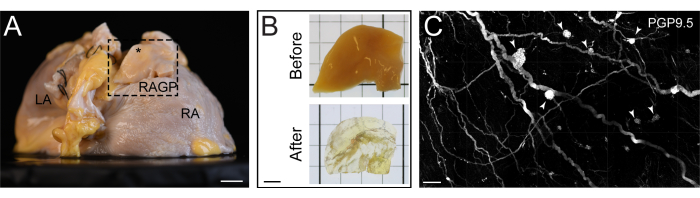
Рисунок 2: Очищенный от тканей участок правого предсердия человека. (A) Вид правого заднего косого предсердия правого предсердия человека с рассечением правого предсердного ганглионарного сплетения (RAGP) для очистки тканей. (B) Образец RAGP до и после очищения тканей. (C) Проекция максимальной интенсивности очищенной iDISCO+ части человеческого RAGP, демонстрирующей ганглии (стреловидные наконечники), иммуноокрашенные продуктом гена паннейронального маркерного белка 9.5 (PGP9.5). Масштабные линейки: 1 см (A), 5 мм (B) и 500 μm (C). Этот рисунок взят из Hanna et al.11. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Иммуноокрашенные слайды левого желудочка человека. Конфокальное изображение из среза миокарда левого желудочка человека, иммуноокрашенного паннейрональным маркерным белком продукта 9,5 (PGP9,5) и маркером гладкомышечных клеток α-гладкомышечным актином (αSMA). Мышечная аутофлуоресценция видна с помощью лазерной линии с длиной волны 488 нм (зеленый). Масштабная линейка составляет 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Микрокомпьютерная томографическая визуализация образцов сердца. (A) Установка микрокомпьютерной томографии для визуализации образцов сердца. (B) Пользовательский интерфейс для микрокомпьютерной томографии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Обстановка фотостудии в Центре сердечной аритмии Калифорнийского университета в Лос-Анджелесе. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Грубая диссекция (вверху слева), виртуальная диссекция (вверху справа), полигональная модель STL (внизу слева) и трехмерная печать (внизу справа) изображения аортального и митрального клапанного комплекса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
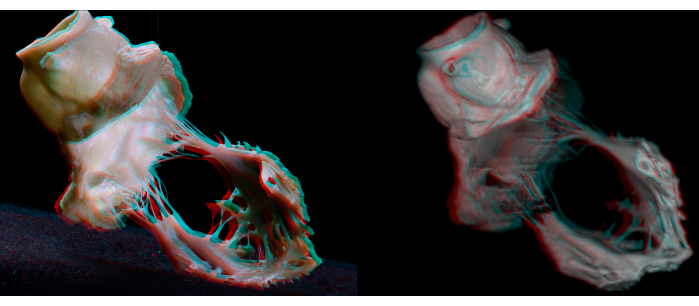
Рисунок 7: Анаглифы грубой диссекции (слева) и виртуальной диссекции (справа) аортального и митрального клапанного комплекса. Анаглифические очки (красные/голубые) необходимы для получения восприятия глубины. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 8: Трехмерная печать образцов сердца. (A) Настройка трехмерного (3D) принтера для 3D-печати образцов сердца с использованием нити ТПУ. (B) Репрезентативные 3D-отпечатки сердца, изготовленные с использованием методов, описанных в данном исследовании. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Настоящее исследование демонстрирует всеобъемлющий конвейер для анализа образцов, полученных из целых человеческих сердец. Репрезентативные результаты показывают микро- и макромасштабные анатомические исследования, проводимые регулярно для одного сердца. Поскольку образец человеческого сердца чрезвычайно ценен, многомасштабный подход является идеальным и эффективным, чтобы не тратить впустую ни одной части образца, применяя несколько протоколов для различных целей, включая открытия в научных исследованиях, улучшение клинических процедур и анатомическое образование с поддержанием анатомической корреляции в контексте всего сердца.
Что касается микромасштабного исследования, иммуноокрашивание и микроскопия могут быть применены для понимания цитоархитектуры сердечных образцов человека. Здесь демонстрируется применение очистки тканей и иммуногистохимии для изучения сердечной нейроанатомии на клеточном уровне. Использование этих методов полезно для характеристики сердечной нервной системы и паттернов иннервации миокарда по отношению к представляющим интерес структурам, таким как сердечная проводящая система и сердечные камеры. Несмотря на то, что достигается превосходное пространственное разрешение, использование конфокальной микроскопии, особенно для образцов, очищенных от тканей, требует много времени. Световая листовая микроскопия может быть использована для сокращения времени получения изображений за счет пространственного разрешения.
Что касается мезо- и макромасштабного исследования, то пространственное разрешение микрокомпьютерных томографов в авторском учреждении колеблется от 10 до 200 мкм. Размер образца ограничен 20 мм для скана 10 мкм и 120 мм для скана 100-200 мкм. Микрокомпьютерные томографы в авторском учреждении не могут вместить все сердце. Таким образом, в авторском учреждении сканирование всего сердца требует использования клинического компьютерного томографа с пространственным разрешением 600 мкм, хотя достижения позволили разработать микрокомпьютерные томографы, которые могут визуализировать все сердце. Технологические разработки, такие как КТ с подсчетом фотонов, несомненно, расширят дальнейшие возможности. Улучшение пространственного разрешения файла STL должно стать первым шагом к дальнейшему повышению качества 3D-печати. Более высокая стоимость 3D-печати ограничивает применение этой техники в рутинной клинической практике. Фотограмметрические изображения, генерируемые с помощью любого приложения для смартфона, просты в разработке и имеют приемлемоекачество, но для улучшения разрешения потребуются дополнительные сложные, но дорогие и трудоемкие системы. Для визуализации в 3D расширенная реальность с помощью специальных головных уборов27,28 и голографических мониторов29 являются дополнительными инструментами, но также ограничены более высокой стоимостью.
Таким образом, благодаря всестороннему структурному анализу в микроскопическом и макроскопическом масштабах, микромасштабная анатомия каждой структуры и ее функциональный вклад могут быть поняты в контексте всего сердца. Вместе с развитием визуализации с высоким разрешением, расстояние между микро- и макромасштабной анатомией резко увеличивается. Специалисты по электронно-микроскопическому анализу кардиомиоцитов могут быть не знакомы с количеством митральных створок и наоборот. Чтобы способствовать всестороннему пониманию морфологии сердца, ученые должны продолжать изучать детали каждого дерева, сохраняя при этом обзор всего леса с высоты птичьего полета.
Раскрытие информации
Никакой.
Благодарности
Мы благодарим людей, которые пожертвовали свои тела для развития образования и исследований. Мы благодарны фонду OneLegacy, который лег в основу получения донорских сердец для исследований. Мы также благодарны Энтони А. Смитсону и Арвину Рок-Вердефлору из Центра трансляционной исследовательской визуализации Калифорнийского университета в Лос-Анджелесе (отделение радиологии) за их поддержку в сборе данных компьютерной томографии. Этот проект был поддержан проектом UCLA Amara Yad Project. Мы благодарны докторам Кальянам Шивкумару и Олуджими А. Аджиджоле за создание и поддержание сердечного конвейера человека для исследований. Мы благодарны нашему менеджеру по исследованиям Амикше С. Ганди за ее преданность делу поддержки наших проектов. Эта работа стала возможной благодаря поддержке грантов NIH OT2OD023848 & P01 HL164311 и гранта Leducq 23CVD04 для Кальянам Шивкумара, премии Американской кардиологической ассоциации за развитие карьеры 23CDA1039446 для PH и проекта UCLA Amara-Yad (https://www.uclahealth.org/medical-services/heart/arrhythmia/about-us/amara-yad-project). Сканер GNEXT microPET/CT, использованный в этом исследовании, был профинансирован грантом NIH Shared Instrumentation for Animal Research Grant (1 S10 OD026917-01A1).
Материалы
| Name | Company | Catalog Number | Comments |
| 1x Phosphate buffered saline | Sigma-Aldrich | P3813 | |
| 3D Viewer | Microsoft | ||
| 647 AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch Laboratories | 711-605-152 | |
| 647 AffiniPure Donkey Anti-Sheep IgG | Jackson ImmunoResearch Laboratories | 713-605-147 | |
| AF Micro-NIKKOR 200 mm f/4D IF-ED lens | Nikon | ||
| Anti-Actin, α-Smooth Muscle - Cy3 antibody | Sigma-Aldrich | C6198 | |
| Antigen Retrieval Buffer (100x EDTA Buffer, pH 8.0) | Abcam | ab93680 | |
| Anti-PGP9.5 (protein gene product 9.5) | Abcam | ab108986 | |
| Anti-TH (tyrosine hydrox ylase) | Abcam | ab1542 | |
| Anti-VAChT (vesicular acetylcholine transporter) | Synaptic Systems | 139 103 | |
| Benzyl ether | Sigma-Aldrich | 108014 | |
| Bovine serum albumin | Sigma-Aldrich | A4503-10G | |
| Cheetah 3D printer filament (95A), 1.75 mm | NinjaTek | ||
| Coverslip, 22 mm x 30mm, No. 1.5 | VWR | 48393 151 | |
| Cy3 AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch Laboratories | 711-165-152 | |
| Dichloromethane | Sigma-Aldrich | 270997-100ML | |
| Dimethyl sulfoxide | Sigma-Aldrich | D8418-500ML | |
| Ethanol, 100% | Decon laboratories | 2701 | |
| Glycine | Sigma-Aldrich | G7126-500G | |
| GNEXT PET/CT | SOFIE Biosciences | ||
| Heparin sodium salt from porcine intestinal mucosa | Sigma-Aldrich | H3149-50KU | |
| Histodenz | Sigma-Aldrich | D2158-100G | |
| Hydrogen peroxide solution | Sigma-Aldrich | H1009-500ML | |
| Imaging software | Zeiss | ZEN (black edition) | |
| Imaging software | Oxford Instruments | Imaris 10 | |
| iSpacer | Sunjin Labs | iSpacer 3mm | |
| KIRI Engine | KIRI Innovation | ||
| Laser scanning confocal microscope | Zeiss | LSM 880 | |
| LEAD-2 - Vertical & Multi-channels Peristaltic Pump | LONGER | ||
| Lightview XL | Brightech | ||
| Methanol (Certified ACS) | Fischer Scientific | A412-4 | |
| Nikon D850 | Nikon | ||
| NinjaTek NinjaFlex TPU @MK4 | NinjaTek | ||
| Normal donkey serum | Jackson ImmunoResearch Laboratories | 017-000-121 | |
| Original Prusa MK4 3D printer | Prusa Research | ||
| PAP pen | Abcam | ab2601 | |
| Paraformaldehyde, 32% | Electron Microscopy Sciences | 15714-S | |
| Polycam | Polycam | ||
| Primary antibody | |||
| PrusaSlicer 2.7.1 | Prusa Research | ||
| SARA-Engine | pita4 mobile LLC | ||
| Scaniverse | Niantic | ||
| Secondary antibody | |||
| SlowFade Gold Antiface Mountant | Invitrogen | S36936 | |
| Sodium azide, 5% (w/v) | Ricca Chemical Company | 7144.8-32 | |
| SOMATOM Definition AS | Siemens Healthcare | ||
| Standard Field Surgi-Spec Telescopes, | Designs for Vision | ||
| Stereomicroscope System SZ61 | OLYMPUS | ||
| StereoPhoto Maker | Free ware developed by Masuji Suto | ||
| Superfrost Plus Microscope Slides, Precleaned | Fisher Scientific | 12-550-15 | |
| Triton X-100 | Sigma-Aldrich | T8787-50ML | |
| Tween-20 | Sigma-Aldrich | P9416-100ML | |
| Xylene | Sigma-Aldrich | 534056-4L | |
| Ziostation2 | Ziosoft, AMIN |
Ссылки
- Tawara, S. Das reizleitungssystem des säugetierherzens. Eine anatomisch-histologische studie über das atrioventrikularbündel und die purkinjeschen fäden. Jena: Gustav fischer. , https://wellcomecollection.org/works/gnxjxg9e (1906).
- Stephenson, R. S., et al. High-resolution 3-dimensional imaging of the human cardiac conduction system from microanatomy to mathematical modeling. Sci Rep. 7 (1), 7188(2017).
- Kawashima, T., Sato, F. First in situ 3D visualization of the human cardiac conduction system and its transformation associated with heart contour and inclination. Sci Rep. 11 (1), 8636(2021).
- Bojsen-Moller, F., Tranum-Jensen, J. Whole-mount demonstration of cholinesterase-containing nerves in the right atrial wall, nodal tissue, and atrioventricular bundle of the pig heart. J Anat. 108, Pt 3 375-386 (1971).
- Zhao, Y., et al. Ganglionated plexi and ligament of marshall ablation reduces atrial vulnerability and causes stellate ganglion remodeling in ambulatory dogs. Heart Rhythm. 13 (10), 2083-2090 (2016).
- Chung, W. H., et al. Ischemia-induced ventricular proarrhythmia and cardiovascular autonomic dysreflexia after cardioneuroablation. Heart Rhythm. 20 (11), 1534-1545 (2023).
- Crick, S. J., Sheppard, M. N., Ho, S. Y., Gebstein, L., Anderson, R. H. Anatomy of the pig heart: Comparisons with normal human cardiac structure. J Anat. 193, Pt 1 105-119 (1998).
- Saburkina, I., Pauziene, N., Solomon, O. I., Rysevaite-Kyguoliene, K., Pauza, D. H. Comparative gross anatomy of epicardiac ganglionated nerve plexi on the human and sheep cardiac ventricles. Anat Rec (Hoboken). 306 (9), 2302-2312 (2023).
- Hoagland, D. T., Santos, W., Poelzing, S., Gourdie, R. G. The role of the gap junction perinexus in cardiac conduction: Potential as a novel anti-arrhythmic drug target. Prog Biophys Mol Biol. 144, 41-50 (2019).
- Aksu, T., Gopinathannair, R., Gupta, D., Pauza, D. H. Intrinsic cardiac autonomic nervous system: What do clinical electrophysiologists need to know about the "heart brain". J Cardiovasc Electrophysiol. 32 (6), 1737-1747 (2021).
- Hanna, P., et al. Innervation and neuronal control of the mammalian sinoatrial node a comprehensive atlas. Circ Res. 128 (9), 1279-1296 (2021).
- Rajendran, P. S., et al. Identification of peripheral neural circuits that regulate heart rate using optogenetic and viral vector strategies. Nature Communications. 10, 1944(2019).
- Renier, N., et al. Mapping of brain activity by automated volume analysis of immediate early genes. Cell. 165 (7), 1789-1802 (2016).
- Mcalpine, W. Heart and coronary arteries: An anatomical atlas for clinical diagnosis, radiological investigation, and surgical treatment. Springer-verlag. , ISBN 13: 9783540069850 (1975).
- Mori, S., Shivkumar, K. Stereoscopic three-dimensional anatomy of the heart: Another legacy of dr. Wallace a. Mcalpine. Anat Sci Int. 96 (3), 485-488 (2021).
- Izawa, Y., Nishii, T., Mori, S. Stereogram of the living heart, lung, and adjacent structures. Tomography. 8 (2), 824-841 (2022).
- Sato, T., Hanna, P., Ajijola, O. A., Shivkumar, K., Mori, S. Photogrammetry of perfusion-fixed heart: Innovative approach to study 3-dimensional cardiac anatomy. JACC Case Rep. 21, 101937(2023).
- Tretter, J. T., Gupta, S. K., Izawa, Y., Nishii, T., Mori, S. Virtual dissection: Emerging as the gold standard of analyzing living heart anatomy. J Cardiovasc Dev Dis. 7 (3), 30(2020).
- Thomas, A. C., Davies, M. J. The demonstration of cardiac pathology using perfusion-fixation. Histopathology. 9 (1), 5-19 (1985).
- Glagov, S., Eckner, F. A., Lev, M. Controlled pressure fixation apparatus for hearts. Arch Pathol. 76, 640-646 (1963).
- Iaizzo, P. A. The visible heart(r) project and free-access website 'atlas of human cardiac anatomy. Europace. 18, suppl 4 163-172 (2016).
- Yang, Y., Huang, H., Li, L., Yang, Y. Multiplex immunohistochemistry staining for paraffin-embedded lung cancer tissue. J Vis Exp. (201), e65850(2023).
- Tripathy, S., Das, S. K. Strategies for organ preservation: Current prospective and challenges. Cell Biol Int. 47 (3), 520-538 (2023).
- Mori, S., Shivkumar, K. Atlas of cardiac anatomy (anatomical basis of cardiac interventions. Vol. 1). Cardiotext. , (2022).
- Crosado, B., et al. Phenoxyethanol-based embalming for anatomy teaching: An 18 years' experience with crosado embalming at the university of otago in new zealand. Anat Sci Educ. 13 (6), 778-793 (2020).
- Titmus, M., et al. A workflow for the creation of photorealistic 3d cadaveric models using photogrammetry. J Anat. 243 (2), 319-333 (2023).
- Silva, J. N. A., Southworth, M., Raptis, C., Silva, J. Emerging applications of virtual reality in cardiovascular medicine. JACC Basic Transl Sci. 3 (3), 420-430 (2018).
- Maresky, H. S., et al. Virtual reality and cardiac anatomy: Exploring immersive three-dimensional cardiac imaging, a pilot study in undergraduate medical anatomy education. Clin Anat. 32 (2), 238-243 (2019).
- Mori, S., Shivkumar, K. Real three-dimensional cardiac imaging using leading-edge holographic display. Clin Anat. 34 (6), 966-968 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены