Method Article
Подготовка образцов органоидов сетчатки для просвечивающей электронной микроскопии
В этой статье
Резюме
Этот протокол обеспечивает оптимизированную и сложную процедуру подготовки образцов органоидов сетчатки для просвечивающей электронной микроскопии. Он подходит для приложений, связанных с анализом синапсов в зрелых органоидах сетчатки.
Аннотация
Органоиды сетчатки (РО) представляют собой трехмерную культуральную систему, имитирующую особенности сетчатки человека, которые дифференцировались от индуцированных плюрипотентных стволовых клеток (ИПСК) в определенных условиях. Развитие и созревание синапсов в АФ изучены иммуноцитохимически и функционально. Однако прямые доказательства синаптической контактной ультраструктуры ограничены, содержащей как специальные ленточные синапсы, так и обычные химические синапсы. Просвечивающая электронная микроскопия (ПЭМ) характеризуется высоким разрешением и хорошей историей, выясняющей развитие сетчатки и созревание синапсов у человека и различных видов. Это мощный инструмент для изучения синаптической структуры в РО, который широко используется в области исследований РО. Поэтому для лучшего изучения структуры синаптических контактов RO на наноуровне и получения высококачественных микроскопических доказательств мы разработали простой и воспроизводимый метод подготовки образцов RO TEM. В этой статье описывается протокол, используемые реагенты и подробные шаги, включая подготовку к фиксации ОО, постфиксацию, встраивание и визуализацию.
Введение
Сетчатка, жизненно важный орган зрительной чувствительности у человека и млекопитающих, имеет отчетливую слоистую структуру, характеризующуюся тремя ядерными слоями, содержащими нейронные сомы, и двумя плексиформными слоями, образованными синаптическими связями1, включая обычные синапсы и специализированный ленточный синапс 2,3. Ленточный синапс играет решающую роль в передаче импульсов везикул в постепенном порядке 2,3. Процесс зрения включает в себя передачу электрооптического сигнала через различные уровни нейронов и синапсов, в конечном итоге достигая зрительной коры 4,5.
Органоиды сетчатки (РО) представляют собой трехмерную (3D) культуральную систему, полученную из индуцированных плюрипотентных стволовых клеток (ИПСК), имитирующую физиологические состояния ткани сетчатки in vitro 1,6,7. Этот подход является перспективным для изучения заболеваний сетчатки8, скрининга лекарств9 и служит потенциальной терапией для необратимых дегенеративных состояний сетчатки, таких как пигментный ретинит10 и глаукома11. Являясь мощной системой оптической проводимости in vitro, синапс в АФ является важнейшей структурой, способствующей эффективному преобразованию и передаче сигнала.
Развитие ОО можно условно разделить на три стадии в соответствии с их морфологическими признаками и профилями молекулярной экспрессии 6,12. RO на стадии 1 (около D21-D60) включают в себя нервные клетки-предшественники сетчатки, множество ганглиозных клеток сетчатки (RGC) и несколько звездообразных амакриновых клеток (SAC), соответствующих первой эпохе развития плода человека. На стадии 2 (около D50-D150) RO экспрессируют некоторые предшественники фоторецепторов, интернейроны и гены, связанные с синаптогенезом, что представляет собой фазу перехода. Фоторецепторы развивают зрелость на стадии 3 RO (примерно после D100-D150), что соответствует третьей стадии развития плода человека 6,12,13. Примечательно, что по сравнению с АФ на стадии 1 и стадии 2, РО на стадии 3 имеют отчетливую пластинчатую структуру, синапсы которой созрели12, включая наличие ленточных синапсов14. Более того, недавнее исследование подтвердило, что зрелые синапсы существуют для передачи световых сигналов, что указывает наих функциональность. Таким образом, АФ на стадии 3 часто отбираются для исследования синаптической структуры.
Иммуногистохимия широко применяется для изучения экспрессии различных молекулярных белков. Тем не менее, ограничение оптической микроскопии заключается в ее способности наблюдать только ограниченное количество конкретных клеток и молекул одновременно, что приводит к отсутствию всестороннего анализа взаимоотношений между клетками и окружающей их средой. Просвечивающая электронная микроскопия (ПЭМ) характеризуется высоким разрешением, с ограниченным разрешением 0,1-0,2 нм, превосходящим световой микроскоп в ~10-20 разв 15 раз. Он восполняет дефекты оптической микроскопии и используется для выяснения развития сетчатки и созревания синапсов у человека16,17 и различных видов 18,19,20,21. ПЭМ позволяет проводить прямое различие между пресинаптическими и постсинаптическими компонентами18,20 и даже позволяет всесторонне наблюдать за субклеточными структурами, такими как ленты 2,3, везикулы22 и митохондрии23. Таким образом, ПЭМ является важным инструментом для идентификации типов синапсов и изучения ультраструктуры синаптических контактов в РО на наноуровне.
Важно отметить, что пробоподготовка имеет большое значение для получения высококачественных электронных микрофотографий. Хотя в некоторых исследованиях ЭМ выполняли на RO 12,13,24, подробные процедуры неясны. Поскольку качество изображения электронной микроскопии в значительной степени зависит от эффекта фиксации RO и проникновения реагента, при подготовке необходимо учитывать различные важные факторы. Следовательно, для лучшего исследования синаптических контактов в РО мы представляем метод с хорошей воспроизводимостью, который показывает рабочие точки фиксации, встраивания и идентификации мест наблюдения РО.
протокол
1. Получение RO от iPSCs25
ПРИМЕЧАНИЕ: RO были получены из iPSC путем модификации ранее описанной процедуры.
- Диссоциировать иПСК при слиянии ~90% с помощью бактериальной протеазы (см. Таблицу материалов). Измельчите колонии на кусочки и соскребите их с помощью клеточного подъемника.
- После сбора повторно суспендируйте кластеры клеток в 0,25 мл ледяного Матригеля. После 20 минут инкубации при 37 °C рассыпьте затвердевший гель средой DMEM/F12 (0,5% добавка N2, 1% добавка B27, 0,1 мМ β-меркаптоэтанол, 0,2 мМ заменитель L-глутамина, 100 ЕД/мл пенициллина и 100 мг/мл стрептомицина). Определите это время как день 0 дифференцировки.
- После 5 дней плавающей культуры клетки группируются в клеточные кисты. Перенесите эти клетки в чашку Петри диаметром 100 мм, где они теперь прилипнут и будут расти.
- На 15-й день используйте бактериальную протеазу для диссоциации адгезивных клеток и культивируйте их в среде DMEM/F12 (2% добавка B27, 0,1 мМ заменимых аминокислот).
- На 21-й день замените среду 20 мл сыворотки, содержащей среду (среда DMEM/F12, 8% FBS, 2% добавка B27, 100 мМ таурин и 2 мМ заменитель L-глютамина) и заменяйте среду каждую неделю.
2. Передняя фиксация АФ
- Аккуратно переместите один из культивируемых РО (~D180, оптимальный размер около 1~2 мм в диаметре) из чашки Петри в микроцентрифужные пробирки объемом 1,5 мл с помощью пипетки и отметьте соответствующую информацию о РО.
ПРИМЕЧАНИЕ: Разрежьте RO пополам или отрежьте плохо структурированную ткань бритвой под микроскопом в чашке, содержащей фиксатор, если RO слишком большие. - Удалите питательную среду из микроцентрифужных пробирок объемом 1,5 мл с помощью пипетки. Добавьте 1,5 мл 2% параформальдегида-2% фиксатора глутаральдегида, разведенного в 0,1 М фосфатном буфере (PB), pH 7,4, и закрепите при комнатной температуре (RT) в течение 4 ч. Храните микроцентрифужные пробирки при температуре 4 °C в течение ночи.
ПРИМЕЧАНИЕ: Этот шаг можно приостановить на 1 неделю, но рекомендуется начать заново как можно раньше. Если РО оставить на более длительный срок, это может вызвать аутолиз клеток, что приведет к разрушению ультраструктуры РО. Из-за хрупкости RO избегайте вращения, колебаний, переворачивания или резких операций.
3. Последующая фиксация RO
- Удалите 2% фиксатор параформальдегид-2% глутаральдегида и промойте 1 мл 0,01 М фосфатно-солевого буфера (PBS) при pH 7,4 в течение 3 x 10 минут. Аккуратно суспендируйте RO в микроцентрифужных пробирках объемом 1,5 мл во время процесса промывки для полного ополаскивания. За каждый дополнительный день фиксации увеличивайте количество стирок на два, чтобы максимально удалить остаточный фиксатор.
- Удалите остатки PBS с помощью пипетки и замените их ~150 μL 1% осмиевой кислоты (OsO4) до тех пор, пока тканевые блоки не будут погружены в воду. Поместите микроцентрифужные пробирки в темный ящик, чтобы защитить их от света, и проведите в режиме RT на 1 ч.
ПРИМЕЧАНИЕ: OsO4 является сильным окислителем и должен обрабатываться в вытяжном шкафу.
4. Окрашивание и обезвоживание
ПРИМЕЧАНИЕ: На этом этапе необходимо включить осушитель воздуха, чтобы высушить окружающую среду.
- Удалите OsO4 с помощью пипетки, промойте 0,01 M PBS (pH 7,4) 3 x 10 минут, а затем промойте 3 x 10 минут деионизированной водой.
ПРИМЕЧАНИЕ: Чтобы обеспечить полную промывку RO, мы рекомендуем суспензировать RO. Аспират OsO4 в специальную бутылку для утилизации. - Удалите последнюю деионизированную воду для промывки и замените ~150 мкл на пробирку (обеспечьте полную инфильтрацию тканевых блоков) ацетата урана и закрасьте на 1-2 часа в RT. Защищайте микроцентрифужные пробирки от света.
- Извлеките ацетат урана и замените его 1 мл 50% ацетона в вытяжном шкафу, обезвоживая в течение 10 минут. Затем используйте 70%, 80%, 90%, 100% и 100% ацетон для последовательного градиентного обезвоживания RO. Каждое обезвоживание длится 10 минут.
ПРИМЕЧАНИЕ: Оставьте немного жидкости для замачивания RO для каждой замены, чтобы предотвратить воздействие воздуха и влаги. Кроме того, действуйте быстро как можно скорее, потому что ацетон летуч. Аспират урана ацетат в специальную бутылку для утилизации.
5. Проникновение
- Выбросьте ацетон и добавьте ~150 мкл смеси, состоящей из ацетона и смолы Эпон-812 в соотношении 1:1. Поместите его в духовку при температуре 37 °C на 1 час.
- Удалите вышеуказанную смесь и замените ее смесью, состоящей из ацетона и смолы Эпон-812 в соотношении 1:4. Поставьте его в духовку при температуре 37 °C на ночь.
- Осторожно переложите RO в новые пробирки, содержащие ~500 μL чистой эпоксидной смолы, и поместите их в духовку при температуре 45 °C на 1 час.
6. Встраивание
- Приготовьте 30-50 мл чистой эпоксидной смолы в центрифужной пробирке объемом 50 мл, заранее смешав набор реагентов в соответствии с инструкциями производителя. Медленно вращайте чистую эпоксидную смолу вверх дном в течение 30 минут, чтобы уменьшить количество пузырьков воздуха, попадающих в смеситель. Затем оставьте в духовке при температуре 37 °C на 20 минут. Добавьте 2/3 объема чистой эпоксидной смолы в паз закладной формы.
- Используйте зубочистку, чтобы зацепить RO в форму для встраивания, оснащенную чистой эпоксидной смолой.
- Заполните углубление чистой эпоксидной смолой до тех пор, пока она немного не выступит или не выпячится.
- Отрегулируйте положение RO на обоих концах закладной формы для направленной закладки. Поместите форму для заделки в духовку при температуре 45 °C на 1-2 часа, а затем поставьте в духовку при температуре 65 °C на 48-72 часа.
7. Полутонкое позиционирование
- Отшлифуйте излишки эпоксидной смолы вокруг ткани с концов более длинных четырех сторон закладного блока, чтобы сформировать трапециевидную поверхность. Установите закладной блок в стенд для крепления образца и закрутите болт с помощью L-образной отвертки. Затем установите стеклянные ножи на подставку для ножей и затяните гайку вручную.
- Обрежьте излишки смолы до тех пор, пока не обнажится нужная область.
- Наполните корыто стеклянного ножа водой. Нарежьте полутонкие ломтики до толщины 1 мкм с помощью полутонкого микротома и выложите их на предметное стекло микроскопа с помощью иглы.
- Добавьте 50 мкл 1% толуидинового синего для окрашивания полутонких ломтиков и выдерживайте в течение 1 минуты при температуре 95 °C на нагревательной пластине. Смыть дистиллированной водой в течение 2 минут. Используйте обычный оптический микроскоп с 20-кратным увеличением, чтобы наблюдать за структурой срезов.
8. Ультратонкая резка
- Установите закладные блоки и стеклянные ножи, как описано в шаге 7.1. Отрегулируйте расстояние между ножом и тканевым блоком, уровень жидкости в раковине и скорость нарезки. Ультратонкие срезы толщиной ~70-100 нм вырежьте ультратонким микротомом и зачерпните срезы на медную сетку (200 меш) с помощью поддерживающей пленки.
- Окрашивайте ультратонкие срезы 3% цитратом свинца в течение 15 минут для усиления контраста при процедуре двойного окрашивания.
9. Визуализация RO по TEM
- Запустите программу (см. Таблицу материалов).
- Нажмите на кнопку «Режим памяти» и примерно отметьте каждый ультратонкий участок.
- Поиск синаптических структур.
- Различают ламинированную структуру RO при малом увеличении.
- Найдите внешний ядерный слой (ONL), который показывает ядерную структуру с более глубокой электронной плотностью. Затем перейдите к окончанию фоторецептора, где скапливаются многочисленные везикулы. Ищите выводы стержней с помощью одной синаптической ленты и конусные терминалы с несколькими синаптическими лентами.
- Перейдите к внутреннему плексиформному слою (IPL) и найдите аналогичную структуру с помощью небольшой ленты.
- Сделайте микроскопическое изображение.
- Нажмите кнопку Пуск и введите соответствующую мощность увеличения.
- Сохраните изображения.
Результаты
Создание 3D RO с помощью дифференцировки iPSC является мощным инструментом для изучения механизмов заболевания сетчатки и заместительной терапии стволовыми клетками. Хотя другие продемонстрировали синаптические связи в РО функционально и иммуноцитохимически, прямые доказательства обычных и ленточных синапсов очень ограничены. В данной работе мы представляем метод исследования ультраструктуры двух типов синапсов в РО с помощью ПЭМ. После 180 дней культивирования RO фиксировали, окрашивали, встраивали и нарезали ультратонкими ломтиками. Наблюдение ПЭМ выявило ленточные синапсы на аксональных окончаниях фоторецепторов (рис. 1 и рис. 2), которые распределены в OPL. Под ПЭМ ленты палочек сферулируют вокруг синаптической инвагинации, образуя подковообразный профиль с горизонтальными ячейками (рис. 1). Стержни обычно имеют только одну ленту, но конусы имеют несколько лент (Рисунок 2). Кроме того, наблюдались классические химические синапсы между амакриновыми клетками в IPL (рис. 3). Согласно ПЭМ, химический синапс состоит из трех частей: пресинаптической, синаптической щели и постсинаптической. Клеточные мембраны, соответствующие пресинаптической и постсинаптической частям, немного толще остальных частей, а узкий промежуток между двумя мембранами называется синаптической щелей. В цитоплазме участка пресинаптической мембраны имеется много синаптических пузырьков. Это исследование подтверждает наличие полных синаптических связей в 3D RO, полученных из iPSC. Однако следует отметить, что неполная промывка между этапами приведет к выпадению в осадок черных частиц в процессе пробоподготовки (рис. 4).
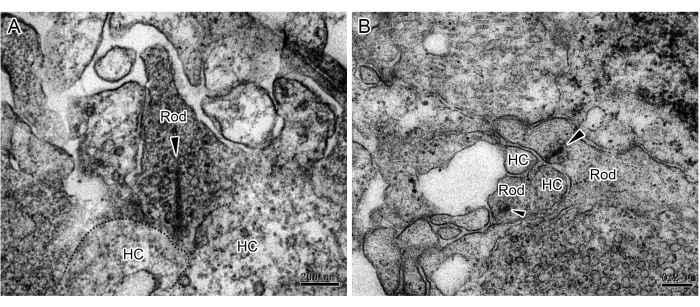
Рисунок 1: ПЭМ-изображения ленточных синапсов палочек в RO. (A,B) Стержень и горизонтальные клетки образуют подковообразный профиль. На каждой сферуле стержня в OPL RO наблюдалась одна лента (наконечники стрел), окруженная многочисленными везикулами. Масштабные линейки = 0,2 мкм. Сокращения: RO = органоиды сетчатки; HC = горизонтальная ячейка; OPL = наружный плексиформный слой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
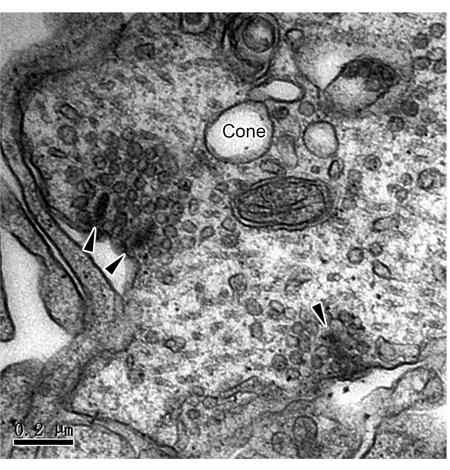
Рисунок 2: ПЭМ-изображения синапсов конусной ленты в RO. Три ленточных синапса (наконечника стрелы) были заметны на ножке конуса в ОПЛ РО. Масштабная линейка = 0,2 мкм. Сокращения: ТЭМ = просвечивающая электронная микроскопия; RO = органоиды сетчатки; OPL = наружный плексиформный слой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: ПЭМ-изображение химических синапсов в АФ. Между амакриновыми клетками в IPL-слое RO наблюдался обычный химический синапс. Химический синапс состоит из трех частей: пресинаптической, синаптической щели и постсинаптиче. В цитоплазме участка пресинаптической мембраны имеется много синаптических пузырьков. Стрелка обозначает направление синаптической передачи, указывая на перенос многочисленных везикул из одного процесса AC1 в другой профиль AC2. Масштабная линейка = 0,2 мкм. Сокращения: ТЭМ = просвечивающая электронная микроскопия; RO = органоиды сетчатки; IPL = внутренний плексиформный слой; ACs = амакриновые клетки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Пример проблемы, которая может возникнуть в процессе пробоподготовки. В ножке конуса много черных частичек (кругов) из-за неполного промывки между этапами. Стрелки: ленточный синапс. Масштабная линейка = 0,2 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В этой статье мы представили подробный протокол наблюдения за обычной и ленточной синаптической ультраструктурой в РО с помощью ПЭМ. Этот протокол основан на описанных ранее способах препарирования сетчатки с некоторыми модификациями20. Чтобы повысить процент успешности обработки образцов и качество микрофотографий ПЭМ, учитывайте следующие ключевые моменты. Во-первых, важно признать, что РО развиваются из иПСК, образуя клеточную массу, лишенную сосудистой сети 6,26 и глиальных клеток26. Это отсутствие может привести к менее компактной организации по сравнению с сетчаткой in vivo. Таким образом, очень важно бережно обращаться с Ros для сохранения их структуры и целостности. Добавьте жидкости вдоль стенки трубки, чтобы свести к минимуму беспокойство.
Важно обеспечить тщательное обезвоживание тканей на этапе протокола 4 и включить осушитель для снижения влажности в помещении перед началом этапа обезвоживания. При замене ацетона оперируйте быстро и оставьте немного жидкости, чтобы погрузить ткани, предотвращая серьезное разрушение структуры ткани RO. Необезвоженная ткань резко сокращается на больших высотах ЭМ, а вода в тканях препятствует проникновению встраивающего агента.
Поскольку RO представлены в виде прозрачных сфер, обеспечьте правильное направление при резке полутонких ломтиков для получения неповрежденных пластинчатых структур. Наконец, АФ на стадии 3 (примерно после D100-D150) считаются зрелыми и обладают интегральными синапсами12, в результате чего рекомендуется проводить исследование синаптических контактов, включая ленточные синапсы и химические синапсы, в этих РО.
Несмотря на то, что в предыдущих исследованиях были предоставлены ограниченные ультраструктурные доказательства существования синапсов ОО, нет подробностей о полной процедуре подготовки образцов ОО, а также идентификации различных типов синаптических структур 12,13,24. Capowski et al. использовали различные методы для исследования характеристик РО, индуцированных различными линиями hPSC на разных стадиях, включая электронные микрофотографии, показывающие существование ленточных синапсов, нагруженных везикулами, в ножке конуса, которые показали, что RO на стадии 3, индуцированные различными линиями hPSC, являются зрелыми и функциональными. Используя ПЭМ и двухфотонную визуализацию, Cowan et al. подтвердили формирование функциональных ленточных синаптических структур у зрелых RO13, но тип синапса не был указан (колбочковые или палочковые синапсы). Тем не менее, наши несколько партий результатов микрофотографии показали мембранную структуру ленточных синапсов с идеальной четкостью и контрастностью, что иллюстрирует, что наш метод осуществим и воспроизводим. Кроме того, мы идентифицировали различные типы синапсов в соответствии с их различными морфологическими характеристиками: синапсы колбочек обычно больше и имеют несколько лент, в то время как синапсы палочек обычно меньше, показывая только одну ленту; В химических синапсах везикулы накапливаются в пресинаптических структурах, и электронная плотность синаптической щели увеличивается.
Ультраструктурная целостность синаптических контактов у АФ жизненно важна для их функционирования. Использование ПЭМ для исследования этих контактов дает широкие и значительные преимущества в различных областях, таких как изучение патогенеза сетчатки in vitro, проведение скрининга лекарственных препаратов при РО и оценка методов дифференцировки РО, среди прочего. При использовании 2D ПЭМ-визуализации можно наблюдать только определенный аспект ультраструктуры АФ, что затрудняет стереоскопический анализ всей структуры синапса. Кроме того, ограниченность дифференцировки способствует неправильному расположению клеток13,26, что еще больше усложняет процесс наблюдения. Таким образом, сочетание объемной ЭМ с 3D реконструкцией может преодолеть эти недостатки в будущем.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Эта работа была частично поддержана грантами Национальной программы ключевых исследований и разработок Китая (2022YFA1105503), Государственной ключевой лаборатории нейронаук (SKLN-202103) и Чжэцзянского фонда естественных наук Китая (Y21H120019), Фонда естественных наук Китая (82070981).
Материалы
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Corning | 430167 | |
| Acetone | Electron Microscopy Science | 10000 | |
| B27 supplement | Gibco | A3582801 | |
| Cell lifter | Santa Cruz | sc-395251 | |
| Copper grids | Beijing Zhongjingkeyi Technology Co., Ltd. | AZH400HH | |
| DigitalMicrograph Software | Gatan, Inc. | Software | |
| Dispase | StemCell Technologies | #07913 | Bacterial protease |
| DMEM/F12 medium | Gibco | #11320033 | |
| Embedding mold | Beijing Zhongjingkeyi Technology Co., Ltd. | GZ10592 | |
| Epon-812 resin | Electron Microscopy Science | #14900 | |
| Fetal Bovine Serum (FBS) | Biological Industries | #04-0021A | |
| Glutaraldehyde | Electron Microscopy Science | 16020 | |
| hiPSC | Shownin Biotechnology Co. Ltd. | RC01001-A | |
| Lead citrate | Beijing Zhongjingkeyi Technology Co., Ltd. | GZ02618 | |
| L-GlutaMax | Life Technologies | #35050061 | L-glutamine substitute |
| Matrigel | Corning | 356234 | |
| Microscope slide | CITOTEST | 80312-3161 | |
| N2 supplement | Gibco | 17502048 | |
| Na2HPO4· 12H2O | Sigma | 71650 | A component of PB/PBS |
| NaH2PO4· H2O | Sigma | 71507 | A component of PB/PBS |
| Non-essential amino acids | Sigma | #M7145 | |
| Optical microscope | Lab Binocular Biological Microscope | Xsz-107bnii | |
| OsO4 | TED PELLA | 4008-160501 | |
| Oven | Bluepard | BPG9040A | |
| Paraformaldehyde | Electron Microscopy Science | 157-8 | |
| Penicillin-Streptomycin | Gibco | #15140-122 | |
| Semi/ultrathin microtome | Reichert-Jung | 396649 | |
| Taurine | Sigma | #T0625 | |
| Toluidine blue | Sangon Biotech | E670105-0100 | |
| Transmission Electron Microscopes | HITACHI | H-7500 | |
| Uranyl acetate | TED PELLA | CA96049 | |
| β-mercaptoethanol | Sigma | 444203 |
Ссылки
- Andreazzoli, M., Barravecchia, I., De Cesari, C., Angeloni, D., Demontis, G. C. Inducible pluripotent stem cells to model and treat inherited degenerative diseases of the outer retina: 3d-organoids limitations and bioengineering solutions. Cells. 10 (9), 2489 (2021).
- Moser, T., Grabner, C. P., Schmitz, F. Sensory processing at ribbon synapses in the retina and the cochlea. Physiol Rev. 100 (1), 103-144 (2020).
- Tom Dieck, S., Brandstätter, J. H. Ribbon synapses of the retina. Cell Tissue Res. 326 (2), 339-346 (2006).
- Kolb, H., Fernandez, E., Nelson, R. . Webvision: The organization of the retina and visual. , (1995).
- Soto, F., Zhao, L., Kerschensteiner, D. Synapse maintenance and restoration in the retina by ngl2. Elife. 7, e30388 (2018).
- Kruczek, K., Swaroop, A. Pluripotent stem cell-derived retinal organoids for disease modeling and development of therapies. Stem Cells. 38 (10), 1206-1215 (2020).
- O'Hara-Wright, M., Gonzalez-Cordero, A. Retinal organoids: A window into human retinal development. Development. 147 (24), (2020).
- Norrie, J. L., et al. Retinoblastoma from human stem cell-derived retinal organoids. Nat Commun. 12 (1), 4535 (2021).
- Luni, C., Serena, E., Elvassore, N. Human-on-chip for therapy development and fundamental science. Curr Opin Biotechnol. 25, 45-50 (2014).
- Chahine Karam, F., et al. Human ipsc-derived retinal organoids and retinal pigment epithelium for novel intronic rpgr variant assessment for therapy suitability. J Pers Med. 12 (3), 502 (2022).
- Lo, J., et al. Therapeutic strategies for glaucoma and optic neuropathies. Mol Aspects Med. 94, 101219 (2023).
- Capowski, E. E., et al. Reproducibility and staging of 3d human retinal organoids across multiple pluripotent stem cell lines. Development. 146 (1), 171686 (2019).
- Cowan, C. S., et al. Cell types of the human retina and its organoids at single-cell resolution. Cell. 182 (6), 1623-1640 (2020).
- Cora, V., et al. A cleared view on retinal organoids. Cells. 8 (5), 391 (2019).
- Żak, A. M. Light-induced in situ transmission electron microscopy─development, challenges, and perspectives. Nano Lett. 22 (23), 9219-9226 (2022).
- Tschulakow, A. V., Oltrup, T., Bende, T., Schmelzle, S., Schraermeyer, U. The anatomy of the foveola reinvestigated. PeerJ. 6, e4482 (2018).
- Syrbe, S., et al. Müller glial cells of the primate foveola: An electron microscopical study. Exp Eye Res. 167, 110-117 (2018).
- Xiao, J., et al. Rod bipolar cells receive cone photoreceptor inputs through both invaginating synapses and flat contacts in the mouse and guinea pig retinas. J Comp Neurol. 531 (11), 1184-1197 (2023).
- Liu, X., et al. Retinal degeneration in rpgra mutant zebrafish. Front Cell Dev Biol. 11, 1169941 (2023).
- Yang, Q., et al. Expression of α-synuclein in the mouse retina is confined to inhibitory presynaptic elements. J Comp Neurol. 531 (10), 1057-1079 (2023).
- Zhang, J., et al. Early degeneration of photoreceptor synapse in ccl2/cx3cr1-deficient mice on crb1(rd8) background. Synapse. 67 (8), 515-531 (2013).
- De Robertis, E., Franchi, C. M. Electron microscope observations on synaptic vesicles in synapses of the retinal rods and cones. J Biophys Biochem Cytol. 2 (3), 307-318 (1956).
- Frey, T. G., Mannella, C. A. The internal structure of mitochondria. Trends Biochem Sci. 25 (7), 319-324 (2000).
- Gonzalez-Cordero, A., et al. Recapitulation of human retinal development from human pluripotent stem cells generates transplantable populations of cone photoreceptors. Stem Cell Reports. 9 (3), 820-837 (2017).
- Gao, M. L., et al. Patient-specific retinal organoids recapitulate disease features of late-onset retinitis pigmentosa. Front Cell Dev Biol. 8, 128 (2020).
- Afanasyeva, T. a. V., et al. A look into retinal organoids: Methods, analytical techniques, and applications. Cell Mol Life Sci. 78 (19-20), 6505-6532 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены