Method Article
투과 전자 현미경을 위한 망막 오가노이드 시료 준비
요약
이 프로토콜은 투과 전자 현미경을 위한 망막 오가노이드 샘플에 대한 최적화되고 정교한 준비 절차를 제공합니다. 성숙한 망막 오가노이드의 시냅스 분석과 관련된 응용 분야에 적합합니다.
초록
망막 오가노이드(RO)는 특정 조건에서 유도만능줄기세포(iPSC)와 구별된 인간의 망막 특징을 모방한 3차원 배양 시스템입니다. RO에서의 시냅스 발달 및 성숙은 면역세포화학적, 기능적으로 연구되어 왔습니다. 그러나 시냅스 접촉 초세구조의 직접적인 증거는 제한적이며, 특수 리본 시냅스와 기존의 화학적 시냅스를 모두 포함합니다. 투과 전자 현미경(TEM)은 고해상도와 인간과 다양한 종의 망막 발달 및 시냅스 성숙을 설명하는 존경할 만한 역사가 특징입니다. RO의 시냅스 구조를 탐구하는 강력한 도구이며 RO의 연구 분야에서 널리 사용됩니다. 따라서 나노 스케일에서 RO 시냅스 접촉의 구조를 더 잘 탐구하고 고품질의 현미경 증거를 얻기 위해 간단하고 반복 가능한 RO TEM 샘플 준비 방법을 개발했습니다. 이 백서에서는 프로토콜, 사용된 시약, RO 고정 준비, 사후 고정, 임베딩 및 시각화를 포함한 자세한 단계를 설명합니다.
서문
인간과 포유류의 중요한 시각 감각 기관인 망막은 뉴런 소마를 수용하는 3개의 핵층과 기존 시냅스와 특수 리본 시냅스 2,3을 포함한 시냅스 연결1에 의해 형성된 2개의 망상층을 특징으로 하는 뚜렷한 적층 구조를 나타냅니다. 리본 시냅스는 단계적 방식으로 소포 자극을 전달하는 데 중요한 역할을 합니다 2,3. 시각 과정은 뉴런과 시냅스의 다양한 수준을 가로지르는 전기 광학 신호 전달을 포함하며, 궁극적으로 시각 피질 4,5에 도달합니다.
망막 오가노이드(RO)는 유도만능줄기세포(iPSC)에서 유래한 3차원(3D) 배양 시스템을 나타내며, in vitro 1,6,7 망막 조직의 생리학적 상태를 모방합니다. 이 접근법은 망막 질환8, 약물 스크리닝9을 연구하고, 색소성 망막염(retinitis pigmentosa)10 및 녹내장(glaucoma)11과 같은 비가역적 망막 퇴행성 질환에 대한 잠재적 치료법으로 사용될 수 있는 가능성을 제시한다. 강력한 체외 광학 전도 시스템인 RO 내의 시냅스는 효과적인 신호 변환 및 전달을 촉진하는 중요한 구조입니다5.
RO 발달은 형태학적 특성과 분자 발현 프로파일에 따라 크게 3단계로 나눌 수 있습니다 6,12. 1기(D21-D60 경)의 RO는 망막의 신경 전구 세포, 많은 망막 신경절 세포(RGC) 및 인간 태아 발달의 첫 번째 시기에 해당하는 몇 개의 별폭발 무축삭 세포(SAC)로 구성됩니다. 2단계(약 D50-D150)에서 RO는 일부 광수용체 전구체, 인터뉴런 및 시냅토 형성 관련 유전자를 발현하며, 이는 전이 단계를 나타냅니다. 광수용체는 인간 태아 발달의 세 번째 단계에 해당하는 3단계 RO(D100-D150 이후)에서 성숙을 이룬다(D100-D150 이후) 6,12,13. 주목할 만한 점은, 1기 및 2기의 RO와 비교했을 때, 3기의 RO는 리본 시냅스(ribbon synapses)14의 존재를 포함하여 시냅스(synapses)가 12개 성숙한 뚜렷한 라멜라 구조를 가지고 있다. 더욱이, 최근의 한 연구는 성숙한 시냅스가 빛 신호의 전달에 존재한다는 것을 확인했으며, 이는 시냅스가 기능적임을 나타낸다13. 따라서 3단계의 RO는 종종 시냅스 구조를 조사하기 위해 선택됩니다.
면역조직화학은 다양한 분자 단백질의 발현 연구에 널리 적용됩니다. 그러나 광학 현미경의 한계는 한 번에 제한된 수의 특정 세포와 분자만 관찰할 수 있기 때문에 세포와 주변 환경 간의 관계에 대한 포괄적인 분석이 부족하다는 것입니다. 투과 전자 현미경(TEM)은 0.1-0.2nm의 제한된 해상도로 고해상도가 특징이며 광학 현미경을 ~10-20배15배 능가합니다. 그것은 광학 현미경의 결함을 보완하고 인간16,17 및 다양한 종 18,19,20,21에서 망막 발달 및 시냅스 성숙을 설명하는 데 사용됩니다. TEM은 시냅스전(presynaptic) 및 시냅스후(postsynaptic) 구성 요소(18,20)를 직접 구별할 수 있으며, 리본(ribbons) 2,3, 소포(vesicles)22 및 미토콘드리아(mitochondria)(23)와 같은 세포 내 구조를 포괄적으로 관찰할 수 있습니다. 따라서 TEM은 시냅스 유형을 식별하고 나노 스케일에서 RO의 시냅스 접촉의 미세 구조를 탐구하는 데 필수적인 도구입니다.
샘플 준비는 고품질 전자 현미경 사진을 획득하는 데 매우 중요하다는 점에 유의하는 것이 중요합니다. 일부 연구에서 RO 12,13,24에 대해 EM을 수행했지만 자세한 절차는 불분명합니다. 전자 현미경 이미지의 품질은 RO 고정 및 시약 투과의 효과에 크게 좌우되기 때문에 준비 중에 여러 가지 중요한 요소를 고려해야 합니다. 결과적으로, RO의 시냅스 접촉을 더 잘 조사하기 위해 RO 고정, 임베딩 및 관찰 부위 식별의 작동 지점을 보여주는 재현성이 우수한 방법을 제시합니다.
프로토콜
1. iPSC에서 RO 얻기25
참고: RO는 이전에 보고된 절차를 수정하여 iPSC에서 파생되었습니다.
- 박테리아 프로테아제를 사용하여 ~90% 합류점에서 iPSC를 해리합니다( 재료 표 참조). 콜로니를 조각으로 자르고 셀 리프터로 긁어냅니다.
- 채취 후 세포 클러스터를 0.25mL의 얼음처럼 차가운 Matrigel에 재현탁시킵니다. 37°C에서 20분 배양한 후 응고된 겔에 DMEM/F12 배지(0.5% N2 보충제, 1% B27 보충제, 0.1mM β-메르캅토에탄올, 0.2mM L-글루타민 대체물, 100U/mL 페니실린 및 100mg/mL 스트렙토마이신)를 뿌립니다. 이 시간을 차별화의 0일차로 정의합니다.
- 5일 동안 부유 배양 후 세포가 모여 세포 낭종을 형성합니다. 이 세포 낭종을 100mm 페트리 접시에 옮기면 이제 부착되고 자랍니다.
- 15일째에 박테리아 프로테아제를 사용하여 부착 세포를 해리하고 DMEM/F12 배지(2% B27 보충제, 0.1mM 비필수 아미노산)에서 배양합니다.
- 21일째에 20mL의 혈청 함유 배지(DMEM/F12 배지, 8% FBS, 2% B27 보충제, 100mM 타우린 및 2mM L-글루타민 대체물)로 배지를 교체하고 매주 배지를 교체합니다.
2. RO의 전방 고정
- 배양된 RO 중 하나(~D180, 직경 약 1~2mm 크기가 최적임)를 피펫으로 페트리 접시에서 1.5mL 마이크로 원심분리기 튜브로 부드럽게 이동하고 RO에 대한 관련 정보를 표시합니다.
알림: RO가 너무 큰 경우 RO를 반으로 자르거나 고정제가 들어 있는 접시에서 현미경으로 면도기로 제대로 구조화되지 않은 조직을 잘라냅니다. - 피펫으로 1.5mL 마이크로 원심분리기 튜브에서 배양 배지를 제거합니다. 0.1M 인산염 완충액(PB), pH 7.4에 희석한 2% 파라포름알데히드-2% 글루타르알데히드 고정제 1.5mL를 넣고 실온(RT)에서 4시간 동안 고정합니다. 마이크로 원심분리기 튜브를 4°C에서 밤새 보관합니다.
참고: 이 단계는 1주일 동안 일시 중지할 수 있지만 가능한 한 빨리 다시 시작하는 것이 좋습니다. RO가 더 오래 방치되면 세포의 자가분해를 일으켜 RO의 초세구조를 파괴할 수 있습니다. RO의 취약성으로 인해 회전, 진동, 뒤집기 또는 거친 작동을 피하십시오.
3. RO의 사후 고정
- 2% 파라포름알데히드-2% 글루타르알데히드 고정제를 제거하고 pH 7.4에서 0.01M 인산염 완충 식염수(PBS) 1mL로 3 x 10분 동안 세척합니다. 세척 과정에서 RO를 1.5mL 마이크로 원심분리기 튜브에 부드럽게 매달아 완전히 헹굽니다. 정착일이 추가될 때마다 세탁 횟수를 2회씩 늘려 잔류 정착제를 최대한 제거하십시오.
- 피펫을 사용하여 남아 있는 PBS를 제거하고 조직 블록이 잠길 때까지 ~150μL의 1% 오즈민산(OsO4)으로 교체합니다. 마이크로 원심분리기 튜브를 어두운 상자에 넣어 빛으로부터 보호하고 실온에서 1시간 동안 침투합니다.
알림: OsO4는 강력한 산화제이므로 흄 후드에서 처리해야 합니다.
4. 염색 및 탈수
알림: 이 단계에서 환경을 건조시키려면 제습기를 켜야 합니다.
- 피펫을 사용하여 OsO4를 제거하고 0.01M PBS(pH 7.4)로 3 x 10분 세척한 다음 탈이온수로 3 x 10분 세척합니다.
알림: RO를 완전히 헹구려면 RO를 일시 중단하는 것이 좋습니다. OsO4를 전용 폐기 병에 흡입합니다. - 마지막 탈이온수 세척을 제거하고 튜브당 ~150μL(조직 블록의 전체 침투 보장)로 아세트산우라늄을 교체하고 RT에서 1-2시간 동안 염색합니다. 미세 원심분리기 튜브를 빛으로부터 보호합니다.
- 우라늄 아세테이트를 제거하고 흄 후드에서 1mL의 50% 아세톤으로 교체하고 10분 동안 탈수합니다. 그런 다음 RO의 그래디언트 탈수를 위해 70%, 80%, 90%, 100% 및 100% 아세톤을 연속적으로 사용합니다. 각 탈수는 10분 동안 지속됩니다.
알림: 공기와 습기에 노출되는 것을 방지하기 위해 각 교환에 대해 RO를 담글 약간의 액체를 남겨 두십시오. 또한 아세톤은 휘발성이므로 가능한 한 빨리 작동하십시오. 우라늄 아세테이트를 전용 폐기 병에 흡입합니다.
5. 침투
- 아세톤을 버리고 아세톤과 Epon-812 수지로 구성된 혼합물의 ~ 150 μL를 1 : 1의 비율로 첨가하십시오. 37°C 오븐에 1시간 동안 굽습니다.
- 위의 혼합물을 제거하고 아세톤과 Epon-812 수지를 1:4의 비율로 혼합한 혼합물로 교체합니다. 37°C 오븐에 하룻밤 담가둡니다.
- RO를 ~500μL의 순수 에폭시 수지가 들어 있는 새 튜브로 조심스럽게 옮기고 45°C 오븐에 1시간 동안 넣습니다.
6. 임베딩
- 사전에 제조업체의 지침에 따라 시약 키트를 혼합하여 50mL 원심분리기 튜브에 30-50mL의 순수 에폭시 수지를 준비합니다. 순수 에폭시 수지를 30분 동안 천천히 거꾸로 회전시켜 믹서에서 유입되는 기포를 줄입니다. 그런 다음 37°C 오븐에 20분 동안 그대로 둡니다. 임베딩 몰드의 홈에 2/3 부피의 순수 에폭시 수지를 추가합니다.
- 이쑤시개를 사용하여 순수 에폭시 수지가 장착된 임베딩 금형에 RO를 집습니다.
- 홈이 약간 튀어나오거나 부풀어 오를 때까지 순수한 에폭시 수지로 홈을 채웁니다.
- 방향성 임베딩을 위해 임베딩 금형의 양쪽 끝에서 RO의 위치를 조정합니다. 임베딩 몰드를 45°C 오븐에 1-2시간 동안 넣은 다음 65°C 오븐에 48-72시간 동안 넣습니다.
7. 반 얇은 포지셔닝
- 임베딩 블록의 더 긴 4면 끝에서 조직 주위에 여분의 에폭시 수지를 샌딩하여 사다리꼴 면을 형성합니다. 임베딩 블록을 샘플 장착 스탠드에 설치하고 L 드라이버로 볼트를 조입니다. 그런 다음 나이프 스탠드에 유리 칼을 설치하고 너트를 수동으로 조입니다.
- 원하는 영역이 노출될 때까지 여분의 수지를 잘라냅니다.
- 유리 칼의 물통에 물을 채 웁니다. 반박형 마이크로톰을 사용하여 반박형 조각을 1μm 두께로 자르고 바늘로 현미경 슬라이드에 놓습니다.
- 50μL의 1% 톨루이딘 블루를 첨가하여 반박형 조각을 염색하고 가열판에서 95°C에서 1분 동안 배양합니다. 증류수로 2분 동안 헹굽니다. 20x 일반 광학 현미경을 사용하여 단면의 구조를 관찰합니다.
8. 초박형 단면
- 7.1단계에 설명된 대로 임베딩 블록과 유리 칼을 설치합니다. 칼과 티슈 블록 사이의 거리, 싱크대의 액체 높이, 슬라이싱 속도를 조정하십시오. 초박형 마이크로톰으로 ~70-100nm 두께의 초박형 부분을 자르고 지지 필름으로 구리 메쉬(200 메쉬)에 조각을 퍼냅니다.
- 이중 염색 절차에서 대비를 향상시키기 위해 3% 구연산염 3%로 초박형 절편을 염색합니다.
9. TEM에 의한 이미징 RO
- 소프트웨어를 실행합니다( 재료 표 참조).
- 메모리 모드 버튼을 클릭하고 각 초박형 섹션을 대략적으로 표시하십시오.
- 시냅스 구조를 검색합니다.
- 낮은 배율에서 RO의 적층 구조를 구별합니다.
- 더 깊은 전자 밀도를 가진 핵 구조를 보여주는 외부 핵층(ONL)을 찾습니다. 그 후, 수많은 소포가 축적되는 광수용체의 말단으로 이동합니다. 단일 시냅스 리본이 있는 rod terminals와 여러 synaptic ribbons가 있는 원뿔 말단을 검색합니다.
- 내부 망상층(IPL)으로 이동하여 작은 리본이 있는 유사한 구조를 찾습니다.
- 현미경 이미지를 캡처합니다.
- 시작을 클릭하고 해당 확대율을 입력합니다.
- 이미지를 저장합니다.
결과
iPSC 분화를 통한 3D RO의 확립은 망막 질환 메커니즘 및 줄기세포 대체 요법을 연구하기 위한 강력한 도구를 제공합니다. 다른 연구자들이 RO의 시냅스 연결을 기능적 및 면역세포화학적으로 입증했지만, 기존 시냅스와 리본 시냅스의 직접적인 증거는 매우 제한적입니다. 여기에서는 TEM에 의해 RO에서 두 가지 유형의 시냅스의 미세 구조를 조사하는 방법을 제시합니다. 180일 배양 후 RO를 고정, 염색, 매립 및 초박형 슬라이스했습니다. TEM 관찰은 OPL에 분포된 광수용체(그림 1 및 그림 2)의 축삭 말단에서 리본 시냅스를 밝혀냈습니다. TEM에서는 간상체의 리본이 시냅스 침입 주위를 구형으로 둘러싸고 수평 세포가 있는 말굽 모양의 프로필을 형성합니다(그림 1). 막대에는 일반적으로 하나의 리본만 있지만 원뿔에는 여러 개의 리본이 있습니다(그림 2). 또한, IPL의 무축삭 세포 사이의 고전적인 화학적 시냅스가 관찰되었습니다(그림 3). TEM에서 화학적 시냅스는 시냅스전(presynaptic), 시냅스 틈새(synaptic cleft), 시냅스후(postsynaptic)의 세 부분으로 구성됩니다. 시냅스전(presynaptic) 부분과 시냅스후(postsynaptic) 부분에 해당하는 세포막은 나머지 부분보다 약간 두껍고, 두 막 사이의 좁은 틈을 시냅스 틈(synaptic cleft)이라고 합니다. 시냅스전막 부위의 세포질에는 많은 시냅스 소포가 있습니다. 이 연구는 iPSC에서 파생된 3D RO에서 완전한 시냅스 연결의 존재를 확인합니다. 그러나 단계 사이에 불완전한 헹굼은 시료 준비 과정에서 검은색 입자가 침전될 수 있다는 점에 유의해야 합니다(그림 4).
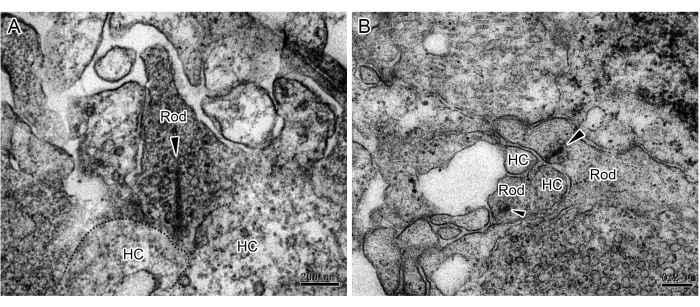
그림 1: ROs. (A,B)의 막대 리본 시냅스에 대한 TEM 이미지. 막대 세포와 수평 세포는 말굽 모양의 프로파일을 형성합니다. 단일 리본 (화살촉)은 수많은 소포로 둘러싸인 RO의 OPL에서 각 막대 구형에서 관찰되었습니다. 스케일 바 = 0.2 μm. 약어: ROs = 망막 오가노이드; HC = 수평 셀; OPL = 외부 망상층. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
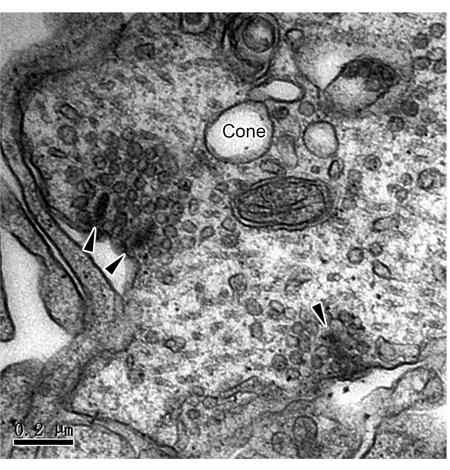
그림 2: RO의 원뿔 리본 시냅스의 TEM 이미지. 3개의 리본 시냅스(화살촉)는 RO의 OPL에서 원뿔 척추경에서 분명했습니다. 눈금 막대 = 0.2 μm. 약어: TEM = 투과 전자 현미경; RO = 망막 오가노이드; OPL = 외부 망상층. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: RO의 화학 시냅스에 대한 TEM 이미지. RO의 IPL 층에서 무축삭 세포 사이에서 종래의 화학적 시냅스가 관찰되었습니다. 화학적 시냅스는 시냅스전(presynaptic), 시냅스 틈새(synaptic cleft), 시냅스후(postsynaptic)의 세 부분으로 구성됩니다. 시냅스전막 부위의 세포질에는 많은 시냅스 소포가 있습니다. 화살표는 시냅스 전달 방향을 나타내며, 한 AC1 과정에서 다른 AC2 프로파일로 수많은 소포가 전달됨을 나타냅니다. 눈금 막대 = 0.2 μm. 약어: TEM = 투과 전자 현미경; RO = 망막 오가노이드; IPL = 내부 망상층; ACs = 무축삭 세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 시료 전처리 과정에서 발생할 수 있는 문제의 예. 원뿔 척추경에 많은 검은색 입자(원)가 있는데, 이는 단계 사이의 불완전한 헹굼 때문입니다. 화살표: 리본 시냅스. 스케일 바 = 0.2 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 기사에서는 TEM에 의한 RO의 기존 및 리본 시냅스 초미구조를 관찰하기 위한 자세한 프로토콜을 제시했습니다. 이 프로토콜은 이전에 설명한 망막 준비 방법에 기초하며, 약간의 변형이 가미되어있다(20). 샘플 처리의 성공률과 TEM 현미경 사진의 품질을 개선하려면 다음 핵심 사항을 고려하십시오. 첫째, RO가 iPSC에서 발생하여 혈관 구조 6,26 및 신경교 세포(26)가 결핍된 세포 덩어리를 형성한다는 것을 인정하는 것이 중요합니다. 이러한 부재는 생체 내 망막에 비해 덜 조밀한 조직으로 이어질 수 있습니다. 따라서 구조와 무결성을 유지하기 위해 Ros를 부드럽게 다루는 것이 중요합니다. 방해를 최소화하기 위해 튜브 벽을 따라 액체를 추가하십시오.
중요한 것은 프로토콜 4단계에서 조직의 철저한 탈수를 확인하고 탈수 단계를 시작하기 전에 제습기를 켜서 실내 습도를 낮추는 것입니다. 아세톤을 교체할 때는 신속하게 작동하고 조직이 잠길 수 있도록 약간의 액체를 남겨 두어 RO 조직 구조의 심각한 파괴를 방지하십시오. 건조되지 않은 조직은 높은 EM 고도에서 급격히 수축하며 조직 내의 물은 매립제의 침투를 방해합니다.
RO는 투명한 구로 존재하기 때문에 손상되지 않은 라멜라 구조를 얻기 위해 반박형 슬라이스를 절단할 때 올바른 방향을 보장하십시오. 마지막으로, 3단계(D100-D150 이후)의 RO는 성숙한 것으로 간주되고 통합 시냅스(12)를 가지고 있으며, 그 결과 리본 시냅스 및 화학적 시냅스를 포함한 시냅스 접촉에 대한 조사가 해당 RO에서 수행되는 것이 권장됩니다.
이전 연구에서 RO 시냅스에 대한 제한적인 초구조적 증거가 제공되었지만, RO 시료 준비의 전체 절차와 다양한 유형의 시냅스 구조 12,13,24의 식별에 대한 세부 정보는 없습니다. Capowski et al.은 원뿔 척추경에 소포가 있는 리본 시냅스의 존재를 보여주는 전자 현미경 사진을 포함하여 서로 다른 단계에서 서로 다른 hPSC 라인에 의해 유도된 RO의 특성을 조사하기 위해 다양한 기술을 사용했으며, 이를 통해 다양한 hPSC 라인에 의해 유도된 3단계의 RO가 성숙하고 기능적임을 밝혔습니다12. TEM 및 이광자 이미징을 사용하여 Cowan et al.은 성숙한 RO13에서 기능적 리본 시냅스 구조의 형성을 확인했지만 시냅스의 유형은 표시되지 않았습니다(원뿔 또는 막대 시냅스). 그러나 여러 배치의 현미경 사진 결과는 리본 시냅스의 막 구조를 이상적인 투명도와 대비로 보여주었으며, 이는 우리의 방법이 실현 가능하고 재현 가능하다는 것을 보여줍니다. 또한, 우리는 서로 다른 형태 학적 특성에 따라 다양한 유형의 시냅스를 식별했습니다 : 원뿔 시냅스는 일반적으로 더 크고 여러 개의 리본이 있는 반면 막대 시냅스는 일반적으로 더 작아서 하나의 리본만 보여줍니다. 화학적 시냅스에서는 소포가 시냅스전 구조에 축적되고 시냅스 틈의 전자 밀도가 향상됩니다.
RO에서 시냅스 접촉의 초구조적 무결성은 RO의 기능에 매우 중요합니다. TEM을 사용하여 이러한 접촉을 조사하면 체외 망막의 발병 기전 연구, RO에서 약물 스크리닝 수행, RO의 분화 기술 평가와 같은 다양한 분야에서 광범위하고 중요한 이점을 얻을 수 있습니다. 2D TEM 이미징으로는 RO 초미세 구조의 특정 측면만 관찰할 수 있어 시냅스의 전체 구조를 입체적으로 분석하기가 어렵습니다. 또한, 분화의 한계성은 잘못 배치된 세포(13,26)에 기여하여 관찰 과정을 더욱 복잡하게 만듭니다. 따라서 볼륨 EM과 3D 재구성을 결합하면 향후 이러한 단점을 극복할 수 있습니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 연구는 중국 국가핵심연구개발프로그램(National Key Research and Development Program of China, 2022YFA1105503), 국가핵심신경과학연구소(State Key Laboratory of Neuroscience, SKLN-202103), 중국 저장자연과학재단(Zhejiang Natural Science Foundation of China, Y21H120019), 중국자연과학재단(Natural Science Foundation of China, 82070981)의 보조금으로 일부 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Corning | 430167 | |
| Acetone | Electron Microscopy Science | 10000 | |
| B27 supplement | Gibco | A3582801 | |
| Cell lifter | Santa Cruz | sc-395251 | |
| Copper grids | Beijing Zhongjingkeyi Technology Co., Ltd. | AZH400HH | |
| DigitalMicrograph Software | Gatan, Inc. | Software | |
| Dispase | StemCell Technologies | #07913 | Bacterial protease |
| DMEM/F12 medium | Gibco | #11320033 | |
| Embedding mold | Beijing Zhongjingkeyi Technology Co., Ltd. | GZ10592 | |
| Epon-812 resin | Electron Microscopy Science | #14900 | |
| Fetal Bovine Serum (FBS) | Biological Industries | #04-0021A | |
| Glutaraldehyde | Electron Microscopy Science | 16020 | |
| hiPSC | Shownin Biotechnology Co. Ltd. | RC01001-A | |
| Lead citrate | Beijing Zhongjingkeyi Technology Co., Ltd. | GZ02618 | |
| L-GlutaMax | Life Technologies | #35050061 | L-glutamine substitute |
| Matrigel | Corning | 356234 | |
| Microscope slide | CITOTEST | 80312-3161 | |
| N2 supplement | Gibco | 17502048 | |
| Na2HPO4· 12H2O | Sigma | 71650 | A component of PB/PBS |
| NaH2PO4· H2O | Sigma | 71507 | A component of PB/PBS |
| Non-essential amino acids | Sigma | #M7145 | |
| Optical microscope | Lab Binocular Biological Microscope | Xsz-107bnii | |
| OsO4 | TED PELLA | 4008-160501 | |
| Oven | Bluepard | BPG9040A | |
| Paraformaldehyde | Electron Microscopy Science | 157-8 | |
| Penicillin-Streptomycin | Gibco | #15140-122 | |
| Semi/ultrathin microtome | Reichert-Jung | 396649 | |
| Taurine | Sigma | #T0625 | |
| Toluidine blue | Sangon Biotech | E670105-0100 | |
| Transmission Electron Microscopes | HITACHI | H-7500 | |
| Uranyl acetate | TED PELLA | CA96049 | |
| β-mercaptoethanol | Sigma | 444203 |
참고문헌
- Andreazzoli, M., Barravecchia, I., De Cesari, C., Angeloni, D., Demontis, G. C. Inducible pluripotent stem cells to model and treat inherited degenerative diseases of the outer retina: 3d-organoids limitations and bioengineering solutions. Cells. 10 (9), 2489 (2021).
- Moser, T., Grabner, C. P., Schmitz, F. Sensory processing at ribbon synapses in the retina and the cochlea. Physiol Rev. 100 (1), 103-144 (2020).
- Tom Dieck, S., Brandstätter, J. H. Ribbon synapses of the retina. Cell Tissue Res. 326 (2), 339-346 (2006).
- Kolb, H., Fernandez, E., Nelson, R. . Webvision: The organization of the retina and visual. , (1995).
- Soto, F., Zhao, L., Kerschensteiner, D. Synapse maintenance and restoration in the retina by ngl2. Elife. 7, e30388 (2018).
- Kruczek, K., Swaroop, A. Pluripotent stem cell-derived retinal organoids for disease modeling and development of therapies. Stem Cells. 38 (10), 1206-1215 (2020).
- O'Hara-Wright, M., Gonzalez-Cordero, A. Retinal organoids: A window into human retinal development. Development. 147 (24), (2020).
- Norrie, J. L., et al. Retinoblastoma from human stem cell-derived retinal organoids. Nat Commun. 12 (1), 4535 (2021).
- Luni, C., Serena, E., Elvassore, N. Human-on-chip for therapy development and fundamental science. Curr Opin Biotechnol. 25, 45-50 (2014).
- Chahine Karam, F., et al. Human ipsc-derived retinal organoids and retinal pigment epithelium for novel intronic rpgr variant assessment for therapy suitability. J Pers Med. 12 (3), 502 (2022).
- Lo, J., et al. Therapeutic strategies for glaucoma and optic neuropathies. Mol Aspects Med. 94, 101219 (2023).
- Capowski, E. E., et al. Reproducibility and staging of 3d human retinal organoids across multiple pluripotent stem cell lines. Development. 146 (1), 171686 (2019).
- Cowan, C. S., et al. Cell types of the human retina and its organoids at single-cell resolution. Cell. 182 (6), 1623-1640 (2020).
- Cora, V., et al. A cleared view on retinal organoids. Cells. 8 (5), 391 (2019).
- Żak, A. M. Light-induced in situ transmission electron microscopy─development, challenges, and perspectives. Nano Lett. 22 (23), 9219-9226 (2022).
- Tschulakow, A. V., Oltrup, T., Bende, T., Schmelzle, S., Schraermeyer, U. The anatomy of the foveola reinvestigated. PeerJ. 6, e4482 (2018).
- Syrbe, S., et al. Müller glial cells of the primate foveola: An electron microscopical study. Exp Eye Res. 167, 110-117 (2018).
- Xiao, J., et al. Rod bipolar cells receive cone photoreceptor inputs through both invaginating synapses and flat contacts in the mouse and guinea pig retinas. J Comp Neurol. 531 (11), 1184-1197 (2023).
- Liu, X., et al. Retinal degeneration in rpgra mutant zebrafish. Front Cell Dev Biol. 11, 1169941 (2023).
- Yang, Q., et al. Expression of α-synuclein in the mouse retina is confined to inhibitory presynaptic elements. J Comp Neurol. 531 (10), 1057-1079 (2023).
- Zhang, J., et al. Early degeneration of photoreceptor synapse in ccl2/cx3cr1-deficient mice on crb1(rd8) background. Synapse. 67 (8), 515-531 (2013).
- De Robertis, E., Franchi, C. M. Electron microscope observations on synaptic vesicles in synapses of the retinal rods and cones. J Biophys Biochem Cytol. 2 (3), 307-318 (1956).
- Frey, T. G., Mannella, C. A. The internal structure of mitochondria. Trends Biochem Sci. 25 (7), 319-324 (2000).
- Gonzalez-Cordero, A., et al. Recapitulation of human retinal development from human pluripotent stem cells generates transplantable populations of cone photoreceptors. Stem Cell Reports. 9 (3), 820-837 (2017).
- Gao, M. L., et al. Patient-specific retinal organoids recapitulate disease features of late-onset retinitis pigmentosa. Front Cell Dev Biol. 8, 128 (2020).
- Afanasyeva, T. a. V., et al. A look into retinal organoids: Methods, analytical techniques, and applications. Cell Mol Life Sci. 78 (19-20), 6505-6532 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유