Method Article
制备用于透射电子显微镜的视网膜类器官样品
摘要
该协议为用于透射电子显微镜的视网膜类器官样品提供了优化和详细的制备程序。它适用于涉及成熟视网膜类器官中突触分析的应用。
摘要
视网膜类器官 (ROs) 是一种三维培养系统,模拟在特定条件下从诱导多能干细胞 (iPSC) 分化而来的人类视网膜特征。RO 中的突触发育和成熟已在免疫细胞化学和功能上进行了研究。然而,突触接触超微结构的直接证据是有限的,包含特殊的带状突触和常规的化学突触。透射电子显微镜 (TEM) 的特点是高分辨率和可观的历史,阐明了人类和各种物种的视网膜发育和突触成熟。它是探索 ROs 突触结构的有力工具,广泛应用于 ROs 的研究领域。因此,为了更好地在纳米尺度上探索 RO 突触接触的结构并获得高质量的显微证据,我们开发了一种简单且可重复的 RO TEM 样品制备方法。本文描述了实验步骤、使用的试剂和详细步骤,包括 RO 固定准备、固定后、包埋和可视化。
引言
视网膜是人类和哺乳动物的重要视觉感觉器官,表现出独特的层状结构,其特征是三个核层容纳神经元胞体和两个由突触连接形成的丛状层1,包括常规突触和特化带状突触 2,3。带状突触在以分级方式传递囊泡冲动中起着至关重要的作用 2,3。视觉过程涉及电光信号跨不同层次的神经元和突触传输,最终到达视觉皮层 4,5。
视网膜类器官 (RO) 代表源自诱导多能干细胞 (iPSC) 的三维 (3D) 培养系统,在体外模拟视网膜组织的生理状态 1,6,7。这种方法有望用于研究视网膜疾病8 (retina diseases)、药物筛查9 (drug screening),并可作为不可逆视网膜退行性疾病(如视网膜色素变性10 和青光眼11)的潜在疗法。作为强大的体外光传导系统,RO 内的突触是促进有效信号转换和转移的关键结构5。
RO 发育根据其形态特征和分子表达谱大致可分为三个阶段 6,12。第 1 阶段 (D21-D60 左右) 的 RO 包括视网膜的神经祖细胞、许多视网膜神经节细胞 (RGC) 和一些星爆无长突细胞 (SAC),对应于人类胎儿发育的第一个时期。在第 2 阶段(D50-D150 左右),ROs 表达一些感光器前体、中间神经元和突触发生相关基因,这代表了一个过渡阶段。光感受器在第 3 阶段 RO (大约在 D100-D150 之后)发育成熟,对应于人类胎儿发育的第 3 阶段 6,12,13。值得注意的是,与第 1 阶段和第 2 阶段的 RO 相比,第 3 阶段的 RO 具有独特的层状结构,其突触已经成熟12,包括带状突触的存在14。此外,最近的一项研究证实,成熟的突触存在光信号的传递,表明它们具有功能性13。因此,通常选择第 3 阶段的 RO 来研究突触结构。
免疫组化广泛应用于研究各种分子蛋白的表达。然而,光学显微镜的局限性在于它一次只能观察有限数量的特定细胞和分子,导致缺乏对细胞与其周围环境之间关系的全面分析。透射电子显微镜 (TEM) 的特点是高分辨率,分辨率限制为 0.1-0.2 nm,比光学显微镜高出 ~10-20 倍15。它弥补了光学显微镜的缺陷,用于阐明人类16,17 和各种物种 18,19,20,21 的视网膜发育和突触成熟。TEM 能够直接区分突触前和突触后成分18,20,甚至允许全面观察亚细胞结构,如丝带 2,3、囊泡22 和线粒体23。因此,TEM 是在纳米尺度上识别突触类型和探索 RO 中突触接触超微结构的重要工具。
需要注意的是,样品制备对于获得高质量的电子显微照片非常重要。尽管一些研究对 ROs12、13、24 进行了 EM,但详细程序尚不清楚。由于电镜图像的质量在很大程度上取决于 RO 固定和试剂渗透的效果,因此在制备过程中需要考虑各种重要因素。因此,为了更好地研究 ROs 中的突触接触,我们提出了一种具有良好重现性的方法,该方法显示了 RO 固定、嵌入和观察位点识别的操作点。
研究方案
1. 从 iPSC 获得 RO25
注意:RO 是通过修改先前报道的程序从 iPSC 衍生的。
- 使用细菌蛋白酶以 ~90% 汇合度解离 iPSC(参见 材料表)。将菌落切成块,然后用细胞提升器刮擦。
- 收集后,将细胞簇重悬于 0.25 mL 冰冷的 Matrigel 中。在 37 °C 下孵育 20 分钟后,用 DMEM/F12 培养基(0.5% N2 补充剂、1% B27 补充剂、0.1 mM β-巯基乙醇、0.2 mM L-谷氨酰胺替代品、100 U/mL 青霉素和 100 mg/mL 链霉素)分散固化凝胶。将此时间定义为分化的第 0 天。
- 漂浮培养 5 天后,细胞分组形成细胞包囊。将这些细胞囊肿转移到 100 mm 培养皿中,它们现在将粘附并生长。
- 第 15 天,使用细菌蛋白酶解离粘附细胞,并在 DMEM/F12 培养基(2% B27 补充剂,0.1 mM 非必需氨基酸)中培养它们。
- 第 21 天,用 20 mL 含血清培养基(DMEM/F12 培养基、8% FBS、2% B27 补充剂、100 mM 牛磺酸和 2 mM L-谷氨酰胺替代品)更换培养基,并每周更换培养基。
2. RO 前固定
- 用移液管将其中一个培养的 RO(~D180,直径约为 1~2 mm 的尺寸最佳)从培养皿中轻轻移动到 1.5 mL 微量离心管中,并标记有关 RO 的相关信息。
注意:如果 RO 太大,请在显微镜下将 RO 切成两半或用剃刀在含有固定剂的培养皿中切掉结构不良的组织。 - 用移液管从 1.5 mL 微量离心管中取出培养基。加入 1.5 mL 2% 多聚甲醛-2% 戊二醛固定剂,在 0.1 M 磷酸盐缓冲液 (PB) 中稀释,pH 值为 7.4,并在室温 (RT) 下固定 4 小时。将微量离心管在4°C下储存过夜。
注意:此步骤可以暂停 1 周,但建议尽早重新启动。如果 ROs 放置时间较长,可能会导致细胞自溶,从而导致 ROs 的超微结构被破坏。由于 RO 的脆弱性,请避免旋转、摆动、翻转或苛刻的操作。
3. RO 的固定后
- 去除 2% 多聚甲醛-2% 戊二醛固定剂,用 1 mL 0.01 M 磷酸盐缓冲盐水 (PBS) 在 pH 7.4 下洗涤 3 x 10 分钟。在洗涤过程中,将 RO 轻轻悬浮在 1.5 mL 微量离心管中,以便充分冲洗。对于每增加一天的固定,将洗涤次数增加 2 次,以尽可能多地去除残留的固定剂。
- 使用移液管去除任何剩余的 PBS,并用 ~150 μL 的 1% 渗透酸 (OsO4) 替换,直到组织块被淹没。将微量离心管放在暗箱中以保护它们避光并在室温下渗透 1 小时。
注意:OsO4 是一种强氧化剂,必须在通风橱中处理。
4. 染色和脱水
注意: 必须打开除湿机才能从此步骤开始干燥环境。
- 使用移液管去除 OsO 4 ,用 0.01 M PBS (pH 7.4) 洗涤 3 x 10 分钟,然后用去离子水洗涤 3 x 10 分钟。
注意:为确保 RO 完全冲洗,我们建议暂停 RO。将 OsO4 吸出到专用的处理瓶中。 - 去除最后的去离子水洗涤液,每管更换为 ~150 μL(确保组织块完全浸润)乙酸铀,并在室温下染色 1-2 小时。保护微量离心管避光。
- 取出乙酸铀,在通风橱中用 1 mL 50% 丙酮替换,脱水 10 分钟。然后,依次使用 70%、80%、90%、100% 和 100% 丙酮对 ROs 进行梯度脱水。每次脱水持续 10 分钟。
注意:每次更换时,请留下一些液体浸泡 RO,以防止暴露在空气和湿气中。此外,由于丙酮易挥发,请尽快操作。将乙酸铀吸入专用的处理瓶中。
5. 渗透
- 弃去丙酮,以 1:1 的比例加入 ~150 μL 由丙酮和 Epon-812 树脂组成的混合物。将其置于 37 °C 的烤箱中 1 小时。
- 除去上述混合物,并以 1:4 的比例用丙酮和 Epon-812 树脂组成的混合物替换。将其置于 37 °C 的烘箱中过夜。
- 小心地将 RO 转移到含有 ~500 μL 纯环氧树脂的新管中,并将它们放入 45 °C 的烘箱中 1 小时。
6. 嵌入
- 根据制造商的说明,提前混合试剂盒,在 50 mL 离心管中制备 30-50 mL 纯环氧树脂。将纯环氧树脂缓慢倒置旋转 30 分钟,以减少混合器引入的气泡。然后,将其置于 37 °C 的烘箱中 20 分钟。将 2/3 体积的纯环氧树脂加入包埋模具的凹槽中。
- 使用牙签将 RO 拾取到装有纯环氧树脂的包埋模具中。
- 用纯环氧树脂填充凹槽,直到它略微突出或凸起。
- 调整包埋模具两端 RO 的位置,进行定向包埋。将包埋模具置于 45 °C 烘箱中 1-2 小时,然后将其放入 65 °C 烘箱中 48-72 小时。
7. 半薄定位
- 从包埋块较长的四个边的末端打磨组织周围多余的环氧树脂,形成梯形面。将包埋块安装到样品安装架上,然后用 L 型螺丝刀拧紧螺栓。然后,将玻璃刀安装在刀架上并手动拧紧螺母。
- 修剪掉多余的树脂,直到露出所需的区域。
- 将玻璃刀的槽装满水。使用半薄切片机将半薄切片切成 1 μm 的厚度,然后用针将它们放在显微镜载玻片上。
- 加入 50 μL 1% 甲苯胺蓝,对半薄片进行染色,并在 95 °C 下在加热板上孵育 1 分钟。用蒸馏水冲洗 2 分钟。使用 20 倍普通光学显微镜观察切片的结构。
8. 超薄切片
- 按照步骤 7.1 中的说明安装嵌入块和玻璃刀。调整刀与组织块的距离、水槽的液位和切片速度。用超薄切片机切下厚度为 ~70-100 nm 的超薄切片,并将切片舀到带有支撑膜的铜网(200 目)上。
- 用 3% 柠檬酸铅对超薄切片染色 15 分钟,以增强双重染色程序中的对比度。
9. TEM 成像 RO
- 启动软件(参见 材料表)。
- 单击 Memory mode(内存模式 )按钮并粗略标记每个超薄部分。
- 搜索突触结构。
- 在低放大倍率下区分 RO 的层压结构。
- 找到外核层 (ONL),它显示了具有更深电子密度的核结构。随后,导航到光感受器的末端,那里积聚了大量囊泡。搜索具有单个突触带的杆状末端和具有多个突触带的视锥末端。
- 移动到内部丛状层 (IPL) 并寻找带有小带状的类似结构。
- 捕获显微图像。
- 点击 Start 开始 并输入相应的放大倍数。
- 保存图像。
结果
通过 iPSC 分化建立 3D RO 为研究视网膜疾病机制和干细胞替代疗法提供了强大的工具。尽管其他人已经在功能和免疫细胞化学上证明了 RO 中的突触连接,但常规突触和带状突触的直接证据非常有限。在这里,我们提出了一种通过 TEM 研究 ROs 中两种突触超微结构的方法。培养 180 天后,对 ROs 进行固定、染色、包埋和超薄切片。TEM 观察显示光感受器轴突末端的带状突触(图 1 和 图 2),它们分布在 OPL 中。在 TEM 下,杆状球带围绕突触内陷,形成带有水平细胞的马蹄形轮廓(图 1)。杆通常只有一个带,但球果有多个带(图 2)。此外,观察到 IPL 中无长突细胞之间的经典化学突触(图 3)。在 TEM 下,化学突触由三部分组成:突触前、突触裂隙和突触后。对应于突触前和突触后部分的细胞膜比其他部分略厚,两层膜之间的狭窄间隙称为突触裂隙。突触前膜部位的细胞质中有许多突触囊泡。本研究证实了源自 iPSC 的 3D RO 中存在完整的突触连接。然而,应该注意的是,步骤之间的不完全冲洗会导致样品制备过程中黑色颗粒沉淀(图 4)。
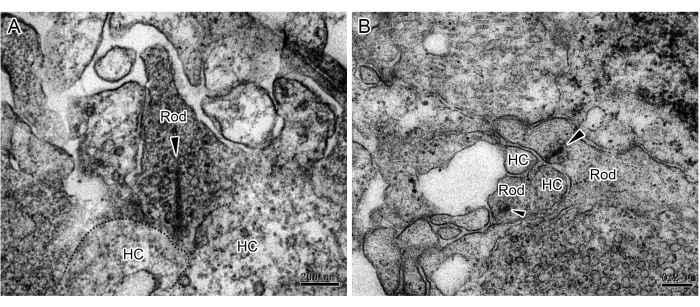
图 1:RO 中杆带突触的 TEM 图像。 (A,B) 杆状细胞和水平细胞形成马蹄形轮廓。在 ROs 的 OPL 中的每个杆状球体处观察到一条带状(箭头),周围环绕着许多囊泡。比例尺 = 0.2 μm。缩写:ROs = 视网膜类器官;HC = 水平单元格;OPL = 外丛状层。 请单击此处查看此图的较大版本。
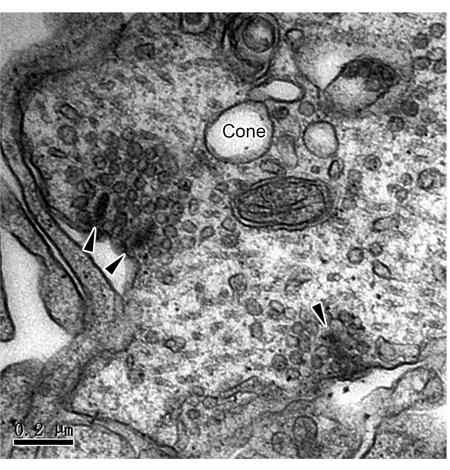
图 2:RO 中视锥带突触的 TEM 图像。 在 ROs 的 OPL 中的锥形蒂处有 3 个带状突触 (箭头) 很明显。比例尺 = 0.2 μm。缩写: TEM = 透射电子显微镜;ROs = 视网膜类器官;OPL = 外丛状层。 请单击此处查看此图的较大版本。

图 3:RO 中化学突触的 TEM 图像。 在 RO 的 IPL 层中的无长突细胞之间观察到常规化学突触。化学突触由三部分组成:突触前、突触裂隙和突触后。突触前膜部位的细胞质中有许多突触囊泡。箭头表示突触传递的方向,表示大量囊泡从一个 AC1 突转移到另一个 AC2 轮廓。比例尺 = 0.2 μm。缩写: TEM = 透射电子显微镜;ROs = 视网膜类器官;IPL = 内丛状层;ACs = 无长突细胞。 请单击此处查看此图的较大版本。

图 4:样品制备过程中可能出现的问题示例。 由于步骤之间的冲洗不完全,锥形椎弓根中有很多黑色颗粒(圆圈)。箭头:丝带突触。比例尺 = 0.2 μm。 请点击此处查看此图的较大版本。
讨论
在本文中,我们提出了一种通过 TEM 观察 RO 中常规突触超微结构和带状突触超微结构的详细方案。该方案基于先前描述的视网膜制备方法,并进行了一些修改20。为了提高样品处理的成功率和 TEM 显微照片的质量,请考虑以下关键点。首先,重要的是要承认 RO 从 iPSC 发育而来,形成缺乏脉管系统 6,26 和神经胶质细胞26 的细胞团。与体内视网膜相比,这种缺失可能导致组织不那么紧凑。因此,轻柔地处理 Ros 以保持其结构和完整性至关重要。沿管壁添加液体以尽量减少干扰。
重要的是,确保在方案步骤 4 中彻底脱水组织,并在开始脱水步骤之前打开除湿机以降低室内湿度。更换丙酮时,应快速操作并留下一些液体浸没组织,以防止 RO 组织结构的严重破坏。未脱水的组织在高 EM 高度急剧收缩,组织中的水会阻碍包埋剂的渗透。
由于 RO 以透明球体的形式存在,因此在切割半薄片时确保正确的方向以获得完整的层状结构。最后,第 3 阶段(大约 D100-D150 之后)的 RO 被认为是成熟的,并且具有完整的突触12,因此,建议在这些 RO 中进行突触接触的研究,包括带状突触和化学突触。
尽管在以前的研究中提供了有限的 RO 突触的超微结构证明,但没有关于 RO 样品制备的完整过程以及各种类型突触结构鉴定的细节 12,13,24。Capowski 等人使用不同的技术研究了不同 hPSC 系在不同阶段诱导的 ROs 的特征,包括电子显微镜照片显示视锥蒂中存在充满囊泡的带状突触,这表明由各种 hPSC 系诱导的第 3 阶段 ROs 是成熟的和功能性的12。使用 TEM 和双光子成像,Cowan 等人证实了成熟 RO13 中功能性带状突触结构的形成,但没有说明突触的类型(圆锥或杆突触)。然而,我们的几批显微照片结果显示带状突触的膜结构具有理想的清晰度和对比度,这说明我们的方法是可行且可重复的。此外,我们根据突触的不同形态特征确定了不同类型的突触:视锥突触通常较大且有几条带状突触,而杆状突触通常较小,仅显示一条带状突触;在化学突触中,囊泡在突触前结构中积累,突触裂隙的电子密度增强。
RO 中突触接触的超微结构完整性对其功能至关重要。使用 TEM 研究这些接触在各个领域具有广泛而显着的优势,例如在体外研究视网膜的发病机制、在 RO 中进行药物筛选以及评估 RO 的分化技术等应用。受 2D TEM 成像的限制,只能观察到 ROs 超微结构的特定方面,这使得立体分析突触的整个结构具有挑战性。此外,分化的边界性导致细胞错位13,26,使观察过程进一步复杂化。因此,将体积 EM 与 3D 重建相结合可能会在未来克服这些缺点。
披露声明
作者没有需要披露的利益冲突。
致谢
这项工作部分得到了中国国家重点研发计划 (2022YFA1105503)、神经科学国家重点实验室 (SKLN-202103) 和浙江省自然科学基金 (Y21H120019)、中国自然科学基金 (82070981) 的资助。
材料
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Corning | 430167 | |
| Acetone | Electron Microscopy Science | 10000 | |
| B27 supplement | Gibco | A3582801 | |
| Cell lifter | Santa Cruz | sc-395251 | |
| Copper grids | Beijing Zhongjingkeyi Technology Co., Ltd. | AZH400HH | |
| DigitalMicrograph Software | Gatan, Inc. | Software | |
| Dispase | StemCell Technologies | #07913 | Bacterial protease |
| DMEM/F12 medium | Gibco | #11320033 | |
| Embedding mold | Beijing Zhongjingkeyi Technology Co., Ltd. | GZ10592 | |
| Epon-812 resin | Electron Microscopy Science | #14900 | |
| Fetal Bovine Serum (FBS) | Biological Industries | #04-0021A | |
| Glutaraldehyde | Electron Microscopy Science | 16020 | |
| hiPSC | Shownin Biotechnology Co. Ltd. | RC01001-A | |
| Lead citrate | Beijing Zhongjingkeyi Technology Co., Ltd. | GZ02618 | |
| L-GlutaMax | Life Technologies | #35050061 | L-glutamine substitute |
| Matrigel | Corning | 356234 | |
| Microscope slide | CITOTEST | 80312-3161 | |
| N2 supplement | Gibco | 17502048 | |
| Na2HPO4· 12H2O | Sigma | 71650 | A component of PB/PBS |
| NaH2PO4· H2O | Sigma | 71507 | A component of PB/PBS |
| Non-essential amino acids | Sigma | #M7145 | |
| Optical microscope | Lab Binocular Biological Microscope | Xsz-107bnii | |
| OsO4 | TED PELLA | 4008-160501 | |
| Oven | Bluepard | BPG9040A | |
| Paraformaldehyde | Electron Microscopy Science | 157-8 | |
| Penicillin-Streptomycin | Gibco | #15140-122 | |
| Semi/ultrathin microtome | Reichert-Jung | 396649 | |
| Taurine | Sigma | #T0625 | |
| Toluidine blue | Sangon Biotech | E670105-0100 | |
| Transmission Electron Microscopes | HITACHI | H-7500 | |
| Uranyl acetate | TED PELLA | CA96049 | |
| β-mercaptoethanol | Sigma | 444203 |
参考文献
- Andreazzoli, M., Barravecchia, I., De Cesari, C., Angeloni, D., Demontis, G. C. Inducible pluripotent stem cells to model and treat inherited degenerative diseases of the outer retina: 3d-organoids limitations and bioengineering solutions. Cells. 10 (9), 2489 (2021).
- Moser, T., Grabner, C. P., Schmitz, F. Sensory processing at ribbon synapses in the retina and the cochlea. Physiol Rev. 100 (1), 103-144 (2020).
- Tom Dieck, S., Brandstätter, J. H. Ribbon synapses of the retina. Cell Tissue Res. 326 (2), 339-346 (2006).
- Kolb, H., Fernandez, E., Nelson, R. . Webvision: The organization of the retina and visual. , (1995).
- Soto, F., Zhao, L., Kerschensteiner, D. Synapse maintenance and restoration in the retina by ngl2. Elife. 7, e30388 (2018).
- Kruczek, K., Swaroop, A. Pluripotent stem cell-derived retinal organoids for disease modeling and development of therapies. Stem Cells. 38 (10), 1206-1215 (2020).
- O'Hara-Wright, M., Gonzalez-Cordero, A. Retinal organoids: A window into human retinal development. Development. 147 (24), (2020).
- Norrie, J. L., et al. Retinoblastoma from human stem cell-derived retinal organoids. Nat Commun. 12 (1), 4535 (2021).
- Luni, C., Serena, E., Elvassore, N. Human-on-chip for therapy development and fundamental science. Curr Opin Biotechnol. 25, 45-50 (2014).
- Chahine Karam, F., et al. Human ipsc-derived retinal organoids and retinal pigment epithelium for novel intronic rpgr variant assessment for therapy suitability. J Pers Med. 12 (3), 502 (2022).
- Lo, J., et al. Therapeutic strategies for glaucoma and optic neuropathies. Mol Aspects Med. 94, 101219 (2023).
- Capowski, E. E., et al. Reproducibility and staging of 3d human retinal organoids across multiple pluripotent stem cell lines. Development. 146 (1), 171686 (2019).
- Cowan, C. S., et al. Cell types of the human retina and its organoids at single-cell resolution. Cell. 182 (6), 1623-1640 (2020).
- Cora, V., et al. A cleared view on retinal organoids. Cells. 8 (5), 391 (2019).
- Żak, A. M. Light-induced in situ transmission electron microscopy─development, challenges, and perspectives. Nano Lett. 22 (23), 9219-9226 (2022).
- Tschulakow, A. V., Oltrup, T., Bende, T., Schmelzle, S., Schraermeyer, U. The anatomy of the foveola reinvestigated. PeerJ. 6, e4482 (2018).
- Syrbe, S., et al. Müller glial cells of the primate foveola: An electron microscopical study. Exp Eye Res. 167, 110-117 (2018).
- Xiao, J., et al. Rod bipolar cells receive cone photoreceptor inputs through both invaginating synapses and flat contacts in the mouse and guinea pig retinas. J Comp Neurol. 531 (11), 1184-1197 (2023).
- Liu, X., et al. Retinal degeneration in rpgra mutant zebrafish. Front Cell Dev Biol. 11, 1169941 (2023).
- Yang, Q., et al. Expression of α-synuclein in the mouse retina is confined to inhibitory presynaptic elements. J Comp Neurol. 531 (10), 1057-1079 (2023).
- Zhang, J., et al. Early degeneration of photoreceptor synapse in ccl2/cx3cr1-deficient mice on crb1(rd8) background. Synapse. 67 (8), 515-531 (2013).
- De Robertis, E., Franchi, C. M. Electron microscope observations on synaptic vesicles in synapses of the retinal rods and cones. J Biophys Biochem Cytol. 2 (3), 307-318 (1956).
- Frey, T. G., Mannella, C. A. The internal structure of mitochondria. Trends Biochem Sci. 25 (7), 319-324 (2000).
- Gonzalez-Cordero, A., et al. Recapitulation of human retinal development from human pluripotent stem cells generates transplantable populations of cone photoreceptors. Stem Cell Reports. 9 (3), 820-837 (2017).
- Gao, M. L., et al. Patient-specific retinal organoids recapitulate disease features of late-onset retinitis pigmentosa. Front Cell Dev Biol. 8, 128 (2020).
- Afanasyeva, T. a. V., et al. A look into retinal organoids: Methods, analytical techniques, and applications. Cell Mol Life Sci. 78 (19-20), 6505-6532 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。