Method Article
Vorbereitung von retinalen Organoidproben für die Transmissionselektronenmikroskopie
In diesem Artikel
Zusammenfassung
Dieses Protokoll bietet ein optimiertes und aufwändiges Präparationsverfahren für retinale Organoidproben für die Transmissionselektronenmikroskopie. Es eignet sich für Anwendungen, die die Analyse von Synapsen in reifen retinalen Organoiden beinhalten.
Zusammenfassung
Retinale Organoide (ROs) sind ein dreidimensionales Kultursystem, das menschliche Netzhautmerkmale nachahmt, die sich unter bestimmten Bedingungen von induzierten pluripotenten Stammzellen (iPSCs) unterschieden haben. Die Entwicklung und Reifung von Synapsen in ROs wurde immunzytochemisch und funktionell untersucht. Der direkte Nachweis der synaptischen Kontaktultrastruktur ist jedoch begrenzt, da sie sowohl spezielle Bandsynapsen als auch konventionelle chemische Synapsen enthält. Die Transmissionselektronenmikroskopie (TEM) zeichnet sich durch eine hohe Auflösung und eine respektable Geschichte aus, die die Entwicklung der Netzhaut und die Synapsenreifung beim Menschen und bei verschiedenen Spezies aufklärt. Es ist ein leistungsfähiges Werkzeug zur Erforschung der synaptischen Struktur in ROs und wird häufig im Forschungsbereich der ROs eingesetzt. Um die Struktur der synaptischen RO-Kontakte auf der Nanoskala besser zu untersuchen und qualitativ hochwertige mikroskopische Beweise zu erhalten, haben wir daher eine einfache und wiederholbare Methode zur Vorbereitung von RO-TEM-Proben entwickelt. In diesem Dokument werden das Protokoll, die verwendeten Reagenzien und die detaillierten Schritte beschrieben, einschließlich der Vorbereitung der RO-Fixierung, der Nachfixierung, der Einbettung und der Visualisierung.
Einleitung
Die Netzhaut, ein lebenswichtiges visuelles Sinnesorgan bei Menschen und Säugetieren, weist eine ausgeprägte laminierte Struktur auf, die durch drei Kernschichten gekennzeichnet ist, in denen Neuronensomas untergebracht sind, und zwei plexiforme Schichten, die durch synaptische Verbindungengebildet werden 1, einschließlich konventioneller Synapsen und der spezialisierten Bandsynapse 2,3. Die Bandsynapse spielt eine entscheidende Rolle bei der abgestuften Übertragung von Vesikelimpulsen 2,3. Der Sehprozess umfasst die elektrooptische Signalübertragung über verschiedene Ebenen von Neuronen und Synapsen, die schließlich den visuellen Kortex erreicht 4,5.
Retinale Organoide (ROs) stellen ein dreidimensionales (3D) Kultursystem dar, das aus induzierten pluripotenten Stammzellen (iPSCs) gewonnen wird und die physiologischen Zustände von Netzhautgewebe in vitro nachahmt 1,6,7. Dieser Ansatz ist vielversprechend für die Untersuchung von Netzhauterkrankungen8, das Wirkstoffscreening9 und als potenzielle Therapie für irreversible degenerative Netzhauterkrankungen wie Retinitis pigmentosa10 und Glaukom11. Als leistungsfähiges optisches In-vitro-Leitungssystem ist die Synapse in ROs eine entscheidende Struktur, die eine effektive Signaltransformation und -übertragung ermöglicht5.
Die Entwicklung der Umkehrosmose kann grob in drei Stadien eingeteilt werden, die sich nach ihren morphologischen Merkmalen und molekularen Expressionsprofilenrichten 6,12. ROs im Stadium 1 (um D21-D60) bestehen aus neuralen Vorläuferzellen der Netzhaut, vielen retinalen Ganglienzellen (RGCs) und einigen Starburst-Amakrinzellen (SACs), was der ersten Epoche der menschlichen fetalen Entwicklung entspricht. Im Stadium 2 (um D50-D150) exprimieren ROs einige Photorezeptorvorläufer, Interneuronen und Synaptogenese-bezogene Gene, was eine Übergangsphase darstellt. Photorezeptoren entwickeln ihre Reife im Stadium 3 ROs (etwa nach D100-D150), was dem dritten Stadium der fetalen Entwicklung des Menschen entspricht 6,12,13. Bemerkenswert ist, dass ROs im Stadium 3 im Vergleich zu ROs in Stadium 1 und Stadium 2 eine ausgeprägte lamelläre Struktur aufweisen, deren Synapsen gereift sind12, einschließlich des Vorhandenseins von Bandsynapsen14. Darüber hinaus hat eine kürzlich durchgeführte Studie bestätigt, dass die reifen Synapsen die Übertragung von Lichtsignalen ermöglichen, was darauf hindeutet, dass sie funktionsfähig sind13. Daher werden ROs im Stadium 3 oft ausgewählt, um die synaptische Struktur zu untersuchen.
Die Immunhistochemie wird häufig zur Untersuchung der Expression verschiedener molekularer Proteine eingesetzt. Die Einschränkung der optischen Mikroskopie liegt jedoch in ihrer Fähigkeit, nur eine begrenzte Anzahl spezifischer Zellen und Moleküle gleichzeitig zu beobachten, was dazu führt, dass die Beziehungen zwischen Zellen und ihrer Umgebung nicht umfassend analysiert werden können. Die Transmissionselektronenmikroskopie (TEM) zeichnet sich durch eine hohe Auflösung mit einer begrenzten Auflösung von 0,1-0,2 nm aus und übertrifft das Lichtmikroskop um ~10-20 mal15. Es gleicht die Defekte der optischen Mikroskopie aus und wird zur Aufklärung der Netzhautentwicklung und Synapsenreifung beim Menschen16,17 und verschiedenen Speziesverwendet 18,19,20,21. TEM ermöglicht die direkte Unterscheidung von präsynaptischen und postsynaptischen Komponenten18,20 und ermöglicht sogar eine umfassende Beobachtung subzellulärer Strukturen wie Bänder 2,3, Vesikel22 und Mitochondrien23. Daher ist TEM ein wesentliches Werkzeug zur Identifizierung von Synapsentypen und zur Erforschung der Ultrastruktur synaptischer Kontakte in ROs auf der Nanoskala.
Es ist wichtig zu beachten, dass die Probenvorbereitung von großer Bedeutung ist, um qualitativ hochwertige elektronenmikroskopische Aufnahmen zu erhalten. Obwohl einige Studien EM an ROs durchgeführt haben 12,13,24, sind die detaillierten Verfahren unklar. Da die Qualität des elektronenmikroskopischen Bildes in hohem Maße vom Effekt der RO-Fixierung und der Reagenzienpermeation abhängt, müssen bei der Präparation verschiedene wichtige Faktoren berücksichtigt werden. Um die synaptischen Kontakte in ROs besser untersuchen zu können, stellen wir daher eine Methode mit guter Reproduzierbarkeit vor, die die Operationspunkte der RO-Fixierung, Einbettung und Identifizierung von Beobachtungsstellen zeigt.
Protokoll
1. Gewinnung von ROs aus iPSCs25
HINWEIS: ROs wurden von iPSCs abgeleitet, indem das zuvor beschriebene Verfahren modifiziert wurde.
- Dissoziieren Sie iPSCs bei ~90% Konfluenz mit einer bakteriellen Protease (siehe Materialtabelle). Zerkleinern Sie die Kolonien in Stücke und kratzen Sie sie mit einem Zellheber ab.
- Nach der Entnahme resuspendieren Sie die Zellcluster in 0,25 ml eiskaltem Matrigel. Nach einer 20-minütigen Inkubation bei 37 °C bestreuen Sie das erstarrte Gel mit dem DMEM/F12-Medium (0,5 % N2-Supplement, 1 % B27-Supplement, 0,1 mM β-Mercaptoethanol, 0,2 mM L-Glutaminersatz, 100 U/mL Penicillin und 100 mg/ml Streptomycin). Definieren Sie diese Zeit als Tag 0 der Differenzierung.
- Nach 5 Tagen schwimmender Kultur gruppieren sich die Zellen zu Zellzysten. Übertragen Sie diese Zellzysten in eine 100 mm Petrischale, wo sie nun anhaften und wachsen.
- Verwenden Sie an Tag 15 eine bakterielle Protease, um die anhaftenden Zellen zu dissoziieren und sie in DMEM/F12-Medium (2% B27-Supplement, 0,1 mM nicht-essentielle Aminosäuren) zu kultivieren.
- Wechseln Sie an Tag 21 das Medium durch 20 ml serumhaltiges Medium (DMEM/F12-Medium, 8 % FBS, 2 % B27-Supplement, 100 mM Taurin und 2 mM L-Glutaminersatz) und ersetzen Sie das Medium jede Woche.
2. Vordere Fixation von ROs
- Bewegen Sie eines der kultivierten ROs (~D180, eine Größe von ca. 1~2 mm Durchmesser ist optimal) vorsichtig mit einer Pipette aus der Petrischale in 1,5 mL Mikrozentrifugenröhrchen und markieren Sie die relevanten Informationen zu den ROs.
HINWEIS: Schneiden Sie ROs in zwei Hälften oder schneiden Sie das schlecht strukturierte Gewebe mit einem Rasiermesser unter dem Mikroskop in der Schale mit dem Fixiermittel ab, wenn die ROs zu groß sind. - Entfernen Sie das Nährmedium mit einer Pipette aus den 1,5-ml-Mikrozentrifugenröhrchen. Geben Sie 1,5 ml 2 % Paraformaldehyd-2 % Glutaraldehyd-Fixiermittel in 0,1 M Phosphatpuffer (PB), pH 7,4, hinzu und fixieren Sie es 4 h lang bei Raumtemperatur (RT). Lagern Sie die Mikrozentrifugenröhrchen über Nacht bei 4 °C.
HINWEIS: Dieser Schritt kann für 1 Woche pausiert werden, es wird jedoch empfohlen, so früh wie möglich neu zu starten. Wenn ROs länger belassen werden, kann dies zu einer Autolyse der Zellen führen, die zur Zerstörung der Ultrastruktur von ROs führt. Vermeiden Sie aufgrund der Zerbrechlichkeit der ROs rotierende, oszillierende, umdrehende oder raue Vorgänge.
3. Nachfixierung von ROs
- Entfernen Sie das 2%ige Paraformaldehyd-2%ige Glutaraldehyd-Fixiermittel und waschen Sie es 3 x 10 Minuten lang mit 1 ml 0,01 M phosphatgepufferter Kochsalzlösung (PBS) bei einem pH-Wert von 7,4. Suspendieren Sie die ROs während des Waschvorgangs vorsichtig in den 1,5-ml-Mikrozentrifugenröhrchen, um sie vollständig zu spülen. Erhöhen Sie für jeden weiteren Tag der Fixierung die Anzahl der Wäschen um zwei, um das restliche Fixiermittel so weit wie möglich zu entfernen.
- Entfernen Sie alle verbleibenden PBS mit einer Pipette und ersetzen Sie sie durch ~150 μl 1%ige Osminsäure (OsO4), bis die Gewebeblöcke untergetaucht sind. Legen Sie die Mikrozentrifugenröhrchen zum Schutz vor Licht in eine dunkle Box und infiltrieren Sie 1 h lang bei RT.
HINWEIS: OsO4 ist ein starkes Oxidationsmittel und muss in einem Abzug gehandhabt werden.
4. Fleckenbildung und Dehydrierung
HINWEIS: Der Luftentfeuchter muss eingeschaltet werden, um die Umgebung nach diesem Schritt zu trocknen.
- Entfernen Sie OsO4 mit einer Pipette, waschen Sie es mit 0,01 M PBS (pH 7,4) 3 x 10 min und waschen Sie es dann 3 x 10 min mit deionisiertem Wasser.
HINWEIS: Um eine vollständige Spülung der ROs zu gewährleisten, empfehlen wir, die ROs aufzuhängen. Aspirieren Sie OsO4 in eine spezielle Entsorgungsflasche. - Entfernen Sie die letzte Wäsche mit entionisiertem Wasser und ersetzen Sie es durch ~150 μl pro Röhrchen (stellen Sie eine vollständige Infiltration der Gewebeblöcke sicher) Uranacetat und färben Sie es für 1-2 h bei RT. Schützen Sie die Mikrozentrifugenröhrchen vor Licht.
- Entfernen Sie das Uranacetat und ersetzen Sie es durch 1 ml 50%iges Aceton in den Abzug, wobei Sie es 10 Minuten lang dehydrieren lassen. Verwenden Sie dann 70 %, 80 %, 90 %, 100 % und 100 % Aceton für die nacheinander gradiente Dehydrierung der ROs. Jede Dehydrierung dauert 10 Minuten.
HINWEIS: Lassen Sie die ROs bei jedem Austausch etwas Flüssigkeit einweichen, um zu verhindern, dass sie Luft und Feuchtigkeit ausgesetzt werden. Darüber hinaus sollten Sie so schnell wie möglich schnell arbeiten, da Aceton flüchtig ist. Aspirieren Sie Uranacetat in eine spezielle Entsorgungsflasche.
5. Infiltration
- Entsorgen Sie das Aceton und fügen Sie ~150 μl der Mischung aus Aceton und Epon-812-Harz im Verhältnis 1:1 hinzu. Für 1 h in den 37 °C Ofen schieben.
- Entfernen Sie die obige Mischung und ersetzen Sie sie durch eine Mischung aus Aceton und Epon-812-Harz im Verhältnis 1:4. Über Nacht in den 37 °C heißen Backofen schieben.
- Übertragen Sie die ROs vorsichtig in die neuen Röhrchen mit ~500 μL reinem Epoxidharz und stellen Sie sie für 1 h in einen 45 °C Ofen.
6. Einbetten
- Bereiten Sie die 30-50 mL reines Epoxidharz in einem 50 mL Zentrifugenröhrchen vor, indem Sie das Reagenzienkit gemäß den Anweisungen des Herstellers im Voraus mischen. Drehen Sie das reine Epoxidharz 30 Minuten lang langsam auf den Kopf, um die vom Mischer eingebrachten Luftblasen zu reduzieren. Anschließend 20 min im 37 °C heißen Ofen ruhen lassen. Geben Sie 2/3 des Volumens reines Epoxidharz in die Rille der Einbettform.
- Verwenden Sie einen Zahnstocher, um ROs in die Einbettungsform zu picken, die mit reinem Epoxidharz ausgestattet ist.
- Füllen Sie die Rille mit reinem Epoxidharz, bis sie leicht hervorsteht oder sich wölbt.
- Passen Sie die Position der ROs an beiden Enden der Einbettungsform für die gerichtete Einbettung an. Stellen Sie die Einbettform für 1-2 h in einen 45 °C Ofen und stellen Sie sie dann für 48-72 h in einen 65 °C Ofen.
7. Halbdünne Positionierung
- Schleifen Sie das überschüssige Epoxidharz von den Enden der längeren vier Seiten des Einbettungsblocks um das Gewebe herum, um eine trapezförmige Fläche zu bilden. Setzen Sie den Einbettblock in den Probenmontageständer ein und schrauben Sie die Schraube mit einem L-Schraubendreher fest. Montieren Sie dann Glasmesser auf dem Messerständer und ziehen Sie die Mutter manuell fest.
- Schneiden Sie das überschüssige Harz ab, bis die gewünschte Stelle freigelegt ist.
- Füllen Sie die Mulde des Glasmessers mit Wasser. Schneiden Sie mit einem halbdünnen Mikrotom halbdünne Scheiben auf eine Dicke von 1 μm und legen Sie sie mit einer Nadel auf einen Objektträger.
- 50 μl 1% Toluidinblau in halbdünne Scheiben geben und 1 min bei 95 °C auf der Heizplatte inkubieren. Mit destilliertem Wasser 2 Min. spülen. Verwenden Sie ein gewöhnliches optisches 20-fach-Mikroskop, um die Struktur der Schnitte zu beobachten.
8. Ultradünnes Schneiden
- Montieren Sie die Einbettblöcke und Glasmesser wie in Schritt 7.1 beschrieben. Passen Sie den Abstand zwischen dem Messer und dem Gewebeblock, den Flüssigkeitsstand des Waschbeckens und die Schnittgeschwindigkeit an. Schneiden Sie die ultradünnen Abschnitte mit einer Dicke von ~70-100 nm mit einem ultradünnen Mikrotom ab und schöpfen Sie die Scheiben mit der Stützfolie auf das Kupfergewebe (200 mesh).
- Färben Sie ultradünne Schnitte mit 3 % Bleicitrat für 15 Minuten, um den Kontrast in einem dualen Färbeverfahren zu verbessern.
9. Bildgebung von ROs durch TEM
- Starten Sie die Software (siehe Materialtabelle).
- Klicken Sie auf die Schaltfläche Speichermodus und markieren Sie jeden ultradünnen Abschnitt grob.
- Suche nach synaptischen Strukturen.
- Unterscheiden Sie die laminierte Struktur von ROs bei geringer Vergrößerung.
- Lokalisieren Sie die äußere Kernschicht (ONL), die eine Kernstruktur mit einer tieferen Elektronendichte aufweist. Navigieren Sie anschließend zum Ende des Photorezeptors, wo sich zahlreiche Vesikel ansammeln. Suchen Sie nach den Stabanschlüssen mit einem einzelnen synaptischen Band und den konischen Anschlüssen mit mehreren synaptischen Bändern.
- Gehen Sie zur inneren plexiformen Schicht (IPL) und suchen Sie mit einem kleinen Band nach einer ähnlichen Struktur.
- Nehmen Sie das mikroskopische Bild auf.
- Klicken Sie auf Start und geben Sie die entsprechende Vergrößerungsstärke ein.
- Speichern Sie die Bilder.
Ergebnisse
Die Etablierung von 3D-ROs durch iPS-Differenzierung bietet ein leistungsfähiges Werkzeug zur Untersuchung der Mechanismen von Netzhauterkrankungen und der Stammzellersatztherapie. Obwohl andere die synaptischen Verbindungen in ROs funktionell und immunzytochemisch nachgewiesen haben, ist die direkte Evidenz von konventionellen und Bandsynapsen sehr begrenzt. Hier stellen wir eine Methode vor, mit der die Ultrastruktur von zwei Arten von Synapsen in ROs mittels TEM untersucht werden kann. Nach 180 Tagen Kultur wurden die ROs fixiert, gefärbt, eingebettet und ultradünn geschnitten. Die TEM-Beobachtung zeigte Bandsynapsen an den axonalen Enden der Photorezeptoren (Abbildung 1 und Abbildung 2), die im OPL verteilt sind. Unter TEM sphäuten sich Bänder aus Stäbchen um die synaptische Invagination herum und bilden ein hufeisenförmiges Profil mit horizontalen Zellen (Abbildung 1). Stäbe haben in der Regel nur ein einzelnes Band, aber Kegel haben mehrere Bänder (Abbildung 2). Zusätzlich wurden klassische chemische Synapsen zwischen Amakrinzellen im IPL beobachtet (Abbildung 3). Unter TEM besteht die chemische Synapse aus drei Teilen: dem präsynaptischen, dem synaptischen Spalt und dem postsynaptischen. Die Zellmembranen, die dem präsynaptischen und postsynaptischen Teil entsprechen, sind etwas dicker als der Rest der Teile, und der schmale Spalt zwischen den beiden Membranen wird als synaptischer Spalt bezeichnet. Es gibt viele synaptische Vesikel im Zytoplasma der präsynaptischen Membranstelle. Diese Studie bestätigt das Vorhandensein vollständiger synaptischer Verbindungen in 3D-ROs, die von iPSC abgeleitet wurden. Es ist jedoch zu beachten, dass ein unvollständiges Spülen zwischen den Schritten zur Ausfällung von schwarzen Partikeln während des Prozesses der Probenvorbereitung führen würde (Abbildung 4).
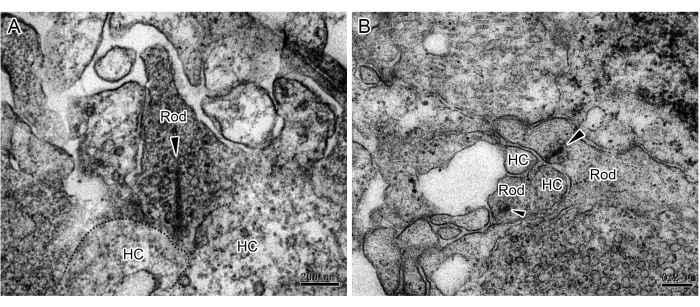
Abbildung 1: TEM-Bilder von Stäbchenbandsynapsen in ROs. (A,B) Stäbchen und horizontale Zellen bilden ein hufeisenförmiges Profil. Ein einzelnes Band (Pfeilspitzen) wurde an jedem Stabkügelchen in der OPL von ROs beobachtet, das von zahlreichen Vesikeln umgeben war. Maßstabsleisten = 0,2 μm. Abkürzungen: ROs = retinale Organoide; HC = horizontale Zelle; OPL = äußere plexiforme Schicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
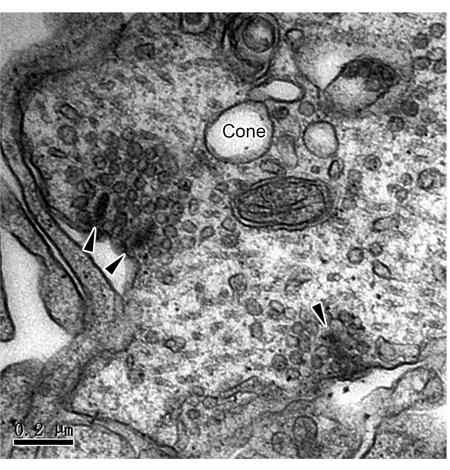
Abbildung 2: TEM-Bilder von Zapfenband-Synapsen in ROs. Drei Bandsynapsen (Pfeilspitzen) waren an einem Kegelstiel in der OPL von ROs sichtbar. Maßstabsleiste = 0,2 μm. Abkürzungen: TEM = Transmissionselektronenmikroskopie; ROs = Netzhaut-Organoide; OPL = äußere plexiforme Schicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: TEM-Bild von chemischen Synapsen in ROs. Eine konventionelle chemische Synapse wurde zwischen Amakrinzellen in der IPL-Schicht von ROs beobachtet. Die chemische Synapse besteht aus drei Teilen: dem präsynaptischen, dem synaptischen Spalt und dem postsynaptischen. Es gibt viele synaptische Vesikel im Zytoplasma der präsynaptischen Membranstelle. Ein Pfeil zeigt die Richtung der synaptischen Übertragung an und zeigt den Transfer zahlreicher Vesikel von einem AC1-Prozess zu einem anderen AC2-Profil an. Maßstabsleiste = 0,2 μm. Abkürzungen: TEM = Transmissionselektronenmikroskopie; ROs = Netzhaut-Organoide; IPL = innere plexiforme Schicht; ACs = amakrine Zellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Ein Beispiel für ein Problem, das während des Prozesses der Probenvorbereitung auftreten kann. Es gibt viele schwarze Partikel (Kreise) im Kegelstiel, weil das Spülen zwischen den Schritten unvollständig ist. Pfeile: Bandsynapse. Maßstabsleiste = 0,2 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In diesem Artikel haben wir ein detailliertes Protokoll zur Beobachtung der konventionellen und bandsynaptischen Ultrastruktur in ROs mittels TEM vorgestellt. Dieses Protokoll basiert auf den zuvor beschriebenen Methoden zur Netzhautpräparation mit einigen Modifikationen20. Um die Erfolgsrate der Probenbehandlung und die Qualität von TEM-Schliffbildern zu verbessern, sollten die folgenden wichtigen Punkte berücksichtigt werden. Zunächst ist es wichtig anzuerkennen, dass sich ROs aus iPSCs entwickeln und eine Zellmasse bilden, der Gefäßefehlen 6,26 und Gliazellen26. Dieses Fehlen kann zu einer weniger kompakten Organisation im Vergleich zur in vivo-Netzhaut führen. Daher ist es wichtig, Ros schonend zu behandeln, um ihre Struktur und Integrität zu erhalten. Fügen Sie Flüssigkeiten entlang der Rohrwand hinzu, um Störungen zu minimieren.
Wichtig ist, dass Sie eine gründliche Dehydrierung des Gewebes in Protokollschritt 4 sicherstellen und den Luftentfeuchter einschalten, um die Raumfeuchtigkeit zu reduzieren, bevor Sie mit dem Dehydratisierungsschritt beginnen. Wenn Sie Aceton ersetzen, gehen Sie schnell vor und lassen Sie etwas Flüssigkeit in das Gewebe eintauchen, um eine schwere Zerstörung der RO-Gewebestruktur zu verhindern. Nicht dehydriertes Gewebe zieht sich in hohen EM-Höhen stark zusammen, und Wasser im Gewebe behindert das Eindringen des Einbettungsmittels.
Da ROs als transparente Kugeln vorliegen, ist beim Schneiden von halbdünnen Scheiben auf die richtige Richtung zu achten, um intakte Lamellenstrukturen zu erhalten. Schließlich gelten ROs im Stadium 3 (etwa nach D100-D150) als reif und besitzen integrale Synapsen12, weshalb die Untersuchung synaptischer Kontakte, einschließlich Bandsynapsen und chemischer Synapsen, empfohlen wird, in diesen ROs durchgeführt zu werden.
Obwohl in früheren Studien nur begrenzte ultrastrukturelle Beweise für RO-Synapsen erbracht wurden, gibt es keine Details über das vollständige Verfahren der RO-Probenvorbereitung sowie die Identifizierung verschiedener Arten von synaptischen Strukturen 12,13,24. Capowski et al. verwendeten verschiedene Techniken, um die Eigenschaften von ROs zu untersuchen, die durch verschiedene hPSC-Linien in verschiedenen Stadien induziert wurden, einschließlich elektronenmikroskopischer Aufnahmen, die das Vorhandensein von vesikelbeladenen Bandsynapsen im Zapfenstiel zeigten, die zeigten, dass ROs im Stadium 3, die durch verschiedene hPSC-Linien induziert wurden, reif und funktionsfähig sind12. Cowan et al. bestätigten mit Hilfe von TEM und Zwei-Photonen-Bildgebung die Bildung von funktionellen Bandsynapsenstrukturen in reifen ROs13, aber die Art der Synapse wurde nicht angegeben (Zapfen- oder Stäbchensynapsen). Unsere verschiedenen Chargen von Schliffbildergebnissen zeigten jedoch die Membranstruktur der Bandsynapsen mit einer idealen Klarheit und einem idealen Kontrast, was zeigt, dass unsere Methode machbar und reproduzierbar ist. Darüber hinaus haben wir verschiedene Arten von Synapsen nach ihren unterschiedlichen morphologischen Eigenschaften identifiziert: Zapfensynapsen sind in der Regel größer und haben mehrere Bänder, während Stäbchensynapsen in der Regel kleiner sind und nur ein Band aufweisen; In chemischen Synapsen reichern sich Vesikel in den präsynaptischen Strukturen an, und die Elektronendichte des synaptischen Spalts wird erhöht.
Die ultrastrukturelle Integrität der synaptischen Kontakte in ROs ist entscheidend für deren Funktion. Der Einsatz von TEM zur Untersuchung dieser Kontakte bietet breite und signifikante Vorteile in verschiedenen Bereichen, wie z. B. der Untersuchung der Pathogenese der Netzhaut in vitro, der Durchführung von Wirkstoffscreenings in ROs und der Evaluierung von Differenzierungstechniken von ROs, um nur einige zu nennen. Begrenzt durch die 2D-TEM-Bildgebung ist nur ein spezifischer Aspekt der Ultrastruktur des ROs beobachtbar, was es schwierig macht, die gesamte Struktur der Synapse stereoskopisch zu analysieren. Darüber hinaus trägt die Begrenztheit der Differenzierung dazu bei, dass Zellen falsch platziertwerden 13,26, was den Beobachtungsprozess weiter erschwert. Die Kombination von Volumen-EM mit 3D-Rekonstruktion könnte diese Mängel in Zukunft beheben.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde teilweise durch Zuschüsse des National Key Research and Development Program of China (2022YFA1105503), des State Key Laboratory of Neuroscience (SKLN-202103) und der Zhejiang Natural Science Foundation of China (Y21H120019) und der Natural Science Foundation of China (82070981) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Corning | 430167 | |
| Acetone | Electron Microscopy Science | 10000 | |
| B27 supplement | Gibco | A3582801 | |
| Cell lifter | Santa Cruz | sc-395251 | |
| Copper grids | Beijing Zhongjingkeyi Technology Co., Ltd. | AZH400HH | |
| DigitalMicrograph Software | Gatan, Inc. | Software | |
| Dispase | StemCell Technologies | #07913 | Bacterial protease |
| DMEM/F12 medium | Gibco | #11320033 | |
| Embedding mold | Beijing Zhongjingkeyi Technology Co., Ltd. | GZ10592 | |
| Epon-812 resin | Electron Microscopy Science | #14900 | |
| Fetal Bovine Serum (FBS) | Biological Industries | #04-0021A | |
| Glutaraldehyde | Electron Microscopy Science | 16020 | |
| hiPSC | Shownin Biotechnology Co. Ltd. | RC01001-A | |
| Lead citrate | Beijing Zhongjingkeyi Technology Co., Ltd. | GZ02618 | |
| L-GlutaMax | Life Technologies | #35050061 | L-glutamine substitute |
| Matrigel | Corning | 356234 | |
| Microscope slide | CITOTEST | 80312-3161 | |
| N2 supplement | Gibco | 17502048 | |
| Na2HPO4· 12H2O | Sigma | 71650 | A component of PB/PBS |
| NaH2PO4· H2O | Sigma | 71507 | A component of PB/PBS |
| Non-essential amino acids | Sigma | #M7145 | |
| Optical microscope | Lab Binocular Biological Microscope | Xsz-107bnii | |
| OsO4 | TED PELLA | 4008-160501 | |
| Oven | Bluepard | BPG9040A | |
| Paraformaldehyde | Electron Microscopy Science | 157-8 | |
| Penicillin-Streptomycin | Gibco | #15140-122 | |
| Semi/ultrathin microtome | Reichert-Jung | 396649 | |
| Taurine | Sigma | #T0625 | |
| Toluidine blue | Sangon Biotech | E670105-0100 | |
| Transmission Electron Microscopes | HITACHI | H-7500 | |
| Uranyl acetate | TED PELLA | CA96049 | |
| β-mercaptoethanol | Sigma | 444203 |
Referenzen
- Andreazzoli, M., Barravecchia, I., De Cesari, C., Angeloni, D., Demontis, G. C. Inducible pluripotent stem cells to model and treat inherited degenerative diseases of the outer retina: 3d-organoids limitations and bioengineering solutions. Cells. 10 (9), 2489 (2021).
- Moser, T., Grabner, C. P., Schmitz, F. Sensory processing at ribbon synapses in the retina and the cochlea. Physiol Rev. 100 (1), 103-144 (2020).
- Tom Dieck, S., Brandstätter, J. H. Ribbon synapses of the retina. Cell Tissue Res. 326 (2), 339-346 (2006).
- Kolb, H., Fernandez, E., Nelson, R. . Webvision: The organization of the retina and visual. , (1995).
- Soto, F., Zhao, L., Kerschensteiner, D. Synapse maintenance and restoration in the retina by ngl2. Elife. 7, e30388 (2018).
- Kruczek, K., Swaroop, A. Pluripotent stem cell-derived retinal organoids for disease modeling and development of therapies. Stem Cells. 38 (10), 1206-1215 (2020).
- O'Hara-Wright, M., Gonzalez-Cordero, A. Retinal organoids: A window into human retinal development. Development. 147 (24), (2020).
- Norrie, J. L., et al. Retinoblastoma from human stem cell-derived retinal organoids. Nat Commun. 12 (1), 4535 (2021).
- Luni, C., Serena, E., Elvassore, N. Human-on-chip for therapy development and fundamental science. Curr Opin Biotechnol. 25, 45-50 (2014).
- Chahine Karam, F., et al. Human ipsc-derived retinal organoids and retinal pigment epithelium for novel intronic rpgr variant assessment for therapy suitability. J Pers Med. 12 (3), 502 (2022).
- Lo, J., et al. Therapeutic strategies for glaucoma and optic neuropathies. Mol Aspects Med. 94, 101219 (2023).
- Capowski, E. E., et al. Reproducibility and staging of 3d human retinal organoids across multiple pluripotent stem cell lines. Development. 146 (1), 171686 (2019).
- Cowan, C. S., et al. Cell types of the human retina and its organoids at single-cell resolution. Cell. 182 (6), 1623-1640 (2020).
- Cora, V., et al. A cleared view on retinal organoids. Cells. 8 (5), 391 (2019).
- Żak, A. M. Light-induced in situ transmission electron microscopy─development, challenges, and perspectives. Nano Lett. 22 (23), 9219-9226 (2022).
- Tschulakow, A. V., Oltrup, T., Bende, T., Schmelzle, S., Schraermeyer, U. The anatomy of the foveola reinvestigated. PeerJ. 6, e4482 (2018).
- Syrbe, S., et al. Müller glial cells of the primate foveola: An electron microscopical study. Exp Eye Res. 167, 110-117 (2018).
- Xiao, J., et al. Rod bipolar cells receive cone photoreceptor inputs through both invaginating synapses and flat contacts in the mouse and guinea pig retinas. J Comp Neurol. 531 (11), 1184-1197 (2023).
- Liu, X., et al. Retinal degeneration in rpgra mutant zebrafish. Front Cell Dev Biol. 11, 1169941 (2023).
- Yang, Q., et al. Expression of α-synuclein in the mouse retina is confined to inhibitory presynaptic elements. J Comp Neurol. 531 (10), 1057-1079 (2023).
- Zhang, J., et al. Early degeneration of photoreceptor synapse in ccl2/cx3cr1-deficient mice on crb1(rd8) background. Synapse. 67 (8), 515-531 (2013).
- De Robertis, E., Franchi, C. M. Electron microscope observations on synaptic vesicles in synapses of the retinal rods and cones. J Biophys Biochem Cytol. 2 (3), 307-318 (1956).
- Frey, T. G., Mannella, C. A. The internal structure of mitochondria. Trends Biochem Sci. 25 (7), 319-324 (2000).
- Gonzalez-Cordero, A., et al. Recapitulation of human retinal development from human pluripotent stem cells generates transplantable populations of cone photoreceptors. Stem Cell Reports. 9 (3), 820-837 (2017).
- Gao, M. L., et al. Patient-specific retinal organoids recapitulate disease features of late-onset retinitis pigmentosa. Front Cell Dev Biol. 8, 128 (2020).
- Afanasyeva, T. a. V., et al. A look into retinal organoids: Methods, analytical techniques, and applications. Cell Mol Life Sci. 78 (19-20), 6505-6532 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten