Method Article
Методика внутрибрюшинной инъекции взрослым рыбкам данио, которая сводит к минимуму повреждение организма и связанную с ним смертность
* Эти авторы внесли равный вклад
В этой статье
Резюме
Описан новый метод внутрибрюшинного (IP) введения взрослым рыбкам данио. При работе с токсичными соединениями, такими как доксорубицин, эта процедура более эффективна, чем два ранее описанных метода IP. Этот метод разработан таким образом, чтобы его можно было легко использовать исследователям с ограниченным опытом работы с моделью рыбок данио.
Аннотация
Взрослая рыбка данио рерио (Danio rerio), которая генетически доступна, используется в качестве ценной модели позвоночных для изучения заболеваний человека, таких как кардиомиопатия. Внутрибрюшинная инъекция (ВП) является важным методом, который доставляет соединения в организм либо для тестирования терапевтических эффектов, либо для создания моделей заболеваний, таких как доксорубицин-индуцированная кардиомиопатия (ДВС-синдром). В настоящее время существует два метода внедрения IP. Оба метода имеют ограничения при работе с токсичными соединениями, такими как доксорубицин, что приводит к побочным эффектам, проявляющимся в виде серьезного повреждения формы тела и гибели рыб. Несмотря на то, что эти недостатки могут быть преодолены путем обширной подготовки следователей, желателен новый метод инъекции IP, который имеет минимальные побочные эффекты. В этой статье сообщается об уникальном методе инъекции IP, который способен работать с токсичными соединениями. Постоянное снижение сердечной функции может привести к значительному падежу рыбы. Методику могут легко освоить исследователи, имеющие минимальный опыт работы со взрослыми рыбками данио.
Введение
Рыбка данио-рерио (Danio rerio) привлекла внимание в качестве экспериментальной модели для изучения болезней человека, потому что это животное включает в себя высокую гомологию генов и органов человека, внешнее оплодотворение, простоту генетических манипуляций и прозрачность тела в раннем возрасте, что облегчаетмножество приложений визуализации. В отличие от простого процесса доставки лекарств непосредственно в воду для эмбрионов и личинок данио-рерио, введение лекарств взрослым рыбкам данио представляет собой более сложную и трудную задачу.
У взрослых рыб соединения могут доставляться с помощью пассивных методов доставки лекарств, таких как прямое введение в воду, или с помощью пероральных методов доставки лекарств, таких как гаваган2. Другие подходы включают покрытие корма рыб соединениями и последующее кормление рыб3, а также непосредственное введение нерастворимых в воде лекарственных препаратов в заданной концентрации, включая ретроорбитальные или внутрибрюшинные инъекции4,5. Внутрибрюшинное введение предпочтительно для исследований in vivo моделей заболеваний из-за его явных фармакокинетических преимуществ6. Этот метод обеспечивает высокую концентрацию препарата и увеличенный период полувыведения в брюшной полости, предлагая эффективный путь доставки препарата 7,8. Этот подход обычно используется в исследовательских целях для обеспечения оптимального абсорбции и распределения лекарственных средств 9. В то время как методы, основанные на инъекциях, оказываются эффективными при однократном родоразрешении, длительные и повторные инъекции часто приводят к повреждению организма и хроническойинфекции.
В настоящее время существует два метода инъекции IP у взрослой рыбы-зерба 4,10. Тем не менее, оба метода имеют ограничения при доставке токсичных соединений, таких как доксорубицин, что приводит к серьезному повреждению формы тела и гибели рыб. Побочные эффекты могут значительно усложнить интерпретацию данных. Несмотря на то, что эти проблемы могут быть решены с помощью интенсивногообучения10, существует явная потребность в новом методе инъекции IP, который сводит к минимуму побочные эффекты.
Наша цель состоит в том, чтобы разработать новый метод инъекции IP, оптимизированный для эффективной доставки доксорубицина взрослым рыбкам данио, способствуя созданию надежных моделей кардиомиопатии (ДВС-синдрома), индуцированной доксорубицином, с минимальным повреждением организма и связанной с ним смертностью.
протокол
Все проводимые процедуры были одобрены Комитетом по уходу за животными и их использованию клиники Майо в соответствии со стандартами, изложенными в «Руководстве по уходу и использованию лабораторных животных» (National Academies Press, 2011). Все рыбки данио, участвовавшие в исследовании, относятся к штамму дикого индийского кариотипа (WIK). Подробная информация о реактивах и оборудовании, использованном для исследования, приведена в Таблице материалов.
1. Приготовление и хранение стокового раствора доксорубицина
- Получите запас доксорубицина из коммерческого источника.
ПРИМЕЧАНИЕ: Доксорубицин светочувствителен, поэтому приобретайте его в виде порошка и храните в непрозрачных контейнерах, чтобы защитить его от воздействия света. Выполните все этапы приготовления порошка Dox в химическом колпаке. - Полностью растворите порошок Dox в дистиллированной воде и приготовьте стоковый раствор с конечной концентрацией 5 мг/мл.
- Аликвотируйте бульон, разделив его на пробирки объемом 1,5 мл.
- Оберните трубки алюминиевой фольгой, чтобы защитить их от воздействия света.
- Хранить раствор аликвота Докс при температуре 4 °С при кратковременном хранении (<1 месяц), или при -20 °С при длительном хранении10.
2. Группировка рыб в соответствии с массой тела
- Сгруппируйте рыбу с разницей в МТ менее 10% вместе для последующего впрыска.
ПРИМЕЧАНИЕ: Чтобы сэкономить усилия на этом этапе, рыба с отклонением BW менее 10% относится к категории одного размера. - Дайте рыбе голодать в течение 24 часов перед инъекцией.
- Обезболите рыб с помощью эмбриональной воды, содержащей 0,16 мг/мл трикаина, в течение 1 минуты.
- Вытащите рыбу из воды с помощью трикаина и промокните обе стороны тела рыбы чистой фильтровальной бумагой, чтобы удалить лишнюю воду.
- Измерьте и запишите МТ каждой рыбы, а затем немедленно верните рыбу в резервуар для восстановления, наполненный пресной водой.
ПРИМЕЧАНИЕ: Инъекция докса проводилась рыбам после достижения 3-месячного возраста. В этом исследовании ученые использовали рыб в возрасте от 3 до 10 месяцев. МТ зрелых рыбок данио рерио штамма WIK может варьироваться от 0,2 г до 0,5 г. Длительная анестезия продолжительностью более 5 минут с последующей инъекцией Dox привела к высокой смертности рыбы.
3. Подготовка иглы и станция для инъекции
- Определите объем ввода исходного раствора Dox (например, 5 мг/мл), необходимый для каждой рыбы, исходя из средней массы тела для достижения целевой дозы 20 г/г.
- Используйте следующую формулу для расчета объема инъекции:

- Добавьте 1x сбалансированный раствор соли Хэнка (HBSS) для разбавления раствора Dox, рассчитанного на шаге 1, для инъекций, достигнув общего объема 5 μл.
ПРИМЕЧАНИЕ: Используйте объемный раствор для каждой группы рыб в зависимости от их МТ и включите еще 3 рыбы в каждую группу, чтобы гарантировать, что не будет недостатка в растворе для инъекций в ходе эксперимента. - Осторожно постучите по пробирке, а затем кратковременно проведите микроцентрифугу на максимальной скорости, чтобы собрать раствор при комнатной температуре в течение 10 секунд.
- Поместите приготовленный раствор на лед и защитите его от воздействия света.
- Поместите чистую чашку Петри диаметром 100 мм с губкой под препарирующий микроскоп, затем отрегулируйте фокус.
ПРИМЕЧАНИЕ: Губка содержит углубление длиной 4 см. Эластичное втягивание губки обеспечит рыбе поддержку и удержит тело рыбы в нужном положении. Губку можно использовать повторно. - Вооружите микрошприц объемом 10 мкл иглой со скошенной массой 34 G.
- Промойте иглу 1x буфером HBSS, чтобы устранить любые пузырьки и удалить потенциальные закупорки из шприца.
- Отмерьте 5 мкл раствора, приготовленного на шаге 4, для инъекции.
4. Процедура инъекции IP Dox
- Поместите взрослую рыбу в воду с 0,16 мг/мл трикаина на 1 минуту, чтобы вызвать состояние потери сознания.
- Расположите рыбу в углублении встроенной губки брюшком вверх (рисунок 1А).
- Введите иглу под углом около 0°, начиная от средней точки грудного плавника по направлению к задней стороне сердечной полости (рис. 1В).
ПРИМЕЧАНИЕ: Избегайте любого контакта с сердцем во время процедуры. - Направьте иглу к хвосту и пройдите под серебристую кожу.
ПРИМЕЧАНИЕ: Расположите иглу в непосредственной близости от серебряной кожи, стараясь не царапать или не прокалывать. - Следите за кончиком иглы в брюшной полости на протяжении всей операции (Рисунок 1C).
ПРИМЕЧАНИЕ: Избегайте повреждения печени, кишечника, плавательного пузыря и других органов. Следите за тем, чтобы игла достигла конца кишечника, рядом с клоакальным отверстием. - Постепенно и равномерно дозируйте 5 мкл раствора Dox, затем медленно извлекайте иглу по исходной траектории, чтобы предотвратить утечку (Рисунок 1D).
- Следите за брюшной полостью на наличие Dox, наблюдая за красной окраской раствора Dox (рисунок 1E).
- Быстро переместите введенную рыбу в чистый резервуар, наполненный пресной водой, чтобы помочь рыбе восстановиться.
ПРИМЕЧАНИЕ: Между инъекциями промойте иглу один раз 1x HBSS буфером.
5. Постинъекционное управление рыбой
- Верните рыбу обратно в систему с циркуляцией после инъекции.
- Заточите всю введенную рыбу еще на 24 часа, чтобы облегчить ее восстановление.
- В течение первой недели внимательно следите за рыбой. Удалите умершую рыбу как можно скорее, чтобы не заразить других рыб.
ПРИМЕЧАНИЕ: Смертельные случаи среди рыб в течение первых 24 часов вероятны из-за физических травм от инъекции или длительной анестезии. Записывайте количество рыб, чтобы построить кривую выживаемости. - Выполните эхокардиографию для фенотипирования рыб, получавших инъекцию Dox, через 56 дней после инъекции11.
Примечание: Обеспечьте единообразие условий и процедур для соответствующей контрольной группы, в которую вводится раствор HBSS.
Результаты
Ранее для введения доксорубицинавзрослым рыбкам данио 4,10 применяли два внутрибрюшинных (ВП) метода. В методе I, также известном как классический метод инъекции IP, описанный Kinkel et al.4, игла вводилась под углом 45° к средней линии между брюшными плавниками животом вверх. В методе II, или альтернативном способе инъекции IP, описанном Ma et al.10, игла вводилась через дорсальную сторону рыбы (рисунок 2A(i,ii)). В отличие от этого, наш метод III претерпел два существенных изменения. Сначала положение инъекции изменяется, живот обращен вверх, а игла направлена от середины грудного плавника к брюшной полости. Место проникновения ориентируется по естественному отверстию в этой области. Во-вторых, уменьшается угол наклона иглы, который должен быть близок к 0° (Рисунок 2A(iii), Рисунок 1).
Сравнение трех методов внутрибрюшинного введения
Для сравнения трех методов инъекции IP представлены данные, полученные от исследователя I, который ранее не имел опыта работы с рыбками данио. При использовании методов I и II для инъекции ВП была отмечена значительная смертность рыб в течение первых двух недель после инъекции ВП. При методе I смерть наблюдалась через три дня после инъекции, в то время как при методе II она наступила через два дня после инъекции. У 70% рыб, получавших инъекцию, наблюдались видимые повреждения тела, особенно вокруг места инъекции, что проявлялось в резком уменьшении размера тела и изогнутой форме тела через один-два месяца после инъекции IP (рис. 2A (iv, v)). Было обосновано, что смертность и наблюдаемые повреждения могут быть связаны с токсичностью доксорубицина12, который может вытекать из отверстия инъекционной иглы в процессе инъекции, повреждая внутренний орган по пути инъекции. В методе I кончик инъекционной иглы мог касаться кишечника (рисунок 2A(i)), в то время как в методе II он мог касаться плавательного пузыря (рисунок 2A(ii)). Было высказано предположение, что с помощью метода III можно предотвратить соприкосновение кончика иглы с каким-либо внутренним органом (рис. 2A(iii)). Действительно, было отмечено значительное улучшение выживаемости, при этом 80% рыб выживали через 1 месяц после инъекции (Рисунок 2B). Это означает значительное улучшение по сравнению с показателями выживаемости при методах I и II, которые составили 53,33% и 33,33% соответственно. Важно отметить, что 80% выживших рыб продемонстрировали нормальную форму тела, в отличие от тех, которые были получены методами I и II (Рисунок 2A(vi)). Чтобы подтвердить успешное создание модели ДВС-синдрома, функция сердца оценивалась путем измерения процента фракции выброса (ЭФ%). Действительно, значительное снижение ФВ наблюдалось через 56 дней после инъекции в группе с использованием метода III (рис. 2В).
Воспроизводимость метода III различными исследователями
Чтобы доказать, что метод III может быть легко освоен разными исследователями, к участию в исследовании были привлечены 3 исследователя, которые никогда ранее не работали с рыбками данио. После первых нескольких попыток с использованием метода III все исследователи смогли достичь 85,71%, 95% и 83,33% выживаемости через 56 дней после инъекции и заметно сниженной ФВ (рис. 3A, B). Следует отметить, что трое исследователей повторили свой эксперимент 3 раза, 3 раза и 2 раза соответственно и неизменно получали успешные результаты. Эти данные подтвердили повторяемость метода III, что позволило исследователям, не имеющим предварительного опыта работы с рыбами, создать надежные модели DIC.
В одной из первых попыток использования метода III исследователь II проверил отклонение метода III: вместо 0° использовался угол 45° при проникновении иглы через кожу (рисунок 2A(iii), пунктирная стрелка). Только 15% рыб выжили через два месяца после инъекции (рисунок 3A), причем у 80% выживших рыб наблюдались значительные повреждения тела. Данные показали, что угол проникновения является критическим этапом для успеха метода III.
Метод III позволяет создать модель хронического ДВС-фактора
Было высказано предположение, что значительно уменьшенное повреждение тела может позволить сделать возможным несколько инъекций IP у одной и той же рыбы, имитируя модель хронического ДВС-синдрома у мышей13,14. Таким образом, метод III был использован для проведения серии инъекций в течение 4 недель подряд с дозой 5 мкг/г Dox в неделю (рис. 4A). В этом эксперименте 100% введенных рыб выжили, а у 80% из них не было никаких признаков повреждения тела. Важно отметить, что при 56 dpi была отмечена значительно сниженная фракция выброса, что указывает на успешное создание модели хронического ДВС-синдрома у взрослых рыбок данио (рис. 4B).
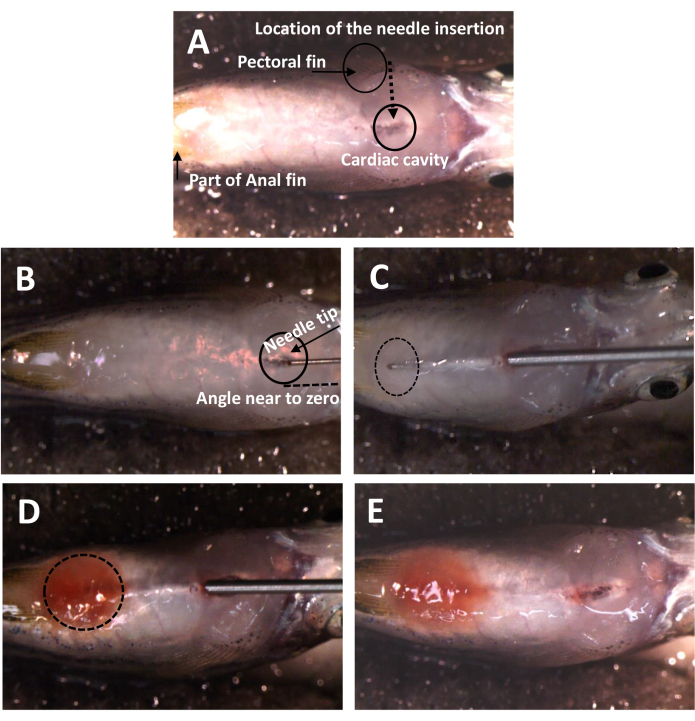
Рисунок 1: Расположение и угол введения иглы для нового метода инъекции IP. (A) Место введения иглы. Рыбу переворачивают вверх ногами, обнажая брюшную сторону. Голова расположена вправо. Между грудными плавниками расположено естественное отверстие, что облегчает проникновение в кожу. (В) Угол введения иглы. Она находится вблизи нуля градусов к поверхности рыбы. (C) След иглы под кожей. Кончик иглы непрерывно контролируется после того, как он находится внутри брюшной полости. Точка входа отличается от точки входа на рисунке 1А из-за искажения пленки в процессе проникновения. (D) Рыба после того, как Докс был отпущен. Брюшная полость становится красной после отпускания Докса. (E) Рыба после инъекции IP. После извлечения иглы нет никаких признаков утечки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
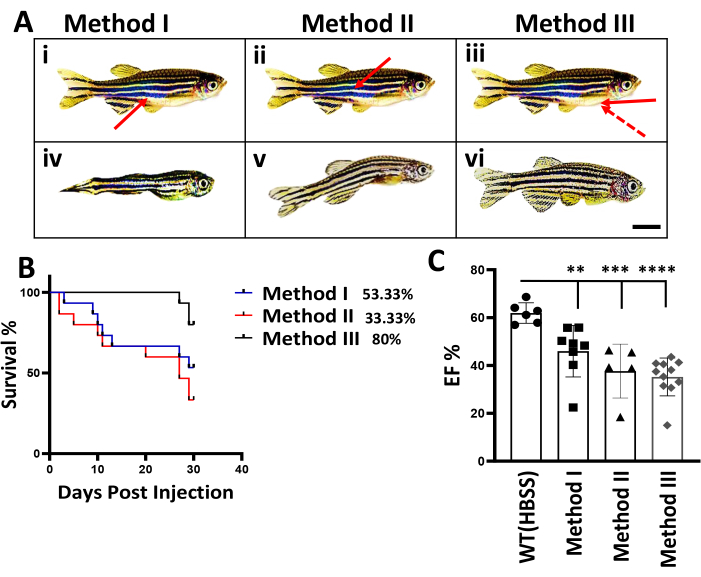
Рисунок 2: Сравнение трех методов инъекции IP у взрослых рыбок данио. (A) Схемы трех методов инъекции IP. (i-iii) На рисунке представлены схемы классической инъекции IP (метод I), альтернативной инъекции IP (метод II) и нового метода (метод III). Стрелками обозначены места проникновения и угол наклона иглы для трех способов инъекции. Пунктирная стрелка, неудачный угол пробития иглой. Масштабная линейка: 5 мм. (iv-vi) Уменьшенный размер кузова и изогнутая форма корпуса в моделях DIC. Показаны репрезентативные рыбы из DIC с разрешением 56 dpi. (B) Сравнение кривых выживаемости при трех методах инъекции IP. Количество выживших рыб регистрировалось еженедельно. (Эксперимент начался с общего числа n = 15). (C) Оценка сердечной функции рыб при давлении 56 dpi после Dox стресса. n = 6 рыб в 1x контрольной группе HBSS, и эксперимент начался с n = 15 рыб в каждых 3 партиях, вводимых Dox. Значения отображаются в виде среднего ± стандартной ошибки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Метод III позволяет последовательно создавать модель DIC рыбки данио в руках трех разных исследователей. (A) Кривые выживаемости рыб DIC с использованием метода III тремя разными исследователями. Высокая выживаемость была отмечена у всех трех исследователей. Численность живой рыбы фиксируется еженедельно. Низкая выживаемость исследователя II была отмечена при использовании неудачного метода III (угол проникновения иглы 45°, как показано пунктирной стрелкой на рисунке 2А). (B) Оценка сердечной функции рыб с использованием метода III тремя различными исследователями. В общей сложности исследователь II, для угла проникновения иглы 45°, использовал 3 партии (9, 12, 14) рыб для инъекции Dox. При угле проникновения иглы 0° n = 6 рыб использовали в 1x HBSS в качестве общей контрольной группы. Эксперимент начался с n = 85 рыб с RII (9, 12, 14), RIII (8, 6, 6) и RIV (12, 18), используемых в каждой из 8 партий, введенных Dox тремя исследователями (II, III, IV) соответственно. Значения отображаются в виде среднего ± стандартной ошибки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
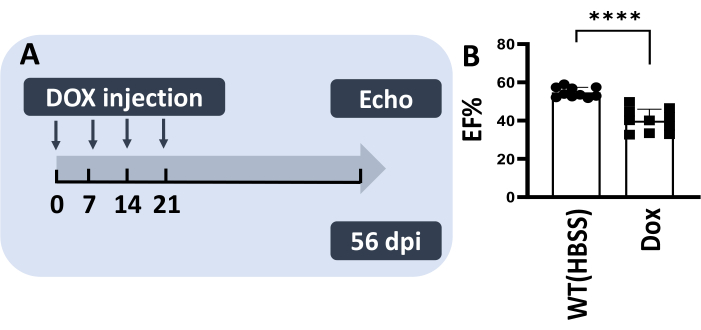
Рисунок 4: Метод III позволяет проводить многократные инъекции Dox взрослой рыбке данио-рерио, повторяя модели хронического ДВС-синдрома у грызунов. (A) Схемы модели многократной инъекции. 5 мкг/г Dox (5 мкл) вводили в течение четырех недель подряд. (B) Модель хронического ДВС-синдрома демонстрирует сниженный процент ЭФВ при 56 dpi. Значения отображаются в виде среднего ± стандартной ошибки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В отличие от двух существующих способов внедрения IP 4,10, новый способ внедрения IP характеризуется следующими отличительными особенностями. Во-первых, используется уникальный угол проникновения иглы (близкий к нулю); во-вторых, игла проникает в рыбу через уникальное место, т.е. естественное отверстие на брюшной поверхности рыбы, что облегчило бы инъекцию; И, наконец, движение иглы происходит от передней к задней. Эти регулировки эффективно снижают травмирование органов, которое происходит в результате минимизации утечки Dox в процессе проникновения. Траектория иглы проходит прямо под серебряной кожей, за которой следователь может постоянно следить. Следовательно, можно эффективно избежать прямого контакта между кончиком иглы и внутренними органами. После инъекции весь введенный докс остается в брюшной полости, а единственный выход (точка прокола) может быть закрыт, когда рыба проснулась и начинает плыть вперед.
По сравнению с двумя существующими методами инъекции IP 4,10, новый метод инъекции IP неизменно приводит к минимизации повреждений тела и повышению выживаемости. Это утверждение было дополнительно подчеркнуто возможностью многократных инъекций в одну и ту же рыбу для создания модели DIC хронической рыбки данио-рерио. Важно отметить, что по сравнению с предыдущими двумя методами инъекции IP 4,10, новый метод может быть быстро освоен исследователями, не имеющими предыдущего опыта работы со взрослыми рыбками данио. Надежные модели ДВС, по-видимому, успешно получаются с первой или второй попытки в руках, по крайней мере, 4 различных исследователей. Об успешности инъекции можно легко сделать вывод в течение первой недели после инъекции: >80%, желательно 100%, рыба должна быть в состоянии выжить после инъекции. Все рыбы доживают до 56 dpi, когда большинство рыб (>80%) должны быть свободны от явных повреждений тела. Это значительное улучшение, потому что надежная модель ДВС, использующая первые два метода IP, может быть стабилизирована только в руках исследователя после более чем 3 раундов практики с не менее чем 10 рыбами в каждом раунде. Этот процесс может занять много времени, потому что каждая практика требовала около 2 месяцев, чтобы прийти к выводу об успехе инъекции. Уменьшение травматизации тканей не только улучшает самочувствие рыб, но и сводит к минимуму мешающие факторы, которые могут повлиять на результаты исследования.
Одним из важнейших шагов для обеспечения успеха нового метода является угол проникновения. Как показано на рисунке 2, при изменении угла проникновения с 0° до 45° отмечалась значительная гибель рыбы, предположительно из-за повышенного риска контакта между кончиком иглы и внутренними органами.
Основным ограничением метода является то, что метод не может быть использован для доставки лекарств рыбам младше 3 месяцев. Из-за небольших размеров тела молодые рыбы не могут выжить после физических повреждений, связанных с проникновением иглы. Тем не менее, метод может быть использован для взрослых рыб, когда их МТ превышает 0,15 г, в том числе в возрасте от 3 месяцев до 4 лет.
Этот новый метод будет широко использоваться для доставки лекарств взрослым рыбкам данио, особенно при работе с потенциально токсичными соединениями, такими как Dox15,16. Когда речь идет о нетоксичных соединениях, должны быть применимы все три метода.
Раскрытие информации
Никакой.
Благодарности
Это исследование было поддержано NIH (HL107304 и HL081753) и Фондом Майо (Центр биомедицинских открытий и сердечно-сосудистых исследований) компании X.X. J.L. финансируется Фондами фундаментальных исследований для центральных университетов Центрального Южного университета, No 56021702. Особая благодарность Бенинио Гору и Квентину Стивенсу за управление заводом по выращиванию рыбок данио.
Материалы
| Name | Company | Catalog Number | Comments |
| 10 μL NanoFil-syringe | World Precision Instruments, Inc | NANOFIL | injection tool |
| 34 G needle | World Precision Instruments, Inc | NI34BV-2 | injcetion tool |
| 60 mm Petri dish | fisher scientific/fisherbrand | FB0875713A | placing the sponge |
| Dissecting microscope | Nikon | SMZ800 | Injceting the Dox |
| Doxorubicin hydrochloride | Sigma | D1515-10MG | drug for creating DIC model |
| Echocardiography | VISUAL SONICS | Vevo 3100 | measuring cardiac function |
| Foam Sponge | Jaece Industries | L800-D | placing the fish |
| Hank's balanced salt solution (HBBS) | Thermo Fisher | 14025076 | Vehicle for Dox |
| Microcentrifuge | southernlabware | MyFuge/C1012 | collect the Dox solution |
| Precision Balance Scale | Torbal | AD60 | Digital scales |
| Tricaine | Argent | MS-222 | Anesthetizing fish |
| Tube | Eppendorf | 1.5 mL | storage |
| vevo LAB software | FUJIFILM VISUAL SONICS | 5.6.0 | quantification of the heart |
Ссылки
- Tavares, B., Lopes, S. S. The importance of Zebrafish in biomedical research. Acta Medica Portuguesa. 26 (5), 583-592 (2013).
- Dang, M., Henderson, R. E., Garraway, L. A., Zon, L. I. Long-term drug administration in the adult zebrafish using oral gavage for cancer preclinical studies. Disease Model Mech. 9 (7), 811-820 (2016).
- Sciarra, J. B., Tyler, A., Kolb, A. A gelatin-based diet for oral dosing juvenile to adult zebrafish (Danio rerio). Lab Animal Sci Prof. , https://api.semanticscholar.org/CorpusID:85611302 32-35 (2014).
- Kinkel, M. D., Eames, S. C., Philipson, L. H., Prince, V. E. Intraperitoneal injection into adult zebrafish. J Vis Exp. (42), e2126(2010).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J Vis Exp. (34), e1645(2009).
- Liu, J., et al. Intraperitoneally delivered mesenchymal stem cells alleviate experimental colitis through THBS1-mediated induction of IL-10-competent regulatory B cells. Front Immunol. 13, 853894(2022).
- De Smet, L., Ceelen, W., Remon, J. P., Vervaet, C. Optimization of drug delivery systems for intraperitoneal therapy to extend the residence time of the chemotherapeutic agent. The Scientific World Journal. 2013, 720858(2013).
- Dakwar, G. R., et al. Nanomedicine-based intraperitoneal therapy for the treatment of peritoneal carcinomatosis-Mission possible. Adv Drug Deliv Rev. 108, 13-24 (2017).
- Al Shoyaib, A., Archie, S. R., Karamyan, V. T. Intraperitoneal route of drug administration: should it be used in experimental animal studies. Pharmaceutical Res. 37, 1-17 (2020).
- Ma, X., Ding, Y., Wang, Y., Xu, X. A doxorubicin-induced cardiomyopathy model in adult zebrafish. J Vis Exp. (136), e57567(2018).
- Wang, L. W., et al. Standardized echocardiographic assessment of cardiac function in normal adult zebrafish and heart disease models. Disease Model Mech. 10 (1), 63-76 (2017).
- Christidi, E., Brunham, L. R. Regulated cell death pathways in doxorubicin-induced cardiotoxicity. Cell Death Dis. 12 (4), 339(2021).
- Zhu, W., Shou, W., Payne, R. M., Caldwell, R., Field, L. J. A mouse model for juvenile doxorubicin-induced cardiac dysfunction. Pediatric Res. 64 (5), 488-494 (2008).
- Podyacheva, E. Y., Kushnareva, E. A., Karpov, A. A., Toropova, Y. G. Analysis of models of doxorubicin-induced cardiomyopathy in rats and mice. A modern view from the perspective of the pathophysiologist and the clinician. Frontiers Pharmacol. 12, 670479(2021).
- Chaoul, V., et al. Assessing drug administration techniques in zebrafish models of neurological disease. Int J Mol Sci. 24 (19), 14898(2023).
- Lu, X., Lu, L., Gao, L., Wang, Y., Wang, W. Calycosin attenuates doxorubicin-induced cardiotoxicity via autophagy regulation in zebrafish models. Biomed Pharmacother. 137, 111375(2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены