Method Article
Eine intraperitoneale Injektionstechnik bei erwachsenen Zebrafischen, die Körperschäden und die damit verbundene Mortalität minimiert
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Eine neue intraperitoneale (IP) Injektionsmethode bei adulten Zebrafischen wird beschrieben. Beim Umgang mit toxischen Verbindungen wie Doxorubicin ist dieses Verfahren wirksamer als die beiden bisher berichteten IP-Methoden. Die Technik ist so konzipiert, dass sie von Forschern mit begrenzter Erfahrung im Zebrafischmodell leicht übernommen werden kann.
Zusammenfassung
Der erwachsene Zebrafisch (Danio rerio), der genetisch zugänglich ist, wird als wertvolles Wirbeltiermodell zur Erforschung menschlicher Erkrankungen wie der Kardiomyopathie eingesetzt. Die intraperitoneale (IP) Injektion ist eine wichtige Methode, die dem Körper Verbindungen zuführt, um entweder therapeutische Wirkungen zu testen oder Krankheitsmodelle wie die Doxorubicin-induzierte Kardiomyopathie (DIC) zu erstellen. Derzeit gibt es zwei Methoden der IP-Injektion. Beide Methoden haben Grenzen beim Umgang mit toxischen Verbindungen wie Doxorubicin, die zu Nebenwirkungen führen, die sich in schweren Schäden an der Körperform und dem Tod der Fische äußern. Während diese Mängel durch eine umfangreiche Schulung der Prüfärzte überwunden werden könnten, ist eine neue IP-Injektionsmethode mit minimalen Nebenwirkungen wünschenswert. Hier wird über eine einzigartige IP-Injektionsmethode berichtet, die in der Lage ist, mit toxischen Verbindungen umzugehen. Eine dauerhaft verminderte Herzfunktion kann die Folge sein, ohne dass es zu einem nennenswerten Fischsterben kommt. Die Technik kann von Forschern, die nur wenig Erfahrung mit erwachsenen Zebrafischen haben, leicht gemeistert werden.
Einleitung
Der Zebrafisch (Danio rerio) hat als experimentelles Modell für die Erforschung menschlicher Krankheiten Aufmerksamkeit erregt, da dieses Tier eine hohe Gen- und Organhomologie zum Menschen, externe Befruchtung, einfache genetische Manipulation und Körpertransparenz bis in die frühe Reife umfasst, was eine Vielzahl von bildgebenden Anwendungen ermöglicht1. Im Gegensatz zu dem einfachen Prozess, Medikamente für Zebrafischembryonen und -larven direkt ins Wasser zu bringen, stellt die Verabreichung von Medikamenten an erwachsene Zebrafische ein komplizierteres und herausfordernderes Unterfangendar 2.
Bei erwachsenen Fischen können Verbindungen durch passive Wirkstoffverabreichungstechniken wie die direkte Verabreichung ins Wasser oder durch orale Wirkstoffverabreichungsmethoden wie Gavaging2 abgegeben werden. Andere Ansätze umfassen das Beschichten von Fischfutter mit den Verbindungen und das anschließende Füttern der Fische3 und die direkte Verabreichung von wasserunlöslichen Medikamenten in einer vorgegebenen Konzentration, einschließlich retroorbitaler oder intraperitonealer Injektionen 4,5. Die intraperitoneale Verabreichung wird aufgrund ihrer ausgeprägten pharmakokinetischen Vorteile für In-vivo-Studien von Krankheitsmodellen bevorzugt6. Diese Methode bietet eine hohe Wirkstoffkonzentration und eine verlängerte Halbwertszeit in der Peritonealhöhle und bietet damit einen effektiven Weg für die Wirkstoffabgabe 7,8. Der Ansatz wird häufig in Forschungsumgebungen verwendet, um eine optimale Wirkstoffabsorption und -verteilung zu gewährleisten 9. Während sich injektionsbasierte Methoden bei der einmaligen Verabreichung als effizient erweisen, führen längere und wiederholte Injektionen häufig zu Körperschäden und chronischen Infektionen2.
Derzeit gibt es zwei Methoden der IP-Injektion bei adulten Zerbafischen 4,10. Beide Methoden haben jedoch Einschränkungen bei der Verabreichung von toxischen Verbindungen wie Doxorubicin, was zu schweren Schäden an der Körperform und zum Fischsterben führt. Die Nebenwirkungen können die Interpretation der Daten erheblich erschweren. Obwohl diese Herausforderungen mit umfangreichen Schulungen angegangen werden können10, besteht ein klarer Bedarf an einer neuen IP-Injektionsmethode, die Nebenwirkungen minimiert.
Unser Ziel ist es, eine neue Methode der IP-Injektion zu entwickeln, die für die effektive Verabreichung von Doxorubicin an erwachsene Zebrafische optimiert ist und die Generierung zuverlässiger Doxorubicin-induzierter Kardiomyopathie (DIC)-Modelle mit minimierter Körperschädigung und damit verbundener Mortalität ermöglicht.
Protokoll
Alle durchgeführten Verfahren wurden vom Mayo Clinic Institutional Animal Care and Use Committee genehmigt und hielten sich an die Standards, die im "Guide for the Care and Use of Laboratory Animals" (National Academies Press, 2011) dargelegt sind. Alle Zebrafische in der Studie gehören zum Stamm des Wild Indian Karyotype (WIK). Die Einzelheiten zu den Reagenzien und den für die Studie verwendeten Geräten sind in der Materialtabelle aufgeführt.
1. Zubereitung und Lagerung von Doxorubicin-Stammlösung
- Beziehen Sie den Doxorubicin-Bestand aus einer kommerziellen Quelle.
HINWEIS: Doxorubicin ist lichtempfindlich, also erwerben Sie es in Pulverform und lagern Sie es in undurchsichtigen Behältern, um es vor Lichteinwirkung zu schützen. Führen Sie alle Schritte für die Dox-Pulveraufbereitung in einer chemischen Haube durch. - Das Dox-Pulver wird vollständig in destilliertem Wasser aufgelöst und eine Stammlösung mit einer Endkonzentration von 5 mg/ml hergestellt.
- Aliquotieren Sie den Stamm, indem Sie ihn in 1,5-ml-Röhrchen aufteilen.
- Wickeln Sie die Röhren in Alufolie ein, um sie vor Lichteinwirkung zu schützen.
- Die aliquote Dox-Lösung ist bei 4 °C für die kurzfristige Lagerung (<1 Monat) oder -20 °C für die Langzeitlagerungzu lagern 10.
2. Gruppierung der Fische nach ihrem Körpergewicht
- Gruppieren Sie die Fische mit einer BW-Differenz von weniger als 10 % für die anschließende Injektion.
HINWEIS: Um in dieser Phase Aufwand zu sparen, werden Fische mit einer BW-Abweichung von weniger als 10 % als gleich groß kategorisiert. - Lassen Sie den Fisch vor der Injektion 24 Stunden nüchtern.
- Betäuben Sie den Fisch 1 Minute lang mit Embryonenwasser, das 0,16 mg/ml Tricain enthält.
- Nehmen Sie den Fisch mit Tricain aus dem Wasser und tupfen Sie beide Seiten des Fischkörpers mit sauberem Filterpapier ab, um überschüssiges Wasser zu entfernen.
- Messen und protokollieren Sie den BW jedes Fisches und setzen Sie den Fisch dann umgehend in einen Auffangbehälter zurück, der mit frischem Systemwasser gefüllt ist.
HINWEIS: Die Dox-Injektion wurde bei Fischen nach Erreichen des 3. Lebensmonats durchgeführt. In dieser Studie verwendeten die Forscher 3 Monate bis 10 Monate alte Fische. Die BWs von ausgewachsenen Zebrafischen des WIK-Stammes können zwischen 0,2 g und 0,5 g variieren. Eine verlängerte Narkose von mehr als 5 Minuten, gefolgt von einer Dox-Injektion, führte zu einer hohen Fischsterblichkeit.
3. Vorbereitung der Nadel und Station für die Injektion
- Bestimmen Sie das Injektionsvolumen der Dox-Stammlösung (z. B. 5 mg/ml), das für jeden Fisch auf der Grundlage des durchschnittlichen Körpergewichts erforderlich ist, um die Zieldosis von 20 μg/g zu erreichen.
- Verwenden Sie die folgende Formel, um das Einspritzvolumen zu berechnen:

- Fügen Sie 1x Hank's Balanced Salt Solution (HBSS) hinzu, um die in Schritt 1 für die Injektion berechnete Dox-Lösung zu verdünnen, bis ein Gesamtvolumen von 5 μl erreicht wird.
HINWEIS: Verwenden Sie die Schüttlösung für jede Gruppe von Fischen basierend auf ihrem BW und schließen Sie weitere 3 Fische in jede Gruppe ein, um sicherzustellen, dass es im Verlauf des Experiments keinen Mangel an Injektionslösung gibt. - Klopfen Sie vorsichtig auf das Röhrchen und zentrifugieren Sie dann kurz mit Höchstgeschwindigkeit, um die Lösung 10 s lang bei Raumtemperatur zu sammeln.
- Legen Sie die vorbereitete Lösung auf Eis und schützen Sie sie vor Lichteinwirkung.
- Stellen Sie eine saubere 100-mm-Petrischale mit einem Schwamm unter ein Präpariermikroskop und stellen Sie dann den Fokus ein.
HINWEIS: Der Schwamm enthält eine 4 cm lange Rille. Das elastische Zurückziehen des Schwamms gibt dem Fisch Halt und hält den Fischkörper in Position. Der Schwamm kann wiederverwendet werden. - Rüsten Sie eine 10-μl-Mikrospritze mit einer abgeschrägten 34-G-Nadel aus.
- Spülen Sie die Nadel mit 1x HBSS-Puffer, um Blasen zu beseitigen und mögliche Verstopfungen aus der Spritze zu entfernen.
- Messen Sie 5 μl der in Schritt 4 für die Injektion vorbereiteten Lösung.
4. Verfahren der IP-Dox-Injektion
- Legen Sie den erwachsenen Fisch 1 Minute lang mit 0,16 mg/ml Tricain in Wasser, um einen Zustand der Bewusstlosigkeit herbeizuführen.
- Positionieren Sie den Fisch in der Rille des eingebetteten Schwamms mit dem Bauch nach oben (Abbildung 1A).
- Führen Sie die Nadel mit einem Winkel nahe 0° ein, beginnend vom Mittelpunkt der Brustflosse in Richtung der hinteren Seite der Herzhöhle (Abbildung 1B).
HINWEIS: Vermeiden Sie während des Eingriffs jeglichen Kontakt mit dem Herzen. - Richte die Nadel auf den Schwanz und gehe unter die silberne Haut.
HINWEIS: Positionieren Sie die Nadel in unmittelbarer Nähe der Silberhaut und achten Sie darauf, dass keine Kratzer oder Löcher entstehen. - Überwachen Sie die Nadelspitze in der Bauchhöhle während der gesamten Operation (Abbildung 1C).
HINWEIS: Vermeiden Sie Schäden an Leber, Darm, Schwimmblase und anderen Organen. Stellen Sie sicher, dass die Nadel das Ende des Darms in der Nähe des Foramen kloakale erreicht. - Geben Sie die 5 μl Dox-Lösung allmählich und gleichmäßig ab und ziehen Sie die Nadel dann langsam entlang des ursprünglichen Weges zurück, um ein Auslaufen zu verhindern (Abbildung 1D).
- Überwachen Sie die Bauchhöhle auf das Vorhandensein von Dox, indem Sie eine rote Färbung der Dox-Lösung beobachten (Abbildung 1E).
- Bringen Sie den injizierten Fisch schnell in ein sauberes Kreuzungsbecken, das mit frischem Systemwasser gefüllt ist, damit sich der Fisch erholen kann.
HINWEIS: Spülen Sie die Nadel zwischen den Injektionen einmal mit 1x HBSS-Puffer.
5. Fischmanagement nach der Injektion
- Bringen Sie den Fisch nach der Injektion mit Zirkulation wieder in das System zurück.
- Fasten Sie alle injizierten Fische für weitere 24 Stunden, um ihre Genesung zu erleichtern.
- Behalten Sie in der ersten Woche die Fische genau im Auge. Entfernen Sie die verstorbenen Fische so schnell wie möglich, um eine Infektion der anderen Fische zu vermeiden.
HINWEIS: Der Tod von Fischen innerhalb der ersten 24 Stunden ist wahrscheinlich auf körperliche Verletzungen durch die Injektion oder eine längere Anästhesie zurückzuführen. Erfassen Sie die Anzahl der Fische, um eine Überlebenskurve zu erstellen. - Führen Sie eine Echokardiographie durch, um den Dox-injizierten Fisch 56 Tage nach der Injektion zu phänotypisieren11.
HINWEIS: Stellen Sie sicher, dass die Bedingungen und Verfahren für die entsprechende Kontrollgruppe, der HBSS-Lösung injiziert wurde, einheitlich sind.
Ergebnisse
Bisher wurden zwei intraperitoneale (IP) Methoden zur Verabreichung von Doxorubicin bei adulten Zebrafischen eingesetzt 4,10. Bei Methode I, auch bekannt als klassische IP-Injektionsmethode, wie von Kinkel et al.4 beschrieben, wurde die Nadel in einem 45°-Winkel zur Mittellinie zwischen den Beckenflossen mit dem Bauch nach oben eingeführt. Bei Methode II oder der alternativen IP-Injektionsmethode, wie sie von Ma et al.10 beschrieben wurde, wurde die Nadel durch die Rückenseite des Fisches eingeführt (Abbildung 2A(i,ii)). Im Gegensatz dazu weist unsere Methode III zwei wesentliche Änderungen auf. Zuerst wird die Position der Injektion verändert, wobei der Bauch nach oben zeigt und die Nadel vom Mittelpunkt der Brustflosse in Richtung Bauch gerichtet ist. Die Eindringstelle wird durch ein natürliches Loch in diesem Bereich geführt. Zweitens wird der Winkel der Nadel verkleinert, der nahe 0° liegen sollte (Abbildung 2A(iii), Abbildung 1).
Vergleich zwischen drei intraperitonealen Injektionsmethoden
Um die drei IP-Injektionsmethoden zu vergleichen, werden Daten von Forscher I vorgestellt, der noch keine Erfahrung mit Zebrafischen hatte. Bei der Anwendung der Methoden I und II für die IP-Injektion wurde eine signifikante Fischsterblichkeit in den ersten zwei Wochen nach der IP-Injektion festgestellt. Bei Methode I wurde der Tod drei Tage nach der Injektion beobachtet, während er bei Methode II zwei Tage nach der Injektion eintrat. 70 % der injizierten Fische wiesen sichtbare Körperschäden auf, insbesondere im Bereich der Injektionsstelle, die sich ein bis zwei Monate nach der IP-Injektion in einer drastisch reduzierten Körpergröße und einer gekrümmten Körperform manifestierten (Abbildung 2A (iv,v)). Es wurde argumentiert, dass die Mortalität und die beobachteten Schäden auf die Toxizität von Doxorubicin12 zurückgeführt werden könnten, das während des Injektionsvorgangs aus dem öffnenden Ende der Injektionsnadel austreten und das innere Organ entlang des Injektionswegs schädigen könnte. Bei Methode I könnte die Spitze der Injektionsnadel den Darm berühren (Abbildung 2A(i)), während sie bei Methode II die Schwimmblase berühren könnte (Abbildung 2A(ii)). Es wurde postuliert, dass man mit der Methode III verhindern könne, dass die Nadelspitze ein inneres Organ berührt (Abbildung 2A(iii)). Tatsächlich wurde eine signifikant verbesserte Überlebensrate festgestellt, wobei 80 % der Fische 1 Monat nach der Injektion überlebten (Abbildung 2B). Dies bedeutet eine bemerkenswerte Verbesserung im Vergleich zu den Überlebensraten der Methoden I und II, die bei 53,33 % bzw. 33,33 % lagen. Wichtig ist, dass 80 % der überlebenden Fische eine normale Körperform aufwiesen, im Gegensatz zu denen, die mit den Methoden I und II erzeugt wurden (Abbildung 2A(vi)). Um die erfolgreiche Generierung des DIC-Modells zu validieren, wurde die Herzfunktion durch Messung des Prozentsatzes der Ejektionsfraktion (EF%) bewertet. Tatsächlich wurde 56 Tage nach der Injektion in der Gruppe mit Methode III eine signifikante Verringerung des EF% beobachtet (Abbildung 2C).
Reproduzierbarkeit der Methode III durch verschiedene Forscher
Um zu beweisen, dass Methode III von verschiedenen Forschern leicht beherrscht werden kann, wurden 3 Forscher für die Studie rekrutiert, die noch nie zuvor mit Zebrafischen gearbeitet hatten. Bei ihren ersten Versuchen mit Methode III konnten alle Forscher 56 Tage nach der Injektion Überlebensraten von 85,71%, 95% und 83,33% und eine deutlich verringerte EF erreichen (Abbildung 3A,B). Bemerkenswert ist, dass drei Forscher ihr Experiment 3 Mal, 3 Mal bzw. 2 Mal wiederholten und durchweg erfolgreiche Ergebnisse erzielten. Diese Daten bestätigten die Wiederholbarkeit von Methode III, die es Forschern ohne vorherige Erfahrung in der Arbeit mit Fischen ermöglichte, zuverlässige DIC-Modelle zu erstellen.
In einem der ersten Versuche mit Methode III testete Forscher II eine Abweichung von Methode III: Statt 0° wurde ein 45°-Winkel verwendet, während die Nadel durch die Haut drang (Abbildung 2A(iii), gestrichelter Pfeil). Nur 15 % der Fische überlebten zwei Monate nach der Injektion (Abbildung 3A), wobei 80 % der überlebenden Fische erhebliche Körperschäden aufwiesen. Die Daten deuten darauf hin, dass der Winkel der Eindringtiefe ein kritischer Schritt für den Erfolg von Methode III ist.
Methode III ermöglicht die Etablierung eines chronischen DIC-Modells
Es wurde postuliert, dass eine signifikant reduzierte Körperschädigung mehrere IP-Injektionen in denselben Fisch ermöglichen könnte, was das chronische DIC-Modell bei Mäusen nachahmt13,14. Daher wurde Methode III verwendet, um eine Reihe von Injektionen über 4 aufeinanderfolgende Wochen mit 5 μg/g Dox pro Woche durchzuführen (Abbildung 4A). In diesem Experiment überlebten 100 % der injizierten Fische, und 80 % von ihnen zeigten keine Anzeichen von Körperschäden. Wichtig ist, dass eine signifikant reduzierte Ejektionsfraktion bei 56 dpi festgestellt wurde, was auf die erfolgreiche Generierung eines chronischen DIC-Modells bei adulten Zebrafischen hinweist (Abbildung 4B).
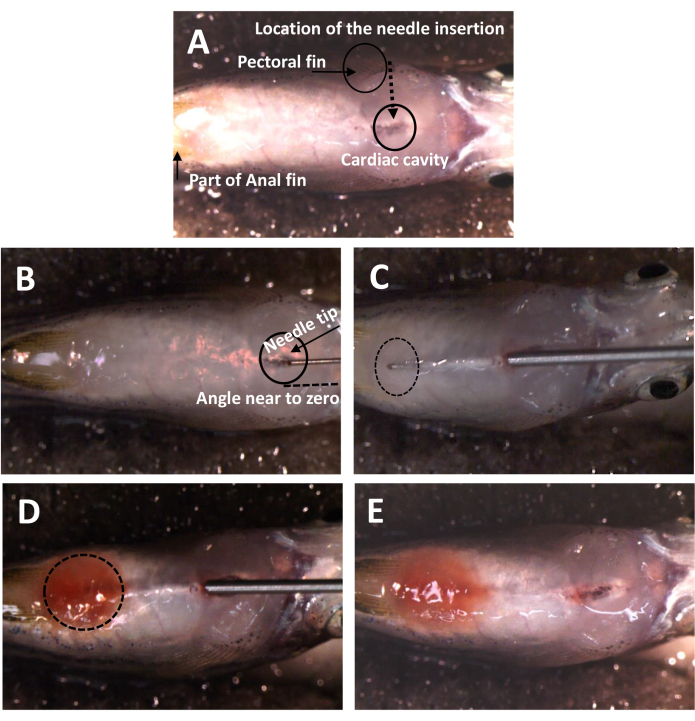
Abbildung 1: Lage und Winkel des Einstechens der Nadel für die neue IP-Injektionsmethode. (A) Die Position des Einstechens der Nadel. Der Fisch steht auf dem Kopf und legt die Bauchseite frei. Der Kopf befindet sich nach rechts. Zwischen den Brustflossen befindet sich ein natürliches Loch, das das Eindringen in die Haut erleichtert. (B) Der Winkel des Einstechens der Nadel. Er liegt nahe null Grad zur Oberfläche des Fisches. (C) Die Spur der Nadel unter der Haut. Die Spitze der Nadel wird kontinuierlich überwacht, sobald sie sich in der Bauchhöhle befindet. Der Eintrittspunkt unterscheidet sich von Abbildung 1A aufgrund der Hautverzerrung während des Penetrationsprozesses. (D) Ein Fisch nach der Freisetzung von Dox. Die Bauchhöhle färbt sich nach dem Lösen des Dox. (E) Ein Fisch nach IP-Injektion. Es gibt keine Anzeichen von Leckagen nach dem Zurückziehen der Nadel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
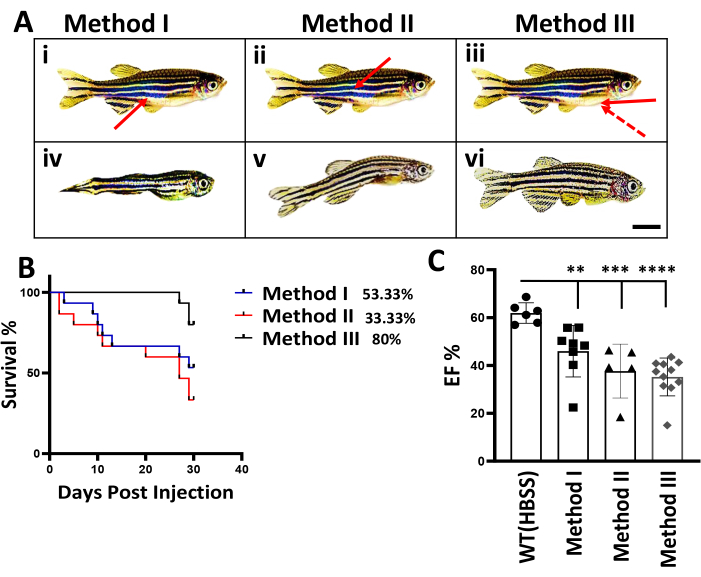
Abbildung 2: Vergleich von drei IP-Injektionsmethoden bei adulten Zebrafischen. (A) Schematische Darstellung von drei IP-Injektionsmethoden. (i-iii) Dargestellt sind schematische Schemata der klassischen IP-Injektion (Methode I), der alternativen IP-Injektion (Methode II) und der neuen Methode (Methode III). Pfeile zeigen die Einstichstellen und den Winkel der Nadel für drei Injektionsmethoden an. Gestrichelter Pfeil, ein erfolgloser Winkel der Nadelpenetration. Maßstabsleiste: 5 mm. (iv-vi) Reduzierte Körpergröße und gekrümmte Korpusform bei DIC-Modellen. Dargestellt sind repräsentative Fische aus DIC fish bei 56 dpi. (B) Vergleich der Überlebenskurven zwischen drei IP-Injektionsmethoden. Die Anzahl der überlebenden Fische wurde wöchentlich erfasst. (Das Experiment begann mit einer Summe von n = 15). (C) Beurteilung der Herzfunktion von Fischen bei 56 dpi nach Dox-Stress. n = 6 Fische in der 1x HBSS-Kontrollgruppe, und das Experiment begann mit insgesamt n = 15 Fischen in jeweils 3 Chargen, die mit Dox injiziert wurden. Die Werte werden als Mittelwert ± Standardfehlers angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Methode III ermöglicht es, das DIC-Modell des Zebrafisches konsistent in den Händen von 3 verschiedenen Forschern zu etablieren. (A) Überlebenskurven von DIC-Fischen mit Methode III von drei verschiedenen Forschern. Bei allen drei Untersuchern wurde eine hohe Überlebensrate festgestellt. Die Anzahl der lebenden Fische wird wöchentlich erfasst. Bei Forscher II wurde eine niedrige Überlebensrate festgestellt, wenn eine erfolglose Methode III angewendet wurde (45° Nadeleinstichwinkel, wie durch einen gestrichelten Pfeil in Abbildung 2A dargestellt). (B) Beurteilung der Herzfunktion von DIC-Fischen nach Methode III durch drei verschiedene Forscher. Insgesamt verwendete Forscher II für einen Nadeleinstichwinkel von 45° 3 Chargen (9, 12, 14) Fische für die Dox-Injektion. Für einen Nadeleinstichwinkel von 0° n = 6 wurden Fische in der 1x HBSS als gemeinsame Kontrollgruppe eingesetzt. Das Experiment begann mit insgesamt n = 85 Fischen mit RII (9, 12, 14), RIII (8, 6, 6) und RIV (12, 18), die in jeder der 8 Chargen verwendet wurden, die von drei Forschern (II, III, IV) mit Dox injiziert wurden. Die Werte werden als Mittelwert ± Standardfehlers angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
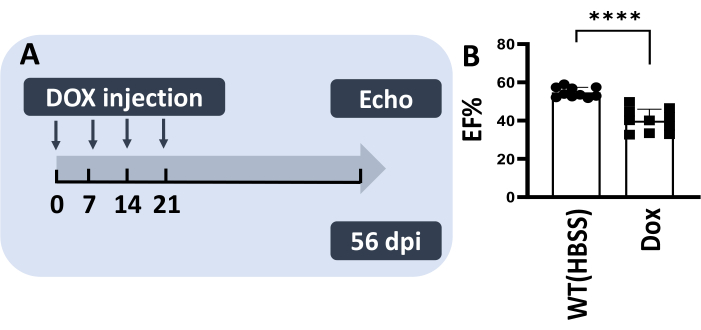
Abbildung 4: Methode III ermöglicht die Mehrfachinjektion von Dox in einen adulten Zebrafisch und rekapituliert chronische DIC-Modelle bei Nagetieren. (A) Schematische Darstellung des Mehrfachinjektionsmodells. 5 μg/g Dox (5 μl) wurden in vier aufeinanderfolgenden Wochen injiziert. (B) Das chronische DIC-Modell zeigt einen reduzierten EF% bei 56 dpi. Die Werte werden als Mittelwert ± Standardfehlers angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Anders als die beiden bestehenden IP-Injektionsverfahren 4,10 zeichnet sich das neue IP-Injektionsverfahren durch folgende Besonderheiten aus. Zunächst wird ein einzigartiger Nadeleinstichwinkel verwendet (nahe Null); Zweitens dringt die Nadel über eine einzigartige Stelle, d.h. ein natürliches Loch auf der Bauchoberfläche eines Fisches, in den Fisch ein, was die Injektion erleichtern würde; Und schließlich bewegt sich die Nadel von anterior nach posterior. Diese Anpassungen reduzieren effektiv Organverletzungen, die sich aus einem minimierten Austreten von Dox während des Penetrationsprozesses ergeben. Der Weg der Nadel befindet sich direkt unter der Silberhaut, die vom Untersucher kontinuierlich überwacht werden kann. So kann ein direkter Kontakt zwischen der Nadelspitze und den inneren Organen effektiv vermieden werden. Nach der Injektion verbleibt der gesamte injizierte Dox in der Bauchhöhle, und der einzige Ausgang (Einstichpunkt) kann geschlossen werden, wenn der Fisch wach ist und anfängt, vorwärts zu schwimmen.
Im Vergleich zu den beiden bestehenden IP-Injektionsmethoden 4,10 führt die neue IP-Injektionsmethode durchweg zu minimierten Körperschäden und verbesserten Überlebensraten. Diese Aussage wurde auch durch die Machbarkeit mehrerer Injektionen in denselben Fisch zur Erstellung eines chronischen Zebrafisch-DIC-Modells unterstrichen. Wichtig ist, dass die neue Methode im Vergleich zu den beiden vorherigen IP-Injektionsmethoden 4,10 von Forschern, die noch keine Erfahrung im Umgang mit erwachsenen Zebrafischen haben, schnell beherrscht werden kann. Zuverlässige DIC-Modelle scheinen beim ersten oder zweiten Versuch in den Händen von mindestens 4 verschiedenen Untersuchern erfolgreich gewonnen zu werden. Der Erfolg der Injektion lässt sich innerhalb der ersten Woche nach der Injektion leicht feststellen: >80%, vorzugsweise 100%, sollten die Fische nach der Injektion überleben können. Alle Fische überleben bis zu 56 dpi, wenn die Mehrheit der Fische (>80%) frei von offensichtlichen Körperschäden sein sollte. Dies ist eine deutliche Verbesserung, da ein zuverlässiges DIC-Modell mit den ersten beiden IP-Methoden erst nach mehr als 3 Übungsrunden mit mindestens 10 Fischen in jeder Runde in der Hand eines Forschers stabilisiert werden kann. Dieser Prozess kann zeitaufwändig sein, da jede Praxis etwa 2 Monate benötigt, um über den Erfolg der Injektion zu entscheiden. Die Reduzierung von Gewebetraumata verbessert nicht nur das Wohlbefinden der Fische, sondern minimiert auch Störfaktoren, die die Ergebnisse der Studie beeinflussen könnten.
Ein entscheidender Schritt, um den Erfolg des neuen Verfahrens zu gewährleisten, ist der Eindringwinkel. Wie in Abbildung 2 gezeigt, wurde bei einer Änderung des Einstichwinkels von 0° auf 45° ein signifikantes Fischsterben festgestellt, vermutlich aufgrund eines erhöhten Risikos eines Kontakts zwischen der Nadelspitze und den inneren Organen.
Die Haupteinschränkung der Methode besteht darin, dass die Methode nicht zur Verabreichung von Medikamenten an Fische unter 3 Monaten verwendet werden kann. Aufgrund ihrer geringen Körpergröße können junge Fische nach den körperlichen Schäden, die mit dem Eindringen einer Nadel verbunden sind, nicht überleben. Die Methode kann jedoch bei erwachsenen Fischen angewendet werden, wenn ihr BW größer als 0,15 g ist, einschließlich Fischen im Alter von 3 Monaten bis 4 Jahren.
Diese neue Methode würde in großem Umfang für die Verabreichung von Medikamenten bei erwachsenen Zebrafischen eingesetzt werden, insbesondere beim Umgang mit potenziell toxischen Verbindungen wie Dox15,16. Wenn es um ungiftige Verbindungen geht, sollten alle drei Methoden anwendbar sein.
Offenlegungen
Nichts.
Danksagungen
Diese Studie wurde von den NIH (HL107304 und HL081753) und der Mayo Foundation (Center for Biomedical Discovery and Cardiovascular Research Center) bis X.X. J.L. wird von den Fundamental Research Funds for the Central Universities der Central South University, Nr. 56021702, finanziert. Besonderer Dank geht an Beninio Gore und Quentin Stevens für die Leitung der Zebrafischanlage.
Materialien
| Name | Company | Catalog Number | Comments |
| 10 μL NanoFil-syringe | World Precision Instruments, Inc | NANOFIL | injection tool |
| 34 G needle | World Precision Instruments, Inc | NI34BV-2 | injcetion tool |
| 60 mm Petri dish | fisher scientific/fisherbrand | FB0875713A | placing the sponge |
| Dissecting microscope | Nikon | SMZ800 | Injceting the Dox |
| Doxorubicin hydrochloride | Sigma | D1515-10MG | drug for creating DIC model |
| Echocardiography | VISUAL SONICS | Vevo 3100 | measuring cardiac function |
| Foam Sponge | Jaece Industries | L800-D | placing the fish |
| Hank's balanced salt solution (HBBS) | Thermo Fisher | 14025076 | Vehicle for Dox |
| Microcentrifuge | southernlabware | MyFuge/C1012 | collect the Dox solution |
| Precision Balance Scale | Torbal | AD60 | Digital scales |
| Tricaine | Argent | MS-222 | Anesthetizing fish |
| Tube | Eppendorf | 1.5 mL | storage |
| vevo LAB software | FUJIFILM VISUAL SONICS | 5.6.0 | quantification of the heart |
Referenzen
- Tavares, B., Lopes, S. S. The importance of Zebrafish in biomedical research. Acta Medica Portuguesa. 26 (5), 583-592 (2013).
- Dang, M., Henderson, R. E., Garraway, L. A., Zon, L. I. Long-term drug administration in the adult zebrafish using oral gavage for cancer preclinical studies. Disease Model Mech. 9 (7), 811-820 (2016).
- Sciarra, J. B., Tyler, A., Kolb, A. A gelatin-based diet for oral dosing juvenile to adult zebrafish (Danio rerio). Lab Animal Sci Prof. , https://api.semanticscholar.org/CorpusID:85611302 32-35 (2014).
- Kinkel, M. D., Eames, S. C., Philipson, L. H., Prince, V. E. Intraperitoneal injection into adult zebrafish. J Vis Exp. (42), e2126(2010).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J Vis Exp. (34), e1645(2009).
- Liu, J., et al. Intraperitoneally delivered mesenchymal stem cells alleviate experimental colitis through THBS1-mediated induction of IL-10-competent regulatory B cells. Front Immunol. 13, 853894(2022).
- De Smet, L., Ceelen, W., Remon, J. P., Vervaet, C. Optimization of drug delivery systems for intraperitoneal therapy to extend the residence time of the chemotherapeutic agent. The Scientific World Journal. 2013, 720858(2013).
- Dakwar, G. R., et al. Nanomedicine-based intraperitoneal therapy for the treatment of peritoneal carcinomatosis-Mission possible. Adv Drug Deliv Rev. 108, 13-24 (2017).
- Al Shoyaib, A., Archie, S. R., Karamyan, V. T. Intraperitoneal route of drug administration: should it be used in experimental animal studies. Pharmaceutical Res. 37, 1-17 (2020).
- Ma, X., Ding, Y., Wang, Y., Xu, X. A doxorubicin-induced cardiomyopathy model in adult zebrafish. J Vis Exp. (136), e57567(2018).
- Wang, L. W., et al. Standardized echocardiographic assessment of cardiac function in normal adult zebrafish and heart disease models. Disease Model Mech. 10 (1), 63-76 (2017).
- Christidi, E., Brunham, L. R. Regulated cell death pathways in doxorubicin-induced cardiotoxicity. Cell Death Dis. 12 (4), 339(2021).
- Zhu, W., Shou, W., Payne, R. M., Caldwell, R., Field, L. J. A mouse model for juvenile doxorubicin-induced cardiac dysfunction. Pediatric Res. 64 (5), 488-494 (2008).
- Podyacheva, E. Y., Kushnareva, E. A., Karpov, A. A., Toropova, Y. G. Analysis of models of doxorubicin-induced cardiomyopathy in rats and mice. A modern view from the perspective of the pathophysiologist and the clinician. Frontiers Pharmacol. 12, 670479(2021).
- Chaoul, V., et al. Assessing drug administration techniques in zebrafish models of neurological disease. Int J Mol Sci. 24 (19), 14898(2023).
- Lu, X., Lu, L., Gao, L., Wang, Y., Wang, W. Calycosin attenuates doxorubicin-induced cardiotoxicity via autophagy regulation in zebrafish models. Biomed Pharmacother. 137, 111375(2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten