Method Article
Une technique d’injection intrapéritonéale chez le poisson-zèbre adulte qui minimise les dommages corporels et la mortalité associée
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Une nouvelle méthode d’injection intrapéritonéale (IP) chez le poisson-zèbre adulte est décrite. Lors de la manipulation de composés toxiques tels que la doxorubicine, cette procédure est plus efficace que les deux méthodes de propriété intellectuelle précédemment mentionnées. La technique est conçue pour être facilement adoptée par les chercheurs ayant une expérience limitée du modèle du poisson zèbre.
Résumé
Le poisson-zèbre adulte (Danio rerio), qui est génétiquement accessible, est utilisé comme un modèle de vertébré précieux pour étudier des troubles humains tels que la cardiomyopathie. L’injection intrapéritonéale (IP) est une méthode importante qui délivre des composés dans le corps pour tester des effets thérapeutiques ou générer des modèles de maladies tels que la cardiomyopathie induite par la doxorubicine (CIVD). Actuellement, il existe deux méthodes d’injection IP. Les deux méthodes ont des limites lors de la manipulation de composés toxiques tels que la doxorubicine, qui entraînent des effets secondaires se manifestant par de graves dommages à la forme du corps et la mort des poissons. Bien que ces lacunes puissent être surmontées par une formation approfondie des enquêteurs, une nouvelle méthode d’injection de PI qui a un minimum d’effets secondaires est souhaitable. Ici, une méthode d’injection IP unique capable de gérer des composés toxiques est rapportée. Une réduction constante de la fonction cardiaque peut entraîner sans entraîner de mort significative des poissons. La technique peut être facilement maîtrisée par des chercheurs qui ont une expérience minimale avec les poissons-zèbres adultes.
Introduction
Le poisson-zèbre (Danio rerio) a attiré l’attention en tant que modèle expérimental pour l’étude des maladies humaines parce que cet animal présente une homologie élevée de gènes et d’organes avec les humains, une fécondation externe, une facilité de manipulation génétique et une transparence corporelle jusqu’à la maturité précoce, ce qui facilite une myriade d’applications d’imagerie1. Contrairement au processus simple consistant à administrer des médicaments directement dans l’eau pour les embryons et les larves de poisson-zèbre, l’administration de médicaments aux poissons-zèbres adultes présente une entreprise plus complexe et plus difficile2.
Chez les poissons adultes, les composés peuvent être délivrés par des techniques d’administration passive de médicaments, telles que l’administration directe dans l’eau, ou par des méthodes d’administration orale de médicaments comme le gavaging2. D’autres approches comprennent l’enrobage de la nourriture pour poissons avec les composés et l’alimentation ultérieure des poissons3, et l’administration directe de médicaments insolubles dans l’eau à une concentration prédéterminée, y compris des injections rétro-orbitaires ou intrapéritonéales 4,5. L’administration intrapéritonéale est préférée pour les études in vivo de modèles de maladies en raison de ses avantages pharmacocinétiques distincts6. Cette méthode permet d’obtenir une concentration élevée de médicament et une demi-vie prolongée dans la cavité péritonéale, offrant une voie efficace pour l’administration de médicaments 7,8. L’approche est couramment utilisée dans les milieux de recherche pour assurer une absorption et une distribution optimales des médicaments 9. Alors que les méthodes basées sur l’injection s’avèrent efficaces pour l’administration unique, les injections prolongées et répétées entraînent souvent des lésions corporelles et des infections chroniques2.
Actuellement, il existe deux méthodes d’injection IP chez les zerbafish adultes 4,10. Cependant, les deux méthodes ont des limites lorsqu’elles délivrent des composés toxiques comme la doxorubicine, entraînant de graves dommages à la forme du corps et la mortalité des poissons. Les effets secondaires peuvent compliquer considérablement l’interprétation des données. Bien que ces défis puissent être relevés grâce à une formation approfondie10, il existe un besoin évident d’une nouvelle méthode d’injection de propriété intellectuelle qui minimise les effets secondaires.
Ici, notre objectif est de développer une nouvelle méthode d’injection IP optimisée pour l’administration efficace de doxorubicine dans le poisson-zèbre adulte, facilitant la génération de modèles fiables de cardiomyopathie induite par la doxorubicine (CIVD) avec une minimisation des dommages corporels et de la mortalité associée.
Protocole
Toutes les procédures effectuées ont été approuvées par le comité institutionnel de soins et d’utilisation des animaux de la Mayo Clinic, conformément aux normes décrites dans le « Guide pour le soin et l’utilisation des animaux de laboratoire » (National Academies Press, 2011). Tous les poissons-zèbres de l’étude appartiennent à la souche Wild Indian Karyotype (WIK). Les détails des réactifs et de l’équipement utilisé pour l’étude sont répertoriés dans la table des matériaux.
1. Préparation et stockage de la solution mère de doxorubicine
- Obtenez le stock de doxorubicine d’une source commerciale.
REMARQUE : La doxorubicine est sensible à la lumière, alors acquérez-la sous forme de poudre et stockez-la dans des récipients opaques pour la protéger de l’exposition à la lumière. Effectuez toutes les étapes de la préparation de la poudre de Dox à l’intérieur d’une hotte chimique. - Dissoudre complètement la poudre de Dox dans de l’eau distillée et préparer une solution mère avec une concentration finale de 5 mg/mL.
- Aliquote la crosse en la divisant en tubes de 1,5 mL.
- Enveloppez les tubes dans du papier d’aluminium pour les protéger de l’exposition à la lumière.
- Conserver la solution aliquote Dox à 4 °C pour un stockage à court terme (<1 mois), ou à -20 °C pour un stockage à long terme10.
2. Regrouper les poissons en fonction de leur poids corporel
- Regroupez les poissons présentant une différence de poids corporel inférieure à 10 % pour l’injection ultérieure.
REMARQUE : Pour économiser des efforts à cette étape, les poissons dont l’écart de poids corporel est inférieur à 10 % sont classés comme étant de la même taille. - Laissez le poisson jeûner pendant 24 heures avant l’injection.
- Anesthésier le poisson à l’aide d’eau embryonnaire contenant 0,16 mg/mL de tricaïne pendant 1 min.
- Sortez le poisson de l’eau avec de la tricaïne et tamponnez les deux côtés du corps du poisson avec du papier filtre propre pour éliminer l’excès d’eau.
- Mesurez et consignez le poids corporel de chaque poisson, puis remettez-le rapidement dans un bassin de récupération rempli d’eau douce du système.
REMARQUE : L’injection de dox a été effectuée sur des poissons après avoir atteint l’âge de 3 mois. Dans cette étude, les chercheurs ont utilisé des poissons âgés de 3 à 10 mois. Les poids corporels du poisson-zèbre de souche WIK mature peuvent varier de 0,2 g à 0,5 g. Une anesthésie prolongée de plus de 5 minutes, suivie d’une injection de Dox, a entraîné une mortalité élevée des poissons.
3. Préparation de l’aiguille et de la station pour l’injection
- Déterminer le volume d’injection de la solution mère de Dox (p. ex., 5 mg/mL) nécessaire pour chaque poisson en fonction du poids corporel moyen pour atteindre la dose cible de 20 μg/g.
- Utilisez la formule suivante pour calculer le volume d’injection :

- Ajouter 1 solution saline équilibrée de Hank (HBSS) pour diluer la solution de Dox calculée à l’étape 1 pour l’injection, atteignant un volume total de 5 μL.
REMARQUE : Utilisez une solution en vrac pour chaque groupe de poissons en fonction de leur poids corporel et incluez 3 poissons supplémentaires dans chaque groupe pour s’assurer qu’il n’y a pas de pénurie de solution injectable au cours de l’expérience. - Tapotez doucement le tube, puis faites une brève microcentrifugeuse à grande vitesse pour recueillir la solution à température ambiante pendant 10 s.
- Placez la solution préparée sur de la glace et protégez-la de l’exposition à la lumière.
- Placez une boîte de Pétri propre de 100 mm avec une éponge sous un microscope à dissection, puis ajustez la mise au point.
REMARQUE : L’éponge contient une rainure de 4 cm de long. La rétraction élastique de l’éponge fournira au poisson un soutien et maintiendra le corps du poisson en position. L’éponge peut être réutilisée. - Équipez une micro-seringue de 10 μL d’une aiguille biseautée de 34 G.
- Rincez l’aiguille avec 1 tampon HBSS pour éliminer les bulles et éliminer les blocages potentiels de la seringue.
- Mesurer 5 μL de la solution préparée à l’étape 4 pour l’injection.
4. Procédure d’injection IP Dox
- Mettez le poisson adulte dans de l’eau avec 0,16 mg/mL de tricaïne pendant 1 min pour induire un état d’inconscience.
- Placez le poisson dans la rainure de l’éponge incrustée, l’abdomen vers le haut (figure 1A).
- Insérez l’aiguille avec un angle proche de 0°, en partant du milieu de la nageoire pectorale vers la face postérieure de la cavité cardiaque (Figure 1B).
REMARQUE : Évitez tout contact avec le cœur pendant la procédure. - Dirigez l’aiguille vers la queue et passez sous la peau argentée.
REMARQUE : Placez l’aiguille à proximité de la peau argentée, en prenant soin d’éviter toute égratignure ou perçage. - Surveillez la pointe de l’aiguille dans la cavité abdominale tout au long de l’opération (Figure 1C).
REMARQUE : Évitez d’endommager le foie, les intestins, la vessie natatoire et d’autres organes. Assurez-vous que l’aiguille atteint l’extrémité de l’intestin, près du foramen cloacal. - Distribuez graduellement et uniformément la solution de Dox de 5 μL, puis retirez lentement l’aiguille le long du chemin d’origine pour éviter toute fuite (Figure 1D).
- Surveillez la cavité abdominale pour détecter la présence de Dox en observant une coloration rouge de la solution de Dox (Figure 1E).
- Déplacez rapidement le poisson injecté dans un réservoir de passage propre rempli d’eau douce du système pour aider le poisson à récupérer.
REMARQUE : Entre les injections, rincez l’aiguille une fois avec 1x tampon HBSS.
5. Gestion des poissons après l’injection
- Remettez le poisson dans le système avec circulation après l’injection.
- Jeûnez tous les poissons injectés pendant 24 heures supplémentaires pour faciliter leur récupération.
- Pendant la première semaine, gardez un œil attentif sur les poissons. Retirez les poissons morts dès que possible pour éviter d’infecter les autres poissons.
REMARQUE : La mort des poissons dans les 24 premières heures est probablement due à des blessures physiques causées par l’injection ou une anesthésie prolongée. Enregistrez le nombre de poissons pour générer une courbe de survie. - Effectuer une échocardiographie pour phénotyper le poisson injecté de Dox à 56 jours après l’injection11.
REMARQUE : Assurer l’uniformité des conditions et des procédures pour le groupe témoin correspondant injecté avec la solution HBSS.
Résultats
Auparavant, deux méthodes intrapéritonéales (IP) ont été employées pour l’administration de doxorubicine chez le poisson-zèbre adulte 4,10. Dans la méthode I, également connue sous le nom de méthode d’injection IP classique décrite par Kinkel et al.4, l’aiguille a été insérée à un angle de 45° par rapport à la ligne médiane entre les nageoires pelviennes, l’abdomen vers le haut. Dans la méthode II, ou la méthode d’injection IP alternative décrite par Ma et al.10, l’aiguille a été insérée à travers la face dorsale du poisson (Figure 2A(i,ii)). En revanche, notre méthode III comporte deux changements majeurs. Tout d’abord, la position de l’injection est modifiée, l’abdomen tourné vers le haut et l’aiguille dirigée du milieu de la nageoire pectorale vers l’abdomen. Le site de pénétration est guidé par un trou naturel dans cette zone. Deuxièmement, l’angle de l’aiguille est réduit, qui doit être proche de 0° (Figure 2A(iii), Figure 1).
Comparaison entre trois méthodes d’injection intrapéritonéale
Pour comparer les trois méthodes d’injection IP, les données obtenues auprès du chercheur I, qui n’avait pas d’expérience préalable avec le poisson zèbre, sont présentées. Lorsque les méthodes I et II ont été utilisées pour l’injection IP, une mortalité significative des poissons a été notée au cours des deux premières semaines suivant l’injection IP. Dans la méthode I, la mort a été observée trois jours après l’injection, tandis que dans la méthode II, elle s’est produite deux jours après l’injection. 70 % des poissons injectés présentaient des lésions corporelles visibles, en particulier autour du site d’injection, se manifestant par une réduction drastique de la taille du corps et une forme incurvée du corps un à deux mois après l’injection IP (figure 2A (iv, v)). Il a été estimé que la mortalité et les dommages observés pouvaient être attribués à la toxicité de la doxorubicine12, qui pouvait s’échapper de l’extrémité initiale de l’aiguille d’injection pendant le processus d’injection, endommageant l’organe interne le long de la voie d’injection. Dans la méthode I, l’extrémité de l’aiguille d’injection pouvait toucher l’intestin (Figure 2A(i)), tandis que dans la méthode II, elle pouvait toucher la vessie natatoire (Figure 2A(ii)). Il a été postulé que l’on pouvait empêcher la pointe de l’aiguille de toucher un organe interne en utilisant la méthode III (Figure 2A(iii)). En effet, une amélioration significative du taux de survie a été notée, avec 80 % des poissons survivant 1 mois après l’injection (Figure 2B). Il s’agit d’une amélioration remarquable par rapport aux taux de survie des méthodes I et II, qui étaient respectivement de 53,33 % et 33,33 %. Il est important de noter que 80 % des poissons survivants présentaient une forme corporelle normale, contrairement à celles générées par les méthodes I et II (figure 2A(vi)). Pour valider la génération réussie du modèle DIC, la fonction cardiaque a été évaluée en mesurant le pourcentage de fraction d’éjection (FE%). En effet, une réduction significative de la FE% a été observée 56 jours après l’injection dans le groupe utilisant la méthode III (Figure 2C).
Reproductibilité de la méthode III par différents chercheurs
Pour prouver que la méthode III peut être facilement maîtrisée par différents chercheurs, 3 chercheurs qui n’avaient jamais travaillé avec le poisson-zèbre ont été recrutés auparavant. Lors de leurs premiers essais avec la méthode III, tous les chercheurs ont pu atteindre des taux de survie de 85,71 %, 95 % et 83,33 % 56 jours après l’injection et une FE nettement diminuée (figures 3A, B). Il est à noter que trois chercheurs ont répété leur expérience 3 fois, 3 fois et 2 fois, respectivement, et ont systématiquement obtenu des résultats positifs. Ces données ont confirmé la répétabilité de la méthode III, permettant aux chercheurs sans expérience préalable de travailler avec des poissons de générer des modèles CID fiables.
Lors de l’une des premières tentatives d’utilisation de la méthode III, le chercheur II a testé une déviation de la méthode III : au lieu de 0°, un angle de 45° a été utilisé lors de la pénétration de l’aiguille à travers la peau (Figure 2A(iii), flèche pointillée). Seulement 15 % des poissons ont survécu deux mois après l’injection (figure 3A), et 80 % des poissons ont présenté des dommages corporels considérables. Les données ont indiqué que l’angle de pénétration est une étape critique pour le succès de la méthode III.
La méthode III permet d’établir un modèle de CIVD chronique
Il a été postulé que des dommages corporels significativement réduits pourraient permettre plusieurs injections IP chez le même poisson, imitant le modèle de CID chronique chez les souris13,14. Par conséquent, la méthode III a été utilisée pour effectuer une série d’injections pendant 4 semaines consécutives, avec 5 μg/g de Dox par semaine (Figure 4A). Dans cette expérience, 100% des poissons injectés ont survécu et 80% d’entre eux ne présentaient aucun signe de dommages corporels. Il est important de noter qu’une fraction d’éjection significativement réduite a été notée à 56 dpi, ce qui indique la génération réussie d’un modèle de CIVD chronique chez le poisson-zèbre adulte (Figure 4B).
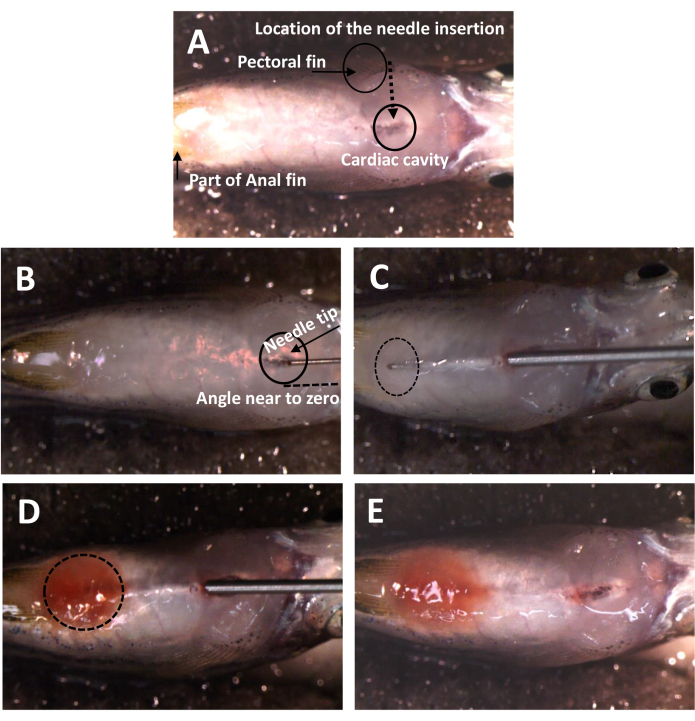
Figure 1 : Emplacement et angle d’insertion de l’aiguille pour la nouvelle méthode d’injection IP. (A) L’emplacement de l’insertion de l’aiguille. Le poisson est à l’envers, exposant la face abdominale. La tête est à droite. Un trou naturel est situé entre les nageoires pectorales qui facilite la pénétration de la peau. (B) L’angle d’insertion de l’aiguille. Il est proche de zéro degré à la surface du poisson. (C) La trace de l’aiguille sous la peau. La pointe de l’aiguille est surveillée en permanence une fois à l’intérieur de la cavité abdominale. Le point d’entrée semble différent de la figure 1A en raison de la distorsion de la peau pendant le processus de pénétration. (D) Un poisson après la remise à l’eau de Dox. La cavité abdominale devient rouge après avoir relâché le Dox. (E) Un poisson après injection IP. Il n’y a aucun signe de fuite après avoir retiré l’aiguille. Veuillez cliquer ici pour voir une version agrandie de cette figure.
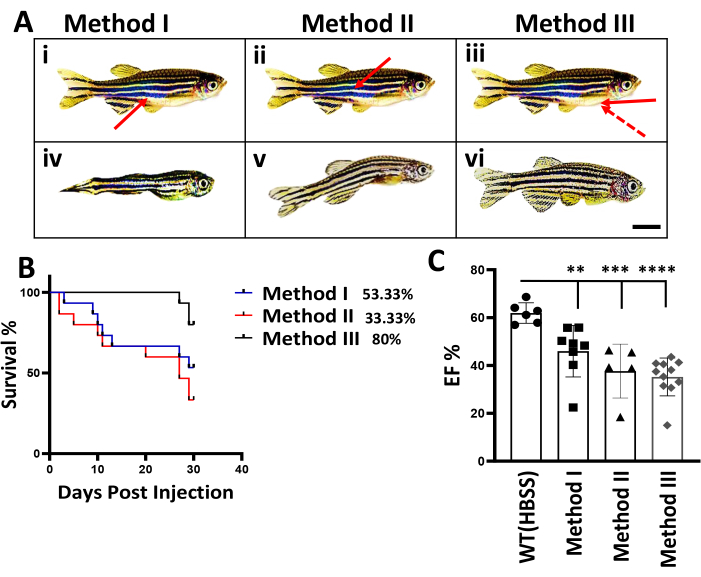
Figure 2 : Comparaison de trois méthodes d’injection IP chez le poisson-zèbre adulte. (A) Schémas de trois méthodes d’injection IP. (i) à iii) On y trouve les schémas de l’injection IP classique (méthode I), de l’injection IP alternative (méthode II) et de la nouvelle méthode (méthode III). Les flèches indiquent les sites de pénétration et l’angle de l’aiguille pour trois méthodes d’injection. Flèche pointillée, un angle de pénétration de l’aiguille infructueux. Barre d’échelle : 5 mm. (iv-vi) Taille du corps réduite et forme du corps incurvée dans les modèles DIC. On voit des poissons représentatifs des poissons DIC à 56 dpi. (B) Comparaison des courbes de survie entre trois méthodes d’injection IP. Le nombre de poissons survivants a été enregistré chaque semaine. (L’expérience a commencé avec un total de n = 15). (C) Évaluation de la fonction cardiaque des poissons à 56 dpi après un stress Dox. n = 6 poissons dans le groupe témoin 1x HBSS, et l’expérience a commencé avec un total de n = 15 poissons dans chacun des 3 lots injectés avec Dox. Les valeurs sont indiquées sous forme de moyenne ± d’erreur type. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : La méthode III permet d’établir le modèle de CID du poisson-zèbre de manière cohérente entre les mains de 3 chercheurs différents. (A) Courbes de survie des poissons CID à l’aide de la méthode III par trois chercheurs différents. Un taux de survie élevé a été noté chez les trois chercheurs. Le nombre de poissons vivants est enregistré chaque semaine. Un faible taux de survie a été observé chez le chercheur II lorsqu’une méthode III a été utilisée sans succès (angle de pénétration de l’aiguille de 45°, comme le montre une flèche pointillée dans la figure 2A). (B) Évaluation de la fonction cardiaque de poissons CID à l’aide de la méthode III par trois chercheurs différents. Au total, Researcher II, pour un angle de pénétration de l’aiguille de 45°, a utilisé 3 lots (9, 12, 14) de poissons pour l’injection de Dox. Pour un angle de pénétration de l’aiguille de 0°, n = 6, les poissons ont été utilisés dans le HBSS 1x comme groupe témoin partagé. L’expérience a commencé avec un total de n = 85 poissons avec RII (9, 12, 14), RIII (8, 6, 6) et RIV (12, 18) employés dans chacun des 8 lots injectés de Dox par trois chercheurs (II, III, IV), respectivement. Les valeurs sont indiquées sous forme de moyenne ± d’erreur type. Veuillez cliquer ici pour voir une version agrandie de cette figure.
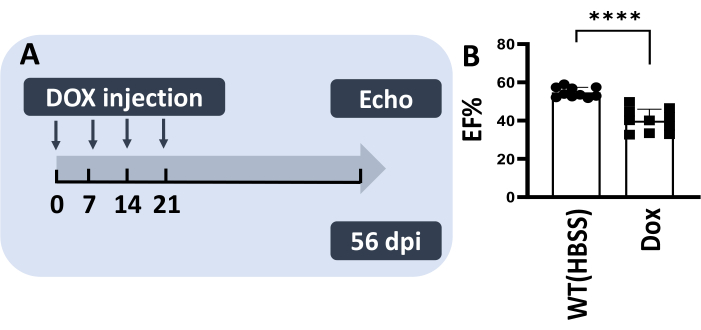
Figure 4 : La méthode III permet des injections multiples de Dox chez un poisson-zèbre adulte, récapitulant les modèles de CIVD chroniques chez les rongeurs. (A) Schémas du modèle d’injection multiple. 5 μg/g de Dox (5 μL) ont été injectés pendant quatre semaines consécutives. (B) Le modèle de CIVD chronique présente une réduction du pourcentage d’efficacité à 56 ppp. Les valeurs sont indiquées sous forme de moyenne ± d’erreur type. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Différente des deux méthodes d’injection IP existantes 4,10, la nouvelle méthode d’injection IP se caractérise par les caractéristiques distinctes suivantes. Tout d’abord, un angle de pénétration unique de l’aiguille est utilisé (proche de zéro) ; deuxièmement, l’aiguille pénètre dans le poisson par un emplacement unique, c’est-à-dire un trou naturel sur la surface ventrale d’un poisson, ce qui faciliterait l’injection ; et enfin, le mouvement de l’aiguille se fait de l’avant vers l’arrière. Ces ajustements réduisent efficacement les lésions organiques, ce qui résulte d’une fuite minimisée de Dox pendant le processus de pénétration. Le trajet de l’aiguille se trouve juste sous la peau argentée, qui peut être surveillée en permanence par l’enquêteur. Par conséquent, le contact direct entre la pointe de l’aiguille et les organes internes peut être évité efficacement. Après l’injection, tout le Dox injecté reste dans la cavité abdominale, et la seule sortie (point de ponction) peut être fermée lorsque le poisson est éveillé et commence à nager vers l’avant.
Comparativement aux deux méthodes d’injection IP existantes 4,10, la nouvelle méthode d’injection IP permet de minimiser les dommages corporels et d’améliorer les taux de survie. Cette affirmation a été soulignée par la faisabilité d’injections multiples chez le même poisson pour générer un modèle de CID chronique de poisson-zèbre. Il est important de noter que, par rapport auxdeux méthodes d’injection IP précédentes4,10, la nouvelle méthode peut être rapidement maîtrisée par des chercheurs qui n’ont aucune expérience préalable de la manipulation du poisson-zèbre adulte. Des modèles DIC fiables semblent avoir été obtenus avec succès lors de leur premier ou deuxième essai entre les mains d’au moins 4 chercheurs différents. Le succès de l’injection peut être facilement conclu dans la première semaine suivant l’injection : >80 %, de préférence 100 %, les poissons devraient pouvoir survivre après l’injection. Tous les poissons survivront jusqu’à 56 dpi, lorsque la majorité des poissons (>80%) devraient être exempts de dommages corporels évidents. Il s’agit d’une amélioration significative, car un modèle DIC fiable utilisant les deux premières méthodes IP ne peut être stabilisé dans la main d’un chercheur qu’après plus de 3 tours de pratique avec au moins 10 poissons dans chaque tour. Ce processus pouvait prendre du temps, car chaque pratique nécessitait environ 2 mois pour conclure sur le succès de son injection. La réduction des traumatismes tissulaires améliore non seulement le bien-être des poissons, mais minimise également les facteurs de confusion qui pourraient affecter les résultats de l’étude.
L’une des étapes essentielles pour assurer le succès de la nouvelle méthode est l’angle de pénétration. Comme le montre la figure 2, lorsque l’angle de pénétration est passé de 0° à 45°, une mortalité importante des poissons a été notée, probablement en raison d’un risque accru de contact entre la pointe de l’aiguille et les organes internes.
La principale limitation de la méthode est qu’elle ne peut pas être utilisée pour administrer des drogues aux poissons de moins de 3 mois. En raison de leur petite taille, les jeunes poissons ne peuvent pas survivre après les dommages physiques associés à la pénétration d’une aiguille. Cependant, la méthode peut être utilisée chez les poissons adultes dont le poids corporel est supérieur à 0,15 g, y compris ceux âgés de 3 mois à 4 ans.
Cette nouvelle méthode serait largement utilisée pour l’administration de médicaments chez les poissons-zèbres adultes, en particulier lorsqu’il s’agit de composés potentiellement toxiques tels que Dox15,16. Lorsqu’il s’agit de composés non toxiques, les trois méthodes doivent être applicables.
Déclarations de divulgation
Aucun.
Remerciements
Cette étude a été soutenue par le NIH (HL107304 et HL081753) et la Fondation Mayo (Center for Biomedical Discovery and Cardiovascular Research Center) à X.X. J.L. est financée par les Fonds de recherche fondamentale pour les Universités centrales de l’Université Central South, n° 56021702. Un merci spécial à Beninio Gore et Quentin Stevens pour la gestion de l’installation de poisson zèbre.
matériels
| Name | Company | Catalog Number | Comments |
| 10 μL NanoFil-syringe | World Precision Instruments, Inc | NANOFIL | injection tool |
| 34 G needle | World Precision Instruments, Inc | NI34BV-2 | injcetion tool |
| 60 mm Petri dish | fisher scientific/fisherbrand | FB0875713A | placing the sponge |
| Dissecting microscope | Nikon | SMZ800 | Injceting the Dox |
| Doxorubicin hydrochloride | Sigma | D1515-10MG | drug for creating DIC model |
| Echocardiography | VISUAL SONICS | Vevo 3100 | measuring cardiac function |
| Foam Sponge | Jaece Industries | L800-D | placing the fish |
| Hank's balanced salt solution (HBBS) | Thermo Fisher | 14025076 | Vehicle for Dox |
| Microcentrifuge | southernlabware | MyFuge/C1012 | collect the Dox solution |
| Precision Balance Scale | Torbal | AD60 | Digital scales |
| Tricaine | Argent | MS-222 | Anesthetizing fish |
| Tube | Eppendorf | 1.5 mL | storage |
| vevo LAB software | FUJIFILM VISUAL SONICS | 5.6.0 | quantification of the heart |
Références
- Tavares, B., Lopes, S. S. The importance of Zebrafish in biomedical research. Acta Medica Portuguesa. 26 (5), 583-592 (2013).
- Dang, M., Henderson, R. E., Garraway, L. A., Zon, L. I. Long-term drug administration in the adult zebrafish using oral gavage for cancer preclinical studies. Disease Model Mech. 9 (7), 811-820 (2016).
- Sciarra, J. B., Tyler, A., Kolb, A. A gelatin-based diet for oral dosing juvenile to adult zebrafish (Danio rerio). Lab Animal Sci Prof. , https://api.semanticscholar.org/CorpusID:85611302 32-35 (2014).
- Kinkel, M. D., Eames, S. C., Philipson, L. H., Prince, V. E. Intraperitoneal injection into adult zebrafish. J Vis Exp. (42), e2126(2010).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J Vis Exp. (34), e1645(2009).
- Liu, J., et al. Intraperitoneally delivered mesenchymal stem cells alleviate experimental colitis through THBS1-mediated induction of IL-10-competent regulatory B cells. Front Immunol. 13, 853894(2022).
- De Smet, L., Ceelen, W., Remon, J. P., Vervaet, C. Optimization of drug delivery systems for intraperitoneal therapy to extend the residence time of the chemotherapeutic agent. The Scientific World Journal. 2013, 720858(2013).
- Dakwar, G. R., et al. Nanomedicine-based intraperitoneal therapy for the treatment of peritoneal carcinomatosis-Mission possible. Adv Drug Deliv Rev. 108, 13-24 (2017).
- Al Shoyaib, A., Archie, S. R., Karamyan, V. T. Intraperitoneal route of drug administration: should it be used in experimental animal studies. Pharmaceutical Res. 37, 1-17 (2020).
- Ma, X., Ding, Y., Wang, Y., Xu, X. A doxorubicin-induced cardiomyopathy model in adult zebrafish. J Vis Exp. (136), e57567(2018).
- Wang, L. W., et al. Standardized echocardiographic assessment of cardiac function in normal adult zebrafish and heart disease models. Disease Model Mech. 10 (1), 63-76 (2017).
- Christidi, E., Brunham, L. R. Regulated cell death pathways in doxorubicin-induced cardiotoxicity. Cell Death Dis. 12 (4), 339(2021).
- Zhu, W., Shou, W., Payne, R. M., Caldwell, R., Field, L. J. A mouse model for juvenile doxorubicin-induced cardiac dysfunction. Pediatric Res. 64 (5), 488-494 (2008).
- Podyacheva, E. Y., Kushnareva, E. A., Karpov, A. A., Toropova, Y. G. Analysis of models of doxorubicin-induced cardiomyopathy in rats and mice. A modern view from the perspective of the pathophysiologist and the clinician. Frontiers Pharmacol. 12, 670479(2021).
- Chaoul, V., et al. Assessing drug administration techniques in zebrafish models of neurological disease. Int J Mol Sci. 24 (19), 14898(2023).
- Lu, X., Lu, L., Gao, L., Wang, Y., Wang, W. Calycosin attenuates doxorubicin-induced cardiotoxicity via autophagy regulation in zebrafish models. Biomed Pharmacother. 137, 111375(2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon