Method Article
成体ゼブラフィッシュにおける腹腔内注射技術により、体の損傷とそれに伴う死亡を最小限に抑える
* これらの著者は同等に貢献しました
要約
成体ゼブラフィッシュにおける新しい腹腔内(IP)注射法について記載する。ドキソルビシンなどの有毒化合物を取り扱う場合、この手順は以前に報告された2つのIPメソッドよりも効果的です。この手法は、ゼブラフィッシュモデルの経験が限られている研究者が簡単に採用できるように設計されています。
要約
遺伝的にアクセス可能な成魚のゼブラフィッシュ(Danio rerio)は、心筋症などのヒトの疾患を研究するための貴重な脊椎動物モデルとして採用されています。腹腔内(IP)注射は、治療効果の試験やドキソルビシン誘発性心筋症(DIC)などの疾患モデルの生成のために、化合物を体内に送達する重要な方法です。現在、IPインジェクションには2つの方法があります。どちらの方法も、ドキソルビシンなどの有毒化合物の取り扱いには制限があり、体型に深刻な損傷を与えたり、魚を死に至らしめたりする副作用が現れます。これらの欠点は、広範な研究者のトレーニングによって克服できますが、副作用が最小限の新しいIP注入方法が望ましいです。ここでは、毒性化合物を扱える独自のIP注入方法について報告します。心機能が一貫して低下すると、魚の死を招くことなく結果を得ることができます。この技術は、ゼブラフィッシュの成魚の経験がほとんどない研究者でも簡単に習得できます。
概要
ゼブラフィッシュ(Danio rerio)は、ヒトとの高い遺伝子・臓器相同性、体外受精、遺伝子操作の容易さ、早期成熟期の体内透明性など、ヒトの疾患研究の実験モデルとして注目されています1。ゼブラフィッシュの胚や幼虫のために直接水に薬を投与する単純なプロセスとは異なり、成体のゼブラフィッシュに薬を投与することは、より複雑で困難な試みを提示します2。
成魚では、化合物は、水中への直接投与などの受動的な薬物送達技術、または強制2のような経口薬物送達方法によって送達することができる。他のアプローチには、魚介類を化合物でコーティングし、続いて魚に給餌すること3、および眼窩後または腹腔内注射4,5を含む、所定の濃度での水不溶性薬物の直接投与が含まれる。腹腔内投与は、その明確な薬物動態学的利点により、疾患モデルのin vivo研究に好まれます6。この方法は、高い薬物濃度と腹腔内の長い半減期を提供し、薬物送達のための効果的な経路を提供する7,8。このアプローチは、最適な薬物の吸収と分布を確保するために、研究環境で一般的に利用されています9。注射ベースの方法は、1回の投与には効率的であることが証明されていますが、長時間の繰り返しの注射は、しばしば体の損傷や慢性感染症につながります2。
現在、成魚のゼルバフィッシュ4,10にIPインジェクションを行うには2つの方法があります。しかし、どちらの方法もドキソルビシンのような有毒化合物を送達する際には限界があり、体型や魚の死亡率に深刻なダメージを与えることになります。副作用は、データの解釈を著しく複雑にする可能性があります。これらの課題は広範なトレーニング10で対処できるかもしれませんが、副作用を最小限に抑える新しいIP注入方法が明らかに必要です。
ここでの目標は、ドキソルビシンを成体ゼブラフィッシュに効果的に送達するために最適化された新しいIP注射法を開発し、信頼性の高いドキソルビシン誘発性心筋症(DIC)モデルの生成を促進し、身体の損傷とそれに伴う死亡率を最小限に抑えることです。
プロトコル
実施されたすべての手順は、メイヨークリニックの施設内動物管理および使用委員会によって承認され、「実験動物のケアと使用に関するガイド」(National Academies Press、2011年)に概説されている基準に準拠していました。この研究に参加したすべてのゼブラフィッシュは、野生インド核型(WIK)株に属しています。本試験に使用した試薬および機器の詳細は、 資料表に記載されています。
1.ドキソルビシン原液の調製と保管
- ドキソルビシンストックは市販の供給元から入手してください。
注:ドキソルビシンは光感受性があるため、粉末状にして入手し、不透明な容器に保管して光への曝露から保護します。薬品フード内でDox粉末調製のすべての手順を実行します。 - Dox粉末を蒸留水に完全に溶解し、最終濃度5 mg / mLのストック溶液を調製します。
- ストックを1.5mLのチューブに分割して分注します。
- チューブをアルミホイルで包み、光にさらされないように保護します。
- アリコートDox溶液は、短期保存(<1か月)の場合は4°Cで、長期保存の場合は-20°Cで保存します10。
2.魚を体重に応じてグループ化します
- BW差が10%未満の魚をグループ化して、その後の注入に備えます。
注:このフェーズでの労力を節約するために、BWの変動が10%未満の魚は同じサイズとして分類されます。 - 注入する前に、魚を24時間絶食させます。
- 0.16 mg / mLのトリカインを含む胚水を使用して魚に1分間麻酔をかけます。.
- トリカインで魚を水から取り出し、魚の体の両面をきれいな濾紙で軽くたたいて余分な水分を取り除きます。
- 各魚のBWを測定して記録し、その後、魚を新鮮なシステム水で満たされた回収タンクに速やかに戻します。
注:Dox注射は、生後3か月に達した後に魚に対して行われました。この研究では、研究者は生後3か月から10か月の魚を利用しました。成熟したWIK株ゼブラフィッシュのBWは、0.2 gから0.5 gまでさまざまです。5分以上続く長時間の麻酔とそれに続くドックス注射は、魚の死亡率を高くしました。
3.注射針と注射ステーションの準備
- 目標用量の20 μg/gを達成するためには、平均体重に基づいて各魚に必要なDox原液の注入量(例:5 mg/mL)を決定します。
- 次の式を使用して、射出量を計算します。

- 1x Hank's Balanced Salt Solution(HBSS)を添加して、ステップ1で計算したDox溶液を注射用に希釈し、総容量5 μLにします。
注:魚のBWに基づいて各グループのバルク溶液を利用し、実験の過程で注射用の溶液が不足しないように、各グループにさらに3匹の魚を含めます。 - チューブを軽くたたいてから、最高速度で短時間微量遠心分離し、室温で10秒間溶液を回収します。
- 調製した溶液を氷の上に置き、光にさらされないようにシールドします。
- きれいな100mmシャーレとスポンジを解剖顕微鏡の下に置き、ピントを調整します。
注:スポンジには長さ4cmの溝があります。スポンジの弾性収縮は、魚を支え、魚の体を所定の位置に保ちます。スポンジは再利用できます。 - 10 μLマイクロシリンジに34 Gの斜め針を取り付けます。
- 1x HBSSバッファーで針を洗い流し、気泡を取り除き、シリンジから潜在的な詰まりを取り除きます。
- ステップ4で調製した注入用溶液の5 μLを測定します。
4. IP Doxインジェクションの手順
- 成魚を0.16 mg / mLトリカインを入れた水に1分間入れて、意識不明の状態を誘発します。.
- 腹部を上に向けて、埋め込まれたスポンジの溝に魚を置きます(図1A)。
- 胸鰭の中点から心腔の後側に向かって、0°に近い角度で針を挿入します(図1B)。
注:処置中は心臓との接触を避けてください。 - 針を尾に向け、銀色の皮の下に入ります。
注意: 針を銀色の肌に近接して配置し、引っかき傷やピアスがないように注意してください。 - 手術全体を通して腹腔内の針先を監視します(図1C)。
注意: 肝臓、腸、水泳用膀胱、およびその他の臓器に損傷を与えないでください。針が腸の端、総排泄孔の近くに到達することを確認します。 - 5 μL Dox溶液を徐々に均一に分注し、その後、漏れを防ぐために元の経路に沿って針をゆっくりと引き抜きます(図1D)。
- Dox溶液の赤色を観察することにより、腹腔内のDoxの存在を監視します(図1E)。
- 注入した魚を新鮮なシステム水で満たされたきれいなクロッシングタンクにすばやく移動して、魚が回復するのを助けます。
注:注射の合間に、針を1x HBSSバッファーで1回洗い流します。
5. 注射後の魚の管理
- 注射後、魚を循環させてシステムに戻します。
- 注入されたすべての魚をさらに24時間速くして、回復を促進します。
- 最初の1週間は、魚から目を離さないでください。他の魚に感染しないように、死んだ魚をできるだけ早く取り除いてください。
注:最初の24時間以内の魚の死亡は、注射または長時間の麻酔による身体的損傷が原因である可能性があります。魚の数を記録して生存曲線を生成します。 - 心エコー検査を実施して、注射後 56 日で Dox 注射された魚の表現型を 11.
注:HBSS溶液を注入する対応する対照群の条件と手順の均一性を確保します。
結果
これまで、成体ゼブラフィッシュにおけるドキソルビシンの投与には、2つの腹腔内(IP)法が用いられていました4,10。方法Iは、Kinkelらによって記述されたクラシックIP注射法としても知られています4、腹部を上に向けて、針を骨盤鰭間の正中線に対して45°の角度で挿入しました。方法II、またはMaら10によって記載された代替IP注入法では、針は魚の背側を通して挿入されました(図2A(i、ii))。これに対し、本手法IIIには大きく2つの変更点があります。まず、注射の位置を変更し、腹部を上に向けて、針を胸鰭の中点から腹部に向けています。侵入部位は、この領域の自然の穴によって導かれます。次に、針の角度を小さくし、0°に近づける必要があります(図2A(iii)、図1)。
3つの腹腔内注射法の比較
3つのIPインジェクション方法を比較するために、ゼブラフィッシュの経験がなかった研究者Iから得られたデータを提示します。方法IおよびIIをIP注入に使用したところ、IP注入後の最初の2週間で有意な魚の死亡率が認められました。方法Iでは、注射後3日で死亡が観察されましたが、方法IIでは、注射後2日後に死亡しました。注入された魚の70%は、特に注射部位の周囲に目に見える体の損傷を示し、IP注入後1〜2か月で体のサイズが急激に縮小し、体型が湾曲した形で現れました(図2A (iv、v))。死亡率と観察された損傷は、ドキソルビシン12の毒性に起因する可能性があり、注射プロセス中に注射針の開口部から漏れ、注射経路に沿って内臓を損傷する可能性があると推論されました。方法Iでは、注射針の先端が腸に触れる可能性があります(図2A(i))、方法IIでは、水泳膀胱に触れる可能性があります(図2A(ii))。方法IIIを使用して、針の先端が内臓に触れるのを防ぐことができると仮定されました(図2A(iii))。実際、生存率が大幅に向上し、注射後1か月で魚の80%が生存しました(図2B)。これは、方法IとIIの生存率がそれぞれ53.33%と33.33%であったのに対し、顕著な改善を示しています。重要なことに、生き残った魚の80%は、方法IおよびIIによって生成されたものとは対照的に、正常な体型を示しました(図2A(vi))。DICモデルの生成が成功したことを検証するために、駆出率(EF%)を測定することにより心機能を評価しました。実際、メソッドIIIを使用したグループでは、注入後56日目にEF%の有意な減少が観察されました(図2C)。
異なる研究者によるメソッドIIIの再現性
方法IIIはさまざまな研究者が簡単に習得できることを証明するために、ゼブラフィッシュを扱ったことのない3人の研究者を研究に採用しました。方法IIIでの最初の数回の試みで、すべての研究者は注射後56日で85.71%、95%、および83.33%の生存率を達成し、EFを著しく減少させることができました(図3A、B)。注目すべきは、3人の研究者がそれぞれ3回、3回、2回と実験を繰り返し、一貫して良好な結果を得ていたことです。これらのデータにより、メソッドIIIの再現性が確認され、魚を扱った経験がない研究者も信頼性の高いDICモデルを作成することができました。
方法IIIを使用した最初の試みの1つでは、研究者IIは方法IIIの偏差をテストしました:0°の代わりに、皮膚を通して針を貫通する際に45°の角度が使用されました(図2A(iii)、破線の矢印)。注射後2か月で生存した魚はわずか15%で(図3A)、生き残った魚の80%がかなりの体損傷を示しました。データは、貫通の角度が方法IIIの成功にとって重要なステップであることを示しました。
方法IIIは、慢性DICモデルの確立を可能にします
体の損傷が大幅に減少すると、マウスの慢性DICモデルを模倣して、同じ魚に複数のIP注射が可能になる可能性があると仮定されました13,14。したがって、メソッドIIIを使用して、1週間あたり5μg/gのDoxで、4週間連続して一連の注射を行いました(図4A)。この実験では、注入された魚の100%が生き残り、80%の魚は体に損傷の兆候を示さなかった。重要なことに、56 dpiで駆出率が大幅に減少したことが認められ、成体ゼブラフィッシュにおける慢性DICモデルの生成が成功したことを示しています(図4B)。
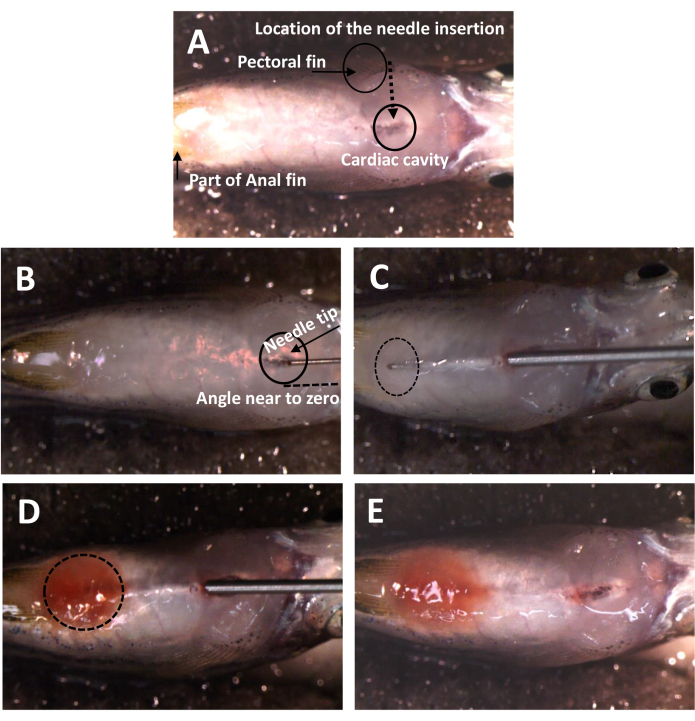
図1:新しいIP注入法における針挿入の位置と角度 (A)針挿入の位置。魚は逆さまになっていて、腹部が露出しています。頭は右側にあります。胸鰭の間には天然の穴があり、皮膚への浸透が容易になります。(B)針の挿入角度。魚の表面から0度に近くなっています。(C)皮膚の下の針の軌跡。針の先端は、腹腔内に入ると継続的に監視されます。エントリポイントは、浸透プロセス中の皮膚の歪みのため、 図1A とは異なって見えます。(D) ドックスがリリースされた後の魚。ドックスを放つと腹腔が赤くなります。(E)IP注入後の魚。針を抜いた後の漏れの兆候はありません。 この図の拡大版を表示するには、ここをクリックしてください。
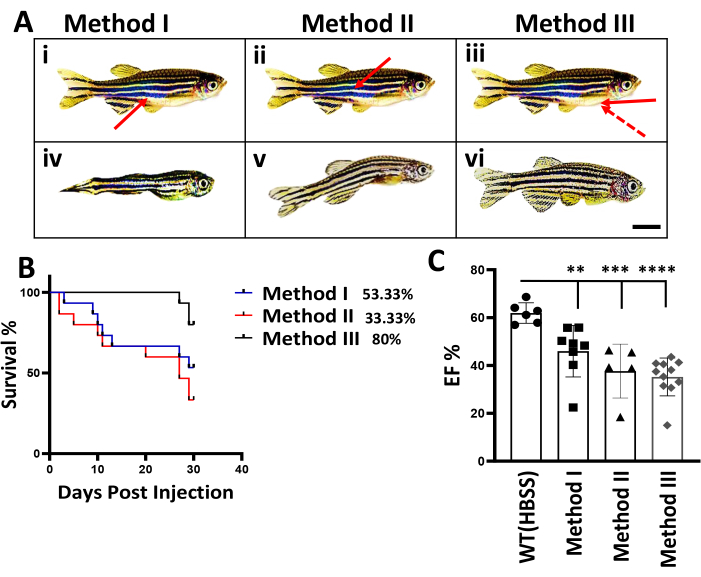
図2:成魚のゼブラフィッシュにおける3種類のIP注入法の比較 (A)3種類のIP注入方法の模式図。(I-III)従来のIPインジェクション(方法I)、代替IPインジェクション(方法II)、および新しい方法(方法III)の概略図を示しています。矢印は、3つの注入方法の針の貫通部位と角度を示しています。破線の矢印、針の貫通の失敗した角度。スケールバー:5mm(iv-vi)DICモデルではボディサイズを縮小し、ボディ形状を湾曲させました。写真はDICフィッシュの代表魚で、56dpiです。(B)3つのIP注入方法間の生存曲線の比較。生き残った魚の数は毎週記録されました。(実験は合計n = 15で始まりました)。(C)Doxストレス後の56dpiでの魚の心機能評価。1x HBSS対照群のn = 6匹の魚、および実験は、Doxを注入した3つのバッチごとに合計n = 15匹の魚から始まりました。値は、平均誤差±標準誤差として表示されます。この図の拡大版を表示するには、ここをクリックしてください。

図3:方法IIIにより、ゼブラフィッシュのDICモデルを3人の研究者の手によって一貫して確立することができます。3人の研究者全員で高い生存率が認められた。生きた魚の数は毎週記録されます。研究者IIでは、方法IIIが失敗した場合(図2Aの破線矢印で示されているように、針の貫通角度が45°)、生存率が低いことが認められました。(B)3人の研究者による方法IIIを用いたDIC魚の心機能評価。合計で、研究者IIは、針の貫通角度が45°の場合、Dox注射に3つのバッチ(9、12、14)の魚を使用しました。針貫通角 n = 6 の魚を 1x HBSS で共有対照群として使用しました。実験は、3人の研究者(II、III、IV)によってDoxを注入した8つのバッチのそれぞれにRII(9、12、14)、RIII(8、6、6)、およびRIP(12、18)を使用した合計n = 85匹の魚から始まりました。値は、平均誤差±標準誤差として表示されます。この図の拡大版を表示するには、ここをクリックしてください。
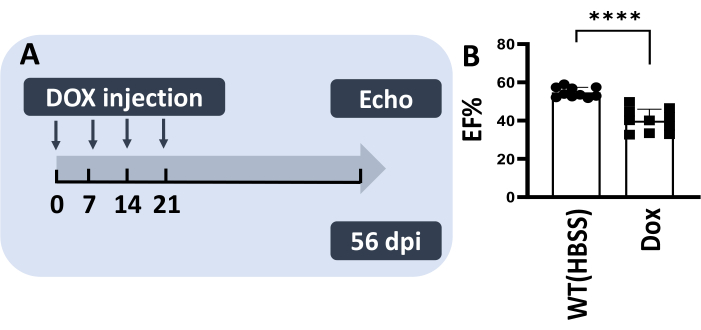
図4:方法IIIは、成体のゼブラフィッシュにDoxを複数回注入し、げっ歯類の慢性DICモデルを再現します。5 μg/g Dox (5 μL) を 4 週間連続で注入しました。(B)慢性DICモデルでは、56dpiでEF%の低下が認められる。値は、平均誤差±標準誤差として表示されます。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
新しいIPインジェクション方法は、既存の2つのIPインジェクション方法4,10とは異なり、以下の明確な特徴によって特徴付けられる。まず、独自の針貫通角度が使用されます(ゼロに近い)。第二に、針は、ユニークな場所、すなわち、魚の腹側表面の自然な穴を介して魚を貫通し、これにより注入が容易になります。そして最後に、針の動きは前部から後部への動きです。これらの調整は、浸透過程でのDoxの漏れを最小限に抑えることに起因する臓器損傷を効果的に減少させます。針の経路は銀色の皮膚のすぐ下にあり、研究者は銀色の皮膚を継続的に監視できます。その結果、針の先端と内臓との直接接触を効果的に回避できます。注射後、注入されたすべてのドックスは腹腔内に留まり、魚が目を覚まして前方に泳ぎ始めたときには、唯一の出口(穿刺点)を閉じることができます。
既存の2つのIP注入方法4,10と比較して、新しいIP注入方法は一貫して身体の損傷を最小限に抑え、生存率を向上させます。この記述は、慢性ゼブラフィッシュDICモデルを生成するために、同じ魚に複数回注射することの実現可能性によってさらに強調されました。重要なことは、前の2つのIP注入方法4,10と比較して、この新しい方法は、成魚のゼブラフィッシュの取り扱い経験がない研究者でもすぐに習得できることです。信頼性の高いDICモデルは、少なくとも4人の異なる研究者の手に渡って、1回目または2回目の試行で成功裏に取得されたようです。注射の成功は、注射後最初の1週間以内に容易に結論付けることができる:>80%、できれば100%の魚は注射後も生き残ることができるはずである。すべての魚は56dpiまで生き残りますが、そのとき大部分の魚(>80%)は明らかな体の損傷を受けていないはずです。最初の 2 つの IP メソッドを使用した信頼性の高い DIC モデルは、各ラウンドで少なくとも 10 匹の魚を使用して 3 ラウンド以上練習した後にのみ、研究者の手で安定させることができるため、これは大幅な改善です。このプロセスは、各練習が彼/彼女の注射の成功について結論を出すのに約2ヶ月を要したため、時間がかかる可能性があります。組織の外傷を減らすことは、魚の健康を改善するだけでなく、研究の結果に影響を与える可能性のある交絡因子を最小限に抑えます。
新しい方法を確実に成功させるための重要なステップの1つは、貫通角度です。 図2に示すように、浸透の角度が0°から45°に変化したとき、針の先端と内臓との接触リスクが高まったためと思われる、著しい魚の死が認められました。
この方法の主な制限は、この方法を使用して3か月未満の魚に薬物を送達できないことです。体のサイズが小さいため、針の貫通に伴う物理的な損傷の後、若い魚は生き残ることができません。ただし、この方法は、BWが0.15gを超える成魚(3か月から4歳までの魚を含む)に使用できます。
この新しい方法は、成体のゼブラフィッシュの薬物送達、特にDox15,16のような潜在的に毒性のある化合物を扱う場合に広く利用されます。無毒の化合物に関しては、3つの方法すべてを適用できるはずです。
開示事項
何一つ。
謝辞
この研究は、NIH(HL107304およびHL081753)およびメイヨー財団(生物医学発見センターおよび心臓血管研究センター)のX.X.J.L 56021702.の支援を受けました。ゼブラフィッシュ施設の管理に携わってくださったベニニオ・ゴア氏とクエンティン・スティーブンス氏に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 10 μL NanoFil-syringe | World Precision Instruments, Inc | NANOFIL | injection tool |
| 34 G needle | World Precision Instruments, Inc | NI34BV-2 | injcetion tool |
| 60 mm Petri dish | fisher scientific/fisherbrand | FB0875713A | placing the sponge |
| Dissecting microscope | Nikon | SMZ800 | Injceting the Dox |
| Doxorubicin hydrochloride | Sigma | D1515-10MG | drug for creating DIC model |
| Echocardiography | VISUAL SONICS | Vevo 3100 | measuring cardiac function |
| Foam Sponge | Jaece Industries | L800-D | placing the fish |
| Hank's balanced salt solution (HBBS) | Thermo Fisher | 14025076 | Vehicle for Dox |
| Microcentrifuge | southernlabware | MyFuge/C1012 | collect the Dox solution |
| Precision Balance Scale | Torbal | AD60 | Digital scales |
| Tricaine | Argent | MS-222 | Anesthetizing fish |
| Tube | Eppendorf | 1.5 mL | storage |
| vevo LAB software | FUJIFILM VISUAL SONICS | 5.6.0 | quantification of the heart |
参考文献
- Tavares, B., Lopes, S. S. The importance of Zebrafish in biomedical research. Acta Medica Portuguesa. 26 (5), 583-592 (2013).
- Dang, M., Henderson, R. E., Garraway, L. A., Zon, L. I. Long-term drug administration in the adult zebrafish using oral gavage for cancer preclinical studies. Disease Model Mech. 9 (7), 811-820 (2016).
- Sciarra, J. B., Tyler, A., Kolb, A. A gelatin-based diet for oral dosing juvenile to adult zebrafish (Danio rerio). Lab Animal Sci Prof. , https://api.semanticscholar.org/CorpusID:85611302 32-35 (2014).
- Kinkel, M. D., Eames, S. C., Philipson, L. H., Prince, V. E. Intraperitoneal injection into adult zebrafish. J Vis Exp. (42), e2126(2010).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J Vis Exp. (34), e1645(2009).
- Liu, J., et al. Intraperitoneally delivered mesenchymal stem cells alleviate experimental colitis through THBS1-mediated induction of IL-10-competent regulatory B cells. Front Immunol. 13, 853894(2022).
- De Smet, L., Ceelen, W., Remon, J. P., Vervaet, C. Optimization of drug delivery systems for intraperitoneal therapy to extend the residence time of the chemotherapeutic agent. The Scientific World Journal. 2013, 720858(2013).
- Dakwar, G. R., et al. Nanomedicine-based intraperitoneal therapy for the treatment of peritoneal carcinomatosis-Mission possible. Adv Drug Deliv Rev. 108, 13-24 (2017).
- Al Shoyaib, A., Archie, S. R., Karamyan, V. T. Intraperitoneal route of drug administration: should it be used in experimental animal studies. Pharmaceutical Res. 37, 1-17 (2020).
- Ma, X., Ding, Y., Wang, Y., Xu, X. A doxorubicin-induced cardiomyopathy model in adult zebrafish. J Vis Exp. (136), e57567(2018).
- Wang, L. W., et al. Standardized echocardiographic assessment of cardiac function in normal adult zebrafish and heart disease models. Disease Model Mech. 10 (1), 63-76 (2017).
- Christidi, E., Brunham, L. R. Regulated cell death pathways in doxorubicin-induced cardiotoxicity. Cell Death Dis. 12 (4), 339(2021).
- Zhu, W., Shou, W., Payne, R. M., Caldwell, R., Field, L. J. A mouse model for juvenile doxorubicin-induced cardiac dysfunction. Pediatric Res. 64 (5), 488-494 (2008).
- Podyacheva, E. Y., Kushnareva, E. A., Karpov, A. A., Toropova, Y. G. Analysis of models of doxorubicin-induced cardiomyopathy in rats and mice. A modern view from the perspective of the pathophysiologist and the clinician. Frontiers Pharmacol. 12, 670479(2021).
- Chaoul, V., et al. Assessing drug administration techniques in zebrafish models of neurological disease. Int J Mol Sci. 24 (19), 14898(2023).
- Lu, X., Lu, L., Gao, L., Wang, Y., Wang, W. Calycosin attenuates doxorubicin-induced cardiotoxicity via autophagy regulation in zebrafish models. Biomed Pharmacother. 137, 111375(2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved